Большая Энциклопедия Нефти и Газа. Ацетилен и водород
Ответы@Mail.Ru: химические свойства ацетилена. химия
Для ацетилена (этина) характерны реакции присоединения, димеризации, полимеризации, цикломеризации. Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова) . В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м3. При сгорании температура пламени достигает 3300градус целсия (5972 фар) . Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен) . Для полимеризации в бензол необходим графит и температура в 400градус целсия . Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор) , образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди. Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Для ацетилена (этина) характерны реакции присоединения: HC≡CH + Cl2 -> СlСН=СНСl Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова) . В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³ (50,4 МДж/Кг) . При сгорании в кислороде температура пламени достигает 3150 °C. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен) . Для полимеризации в бензол необходим графит и температура в 400 °C. Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор) , образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди. Ацетилен обесцвечивает бромную воду и раствор перманганата калия. Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.): Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.): <img src="//otvet.imgsmail.ru/download/b1e2add8baafcbe36ce709b8b3cbcd07_i-182.jpg" ><img src="//otvet.imgsmail.ru/download/8b2ce91563edce9713b0a030b5308f82_i-183.jpg" >
touch.otvet.mail.ru
Структурная и молекулярная формула: ацетилен
Особенности строения ацетилена влияют на его свойства, получение и применение. Условное обозначение состава вещества — С2Н2 — это его простейшая и брутто-формула. Ацетилен образован двумя атомами углерода, между которыми возникает тройная связь. Ее наличие отражают разные виды формул и моделей молекулы этина, позволяющих разобраться в проблеме влияния строения на свойства вещества.
Алкины. Общая формула. Ацетилен
Углеводороды алкины, или ацетиленовые, являются ациклическими, непредельными. Цепочка атомов углерода — не замкнутая, в ней присутствуют простые и кратные связи. Состав алкинов отражает сводная формула Cnh3n– 2. В молекулах веществ этого класса присутствует одна или несколько тройных связей. Ацетиленовые соединения относятся к ненасыщенным. Это означает, что только одна валентность углерода реализуется за счет водорода. Оставшиеся три связи используются при взаимодействии с другими атомами углерода.
Первый - и наиболее известный представитель алкинов - ацетилен, или этин. Тривиальное название вещества произошло от латинского слова «acetum» — «уксус» и греческого — «hyle» — «дерево». Родоначальник гомологического ряда был открыт в 1836 году в химических опытах, позже вещество синтезировали из угля и водорода Э. Дэви и М. Бертло (1862 год). При обычной температуре и нормальном атмосферном давлении ацетилен находится в газообразном состоянии. Это бесцветный газ, без запаха, малорастворимый воде. Этин легче растворяется в этаноле и ацетоне.
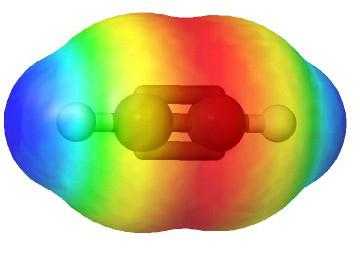
Молекулярная формула ацетилена
Этин — простейший член своего гомологического ряда, его состав и строение отражают формулы:
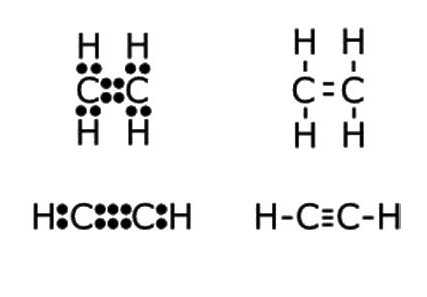
- С2Н2 — молекулярная запись состава этина, которая дает представление о том, что вещество образовано двумя углеродными атомами и таким же числом атомов водорода. По этой формуле можно рассчитать молекулярную и молярную массы соединения. Mr (С2Н2) = 26 а. е. м., М (С2Н2) = 26,04 г/моль.
- Н:С:::С:Н — электронно-точечная формула ацетилена. Подобные изображения, получившие название «структуры Льюиса», отражают электронное строение молекулы. При написании необходимо соблюдать правила: атом водорода стремится при образовании химической связи обладать конфигурацией валентной оболочки гелия, другие элементы — октетом внешних электронов. Каждое двоеточие означает общую для двух атомов или неподеленную пару электронов внешнего энергетического уровня.
- H—C≡C—H — структурная формула ацетилена, отражающая порядок и кратность связей между атомами. Одна черточка заменяет собой одну пару электронов.
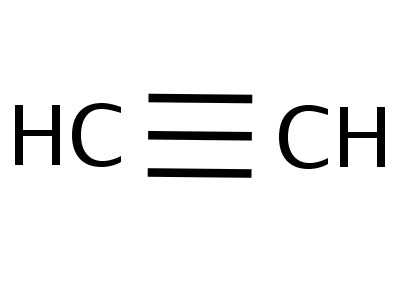
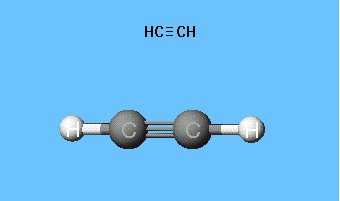
Модели молекулы ацетилена
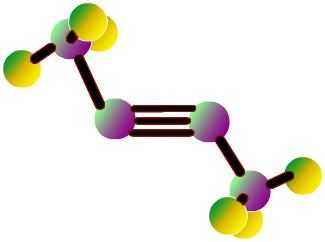
Формулы, показывающие распределение электронов, послужили фундаментом для создания атомно-орбитальных моделей, пространственных формул молекул (стереохимических). Еще в конце XVIII века получили распространение шаростержневые модели - например, шарики разного цвета и размера, обозначающие углерод и водород, которые образуют ацетилен. Структурная формула молекулы представлена в виде стержней, символизирующих химические связи и их количество у каждого атома.
Шаростержневая модель ацетилена воспроизводит валентные углы, равные 180°, но межъядерные расстояния в молекуле отражаются приблизительно. Пустоты между шариками не создают представления о заполнении пространства атомов электронной плотностью. Недостаток устранен в моделях Дрейдинга, обозначающих ядра атомов не шариками, а точками присоединения стержней друг к другу. Современные объемные модели дают более яркое представление об атомных и молекулярных орбиталях.
Гибридные атомные орбитали ацетилена
Углерод в возбужденном состоянии содержит три р-орбитали и одну s с неспаренными электронами. При образовании метана (СН4) они принимают участие в создании равноценных связей с атомами водорода. Известный американский исследователь Л. Полинг разработал учение о гибридном состоянии атомных орбиталей (АО). Объяснение поведения углерода в химических реакциях заключается в выравнивании АО по форме и энергии, образовании новых облаков. Гибридные орбитали дают более прочные связи, становится устойчивее формула.
Атомы углерода в молекуле ацетилена, в отличие от метана, подвергаются sp-гибридизации. По форме и энергии смешиваются s- и р электроны. Появляются две sp-орбитали, лежащие под углом 180°, направленные по разные стороны от ядра.
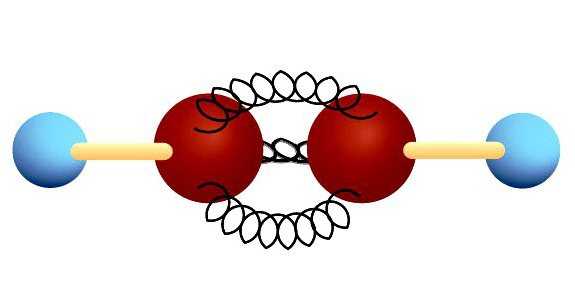
Тройная связь
В ацетилене гибридные электронные облака углерода участвуют в создании σ-связей с такими же соседними атомами и с водородом в парах С—Н. Остаются две перпендикулярные друг другу негибридные p-орбитали. В молекуле этина они участвуют в образовании двух π-связей. Вместе с σ возникает тройная связь, которую отражает структурная формула. Ацетилен отличается от этана и этилена расстоянием между атомами. Тройная связь короче двойной, но обладает большим запасом энергии, является более прочной. Максимальная плотность σ- и π-связей расположена в перпендикулярных областях, что приводит к образованию цилиндрического электронного облака.
Особенности химической связи в ацетилене
Молекула этина имеет линейную форму, что удачно отражает химическая формула ацетилена — H—C≡C—H. Атомы углерода и водорода находятся вдоль одной прямой, между ними возникают 3 σ- и 2 π-связи. Свободное движение, вращение вдоль оси C—C невозможно, этому препятствует наличие кратных связей. Другие особенности тройной связи:
- количество пар электронов, связывающих два атома углерода, — 3;
- длина — 0,120 нм;
- энергия разрыва — 836 кДж/моль.
Для сравнения: в молекулах этана и этилена длина одинарной и двойной химической связи — 1,54 и 1,34 нм соответственно, энергия разрыва С—С составляет 348 кДж/моль, C=C — 614 кДж/моль.
Гомологи ацетилена
Ацетилен — простейший представитель алкинов, в молекулах которых также присутствует тройная связь. Пропин СН3С≡СН — гомолог ацетилена. Формула третьего представителя алкинов — бутина-1 — СН3СН2С≡СН. Ацетилен — тривиальное название этина. Систематическая номенклатура алкинов подчиняется правилам ИЮПАК:
- в линейных молекулах указывается название основной цепи, возникшее от греческого числительного, к которому добавляется суффикс -ин и номер атома при тройной связи, например, этин, пропин, бутин-1;
- нумерацию главной цепочки атомов начинают с конца молекулы, ближайшего к тройной связи;
- для разветвленных углеводородов сначала идет наименование бокового ответвления, затем следует название главной цепочки атомов с суффиксом -ин.
- заключительная часть наименования — цифра, указывающая расположение в молекуле тройной связи, например, бутин-2.
Изомерия алкинов. Зависимость свойств от строения
Этин и пропин не имеют изомеров положения тройной связи, они появляются, начиная с бутина. Изомеры углеродного скелета есть у пентина и следующих за ним гомологов. Относительно тройной связи не проявляется пространственная изомерия ацетиленовых углеводородов.
Первые 4 гомолога этина — газы, плохо растворимые в воде. Ацетиленовые углеводороды C5 – C15 — жидкости. Твердыми веществами являются гомологи этина, начиная с углеводорода C17. Химическая природа алкинов испытывает значительное влияние тройной связи. Углеводороды этого типа активнее, чем этиленовые, присоединяют различные частицы. На этом свойстве основано широкое применение этина в промышленности и технике. При горении ацетилена выделяется большое количество теплоты, что находит применение в газовой резке и сварке металлов.
fb.ru
какое строение имеет молекула этилена и ацетилена? помогитее пожаалуйста.. оч надо)
Ответы к билетам повышенной трудности по химии Метан, этилен, ацетилен: химическое строение, горение. Реакция полимеризации Химическим строением называют последовательность соединения атомов в молекуле и их расположение в пространстве. Химическое строение изображают с помощью структурных формул. Черточка изображает ковалентную химическую связь. Если связь кратная: двойная, тройная, – то ставят две (не путать со знаком «равно» ) или три черточки. Углы между связями изображают по возможности. Чтобы правильно составлять структурные формулы органических веществ, нужно помнить, что атомы углерода образуют по 4 связи (т. е. валентность углерода по числу связей равна четырем. В органической химии преимущественно используется именно валентность по числу связей) . Метан (его также называют болотный, рудничный газ) состоит из одного атома углерода, связанного ковалентными связями с четырьмя атомами водорода. Молекулярная формула Ch5. Структурная формула: H l H – C – H l H Угол между связями в молекуле метана составляет около 109° – электронные пары, образующие ковалентные связи атома углерода (в центре) с атомами водорода, располагаются в пространстве на максимальном удалении друг от друга. В 10-11 классах изучается, что молекула метана имеет форму треугольной пирамиды – тетраэдра, подобно знаменитым египетским пирамидам. Этилен C2h5 содержит два атома углерода, соединенных двойной связью: Угол между связями составляет 120° (электронные пары отталкиваются и располагаются на максимальном расстоянии друг от друга) . Атомы располагаются в одной плоскости. Если не изображать отдельно каждый атом водорода, то получаем сокращенную структурную формулу: Ch3 = Ch3 Ацетилен C2h3 содержит тройную связь: H – C ≡ C – H Угол между связями 180°, молекула имеет линейную форму. При горении углеводородов образуются оксиды углерода (IV) и водорода, т. е. углекислый газ и вода, при этом выделяется много тепла: Ch5 + 2O2 → CO2 + 2h3O C2h5 + 3O2 → 2CO2 + 2h3O 2C2h3 + 5O2 → 4CO2 + 2h3O (в уравнении с ацетиленом перед формулой ацетилена ставим коэффициент 2, чтобы число атомов кислорода в правой части было чётным) Большое практическое значение имеет реакция полимеризации этилена – соединение большого числа молекул с образованием макромолекул полимера – полиэтилена. Связи между молекулами образуются за счет разрыва одной из связей двойной связи. В общем виде это можно записать так: nCh3 = Ch3 → (- Ch3 – Ch3 -)n где n – число соединившихся молекул, называемое степенью полимеризации. Реакция происходит при повышенном давлении и температуре, в присутствии катализатора. Из полиэтилена изготавливают пленку для парников, покрышки для банок и пр. Образование бензола из ацетилена тоже относят к реакциям полимеризации: 3C2h3 → C6H6
touch.otvet.mail.ru
Ацетилен и другие горючие газы
Ацетилен является основным горючим газом для газовой сварки и резки металлов, температура его плавления при сгорании в смеси с технически чистым кислородом достигает 3150°С.
Ацетилен С2Н2 является химическим соединением углерода и водорода. Технический ацетилен при нормальных давлении и температуре представляет собой бесцветный газ с резким специфическим чесночным запахом, обусловленным содержащимися в нем примесями сероводорода, аммиака, фосфористого водорода и др. Длительное вдыхание его вызывает тошноту, головокружение и даже отравление.
Ацетилен легче воздуха, 1 м3 ацетилена при нормальном атмосферном давлении и температуре 20°С имеет массу 1,09 кг. При нормальном давлении и температуре от —82,4°С (190,6 К) до —84,0°С (189 К) ацетилен переходит в жидкое состояние, а при температуре —85°С (188 К) затвердевает.
Ацетилен — самое распространенное горючее, используемое в процессах газопламенной обработки. При использовании ацетилена необходимо учитывать его взрывоопасные свойства. Ацетилен — высокое эндотермическое соединение, при разложении 1 кг ацетилена выделяется 8373,6 кДж. Температура самовоспламенения колеблется в пределах 240—630°С и зависит от давления и присутствия в нем различных веществ.
Повышение давления существенно снижает температуру самовоспламенения ацетилена. Присутствие в ацетилене других веществ увеличивает поверхность контакта и тем понижает температуру самовоспламенения.
Зависимость температуры воспламенения ацетилена от давления приведена ниже:
Температура, °С........................630 530 475 350
Абсолютное давление, МПа......0,2 0,3 0,4 2,2
При взрыве ацетилена происходит резкое повышение давления и температуры, что может вызвать большие разрушения и тяжелые несчастные случаи. Ацетилен с воздухом образует взрывоопасные смеси в пределах от 2,2 до 81 % ацетилена по объему при нормальном атмосферном давлении, а с технически чистым кислородом — в пределах от 2,3 до 93% ацетилена. Наиболее взрывоопасны ацетиленовоздушные смеси, содержащие 7—13% ацетилена. Взрыв ацетиле-нокислородной и ацетиленовоздушной смеси, в указанных пределах может произойти от сильного нагрева и искры.
Присутствие окиси меди снижает температуру самовоспламенения ацетилена до 240°С. При определенных условиях ацетилен реагирует с медью, образуя взрывоопасные соединения; вот почему категорически запрещается при изготовлении ацетиленового оборудования применение сплавов, содержащих более 70% меди.
Взрываемость ацетилена понижается при растворении его в жидкостях. Особенно хорошо он растворяется в ацетоне. В одном объеме технического ацетона при 20°С и нормальном атмосферном давлении можно растворить до 20 объемов ацетилена. Растворимость ацетилена в ацетоне увеличивается с увеличением давления и понижением температуры.
Технический ацетилен получают двумя способами: из карбида кальция и из природного газа, нефти, угля.
Ацетилен, полученный из природного газа, называется пиролизным. Пиролизный ацетилен выпускается по МРТУ-03-165—64. Получение ацетилена из природного газа на 30—40% дешевле, чем из карбида кальция.
К месту сварки ацетилен доставляется в специальных стальных баллонах, заполненных пористой пропитанной ацетоном массой, под давлением 1,9 МПа.
Кроме ацетилена при сварке и резке металлов применяют и другие более дешевые и менее дефицитные горючие газы и пары горючих жидкостей. Основная область применения газов-заменителей — кислородная резка, однако в последние годы они находят широкое применение и при других видах газопламенной обработки металлов — пайке, наплавке, газопламенной закалке, металлизации, газопрессовой сварке, сварке цветных металлов и сплавов. Правильное использование газов-заменителей не ухудшает качество сварки и резки металлов; применение их дает более высокую чистоту реза при резке металлов малых толщин.
При сварке температура пламени должна примерно в два раза превышать температуру плавления металлов, поэтому газы-заменители, температура пламени которых ниже, чем у ацетилена, необходимо использовать при сварке металлов с более низкой температурой плавления, чем у сталей. При кислородной резке используются горючие газы, которые при сгорании в смеси с кислородом дают пламя с температурой не ниже 2000°С. Выбор горючего газа зависит от его теплотворной способности. Теплотворной способностью тага называется количество теплоты в килоджоулях, получаемое при полном сгорании 1 м3 газа. Чем выше теплотворная способность газа, тем меньше его расход при сварке и резке металлов. Для полного сгорания одинакового объема различных горючих газов требуется различное количество кислорода, от этого зависит эффективная мощность пламени.
Эффективной мощностью пламени называется количество тепла, вводимое в нагреваемый металл в единицу времени. Для расчетов замены ацетилена другим газом-заменителем пользуются коэффициентом замены ацетилена. Коэффициентом замены ацетилена называется отношение расхода газа-заменителя V3 к расходу ацетилена Va при одинаковой эффективной тепловой мощности: ip=V3/Va.
Водород h3 в нормальных условиях представляет собой горючий газ без цвета и запаха. Это один из самых легких газов, он в 14,5 раза легче воздуха. Водород способен образовывать в определенных пропорциях взрывоопасные смеси с воздухом и кислородом. Поэтому при сварочных работах необходимо строго соблюдать правила безопасности труда. Получают водород разложением воды электрическим током. К месту сварки водород доставляют в стальных баллонах в газообразном состоянии под давлением 15 МГ1а. Баллоны для водорода окрашивают в зеленый цвет. Водород, применяемый для сварочных работ, должен удовлетворять требованиям ГОСТ 3022—80 «Водород технический». Водородно-кислородное пламя имеет синюю окраску и не имеет четких очертаний зон пламени, что затрудняет, его регулировку.
Коксовый газ — бесцветный газ с запахом сероводорода. Коксовый газ получают при выработке кокса из каменного угля, состоит он из смеси газообразных горючих продуктов водорода, метана и других непредельных углеводородов. Применяют в основном для резки сталей, сварки и пайки легкоплавких цветных металлов. Для сварки и резки применяют коксовый газ, очищенный от сернистых соединений и смолистых веществ. Для полного сгорания 1 м3 необходимо 0,9 м3 кислорода. К месту сварки и резки коксовый газ подают по трубопроводам под давлением 1,3— ,1,5 кПа.
Городской газ является составным горючим газом. Обычно основным компонентом городского газа является природный газ, к нему добавляют коксовый и генераторный газы. Состав городского газа непостоянен, газ типа московского имеет следующий состав: метан (70—95%), водород (до 25%), тяжелые углеводороды (до 1%), азот (до 3%), оксид углерода (до 3%), двуоксид углерода (до 1%), кислород (до 0,5%). К месту сварки городской газ доставляют по трубопроводам. Как заменитель ацетилена он используется для резки сталей, сварки и пайки легкоплавких цветных металлов.
Пропан технический — бесцветный газ с резким запахом, состоящий из пропана С3Н8 или из пропана и пропилена С3Н8, суммарное содержание которых должно быть не менее 93%. Получают пропан при переработке нефтепродуктов. При нормальных условиях пропан находится в газообразном состоянии, а при понижении температуры или повышении давления переходит в жидкое состояние. Так, при температуре 293 К пропан переходит в жидкое состояние при давлении 0,85 МПа. Испарение 1 кг жидкого пропана дает 0,53 м3 паров.
Пропан-бутановая смесь — бесцветный газ с резким запахом —является побочным продуктом при переработке нефти.
Смесь легко превращается в жидкое состояние, например при температуре 233 К пропан-бутановая смесь сжижается при атмосферном давлении. Сжиженные газы хранят только в закрытых емкостях, так как испарение жидкости происходит даже при 273 К.
Плотность пропан-бутана больше плотности воздуха, поэтому необходимо тщательно следить за герметичностью аппаратуры и коммуникаций во избежание образования взрывоопасной смеси газа с воздухом внизу помещения. Заполнение емкостей пропаном и пропан-бутановой смесью, транспортирование их, а также слив газа должны выполняться в соответствии с «Правилами устройства и безопасной эксплуатации сосудов, работающих под давлением», утвержденными Госгортехнадзором.
Пропан-бутановые смеси широко применяются при резке сталей, сварке и пайке легкоплавких цветных металлов, закалке, газовой сварке пластмасс. К месту сварки смесь поставляют в стальных баллонах под давлением 1,6 МПа или по газопроводам через перепускную рампу. При испарении 1 кг пропана образуется 500 дм3 газа.
Бензин является продуктом переработки нефти. Он представляет собой легко испаряющуюся прозрачную жидкость с резким характерным запахом. Пары бензина при сгорании в кислороде дают температуру пламени 2400— 2500°С. Для очистки бензина его фильтруют через войлок. Бензин используется для кислородной резки, а также для сварки и пайки легкоплавких металлов.
Керосин также является продуктом переработки нефти и представляет собой бесцветную желтоватую легко испаряющуюся жидкость. Керосин, применяемый для сварки и резки металлов, должен удовлетворять требованиям ГОСТ 4753—68. Керосин применяют также для сварки и пайки легкоплавких цветных металлов.
infopedia.su
Водород к ацетиленовым углеводородам - Справочник химика 21
Гибридные состояния углерода и 5р. Строение и особенности двойной и тройной связи. Изомерия и номенклатура этиленовых и аце тиленовых у1 леводородов. Геометрическая цис-, транс-) изомерия Способы получения. Физические и химические свойства алкенов и ал кинов. Реакции присоединения. Правило В. В. Марковникова. Исклю чение из этого правила (Хараш). Реакции окисления. Полимеризация Свойства ацетиленового водорода. Классификация и получение диено вых углеводородов. Физические и химические свойства. Эффект сопря жения. 1,4-Присоединение, Диеновые синтезы. Полимеризация диено вых углеводородов. Каучуки синтетические и натуральные. УФ и ИК спектры этиленовых и ацетиленовых углеводородов. [c.169] В соединениях первого типа при углероде с тройной связью имеется водород, в соединениях второго типа при атомах углерода с тройной связью водорода нет. Различия в свойствах таких соединений см. на стр. 87, 88. Изомерия ацетиленовых углеводородов, так же как и этиленовых, обусловлена изомерией углеродного ске-Рис. 17. Модель молекулы ацетилена лета И изомерией положения кратной связи. Интересно отметить, что общая формула состава ацетиленовых углеводородов С Н2 2 аналогична общей формуле состава диеновых углеводородов. Иначе говоря, непредельные углеводороды с двумя двойными связями изомерны углеводородам с одной тройной связью. Например, бутадиен-1,3 [c.84]Реакции присоединения. Ацетилены обладают большей ненасы-щенностью, чем олефины (алкены). В реакциях присоединения они могут взаимодействовать с двумя молекулами водорода, галогена и т. д, Для ацетиленовых углеводородов, как и для этиленовых, свойственны реакции электрофильного присоединения. Однако, учитывая характер хр-гибридизации углеродных атомов в ацетилене, при которой электроны, располагаясь ближе к ядру, втянуты внутрь молекулы, для алкинов будут более характерны реакции нуклеофильного присоединения. [c.86]
АЦЕТИЛЕН (этин) СН=СН - первый член гомологического ряда ацетиленовых углеводородов. Бесцветный газ, хорошо растворяется в ацетоне и хлороформе. А. открыт в 1836 г. Дэви, синтезирован в 1862 г. Бертло с угля и водорода, получен из карбида кальция в том же году Велером. В промышленности А. получают из карбида кальция, электронрекингом нли термоокислнтель-ным крекингом из метана. Смеси А, с воздухом взрывоопасны. А. чрезвычайно реакционноспособное непредельное соединение. Молекула А. имеет линейное строение. Расстояние между углеродными атомами составляет 1,20 А, углерод находится в молекуле А, в третьем валентном состоянии (ер-гибридизация), атомы углерода связаны одной о- и двумя я-связями. Для А. характерны реакции присоединения галогенов, галогеноводородов, воды (в присутствии солей ртути), цианистоводородной кислоты, оксида углерода, спиртов, кислот, водорода и др. Атомы водорода в молекуле А, можно заместить щелочными металлами, медью, серебром, магнием. [c.36]
Замещение водорода при атомах углерода с тройной связью на металл. Все рассмотренные до сих пор реакции ацетиленовых углеводородов аналогичны реакциям углеводородов ряда этилена. Отличительной особенностью ацетиленовых углеводородов является подвижность атомов водорода, соединенных с углеродными атомами при тройной связи. Под влиянием последней эти атомы водорода проявляют способность замещаться на металл. При этом образуются металлические производные — Так, при пропуска- [c.87]
Образовавшиеся гибридные л/ -орбитали перекрываются друг с другом н орбиталями атома водорода, образуя по две сигма-связи, расположенные вдоль линии, соединяющей центры атомов (валентный угол 180°). Поэтому говорят о линейном строении ацетиленовых углеводородов. Схема образования а- и я-связи [c.197]
Исследование потенциалов ионизации ацетиленовых углеводородов [302] позволило установить ряд закономерностей, хорошо согласующихся с квантово-механическими представлениями о характере тройной связи. Согласно этим представлениям тройная связь образуется за счет одной пары ст-электронов и двух пар л-электронов, что обеспечивает ее большую прочность по сравнению с двойной связью. Действительно, потенциал ионизации ацетилена равен 11,46 в, т. е. на 0,84 в выше ионизационного потенциала этилена. При введении алкильных заместителей в молекулу ацетилена наблюдаются зависимости в определенной степени аналогичные тем, которые наблюдались в ряду метановых и -этиленовых углеводородов. Замещение водорода метильным радикалом приводит к заметному снижению ионизационного потенциала. Дальнейшее увеличение алкильного радикала дает значительно меньший эффект. [c.182]
Исходное сырье Мольное отношение водород ацетиленовые углеводороды Объемная скорость сырья, ч Содержание ацетиленовых углеводородов в продуктах гидрирования, вес. % [c.251]
Мольное отношение водород ацетиленовые углеводороды. ....... 35 1 [c.252]
Реакция присоединения хлористого водорода к ацетиленовым углеводородам типична для соединений с тройной связью [c.132]
Подвижность водородных атомов допускает и Я. М. Слободин. В одной из своих работ по изомеризации ацетиленовых углеводородов [24] он считает (бездоказательно), что на катализаторе происходит отщепление водородных атомов, находящихся в р-положе-НИИ к ацетиленовой связи, в результате чего образуются свободные радикалы, которые изомеризуются и обратно присоединяют водород [c.566]
Поскольку по условию задачи данный ацетиленовый углеводород не взаимодействует с аммиачным раствором А 20, он не имеет в своей структуре атомов водорода, связанных с sp-гибридизованны-ми атомами углерода. Единственная структура, соответствующая этому условию и содержащая 5 атомов углерода в главной цепи, это [c.220]
Присоединение водорода, галоидоводородов и галоидов. Присоединение водорода, галоидоводородов и галоидов к ацетиленовым углеводородам происходит в две стадии вначале разрывается [c.53]
Непосредственное присоединение водорода к углеводородным молекулам исходного сырья может происходить только при наличии в них двойных и тройных связей. При этом наиболее легко насыщаются ацетиленовые углеводороды, затем идут диены, а за ними олефины алифатического и циклического строения. Ароматические углеводороды требуют для своего гидрирования более высоких парциальных давлений водорода. [c.67]
Если в ацетиленовых углеводородах при углероде с тройной связью имеется атом водорода, то этот атом способен замещаться металлом. Так, при пропускании ацетилена через аммиачный раствор азотнокислого серебра выпадает белый осадок ацетиленистого серебра Ag—С=С—Ag. Аммиачный раствор хлористой меди дает красно-бурый осадок ацетиленистой меди. Ацетиленистая медь и ацетиленистое серебро в сухом виде при нагревании или прн ударе легко взрываются. [c.93]
Напротив, для таких прочно адсорбирующихся соединений, как нитросоединения, ацетиленовые углеводороды и т. п., вытесняющих водород с поверхности, эффект сольватации будет уменьшать их поверхностную концентрацию, улучшать активацию водорода и, как следствие этого, увеличивать скорость реакции в полном противоречии с выводами теории абсолютных скоростей реакций. С точки зрения потенциальных профилей реакции (рпс. 13) сольватация продуктов реакции не должна менять высоту энергетического барьера и, следовательно, скорость процесса. Между тем блокировка поверхности продуктами реакции — одна из основных причин изменения скорости реакции и ее порядка. Сольватация продуктов реакции, облегчающая их десорбцию с поверхности, может весьма существенно влиять на скорость процесса. [c.102]
Таким образом, для слабо адсорбирующихся соединений (малое смещение потенциала в ходе реакции) влияние природы растворителя проявляется прежде всего в изменении энергии связи водорода с поверхностью катализатора. Для 0 = 0,5 энергия связи Р1—Н растет с повышением pH (в пределах 1—13) от 258 до 269 кДлмоль. В том же интервале pH энергия связи этиленовых углеводородов (гексен-1) уменьшается от 93,4 до 90,7 кДж/моль, а для ацетиленовых углеводородов — с 212 до 205,5 кДж/моль. [c.201]
При гидрогенизации этиленовых или ацетиленовых углеводородов молекулярным водородом в присутствии N1 молекулы водорода адсорбируются на поверхности катализатора, что вызывает ослабление связи Н — Н и позволяет атомам водорода присоединиться к этиленовому производному, которое также адсорбировано на поверхности катализатора (рис. 85). [c.151]
Ацетиленовый углеводород с концевой тройной связью перемешивают с сильнощелочным раствором гипобромита натрия. Более тяжелый 1-бромацетилен оседает через несколько минут или часов в зависимости от кислотности атома водорода у тройной связи и от растворимости образующегося соединения в воде. [c.288]
Так как молекулы ацетиленовых углеводородов с одной тройной связью содержат на четыре атома водорода меньше, чем молекулы соответствующих предельных углеводородов, то состав их можно выразить общей формулой / [c.90]
Ацетиленовые углеводороды являются в еще большей мере ненасыщенными, чем этиленовые углеводороды. Поэтому ацетиленовые углеводороды легко вступают в реакции присоединения. Их молекулы способны присоединить четыре атома водорода или галоида или две молекулы галоидоводорода. [c.91]
Ацетиленовые углеводороды способны к полимеризации. Так, ацетилен в присутствии солей закиси меди (катализатор) по-лимеризуется в весьма интересный продукт—винилацетилен СН=С—СН=СН2- Его можно рассматривать как продукт, полученный замещением в ацетилене атома водорода радикалом винилом —СН=СН2. [c.93]
Эта реакция интересна с точки зрения источника, из которого получается активный водород, идущий на образование углеводорода. Простые виниловые эфиры легко получить реакцией между ацетиленовыми углеводородами и спиртами или между кетонами и этилортоформиатом последняя обычно используется для защиты кето-группы [17]. Виниловые эфиры практически мгновенно гидролизуются кислотой, а в некоторых случаях — кипящей водой в отсутствие катализатора, образуя кетоны. [c.141]
На основе результатов исследования реакций гидрирования олефиновых, диеновых и ацетиленовых углеводородов можно отметить общие черты и особенности каталитического действия катионных форм цеолитов в сравнении с катализаторами других классов. Так, по некоторым свойствам, проявляемым в реакциях гидрирования, цеолиты близки к металлическим катализаторам. Сюда относятся дейтероводородный обмен в олефинах, происходящий при дейтерировании пиперилена, и отсутствие этого обмена в исходном диеновом углеводороде. Распределение изомерных пентенов при гидрировании пиперилена, соответствующее равновероятному присоединению водорода к системе сопряженных двойных связей, также сближает цеолиты с металлическими катализаторами. И наконец, чприсоединение водорода к тройной углерод-углеродной связи при гидрировании ацетиленовых углеводородов, характерное для металлических катализаторов, происходит и на катионных формах цеолитов. [c.75]
Кроме того, для ацетиленовых углеводородов характерным свойством является способность замещать на металлы атомы водорода, находящиеся при атомах углерода тройной связи. При этом получаются ацетилениды [c.84]
Сравнительно недавно был разработан метод прямого введения алюминия на место водорода ацетиленовых углеводородов (гл. VI). Аналогичная реакция оказалась возможной и в случае циклопеитадиена, бензола и флуорена. Прямое алюминирование оказалось возможным и в случае супер-ароматического фурана и тиофена. [c.287]
Высокая склонность ацетилена к полимеризации проявляется даже при сильном разбавлении его водородом. Исследователи, изучавшие поведение ацетилено-водородных смесей в тихих разрядах, при напряжении 10 kV, отмечают Р , что проведение реакции при десятых долях мм Hg вызывает заметную полимеризацию ацетилена. Основными продуктами реакции являются при всех условиях и разбавлениях водородом ацетиленовые углеводороды, среди которых были найдены соединения, содержащие jo- [c.148]
КРЕМНЕВОДОРОДЫ (силаны) — соединения кремния с водородом. Предельные К-— силаны, аналоги предельных углеводородов, общей формулы 51лН2 21 предполагают, что существуют и непредельные К.— силены, аналоги этиленовых углеводородов, и силины — аналоги ацетиленовых углеводородов. К. отличаются неустойчивостью силано-вых цепей —31—31—. Плотность, температуры плавления и кипения К. выше, чем у соответствующих углеводородов. Низшие К.— газы с неприятным запахом высшие — летучие ядовитые жидкости с еще более неприятным запахом. Силаны растворяются в спирте, бензине, сероуглероде. Характерным свойством силанов является их чрезвычайно легкое окисление для некоторых силанов реакция окисления протекает с сильным взрывом. Если в закрытые сосуды с раствором силана в сероуглероде попадает воздух, происходит взрыв. Силаны — хорошие восстановители, быстро гидролизуются. Силаны получают разложением силицидов металлов кислотами или щелочами, восстановлением галогеносиланов гидридами или водородом и другими методами. [c.138]
Для очистки от сероокиси углерода, сероводорода и окиси углерода эти примеси каталитическими процессами превращают в соединения, менее вредные или легче удаляемые из газового потока. В качестве катализатора для гидрирования сернистых соединений в сероводород на промышленных установках применяют сульфид никеля [13], сульфат магния и окись цинка [22, 25], тиомолибдаты металлов [12] и окислы металлов [44]. Окись углерода превращают в двуокись, пропуская газ через один или несколько конверторов, в которых окись углерода, взаимодействуя на стационарном катализаторе с водяным паром, образует двуокись углерода и водород [5]. Образующуюся двуокись углерода удаляют из газового потока одним из рассмотренных выше процессов. Иногда небольшие количества окиси и двуокиси углерода удаляют превращением в метан реакцией гидрирования. Ацетиленовые углеводороды удаляют из алкенсодержащих газовых потоков процессом избирательного гидрирования [35, 68]. [c.99]
Ацетиленовые углеводороды ряда НС г СЕ, имеющие водород у углерода с тройной связью, дают натрий-зайащенные производные. [c.36]
Гидрирование ацетиленовых углеводородов. Присоединение водорода к ацетилену протекает очень легко. В 1874 г. П. Вильде 130], пропуская ацетилен с водородом над платиновой чернью, [c.351]
Затруднения на пути мыслимого процесса приводят и к тому, что существует немало веществ, для распада которых А00) тем не менее они могут существовать сколь угодно долго. Примером первого случая могут служить реакции горения различных органических соединений хотя для всех этих процессов уже при комнатной температуре АО О, эти вещества горят только при высокой температуре. Примером случая, когда АО > О, являются ацетиленовые углеводороды они неустойчивы к разложению на углерод и водород, причем их неустойчивость с ростом молекулярной массы возрастает, однако только при сысорсой температуре скорость их распада становится ощутимой. Эти обстоятельства позволяют сделать важный вывод если для образования данного вещества из элементарных веществ АО > О, то его можно получить только косвенным путем. Действительно, все оксиды хлора и азота (кроме N0) и многие другие соединения (в частности, ВаНв, 51Н4, НаТе) не могут быть получены прямым синтезом. [c.55]
Алкинами или ацетиленовыми углеводородами называют такие соединения углерода с водородом общей формулы СпН2,1-2, в молекулах которых есть тройные связи между атомами углерода. [c.197]
При действии б ромистого водорода на ацетиленовые углеводороды имеет место перекисный эффект Хараша , т. е. в присутствии перекиси бромистый водород присоединяется вопреки правилу Марковникова. [c.219]
Обессеривание соответствующим образом аамещенных серусо-держащих соединений никелем Ренея, насыщенным водородом, представляет собой один из путей получения углеводородов (гл. 1 Алканы , разд. А.7). Однако если одновременно с никелем Ренея использовать азеотропную перегонку с бензолом или циклогексаном с целью удаления как воды, так и водорода, то из тиондисульфидов можно получить и ацетиленовые углеводороды [421 [c.186]
Кадьо и Ходкевич недавно разработали специфический метод окислительной конденсации двух неодинаковых ацетиленовых углеводородов. Этинильное соединение и 1-бромацетиленовое производное реагируют в присутствии основания с отщеплением бромистого водорода. Реакция катализируется солью одновалентной меди в результате быстро образуется несимметричный диин с высоким выходом. [c.241]
chem21.info
Ацетиленовый водород - Большая Энциклопедия Нефти и Газа, статья, страница 1
Ацетиленовый водород
Cтраница 1
Ацетиленовый водород, по-видимому, не имеет непосредственного отношения к катализу, поскольку типичные продукты присоединения дают и диалкилацетилены. [1]
Ацетиленовый водород винилацетилена также способен перемещаться в а-положение, и образующаяся нестойкая молекула может димеризо-ваться или сама по себе, или с новой молекулой ацетилидена. В последнем случае образуется триен, который будет изомеризоваться, как и в случае триена Вилыптеттера, вследствие перемещения водорода в р-положение, и в зависимости от того, из какого из ограничивающих триеновую группировку углеводородных остатков - СН или СН2 - произойдет перемещение водорода в р-положение. [2]
Поскольку определению ацетиленового водорода с помощью нитрата серебра мешают альдегиды, была предложена модификация этого метода, включающая отделение ацетиленида серебра до титрования. В другом методе 158 осаждение ацетиленида серебра осуществляют в 2 % - ном растворе ацетата натрия, в котором альдегиды лишь очень медленно окисляются нитратом серебра. [3]
Положение сигнала ацетиленового водорода в спектрах ПМР в некотором смысле аномально, так как экранирование протона в этилене меньше, чем в этане, то можно было ожидать, что в молекуле ацетилена оно будет еще меньшим. Однако сигнал ацетиле новых протонов появляется в спектре между сигналами протонов этана и этилена. Причина этого явления заключается в магнитной анизотропии тройной связи. [4]
AgjjO и GuaO ацетиленовый водород замещается па металл. Na образует аллиленнатрий СН3С: GNa; при пропускании над флоридином ( 180 - 360) изомеризуется в аллеи СН2ССН2; по-лимеризуется под действием УФ-света; гидратируется над H. [5]
Роль радикалов, замещающих ацетиленовый водород, играли: третичный бутил, вторичный пропил, первичный нормальный гексил, фенил и водород. В последнем случае образующийся а-ацетиленилпропионо-вый альдегид был получен взаимодействием хлорацетона с очень большим избытком магнийбромацетилена. [6]
Большое смещение полос поглощения ацетиленового водорода обусловлено, кроме того, образованием водородной связи за счет неподеленных пар электронов кислорода окиси и подвижного водорода связи. [7]
Благодаря содержанию в частицах ацетиленового водорода, эти углеводороды дают медное и серебряное производные при обработке аммиачными растворами полухлористой меди и окиси серебра. Из их производных особенно важное значение имеют продукты присоединения хлористого водорода при действии соляной кислоты в присутствии полухлористой меди и нашатыря. [8]
Вещество дает типичные реакции на активный ацетиленовый водород: с 2 % раствором сулемы - белый осадок, с аммиачным раствором окиси серебра - белый, моментально чернеющий осадок, с аммиачно-медным раствором - желтый осадок. [9]
Ниже описано шесть мето-юв определения ацетиленового водорода с помощью реакции замещения серебром. [10]
Ниже описано шесть мето-юв определения ацетиленового водорода с помощью реакции замещения серебром. [11]
Несмотря на наличие в нем незамещенного ацетиленового водорода, гликоль этот не реагирует с аммиачным раствором окиси серебра в обычных условиях, осадок ацетиленида серебра образуется лишь при нагревании. [12]
Если из ацетиленовых а-гликолей с замещенным и незамещенным ацетиленовым водородом тюд влиянием серной кислоты образуются производные дигидро - и тетрагидрофурана, то можно было ожидать, что из соответствующих ацетиленовые Р - ГЛИ-колей в указанных условиях получатся производные дигидро - и тетрагидропирана. Чтобы проверить это предположение, нами было синтезировано несколько таких гликолсй и изучено их взаимодействие с серной кислотой. [13]
Для получения ацетиленовых пинаконов, содержащих свободный ацетиленовый водород, пользуются обычно а-кетоспиртами типа RRjCOH-СО-R2, конденсируя их с ацетиленом в присутствии порошкообразного КОН или в присутствии амида натрия, или же действуя на них димагнийдибромацетиленом. [14]
Влияние галогенидов и альдегидов на определение ацетиленового водорода иллюстрируют данные табл. 9.2. Галогениды в указанных в таблице количествах не мешают определению. После осаждения галогенида серебра легко наблюдается конечная точка титрования. [15]
Страницы: 1 2 3
www.ngpedia.ru
Ацетилен реакции гидрирования - Справочник химика 21
По некоторым данным, реакция гидрирования ацетилена (как в этилен, так и в этан) — первого порядка по водороду и нулевого (или отрицательного) — по ацетилену. Аналогичными кинетически- [c.240]Методом низкотемпературного фракционирования смесь разделяют на этан, этилен, пропан, пропилен и топливный газ. Этан и пропан подвергают дальнейшему крекингу в трубчатых печах в присутствии водяного пара для получения этилена и пропилена. После компрессии и охлаждения газы снова направляют на установку для разделения газов. Ацетилен удаляется путем каталитического гидрирования либо из общего количества нефтезаводского газа, либо только из этиленовой фракции. Разделение пропана и пропилена осуществляется дистилляцией или, если это целесообразно, проведением со смесью ряда реакций. Стоимость установки для производства 90 ООО т этилена и 43 ООО т пропилена из нефтезаводских газов составляет 9,9 млн. долларов, цена 1 фунта этилена и пропилена 0,0241 доллара. [c.9]
Гораздо большее значение имеет парциальное (частичное) гидрирование ацетиленов. Возможность селективного осуществления этой реакции определяет, как правило, высокий выход олефинов. Наиболее подходящими катализаторами являются поверхностные палладиевые катализаторы, особенно частично дезактивированные ацетатом свинца (катализатор Линдлара, см. ГЗ), хинолином или гидроксидом калия, и никелевые катализаторы (скелетный, а также так называемые бориды никеля Р-1 и Р-2 и К1с-катализатор, получаемые восстановлением ацетата никеля соответственно борогидридом натрия в водно-спиртовом растворе и гидридом натрия в тетрагидрофуране в присутствии третичного амилового спирта). Скорость гидрирования тройной связи на этих катализаторах выше, чем двойной, в то время как на других катализаторах такого различия или нет, или, наоборот, двойная связь гидрируется с большей скоростью (особенно если это концевые связи). Замедление реакции гидрирования алкинов после поглощения 1 моль водорода значительно облегчает необходимое его дозирование. [c.43]Реакции ацетилена, а. Ацетилен, подобно прочим непредельным углеводородам, обладает способностью присоединять водород, галогены и т. д. Так, при реакции гидрирования ацетилен способен присоединять до четырех атомов водорода, переходя в конечном счете в предельный этан [c.65]
С промышленной точки зрения метан является более перспективным исходным материалом для синтеза цианистого водорода, чем ацетилен. Реакции (1) и (2) весьма эндотермичны, и в случае применения обычного трубчатого реактора интенсивный подвод большого количества тепла для поддержания температуры 1500° представляет в промышленных условиях очень значительные трудности. Выше упоминалось о проведении реакции в электрической дуге как об одном из решений этой проблемы. Вторым решением является сожжение части реагирующих газов внутри реактора. Последний способ был применен при осуществлении реакции (2) и используется сейчас при промышленном производстве цианистого водорода из нефтяного сырья. Этот метод разработан в начале тридцатых годов Андрус-совым [6], который пропускал при 1000° над платиновым катализатором смесь аммиака, кислорода и метана, полученного гидрированием угля или из коксовых газов. В смеси должно находиться достаточное количество кислорода, чтобы могла протекать реакция [c.376]
Псевдоионон в 6 стадий наращивают до изофитола [31, 32] при многократном повторении однотипных реакций конденсации кетонов с ацетиленом, частичном гидрировании тройных связей ацетиленовых спиртов до двойных, кроме того, применяется конденсация третичного ненасыщенного спирта с дикетеном или ацетоуксусным эфиром с последующей перегруппировкой [34]. [c.318]
Изз чению кинетики реакции гидрирования ацетилена и окиси азота на различных катализаторах посвящены многие работы [60, 84—87]. Установлено, что на никелевых, палладиевых и платиновых катализаторах реакция гидрирования ацетилена до этана имеет нулевой порядок по ацетилену и первый по водороду. [c.443]
Доказательства участия в реакциях гидрирования атомов водорода были получены и в опытах с ацетиленом. На катализаторе из сплава палладия с 5,9% (масс.) никеля при низких давлениях ацетилена этилен является единственным продуктом гидрирования водородом, поступающим через мембранный катализатор. Скорость образования этилена не увеличивается при нарастании количества водорода в газовой фазе, а подача смеси ацетилена с водородом при тех же условиях не приводит к гидрированию [70]. [c.112]
Несовпадение расчетных и экспериментальных составов по водороду и по ацетилену и этилену можно объяснить отсутствием в условиях плазмоструйного пиролиза реакций гидрирования. Нами были проведены также термодинамические расчеты квазиравновесных составов продуктов разложения углеводородов с соотношением [c.114]
Отсутствие зависимости скорости реакции от давления ацетилена или небольшое снижение скорости с ростом давления отражает тот факт, что гидрирование не зависит от концентрации или тормозится с повышением концентрации ацетилена. Это показывает, что ацетилен прочно связан с поверхностью катализатора с одновременным разрывом связи СН. Ацетилен сильно адсорбируется поверхностью металлов, затрудняя последующие реакции. Например, Фаркаш А., Фаркаш Л. и Ридил (1934) нашли, что никелевая спираль, обработанная вначале ацетиленом, была затем не активна в реакции гидрирования этилена. [c.149]
Согласно этой схеме, этилен разлагается по трем параллельным направлениям превращается в ацетилен (А з), гидрируется до этана к ) и превращается в какие-то другие продукты, которыми могут быть метан, пропан, пропилен и твердые вещества (кд). В качестве конечных продуктов реакции в этой схеме взяты, кроме твердых веществ и водорода, все те, которые в данном случае в меньшей степени могут участвовать в образовании ацетилена, т. е. метан, пропан и пропилен. Таким образом, мы не рассматриваем образование и разложение каждого из перечисленных углеводородов в отдельности и пренебрегаем безусловно малыми количествами этана, этилена и ацетилена, возможно, из них образующихся. Кроме того, не учтены обратные реакции гидрирование ацетилена и дегидрирование этана, поскольку, как показали опыты с ацетиленом и этаном, степени превращения их в этилен невелики и количеством образующегося из них этилена можно вполне пренебречь ио сравнению с его исходным количеством. [c.63]
Для ненасыщенных соединений хорошо изучены реакции присоединения к олефинам и ацетиленам. Каталитическое гидрирование ацетиленов обычно приводит к г ыс-олефинам (рис. 42), так как водород с поверхности катализатора приближается к тройной связи с одной стороны. Аналогично восстановление действием ВгНе с последующим гидролизом уксусной [c.81]
Изучению кинетики реакции гидрирования ацетилена и окиси азота на различных катализаторах посвящены многие работы - Установлено, что на никелевых, палладиевых и платиновых катализаторах реакция гидрирования ацетилена до этана имеет нулевой порядок по ацетилену и первый по водороду. Однако в литературе отсутствуют надежные данные о кинетике реакции гидрирования N0 на катализаторах платиновой группы. [c.347]
Благодаря этому появляется возможность более глубоко проникнуть в механизм реакции гидрирования. Наиболее наглядно преимущества этого метода выявляются при гидрировании за счет поглощенного катализатором водорода. Если в каком-либо растворителе насытить водородом мелкораздробленный катализатор до установления обратимого потенциала, а затем при интенсивном перемешивании проводить гидрирование за счет этого водорода, то э. д. с. катализатора падает непрерывно до тех пор, пока не израсходуется адсорбированный водород. Затем может проходить гидрирование за счет растворенного водорода при постоянном потенциале. Общее количество водорода, которое удается извлечь из катализатора, зависит от растворителя, температуры и природы гидрируемого вещества. Некоторые соединения, подобные ацетилену способны по энергетическим и пространственным соображениям извлекать из катализатора весь водород, и адсорбированный и растворенный. [c.588]
Сероводород и СОг обычно удаляют абсорбцией диэтанолами-нами. Ацетилен можно удалять гидрированием его в присутствии катализаторов в этилен или экстракцией растворителями. Фирмы Галф , Келлог и др., например, применяют метод гидрирования. Гидрирование обычно проводится при температуре 120— 130 в присутствии окиси никеля или хрома в качестве катализаторов. Для гидрирования используется водород, образующийся в результате реакций пиролиза. [c.55]
Переработка этилена в большинстве случаев требует тщательной очистки его от ацетилена. Так, при производстве полиэтилена под высоким давлением и окиси этилена содержание С2Н2 не должно превышать 10 частей на 1 млн, частей [2], что соответствует 99,5—99,8%-ному удалению ацетилена. Селективному гидрированию подвергаются целиком газы пиролиза перед фрак-циопировкоп или же только этиленовая фракция. В первом случае ацетилен гидрируется водородом, содержащимся в газах пиролиза. В последнем случае для производства этилена высокой чистоты потребовалось бы введение водорода извне, а также новая ступень разделения газов кроме того, управление высокоэкзотермической реакцией гидрирования затрудняется [13]. Вследствие этого установка гидрирования ацетилена размещается обычно перед фракдпопировкоп, после очистки от кислых газов. [c.151]
В работе [69] выполнено специальное исследование катализаторов на основе металлов платиновой группы (Р1, Р(1, Ни, 1г, Об, КЬ) в реакциях гидрирования ацетилена и окиси азота. Катализаторы содержали 0,1% металла, в качестве носителя использовалась активная окись алюмипия. Очистке подвергали водородсодержащий газ в смеси с ацетиленом (концентрация СдНа 1000 см /м ) или с окисью азота (концентрация N0 1 см /м ). Исследуемые металлы по активности в отношении обеих реакций располагались следующим образом [c.439]
Реакции гидрирования с участием к льтцианидной системы — примеры каталитического процесса, при котором металл активирует только водород [реакция (1) в разд. 2]. Скорости реакций (21), (22) [39] и (23) [33, 39] не зависят от концентрации цианид-иона это указывает на то, что олефиновые комплексы кобальта в ходе гидрирования не образуются. Другой пример гидрирования, протекающего по реакции (1),—это гидрирование, катализируемое, производными непереходных металлов н, в частности, литийалюминййгидридом, который катализирует восстановление ацетиленов до гранс-олефинов и сопряженных диенов до моноенов в тетрагидрофуране при 190 °С и давлении 100 атм [40]. Эти и другие сходные реакции, катализируемые гидридами металлов [41], протекают через промежуточное образование металлалкильных производных, которые расщепляются непосредственно водородом. [c.19]
При реакции атомарного водорода с этиленом при обыкновенных температурах испускается свет и получается этанЭта реакция гидрирования идет даже при температуре жидкого воздуха. Могут итти также реакции дегидрирования, поскольку Клеменс и Патат изолировали из продуктов реакции ацетилен. [c.105]
Наряду с широко используемыми реакциями гидрирования для превращения недетектируемых соединений в органические соединения, определяемые пламенно-ионизационным детектором, в конвертерах используется также реакция воды с карбидом кальция, в результате которой образуется ацетилен [40], и реакция двойного конвертирования для регистрации кислорода пламенно-ионизационным детектором [41]. Оригинальным является направление, предложенное Б. Гудзиновичем и В. Смитом [42] для анализа нерадиоактивных соединений радиометрическим методом. Предложенный ими метод основан на том, что неорганический окислитель разрушает клатрат радиоактивного криптона с выделением радиоактивного изотопа, который затем регистрируется радиометрическим счетчиком. [c.180]
При гидрировании ацетиленов могут быть получены цис- и транс-алкепы в зависимости от условий проведения реакции. Гидрирование на палладии, слегка отравленном соединениями свинца или другими реагентами, приводит к образованию / ыс-алкенов. Гидрирование действием мэталлического лития в аммиаке или аминах дает транс-алкены. [c.99]
Если, как уже отмечалось выше, ключевым моментом реакции гидрирования является диссоциация водорода, то возникает вопрос почему поверхность катализатора способствует гидрированию ацетилена, но не способствует гидрированию этилена При рассмотрении зависимостей, описывающих процесс гидрирования (рис. 5.13), можно от метить, что,как только заканчивается индукционный период и весь ацетилен расходуется, ускоряется гидрирование этилена. Следовательно, исходная сульфидированная поверхность (поверхность I) не проявляет каталитической активности ни в реакции гидрирования ацетилена, ни в реакции гидрирования этилена. Однако в контакте с ацетиленш эта поверхность изменяется и образуется новая поверхность (П), обладающая способностью гидриршать ацетилен и этилен. Как только весь ацетилен из газовой фазы расходуется, поверхность возвращается в начальное неактивное состояние (I) и гидрирование этилена прекращается, т.е. ацетилен-гидрируется лишь частично. [c.126]
При каталитическом гидрировании олефинов ире-нмущественно происходит цис ш -присоединение аналогично ацетиленам. Реакции, в которых одновременно присоединяются две частицы от одной и [c.83]
Реакция между ацетиленом и водородом при участии металлических катализаторов приводит к образованию не то.лько этилена и этана, но также и продуктов с гораздо более высоким молекулярным весом. Последний процесс проходит при температуре значительно более низкой, чем температура, требуемая для полимеризации одного ацетилена в присутствии тех же металлов. Шеридан [11] изучал кинетику реакций, связанных с этим процессом, и внес некоторую ясность в понимание геометрических условий, имеющих место на подобных катализаторах. Хотя полное исчезновение ацетилена почти совершенно не зависит от температуры в пределах О—130°, соотношение этана, этилена или более тяжелых углеводородов меняется, причем чем проще реакция гидрирования, тем ниже кажущаяся энергия активации. Это различие в поведении этилена и ацетилена при гидрировании с простыми металлическими катализаторами, вероятно, возникает из-за большей ненасыщенности ацетилена. Адсорбированная молекула этиле[1а, удерживаемая в двух точках, вероятно, имеет углеродный скелет этана удерживаемый подобным же образом ацетилен имеет скелет этилена, и расстоя- [c.78]
Комплексы иридия(Т) также являются активными катализаторами процессов гидрирования [110]. Если в качестве катализатора используют т/)анс-1г С1(С0)(РРЬ)2, то этилен, пропилен и ацетилен подвергаются гидрированию при 40—60°. Колшлекс реагирует как с На, так и с С2Н4 с образованием продуктов, которые могут быть промежуточными соединениями в этой реакции. Лучшим катализатором этих реакций является 1гН(С0)(РР11з)д. Полагают, что в результате присоединения водорода и (или) субстрата образуются семикоординационные комплексы, менее стабильные, чем аналогичные шестикоординационные комплексы, полученные [c.125]
Практически не дает преимуществ. Повышение давления газообразного ацетилена выше одной атмосферы при температурах, требуемых для реакции конденсации, может привести к опасным взрывам. Однако имеется патент,по которому ацетилен, если он растворен в инертном масле, может быть превращен с большим выходом в жидкие углеводороды под давлением от IО до 200 атмосфер в присутствии таких катализаторов, как мелкораздробленное железо или бромистый магний. Роль катализатора при процессе конденсации ацетилена несколько трудно определима. Часто продолжительность его действия очень мала вследствие обволакивания углеродом, практически всегда осаждающимся при термической конденсации ацетилена при температурах от 650° и выше, в отсутствии таких активных разбавителей, как водород или водяной газ. Этотуглерод влияет на ход реакции и в некоторых случаях накапливается в таких количествах, что закупоривает реакционную трубку. Зелинский [31] утверждает, что наполнение трубки активированным углем снижает опасность вспышки и отложения углерода, а также повышает при температуре 600—650° содержание бензола в конечном продукте. Ики и Огура [32] нашли, что разница в каталитическом действии активированного угля, кокса и каолина при температурах 600°и выше невелика. Ковач и Трико [22] не смогли обнаружить специфического влияния активированного угля и нашли, что окись алюминия, кварц, фарфор, пемза и куски кирпича одинаково эффективны при оптимальной температуре 650 , после того как покроются углеродом в результате разложения ацетилена. Фишер, Бангерт и Пихлер [24 полагают, что выделившийся углерод действует как катализатор на полимеризацию ацетилена при 600—650. Этот же факт отмечает и Фужио [27]. Берль и Гофман [26] считают, что более пористые формы углерода способствуют разложению ацетилена, а более плотные—превращению его в жидкие продукты. Металлы, являющиеся промоторами реакций гидрирования и дегидрирования, [c.225]
chem21.info