Содержание
Свойства металлов и сплавов: химические, физические, механические, технологические
Главная » Сплавы » Какими свойствами обладают металлы и сплавы
На чтение 5 мин
Содержание
- Признаки металлов
- Классификация металлов
- Черные
- Цветные
- Основные виды сплавов
- Цинковые сплавы
- Алюминиевые сплавы
- Медные сплавы
- Свойства сплавов
- Физические свойства
- Химические свойства
- Механические свойства
- Технологические свойства
Металлические изделия и детали используются в разных сферах промышленности. Существует множество видов металлов и каждый из них обладает сильными и слабыми сторонами. При изготовлении деталей для машин, самолётов или промышленного оборудования мастера обращают внимание на характеристики материала. Поэтому требуется знать свойства металлов и сплавов.
Свойства металлов и сплавов
Признаки металлов
У металлов есть признаки, которые их характеризуют:
- Высокие показатели теплопроводности.
 Металлические материалы хорошо проводят электричество.
Металлические материалы хорошо проводят электричество. - Блеск на изломе.
- Ковкость.
- Кристаллическая структура.
Не все материалы прочные и обладают высокими показателя износоустойчивости. Это же касается плавления при высоких температурах.
Классификация металлов
Металлы разделяются на две большие группы — черные и цветные. Представители обоих видов различаются не только характеристиками, но и внешним видом.
Черные
Представители этой группы считаются самыми распространёнными и недорогими. В большинстве своем имеют серый или тёмный цвет. Плавятся при высокой температуре, обладают высокой твердостью и большой плотностью. Главный представитель этой группы — железо. Эта группа разделяется на подгруппы:
- Железные — к представителям этой подгруппы относится железо, никель и кобальт.
- Тугоплавкие — сюда входят металлы температура плавления которых начинается с 1600 градусов. Их применяют при создании основ для сплавов.

- Редкоземельные — к ним относятся церий, празеодим и неодим. Обладают низкой прочностью.
Существуют урановые и щелочноземельные металлы, однако они менее популярны.
Цветные
Представители этой группы отличаются яркой окраской, меньшей прочностью, твердостью и температурой плавления (не для всех). Разделяется эта группа на следующие подгруппы:
- Лёгкие — подгруппа, включающая в себя металлы с плотностью до 5000 кг/м3. Это такие материалы, как литий, натрий, калий, магний и другие.
- Тяжёлые — сюда относится серебро, медь, свинец и другие. Плотность превышает 5000 кг/м3.
- Благородные — представили этой подгруппы имеют высокую стоимость и устойчивость к коррозийным процессам. К ним относятся золото, палладий, иридий, платина, серебро и другие.
Основные виды сплавов
Человечество знакомо с различными металлическими сплавами. Самыми многочисленными из них являются соединения на основе железа. К ним относятся ферриты, стали и чугун. Ферриты имеют магнитные свойства, в чугуне содержится более 2,4% углерода, а сталь — это материал с высокой прочность и твердостью.
Самыми многочисленными из них являются соединения на основе железа. К ним относятся ферриты, стали и чугун. Ферриты имеют магнитные свойства, в чугуне содержится более 2,4% углерода, а сталь — это материал с высокой прочность и твердостью.
Отдельное внимания требуют металлические сплавы из цветных металлов.
Производство стали
Цинковые сплавы
Соединения металлов, которые плавятся при низких температурах. Смеси на основе цинка устойчивы к воздействию коррозийных процессов. Легко обрабатываются.
Алюминиевые сплавы
Популярность алюминий и сплавы на его основе получили во второй половине 20 века. Этот материал обладает такими преимуществами:
- Устойчивость к низким температурам.
- Электропроводность.
- Малый вес заготовок в сравнении с другими металлами.
- Износоустойчивость.
Однако нельзя забывать про то, что алюминий плавится при низких температурах. При температуре около 200 градусов характеристики ухудшаются.
Алюминий применяется при изготовлении комплектующих к машинам, производстве деталей для самолётов, составляющих промышленного оборудования, посуды, инструментов.
Не многие знают, что алюминий популярен в сфере производства оружия. Связано это с тем, что детали из алюминия не искрят при сильном трении.
Медные сплавы
Сплавы на основе меди — марки латуни. Из этого материала изготавливаются детали высокой точности, так как латунь легко обрабатывать. В составе сплава может содержаться до 45% цинка.
Свойства сплавов
Чтобы изготавливать детали и конструкции, нужно знать основные свойства металлов и сплавов. При неправильной обработке готовая деталь может быстро выйти из строя и разрушить оборудование.
Двигатель внутреннего сгорания
Физические свойства
Сюда относятся визуальные параметры и характеристики материала, изменяющиеся при обработке:
- Теплопроводность. От этого зависит насколько поверхность будет передавать тепло при нагревании.
- Плотность. По этому параметру определяется количество материла, которое содержится в единице объёма.

- Электропроводность. Возможность металла проводить электрический ток. Этот параметр называется электрическое сопротивление.
- Цвет. Этот визуальный показатель меняется под воздействием температур.
- Прочность. Возможность материала сохранять структуру при обработке. Сюда же относится твердость. Эти показатели относятся и к механическим свойствам.
- Восприимчивость к действию магнитов. Это возможность материала проводить через себя магнитные лучи.
Физические основы позволяют определить в какой сфере будет использоваться материал.
Химические свойства
Сюда относятся возможности материала противостоять воздействию химических веществ:
- Устойчивость к коррозийным процессам. Этот показатель определяет на сколько материал защищён от воздействия воды.
- Растворимость. Устойчивость металла к воздействию растворителей — кислотам или щелочным составам.
- Окисляемость. Параметр указывает на выделение оксидов металлом при его взаимодействии с кислородом.

Обуславливаются эти характеристики химическим составом материала.
Механические свойства
Механические свойства металлов и сплавов отвечают за целостность структуры материала:
- прочность;
- твердость;
- пластичность;
- вязкость;
- хрупкость;
- устойчивость к механическим нагрузкам.
Технологические свойства
Технологические свойства определяют способность металла или сплава изменяться при обработке:
- Ковкость. Обработка заготовки давлением. Материал не разрушается. Структура изменяется.
- Свариваемость. Восприимчивость детали к работе сварочным оборудованием.
- Усадка. Происходит этот процесс при охлаждении заготовки после её разогрева.
- Обработка режущим инструментом.
- Ликвация (затвердевание жидкого металла при понижении температуры).
Основной способ обработки металлических деталей — нагревание.
( 3 оценки, среднее 3. 67 из 5 )
67 из 5 )
Поделиться
КАКИМИ СВОЙСТВАМИ ОБЛАДАЮТ МЕТАЛЛЫ
РЕДКИЕ МЕТАЛЛЫ
Одно из важнейших свойств металла — его твёрдость.
Железный гвоздь нельзя забить в камень или кирпич, так как они твёрже, чем железо. Твёрдость — это способность тела сопротивляться вдавливанию в его поверхность другого тела.
Самой высокой твёрдостью обладает химический элемент углерод, встречающийся в виде алмаза. Алмазной крупинкой с остро отточенными краями легко режут стекло. С твёрдостью алмаза сравнивают твёрдость всех других веществ.
Установлена сравнительная шкала твёрдости. По этой шкале твёрдость алмаза равна 10 единицам. Все другие минералы и металлы имеют твёрдость меньше 10. Эта шкала твёрдости называется минералогической.
Твёрдость кристаллического тела во многом зависит от типа решётки. Чем ближе расположены атомы друг к другу и чем больше находится электронов во внешних слоях атомов, тем твёрже тело.
Различные металлы имеют разную твёрдость. На этом основана их обработка резанием. Например, стальной резец легко снимает стружку с медных или алюминиевых изделий, а для обработки самой стали требуется резец из более твёрдых, чем сталь, сплавов.
Твёрдость металлов и сплавов измеряют особым прибором — твердомером (рис. 6), главной частью которого является оправка с алмазным наконечником. Под действием строго определённого груза алмаз углубляется в поверхность испытуемого изделия. Чем глубже он войдёт, тем менее твёрдо изделие. Конечно, не всякий раз замеряют глубину внедрения алмаза. Стрелка твердомера сразу показывает единицы твёрдости.
Испытаниями определено, что твёрдость закалённой стали в де — сять-пятнадцать раз выше твёрдости меди и в пять раз выше твёрдости алюминиевых сплавов.
Важным качеством металла является его прочность.
Какой груз можно подвесить, например, на тонкой проволоке, поперечное сечение которой один квадратный миллиметр?
Если проволока из меди, то она выдержит груз не более 20—22 килограммов, проволо — рис 0^ Прибор для испытания металлов ка из высокопрочной на твёрдость: /—циферблат, 2—алмаз стали выдерживает для испытания, 3 — столик с винтом, 4 — до 180—200 килограм — рукоятка, 5—груз,
Мов. Эти нагрузки соответствуют пределу прочности, так как дальнейшее увеличение груза приведёт к разрыву проволоки.
Эти нагрузки соответствуют пределу прочности, так как дальнейшее увеличение груза приведёт к разрыву проволоки.
Пределом прочности металла при растяжении называется нагрузка, приходящаяся на каждый квадратный миллиметр поперечного сечения образца в момент его разрушения.
Часто нагрузку, которая приходится на единицу площади (на 1 мм), называют напряжением. При испытании металлов на прочность получают специальные диаграммы растяжения (рис. 7). На этой диаграмме по
Рис. 7. Диаграмма растяжения образца: перво Начальная длина образца, — увеличение длины образца. |
Вертикальной оси отмечается величина нагрузки, а по горизонтальной — величина удлинения образца при его растяжении.
Рис. 8. Образцы двух разных металлов после испытания на растяжение: а — хрупкий металл, б—пластичный металл. |
Разные металлы резко отличаются друг от друга по прочности. Например, некоторые сорта стали имеют предел прочности до 200 кг! мм2, а свинец — всего 2 кг! мм2.
Во время испытания на растяжение стального и свинцового образцов (рис. 8) даже неопытный наблюдатель заметит существенную разницу в их поведении. Свинцовый образец до разрыва увеличивается в длину почти вдвое. Стальной же образец до самого разрушения почти не изменится в длине и разрушится с треском сразу.
Способность металла под действием сил изменять свою первоначальную форму называется пластичностью.
Какой металл практически лучше — тот, который разрушается без изменения своей формы, или тот, который способен перед разрушением несколько изменять форму, т. е. деформироваться?
Стальные балки железнодорожного моста, по которому идут днём и ночью нагруженные составы, обладают, кроме прочности, ещё и пластичностью. В противном случае они при перегрузке моста без изменения формы и размеров разрушились бы, как разрушается стекло. Но так как стальные балки моста обладают некоторой пластичностью, то при действии больших нагрузок они вначале чуть-чуть изогнутся и останутся в таком виде и после того, как состав уйдёт. Это даёт возможность при осмотре обнаружить изгиб балок и принять меры, предупредить катастрофу.
Но так как стальные балки моста обладают некоторой пластичностью, то при действии больших нагрузок они вначале чуть-чуть изогнутся и останутся в таком виде и после того, как состав уйдёт. Это даёт возможность при осмотре обнаружить изгиб балок и принять меры, предупредить катастрофу.
Благодаря свойству пластичности детали машин и сооружений как бы «сигнализируют» о том, что работают при чрезмерно больших напряжениях. Вот почему для изготовления деталей машин и для узлов конструкций употребляются металлы, обладающие достаточными пластичными свойствами.
В технике очень много сооружений, на которые длительное время воздействуют небольшие нагрузки. Наблюдая за поведением нагруженных узлов, можно обнаружить, что они непрерывно, хотя и очень медленно, изменяют свою первоначальную форму.
Свойство металлов медленно и непрерывно изменять свою форму при длительном воздействии даже невысоких напряжений называется ползучестью. Одни металлы, как, например, свинец, медь, олово и др. , находясь под нагрузкой, заметно ползут уже при комнатной температуре. Например, тяжёлый свинцовый лист, прибитый гвоздём к стенке, под действием своего веса постепенно «поползёт» вниз (рис. 9). Ползучесть стали возможна лишь при повышенных температурах. Чем большей устойчивостью против ползучести обладает сплав, тем он более ценен для машин, детали которых ргаботают при высоких температурах.
, находясь под нагрузкой, заметно ползут уже при комнатной температуре. Например, тяжёлый свинцовый лист, прибитый гвоздём к стенке, под действием своего веса постепенно «поползёт» вниз (рис. 9). Ползучесть стали возможна лишь при повышенных температурах. Чем большей устойчивостью против ползучести обладает сплав, тем он более ценен для машин, детали которых ргаботают при высоких температурах.
Есть ещё очень важное свойство металлических изделий — сопротивляться действию переменных по величине и по направлению нагрузок. Примером такого изде —
Рис. 9 — Свинцовый лист, прибитый гвоздём к стене, «ползёт» даже ори обычной температуре; а — перемещение листа под действием собственного веса. |
Лия может служить коленчатый вал двигателя (рис. 10). При работе он многократно подвергается изгибу во всевозможных направлениях. При этом напряжение всё время изменяет свою величину и направление.
Известны случаи поломки коленчатых валов даже при небольших напряжениях. Такие поломки обычно происходят после длительной работы детали. Объясняется это
Рис. 10. Коленчатый вал должен обладать высокой выносливостью при переменных нагрузках. |
Тем, что при длительном воздействии многократно повторяющихся напряжений в одном каком-то месте появляется мельчайшая невидимая невооружённым глазом трещина, которая с течением времени увеличивается и, наконец, приводит к разрушению детали. В таких случаях говорят, что деталь разрушилась от усталости. Изучение усталости металлов показало, что все металлы и сплавы обладают пределом выносливости. Пределом выносливости называется величина напряжения,
Которое может выдержать деталь без разрушения при сколь угодно большом количестве нагружений. Чем выше предел выносливости металла, тем при более высоких переменных напряжениях может работать деталь. Например, стальная ось железнодорожного вагона рассчитывается так, чтобы она в течение своей жизни могла выдержать 400 миллионов нагружений, а вал паровой турбины— не менее 15 миллиардов смен нагрузок.
Например, стальная ось железнодорожного вагона рассчитывается так, чтобы она в течение своей жизни могла выдержать 400 миллионов нагружений, а вал паровой турбины— не менее 15 миллиардов смен нагрузок.
Мы выяснили, что практическая ценность металлов определяется в первую очередь их прочностью, пластичностью, твёрдостью и пределом выносливости. А можно ли улучшить эти качества металлов? Можно. Такую возможность даёт введение в обычные металлы небольших добавок некоторых редких металлов. Эти добавки в несколько раз повышают механические свойства металлов: твёрдость, предел прочности, предел усталости, сопротивление ползучести, упругость. Помимо этого, металлы становятся более стойкими против воздействия крепких кислот и щелочей, меньше теряют прочность при разогревании, лучше сопротивляются окислению.
Вот об этих свойствах редких металлов мы сейчас и расскажем.
С Реди редких металлов имеются такие, которые обладают особым физическим свойством — радиоактивностью.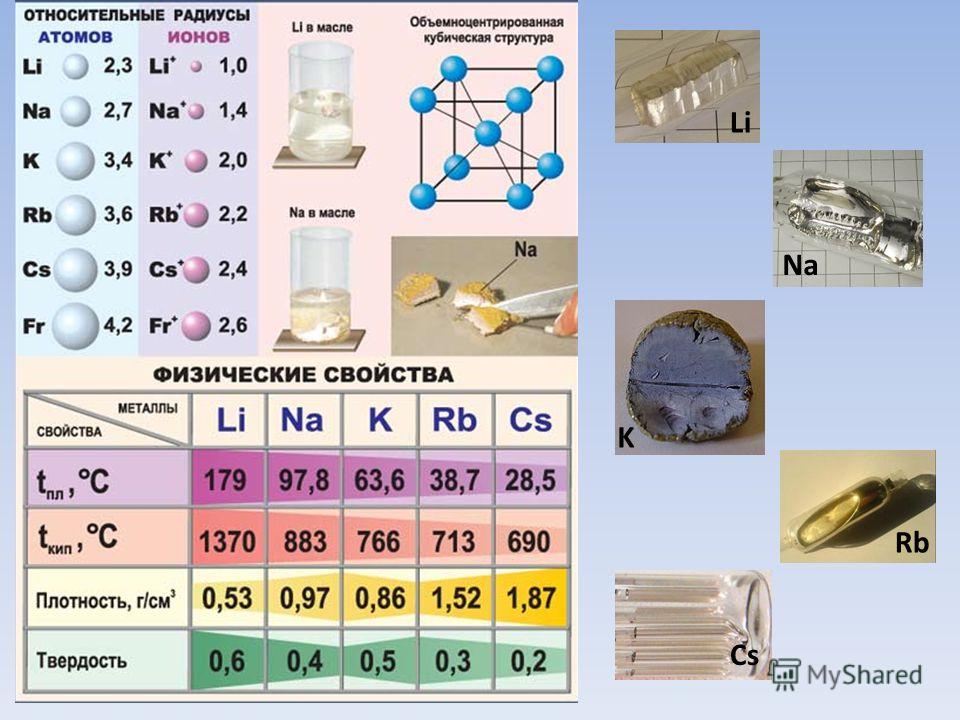 К ним относится радий, торий, уран. Изучение их началось с конца XIX века. В 1898 году молодой …
К ним относится радий, торий, уран. Изучение их началось с конца XIX века. В 1898 году молодой …
М Ного лет назад, исследуя золу, получающуюся при сжигании каменного угля, химики обнаружили в её составе 46 химических элементов. В их числе было немало редких и рассеянных элементов. Исследование морских …
В прежние времена, когда наука и техника были на низком уровне развития, природа для человека была единственным источником, откуда он брал в готовом виде всё, что ему нужно было для …
Свойства металлов, неметаллов и металлоидов
Учебные пособия
- Сообщение от
Джесси Ли
12
Апрель
Основные понятия – свойства металлов
В этом учебном пособии вы узнаете о свойствах металлов, неметаллов и металлоидов (полуметаллов), а также примеры металлических и неметаллических элементов.
Темы, освещенные в других статьях
- Катионы и анионы
- Как прочитать периодическую таблицу
- Периодические тенденции
Словарь
LUCKITION — способность быть втянутым в WEWER
Malleability — Способность быть в роли.
Блеск – качество отражения света от поверхности и возможность полировки
Знакомство с металлами, металлоидами и неметаллами
Элемент – это вещество, которое нельзя разложить на какое-либо другое вещество. Другими словами, элемент — это простейшая форма материи. Элементы далее классифицируются на металлы, неметаллы и металлоиды (полуметаллы). Неметаллы обычно находятся в верхней правой части периодической таблицы, металлы покрывают большую часть оставшейся площади, а между ними металлоиды.
Свойства металлов
Металлы — это элементы, образующие положительные ионы за счет потери электронов во время химических реакций, за исключением водорода. Таким образом, они являются электроположительными элементами с низкими энергиями ионизации. Большинство металлов обладают такими свойствами, как блестящие, очень плотные и имеющие высокие температуры плавления. Кроме того, они пластичны, податливы и блестящие. Металлы также являются хорошими проводниками тепла и электричества. Все металлы твердые при комнатной температуре, кроме ртути, которая находится в жидком состоянии.
Все металлы твердые при комнатной температуре, кроме ртути, которая находится в жидком состоянии.
Металлы обычно образуют ионные связи с неметаллами, но есть исключения. Большинство металлов образуют по крайней мере один основной оксид, хотя некоторые из них являются амфотерными. Металлы проявляют широкий диапазон реакционной способности. К особым группам металлов относятся благородные металлы Ru, Rh, Pd, Pt, Au, Os, Ir, Ag и тугоплавкие металлы Nb, Mo, Ta, W и Re.
Свойства металла:
- Имеющий блеск (блеск) от отражения света. Некоторые металлы образуют патину, и блеск теряется.
- Податливость в твердом состоянии. Золото — самый ковкий из всех металлов
- Будучи пластичным, это означает, что его можно вытянуть в проволоку. Серебро является одним из самых пластичных металлов
- Способен проводить тепло и электричество
- Образует катионы в водном растворе, теряя свои электроны
- Температура плавления металлов : Металлы часто имеют высокие температуры плавления и кипения, но есть много исключений до точки плавления, как цезий, галлий, ртуть, рубидий и олово, которые имеют довольно низкие температуры плавления.
 Тем не менее, большинство температур кипения все еще довольно высоки.
Тем не менее, большинство температур кипения все еще довольно высоки. - Металлы имеют широкий диапазон плотностей, но обычно они более плотные, чем неметаллы. Вольфрам, платина, осмий, золото и иридий очень плотные.
- Большинство металлов имеют серебристый цвет, хотя некоторые, такие как золото, цезий и медь, окрашены.
Примеры металлов
- Железо
- Медная
- Silver
- Mercury
- HEAND
- Алюминий
Свойства неметал
Немотибы являются элементами, которые образуют негативные INS на GONAPINGS. Таким образом, они являются электроотрицательными элементами с высокими энергиями ионизации. В целом неметаллы хрупкие, тусклые и плохо проводят тепло и электричество. Они, как правило, имеют более низкую температуру плавления, чем металлы. Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газообразное и твердое, за исключением брома, который существует в виде жидкости.
Примеры неметальных элементов
- Hydrogen
- Carbon
- Азот
- кислород
- Phosphorus
- Sulphur
Properties of Metalloids, Aka Semimetals
Semimets, Assalless, As Metallesles, Assalless, Asselals, Assalless, Asselals, Assalless
. и неметаллы. Все металлоиды являются твердыми телами. Металлоиды могут быть блестящими или тусклыми, но обычно имеют металлический блеск. Некоторые формы селена обладают удивительным, почти космическим блеском.
Они хрупкие и обычно являются полупроводниками. Полупроводники способны проводить электричество лучше, чем изолятор, но не так хорошо, как проводники.
Металлоиды обычно имеют химические свойства, подобные неметаллам. Большинство из них образуют несколько различных анионов с кислородом, которые образуют различные соли с металлами, хотя водный химический состав германия более ограничен. Они действуют как металлы при взаимодействии с галогенами и как неметаллы при взаимодействии с щелочными металлами. Германий активно используется в полупроводниковой промышленности.
Германий активно используется в полупроводниковой промышленности.
Некоторые полуметаллы, такие как селен и мышьяк, могут быть токсичными. Машина определения состава селена может измерять количество присутствующего селена.
Пять основных свойств металлоидов
- Свойства, промежуточные между металлами и неметаллами
- Внешнее сходство с металлами
- Полупроводники электричества
- Хрупкость
- Химические свойства больше похожи на неметаллы
- Металлоиды
- Boron
- Silicon
- Германия
- Селен (некоторые источники классифицируют селен как неметал)
- Arsenic
- ЭРТИМОНА
- Tellurium
Свойства для металлов. железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.

Металлы находятся в центре и слева в периодической таблице. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок науки о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы обладают характеристиками обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.
- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму. На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком.
 Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичный , что означает, что их можно вытягивать для изготовления проволоки.
Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичный , что означает, что их можно вытягивать для изготовления проволоки. - Электропроводность: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это с помощью некоторых предметов домашнего обихода. Продолжайте читать, чтобы узнать, как!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы претерпевают химические изменения (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся.
 Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!Другие металлы вообще не реагируют с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются как чистые металлы, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений. Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом.
 Калий и натрий — два щелочных металла.
Калий и натрий — два щелочных металла.Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Плохие металлы довольно мягкие, и большинство из них редко используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные сочетания
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе.
 Полученное вещество называют сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Полученное вещество называют сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются обработке и выглядят красиво. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения.
 Чистота золота измеряется в карата. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Чистота золота измеряется в карата. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.Металл из руды
Руды – это горные породы или минералы, из которых можно извлечь ценное вещество – обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа.
 Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: обработка и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже отверстия в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом.
 Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такого рода химическому разрушению или коррозии .
Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такого рода химическому разрушению или коррозии .Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Железо и сталь, с другой стороны, имеют серьезные проблемы, если они не обработаны для предотвращения коррозии. Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другим методом является гальванизация : в этом процессе сталь покрывается цинком.
 Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.Технология: фейерверк и химия
Если вы посмотрите фейерверк Четвертого июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад. Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу.
 В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, который при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездами , и сделаны из соединения, похожего на то, из которого работает бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета.
 Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Менее реакционноспособные соединения не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий.

, чем на металлы
 Металлические материалы хорошо проводят электричество.
Металлические материалы хорошо проводят электричество.
 Не многие знают, что алюминий популярен в сфере производства оружия. Связано это с тем, что детали из алюминия не искрят при сильном трении.
Не многие знают, что алюминий популярен в сфере производства оружия. Связано это с тем, что детали из алюминия не искрят при сильном трении.


 Тем не менее, большинство температур кипения все еще довольно высоки.
Тем не менее, большинство температур кипения все еще довольно высоки.
 Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичный , что означает, что их можно вытягивать для изготовления проволоки.
Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичный , что означает, что их можно вытягивать для изготовления проволоки. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой! Калий и натрий — два щелочных металла.
Калий и натрий — два щелочных металла. Полученное вещество называют сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Полученное вещество называют сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!) Чистота золота измеряется в карата. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Чистота золота измеряется в карата. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо . Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такого рода химическому разрушению или коррозии .
Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такого рода химическому разрушению или коррозии . Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.