Как отличить медь от других металлов. Медь металлический блеск
Характерный металлический блеск - Большая Энциклопедия Нефти и Газа, статья, страница 2
Характерный металлический блеск
Cтраница 2
Железо, медь и алюминий имеют характерный металлический блеск. [16]
Изучая твердые вещества, не имеющие характерного металлического блеска, мы замечаем, что их электропроводность очень низкая. К ним относятся вещества, которые мы называем ионными - хлористый натрий, хлористый кальций, нитрат серебра и хлористое серебро, а также молекулярные кристаллы, например лед. Лед, изображенный на рис. 5 - 3, состоит из тех же молекул, которые существуют в газовой фазе, но упорядочение расположенных в кристаллической решетке. Эти плохие проводники электрического тока сильно отличаются от металлов почти по всем свойствам. Таким образом, электропроводность может быть использована для классификации веществ, которая является однош из наиболее обоснованных. [17]
Металлами называются простые кристаллические вещества, имеющие характерный металлический блеск, хорошо проводящие тепло и электрический ток, способные изменять свою форму под действием внешних усилий и сохранять ее после снятия нагрузки без каких-либо признаков разрушения. Из всего количества химических элементов, известных в настоящее время, восемьдесят элементов относятся к металлам. Наиболее распространенными в земной коре металлами в виде химических соединений являются алюминий, железо, магний, калий, натрий и кальций. Чистые металлы имеют ограниченное применение в технике, так как в природе встречаются крайне редко, а получение их из химических соединений ( руд) связано с большими трудностями. [18]
В результате водородной коррозии поверхность стали теряет характерный металлический блеск и становится матовой. [20]
Полимеры представляют собой тонкодисперсные окрашенные порошки с характерным металлическим блеском, растворимые лишь в концентрированной серной кислоте. [21]
Все d - элементы являются металлами с характерным металлическим блеском. По сравнению с s - металлами их прочность значительно выше. [22]
Не растворившийся иод образует хорошо видимую пленку с характерным металлическим блеском ( плавающую на поверхности раствора) или собирается на дне колбы в виде черных частичек. Так как раствор иода окрашен в интенсивно красный цвет и почти не прозрачен, рассматривать его нужно очень тщательно, держа колбу против яркой электрической лампы, висящей на потолке. Для этого нужно встать под лампой, держа колбу за горло в наклонном положении между лампой и лицом, и стараться увидеть в ней яркое изображение лампы. На таком фоне не растворившиеся кристаллы иода хорошо заметны. Тогда кристаллы обоих веществ соберутся в одном месте и вокруг кристаллов иода создастся зона концентрированного раствора KJ, в котором иод быстро растворится. [23]
Все щелочные металлы - вещества серебристо-белого цвета, с характерным металлическим блеском, хорошей электро - и теплопроводностью, низкими температурами плавления и сравнительно низкими температурами кипения, малой плотностью и большим объемом атомов. В парообразном состоянии их молекулы одноатомны; ионы бесцветны. [25]
По внешнему виду темно-фиолетовые, почти черные кристаллы с характерным металлическим блеском. Хорошо растворяется в воде. Марганцовокислый калий относится к числу сильных окислителей, чем и обусловлены его дезинфекционные свойства. [26]
Благодаря коллективизированным электронам металлы обладают электро - и теплопроводностью, характерным металлическим блеском и некоторыми другими чисто металлическими свойствами. Например, блеск объясняется отражением световых лучей от коллективизированных электронов. [28]
Графит имеет цвет от серебристо-серого и темно-свинцового до черного с характерным металлическим блеском. [29]
Металлами называются химические элементы, отличительными признаками которых являются непрозрачность, характерный металлический блеск, свойство коваться, вытягиваться в нить и проволоку, свариваться, хорошо проводить тепло и электричество. Химические элементы, не обладающие перечисленными свойствами, называются неметаллами. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Медь. Описание, свойства, происхождение и применение металла

Самородная медь размером около 4 см
Медь — минерал из класса самородных элементов. В природном минерале обнаруживаются Fe, Ag, Au, As и другие элементы в виде примеси или образующие с Cu твёрдые растворы. Простое вещество медь — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Один из первых металлов, широко освоенных человеком из-за сравнительной доступности для получения из руды и малой температуры плавления. Он входит в семёрку металлов, известных человеку с очень древних времён. Медь является необходимым элементом для всех высших растений и животных.
СТРУКТУРА
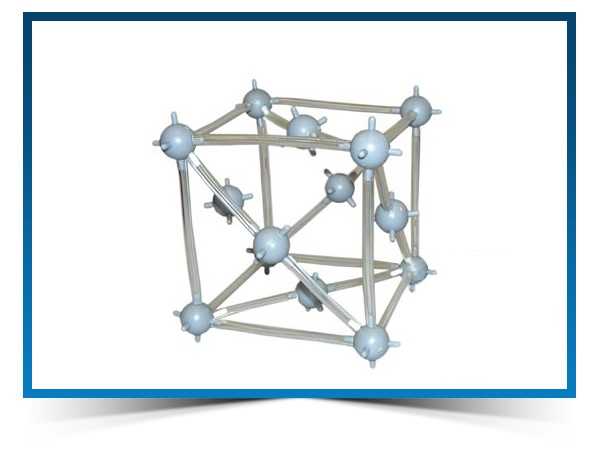
Кристаллическая структура меди
Кубическая сингония, гексаоктаэдрический вид симметрии m3m, кристаллическая структура — кубическая гранецентрированная решётка. Модель представляет собой куб из восьми атомов в углах и шести атомов , расположенных в центре граней (6 граней). Каждый атом данной кристаллической решетки имеет координационное число 12. Самородная медь встречается в виде пластинок, губчатых и сплошных масс, нитевидных и проволочных агрегатов, а также кристаллов, сложных двойников, скелетных кристаллов и дендритов. Поверхность часто покрыта плёнками «медной зелени» (малахит), «медной сини» (азурит), фосфатов меди и других продуктов её вторичного изменения.
СВОЙСТВА
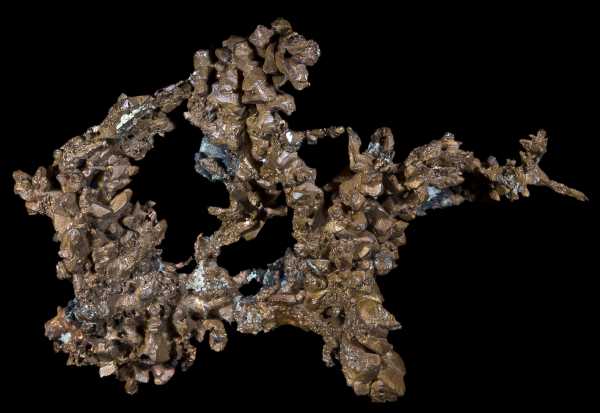
Кристаллы самородной меди, Верхнее озеро, округ Кинави, Мичиган, США. Размер 12 х 8,5 см
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Наряду с осмием, цезием и золотом, медь — один из четырёх металлов, имеющих явную цветовую окраску, отличную от серой или серебристой у прочих металлов. Этот цветовой оттенок объясняется наличием электронных переходов между заполненной третьей и полупустой четвёртой атомными орбиталями: энергетическая разница между ними соответствует длине волны оранжевого света. Тот же механизм отвечает за характерный цвет золота.
Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности среди металлов после серебра). Удельная электропроводность при 20 °C: 55,5-58 МСм/м. Медь имеет относительно большой температурный коэффициент сопротивления: 0,4 %/°С и в широком диапазоне температур слабо зависит от температуры. Медь является диамагнетиком.
Существует ряд сплавов меди: латуни — с цинком, бронзы — с оловом и другими элементами, мельхиор — с никелем и другие.
ЗАПАСЫ И ДОБЫЧА

Образец меди, 13,6 см. Полуостров Кинави, Мичиган, США
Среднее содержание меди в земной коре (кларк) — (4,7-5,5)·10−3% (по массе). В морской и речной воде содержание меди гораздо меньше: 3·10−7% и 10−7% (по массе) соответственно. Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,3 до 1,0 %. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т, из них 687 млн т — подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.Медь получают из медных руд и минералов. Основные методы получения меди — пирометаллургия, гидрометаллургия и электролиз. Пирометаллургический метод заключается в получении меди из сульфидных руд, например, халькопирита CuFeS2. Гидрометаллургический метод заключается в растворении минералов меди в разбавленной серной кислоте или в растворе аммиака; из полученных растворов медь вытесняют металлическим железом.
ПРОИСХОЖДЕНИЕ

Небольшой самородок меди
Обычно самородная медь образуется в зоне окисления некоторых медносульфидных месторождений в ассоциации с кальцитом, самородным серебром, купритом, малахитом, азуритом, брошантитом и другими минералами. Массы отдельных скоплений самородной меди достигают 400 тонн. Крупные промышленные месторождения самородной меди вместе с другими медьсодержащими минералами формируются при воздействии на вулканические породы (диабазы, мелафиры) гидротермальных растворов, вулканических паров и газов, обогащенных летучими соединениями меди (например, месторождение озера Верхнее, США).Самородная медь встречается также в осадочных породах, преимущественно в медистых песчаниках и сланцах.Наиболее известные месторождения самородной меди — Туринские рудники (Урал), Джезказганское (Казахстан), в США (на полуострове Кивино, в штатах Аризона и Юта).
ПРИМЕНЕНИЕ

Браслеты из меди
Из-за низкого удельного сопротивления, медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов.Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы.В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Медь (англ. Copper) — Cu
| Молекулярный вес | 63.55 г/моль |
| Происхождение названия | От греческого «Kyprium», то есть «кипрский металл», по названию острова Кипр |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
КЛАССИФИКАЦИЯ
Hey’s CIM Ref1.1
| Strunz (8-ое издание) | 1/A.01-10 |
| Nickel-Strunz (10-ое издание) | 1.AA.05 |
| Dana (7-ое издание) | 1.1.1.3 |
| Dana (8-ое издание) | 1.1.1.3 |
ФИЗИЧЕСКИЕ СВОЙСТВА
| Цвет минерала | медно-красный, тускнеющий в черный или зеленый на воздухе |
| Цвет черты | медно-красный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | нет |
| Твердость (шкала Мооса) | 2,5-3 |
| Прочность | ковкий |
| Излом | зазубренный |
| Плотность (измеренная) | 8.94 — 8.95 г/см3 |
| Радиоактивность (GRapi) | 0 |
| Магнетизм | диамагнетик |
ОПТИЧЕСКИЕ СВОЙСТВА
| Цвет в отраженном свете | розовато-белый |
| Плеохроизм | не плеохроирует |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
КРИСТАЛЛОГРАФИЧЕСКИЕ СВОЙСТВА
| Точечная группа | m3m (4/m 3 2/m) — гексоктаэдрический |
| Пространственная группа | Fm3m (F4/m 3 2/m) |
| Сингония | кубическая |
| Параметры ячейки | a = 3.615Å |
| Морфология | кубы, додекаэдры и тетрагексаэдры; редко октаэдры и сложные комбинации; нитевидные, древовидные |
| Двойникование | Двойники по {111} по шпинелевому закону |
Интересные статьи:
mineralpro.ru 28.07.2016mineralpro.ru
Металлический блеск - Большая Энциклопедия Нефти и Газа, статья, страница 1
Металлический блеск
Cтраница 1
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать этот порошок и отшлифовать его, чтобы метал лический блеск появился. [1]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [2]
Металлический блеск металлы проявляют в компактной своей массе. Так, пластинка платины имеет серебристо-белый цвет и металлический блеск, тогда как в мелкораздробленном состоянии этот металл черного цвета и без металлического блеска. Металлы, отражающие примерно в одинаковой степени все лучи видимого спектра, имеют серебристо-белый цвет. [3]
Металлический блеск, появляющийся на некоторых пленках красок, не содержащих металлических пигментов, и маскирующий обычный цвет покрытия при наблюдении его вблизи к углам возникновения блеска68, называется бронзированием, так как отраженный свет при этом окрашен обычно в желтоватый цвет. Это, по-видимому, обусловлено очень высоким показателем преломления пигмента по отношению к узкому диапазону длин волн падающего света33, вследствие чего для этих длин волн пигмент более непрозрачен, чем для других. [5]
Металлический блеск - сильный блеск, свойственный металлам. Им обладают непрозрачные минералы, дающие в большинстве случаев черную черту на фарфоровой пластинке. Таким блеском обладают самородные металлы ( золото, серебро, платина), многие сульфиды и окислы железа. [6]
Металлический блеск имеют, например, галенит пирит. Все минералы с металлическим блеском непрозрачные, цвет их черты черный или темноокрашенный. [7]
Металлический блеск обусловлен отражением световых лучей от электронного газа, который несколько выходит за границу положительно заряженных ионов. [8]
Металлический блеск, сильное поглощение света, возрастающее с переходом в инфракрасную область спектра, является естественным следствием наличия в металлах большой концентрации свободных электронов. [9]
Металлический блеск наблюдается обычно только в том случае, когда металл образует компактную массу. Только магний и алюминий в виде порошков имеют металлический блеск. Блеск металлов обусловлен отражением падающего на металл света от электронов в его поверхностном слое. [11]
Металлический блеск проявляют лишь компактные массы металла. Так, при восстановлении водородом окиси меди медь получается в виде порошка, лишенного металлического блеска, но достаточно утрамбовать-этот порошок и отшлифовать его, чтобы металлический блеск - появился. Лишь два металла сохраняют металлический блеск и в порошкообразном состоянии: магний и алюминий. Поэтому алюминиевая пыль применяется в качестве серебряной краски. [13]
Металлическим блеском различной степени интенсивности обладают некоторые минералы, например графит, пирротин, пирит, никелин, арсенопирит. [14]
Кроме металлического блеска и пластичности, все металлы обладают выср-кой электропроводностью и теплопроводностью. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Как отличить лом меди в домашних условиях
У большинства из нас знания о меди и ее свойствах ограничиваются школьным курсом химии, что на бытовом уровне вполне достаточно. Однако иногда возникает необходимость достоверно определить, является ли материал чистым элементом, сплавом или даже композитным материалом. Мнение, что эта информация нужна лишь тем, кто занимается приемом или сдачей металлолома, ошибочно: к примеру, на форумах радиолюбителей и очень часто поднимаются темы, как отличить медь в проводах от омедненного алюминия.

Коротко об элементе №29
Чистая медь (Cu) – золотисто-розовый металл, обладающий высокой пластичностью, тепло- и электропроводностью. Химическую инертность в обычной неагрессивной среде обеспечивает тончайшая оксидная пленка, которая придает металлу интенсивный красноватый оттенок.
Главное отличие меди от других металлов – окраска. На самом деле окрашенных металлов не так много: внешне похожи лишь золото, цезий и осмий, а все элементы, входящие в группу цветных металлов (железо, олово, свинец, алюминий, цинк, магний и никель) обладают серым цветом с различной интенсивностью блеска.
Абсолютную гарантию химического состава любого материала можно получить лишь с помощью спектрального анализа. Оборудование для его проведения очень дорогое, и даже многие экспертные лаборатории могут о нем лишь мечтать. Однако, существует немало способов, как отличить медь в домашних условиях с высокой долей вероятности.
1. Определение по цвету
Итак, перед нами кусок неизвестного материала, который необходимо идентифицировать как медь. Упор на термин «материал», а не «металл», сделан специально, так как в последнее время появилось немало композитов, которые по внешним признакам и тактильным ощущениям очень похожи на металлы.
В первую очередь рассматриваем цвет. Это желательно делать при дневном свете или «теплом» светодиодном освещении (под «холодными» светодиодами красноватый оттенок меняется на желто-зеленый). Идеально, если для сравнения есть медная пластинка или проволока – в этом случае ошибка в цветовосприятии практически исключена.
Важно: старые медные изделия могут быть покрыты окислившимся слоем (зеленовато-голубым рыхлым налетом): в этом случае цвет металла нужно смотреть на срезе или спиле.
2. Определение магнитом

Совпадение по цвету – достоверный, но не достаточный способ идентификации. Вторым шагом самостоятельных экспериментов будет проба с магнитом. Химически чистая медь относится к диамагнетикам – т.е. к веществам, не реагирующим на магнитное воздействие. Если исследуемый материал притягивается к магниту, то это – сплав, в котором содержание основного вещества не более 50%. Однако, даже если образец не среагировал на магнит, радоваться рано, поскольку нередко под медным покрытием спрятана алюминиевая основа, которая тоже не магнитится (исключить подобное можно с помощью надпиливания или среза).
3. Определение по реакции на пламя
Еще один способ распознать медь – раскалить образец на открытом огне (газовая плита, зажигалка или обычная спичка). Медная проволока при накаливании сначала потеряет блеск, а затем окрасится в черно-бурый цвет, покрывшись оксидом. Этим способом можно отсечь и композитные материалы, которые при накаливании начинают дымить с образованием газа с резким запахом.
4. Определение посредством химических экспериментов
Показательной является реакция с концентрированной азотной кислоты: если последнюю капнуть на поверхность медного изделия, произойдет окрашивание в зелено-голубой цвет.
Качественной реакцией на медь является растворение в соляной кислоте с последующим воздействием аммиаком. Если медный образец оставить в растворе HCl до полного или частичного растворения, а потом капнуть туда обычный аптечный нашатырный спирт, раствор окрасится в интенсивно синий цвет.
Важно: работа с химическими реактивами требует соблюдения мер предосторожности. Самостоятельные эксперименты нужно проводить в хорошо проветриваемом помещении с применением средств индивидуальной защиты (резиновые перчатки, фартук, очки).
Как различить медь и сплавы на ее основе?
В промышленности широко распространены медные сплавы. За многие годы исследований удалось получить немало материалов с уникальными свойствами: высокой пластичностью, электропроводностью, химической стойкостью, прочностью (все зависит от легирующих добавок). Самыми распространенными являются бронзы (с добавкой олова, алюминия, кремния, марганца, свинца и бериллия), латуни (с добавлением 10-45% цинка), а также медно-никелевые сплавы (нейзильбер, мельхиор, копель, манганин).
Сложность в плане идентификации представляют лишь бронзы и латуни, поскольку медно-никелевые сплавы значительно отличаются цветом из-за низкого содержания меди.
Медь или латунь?
В латуни может содержаться от 10 до 45% цинка – металла серебристо-серого цвета. Естественно, чем больше цинка, тем бледнее сплав. Однако, высокомедные латуни, в которых количество добавок не превышает 10%, мало отличаются по цвету от медного образца. В этом случае остается лишь доверять своим ощущениям: латунь намного тверже, труднее поддается изгибу (для большей достоверности желательно сравнение с эталонным образцом). Можно попробовать снять стружку: медная будет иметь форму завитка, латунная – прямолинейную, игольчатую. При помещении образцов в раствор соляной кислоты реакции с медью не наблюдается, а на поверхности латуни образуется белый налет хлорида цинка.
Медь или бронза?
Как и латуни, бронзы гораздо прочнее, что объясняется присутствием в сплаве более твердых металлов. Самой достоверной будет проба «на зубок» - на поверхности бронзы вряд ли останется след от надавливания.
Можно также поэкспериментировать с горячим солевым раствором (200 г поваренной соли на 1 литр воды). Медный образец через 10-15 минут приобретет более интенсивный оттенок, чем бронзовый.
Для тех, кто знаком с электротехникой
Очень часто в качестве лома цветных металлов сдаются медные жилы от электрических кабелей, и нередки случаи, когда при производстве электротехнической продукции используется медненый алюминий. Этот материал имеет значительно меньшую плотность, но из-за неправильной геометрической формы определить объем для расчета плотности довольно сложно. В этом случае определить медь можно по электрическому сопротивлению (естественно, при наличии соответствующих приборов – вольтметра, амперметра, реостата). Измеряем сечение и длину жилы, снимаем показания приборов, и – закон Ома вам в помощь. Удельное сопротивление – достаточно точная характеристика, по которой можно с высокой долей достоверности идентифицировать любой металл.
Заключение
Точно определить качество медного лома или содержание основного вещества в сплаве можно только после проведения экспертизы: все вышеприведенные методы являются приблизительными. Если рассматривать ценообразование при покупке металлолома, то дороже всего стоит электротехническая медь, самые дешевые – сплавы латунной группы. Окончательную стоимость сделки можно уточнить у менеджеров компаний, занимающихся скупкой лома цветных металлов.
blizkolom.ru
Медь блеск
Это очищенные от изоляции медные провода и кабели. Такой блестящий медный лом также часто называют электротехническим.
Медь дорогой и очень дорогой материал. Так, например цена медного провода 335р - цена меди за кг. Медный лом имеет возможность быть в облике кусков, провода, медного провода, шин, стружки и остального. По причине собственных особых телесных данных, он в том числе и чем какого-либо другого алюминия. Данный металл содержитвысшую тепло и электропроводимость, стоек к коррозии и воде, а еще довольно может быть полезен для человека, например как содержит антибактериальные качества. На нынешний денек без меди не сможете стать каждое промышленное предприятие, а еще медицина. Медный провод – раз из самых нередко встречаемых металлов попадающих в пункты способа, поскольку цена меди на него самая высокая. Эта востребованность в меди, заключается в том, собственно что ее очень не достаточно в нашей стране, всего только 3%, все остальное в Российскую Федерацию привозят по причине грани. Медь довольно плавная и эластичная, она легка в переработке и ей это потребуется, например как лишь только этим способом мы можем сделать лучше изготовления и не загрязнять природу. Стоит припоминать, собственно что в процессе изготовления медного провода, тем более ювелирных изделий, по завершению остается большущее численность цены медной стружки, по установленным общепризнанным меркам, она обязана быть утилизирована. Выкидывать подобный дорогойметалл на свалку противопоказано, например как медный провод имеет возможность держать грязюка, масло и иные вредные для природы составляющие, которые имеют все шансы причинить убыток плодородности земли. В следствие этого не идет по стопам выбрасывать медные провода на свалку, например как вы сможете собрать ее и отдать в пункты способа. С поддержкой ее, вы можете владеть удовлетворительной вспомогательный заработок. В случае если вы приняли решение отдать медный провод, то для вас надо адресоваться в пункты способа металла, при выборе такового семейства пунктов, в начале выучите цены медных проводов. Наша фирма «Лебедь» воплотит в жизньспособ медного провода по наиболее высочайшим ценовым категориям по Великим Лукам. Мы сотрудничаем, как с физиологическими, например и с юридическими лицами. В случае если у вас наличествует большущий припас медного провода, то мы можем дать для вас важный автотранспорт и грузчиков. У нас высококвалифицированные знатоки и свежайшее оснащение. Мы всякий раз идем навстречу нашим покупателям, и договаривается на прибыльные обстоятельства с обеих сторон. Мы берем на себя медные провода в облике: рассыпном, отсортированном, вьюнообразном, в всяком числе. Наша фирма еще проводит экспресс-анализ, где ориентируется цена меди. Не загрязняйте находящуюся вокруг среду, звоните нам, и мы проворно и неопасно избавим вас от ненужно для вас мусора!

lebedvl.ru
Металлы блеск - Справочник химика 21
Металлы обладают металлическим блеском, если они находятся в крупнокристаллическом состоянии. Порошкообразные металлы блеска не имеют. Исключение составляют лишь магний и алюминий, которые и в мелкораздробленном состоянии сохраняют свой блеск. [c.235]МЕТАЛЛИЧЕСКАЯ СВЯЗЬ — один из видов химической связи — связь ионов металла со свободными обобществленными внешними электронами. М. с. обусловливает характерные свойства металлов блеск, пластичность, высокие электро- и теплопроводность, положительный температурный коэффициент электросопротивления, термоэлектронную эмиссию и др. [c.159]
Если необходимо показать некоторые физические свойства металлов (блеск, цвет), можно продемонстрировать образцы (по возможности, крупные) различных металлов Ре, А1, Мд, 2п, Сг, Т1, Си, 8п, РЬ и др. Для сравнения можно показать и образцы неметаллов. [c.165]Алюминий — серебристо-белый легкий металл, р = 2,699 г/см , 660,24 С, i .,j,= 2500 С. Он очень пластичен, легко прокатывается в фольгу к протягивается в проволоку. Прекрасный проводник электрического тока — его электрическая проводимость сравнима с электрической проводимостью меди. Поверхность металла всегда покрыта очень тонкой и очень плотной пленкой оксида АЬОз. Эта пленка оптически прозрачна и сохраняет отражающую способность металла (блеск). [c.150]
Иод I 2 AI = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,940 [c.65]
Неметаллы не обладают характерным для металлов блеском, хрупки, очень плохо проводят теплоту и электричество. Некоторые из них при обычных условиях газообразны. [c.29]
Соблюдение этих условий дало возможность получить светлое качественное покрытие с максимальной толщиной 10—12 мк на медной основе, с содержанием таллия 12,5—22,4 вес. %. Покрытие имеет хорошее сцепление с поверхностью основного металла. Блеск покрытия достигается небольшим полированием. Это покрытие обладает устойчивыми сверхпроводящими свойствами при низких температурах. [c.127]
Применяют для придания металлу блеска при никелирований. [c.1001]
Следует подчеркнуть, что положение этой граничной диагонали и само деление элементов на металлы и неметаллы весьма условны. Целый ряд элементов, обладая характерными физическими свойствами металлов — блеском, высокой электропроводностью, пластичностью, проявляет химические свойства двойственной природы — [c.109]
Сложных веществ насчитывается в природе сотни тысяч, простых около двухсот, а элементов, из которых образуются все вещества, известно 92. Большее количество известных простых веществ в сравнении с количеством элементов объясняется свойством последних образовать несколько простых веществ. Например, общеизвестные вещества — уголь, графит и алмаз, резко различающиеся по своим свойствам, являются видоизменениями одного и того же химического элемента — углерода. Хи.мические элементы подразделяются на металлы и металлоиды. В группу металлов входит 71 элемент, а в группу металлоидов 21 элемент. Металлы обладают характерным блеском, хорошо проводят тепло и электричество,- обладают ковкостью и т. д. Металлоиды не имеют характерного для металлов блеска и плохо или совсем не проводят тепло и электрический ток. [c.8]
Класс 3. Карбиды промежуточного типа представляют собой огнеупорные материалы с некоторыми характерными свойствами металлов (блеск, металлическая проводимость) и, кроме того, отличаются необычной твердостью и тугоплавкостью. Атомы металла в них плотно упакованы, а атомы С занимают октаэдрические пустоты, но следует отметить, что упорядочение атомов металла в карбиде не всегда такое, как в самом металле. В таких случаях карбид МС нельзя рассматривать как предельный твердый раствор углерода в структуре металла наоборот, присутствие атомов С влияет на упорядочение [c.50]
Иод I2 Ai = 253,81 фиол.-черн. ромб, с металл, блеском р= 4,9402 3,960 (ж.) п = 3,34 = 113,6 = 185,5 = 553 С° = 54,43 [c.65]
В свободном металле атомы плотно заполняют пространство, а их наружные энергетические уровни, весьма слабо заполненные электронами, перекрывают друг друга. Благодаря этому наружные электроны легко переходят от атома к атому, так что принадлежат не отдельному атому, а как бы обобществлены. Таким образом ионы металла (ядра с внутренними энергетическими уровнями) крепко связываются в одно целое суммой свободно блуждающих между ними электронов. Эти свободные электроны обусловливают и физические свойства металлов (блеск, тепло- и электропроводность и пр.). [c.75]
В связи с большим разнообразием вопросов, решаемых при изучении электроосаждения металлов, методы, применяемые в этой области, также очень разнообразны и охватывают не только электрохимические, но и физические, механические и другие способы исследования. Это связано с тем, что при электроосаждении металлов изучают как кинетику электродных процессов, так и физико-механические свойства металлов, блеск, пористость, сцепляемость и другие свойства электролитических осадков. Для разрешения каждого из перечисленных вопросов требуются свои специфические методы исследования применительно к процессу электрокристаллизации металла на катоде. [c.4]
Роспись фаянсовых и фарфоровых изделий проводят с использованием окислов и солей металлов, которые при обжиге переходят в силикаты, обладающие различной окраской окись кобальта дает синюю окраску, окись хрома — зеленую, закись урана — черную и т. д. Из солей легко восстанавливающихся металлов (золота и платины) при обх[c.121]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, прочностью на изгиб, стойкостью при эксплуатации на воздухе, внутри и вне помещения, преимущественно в условиях умеренного климата. [c.12]
Алкидные покрытия обладают хорошей адгезией к металлу, блеском, эластичностью. С повышением жирности алкидной смолы улучшается эластичность покрытий, но уменьшаются твердость, стойкость к растворителям и маслам, стабильность блеска и цвета при горячей сушке и действии света. [c.47]
Иод 1 2 М = 253,81 фиол.-черн. ромб, с металл, блеском р = 4,9402 [c.65]
ТЕЛЛУР Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р — = 6,25 = 449,8 = 990 Ср = 0,202 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯпл = 17,5 ДЯ сп = 51,0 р = 0,1 2. [c.103]
Алкидные ЛКП имеют высокую адгезию к металлу, блеск, стойкость на изгиб. [c.10]
Металлические и неметаллические элементы различаются по своим физическим и химическим свойствам. Неметаллические элементы не имеют характерных для металлов блеска, ковкости и пластичности, а также хорошей электро- и теплопроводности. В структуре твердых неметаллических элементов атомы окружены сравнительно небольшим числом ближайших соседей и связаны друг с другом ковалентными связями. Неметаллические элементы характеризуются более высокими энергиями ионизации и электроотрицательностями, чем металлические элементы. Растворимые оксиды неметаллических элементов обычно образуют водные растворы, обладающие кислотными свойствами по этой причине неметаллические оксиды называю 1О1СЛ0ТИЫМИ ангидридами. В отличие от них растворимые оксиды металлов образуют основные растворы, и поэтому называются основными ангидридами. [c.329]
Теллур Те >1=127,60 серебр.-сер. с металл, блеском, триг. р = 6,252 44g g. ggg. 25,77 s = 49,50 [c.104]
Мышьяк обладает свойством придавать металлам блеск олову при- дает твердость и зво Н и делает его более плотным медь Т же.юзо отбеливает, а соедипенный с неблагородными металлами сплавлезшем при болео длительной обработке облагораживает часть их Поэтому весьма вероятно, чтч з в состав блеска металлов входит некоторая мышьяковистая часть (особенно металлов, кото рые добываются из ншл чаще в соединении с мышьяком, чем с серою) и что благодаря ей они От других отличаются блеском и крепостью. Это можно с достаточным основанием утверждать П1режде Всего об олове. [c.53]
Теллур Те Л = 127,60 серебр.-сер. с металл, блеском, триг. р = 6,25 5 = 449.8 / ип = 90 Ср = 0,20225 С° = 25,77 S° = 49,50 ДЯ = 0 Д0° = 0 ДЯт=17,5 ДЯисп = 51,0 р=0,01 в 0,1 2 sn. 10632. 1001792. н р S2 реаг. h3SO4, HNO3, Ц. в. медл, реаг. [c.104]
chem21.info
Металлический блеск деревянной модели « Учи физику!
Да, моделисты и начинающие ювелиры могут покрыть металлическим слоем уже готовые детали моделей и даже такие объемные «изделия», как бутон цветка, дубовый лист или засушенный жук-скарабей.
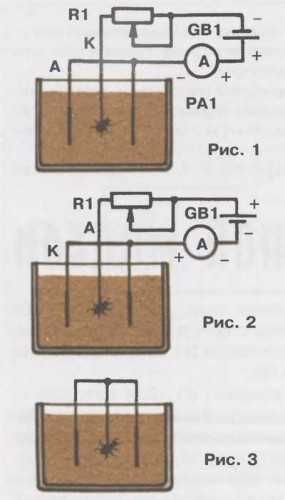
Покрываемые детали выдерживают в 1,5%-ном растворе сулемы, просушивают и покрывают тонким слоем любого лака. Чтобы основа стала электропроводной, ее тщательно покрывают аквадагом — кашицей из графитовой пудры, разведенной спиртом, одеколоном или водкой. Выполняют эту работу мягкой пушистой кисточкой.Прежде чем поместить объект в гальваническую ванну, следует подвести к нему электрод. Для этого деталь опутывают тонкими оголенными медными проволочками диаметром 0,1 мм в нескольких местах и соединяют все выводы в одну косичку.После этого деталь погружают в электролит. Источником тока может служить аккумуляторная батарея GRI(рис. 1) от автомобиля или мотоцикла либо мощный выпрямитель с несколькими диодами. Ток регулируется реостатом R1 сопротивлением в пределах 20…250 Ом.Обрабатываемый предмет служит катодом — к нему подключают минус батареи. Анод же батареи подсоединяют к алюминиевому кольцу или нескольким пластинам, окружающим обрабатываемый предмет. Оба электрода подвешивают над банкой с электролитом на деревянной палочке. Ток контролируют по амперметру.
Состав электролита для предварительного меднения следующий: сернокислая медь (медный купорос) 150…200 г, серная кислота (концентрированная) — 7… 15 г (вливать ее нужно по каплям в воду, а не наоборот!), этанол (винный спирт) — 30…50 мл, вода — 1000 мл. Плотность тока — 0,01…0,02 А/см2.
Когда вся деталь покроется металлом, смените электролит для окончательного меднения. Он содержит 200…250 г медного купороса и около 2 г серной кислоты на 1000 мл дистиллированной воды. Продолжительность процесса — несколько часов. Толщина покрытия будет составлять от 0,1 до 2 мм.
Иногда поверхность получается чересчур зернистой, тогда применяют электролитическое полирование (рис. 2). Для этого необходимо поменять полярность, и объектом обработки станет анод. Состав электролита тоже будет другой: 10 г серной кислоты (концентрированной), 12,5 г хромового ангидрида и столько же уксусной кислоты, 37,5 г двухромовокислого (дихлориат) натрия. Рабочая температура 60…75° С, плотность тока 0,25…0,5 А/см2, время обработки от 1 до 5 минут.
Для имитации золота применяют электрохимическое оксидирование (рис. 3). Электроэнергии для этого не потребуется, так как используется ток, создаваемый гальванопарой, образованной алюминиевыми пластинами и медным покрытием изделия. Чтобы пошел гальваноток, оба электрода замыкают накоротко.При оксидировании на медной поверхности образуется прочная яркая пленка. В течение нескольких минут она меняет цвет от желтого, оранжевого, фиолетового, светло-золотистого, малинового до зеленого.
Процесс оксидирования можно проводить в алюминиевой кастрюле, тогда вам не потребуются алюминиевые пластины. Медные проволочки, идущие от изделия, соединяют с кастрюлей толстым проводом при помощи зажима «крокодил». При присоединении изделие не трогайте руками, но если это произошло, деталь обезжирьте в бензине или ацетоне, а затем в крепком растворе питьевой соды, стирального порошка или обычного мыла. После обезжиривания изделие полминуты протравливают в 10…20%-ном растворе серной кислоты, а затем помещают в ванну оксидирования.
Состав электролита для оксидирования: щавелевая кислота (концентрированная) — 30 г, медный купорос — 50 г, едкий натр — 35 г. Компоненты растворяют в воде по отдельности, а затем сливают воедино в следующем порядке: раствор кислоты, постоянно помешивая, вливают в раствор купороса, через минуту к смеси добавляют раствор едкого натра. Правильно составленный электролит имеет светло-бирюзовый цвет.
Перед использованием раствор взбалтывают, а в процессе оксидирования сам предмет покачивают в электролите, периодически вынимая для осмотра. Когда появилась нужная окраска, готовую вещь промывают в воде, затем в содовом растворе, сушат. После этого деталь можно покрыть тонким слоем бесцветного нитролака, хотя цветная пленка и так достаточно прочна и химически стойка.
Журнал “Левша” №11-07г.
uchifiziku.ru