Химия, Биология, подготовка к ГИА и ЕГЭ. Металл хром
Хром — общая характеристика элемента, химические свойства хрома и его соединений
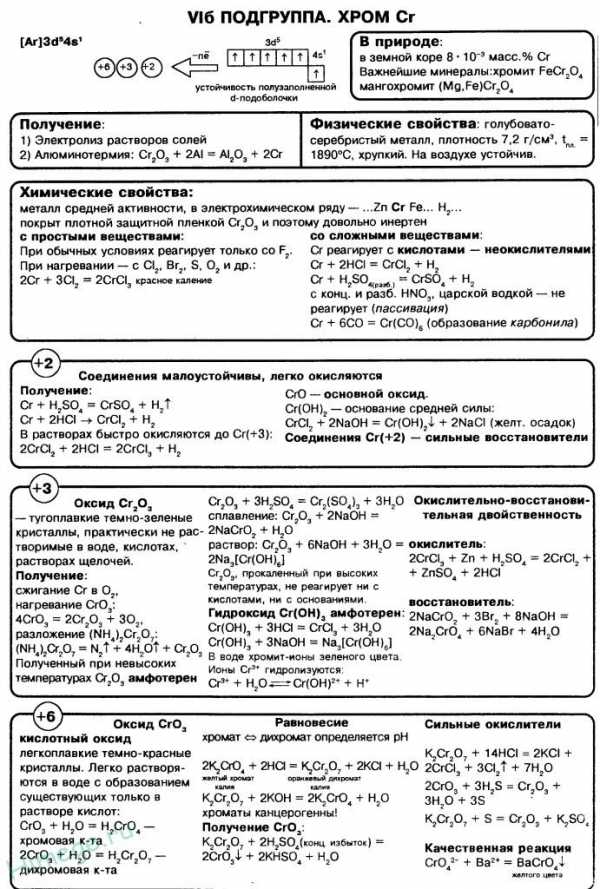
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 24. Обозначается символом Cr (лат. Chromium). Простое вещество хром— твёрдый металл голубовато-белого цвета.
Химические свойства хрома
При обычных условиях хром реагирует только со фтором. При высоких температурах (выше 600°C) взаимодействует с кислородом, галогенами, азотом, кремнием, бором, серой, фосфором.
4Cr + 3O2 –t° →2Cr2O3
2Cr + 3Cl2 –t°→ 2CrCl3
2Cr + N2 –t°→ 2CrN
2Cr + 3S –t°→ Cr2S3
В раскалённом состоянии реагирует с парами воды:
2Cr + 3h3O → Cr2O3 + 3h3
Хром растворяется в разбавленных сильных кислотах (HCl, h3SO4)
В отсутствии воздуха образуются соли Cr2+, а на воздухе – соли Cr3+.
Cr + 2HCl → CrCl2 + h3
2Cr + 6HCl + O2 → 2CrCl3 + 2h3O + h3
Наличие защитной окисной плёнки на поверхности металла объясняет его пассив-ность по отношению к концентрированным растворам кислот – окислителей.
Соединения хрома
Оксид хрома (II) и гидроксид хрома (II) имеют основной характер.
Cr(OH)2 + 2HCl → CrCl2 + 2h3O
Соединения хрома (II) — сильные восстановители; переходят в соединения хрома (III) под действием кислорода воздуха.
2CrCl2 + 2HCl → 2CrCl3 + h3
4Cr(OH)2 + O2 + 2h3O → 4Cr(OH)3
Оксид хрома (III) Cr2O3 – зелёный, нерастворимый в воде порошок. Может быть получен при прокаливании гидроксида хрома (III) или дихроматов калия и аммония:
2Cr(OH)3 –t°→ Cr2O3 + 3h3O
4K2Cr2O7 –t°→ 2Cr2O3 + 4K2CrO4 + 3O2
(Nh5)2Cr2O7 –t°→ Cr2O3 + N2+ 4h3O (реакция «вулканчик»)
Амфотерный оксид. При сплавлении Cr2O3 со щелочами, содой и кислыми солями получаются соединения хрома со степенью окисления (+3):
Cr2O3 + 2NaOH → 2NaCrO2 + h3O
Cr2O3 + Na2CO3 → 2NaCrO2 + CO2
При сплавлении со смесью щёлочи и окислителя получают соединения хрома в степени окисления (+6):
Cr2O3 + 4KOH + KClO3 → 2K2CrO4+ KCl + 2h3O
Гидроксид хрома (III) Сr(ОН)3 . Амфотерный гидроксид. Серо-зеленый, разлагается при нагревании, теряя воду и образуя зеленый метагидроксид СrО(ОН). Не растворяется в воде. Из раствора осаждается в виде серо-голубого и голубовато-зеленого гидрата. Реагирует с кислотами и щелочами, не взаимодействует с гидратом аммиака.
Обладает амфотерными свойствами — растворяется как в кислотах, так и в щелочах:
2Cr(OH)3 + 3h3SO4 → Cr2(SO4)3 + 6h3O Сr(ОН)3 + ЗН+ = Сr3+ + 3h3O
Cr(OH)3 + KOH → K[Cr(OH)4] , Сr(ОН)3 + ЗОН— (конц.) = [Сr(ОН)6]3-
Cr(OH)3 + KOH → KCrO2+2h3O Сr(ОН)3 + МОН = МСrO2(зел.) + 2Н2O (300—400 °С, М = Li, Na)
Сr(ОН)3→(120oC –h3O) СrO(ОН) →(430-10000С –h3O) Cr2O3
2Сr(ОН)3 + 4NаОН(конц.) + ЗН2O2(конц.) =2Na2СrO4 + 8Н20
Получение: осаждение гидратом аммиака из раствора солей хрома(Ш):
Сr3+ + 3(Nh4 Н2O) = Сr(ОН)3↓ + ЗNН4+
Cr2(SO4)3 + 6NaOH → 2Cr(OH)3 ↓+ 3Na2SO4 (в избытке щелочи — осадок растворяется)
Соли хрома (III) имеют фиолетовую или тёмно-зелёную окраску. По химическим свойствам напоминают бесцветные соли алюминия.
Соединения Cr (III) могут проявлять и окислительные, и восстановительные свойства:
Zn + 2Cr+3Cl3 → 2Cr+2Cl2 + ZnCl2
2Cr+3Cl3 + 16NaOH + 3Br2 → 6NaBr + 6NaCl + 8h3O + 2Na2Cr+6O4
Соединения шестивалентного хрома
Оксид хрома (VI) CrO3 — ярко-красные кристаллы, растворимые в воде.
Получают из хромата (или дихромата) калия и h3SO4(конц.).
K2CrO4 + h3SO4 → CrO3 + K2SO4 + h3O
K2Cr2O7 + h3SO4 → 2CrO3 + K2SO4 + h3O
CrO3 — кислотный оксид, со щелочами образует жёлтые хроматы CrO42-:
CrO3 + 2KOH → K2CrO4 + h3O
В кислой среде хроматы превращаются в оранжевые дихроматы Cr2O72-:
2K2CrO4 + h3SO4 → K2Cr2O7 + K2SO4 + h3O
В щелочной среде эта реакция протекает в обратном направлении:
K2Cr2O7 + 2KOH → 2K2CrO4 + h3O
Дихромат калия – окислитель в кислой среде:
К2Сr2O7 + 4h3SO4 + 3Na2SO3 = Cr2(SO4)3 + 3Na2SO4 + K2SO4 + 4h3O
K2Cr2O7 + 4h3SO4 + 3NaNO2 = Cr2(SO4)3 + 3NaNO3 + K2SO4 + 4h3O
K2Cr2O7 + 7h3SO4 + 6KI = Cr2(SO4)3 + 3I2 + 4K2SO4 + 7h3O
K2Cr2O7 + 7h3SO4 + 6FeSO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7h3O
Хромат калия К2 CrО4. Оксосоль. Желтый, негигроскопичный. Плавится без разложения, термически устойчивый. Хорошо растворим в воде (желтая окраска раствора отвечает иону СrO42-), незначительно гидролизуется по аниону. В кислотной среде переходит в К2Cr2O7. Окислитель (более слабый, чем К2Cr2O7). Вступает в реакции ионного обмена.
Качественная реакция на ион CrO42- — выпадение желтого осадка хромата бария, разлагающегося в сильнокислотной среде. Применяется как протрава при крашении тканей, дубитель кож, селективный окислитель, реактив в аналитической химии.
Уравнения важнейших реакций:
2K2CrO4+h3 SO4(30%)=K2Cr2O7 +K2SO4 +h3O
2K2CrO4(т)+16HCl(конц.,гор.) =2CrCl3+3Cl2↑+8h3O+4KCl
2K2CrO4+2h3O+3h3S=2Cr(OH)3↓+3S↓+4KOH
2K2CrO4+8h3O+3K2S=2K[Сr(ОН)6]+3S↓+4KOH
2K2CrO4+2AgNO3=KNO3+Ag2CrO4(красн.)↓
Качественная реакция:
К2СгO4 + ВаСl2 = 2КСl + ВаCrO4↓
2ВаСrO4(т)+ 2НСl (разб.) = ВаСr2O7(p)+ ВаС12 + Н2O
Получение: спекание хромита с поташом на воздухе:
4(Сr2Fe‖‖)O4 + 8К2CO3 + 7O2 = 8К2СrO4 + 2Fе2O3 + 8СO2 (1000 °С)
Дихромат калия K2Cr2O7 . Оксосоль. Техническое название хромпик. Оранжево-красный, негигроскопичный. Плавится без разложения, при дальнейшем нагревании разлагается. Хорошо растворим в воде (оранжевая окраска раствора отвечает иону Сr2O72- ). В щелочной среде образует К2CrO4 . Типичный окислитель в растворе и при сплавлении. Вступает в реакции ионного обмена.
Качественные реакции — синее окрашивание эфирного раствора в присутствии Н2O2 , синее окрашивание водного раствора при действии атомарного водорода.
Применяется как дубитель кож, протрава при крашении тканей, компонент пиротехнических составов, реагент в аналитической химии, ингибитор коррозии металлов, в смеси с Н2SO4 (конц.) — для мытья химической посуды.
Уравнения важнейших реакций:
4К2Cr2O7=4K2CrO4+2Cr2O3+3O2 (500-600o C)
K2Cr2O7(т)+14HCl (конц) =2CrCl3+3Cl2↑+7h3O+2KCl (кипячение)
K2Cr2O7(т)+2h3SO4(96%) ⇌2KHSO4+2CrO3+h3O (“хромовая смесь”)
K2Cr2O7+KOH (конц ) =h3O+2K2CrO4
Cr2O72- +14H+ +6I— =2Cr3+ +3I2↓+7h3O
Cr2O72- +2H+ +3SO2(г)=2Cr3+ +3SO42- +h3O
Cr2O72- +h3O +3h3S(г)=3S↓+2OH— +2Cr2(OH)3↓
Cr2O72- (конц )+2Ag+(разб.) =Ag2Cr2O7 (т. красный)↓
Cr2O72-(разб.) +h3O +Pb2+=2H+ + 2PbCrO4 (красный)↓
K2Cr2O7(т) +6HCl+8H0(Zn)=2CrCl2(син)+7h3O+2KCl
Получение: обработка К2СrO4 серной кислотой:
2К2СrO4 + Н2SO4(30%) = К2Cr2O7 + К2SO4 + Н2O
himege.ru
Элемент хром | Дистанционные уроки
06-Ноя-2012 | комментариев 5 | Лолита Окольнова
За счет большого количества валентных электронов образует большое количество окрашенных соединений.
Электронное строение атома
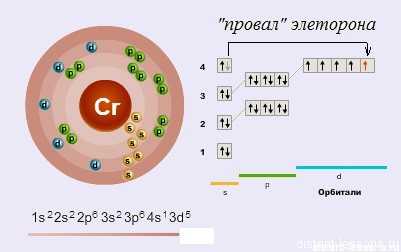
Как видно из схемы, у d-элемента хрома наблюдается такое явление как «провал электрона» — один электрон с s-орбитали перескакивает на d-орбиталь.
«Провал» электрона — переход электрона с внешнего энергетического уровня на более низкий, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций.
Соответственно, возможные степени окисления хрома:+6, +4, +3 и +2.
Свойства простого вещества
Хром — типичный металл — блестящий, бело-голубого цвета. Довольно часто встречающийся элемент в минералах земли.
Это малоактивный металл, т.к. на воздухе он покрывается оксидной пленкой
- Взаимодействие с неметаллами:2Сr + 3F2 = 2CrF34Cr + 3O2 = 2Cr2O3
- Взаимодействие с водой (при нагревании):2Cr + 3h3O = Cr2O3 + 3h3
- Взаимодействие с кислотами— при н.у. это пассивный металл, ни с серной, ни с азотной кислотой не взаимодействует— с разбавленной соляной и серной кислотами образует соли хрома (II): Сr + 2HCl = CrCl2 + h3
Оксиды хрома
СrO — оксид хрома (II), (черного цвета) — основной оксид.
Сr(OH)2 — желто-коричневого цвета, быстро окисляется до Cr2O3 или Сr(Oh4).
СrO + 2HCl = CrCl2 + h3O (cоли — голубого цвета)
Cr2O3 — оксид хрома (III), (зеленого цвета) — амфотерный оксид.
Сr2O3 + 2NaOH = 2NaCrO2 + h3O
Cr2O3 + 6HCl = 2CrCl3 + 3h3OСr(OH)3 — амфотерный гидроксид, серо-зеленого цвета.
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Соли Cr(3+) — зеленого цвета
СrO3 — оксид хрома (VI), кислотный оксид, красного цвета.
Образует кислоты: HCrO4 — хромовая кислота и h3Cr2O7 — дихромовая кислота. Это сильные кислоты-окислители.
CrO4(2-) — хроматы — желтого цвета
В зависимости от среды (кислой или щелочной) — хроматы и бихроматы переходят друг в друга:
Итого соединения d- элемента хрома, их свойств и цветов можно выразить схемой:
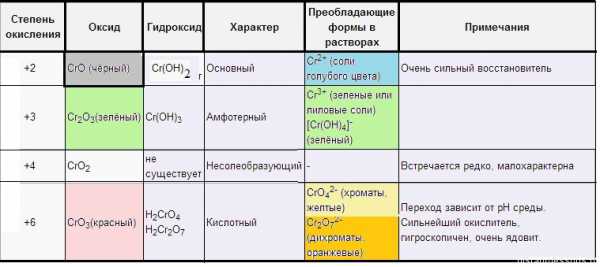
Отсюда, кстати, и название элемента: «хром» — это «цвет»!
У d- элемента — хрома свойства веществ меняются следующим образом:
- вещества, в которых хром в низшей степени окисления, проявляют металлические (основные) свойства;
- в средней степени окисления (+3) — амфотерные;
- вещества с хромом в высшей степени окисления проявляют кислотные свойства.
Категории: |
Обсуждение: "Элемент Хром"
(Правила комментирования)distant-lessons.ru
Хром и его характеристики
Общая характеристика хрома
Хром содержится в земной коре в количестве 0,02% (масс.). В природе он встречается главным образом в виде хромистого железняка FeO×Cr2O3.
Хром представляет собой твердый блестящий металл (рис. 1), плавящийся при 1890oС; плотность его 7,19 г/см 3. При комнатной температуре хром стоек и к воде, и к воздуху. Разбавленные серная и соляная кислоты растворяют хром с выделением водорода. В холодной концентрированной азотной кислоте хром нерастворим и после обработки ею становится пассивным.
Рис. 1. Хром. Внешний вид.
Атомная и молекулярная масса хрома
Поскольку в свободном состоянии хром существует в виде одноатомных молекул Cr, значения его атомной и молекулярной масс совпадают. Они равны 51,9962.
Изотопы хрома
Известно, что в природе хром может находиться в виде четырех стабильных изотопов 50Cr, 52Cr, 53Cr и 54Cr. Их массовые числа равны 50, 52, 53 и 54 соответственно. Ядро атома изотопа хрома 50Cr содержит двадцать четыре протона и двадцать шесть нейтронов, а остальные изотопы отличаются от него только числом нейтронов.
Существуют искусственные изотопы хрома с массовыми числами от 42-х до 67-ми, среди которых наиболее стабильным является 59Cr с периодом полураспада равным 42,3 минуты, а также один ядерный изотоп.
Ионы хрома
На внешнем энергетическом уровне атома хрома имеется шесть электронов, которые являются валентными:
1s22s22p63s23p63d54s1.
В результате химического взаимодействия хром отдает свои валентные электроны, т.е. является их донором, и превращается в положительно заряженный ион:
Cr0 -2e → Cr2+;
Cr0 -3e → Cr3+;
Cr0 -6e → Cr6+.
Молекула и атом хрома
В свободном состоянии хром существует в виде одноатомных молекул Cr. Приведем некоторые свойства, характеризующие атом и молекулу хрома:
|
Энергия ионизации атома, эВ |
6,76 |
|
Относительная электроотрицательность |
1,66 |
|
Радиус атома, нм |
0,130 |
Сплавы хрома
Металлический хром используется для хромирования, а также в качестве одного из важнейших компонентов легированных сталей. Введение хрома в сталь повышает её устойчивость против коррозии как в водных средах при обычных температурах, так и в газах при повышенных температурах. Кроме того, хромистые стали обладают повышенной твердостью. Хром входит в состав нержавеющих кислотоупорных, жаропрочных сталей.
Примеры решения задач
ru.solverbook.com
Химические свойства
«Национальный исследовательский Томский политехнический Университет»

Институт природных ресурсов Геоэкология и геохимия
РЕФЕРАТ
Хром
по дисциплине:
Химия
Выполнил:
студент группы 2Г41 Ткачева Анастасия Владимировна 29.10.2014
Проверил:
преподаватель Стась Николай Федорович
Томск 2014
Положение в периодической системе
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Д. И. Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром — твёрдый металлголубовато-белого цвета. Хром иногда относят к чёрным металлам.
Строение атома
+17 Cl )2 )8 )7 - схема строения атома
1s2s2p3s3p- электронная формула
Атом располагается в III периоде, и имеет три энергетических уровня
Атом располагается в VII в группе, в главной подгруппе – на внешнем энергетическом уровне 7 электронов
Свойства элемента
Физические свойства
Хром - белый блестящий металл с кубической объемно-центрированной решеткой, а = 0,28845 нм, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, один из самых твердых чистых металлов (уступает только бериллию, вольфраму и урану), с температурой плавления 1903 град. И с температурой кипения около 2570 град. С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода к хрому еще больше увеличивает его твердость.
Хром при обычных условиях – инертный металл, при нагревании становится довольно активным.
Взаимодействие с неметаллами
При нагревании выше 600°С хром сгорает в кислороде:
4Cr + 3O2 = 2Cr2O3.
С фтором реагирует при 350°С, с хлором – при 300°С, с бромом – при температуре красного каления, образуя галогениды хрома (III):
2Cr + 3Cl2 = 2CrCl3.
С азотом реагирует при температуре выше 1000°С с образованием нитридов:
2Cr + N2 = 2CrN
или 4Cr + N2 = 2Cr2N.
Сера при температуре выше 300°С образует сульфиды от CrS до Cr5S8, например:
2Cr + 3S = Cr2S3.
Реагирует с бором, углеродом и кремнием с образованием боридов, карбидов и силицидов:
Cr + 2B = CrB2 (возможно образование Cr2B, CrB, Cr3B4, CrB4),
2Cr + 3C = Cr2C3 (возможно образование Cr23C6, Cr7B3),
Cr + 2Si = CrSi2 (возможно образование Cr3Si, Cr5Si3, CrSi).
С водородом непосредственно не взаимодействует.
Взаимодействие с водой
В тонкоизмельченном раскаленном состоянии хром реагирует с водой, образуя оксид хрома (III) и водород:
2Cr + 3h3O = Cr2O3 + 3h3
Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов хром находится до водорода, он вытесняет водород из растворов неокисляющих кислот:
Cr + 2HCl = CrCl2 + h3;
Cr + h3SO4 = CrSO4 + h3.
В присутствии кислорода воздуха образуются соли хрома (III):
4Cr + 12HCl + 3O2 = 4CrCl3 + 6h3O.
Концентрированная азотная и серная кислоты пассивируют хром. Хром может растворяться в них лишь при сильном нагревании, образуются соли хрома (III) и продукты восстановления кислоты:
2Cr + 6h3SO4 = Cr2(SO4)3 + 3SO2 + 6h3O;
Cr + 6HNO3 = Cr(NO3)3 + 3NO2 + 3h3O.
Взаимодействие с щелочными реагентами
В водных растворах щелочей хром не растворяется, медленно реагирует с расплавами щелочей с образованием хромитов и выделением водорода:
2Cr + 6KOH = 2KCrO2 + 2K2O + 3h3.
Реагирует с щелочными расплавами окислителей, например хлоратом калия, при этом хром переходит в хромат калия:
Cr + KClO3 + 2KOH = K2CrO4 + KCl + h3O.
Восстановление металлов из оксидов и солей
Хром – активный металл, способен вытеснять металлы из растворов их солей: 2Cr + 3CuCl2 = 2CrCl3 + 3Cu.
Свойства простого вещества
Устойчив на воздухе за счёт пассивирования. По этой же причине не реагирует с серной и азотной кислотами. При 2000 °C сгорает с образованием зелёного оксида хрома(III) Cr2O3, обладающего амфотерными свойствами.
Синтезированы соединения хрома с бором (бориды Cr2B, CrB, Cr3B4, CrB2, CrB4 и Cr5B3), с углеродом (карбиды Cr23C6, Cr7C3 и Cr3C2), c кремнием (силициды Cr3Si, Cr5Si3 и CrSi) и азотом (нитриды CrN и Cr2N).
Соединения Cr(+2)
Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
2Cr→2Cr
Все эти соли Cr2+ — сильные восстановители вплоть до того, что при стоянии вытесняют водород из воды. Кислородом воздуха, особенно в кислой среде, Cr2+ окисляется, в результате чего голубой раствор быстро зеленеет.
Коричневый или желтый гидроксид Cr(OH)2 осаждается при добавлении щелочей к растворам солей хрома(II).
Синтезированы дигалогениды хрома CrF2, CrCl2, CrBr2 и CrI2
Соединения Cr(+3)
Степени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 (оба — зелёного цвета). Это — наиболее устойчивая степень окисления хрома. Соединения хрома в этой степени окисления имеют цвет от грязно-лилового (ион [Cr(h3O)6]3+) до зелёного (в координационной сфере присутствуют анионы).
Cr3+ склонен к образованию двойных сульфатов вида MICr(SO4)2·12h3O (квасцов)
Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Cr+3NH+3h3O→Cr(OH)↓+3NH
Можно использовать растворы щелочей, но в их избытке образуется растворимый гидроксокомплекс:
Cr+3OH→Cr(OH)↓
Cr(OH)+3OH→[Cr(OH)]
Сплавляя Cr2O3 со щелочами получают хромиты:
Cr2O3+2NaOH→2NaCrO2+h3O
Непрокаленный оксид хрома(III) растворяется в щелочных растворах и в кислотах:
Cr2O3+6HCl→2CrCl3+3h3O
При окислении соединений хрома(III) в щелочной среде образуются соединения хрома(VI):
2Na[Cr(OH)]+3HO→2NaCrO+2NaOH+8HO
То же самое происходит при сплавлении оксида хрома (III) со щелочью и окислителями, или со щелочью на воздухе (расплав при этом приобретает жёлтую окраску):
2Cr2O3+8NaOH+3O2→4Na2CrO4+4h3O
Соединения хрома (+4)[
При осторожном разложении оксида хрома(VI) CrO3 в гидротермальных условиях получают оксид хрома(IV) CrO2, который является ферромагнетикоми обладает металлической проводимостью.
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах.
Соединения хрома (+6)
Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Простейшие из них — хромовая h3CrO4 и двухромовая h3Cr2O7. Они образуют два ряда солей: желтые хроматы и оранжевые дихроматы соответственно.
Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую h3CrO4, дихромовую h3Cr2O7 и другие изополикислоты с общей формулой h3CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
2CrO+2H→Cr2O+h3O
Но если к оранжевому раствору K2Cr2O7 прилить раствор щёлочи, как окраска вновь переходит в жёлтую так как снова образуется хромат K2CrO4:
Cr2O+2OH→2CrO+HO
До высокой степени полимеризации, как это происходит у вольфрама и молибдена, не доходит, так как полихромовая кислота распадается на оксид хрома(VI) и воду:
h3CrnO3n+1→h3O+nCrO3
Растворимость хроматов примерно соответствует растворимости сульфатов. В частности, желтый хромат бария BaCrO4 выпадает при добавлении солей бария, как к растворам хроматов, так и к растворам дихроматов:
Ba+CrO→BaCrO↓
2Ba+CrO+h3O→2BaCrO↓+2H
Образование кроваво-красного малорастворимого хромата серебра используют для обнаружения серебра в сплавах при помощи пробирной кислоты.
Известны пентафторид хрома CrF5 и малоустойчивый гексафторид хрома CrF6. Также получены летучие оксигалогениды хрома CrO2F2 и CrO2Cl2 (хромилхлорид).
Соединения хрома(VI) — сильные окислители, например:
K2Cr2O7+14HCl→2CrCl3+2KCl+3Cl2↑+7h3O
Добавление к дихроматам перекиси водорода, серной кислоты и органического растворителя (эфира) приводит к образованию синего пероксида хрома CrO5L (L — молекула растворителя), который экстрагируется в органический слой; данная реакция используется как аналитическая.
studfiles.net
Хром | Мир металлов
Хром. Приоритет открытия хрома принадлежит французскому ученому Л.Н. Воклену, который в 1797 г. представил в Парижскую Академию наук образцы нового металла - хромат свинца, полученного из природного соединения - крокоита.
Первые попытки применения хрома в роли легирующего элемента относятся к 1821 г., когда была получена первая хромистая сталь. Это и было начало трудовой деятельности хрома. Металлурги достойно оценили влияние хрома на свойства стали и на сегодняшний день, можно сказать, хром - это легирующий элемент номер один. Сталей, легированных хромом, чрезвычайно много. Обычно принято подразделять такие стали на низко- и высоколегированные. Первые содержат, как правило, не более 1,6, а вторые - более 12 % хрома.
Конструкционные стали, содержащие хрома от 0,6 до 1,6 %, имеют повышенную прочность и твердость. Хром также улучшает прокаливаемость. Например, сталь 40 имеет предел прочности 580 МПа, предел текучести 340 МПа, относительное удлинение 19 %. А сталь марки 40Х имеет аналогичные показатели, соответственно, 1000 МПа, 800 МПа, 13 %; прокаливаемость при этом возрастает в 3 раза. Вот что значит 1 % хрома в стали. Из хромистых сталей изготовляют валы, зубчатые колеса, толкатели, болты, шпильки и другие детали.
При добавлении в железо более 12 % хрома происходят поразительные изменения. Такой сплав при обыкновенных условиях не подвергается коррозии. Это свойство было впервые открыто в 1911 г., а 1913 г. считается годом начала промышленного производства хромистой нержавеющей стали. Еще спустя 10 лет было освоено производство хромоникелевой нержавеющей стали.
Чем объясняется высокая коррозионная стойкость хромистых сталей? При введении хрома в сталь происходит резкое увеличение потенциала твердого раствора а-железа и на поверхности металла образуется тончайшая плотная окисная пленка - поверхность металла изолируется от воздействия внешней среды.
Естественно, что хромистые стали нашли широкое применение. Однако есть у хромистых сталей недостаток - из них нельзя получить листовой прокат. Эта очень важная проблема все же была решена созданием хромоникелевой стали типа Х18Н9. Подобные стали прокатываются и их коррозионная стойкость стала еще выше. Дело в том, что никель, вводимый в хромистую нержавеющую сталь в количестве более 8 %, переводит ее в аустенитное состояние. А однородная структура аустенита, естественно, исключает возникновение микрогальванических элементов на поверхности деталей, изготовленных из такой стали.
Дальнейшая эксплуатация стали типа Х18Н9 показала, что., если при работе деталь из такой стали подвергалась нагреву до 500 700 °С, то появлялось коррозионное разрушение по границам зерен. Такая коррозия называется межкристаллитной. Оказывается, в данном интервале температур происходит нарушение однородности аусте-нитной структуры вследствие выделения карбидов хрома и соединений, очень богатых хромом. Очевидно, такой процесс сопровождается уменьшением содержания хрома в прилегающих к карбиду хрома участках твердого раствора. В среде электролита карбиды хрома становятся катодами, а обедненные хромом зоны аустенита - анодными участками. Особенно неблагоприятно выделение карбидов хрома по границам зерен. Обедненные хромом границы зерен подвергаются коррозии, и общее коррозионное разрушение приобретает наиболее опасный межкристаллитный характер.Опасность устраняется, если в указанную хромоникелевую сталь добавить 1 % титана, который является наиболее активным карбидо-образующим элементом. При нагреве до температур 500-700 °С титан опережает хром, не дает ему соединиться с углеродом, образует карбиды титана и менее активный хром вынужден продолжать выполнять свою благородную задачу - обеспечивать высокий электродный потенциал аустенита. Надо отдать должное металлургам и металловедам - подобный способ борьбы с межкристалитной коррозией оригинален и, главное, эффективен.
Введение титана как легирующего элемента, т. е. более 0,025 %, помимо только что отмеченного благоприятного влияния, обеспечивает более высокую жаростойкость, сопротивление износу, получение мелкозернистой структуры, более полное удаление вредных примесей. Иногда титан заменяют ниобием. Ниобий оказывает аналогичное влияние на свойства хромоникелевой нержавеющей стали, и можно было бы всегда применять ниобий, если бы не высокая цена. Ниобий более чем в 30 раз дороже титана. Поэтому заменяют титан ниобием лишь тогда, когда листовой прокат поступает для получения сварных конструкций. Титан при сварке выгорает, а ниобий, как более тугоплавкий металл, не выгорает, и высокие антикоррозионные свойства сварных швов сохраняются.
Дальнейшее повышение коррозионной стойкости сталей типа Х18Н9Т пошло по пути уменьшения углерода в стали, что приводит к снижению содержания карбидов. Появились стали с пониженным содержанием углерода. Примерами таких сталей являются стали марок 0Х18Н9Т (углерода менее 0,08%), 00Х18Н9Т (углерода менее 0,04 %), 000Х18Н9Т (углерода менее 0,02%). Эти стали хорошо свариваются и применяются для изготовления трубопроводов, выхлопных конусов, деталей камер сгорания, диафрагм, листовых металлических частей турбины, емкостей заправочного и другого аналогичного оборудования.
Хромистые нержавеющие стали марок 12X13, 20X13 применяются для изготовления деталей топливной аппаратуры, соединительных элементов трубопроводов, клапанов, предметов домашнего обихода, а стали марок 28X13 и 40X13 -для изготовления хирургического инструмента, пружин и других деталей, работающих в слабоагрессивных средах (воздух, пар, вода).
Большая группа специальных сталей и сплавов носит название жаропрочных. Они способны длительное время работать при высоких температурах в сложнонапряженном состоянии при одновременном воздействии агрессивной внешней среды. Это стали и сплавы, которые содержат много легирующих элементов, главным из них является никель. Но обойтись без хрома и здесь пока невозможно. А низколегированные жаропрочные и жаростойкие сплавы не содержат никеля, но хром - обязательно.
Необходимый уровень жаропрочности достигается в сталях типа 12Х2МФСР, 12Х2МФБ (ЭИ531) за счет комплексного легирования. Легирующие элементы повышают силы связи атомов в кристаллической решетке железа, вызывают дисперсионное твердение, стабилизируют карбидную фазу. Все эти факторы и обусловливают повышенную жаропрочность.
Одной из самых заслуженных жаропрочных сталей является сталь ЭИ69. Эта сталь была применена впервые в нашей стране в 1939 г. для лопаток и дисков газовых турбин. Она применяется и сегодня, но не как турбинная сталь, а как сталь для клапанов поршневых двигателей, для крепежных деталей. И это закономерно - рабочие температуры за этот период существенно возросли.
Жаропрочные сплавы обычно называют «на никелевой основе», на основе «железа и никеля». Но и хрома в этих сплавах содержится до 30 %, а в сплавах типа ВХ-4 до 66 % хрома. Такие сплавы могут работать при температурах до 1200 °С.
Необходимо отметить, что долгое время существовало мнение о неперспективности сплавов на основе хрома из-за свойственной хрому хрупкости при обыкновенных температурах. Но человек-исследователь решил: хром не первый неподдающийся металл, были и потруднее. И начал освоение непокорного. Вначале добился повышения чистоты при плавке, применяя рафинирование, раскисление и денитрирование. Хром стал менее хрупким, но не настолько, чтобы стать пригодным для изготовления из него деталей. Ввели модифицирование при кристаллизации, всестороннее сжатие при обработке давлением - хром стал еще менее хрупким. Но этого было недостаточно. Только при образовании двухфазной структуры, при которой одна фаза была более пластичной по сравнению с другой, получили пластичный хром и сплавы на его основе с температурой перехода в хрупкое состояние ниже минус 60 °С.
В последние годы в нашей стране и за рубежом появились необычные нержавеющие стали типа СН-2. Их называют стареющими нержавеющими или сверхпрочными. Почти трехкратное повышение прочности достигается комплексным влиянием легирующих элементов {в основном меди, титана и алюминия), которые при старении способствуют образованию карбидов и протеканию ряда других процессов. Но не только высокая прочность является достоинством сталей данной группы. Например, сталь ВСН-2 обладает отличной свариваемостью многими видами сварки, она не требует термической обработки сварного шва, сварные швы отличаются высокой пластичностью и ударной вязкостью, сварка не вызывает поводки (коробления) изделия. Последнее объясняется малым содержанием углерода и низкой температурой мартенситного превращения.
Многие резервы данной группы сталей еще не использованы, многие еще не выявлены, но то, что их внедрение в различные отрасли современной техники является одним из направлений по созданию машин с минимальной материалоемкостью,- это очевидно.
С 1970 г. хром получил новую профессию - защищать сталь от коррозии: ученые разработали методы хромирования. К 20-м годам нашего века методы покрытия поверхности металлов металлическим хромом были доведены до их практического применения. Установлено, что даже тончайшее покрытие в 0,005 мм дает эффект защиты от коррозии. Такие покрытия отличаются высокой устойчивостью против химических, механических и термических воздействий.
Широкое применение имеют соединения хрома. Например, в огнеупорной промышленности применяются хромиты (кислородные соединения хрома), отличающиеся высокими химической инертностью и температурой плавления. В дубильном производстве и при изготовлении красителей без соединений хрома пока обойтись просто невозможно.
Большое значение для промышленности имеют сплавы на основе карбида хрома, которые используются в производстве фильер для волочения проволоки, вкладышей пресс-форм, вырубных штампов и других быстроизнашивающихся деталей (деталей насосов, клапанов в устройствах перекачки кислот в химическом машиностроении и др.).
Фосфид хрома применяется в качестве наполнителя при изготовлении шлифовальных кругов.
Несмотря на то что хром является широко распространенным металлом в природных месторождениях, цены за последние 30 лет на хром практически не снизились. Причинами являются возрастающая потребность в этом металле и трудность получения чистого хрома.
Цена 1 т хрома в 1983 г. составляла 3570 р.
metalls.info
Хром — Циклопедия
Хром
Химический элемент
Твёрдый металл голубовато-белого цвета| Символ, номер | (Cr), 24 |
| Атомная масса | 51,9961(6) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 3d5 4s1 |
| Электроотрицательность | 1,66 |
| Степени окисления | 6, 3, 2, 0 |
| Температура плавления | 21 |
| Температура кипения | 2945 |
| Структура кристаллической решетки | кубическаяобъёмноцентрированая |
| Теплопроводность | 93,9 |
Хром (лат. Chromium) Cr — химический элемент VI группы периодической системы; атомный номер 24. Металл серо-стального цвета.
[править] Природные источники
По распространенности в земной коре занимает 22-е место. Из минералов наибольшее значение имеет хромитов FeO·Cr2O3. Месторождения в ЮАР, Индии, России, Казахстане, Турции.
[править] Физические свойства
В свободном виде хром — серый металл с кубической объемно-центрированной решеткой, а = 0,28845 нм. Это единственное элементарное твердое соединение, которое проявляет антиферромагнитные свойства при комнатной температуре (и ниже). При температуре выше 38 °C он превращается в парамагнетик.
Хром имеет твердость по шкале Мооса 5, твердый из чистых металлов. Очень чистый хром достаточно хорошо поддается механической обработке.
Металлический хром на воздухе пассивируя под действием кислорода, образует тонкий защитный слой поверхностного оксида. Слой, состоящий всего из нескольких атомов толщиной, очень плотный и, в отличие от железа или нелегированной стали, предотвращает диффузию кислорода в материал и возникновение ржавчины. Пассивация может быть повышена путем кратковременного контакта с такой кислотой-окислителем как азотная. Противоположный эффект достигается при обработке сильным восстановителем, который разрушает защитный слой окисла на металле. Хром, обработанный таким способом, легко растворяется даже в слабых кислотах.
Основной потребитель — металлургия (добавки в сталь). Электролитическое покрытие хромом железных изделий (хромирование) придает им коррозионную стойкость. Хромовые сплавы применяются в машино- и приборостроении.
В текстильной и кожевенной промышленности используется как краситель и как составная часть дубильных растворов.
Оксид хрома применяется при выращивании искусственных рубинов (лазерная техника, приборостроение, ювелирное дело).
[править] Биологическая роль
Хром играет важную биологическую роль в организме человека. Он положительно влияет на процессы кроветворения, а также на ферментативные системы. В составе фермента трипсина хром участвует в процессе пищеварения. Учеными установлено, что изъятие хрома из пищевого рациона животных приводит к повышению в крови и моче глюкозы. Добавление хрома в еду больным диабетом нормализует углеводный обмен. Хром в организм человека попадает с такими продуктами питания, как соя, кукурузная и овсяная крупы. Суточная потребность организма в хроме составляет 5-10 мг.
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, h3,W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au
cyclowiki.org
Хром свойства — Знаешь как
Атомная масса хрома 51,996. В менделеевской таблице он занимает место в шестой группе. Его ближайшие соседи и аналоги — молибден и вольфрам. Характерно, что соседи хрома, так же как и он сам, широко применяются для легирования сталей. Температура плавления хрома зависит от его чистоты. Многие исследователи пытались ее определить и получили значения от 1513 до 1920° С. Такой большой «разброс» объясняется прежде всего количеством и составом содержащихся в хроме примесей. Сейчас считают, что хром плавится при температуре около 1875° С. Температура кипения 2199° С. Плотность хрома меньше, чем железа; она равна 7,19. По химическим свойствам хром близок к молибдену и вольфраму. Высший окисел его СrО3 — кислотный, это — ангидрид хромовой кислоты Н2СrO4. Минерал крокоит, с которого мы начинали знакомство с элементом № 24,— соль этой кислоты. Кроме хромовой, известна двухромовая кислота Н2Сr2O7, в химии широко применяются ее соли — бихроматы. Наиболее распространенный окисел хрома Сг2О3 — амфотерен. А вообще в разных условиях хром может проявлять валентности от 2 до 6. Широко используются только соединения трех- и шестивалентного хрома.
Хром обладает всеми свойствами металла — хорошо проводит тепло и электрический ток, имеет характерный металлический блеск. Главная особенность хрома — его устойчивость к действию кислот и кислорода.
Для тех, кто постоянно имеет дело с хромом, стала притчей во языцех еще одна его особенность: при температуре около 37° С некоторые физические свойства этого металла резко, скачкообразно меняются. При этой температуре — явно выраженный максимум внутреннего трения и минимум модуля упругости. Почти также резко изменяются электросопротивление, коэффициент линейного расширения, термоэлектродвижущая сила.
Объяснить эту аномалию ученые пока не могут.
Известны четыре природных изотопа хрома. Их массовые числа 50, 52, 53 и 54. Доля самого распространенного изотопа 52Сг — около 84%.
Хром в сплавах
Вероятно, было бы противоестественным, если бы рассказ о применении хрома и его соединений начался не со стали, а с чего-либо иного. Хром — один из самых важных легирующих элементов, применяемых в черной металлургии. Добавка хрома к обычным сталям (до 5% Сг) улучшает их физические свойства и делает металл более восприимчивым к термической обработке. Хромом легируют пружинные, рессорные, инструментальные, штамповые и шарикоподшипниковые стали. В них (кроме шарикоподшипниковых сталей) хром присутствует вместе с марганцем, молибденом, никелем, ванадием. А шарикоподшипниковые стали содержат лишь хром (около 1,5%) и углерод (около 1 %). Последний образует с хромом карбиды исключительной твердости: Сг3С, Сг7С3 и Сг23С6. Они придают шарикоподшипниковой стали высокую износостойкость.Если содержание хрома в стали повысить до 10% и более, сталь становится более стойкой к окислению и коррозии, но здесь вступает в силу фактор, который можно назвать углеродным ограничением. Способность углерода связывать большие количества хрома приводит к обеднению стали этим элементом. Поэтому металлурги оказываются перед дилеммой: хочешь получить коррозионную стойкость — уменьшай содержание углерода и теряй на износостойкости и твердости.
Нержавеющая сталь самой распространенной марки содержит 18% хрома и 8% никеля. Содержание углерода в ней очень невелико —до 0,1%. Нержавеющие стали хорошо противостоят коррозии и окислению, сохраняют прочность при высоких температурах. Из листов такой стали сделана скульптурная группа В. И. Мухиной «Рабочий и колхозница», которая установлена в Москве у Северного входа на Выставку достижений народного хозяйства. Нержавеющие стали широко используются в химической и нефтяной промышленности.
Высокохромистые стали (содержащие 25—30% Сr) обладают особой стойкостью к окислению при высокой температуре. Их применяют для изготовления деталей нагревательных печей.
Теперь несколько слов о сплавах на основе хрома. Это сплавы, содержащие более 50% хрома. Они обладают весьма высокой жаропрочностью. Однако у них есть очень большой недостаток, сводящий на нет все преимущества: эти сплавы очень чувствительны к поверхностным дефектам: достаточно появиться царапине, микротрещине, и изделие быстро разрушится под нагрузкой. У большинства сплавов подобные недостатки устраняются термомеханической обработкой, но сплавы на основе хрома такой обработке не поддаются. Кроме того, они чересчур хрупки при комнатной температуре, что также ограничивает возможности их применения.Более ценны сплавы хрома с никелем (в них часто вводятся как легирующие добавки и другие элементы). Самые распространенные сплавы этой группы — нихромы содержат до 20% хрома (остальное никель) и применяются для изготовления нагревательных элементов. У нихромов — большое для металлов электросопротивление, при пропускании тока они сильно нагреваются.
Добавка к хромоникелевым сплавам молибдена и кобальта позволяет получить материалы, обладающие высокой жаропрочностью, способностью выносить большие нагрузки при 650—900° С. Из этих сплавов делают, например, лопатки газовых турбин. Жаропрочностью обладают также хромокобальтовые сплавы, содержащие 25-30% хрома. Промышленность использует хром и как материал для антикоррозионных и декоративных покрытий.
Вы читаете, статья на тему хром свойства и сплавы
znaesh-kak.com