Содержание
Химический элемент Аргон: свойства и применение
Содержание
- История открытия
- Химические и физические свойства
- Где находится
- В каких областях применяется
Аргон — химический элемент, который находится под номером 18 в периодической таблице Менделеева. Как вещество, аргон представляет собой одноатомный инертный газ без запаха, вкуса и цвета. Занимает 3-е место по распространённости на Земле. Его опережают кислород и азот.
История открытия
Учёные не подозревали о существовании аргона до 1785 года. С того момента начались многочисленные эксперименты. Химики и физики из Англии подвергали порцию воздуха воздействию электрического тока и щёлочи. Это было необходимо для того, чтобы разделить воздух на молекулы веществ, из которых он состоит. В конце экспериментов всегда оставался неизвестный газ, который в полтора раза тяжелее азота.
Аргон официально был представлен 7 августа 1894 года на Британском собрании физиков, химиков и естествоиспытателей в Оксфорде. О его открытии был сделан доклад английскими учёными Джоном Рэлеем и Уильямом Рамзаем. Именно они проводили большинство исследований воздуха, и в конце концов обнаружили аргон.
О его открытии был сделан доклад английскими учёными Джоном Рэлеем и Уильямом Рамзаем. Именно они проводили большинство исследований воздуха, и в конце концов обнаружили аргон.
«Аргон» с древнегреческого переводится как «неактивный, медленный, ленивый». Название полностью отражает суть элемента, поскольку он химически неактивен.
Химические и физические свойства
Аргон недеятелен. Практически не вступает в реакцию с другими веществами. Кипит при температуре -185 °C в нормальных условиях. При температуре -189 °C образует кристаллы. Имеет 3 стабильных изотопа 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %).
Где находится
На Земле аргона больше всего содержится в воздухе. Также вещество находится в Мировом океане, в солёной и пресной воде, и в земной коре.
Во Вселенной данный инертный газ распространён мало. Совместно с неоном аргон присутствует в некоторых планетарных туманностях и на звёздах.
В каких областях применяется
Аргон используется для создания лазеров и плазмообразователя. Широкое применение для инертного газа нашли в контактной, лазерной и дуговой сварке. При этом существует 3 сорта аргона. Они различаются между собой по наличию посторонних примесей и используются для разных металлов. Первый сорт чист на 99,99%, второй на 99,99%, а третий на 99,95%.
Широкое применение для инертного газа нашли в контактной, лазерной и дуговой сварке. При этом существует 3 сорта аргона. Они различаются между собой по наличию посторонних примесей и используются для разных металлов. Первый сорт чист на 99,99%, второй на 99,99%, а третий на 99,95%.
Инертный газ нашёл своё место не только в технической промышленности, но и в пищевой. Так, пищевая добавка Е938 — это и есть аргон.
Аргон не влияет на организм человека, если он находится в воздухе в нормальных количествах. Всемирное антидопинговое агентство (ВАДА) признало аргон допингом в 2014 году. При барометрическом давлении от 0,2 МПа и выше данный инертный газ может временно усилить психологическую или физическую деятельность человека. Только при очень высокой концентрации аргон может спровоцировать тошноту, головную боль, рвоту и даже удушение от нехватки кислорода.
Смотрите также химические соединения аргона.
Аргон: факты и фактики
А. Мотыляев
«Химия и жизнь» №7, 2015
Как аргон поставил в тупик Д. И. Менделеева и других именитых химиков? Первым аргон открыл Генри Кавендиш в 1795 году: он несколько недель пропускал электрический разряд сквозь воздух, при этом кислород реагировал с азотом (их тогда называли «дефлогистонный воздух» и «флогистонный воздух» соответственно) и давал азотистую кислоту, которую поглощал поташ. Объем газа в сосуде уменьшался, однако газ не исчезал полностью: оставалось что-то, не вступающее в реакцию. Никто на открытие Кавендиша особого внимания не обратил. Но вот в 1882 году лорд Рэлей начал серию нудных опытов по измерению плотности газов. И все время у него получалось, что соотношение веса водорода и изучаемого газа немного меньше целочисленного. Физикам же, еще не подозревавшим о существовании изотопов, очень хотелось, чтобы оно было целочисленным. Желая найти источник ошибки, Рэлей решил получить чистый, не атмосферный, азот. Для этого он прогнал над раскаленной медью смесь аммиака с кислородом: аммиак разлагался, давая азот и воду. Такой азот оказался на полпроцента легче, нежели атмосферный.
И. Менделеева и других именитых химиков? Первым аргон открыл Генри Кавендиш в 1795 году: он несколько недель пропускал электрический разряд сквозь воздух, при этом кислород реагировал с азотом (их тогда называли «дефлогистонный воздух» и «флогистонный воздух» соответственно) и давал азотистую кислоту, которую поглощал поташ. Объем газа в сосуде уменьшался, однако газ не исчезал полностью: оставалось что-то, не вступающее в реакцию. Никто на открытие Кавендиша особого внимания не обратил. Но вот в 1882 году лорд Рэлей начал серию нудных опытов по измерению плотности газов. И все время у него получалось, что соотношение веса водорода и изучаемого газа немного меньше целочисленного. Физикам же, еще не подозревавшим о существовании изотопов, очень хотелось, чтобы оно было целочисленным. Желая найти источник ошибки, Рэлей решил получить чистый, не атмосферный, азот. Для этого он прогнал над раскаленной медью смесь аммиака с кислородом: аммиак разлагался, давая азот и воду. Такой азот оказался на полпроцента легче, нежели атмосферный. А в 1894 году Уильям Рамзай обнаружил, что азот поглощается раскаленным магнием. Он-то и решил выделить обнаруженную Рэлеем тяжелую примесь к азоту. Вскоре в руках Рамзая оказалось 40 мл газа, который не поглощался магнием. Измерения показали, что его молекулярный вес равен 40. Поскольку все известные на тот момент газы были двухатомными, получался атомный вес 20, что выглядело странно — тяжелее фтора, легче натрия. Одноатомный же газ был бы слишком тяжелым и никак не вписывался в Периодическую таблицу — такой элемент следовало поставить между двумя металлами — калием и кальцием. Поэтому возникла гипотеза, что Рамзай обнаружил трехатомный азот, благо 40 примерно в три раза больше, чем 14. Вот как Менделеев пишет об этом в «Дополнении к 5-й главе» шестого издания «Основ химии»: «Гипотеза А=40 вовсе не дает места аргону в периодической системе… Мне кажется более простым предположение, что аргон содержит N3, особенно потому, что аргон содержится в азоте…» Рэлей, огорченный неприятием его нового газа, больше химией не занимался и Нобелевскую премию получил в 1904 году по физике за исследование плотностей газов и открытие в связи с этим аргона.
А в 1894 году Уильям Рамзай обнаружил, что азот поглощается раскаленным магнием. Он-то и решил выделить обнаруженную Рэлеем тяжелую примесь к азоту. Вскоре в руках Рамзая оказалось 40 мл газа, который не поглощался магнием. Измерения показали, что его молекулярный вес равен 40. Поскольку все известные на тот момент газы были двухатомными, получался атомный вес 20, что выглядело странно — тяжелее фтора, легче натрия. Одноатомный же газ был бы слишком тяжелым и никак не вписывался в Периодическую таблицу — такой элемент следовало поставить между двумя металлами — калием и кальцием. Поэтому возникла гипотеза, что Рамзай обнаружил трехатомный азот, благо 40 примерно в три раза больше, чем 14. Вот как Менделеев пишет об этом в «Дополнении к 5-й главе» шестого издания «Основ химии»: «Гипотеза А=40 вовсе не дает места аргону в периодической системе… Мне кажется более простым предположение, что аргон содержит N3, особенно потому, что аргон содержится в азоте…» Рэлей, огорченный неприятием его нового газа, больше химией не занимался и Нобелевскую премию получил в 1904 году по физике за исследование плотностей газов и открытие в связи с этим аргона. А Рамзай за открытие и исследование элементов нулевой группы получил в том же году премию по химии.
А Рамзай за открытие и исследование элементов нулевой группы получил в том же году премию по химии.
Почему аргон с весом 39,9 стоит в таблице перед калием, вес которого 39,1? У аргона есть три устойчивых изотопа с весами 36, 38 и 40. Во Вселенной больше легких изотопов, а аргона-40 очень мало. При этом аргона в планетарных туманностях и в веществе звезд много, он преобладает над такими распространенными на Земле элементами, как калий, кальций, фтор и хлор. А вот на нашей планете и самого-то аргона немного, и его легких изотопов ничтожно мало — видимо, они улетели на периферию Солнечной системы. Аргон-40 мы не унаследовали из протопланетного облака; он образуется здесь и сейчас — в результате радиоактивного превращения калия-40. Обычно у этого изотопа, обеспечивающего основную часть природного фона излучений, нейтрон становится протоном с испусканием позитрона, и получается следующий элемент — кальций-40. Но в каждом пятом случае происходит так называемый К-захват: электрон с нижней орбитали падает в ядро, один из протонов становится нейтроном с испусканием нейтрино, атом же уходит на предыдущую клетку Периодической системы. Именно из-за недостатка легких изотопов аргона на Земле его вес, измеренный химиками, оказался больше, чем у следующего за ним калия, представленного всеми изотопами.
Именно из-за недостатка легких изотопов аргона на Земле его вес, измеренный химиками, оказался больше, чем у следующего за ним калия, представленного всеми изотопами.
Есть ли на Земле радиоактивный аргон? В природе радиоактивного аргона почти нет, поскольку самый долгоживущий — аргон-39 — имеет период полураспада 269 лет. Однако высокоактивный аргон-41 с периодом полураспада 1,85 часа непрерывно образуется в атомном реакторе, а при неисправностях в системе вентиляции может попасть и за его пределы. После запуска термоядерного реактора проблема усложнится. Согласно расчету Владимира Хрипунова из Курчатовского института (Fusion Engineering and Design, 2015, DOI:10.1016/j.fusengdes.2015.02.058), при массированной нейтронной бомбардировке — напомним, что именно за счет торможения нейтронов стенками токамака планируется снимать тепло, выделяющееся при термоядерном синтезе, — начнет образовываться аргон-39 в достаточном количестве, чтобы вызвать беспокойство за здоровье работников термоядерной станции.
Как аргоном измеряют время? Калий — один из самых распространенных элементов на Земле и других каменистых планетах, а период полураспад калия-40 — 1,3 млрд лет. Постоянно образующийся аргон-40 оказывается заключенным в любую горную породу, и его количество растет начиная со времени ее затвердевания. Соответственно по соотношению аргона-40 и калия-40 можно узнать, когда эта порода (как правило, речь идет о базальте) была извержена из недр планеты. Измерения проводят, бомбардируя аргон-40 потоком нейтронов: получается короткоживущий аргон-41, его распад легко заметить. Аргоном удается мерить время в масштабе от сотен миллионов до десятков тысяч лет, то есть когда углеродный метод работает уже неточно. За разработку метода профессор Э. К. Герлинг получил в 1963 году Ленинскую премию. В частности, аргоновым методом по возрасту окружающих камешков были датированы первые, найденные в Олдувейском ущелье в Кении, останки человека умелого Homo habilis, его возраст оказался 1,7 млн лет (см. «Химию и жизнь», 1967, №6). В числе последних достижений — новая датировка Деканских траппов (Journal of Asian Earth Sciences, 2014, 84, 9–23, DOI:10.1016/j.jseaes.2013.08.021), крупнейшего разлива лавы, занимающего треть Индостана с западной его стороны. Как оказалось, возраст наиболее объемных разливов статистически неотличим от даты катастрофы, погубившей динозавров. Падение же метеорита в районе Юкатана, создавшее кратер Чиксулуб, по новейшим данным произошло на 300 тысяч лет раньше массового вымирания. Вообще, деканская гипотеза давно конкурирует с чиксулубской.
«Химию и жизнь», 1967, №6). В числе последних достижений — новая датировка Деканских траппов (Journal of Asian Earth Sciences, 2014, 84, 9–23, DOI:10.1016/j.jseaes.2013.08.021), крупнейшего разлива лавы, занимающего треть Индостана с западной его стороны. Как оказалось, возраст наиболее объемных разливов статистически неотличим от даты катастрофы, погубившей динозавров. Падение же метеорита в районе Юкатана, создавшее кратер Чиксулуб, по новейшим данным произошло на 300 тысяч лет раньше массового вымирания. Вообще, деканская гипотеза давно конкурирует с чиксулубской.
В какие реакции вступает аргон? Не имея свободных электронов и потому будучи химически инертным, аргон образует химические соединения неохотно и в весьма экзотических условиях. Однако он формирует так называемые клатратные соединения: атом аргона может оказаться заключенным в полость, образованную какой-то молекулой, либо в кристаллической решетке другого вещества. Подобно ксенону, аргон способен образовывать и соединения с белками; в результате при повышенном давлении аргон-кислородная смесь вызывает потерю сознания — аргоновый наркоз.
Чем опасен аргон? При работе с установками, заполненными аргоном, следует соблюдать меры предосторожности: аргон — тяжелый газ, он скапливается во всевозможных углублениях, например колодцах, вытесняя оттуда кислород, то есть может создать атмосферу, непригодную для дыхания. Если рабочий, потеряв сознание, упадет в такое углубление, он задохнется. Материаловеды, работающие с аргоном, говорят: «Аргон дырочку найдет», а изготовители оборудования это обстоятельство учитывают. Рассказывают такой случай. На одном предприятии ставили новый шведский газостат. Это огромная установка высотой с пятиэтажный дом, в которой можно подвергать детали нагреву и высокому давлению для устранения внутренних полостей в металле, образующихся при изготовлении. Чтобы избежать окисления детали, газостат заполняют инертным газом — аргоном. Поскольку копать вниз проще, чем строить вверх, газостат хотели заглубить, но изготовители категорически это запретили именно потому, что вытекающий из установки аргон нигде не должен скапливаться.![]() А вот на растения аргон влияет хорошо: в атмосфере из 98% аргона и 2% кислорода семена лука, моркови и салата прорастают вполне успешно.
А вот на растения аргон влияет хорошо: в атмосфере из 98% аргона и 2% кислорода семена лука, моркови и салата прорастают вполне успешно.
Зачем заполняют аргоном стеклопакет? Для повышения звукоизоляции и снижения теплопроводности — у аргона выше модуль упругости и ниже теплопроводность, чем у воздуха. Правда, с учетом правила «аргон дырочку найдет», не ясно, как долго этот газ будет находиться внутри стеклопакета.
Как получают аргон? При разделении воздуха на кислород и азот в колоннах высокого давления. Летучесть аргона больше, чем у кислорода, и меньше, чем у азота, — его и забирают из верхней трети колонны. Отделяют аргон также из отхода производства аммиака — того азота, что не израсходовался на реакцию с водородом; он сам собой оказывается обогащенным аргоном.
Как аргон применяют в технике? Будучи самым распространенным инертным газом — все-таки третий по значимости компонент атмосферы Земли после азота и кислорода, — аргон очень востребован, прежде всего в качестве вещества, не способного к химическим реакциям. Заполнив установку или весь цех аргоном, можно не бояться, что нагретая металлическая деталь или заготовка окислится либо насытится азотом с последующим выделением нитридов. Склонны к окислению, например, молибден и вольфрам: многие могли наблюдать мгновенное превращение спирали лампы накаливания в синеватый порошок при попадании в нее воздуха. В среде аргона обрабатывают титан, тантал, ниобий, бериллий, гафний, цирконий, а также уран, торий и плутоний. Продувая аргон через сталь в конвертере, из нее удаляют газовые включения. Революцию в технике совершил метод аргонно-дуговой сварки: поток аргона, подаваемый в то место, где горит электрическая дуга, вытесняет воздух и не дает металлу окисляться — оксиды снижают прочность шва, а то и вовсе делают сварку материалов невозможной. Таким методом сваривают легированные стали и цветные металлы, режут их толстые листы. Еще одно серьезное направление — распыление всевозможных материалов для получения чистого от оксидов порошка.
Заполнив установку или весь цех аргоном, можно не бояться, что нагретая металлическая деталь или заготовка окислится либо насытится азотом с последующим выделением нитридов. Склонны к окислению, например, молибден и вольфрам: многие могли наблюдать мгновенное превращение спирали лампы накаливания в синеватый порошок при попадании в нее воздуха. В среде аргона обрабатывают титан, тантал, ниобий, бериллий, гафний, цирконий, а также уран, торий и плутоний. Продувая аргон через сталь в конвертере, из нее удаляют газовые включения. Революцию в технике совершил метод аргонно-дуговой сварки: поток аргона, подаваемый в то место, где горит электрическая дуга, вытесняет воздух и не дает металлу окисляться — оксиды снижают прочность шва, а то и вовсе делают сварку материалов невозможной. Таким методом сваривают легированные стали и цветные металлы, режут их толстые листы. Еще одно серьезное направление — распыление всевозможных материалов для получения чистого от оксидов порошка.
Что такое аргоновые кластеры? Пучки ионизированных кластеров — новый метод обработки поверхности до атомной гладкости. Его суть — бомбардировка не отдельными ионами (это называется «ионное травление»), а гораздо более тяжелыми частицами, состоящими из десятков, а то и тысяч атомов. Пучки аргоновых кластеров получили широкое распространение из-за инертности газа и его относительной дешевизны. Кластеры формируют, подавая газ под высоким давлением через узкое сопло. Проходя сквозь него, газовый поток резко расширяется и охлаждается; атомы аргона слипаются в твердое вещество, где их удерживают силы Ван-дер-Ваальса. Когда поверхность бомбардируют кластерами с высокой энергией, образуются кратеры размером в нанометры; такой будет и гладкость всей поверхности. Повторяя сканирование пучком менее энергичных кластеров, гладкость увеличивают. Таким методом обрабатывают полупроводники, тонкие пленки, поверхность дисков для компьютеров и многое другое. Кластерными пучками можно и создавать наноузоры на поверхностях. Они же позволяют, не нагревая образец, проводить послойное изучение его состава, постепенно забираясь все глубже и глубже; этот метод применяют для анализа строения органических веществ.
Его суть — бомбардировка не отдельными ионами (это называется «ионное травление»), а гораздо более тяжелыми частицами, состоящими из десятков, а то и тысяч атомов. Пучки аргоновых кластеров получили широкое распространение из-за инертности газа и его относительной дешевизны. Кластеры формируют, подавая газ под высоким давлением через узкое сопло. Проходя сквозь него, газовый поток резко расширяется и охлаждается; атомы аргона слипаются в твердое вещество, где их удерживают силы Ван-дер-Ваальса. Когда поверхность бомбардируют кластерами с высокой энергией, образуются кратеры размером в нанометры; такой будет и гладкость всей поверхности. Повторяя сканирование пучком менее энергичных кластеров, гладкость увеличивают. Таким методом обрабатывают полупроводники, тонкие пленки, поверхность дисков для компьютеров и многое другое. Кластерными пучками можно и создавать наноузоры на поверхностях. Они же позволяют, не нагревая образец, проводить послойное изучение его состава, постепенно забираясь все глубже и глубже; этот метод применяют для анализа строения органических веществ.
Как аргон работает в нанотехнологиях? Аргоновая плазма либо добавка аргона к плазме другого газа — важнейший метод получения всяческих наноструктур: сферических наночастиц, нанолезвий, наноигл. Суть плазменного метода состоит в том, что разделенное на ионы и электроны вещество обладает способностью активировать химические реакции и даже делает возможными те, что в нормальных условиях запрещены термодинамически. Аргон — прекрасный активатор: сам в реакцию не вмешивается, а продукты реакции либо конденсируются в равноосные частицы, либо оседают на поверхности, давая неравноосные структуры. Он же может служить разбавителем плазмы другого, реакционного газа — таким способом меняют параметры процесса. Наконец, высокотемпературную плазму аргона применяют для распыления металлической мишени и получения из нее нанопорошков с частицами заданного размера. Другие инертные газы — неон, ксенон — дают свои размеры. Применяют аргон и как охладитель: он выдувает порошок из зоны плазмы, что опять же позволяет регулировать размер частиц, поскольку тот зависит от времени нахождения материала в зоне плазмы.
Кому нужна пена с аргоном? С помощью аргона можно делать пористые шаблоны из желатина для последующего их заселения клетками при выращивании искусственных органов. Преимущество аргона здесь очевидно — его химическая инертность.
Что такое аргоновый лазер? В этом лазере, изобретенном в 1964 году, генератором света служит трубка, заполненная аргоном. Электроды создают в ней плазму с большой плотностью ионов аргона, а катушка, обмотанная вокруг трубки, формирует магнитное поле, еще больше увеличивающее плотность плазмы. Этот лазер дешевле твердотельных аналогов, дает мощное — 20–30 ватт — излучение в сине-зеленой части спектра, причем его цвет можно переключать между 14-ю спектральными линиями. Такие лазеры применяют для накачки других лазеров, для световых шоу, а также для стимулирования флуоресценции при химическом анализе сложных органических веществ. С его помощью, например, находят следы РНК в количестве пикограмм, то есть столько, сколько есть в одной клетке (Electrophoresis, 2015, DOI:10. 1002/elps.201500117). Применяют аргоновый лазер и при лечении слепоты, вызванной диабетом, — она появляется из-за чрезмерного развития кровеносных сосудов в глазу, а лазером их можно безболезненно проредить.
1002/elps.201500117). Применяют аргоновый лазер и при лечении слепоты, вызванной диабетом, — она появляется из-за чрезмерного развития кровеносных сосудов в глазу, а лазером их можно безболезненно проредить.
Как аргоном проводят стерилизацию? Для уничтожения бактерий используют холодную аргоновую плазму. В такой плазме есть горячие электроны, а температура ионов равна комнатной, то есть она не может обжечь, но сохраняет способность активировать реакции. Реакции же эти зависят и от способа получения плазмы (от температуры ее электронов), и от добавок других газов. Например, облучение клеток млекопитающих в физиологическом растворе чистым или влажным аргоном давало прежде всего гидроксил-радикал, который угнетал развитие клеток. А вот плазма из аргона с добавками 1% кислорода или 1% воздуха давала, скорее всего, атомарный кислород. Реагируя с хлорид-ионом, он порождал радикалы Cl2– или ClO–, убийственно действующие на клетки, причем никакие ферменты-антиоксиданты вроде супероксиддисмутазы с ними справиться не могли. Время жизни таких радикалов оказалось на уровне получаса (Biointerphases, 2015, 10, 2: 029518; DOI:10.1116/1.4919710). Итог понятен: аргоновой плазмой можно проводить «холодную» дезинфекцию. Так, кишечную палочку на образце удается извести за 10 минут (Applied Biochemistry & Biotechnology, 2013, 171, 7; DOI:10.1007/s12010-013-0430-9), а с добавкой 0,5% кислорода — уже за 30 секунд (International Journal of Radiation Biology, 2009, 85, 4; DOI:10.1080/09553000902781105). Вообще, холодная плазма из различных газов очищает поверхность мяса, птицы, овощей, фруктов от таких микробов, как кишечная палочка, листерия, сальмонелла, золотистый стафилококк, за считаные секунды. И никакой антимикробной «химии», пугающей потребителя. Однако технология эта новая, оборудование не стандартизировано, каждый генератор дает свою плазму, и результаты опытов сравнивать трудно. Также неизвестно, как такая обработка повлияет на качество пищи при ее массовой обработке (Annual Review of Food Science & Technology.
Время жизни таких радикалов оказалось на уровне получаса (Biointerphases, 2015, 10, 2: 029518; DOI:10.1116/1.4919710). Итог понятен: аргоновой плазмой можно проводить «холодную» дезинфекцию. Так, кишечную палочку на образце удается извести за 10 минут (Applied Biochemistry & Biotechnology, 2013, 171, 7; DOI:10.1007/s12010-013-0430-9), а с добавкой 0,5% кислорода — уже за 30 секунд (International Journal of Radiation Biology, 2009, 85, 4; DOI:10.1080/09553000902781105). Вообще, холодная плазма из различных газов очищает поверхность мяса, птицы, овощей, фруктов от таких микробов, как кишечная палочка, листерия, сальмонелла, золотистый стафилококк, за считаные секунды. И никакой антимикробной «химии», пугающей потребителя. Однако технология эта новая, оборудование не стандартизировано, каждый генератор дает свою плазму, и результаты опытов сравнивать трудно. Также неизвестно, как такая обработка повлияет на качество пищи при ее массовой обработке (Annual Review of Food Science & Technology. 2012, 3, 125-42; DOI:10.1146/annurev-food-022811-101132).
2012, 3, 125-42; DOI:10.1146/annurev-food-022811-101132).
Как аргон применяют в медицине? Разными способами. Например, плазма может пригодиться для той же дезинфекции ран, хотя в случае с трофическими язвами результаты вышли неоднозначными: вроде бы число бактерий уменьшалось не так быстро, как при применении лекарства, однако язвы заживали с той же скоростью. Возможно, дело в том, что плазмой можно обрабатывать язвы меньшего размера и они заживают быстрее (Journal of Wound Care, 201, 24, 5; DOI:10.12968/jowc.2015.24.5.196). Плазменное лечение не вызывает таких побочных действий, как лекарственные средства, поэтому авторы рекомендуют продолжить исследования с разными источниками плазмы, тем более что устойчивости к ней не может развиться по определению, чего о лекарствах не скажешь.
С помощью специально придуманной плазменной щетки удается уничтожать и бактерии, вызывающие кариес. Но здесь есть нюансы. Так, основными вредителями зубов считаются Streptococcus mutans и Lactobacillus acidophilus, которые образуют на эмали бактериальные маты и выделяют много кислоты. У стрептококка клетки маленькие, и они разрушаются всего за 13 секунд. А у лактобактерии — большие, образующие толстые слои, и, чтобы избавиться от них, нужны уже минуты (Journal of Dentistry, 2011, 39, 1; DOI:10.1016/j.jdent.2010.10.002). Вряд ли такая щетка появится в быту, а вот стоматологу для дезинфекции свежеобработанного дупла пригодится. К тому же плазма изменяет поверхность вещества зуба, что увеличивает прочность ее соединения с пломбой на 60%. Тут главное — не перестараться: эффект дает обработка в течение 30 секунд, а несколько минут, наоборот, ухудшают сцепление (European Journal of Oral Science. 2010, 118, 5; DOI:10.1111/j.1600-0722.2010.00761). Аргоновой плазмой можно быстро остановить кровь при внутреннем кровотечении. Вдыхание аргона защищает нейроны, пострадавшие от ишемического удара или вследствие травмы (PLoS One, 2014, 9, 12:e115984, DOI:10.1371/journal.pone.0115984).
У стрептококка клетки маленькие, и они разрушаются всего за 13 секунд. А у лактобактерии — большие, образующие толстые слои, и, чтобы избавиться от них, нужны уже минуты (Journal of Dentistry, 2011, 39, 1; DOI:10.1016/j.jdent.2010.10.002). Вряд ли такая щетка появится в быту, а вот стоматологу для дезинфекции свежеобработанного дупла пригодится. К тому же плазма изменяет поверхность вещества зуба, что увеличивает прочность ее соединения с пломбой на 60%. Тут главное — не перестараться: эффект дает обработка в течение 30 секунд, а несколько минут, наоборот, ухудшают сцепление (European Journal of Oral Science. 2010, 118, 5; DOI:10.1111/j.1600-0722.2010.00761). Аргоновой плазмой можно быстро остановить кровь при внутреннем кровотечении. Вдыхание аргона защищает нейроны, пострадавшие от ишемического удара или вследствие травмы (PLoS One, 2014, 9, 12:e115984, DOI:10.1371/journal.pone.0115984).
Как работает аргоновая криохирургия? Криохирургия — это уничтожение больных тканей в результате их быстрого замораживания. Ее применяют по самым разным показаниям, от сведения бородавок и сглаживания шрамов до удаления опухолей. Если бородавки замораживают снаружи ваткой, смоченной в жидком азоте, то шрамы и опухоли — изнутри, вводя в них полую иглу — криозонд, через которую прокачивают холодное вещество. Используют еще и криоаппликаторы — их на замораживаемый объект накладывают. Установка с жидким азотом — гораздо проще и дешевле, но в ней применяют толстые, диаметром 6 мм, зонды. Аргоновая же устроена гораздо сложнее, требует высокой квалификации персонала, в частности специальных знаний по работе с высоким давлением, но позволяет очень точно замораживать ткань: диаметр иглы может быть величиной с миллиметр, такая игла легко проходит сквозь кожу. Заморозку проводят газообразным аргоном. Газ хранят под давлением 400 атмосфер, а, проходя через узкое сопло и затем резко расширяясь, он вследствие эффекта Джоуля—Томсона охлаждает до –140°С. Если термодатчики, воткнутые рядом с местом заморозки, показывают, что температура слишком упала и могут пострадать здоровые ткани, в зонд подают гелий, который отогревает замерзшую ткань.
Ее применяют по самым разным показаниям, от сведения бородавок и сглаживания шрамов до удаления опухолей. Если бородавки замораживают снаружи ваткой, смоченной в жидком азоте, то шрамы и опухоли — изнутри, вводя в них полую иглу — криозонд, через которую прокачивают холодное вещество. Используют еще и криоаппликаторы — их на замораживаемый объект накладывают. Установка с жидким азотом — гораздо проще и дешевле, но в ней применяют толстые, диаметром 6 мм, зонды. Аргоновая же устроена гораздо сложнее, требует высокой квалификации персонала, в частности специальных знаний по работе с высоким давлением, но позволяет очень точно замораживать ткань: диаметр иглы может быть величиной с миллиметр, такая игла легко проходит сквозь кожу. Заморозку проводят газообразным аргоном. Газ хранят под давлением 400 атмосфер, а, проходя через узкое сопло и затем резко расширяясь, он вследствие эффекта Джоуля—Томсона охлаждает до –140°С. Если термодатчики, воткнутые рядом с местом заморозки, показывают, что температура слишком упала и могут пострадать здоровые ткани, в зонд подают гелий, который отогревает замерзшую ткань. Так можно проводить циклы контролируемого замораживания-размораживания, что увеличивает эффективность процедуры, да и примерзший криозонд проще извлекать.
Так можно проводить циклы контролируемого замораживания-размораживания, что увеличивает эффективность процедуры, да и примерзший криозонд проще извлекать.
Как аргоновый резак используют хирурги? С помощью аргонового плазменного резака можно проводить удивительные по виртуозности операции — подрезать стенты, вставленные в кишечник, или тонкие протоки пищеварительной системы, например те, что доставляют желчь и секрет поджелудочной железы. В силу разных причин (опухоль, камни и подобное) проток может перекрыться. Для лечения туда вставляют трубочку — стент, например, из интерметаллида NiTi — нитинола. Изначально ее диаметр невелик, а попав на место и нагревшись, изделие, в силу эффекта памяти формы нитинола, увеличивается в размере и расширяет просвет сосуда. Однако может получиться так, что размер стента выбран неверно либо со временем из-за изменений в организме становится неподходящим. Кроме того, стент может зарасти или сдвинуться с места и так перекрыть канал, что к нему не подберешься с тем эндоскопом, которым этот стент размещали. Тогда вводят плазменный резак мощностью в несколько десятков ватт и подрезают стент. Во многих случаях эта операция проходит вполне успешно, никаких повреждений сосудов и кровотечения не вызывает (а если и вызовет, той же плазмой можно остановить кровь), но для самочувствия пациента она гораздо лучше, нежели изъятие старого стента и установка нового (Endoscopy, 2005, 37, 5,434–438). Это важно, поскольку возраст пациента может быть преклонным.
Тогда вводят плазменный резак мощностью в несколько десятков ватт и подрезают стент. Во многих случаях эта операция проходит вполне успешно, никаких повреждений сосудов и кровотечения не вызывает (а если и вызовет, той же плазмой можно остановить кровь), но для самочувствия пациента она гораздо лучше, нежели изъятие старого стента и установка нового (Endoscopy, 2005, 37, 5,434–438). Это важно, поскольку возраст пациента может быть преклонным.
Элемент Аргон — Атом Аргона
| |||||
| Общий | |||||
|---|---|---|---|---|---|
| Имя, символ, номер | аргон, Ar, 18 | ||||
| Химическая серия | благородные газы | ||||
| Группа, период, блок | 18 (VIIIA), д. 3, стр. 3, стр. | ||||
| Плотность, твердость | 1,784 кг/м 3 (273 К) , Н/Д | ||||
| Внешний вид | Бесцветный | ||||
| Атомные свойства | |||||
| Атомный вес | 39,948 а.е.м. | ||||
| Атомный радиус (расч.) | нет данных (19:00) | ||||
| Ковалентный радиус | 97 вечера | ||||
| Радиус Ван-дер-Ваальса | 188 вечера | ||||
| Электронная конфигурация | [Ne]3s 2 3p 6 | ||||
| e — на уровень энергии | 2, 8, 8 | ||||
| Степени окисления (оксид) | 0 (неизвестно) | ||||
| Кристаллическая структура | кубический гранецентрированный | ||||
| Физические свойства | |||||
| Состояние вещества | газ (немагнитный) | ||||
| Температура плавления | 83,8 К (308,7 F) | ||||
| Точка кипения | 87,3 К («302,4 F») | ||||
| Молярный объем | 22,56 10 -6 м 3 /моль | ||||
| Теплота парообразования | 6,447 кДж/моль | ||||
| Теплота плавления | 1,188 кДж/моль | ||||
| Давление паров | нет данных | ||||
| Скорость звука | 319 м/с при 293,15 К | ||||
| Разное | |||||
| Электроотрицательность | нет данных (шкала Полинга) | ||||
| Удельная теплоемкость | 520 Дж/(кг*К) | ||||
| Электропроводность | нет данных | ||||
| Теплопроводность | 0,01772 Вт/(м*К) | ||||
| 1 st потенциал ионизации | 1520,6 кДж/моль | ||||
| 2 nd потенциал ионизации | 2665,8 кДж/моль | ||||
| 3 rd потенциал ионизации | 3931 кДж/моль | ||||
| 4 -й потенциал ионизации | 5771 кДж/моль | ||||
| 5 -й потенциал ионизации | 7238 кДж/моль | ||||
| 6 -й потенциал ионизации | 8781 кДж/моль | ||||
| 7 -й потенциал ионизации | 11995 кДж/моль | ||||
| 8 -й потенциал ионизации | 13842 кДж/моль | ||||
| СИ единицы и STP используются, если не указано иное. 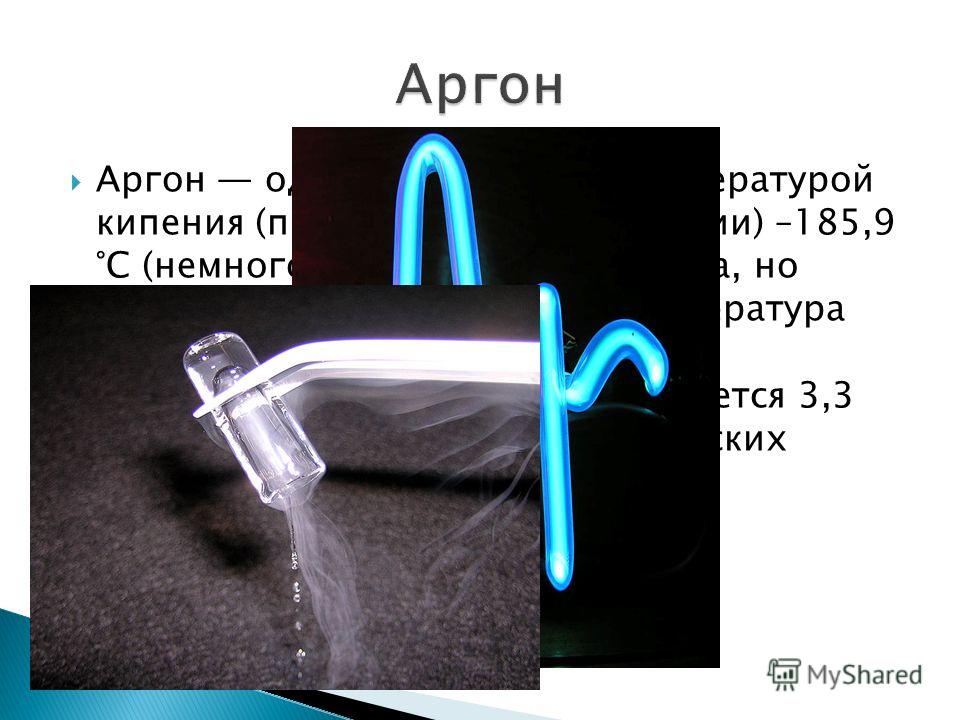 | |||||
Аргон — химический элемент
в периодической таблице, который имеет символ Ar
и атомный номер 18. Третий благородный газ в периоде 8,
аргон составляет около 1% атмосферы Земли.
Примечательные характеристики
Аргон растворим в воде в 2,5 раза лучше, чем азот, что примерно равно
растворимость в виде кислорода. Этот химически инертный элемент не имеет цвета и запаха.
как в жидком, так и в газообразном виде. Нет известных истинных
химические соединения, содержащие аргон. Создание аргона
гидрофторида (HArF) сообщили исследователи из Университета
Хельсинки в 2000 году. Сообщалось о крайне нестабильном соединении с фтором, но это еще не доказано. Несмотря на то что
химические соединения аргона в настоящее время не подтверждены, аргон
может образовывать клатраты с водой, когда ее атомы захвачены
в решетке молекул воды.
Применение
Используется в освещении, так как не реагирует на
нить накаливания в лампочке даже при высоких температурах и
другие случаи, когда двухатомный азот является непригодным (полу)инертным
газ. Другое использование;
- Используется в качестве защиты от инертного газа во многих видах сварки,
включая миг и тиг (где « I »
означает инертный). - в качестве нереакционноспособного покрытия при производстве титана
и другие реактивные элементы. - в качестве защитной атмосферы для выращивания кремния и германия
кристаллы. - Аргон-39 использовался для ряда применений,
прежде всего ледяной керн. Он также использовался для земли
водные знакомства.
Аргон также используется в техническом подводном плавании с аквалангом для надувания
сухой костюм из-за его нереактивного теплоизолирующего эффекта.
История
Подозревался Аргон (греч. argos , что означает «ленивый»)
присутствовать в воздухе Генри Кавендиша в 1785 году, но был
не обнаружен до 1894 года лордом Рэлеем и сэром Уильямом.
Рамзи.
Возникновение
Этот газ выделяют с помощью жидкостного фракционирования воздуха, поскольку
в атмосфере всего 0,94% объема аргона (1,29%
масса). Марсианская атмосфера, напротив, содержит 1,6%
Ar-40 и 5 мд Ar-36.
Изотопы
Основными изотопами аргона, встречающимися на Земле, являются Ar-40, Ar-36,
и Ар-38. Встречающийся в природе К-40 с периодом полураспада
1,250 x 10 9 лет, распадается до стабильного Ar-40 (11,2%)
захватом электронов и испусканием позитронов, а также распадом
до стабильного Ca-40 (88,8%) по негатронному излучению. Эти свойства
Эти свойства
и коэффициенты используются для определения возраста горных пород.
В атмосфере Земли Ar-39 производится космическими лучами
активность, в первую очередь с Ар-40. В подземной среде,
он также производится путем захвата нейтронов К-39 или альфа
эмиссия кальцием. Аргон-37 создается из распада
кальция-40 в результате подземных ядерных взрывов.
Период полувыведения составляет 35 дней.
Ссылка
- Лос-Аламосская национальная лаборатория
Аргон ( http://periodic.lanl.gov/elements/18.html )
Общая информация и повседневные товары
Забавно, что ученым понадобилось 1894 год, чтобы открыть самый распространенный благородный газ на Земле. Правильно, аргон (Ar) составляет немногим более одного процента нашей атмосферы. Лорд Рэлей и сэр Уильям Рамзи открыли и выделили аргон, но мы шутим о том, сколько времени это заняло. Они никогда не смогли бы сделать это раньше, потому что технологии не были доступны. Мы говорим, что сегодняшние ученые находятся на переднем крае и открывают элементы, которые будут иметь атомные номера более 120. Столетие назад методы, используемые для открытия аргона, были на переднем крае. Потому что это инертный , вы найдете аргон в лампочках, сварке и электронных лампах (хотя вы, вероятно, не знаете, что это такое).
Лорд Рэлей и сэр Уильям Рамзи открыли и выделили аргон, но мы шутим о том, сколько времени это заняло. Они никогда не смогли бы сделать это раньше, потому что технологии не были доступны. Мы говорим, что сегодняшние ученые находятся на переднем крае и открывают элементы, которые будут иметь атомные номера более 120. Столетие назад методы, используемые для открытия аргона, были на переднем крае. Потому что это инертный , вы найдете аргон в лампочках, сварке и электронных лампах (хотя вы, вероятно, не знаете, что это такое).
Когда-то изолированный аргон не был чем-то особенным. Он не имеет запаха и цвета. Он оказался последним элементом в третьем периоде на восемнадцатой позиции. Как обычно, последним элементом в ряду является благородный газ. Аргон находится в том же семействе , что и гелий (He) и неон (Ne). Долгое время ученые считали, что аргон не соединяется ни с какими другими элементами. Они были не правы. Видеть? Даже ученые не всегда получают правильный ответ!
| Сварка Если вы видите, что кто-то занимается сваркой, знайте, что иногда они используют аргон.  Аргон нереактивен, так что это хороший элемент, когда вы используете очень высокие температуры. Это делает вещи более безопасными. Аргон нереактивен, так что это хороший элемент, когда вы используете очень высокие температуры. Это делает вещи более безопасными. | |
| Выращивание кристаллов Аргон используется для выращивания кристаллов кремния. Когда ученые выращивают кристаллы кремния, это нужно делать в чистой среде. Не может быть никаких других элементов, которые могли бы сочетаться с кремнием. Аргон используется потому, что он не вступает в реакцию с кремнием. | |
| Лампочки Когда вы смотрите в лампочку, кажется, что там ничего нет. Но есть! Аргон — это газ, который ученые добавляют в лампочки, чтобы они работали лучше. | |
| Вакуумные лампы Когда вы смотрите на радио, они очень маленькие. Много лет назад радиоприемники были намного больше и имели внутри большие стеклянные трубки. 
|