Неограниченной растворимостью системы медь - никель. Диаграмма состояния медь никель
Неограниченной растворимостью системы медь - никель — Мегаобучалка
Сплав Сu–Ni относится к сплавам — твердым растворам II типа. Компоненты сплава имеют одинаковую кристаллическую решетку гранецентрированного куба и неограниченно растворимы как в жидком, так и в твердом состоянии. Взаимодействуя между собой они образуют единую кристаллическую решетку. Общий вид диаграммы состояния Сu – Ni приведен на рис. 3.6. Выпуклая линия АВ диаграммы является ликвидусом, выше которой все сплавы данной системы находятся в жидком состоянии. Вогнутая линия АВ (солидус), ниже которой сплавы с любой концентрацией представляют собой твердые растворы. Между ликвидусом и солидусом одновременно находятся две фазы: жидкий и твердый растворы.
Чтобы охарактеризовать фазовое состояние конкретного сплава при заданной температуре, необходимо определить природу фаз, находящихся в равновесии при данной температуре, их химический состав и относительное количество. Для этого используют правило отрезков, которое подробно рассмотрено выше.
| ||||||||||
| ||||||||||
Рис. 3.6. Диаграмма состояния сплава «медь—никель», образующего
твердый раствор с неограниченной растворимостью
Анализ диаграммы проводим на примере изменения фазового состояния, происходящего при снижении температуры в сплаве, содержащем 72 % Ni и 28 % Сu (рис. 3.7).
Рис. 3.7. Диаграмма состояния системы «медь – никель»
Для определения фазового состава сплава в интервале кристаллизации применяют правило отрезков.
При охлаждении сплава из жидкого состояния ниже точки 1, лежащей на линии ликвидус, начинается кристаллизация, которая заканчивается при достижении температуры точки 2 на линии солидус. В двухфазной системе число степеней свободы С1-2 = 2–2+1=1. Скорость охлаждения снижается, т.к. затвердевание сплава сопровождается тепловым эффектом. Фазовые превращения выражаются уравнением α2 . После окончания кристаллизации структура сплава состоит из зерен твердого раствора α, имеющих одинаковый состав.
Однако в процессе кристаллизации концентрация компонентов постоянно изменяется: в жидком растворе – по линии ликвидус от точки 1 до точки 2', а в растущих кристаллах твердого раствора α – по линии солидус от точки 1' до точки 2 (показано стрелками на рис. 3.7).
Поэтому микроструктура литого сплава (рис. 3.8, а) имеет ярко выраженную внутризёренную химическую неоднородность, называемую дендритной ликвацией. Это снижает коррозионную стойкость сплава. Для выравнивания химического состава, а, следовательно, повышения свойств, литой сплав подвергают деформированию с последующим отжигом. В результате микроструктура становится однородной (рис. 3.8, б).

а) б)
Рис. 3.8. Микроструктуры сплава Сu – Ni, содержащего 30% Ni
(Î135, травлено): а) – сплав литой; б) – сплав деформированный и
отожжённый
Применение сплавов твердых растворов:
1. Коррозионно-стойкие (нержавеющие) сплавы, свойства которых обеспечиваются однофазной структурой, устойчивой к электрохимическому воздействию (используются в атомных реакторах, подводных лодках, химической промышленности и т.п.).
2. Сплавы для резисторов, реостатных проволок (Сu – Ni, Ni – Мn), нагревательных элементов (Ni – Сr, Fе – Сr). Их высокое электросопротивление обеспечивается благодаря наличию в кристаллической решетке металла-растворителя чужеродных атомов растворенного металла.
План составления отчета
1. Вычертить в масштабе диаграммы состояния Pb – Sb и Cu-Ni; используя правила фаз и отрезков, описать процессы кристаллизации и построить кривые охлаждения для сплавов заданной концентрации.
2. В промежуточной точке между линиями ликвидус и солидус определить количество сплава в жидком и твердом состоянии.
3. Зарисовать и описать схемы микроструктур.
4. Построить кривую охлаждения для сплава Pb – Sb заданной преподавателем концентрации.
megaobuchalka.ru
21 Диаграммы состояния двойных систем
Системой называется совокупность фаз, находящихся в равновесии при определенных внешних условиях (температуре, давлении). Система может быть простой, если она состоит из одного элемента, и сложной, если она состоит из нескольких элементов.
Компонентаминазываются вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов – двухкомпонентную и т.д. Устойчивые химические соединения могут быть компонентами.
Диаграммы состояния (ДС), или диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним и не учитывают кинетику процессов превращений.
По диаграммам состояния можно можно определить:
число фаз, их весовое соотношение и состав фаз (содержание, концентрация компонентов в каждой фазе) в любом сплаве при любой температуре данной системы;
можно проследить за структурными превращениями и дать качественную оценку ожидаемой структуры в сплаве при комнатной температуре.
Точкой ликвидусназывается точка, отвечающая началу кристаллизации, а точкойсолидус– точка, отвечающая концу кристаллизации.
Обычно ДС строят экспериментально в координатах температура - концентрация в весовых или реже атомных процентах. Для построения ДС используют термический анализ, разработанный Курнаковым Н.С. экспериментально получают кривые охлаждения отдельных сплавов и по их перегибам или остановкам, связанным с тепловыми эффектами превращений, определяют температуры соответствующих превращений. Эти температуры называют критическими точками. Температуру металлов измеряют обычно при помощи термопары.
Диаграмма состояния сплавов, образующих в твердом состоянии механические смеси кристаллов чистых компонентов (диаграмма состояния I рода). Компоненты таких сплавов в жидком состоянии неограниченно растворимы друг в друге, а в твердом – не растворимы и не образуют химических соединений. Поэтому в этом сплаве возможно образование трех фаз: жидкого сплава и кристаллов компонентов. Механические смеси образуют сплавы свинца и сурьмы, свинца и олова, цинка и олова, алюминия и кремния и др. Рассмотрим построение диаграммы на примере сплава свинца с сурьмой. Вначале строятся кривые охлаждения чистых свинца и сурьмы (рис. 29.). Температуры их кристаллизации соответствуют горизонтальным площадкам на кривых 1 и 6 (для свинца 327°С и для сурьмы 631°С). Далее рассматриваются несколько сплавов с соответствующим содержанием свинца РЬ и сурьмы Sb, %, например: РЬ 95, Sb 5; Pb 90, Sb 10; Pb 87, Sb 13; Pb 60, Sb 40. Строятся кривые их охлаждения (кривые 2-5 соответственно).
Критические точки, полученные на кривых охлаждения, переносятся на диаграмму состояния и соединяются. получаются линии АЕВ и MEN. Линия АЕВ диаграммы является линией ликвидус: все сплавы, лежащие выше этой линии, находятся в жидком состоянии. Линия MEN является линией солидус, ниже нее все сплавы свинец – сурьма находятся в твердом состоянии. В интервале между ликвидусом и солидусом сплав состоит из двух фаз — жидкого раствора и кристаллов одного из компонентов. Сплавы, содержащие менее 13% Sb, лежащие слева от эвтектического сплава, называют доэвтектическими, а более 13% Sb, — заэвтектическими. Структура и свойства их резко отличаются. В доэвтектических сплавах наряду с эвтектикой находятся избыточные кристаллы свинца, а в заэвтектических - кристаллы сурьмы. Различие структур определяет различие свойств сплавов.
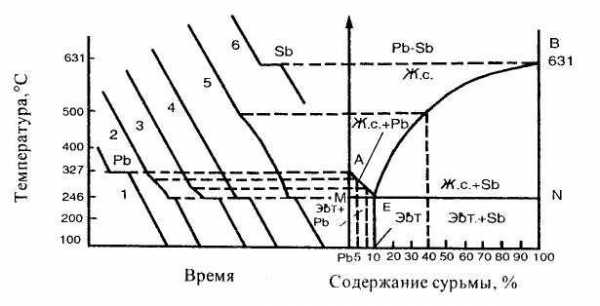
Рисунолк 29 - Дииаграмма состояния сплавов Pb – Sb
Чтобы определить состояние сплава любого состава при данной температуре и для нахождения его критических точек с помощью диаграммы, нужно из точки, указывающей содержание концентрации данного сплава, провести вертикальную линию до пересечения с линиями ликвидус и солидус (см. рис. 29). Точки пересечения показывают начало и конец кристаллизации заданного сплава. Например, требуется определить состояние сплава, содержащего 50 % сурьмы при температуре 400°С. Точка пересечения вертикали с линиями ликвидус и солидус показывают, что данный сплав будет иметь две фазы - жидкий сплав и кристаллы сурьмы, так как точка соответствующая 400°С лежит в области диаграммы BEN.
В процессе кристаллизации непрерывно изменяется концентрация фаз и количество каждой фазы (количество жидкой фазы уменьшается, а твердой увеличивается). Концентрацию (состав) и количество каждой фазы можно определить в любой точке двухфазной области диаграммы состояния, используя правило отрезков. Правило отрезков формулируется следующим образом. Через заданную точку диаграммы состояния проводится горизонтальная линия до пересечения с линиями, ограничивающими данную область диаграммы. Проекции точек пересечения на ось концентраций показывают состав фаз. Длины отрезков горизонтальной линии между заданной точкой и точками, определяющими состав фаз, обратно пропорциональны количествам этих фаз.
На рис. 30 показано применение правила отрезков для точки m диаграммы. Через нее проведена горизонтальная линия и отмечены точки пересечения с линиями диаграммы k и n. Проекции этих точек на ось концентраций k1 и nlпоказывают состав фаз. Так, для диаграммы состояния свинец - сурьма (рис.4,а) точка kl показывает состав жидкой фазы, а точка nl твердой фазы (100 % Sb). Для диаграммы состояния медь - никель (рис.4,б) точка klпоказывает состав жидкой фазы, а точка nlсостав твердого раствора.
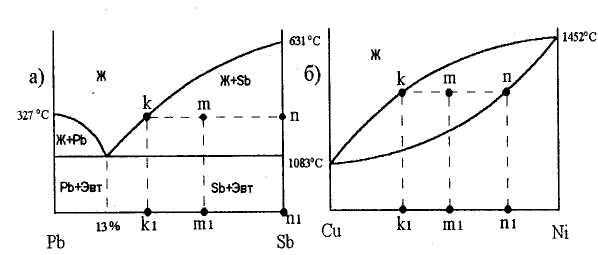
Рисунок 30 - Пример применения правила отрезков: а – для сплавов, образующих механические смеси, б – для сплавов, образующих твердые растворы
Рассмотрим теперь определение относительного количества каждой фазы. Обозначим количество жидкой фазы Qж, а количество твердой фазы — Qт. (Для примера на рис. 4,а твердой фазой является сурьма, а на рис. 4,6 — твердый раствор).
Тогда, в соответствии с правилом отрезков, количества фаз обратно пропорциональны длинам соответствующих отрезков:
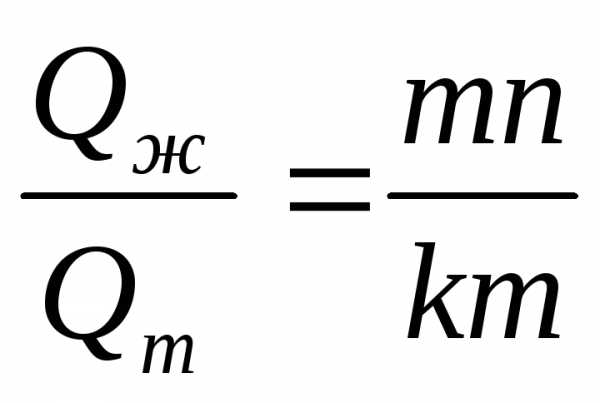
Если обозначить количество всего сплава Q, то ему будет соответствовать отрезок kn, и можно найти относительные количества фаз:
;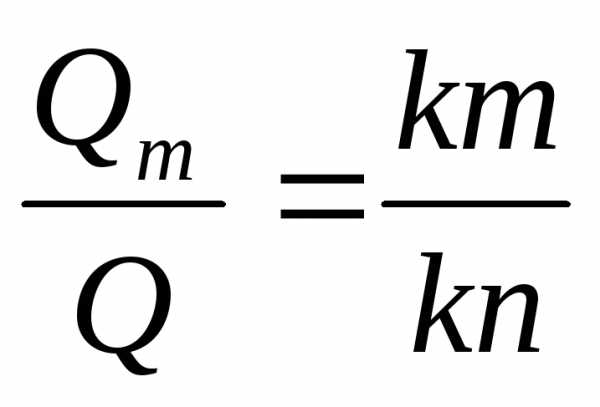
Правило отрезков может быть применено для любой двухфазной области диаграммы состояния, т.е. не только для рассмотрения кристаллизации сплава, но и для изучения процессов, происходящих в твердом состоянии. В однофазных областях диаграммы состояния правило отрезков неприменимо. Любая точка внутри однофазной области характеризует концентрацию данной фазы.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом и жидком состоянии (диаграмма состояния II рода). Эти диаграммы соответствуют сплавам, у которых компоненты и в жидком, и в твердом состоянии образуют раствор. Для таких сплавов возможно образование двух фаз: жидкого сплава и твердого раствора. К таким сплавам относят медь - никель, железо - никель, железо - хром, кобальт - хром и др. Рассмотрим диаграмму состояния сплавов медь - никель (рис. 31). Кривая 1 является кривой охлаждения чистой меди с температурой кристаллизации 1083°С, кривая 5 — кривая охлаждения никеля с температурой кристаллизации 1452°С. Кривая 2 характерна для кристаллизации сплава, содержащего 20 % никеля. Кристаллизация этого сплава начинается в точке а, при этом образуется кристаллическая решетка меди, в которой имеется 20 % никеля. В точке b кристаллизация заканчивается. Аналогично кристаллизуются сплавы с содержанием 40% (кривая 3) и 80% никеля (кривая 4), но точки начала (а1 и а2) и конца (b1 и b2) кристаллизации у первого сплава ниже, чем у второго. Все точки начала и конца кристаллизации меди, никеля и указанных выше сплавов переносятся на диаграмму (рис. 5, справа). Соединяя эти точки, получим линии ликвидус АаВ и солидус АbВ. Выше линии АаВ сплав меди с никелем находится в жидком стоянии, а ниже линии АbВ — в твердом. В зоне между линиями АаВ и АbВ имеются две фазы: жидкий сплав и кристаллы твердого раствора никеля и меди.
Диаграмма II-го рода отличается от диаграммы 1-го рода тем, что в первом случае образуется одна кристаллическая решетка, а значит, нет и эвтектического сплава как у сплавов, образующих механическую смесь. Кроме того, у сплавов медь — никель начало и конец кристаллизации сплавов с различным содержанием компонентов протекают при различных температурах.
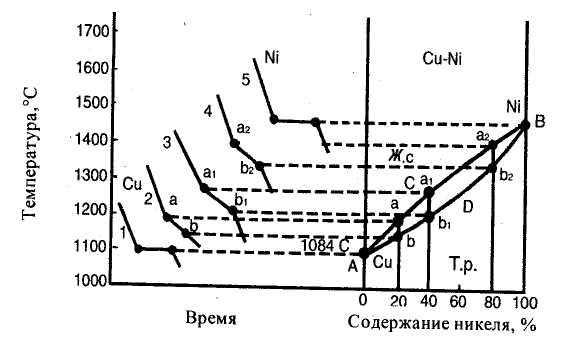
Рисунок 31-. Диаграмма состояния сплавов Cu - Ni
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии (диаграмма состояния III рода). Данная диаграмма характеризует сплавы, у которых компоненты неограниченно растворимы в жидком состоянии, ограниченно — в твердом и получающиеся твердые растворы образуют эвтектику. К таким сплавам относятся алюминий-медь, магний-алюминий, магний-цинк и др. Рассмотрим этот тип диаграммы в общем виде ( рис. 32). В сплаве могут существовать три фазы: жидкий сплав, твердый раствор α компонента В в компоненте А и твердый раствор β компонента А в компоненте В. Твердые растворы обозначены здесь строчными греческими буквами, а компоненты - заглавными латинскими буквами. Данная диаграмма содержит в себе элементы двух предыдущих. Линия АСВ является линией ликвидус, линия ADCEB - линией солидус. По линии АС начинают выделяться кристаллы твердого раствора α, по линии СВ — твердого раствора β. Левее точки D кристаллизация заканчивается образованием структуры однородного твердого раствора α, a правее точки Е - однородного твердого раствора β. Точка D характеризует предельную растворимость компонента В в компоненте А, а точка Е - предельную растворимость компонента А в компоненте В. Чаще всего с понижением температуры растворимость компонентов уменьшается. Поэтому по линиям FD и EG происходит выделение вторичных кристаллов αII и βII. Процесс выделения вторичных кристаллов из твердой фазы называется вторичной кристаллизацией. Возможен случай, когда растворимость не уменьшается с понижением температуры. Тогда вторичная кристаллизация происходить не будет, а линии DF и EG будут вертикальными.
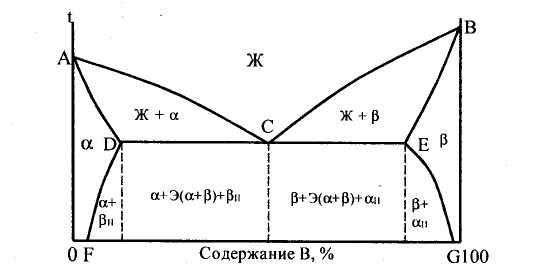
Рисунок 32 - Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
На участке DE кристаллизация заканчивается с образованием эвтектики. В данном случае эвтектика состоит не из механической смеси двух компонентов, как на диаграмме I рода, а из механической смеси твердых растворов α и β. Сплав соответствующий точке С диаграммы называется эвтектическим. Все сплавы, расположенные межу точками D и С, называются доэвтектическими, а между точками С и Е - заэвтектическими. После образования эвтектики в доэвтектическом сплаве также будет происходить вторичная кристаллизация твердого раствора βII, а в заэвтектическом - твердого раствора αII.
Диаграмма состояния сплавов, образующих химическое соединение (диаграмма состояния IV рода). Данная диаграмма характеризует сплавы, компоненты которых неограниченно растворимы в жидком состоянии, нерастворимы в твердом и образуют устойчивое химическое соединение. К таким сплавам относятся магний-медь, магний-кальций и др. Диаграмма этого типа в общем виде изображена на рис. 33. Она характеризуется наличием вертикальной линии, соответствующей соотношению компонентов в химическом соединении AmBn. Эта линия делит диаграмму на две части, которые можно рассматривать как самостоятельные диаграммы сплавов, образуемых одним из компонентов с химическим соединением. В случае устойчивого химического соединения каждый из компонентов образует с химическим соединением механическую смесь. Линия ADCEB является линией ликвидус данной диаграммы. На участке AD начинается кристаллизация компонента А, на участке DCE - химического соединения AmBn, на участке ЕВ - компонента В. Точка С диаграммы соответствует химическому соединению AmBn. Кристаллизация происходит полностью аналогично кристаллизации сплавов, образующих механические смеси из чистых компонентов. Компонент А образует с химическим соединением AmBn эвтектику Э1, состав которой соответствует точке D. Компонент В образует с химическим соединением AmBn эвтектику Э2, состав которой соответствует точке Е.
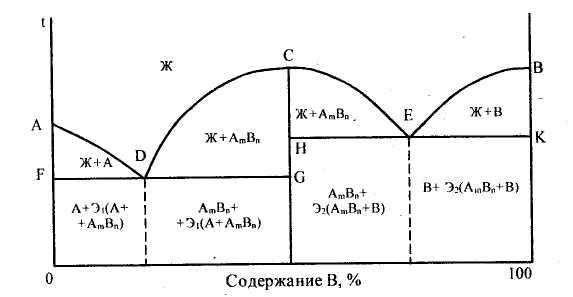
Рисунок 33 - Диаграмма состояния сплавов, образующих химическое соединение
В некоторых сплавах могут одновременно находиться все виды соединений: механическая смесь, твердый раствор и химическое соединение. Примером таких сплавов служат сталь и чугун.
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов. Большой практический интерес представляют сплавы, у которых один из компонентов или оба имеют полиморфные превращения. В этих сплавах в результате термической обработки можно получать метастабильные состояния структуры с новыми свойствами.
Диаграмма состояния сплавов с полиморфным превращением одного из компонентов представлена на рис. 34. Сплав I после полного затвердевания при температуре точки 2 в твердом состоянии в интервале температур точек 3 и 4 изменяет кристаллическую структуру. Это вызвано полиморфизмом компонента А, который до температуры точки А1 имеет тип кристаллической решетки Аα, а при температуре более высокой - Аγ. Причем кристаллическая решетка Аγ такая же, как у компонента В, в результате чего между ними образуется непрерывный ряд твердых растворов.
В сплавах, составы которых лежат между точками ха и хb, превращение γ →α при охлаждении не заканчивается и сплав остается двухфазным (γ + α). Сплавы, составы которых лежат правее точки хb, в твердом состоянии превращений не имеют, структура у них однофазная - γ–твердыйраствор.
Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением. Из анализа диаграммы, представленной на рис. 35, можно заключить, что после кристаллизации всех сплавов данной системы в определенном интервале температур образуется твердый раствор γ, который при понижении температуры ниже t3 испытывает эвтектоидное превращение
Образовавшуюся смесь двух твердых фаз принято называть эвтектоидом. В связи с переменной растворимостью компонентов в твердых растворах α и β при дальнейшем охлаждении следуют вторичные выделения твердыхрастворов βII и αII, которые показаны на структурной схеме сплавов, приведенной под диаграммой (см. рис.9).
| Рисунок 34 -Диаграмма состояния сплавов с полиморфным превращением одного из компонентов | Рисунок 35 - Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением |
studfiles.net
Никель диаграмма состояния - Справочник химика 21
Система N1—Си рассматривается во многих работах, см., например, [109—116]. Согласно данным известных справочников [117], никель-медный сплав однофазен во всем интервале составов полиморфные превращения или образование промежуточных фаз в твердом состоянии не наблюдаются, и упорядоченность мала или отсутствует. Диаграмма состояния системы приведена на рис. 32. На примере этой системы видны трудности, [c.155]Системы железо—никель и железо—хром—никель подробно рассмотрены в работе [56]. Сплавы железа с никелем образуют в основном у-твердые растворы. Никель сильно снижает критические точки, фиксирующие превращение у- в а-железо, причем точки на диаграмме состояния, соответствующие превращению а- в у-железо, с увеличением содержания никеля смещаются вверх, а точки, соответствующие превращению у- в а-железо, смещаются вниз. Превращения у —> а при охлаждении и а у при нагреве никелевых и хромоникелевых сталей происходят с большим гистерезисом. [c.158]
Только с оловом (тоже зр-ме-талл) алюминий дает на диаграмме состояния простую 25. Диаграмма состояния систе-эвтектику. Алюминии не ь, алюминий - никель взаимодействует с натрием и [c.155]
Как видно из диаграммы состояния углерода (рис. 31), алмаз является его модификацией, стабильной только при высоких давлениях. Область термодинамической стабильности алмаза отвечает температурам выше 3650 °С и давлениям больше 1000 МПа. При меньших давлениях и температурах устойчивой модификацией углерода является графит, а алмаз метастабилен. Однако переход алмаза в графит кинетически заторможен и практически не происходит в обычных условиях. Уже более 30 лет тому назад стали получать искусственные алмазы из графита. В отсутствие катализатора даже в условиях высоких температур (3000 °С и выше) и давлений (12 500 МПа) скорость превращения графита в алмаз очень мала. Поэтому синтез алмаза проводят в присутствии катализаторов (железо, никель, платиновые металлы). Алмазы образуются на поверхности раздела между графитом и расплавленным металлом — катализатором. Для извлечения алмазов охлажденную массу дробят и обрабатывают смесью кислот. В отсутствие катализатора алмазы могут быть получены при 5000 °С и давлении 2100 МПа действием ударной волны на графит. [c.183]
Используемые в технике сплавы содержат больше двух компонентов. В состав большинства марок стали входят наряду с железом и углеродом так называемые легирующие элементы — Мп, Сг, N1, 5 и др. Несколько элементов обычно входит в состав сплавов на основе меди, олова, алюминия и многих других цветных металлов. Для описания фазовых равновесий в реальных сплавах во многих случаях достаточно знания диаграмм состояния для систем, состоящих из трех основных компонентов, например, для нержавеющих сталей из железа, хрома и никеля. [c.180]
Как и ожидалось из сравнения металлохимических свойств титана и металлов группы платины, в этих системах существуют первичные твердые растворы и интерметаллические соединения. Количество соединений при переходе от рутения к родию и палладию и от осмия к иридию и платине увеличивается. В составе, структуре и свойствах этих соединений при определенном сходстве наблюдается и существенное отличие (рис. 6). Для сравнения рассмотрим также соединения, образующиеся в сплавах титана с железом, кобальтом и никелем [3, 17]. (Диаграммы состояния двойных систем титана с железом, кобальтом и никелем на рис. 6 приведены из справочника Р. П. Эллиота Структуры двойных сплавов , системы с платиной — по данным [22 ). [c.187]
Некоторые фазы из числа существующих по диаграмме состояния отсутствуют в электроосажденных сплавах, а в ряде случаев наблюдается образование фаз, устойчивых согласно диаграмме состояния лишь в области высоких температур в некоторых сплавах найдены фазы, отсутствующие на диаграмме состояния. Например, при электролитическом осаждении сплава никель — олово установлено образование интерметаллического соединения N 30, которое отсутствует на диаграмме состояния. [c.142]
Третий компонент в латуни прежде всего изменяет ее структуру. Диаграммы состояния тройных латуней изучены недостаточно, поэтому для определения ожидаемой структуры исходят из представления о так называемых коэффициентах замены цинка (коэффициенты эквивалентности). Третий элемент действует на структуру латуни так же, как и цинк, но эффект от добавки 1 % элемента иной. Приняты следующие значения коэффициентов эквивалентности для кремния 10—12, алюминия 4—б, олова 2, свинца 1, железа 0,9, марганца 0,5 и никеля минус 1,3, т. е. все добавки сужают -область, а никель расширяет. [c.218]
Разобранные диаграммы состояний представляют собой 5 простейшие случаи. Некоторые пары металлов действительно дают диаграммы одного из этих четырех типов свинец—сурьма, свинец —олово — диаграмму 1-го типа медь—никель, мо- [c.66]
Итак, рис. 34,а, б и 36,а, б пригодны для определения свойств шестикомпонентных сплавов, обогаш,енных никелем рис. 35,а, б и 37, а, б — для сплавов, обогаш,енных титаном. Так как они составлены на основе диаграмм плавкости различных тройных систем, то могут служить для взаимной проверки. Поэтому все приведенные ниже температуры плавления четырех сплавов были рассчитаны на основе каждой пары диаграмм в отдельности после, этого была взята средняя арифметическая из полученных данных. При этом только для сплавов, обогащенных никелем, имелись некоторые данные о диаграммах состояния использованных тройных систем. [c.72]
Данные термодинамических исследований позволяют построить диаграмму состояния системы никель — вода в координатах потенциал — pH (рис. 5.4) [9]. Никель мало благороден и термодинамически нестоек при соприкосновении с водой в области ниже прямой водородного электрода и выше семейства кривых I. Выше прямой водородного электрода примерно до pH 6 (левая часть) образуются ионы никеля, при более высоких pH — гидроокись никеля в соответствии с уравнением II), или в результате гидролиза [c.346]
На рис. 38 приведен разрез диаграммы состояния Ре—Сг—N1—С при содержании 18% хрома и 8% никеля. Как видно из рисунка, сталь, содержащая С > 0,04%, испытывает при нагревании и охлаждении полиморфные превращения (а у). В равновесном состоянии при атмосферной температуре эта сталь представляет смесь [c.86]
Следующим объектом исследования был выбран сплав цинк-никель. Диаграмма состояния системы цинк-никель [61] представлена на фиг. 38. Как следует из этой диаграммы, небольшие присадки никеля к цинку должны вызвать образование в сплаве интерметаллического соединения NI2Zrii5. Поскольку растворимость никеля в цинке очень мала (интерметаллического соединения. Перенапряжение водорода на никеле не очень велико, поэтому можно ориентировочно предположить, что и на интерметаллическом соединении NI2Zni5 значение перенапряжения водорода также будет Дтоми.%гп невелико. Если это так, то тог Г 1 коррозия цинка с присадкои никеля должна развиваться относительно энергично. [c.41]
Как следует из диаграммы состояния системы Си—N1—8 (рис. 141), при застывании, например, сплава, содержащего 95% N1, 4% Си и 1% 8, вначале будут выпадать кристаллы твердого раствора никеля с медью (и другими металлическими примесями), затем начнется образование кристаллов двойной эвтектики из твердого раствора и су 1ьфида никеля и, наконец, тройной эвтектики из кристаллов твердого раствора, Сиг8 и N1382. [c.303]
При введении в систему Ре—С небольших добавок других металлов (легирование) общий вид диаграммы состояния сохраняется. Однако эти добавки способствуют стабилизации одних структурных составляющих и разрушению других. Так, легирование ванадием, хромом, вольфрамом стабилизирует структуру аустенита, что придает стали повышенную твердость и износоустойчиЕость. В то же время случайные включения цементита при этом подвергаются распаду за счет образования более прочных карбидов указанных легирующих металлов. Легирование белых чугунов переходными металлами с сильно дефектной -оболочкой (Т], V, Сг) приводит к разрушению цементита и образованию прослоек чешуйчатого графита между кристаллами сплава. Следствием этого является повышение ударной прочности. Добавки хрома и никеля, расширяющие область аустенита и стабилизирующие ее структуру, обеспечивают повышенную коррозионную стойкость сталей (нержавеющие стали), поскольку в гомогенных системах процессы коррозионного разрушения протекают медленнее. [c.415]
Металлохимия. Ни с одним металлом Периодической системы алюминий не дает непрерывных твердых растворов. Алюминий является плохим растворителем для других металлов, хотя сам хорошо растворяется в них, особенно в переходных. Для алюминия исключительно характерно образование большого числа металлидов с литием, щелочно-земельными и со всеми переходными металлами. Как видно из диаграммы состояния А1—Ni (рис. 140), алюминий с никелем образует широкую область твердых ( -растворов, тогда как со стор Оны алюминия отсутствует область твердых растворов. Кроме того, эквиатомный металлид АШ плавится при значительно более высокой температуре, чем ту] оплавкий компонент — никель, тем более алюминий. Это соединение является истинным металлидом, ибо на его основе существует широкая область однородности. Наконец, алюминий с никелем образуют ряд инконгруэнтно плавящихся металлидов. [c.337]
В нее вошла большая часть первого издания, посвященная водородным ДСК-анодам, а также добавлена новая глава (гл. VIH), в которой впервые описаны успешно нами проведенные работы над конструкцией и технологией изготовления кислородных ДСК-катодов с катализатором преимущественно из серебра Ренея и опорным скелетом из карбонильного никеля. Указаны специфические трудности, такие как выбор методов размола, активации и неотравляющегося катализатора, а также осложнения при подборе опорного скелета, которые, учитывая диаграмму состояния системы серебро — алюминий, удается преодолеть методом горячего прессования. Совместные испытания этих кислородных (воздушных) катодов и водородных анодов в водородно-кислородных ячейках дополнили ранее полученные результаты испытаний водородных анодов. Для более полного изложения материала во вводной главе (гл. I) новой монографии приводится подробная классификация всех видов топливных элементов. Глава II содержит краткое описание нашей ДСК-системы для тех читателей, которые не пожелают читать более подробное детальное изложение. В главе IX собраны подлинные доклады важнейших исследовательских групп, работающих в настоящее время в области топливных элементов. [c.9]
В свою очередь причина этого, вероятно, заключается в наличии в спрессованном электроде тонкораспределенного алюминия из сплава Ренея (см. табл. 4.3) и также тонкораспределенного порошка карбонильного никеля. Перед достижением установленной для электродов всех трех групп температуры спекания (700° С), согласно диаграмме состояния, появляется жидкая фаза алюминия. Хорошо подвижный жидкий алюминий диффундирует в окружающий порошок карбонильного никеля, причем благодаря его большой реакционной активности при взаимодействии с никелем имеет место значительный тепловой эффект [32]. Выделение тепла ввиду его медленного отвода приводит к повышению температуры и увеличению вследствие этого скорости реакции. В течение нескольких секунд электрод может нагреться более чем до 1000 " С, благодаря чему имеющиеся в сплаве твердые растворы частично переходят в интерметаллическое соединение Ы1А1. Относительно этого соединения известно, что из него нельзя растворить алюминий. [c.176]
В отличие от электродов с серебряным скелетом в таких же электродах с никелевым скелетом при спекании с появлением жидкой фазы (серебра Ренея) происходит значительно более энергичное химическое взаимодействие, протекающее иногда настолько бурно, что электроды вследствие сильного разогрева изгибаются. Алюминий из таких электродов практически не растворяется даже кипящим концентрированным раствором КОН. Несомненно, реакция между жидким сере- бряным сплавом Ренея и карбонильным никелем приводит к образованию сплава N1—А1—А , который очень похож иа интерметаллическое соединение N1—А1. Сплав не травится, как и интерметаллическое соединение N1—А1, кипящей концентрированной КОН. Бинарная система N1—А1 при содержании 50 ат.% N1 имеет максимум температуры плавления на диаграмме состояния и максимальную теплоту образования, т. е. этот состав соответствует минимуму энергии системы [21]. [c.342]
Ершова Т. ПКаменецкая Д. С, Т — Р-диаграммы состояния двойных систем металл (марганец, кобальт, никель) — углерод // Диаграммы сосгояния в л егалловедени .— Киев ИПМ ЛИ У(ХР, 1980,— С. 34—35. [c.172]
Подробное описание механических свойств металлического рения приводится в статье М. А. Тылкиной и Е. М. Савицкого [28]. Рений образует сплавы и соединения со многими элементами. Некоторые сплавы рения имеют практическое значение и потому изучены особенно подробно — например, сплавы с вольфрамом, молибденом, никелем, хромом, кобальтом, платиной [29—31]. Получены диаграммы состояния рения со многим металлами, дающие представление о характере взаимодействия рения с этими элементами например, установлена полная несмешиваемость рения с медью, серебром и золотом ни в жидком, ни в твердом состоянии, образование непрерывного ряда твердых растворов с кобальтом и осмием, наличие ограниченной рас- [c.27]
Н. Д. Томашов [123] объясняет влияние концентрации никеля на стойкость сталей к коррозионному растрескиванию изменением фазового состава сплавов. Стали, содержащие ферритную структуру, а с высоким содержанием никеля — чисто аустецитную. Основной причиной (возмол но не единственной) хлоридно-го коррозионного растрескивания нержавеющих сталей, содержащих от 1 до 40 % N1, является принципиальная возможность образования двухфаз-ности (аН- ) в структуре стали. Как следует из анализа диаграммы состояния системы Ре—Сг—N1, в хромоникелевых сталях и при довольно высоком (35—40 %) содержании N1 (особенно в условиях деформации или напряженного состояния) возможно присутствие выделений феррита. [c.114]
Диаграммы состояния Аи—Н , Ag—Нд, Р1—Нд и Зп—Нд имеют характерные переходные точки, соответствующие разложению химических соединений, образующихся прн амальгамировании в различных температурных условиях. С этими соединениями ртуть образует ряд металлических соединений Стали, легированные углеродом, кремнием, хромом, никелем, молибденом и ниобнем, не амальгамируются. [c.147]
Указанные свойства ферритов никеля и цинка приводят, с одной стороны, к невозможности построения диаграммы состояния, а с другой, — к трудностям получения ферритов заданного состава вследствие з летучивания цинка и потери кислорода при спекании. [c.79]
Система никель—цинк. Система N1—2п исследована Раубом и Эльсером [52]. Гальванические сплавы N1—2п осаждались из сернокислых электролитов. По диаграмме состояния в сплавах М1 —2п имеются три промежуточные фазы Р-фаза с кубической объемно-центрированной решеткой, которая нри низких температурах превращается в тетрагональную Р -фазу, уфаза с большими кубическими ячейками и гексагональная б-фаза. [c.17]
Ртуть часто применяют в качестве вспомогательного вещества при изучении металлических систем. Например, с ее помощью были уточнены диаграммы состояния бинарных сплавов никель — цинк, никель — олово, железо — марганец, хром — цинк и др. Она применяется в качестве растворителя для получения полупроводниковых материалов, в частности, для выращивания при низких температурах из насыщенных ртутных растворов а-олова монокристаллов серого олова Пластинки, изготовленные из серого олова, обладают большой чувствительностью к инфракрасному излучению и позволяют обнаруншвать электромагнитные волны длиною до 15 мкм. [c.8]
Лучшей растворимостью в ртути обладают индий (57,5 вес. %), таллий (44,2 вес. %), кадмий (5,9 вес. %), цезий (4,4 вес. %), цинк (1,99 вес. %), рубидий (1,37 вес. %), галлий (1,9 вес. %) и стронций (1,12 вес. %). Растворимость других металлов не превышает долей %, а такие металлы, как железо, кобальт, никель, металлы платиновой группы в ртутн практически не растворяются. С повышением температуры растворимость металлов в ртути возрастает на диаграммах состояния двойных металлических растворов ртуть — металл можно видеть большое число интерметаллических соединений, промежуточных фаз и различных превращений . [c.24]
Установлено, что по структуре и фазовому составу электроосажденных сплавов железо—никель—хромовые сплавы, полученные из сульфамидного электролита, отличаются от нержавеющих сталей. Электроосажденные сплавы имеют мелкодисперсное строение и представляют собой преимущественно а-фа-зу. Термообработка при температуре 800—850° С в защитной атмосфере вызывает укрупнение зерен и изменение фазового состава сплава в соответствии с диаграммой состояния системы железо—никель—хром. Табл. 1, рис. 4, библ. 8. [c.124]
chem21.info
ДИАГРАММА СОСТОЯНИЯ МЕТАЛЛОВ И СПЛАВОВ
Студент должен
Знать:
· Классификацию сплавов и основные определения;
· Диаграммы состояния сплавов;
· Понятия о ликвации;
· Диаграмму состояния железо-цементит;
· Критические точки диаграммы железо-цементит;
· Классификацию железоуглеродистых сталей и сплавов;
Уметь:
· Находить критические точки диаграммы
Физические свойства. К физическим свойствам металлов относят цвет, плотность, температуру плавления, теплопроводность, тепловое расширение, теплоемкость, электропроводность, магнитные свойства и др.
Цветом называют способность металлов отражать световое излучение с определенной длиной волны. Например, медь имеет розово-красный цвет, алюминий - серебристо-белый.
Плотность металла характеризуется его массой, заключенной в единице объема. По плотности все металлы делят на легкие (менее 4500 кг/м3) и тяжелые. Плотность имеет большое значение при создании различных изделий. Например, в самолето- и ракетостроении стремятся использовать более легкие металлы и сплавы (алюминиевые, магниевые, титановые), что способствует снижению массы изделий.
Температурой плавления называют температуру, при которой металл переходит из твердого состояния в жидкое. По температуре плавления различают тугоплавкие металлы (вольфрам 3416°С, тантал 2950°С. титан 1725°С, и др.) и легкоплавкие (олово 232°С, свинец 327°С, цинк 419,5°С, алюминий 660°С). Температура плавления имеет большое значение при выборе металлов для изготовления литых изделий, сварных и паяных соединений, термоэлектрических приборов и других изделий. В единицах СИ температуру плавления выражают в градусах Кельвина (К).
Теплопроводностью называют способность металлов передавать тепло от более нагретых к менее нагретым участкам тела. Серебро, медь, алюминий обладают большой теплопроводностью. Железо имеет теплопроводность примерно в три раза меньше, чем алюминий, и в пять раз меньше, чем медь. Теплопроводность имеет большое значение при выборе материала для деталей. Например, если металл плохо .проводит тепло, то при нагреве и быстром охлаждении (термическая обработка, сварка) в нем образуются трещины. Некоторые детали машин (поршни двигателей, лопатки турбин) должны быть изготовлены из материалов с хорошей теплопроводностью. В единицах СИ теплопроводность имеет размерность Вт/ (м·К).
Тепловым расширением называют способность металлов увеличиваться в размерах при нагревании и уменьшаться при охлаждении. Тепловые расширения должны учитываться при сварке, ковке и горячей объемной штамповке, изготовлении литейных форм, штампов, прокатных валков, калибров, выполнении точных соединений и сборке приборов, при строительстве мостовых ферм, укладке железнодорожных рельс. Теплоемкостью называют способность металла при нагревании поглощать определенное количество тепла. В единицах СИ имеет размерность Дж/К. Теплоемкость различных металлов сравнивают по величине удельной теплоемкости - количеству тепла, выраженному в больших калориях, которое требуется для повышения температуры 1 кг металла на 1°С (в единицах СИ - Дж/(кг-К).
Способность металлов проводить электрический ток оценивают двумя взаимно противоположными характеристиками - электропроводностью и электросопротивлением. Электрическая проводимость оценивается в системе СИ в сименсах (См), а удельная электропроводность — в См/м, аналогично электросопротивление выражают в омах (Ом), а удельное электросопротивление - в Ом/м. Хорошая электропроводность необходима, например, для токонесущих проводов (медь, алюминий). При изготовлении электронагревателей приборов и печей необходимы сплавы с высоким электросопротивлением (нихром, константан, манганин). С повышением температуры металла его электропроводность уменьшается, а с понижением - увеличивается.
Магнитные свойства характеризуются абсолютной магнитной проницаемостью или магнитной постоянной, т. е. способностью металлов намагничиваться. В единицах СИ магнитная постоянная имеет размерность Гн/м. Высокими магнитными свойствами обладают железо, никель, кобальт и их сплавы, называемые ферромагнитными. Материалы с магнитными свойствами применяют в электротехнической аппаратуре и для изготовления магнитов.
Химические свойства. Химические свойства характеризуют способность металлов и сплавов сопротивляться окислению или вступать в соединение с различными веществами: кислородом воздуха, растворами кислот, щелочей и др. Чем легче металл вступает в соединение с другими элементами, тем быстрее он разрушается. Химическое разрушение металлов под действием на их поверхность внешней агрессивной среды называют коррозией.
Металлы, стойкие к окислению при сильном нагреве, называют жаростойкими или окалино-стойкими. Такие металлы применяют для изготовления деталей, которые эксплуатируются в зоне высоких температур.
Сопротивление металлов коррозии, окалино-образованию и растворению определяют по изменению массы испытуемых образцов на единицу поверхности за единицу времени.
Химические свойства металлов обязательно учитываются при изготовлении тех или иных изделий. Особенно это относится к изделиям или деталям, работающим в химически агрессивных средах.
Ликвация - неоднородность химического состава сплавов, возникающая при их кристаллизации, обусловлена тем, что сплавы в отличие от чистых металлов кристаллизуются не при одной температуре, а в интервале температур. Чем шире температурный интервал кристаллизации сплава, тем сильнее развивается ликвация, причем наибольшую склонность к ней проявляют те компоненты сплава, которые наиболее сильно влияют на ширину температурного интервала кристаллизации (для стали, например, сера, кислород, фосфор, углерод).
Механические свойства Способность металла сопротивляться воздействию внешних сил характеризуется механическими свойствами. Поэтому при выборе материала для изготовления деталей машин необходимо прежде всего учитывать его механические свойства: прочность, упругость, пластичность, ударную вязкость, твердость и выносливость. Эти свойства определяют по результатам механических испытаний, при которых металлы подвергают воздействию внешних сил (нагрузок). Внешние силы могут быть статическими, динамическими или циклическими (повторно-неременными). Нагрузка вызывает в твердом теле напряжение и деформацию.
Напряжение — величина нагрузки, отнесенная к единице площади поперечного сечения испытуемого образца.
Деформация - изменение формы и размеров твердого тела под влиянием приложенных внешних сил.
Различают деформации растяжения (сжатия), изгиба, кручения, среза (рис. 1.15). В действительности материал может подвергаться одному или нескольким видам деформации одновременно.
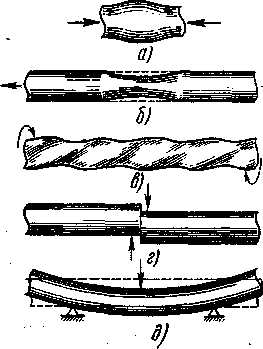
Рис. 1.15 . Виды деформаций:
а - сжатие, б - растяжение, в - кручение, г – срез, д - изгиб
Прочность - способность материала сопротивляться разрушению под действием нагрузок оценивается пределом прочности и пределом текучести. Важным показателем прочности материала является также удельная прочность - отношение предела прочности материала к его плотности.
Упругость- способность материала восстанавливать первоначальную форму и размеры после прекращения действия нагрузки.
Пластичность, т. е. способность материала принимать новую форму и размеры под действием внешних сил не разрушаясь, характеризуется относительным удлинением и относительным сужением.
Относительное удлинение (после разрыва) δ — это отношение приращения (lк—lо) расчетной длины образца после разрыва к его первоначальной расчетной длине 1о, выраженное в процентах: δ=[(1к—1о)/l0] 100%.
Относительное сужение (после разрыва) φ — это отношение разности начальной и минимальной площадей (F0—Fк) поперечного сечения образца после разрыва к начальной площади Fo поперечного сечения, выраженное в процентах: φ =[(Fо— Fк)/Fo] 100%.
Чем больше значения относительного удлинения и сужения для материала, тем он более пластичен. У хрупких материалов эти значения близки к нулю.- Хрупкость конструкционного материала является отрицательным свойством.
Ударная вязкость, т. е. способность материала сопротивляться динамическим нагрузкам
Определение ударной вязкости особенно важно для некоторых металлов, работающих при минусовых температурах и проявляющих склонность к хладноломкости. Чем ниже порог хладноломкости, т. е. температура, при которой вязкое разрушение материала переходит в хрупкое и больше запас вязкости материала, тем больше ударная вязкость материала.Хладноломкость - снижение ударной вязкости при низких температурах.
Циклическая вязкость — это способность материалов поглощать энергию при повторно-переменных нагрузках. Материалы с высокой циклической вязкостью быстро гасят вибрации, которые часто являются причиной преждевременного разрушения. Например, чугун, имеющий высокую циклическую вязкость, в некоторых случаях (для станин и других корпусных деталей) является более ценным материалом, чем углеродистая сталь.
Усталостью называют процесс постепенного накопления повреждений материала под действием повторно-переменных напряжений, приводящий к образованию трещин и разрушению. Усталость металла обусловлена концентрацией напряжений в отдельных его объемах, в которых имеются неметаллические включения, газовые пузыри, различные местные дефекты и т. д.
Выносливость - свойство материала противостоять усталости. Предел выносливости — это максимальное напряжение, которое может выдержать металл без разрушения заданное число циклов нагружения.
Основные сведения о сплавах. Чистые металлы характеризуются низким пределом прочности, поэтому в машиностроении применяют главным образом их сплавы. Металлическим сплавом называют сложное вещество, полученное сплавлением (или спеканием) нескольких металлов или металлов с неметаллами. Например, мягкая медь с добавлением олова превращается в более твердую бронзу. При этом улучшаются эксплуатационные и технологические свойства металлического материала.
Для изучения процессов, происходящих в сплавах при их превращениях, а также для описания строения сплавов в металловедении используют понятия: компонент, фаза, система. Компонентами называют вещества, образующие систему. Чистый металл представляет собой однокомпонентную систему, сплав двух металлов - двухкомпонентную систему и т. д. Компонентами могут быть металлы и неметаллы, а также устойчивые, т. е. не диссоциирующие на составные части в рассматриваемых интервалах температур вещества - химические соединения. Так, для цветных металлических сплавов компонентами могут быть металлы (например, медь с цинком образует латунь), а для железоуглеродистых - металлы с небольшим содержанием неметаллов (железо с углеродом - чугун, сталь).
Фазой называют однородную часть системы, имеющую одинаковый состав одно и то же агрегатное состояние и отделенную от остальных частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно. Совокупность фаз, находящихся в равновесии при определенных внешних условиях (давлении, температуре), называют системой. Например, однородная жидкость (расплавленный металл) является однофазной системой, при кристаллизации чистого металла система состоит из двух фаз: жидкой (расплавленный металл) и твердой (зерна закристаллизовавшегося металла). Другой пример: механическая смесь двух видов кристаллов образует двухфазную систему, так как •каждый кристалл отличен от другого по составу или строению и отделен один от другого поверхностью раздела. Сплав называют однородным (гомогенным), если его структура однофазна, и разнородным (гетерогенным), если его структура состоит из нескольких фаз. Под структурой сплава понимают видимое в микроскоп взаимное расположение фаз, их форму и размеры. Компоненты в сплавах могут составлять (рис. 1.16) жидкие и твердые растворы, химические соединения и механические смеси.
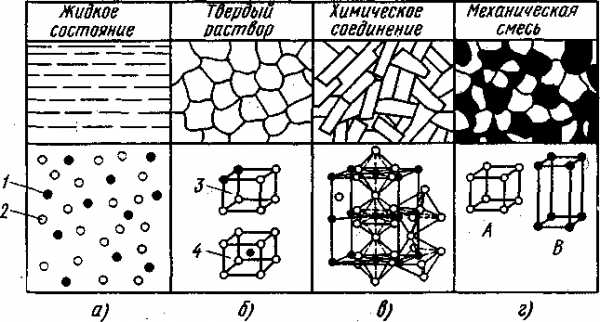
Рис. 1.16. Структура и строение элементарной ячейки различных сплавов из двух металлов А и В:
1 -атомы металла А, 2 - атомы металла В, 3 - твердый раствор замещения. 4 — твердый раствор внедрения
Однородные жидкие растворы, (рис. 1.16,а) характерны почти для всех металлов, растворяющихся друг в друге в жидком состоянии в любых соотношениях. В однородном жидком растворе атомы растворимого металла (компонента) А равномерно распределены среди атомов 2 металла В — растворителя. Лишь немногие металлы растворяются в жидком состоянии ограниченно. И только очень немногие металлы из-за большой разницы в размерах своих атомов не растворяются друг в друге в жидком состоянии. В процессе кристаллизации и затвердевания сплавов взаимодействие компонентов может быть различным.
Твердые растворы образуются в результате перехода в твердое состояние однородных жидких растворов. В твердом растворе одно из веществ, входящих в состав сплава, сохраняет присущую ему кристаллическую решетку, а другое в виде отдельных атомов распределяется в кристаллической решетке первого вещества. Твердые растворы бывают двух типов: твердые растворы замещения и твердые растворы внедрения. Независимо от типа твердые растворы однофазны.
В твердых растворах замещения часть атомов в кристаллической решетке одного из компонентов замещена атомами другого (рис. 1.16 6). Твердые растворы замещения образуются, например, в сплавах железа с хромом, никелем и с другими элементами. Твердые растворы замещения называют неупорядоченными твердыми растворами, поскольку атомы растворимого элемента могут замещать атомы растворителя в любых узлах решетки.
В твердых растворах внедрения атомы растворенного компонента внедряются в межатомное пространство кристаллической решетки другого компонента-растворителя (см. рис. 1.16 6). Твердые растворы внедрения образуются, например, в сплавах железа с водородом, азотом, бором.
Химические соединения (рис. 1.16 в) образуются при сплавлении различных металлов или металла с неметаллом. Соотношение чисел атомов элементов химического соединения может быть выражено формулой вида АnВm. Химическое соединение - однородное кристаллическое тело, имеет кристаллическую решетку с упорядоченным расположением атомов, которая отлична от решеток элементов, образующих это соединение. Химические соединения, как и чистые металлы, имеют постоянную температуру плавления и, как правило, обладают большой твердостью и значительной хрупкостью.
Механическая смесь (рис. 1.16 г) двух компонентов А и В образуется тогда, когда при кристаллизации компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения. Механическая смесь может состоять из зерен двух насыщенных твердых растворов или из зерен твердого раствора и химического соединения. В этом случае сплав состоит из кристаллов А и В, которые, если они достаточно крупны, отчетливо выявляются на микроструктуре. Рентгенограмма сплава отчетливо показывает наличие двух решеток компонентов А и В.
Температуры, при которых изменяется строение металлов и сплавов, называют критическими точками. При плавлении и затвердевании чистые металлы имеют одну критическую точку, а сплавы — две. В интервале между этими двумя точками в сплавах существуют две фазы — жидкий сплав и кристаллы.
Диаграммы состояния представляют собой графическое изображение фазового состояния сплавов в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия, т. е. такого состояния сплава, которое достигается при очень малых скоростях охлаждения или длительном нагреве. Диаграммы состояния сплавов в равновесном состоянии являются теоретическими диаграммами, так как истинное равновесие в практических условиях достигается редко. В большинстве случаев сплавы находятся в метастабильном состоянии, т. е. в состоянии с ограниченной устойчивостью.
Диаграмма состояния сплавов для случая неограниченной растворимости компонентов в твердом состоянии. Рассмотрим диаграмму состояния сплавов системы медь — никель (рис. 1.16). Медь и никель, соединяясь в любых пропорциях, образуют непрерывный ряд твердых растворов, так как атомы никеля способны заместить в кристаллической решетке все атомы меди. Температура плавления меди составляет 1083°С, никеля 1445°С.
Рассмотрим кривые охлаждения (рис. 1.17, а) сплавов системы медь— никель для пяти составов следующей концентрации, %: 100Cu, 80Cu + 20Ni, 60Cu+40Ni, 20Cu + 80Ni, 100Ni.
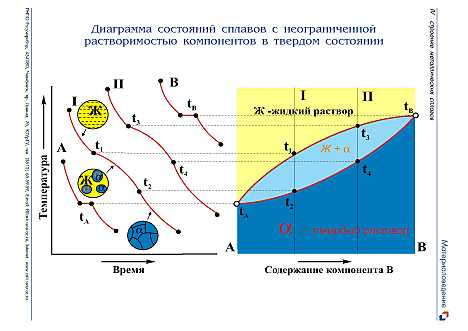
Рис. 1.17. Диаграмма состояния сплавов медь никель
Чистые металлы (кривые 1 и 5) имеют одну критическую точку - температуру затвердевания (кристаллизации), а сплавы (кривые 2, 3, 4) - две, т. е. сплавы в отличие от чистых металлов кристаллизуются в интервале температур. Например, кристаллизация сплава 3 начинается при температуре t1 (точка a1), при этой температуре из жидкого сплава начинают выпадать первые кристаллы твердого α-раствора, а заканчивается кристаллизация при темепратуре t3 (точка b1). При этой температуре затвердевает последняя капля жидкого сплава. Разная температура конца кристаллизации сплавов свидетельствует о том, что состав твердой фазы непрерывно изменяется.
Для построения диаграммы состояния (рис. 1.17) на оси абсцисс сетки в координатах температура - концентрация откладывают (отмечают точками) составы пяти сплавов и восстанавливают из каждой точки вертикальные линии. После этого переносят на эти вертикальные линии с кривых охлаждения сплавов критические точки, а на левой и правой ординатах температур отмечают температуры кристаллизации чистых металлов — меди (100%) и никеля (100%). Соединив плавными, кривыми температуры начала и конца кристаллизации всех сплавов, получают диаграмму состояния сплавов системы медь-никель с неограниченной растворимостью компонентов в твердом состоянии. Сплавы меди и никеля кристаллизуются и затвердевают в некотором температурном интервале. В пределах этого температурного интервала одновременно существуют две фазы: жидкий сплав и кристаллы твердого раствора меди и никеля. На диаграмме этот интервал ограничен двумя линиями, соединяющими (точки плавления чистых меди и никеля. Верхняя линия обозначает начало затвердевания при охлаждении или конец расплавления при нагреве, нижняя соответственно конец затвердевания или начало плавления. Рассмотренная диаграмма состояния сплава меди и никеля имеет три области. Область существования жидкого расплава лежит выше верхней линии, соединяющей точки плавления меди и никеля, а область существования кристаллических твердых растворов — ниже нижней линии. Между этими линиями находится двухфазная область, в которой одновременно существуют расплав и кристаллы твердого раствора. Верхнюю границу этой области называют линией ликвидус, а нижнюю - солидус («ликвидус» в переводе с латинского означает жидкий, «солидус» - твердый).
По этой же диаграмме состояния можно определить концентрации твердой и жидкой фаз в сплаве при его кристаллизации. Например, для сплава 3 при температуре t2 концентрация фаз определяется горизонтальной линией mn1 проведенной до пересечения с линиями солидус и ликвидус. Точка n1 показывает концентрацию твердой фазы, а точка m - концентрацию жидкой фазы. При температуре t3 концентрация твердой фазы определяется точкой b1 на диаграмме состояния, а концентрация жидкой фазы - точкой m1.
В процессе кристаллизации непрерывно изменяется состав фаз: жидкой по линии ликвидус и твердой по линии солидус. Кристаллы твердого раствора, выпадающие из жидкого при разной температуре, имеют переменный состав. Выросшие в первый момент кристаллизации, оси кристаллов обычно обогащаются тугоплавким компонентом (никелем), а междуосные пространства заполняются позже к обогащаются более легкоплавкие компонентом (медью). Такую неоднородность отдельных кристаллов какого-либо сплава называют внутрикристаллической, или дендритной ликвацией. Дендритная ликвация тем больше, чем больше расстояние между линиями ликвидус и солидус.
Обычно это явление нежелательно и дендритную ликвацию предотвращают последующим длительным нагревом для выравнивания состава сплава, вследствие происходящего в нем диффузионного процесса.
К твердым растворам относят также сплавы систем Сu-Аu, Ag-Аu, Ni-Аu, Fe-Сг, Fe-V, Bi-Sb и др., кристаллизующиеся по рассмотренному типу диаграммы состояния, когда оба компонента неограниченно растворимы в жидком и твердом состояниях и не образуют химических соединений.
Диаграмма состояния сплавов образующих механические смеси из чистых компонентов. Рассмотрим например, диаграмму состояния сплавов системы висмут - кадмий (рис. 1.18). Область существования жидкого расплава ограничена сверху ломаной линией, соединяющей точки плавления висмута и кадмия через точку Е. В точке Е сплав (40% висмута и 60% кадмия) имеет одинаковые температуры ликвидуса и солидуса. Все остальные сплавы системы затвердевают и плавятся в пределах температурного интервала, который снизу ограничен горизонтальной линией солидуса.
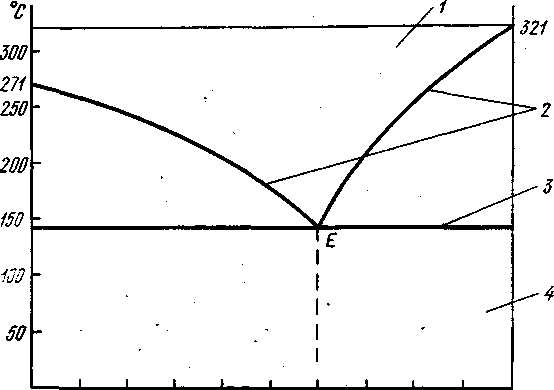
| Кристаллы висмута | Кристаллы висмута и втектика | Эвтекти ка | Кристаллы Кадмия и эвтектика | Кристал- лы кадмия |
Рис. 1.18. Диаграмма состояния сплавов висмут-кадмий:
1 -жидкий сплавы, 2- линия ликвидуса, 3 -линия солидуса, 4 - механическая смесь кристаллов висмута и кадмия; Е - эвтектика
Сплав в точке Е имеет очень мелкие кристаллы висмута и кадмия, находящиеся в определенном взаимном расположении. Этот сплав называется эвтектикой («эвтектика» в переводе с греческого означает легкоплавкая).Эвтектикой называют механическую смесь двух (или более) видов кристаллов, одновременно кристаллизующихся из жидкого сплава. Твердые сплавы, лежащие левее эвтектической точки Е, и сплавы, содержащие до 40% висмута, называют доэвтектическими, а лежащие правее точки Е и содержащие более 40% висмута — заэвтектическими. Доэвтектические сплавы состоят из смеси кристаллов висмута и эвтектики (кристаллы висмута + кристаллы кадмия) заэвтектические — из смеси кристаллов кадмия с эвтектикой. По этому типу диаграммы состояния кристаллизуются также сплавы системы Zn—Sn, Pb—Ag, Ni—Cr, Cr—Mn, Cu—Bi, Al- Si
Диаграмма состояния сплавов для случая ограниченной растворимости компонентов в твердом состоянии.
Одна из таких диаграмм показана на рис. 1.19, а. Система содержит три фазы жидкий раствор, твердый раствор компонента в компоненте А (назовем его α) и твердый раствор компонента А в компоненте В (назовем его β). Линия диаграммы АCВ — линия ликвидуса, линия KECDN - линия солидуса.
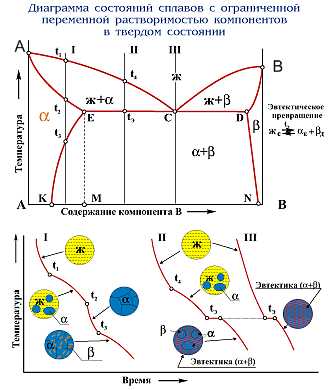
Рис. 1.19
Диаграмма состояния сплавом для случая ограниченной растворимости компонентов в твердом состоянии
Кристаллы α выделяются из жидкого сплава по линии ликвидуса КС, а кристаллы β - по линии CD. Затвердевание сплавов происходит по линии солидуса КЕ с образованием кристаллов α и по линии DF - с образованием кристаллов β. Одновременная кристаллизация α и β-фаз с образованием механической смеси кристаллов этих фаз происходит на линии солидуса ECF.
Сплав состава точки С после затвердевания называется эвтектическим, поскольку он состоит только из одной эвтектики α+ β. Составы сплавов, лежащих левее эвтектической точки С на линии ЕС после затвердевания, называются доэвтектическими сплавами и имеют структуру α+ эвтектика (α + β). Составы сплавов, лежащих правее точки С на линии CF после затвердевания, называются заэвтектическими сплавами и имеют структуру β + эвтектика (α+β).
Линия ES показывает ограниченную растворимость в твердом состоянии компонента В в компоненте А, уменьшающуюся с понижением температуры. Линия FM показывает растворимость компонента А в В, не изменяющуюся с понижением температуры.
Предельная растворимость компонента В в А характеризуется точкой Е. а А в В - точкой F. При кристаллизации сплавов, состав которых находится левее точки S (или правее точки М), при любой температуре в твердом состоянии все количество компонента В (или А) находится в твердом растворе и структура таких сплавов состоит из зерен α (или β).
В сплавах, состав которых находится между точками S и Е' (за пределами растворимости В в А), образовавшиеся при затвердевании кристаллы а при понижении температуры ниже линии ES пересыщены компонентом В и поэтому из них происходит выделение избыточных кристаллов. Этими кристаллами являются кристаллы β концентрации точки М. называемые вторичными (βII). Такие сплавы после полного охлаждения имеют структуру, состоящую из кристаллов а состава точки S и кристаллов
βII, т. е. α+. βII
В сплавах состава линии ЕС. имеющих после затвердевания структуру α + эвтектика (α+β), из кристаллов α выделяются кристаллы β и после полного охлаждения структура будет α+эвтектика (α+β) + βII -
pdnr.ru
Диаграмма состояния системы медь-никель-цинк (Cu-Ni-Zn) :: Диаграммы сплавов
Диаграмма состояния системы Cu—Ni— Ζn была изучена методами термического, микроструктурного и рентгеновского анализов . На рис. приведены изотермы ликвидуса системы и изотермические сечения при 775°C и комнатной температурах. В приведенной части системы не обнаружено нонвариантных превращений при кристаллизации. В области сплавов, прилегающих к Cu—Niстороне, в равновесии с твердым раствором Cu— Ni могут находиться фазы (Ni—Ζn)и β (Cu—Zn) при температурах 775 и 650°, а при комнатной температуре — фазы β1(Ni— Zn) и β' (Cu—Ζn). Эти фазы имеют следующие кристаллические решетки: α — ГЦК; β—ОЦК; β' — ОЦК с субструктурой, соответствующей низкотемпературной фазе системы Cu — Zn; β1— объемноцентрированная тетрагональная (тип AuCu), соответствующая низкотемпературной фазе системы Ni— Ζn.
Источники:
- Диаграммы состояния двойных и многокомпонентных систем на основе железа. Банных О. А., Будберг П.Б., Алисова С. П. и др. Металлургия, 1986 г.
- Двойные и многокомпонентные системы на основе меди. под ред. Шухардина С.В. Наука, 1979 г.
- Диаграммы состояния двойных металлических систем ред. Лякишева Н.П.Машиностроение, 1996-2000 г.
markmet.ru
Никель диаграмма состояния - Энциклопедия по машиностроению XXL
Влияние легирующих добавок на свойства никеля Диаграммы состояния [c.258]Сера и фосфор. Влияние серы и фосфора на образование горячих трещин при сварке аустенитных сталей и сплавов обусловлено их способностью образовывать легкоплавкие эвтектики с железом и никелем. Диаграммы состояния Fe—S, Ni—S, Fe—P, Ni—P относятся ко второму типу (см. рис. 77, б). В соот-14 211 [c.211]
Влияние никеля. Диаграмма состояния [c.43]Никель. Диаграмма состояния тройной системы медь — никель — олово изучена лишь частично. Вертикальный разрез диаграммы медь — никель — олово с постоянным содержанием 2% N1 и горизонтальный разрез медного угла этой системы при комнатной температуре показаны на рис. 182 и 183. [c.159]
Из схематических диаграмм состояния железо — легирующий элемент, приведенных на рис. 273, видно, что свыше определенного содержания марганца, никеля или некоторых других элементов (рис. 273,а) состояние существует как стабильное [c.342]
На сечении диаграммы состояния тройной системы Fe—Сг—Ni при 1100 "С (рис 304) этим сплавам соответствуют двухфазные области a -fv (основа никель или железо-f никель) и a-fv (основа железо), где а -фаза с о. ц. к. решеткой обогащена хромом. При более высоких температурах эти сплавы являются однофазными а (о, ц. к.) в сплавах на основе железа и у (г. ц. к.) в сплавах с высоким содержанием никеля. [c.577]
| Фиг. 6. Диаграмма состояния никель — хром | 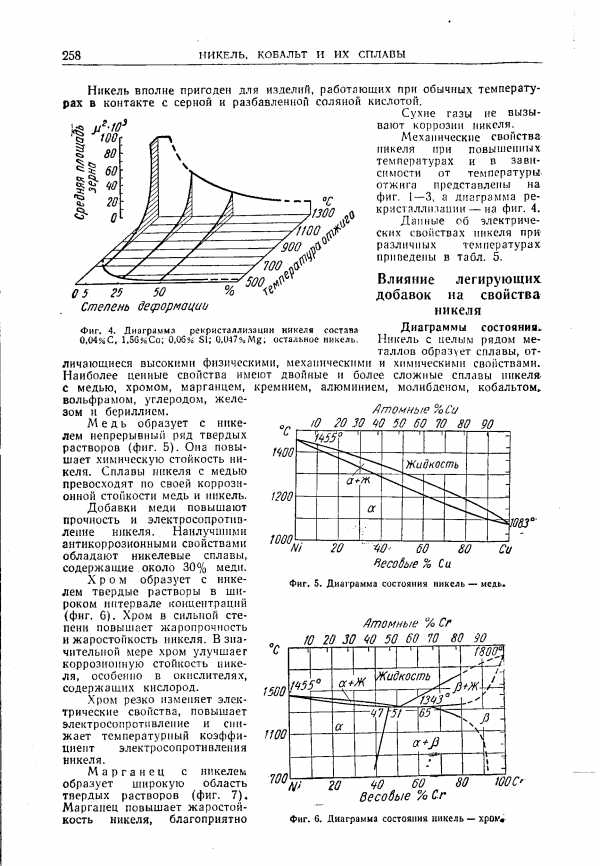 |
| Фиг. 8. Диаграмма состояния никель — кремний. | 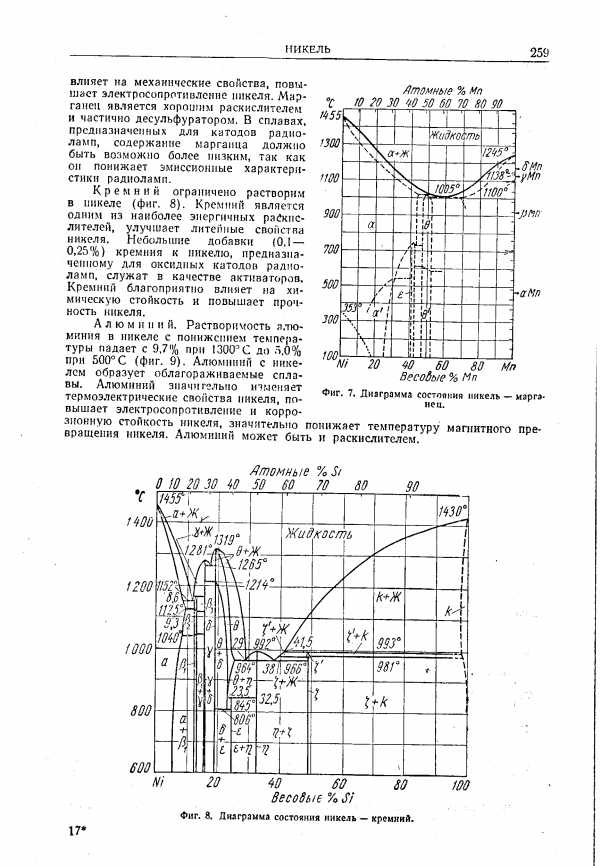 |
| Фиг. 9. Диаграмма состояния никель — алюминий. | 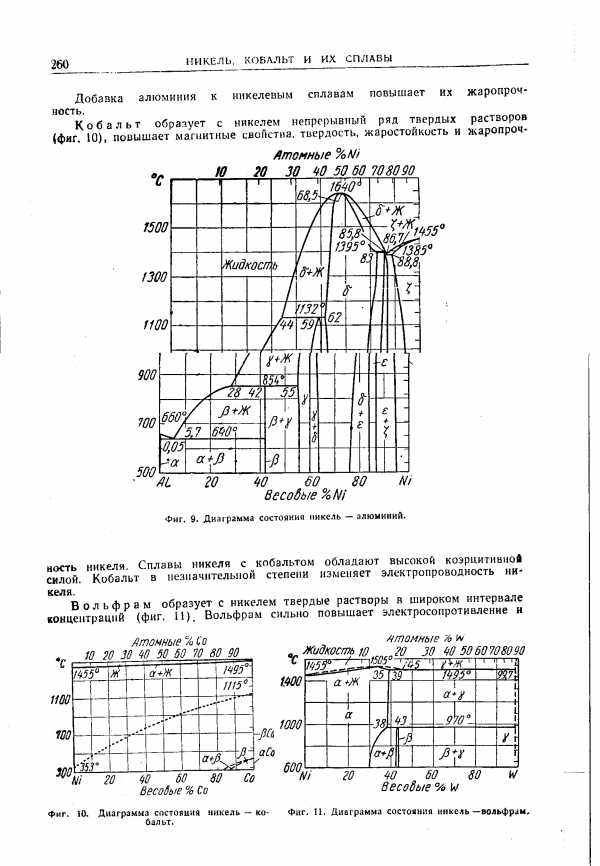 |
| Фиг. 10. Диаграмма состояния никель — кобальт. | 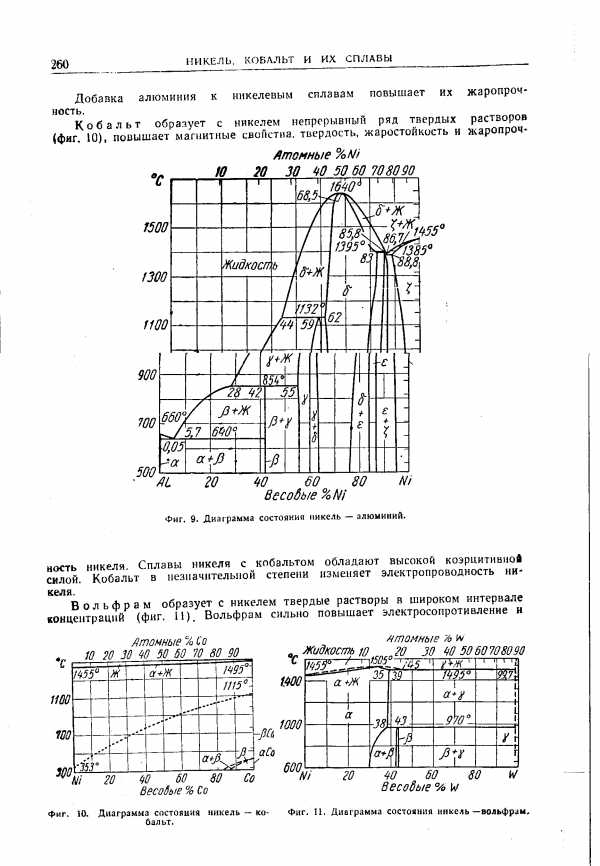 |
| Фиг. 11. Диаграмма состояния никель —вольфрам. | 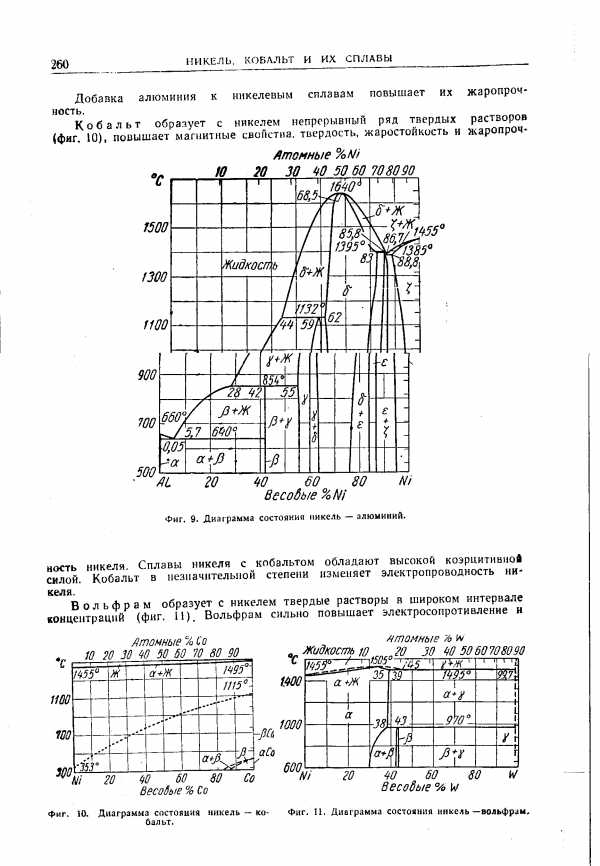 |
| Фиг. 13. Диаграмма состояния никель — углерод. | 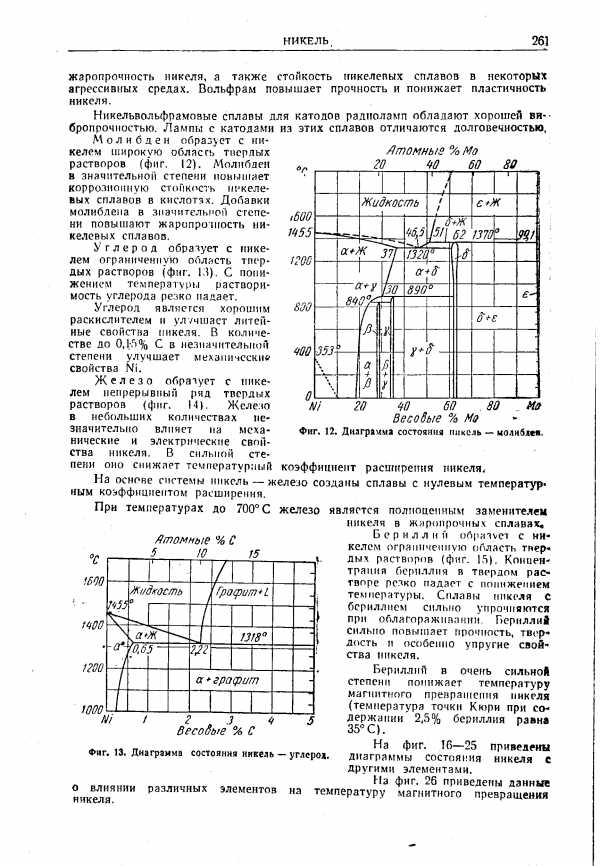 |
| Фиг. 14. Диаграмма состояния никель — железо. | 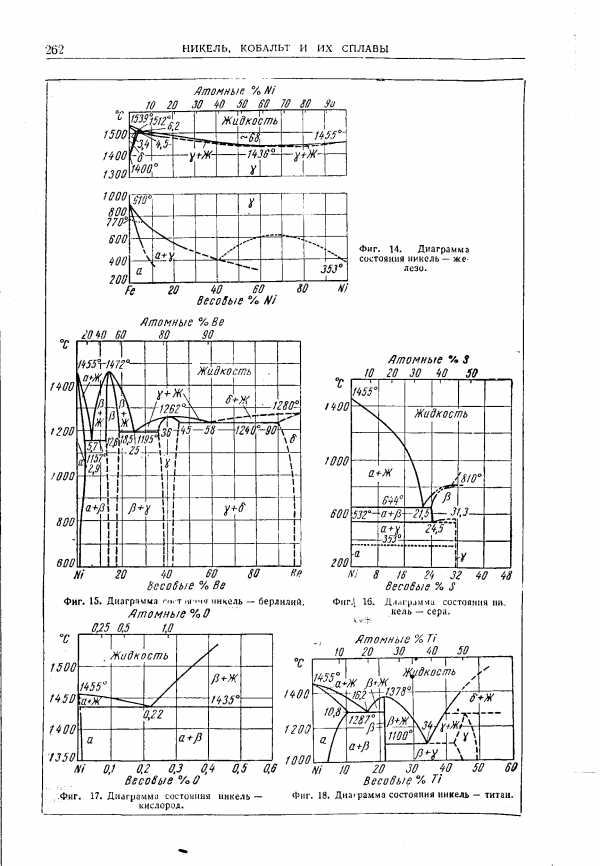 |
| Фиг. 18. Диаграмма состояния никель - титан. | 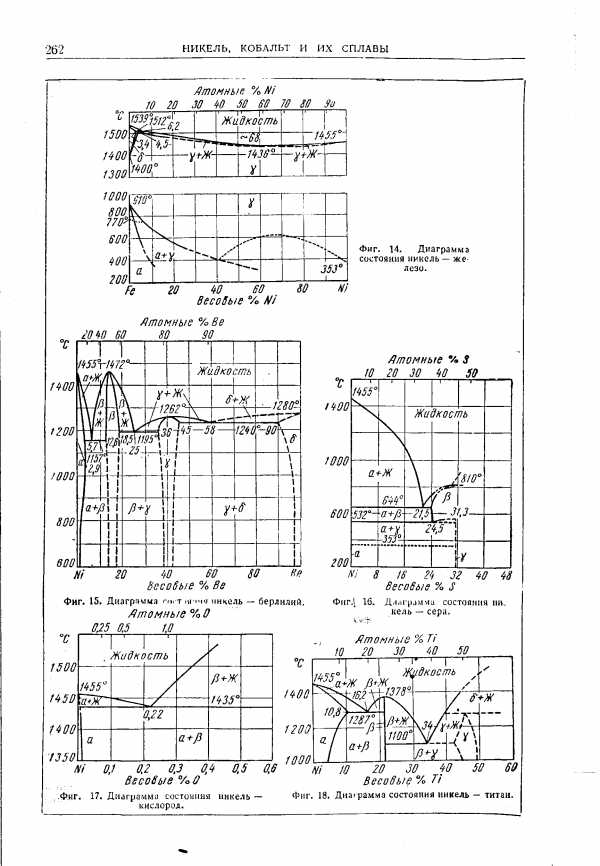 |
| Фиг. 21. Диаграмма состояния никель — олово. | 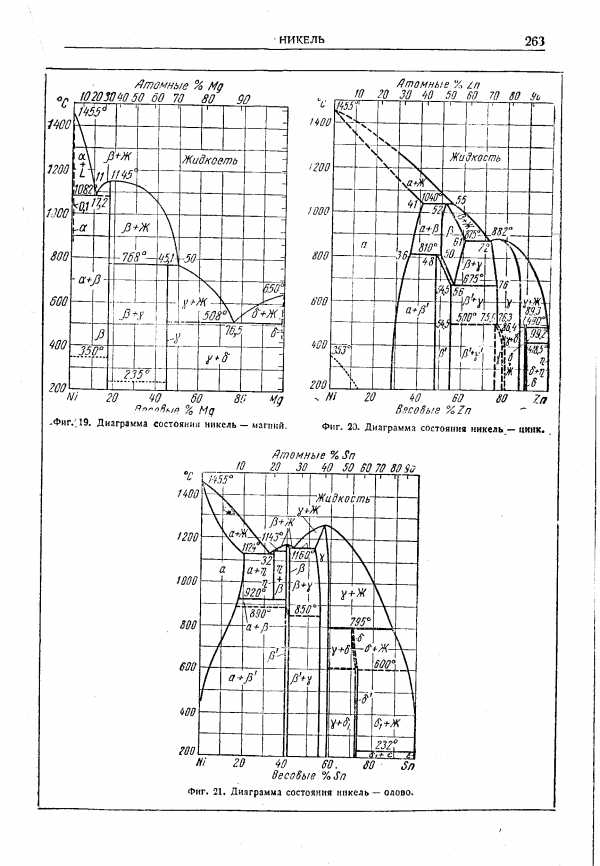 |
| Фиг. 22. Диаграмма состояния никель — тантал. | 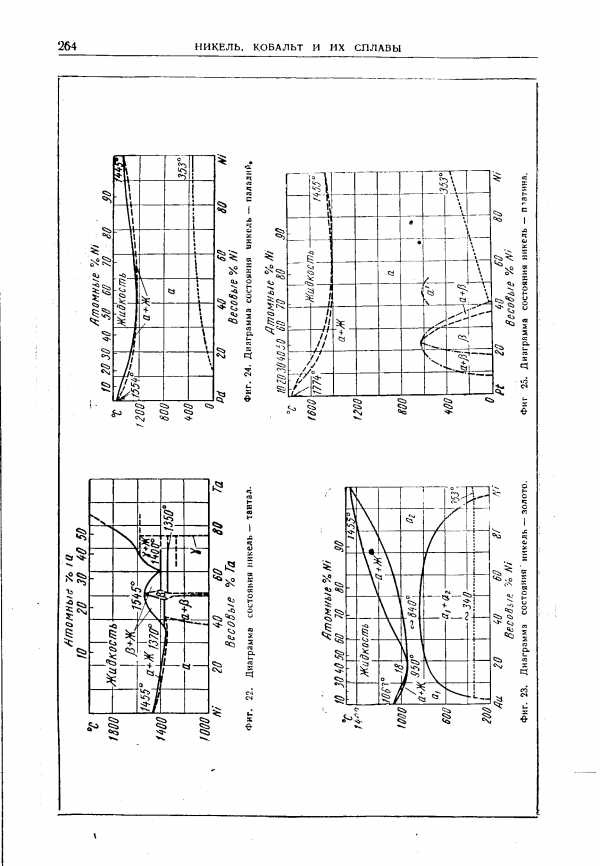 |
| Фиг. 81, Диаграмма, состояния никель — бериллий. | 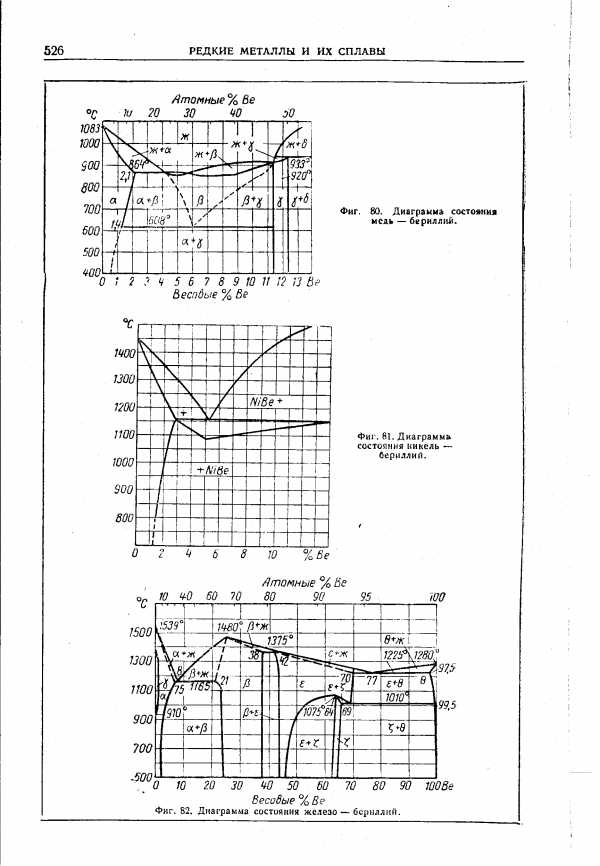 |
Никель весьма резко повышает механические свойства алюминиевых бронз. Под влиянием никеля область твёрдого раствора а в алюминиевых бронзах с понижением температуры резко сдвигается в сторону медного угла, что указывает на возможность облагораживания данных сплавов. Диаграмма состояний Тройной системы Си — А1 — Ni (медный угол) приведена на фиг. 39. [c.114]
| Фиг. 205. Диаграмма состояния никель—углерод. |  |
Сплавы медь — никель. Диаграмма состояния [14] — рис. I.I15. Си и Ni обра-- [c.51]
Следующим объектом исследования был выбран сплав цинк-никель. Диаграмма состояния системы цинк-никель [61] представлена на фиг. 38. Как следует из этой диаграммы, небольшие присадки никеля к цинку должны вызвать образование в сплаве интерметаллического соединения NI2Zrii5. Поскольку растворимость никеля в цинке очень мала (интерметаллического соединения. Перенапряжение водорода на никеле не очень велико, поэтому можно ориентировочно предположить, что и на интерметаллическом соединении NI2Zni5 значение перенапряжения водорода также будет Дтоми.%гп невелико. Если это так, то тог Г 1 -yW—8 90 коррозия цинка с присадком никеля должна развиваться относительно энергично. [c.41]
Для приближенного определения характера структуры обычно пользуются диаграммой Шеффлера, предварительно подсчитав эквивалеитпые содержания никеля и хрома. На структуру этих сталей оказывает влияние также термообработка, пластическая деформация н другие факторы. По )тому положение фазовых областей на диаграммах состояния определено для немногих систем в виде псевдобинарн1,[х разрезов тройных систем, обычно Fe—Сг—Ni с углеродом. [c.281]
Алюминиевые бронзы. Наиболее часто применяют алюминиевые бронзы, двойные (БрА5 и БрА7) и добавочно легированные никелем, марганцем, железом и др. Эти бронзы используют для различных втулок, направляющих седел, фланцев, шестерен и других небольших ответственных деталей. На рис. 172 приведена диаграмма состояния Си—А1. Сплавы, содержащие до 9,0 % А1, —однофазные и состоят только из а-твердого раствора алюминия в меди. Фаза 3 представляет твердый раствор иа базе электронного соединения Си ,Л1 (3/2). При содержании более 9 % А1 (в структуре появляется эвтектоид а -f у (у — электронное соединение ug Ali,,). При ускоренном охла>кд,е-нии эвтектоид может наблюдаться в сплавах, содержащих 6—8 % А1. Фаза а пластична, но прочность ее невелика, у -фазн обладает повышенной твердостью, но пластичность ее крайне незначительная. [c.351]
Взаимодействие примеси и добавки в металле довольно сложно п определяется диаграммой состояния металл — примесь — добавка. Упомянутые выше факторы имеют основное значение, но они не единственные. Церий в виде металла или в виде сплава с редкими землями полностью устраняет зону горячеломкости технического никеля. Оптимальное остаточное содержание церия равно 0,02—0,025 % меньшее содержание недостаточно для устранения вредного влияния примесей, а большее уменьшает пластичность [IJ. Избыток магния также вреден. Растворимость его в никеле менее 0,1 % при большем содержании образуется эвтектика. При легировании неодимом, празеодимом, церием и лантаном они раеполагаются преимущеетвенно по границам зерен никеля. [c.160]
Фиг, 27. Диаграмма состояния и свойства сплавов системы платина—никель 1 — закаленные 2 — отожженные магнитные преврятечия. [c.416]
Наличием в системе двух интерметаллических соединений — богатого никелем NbNiз и более бедного никелем соединения NbNi, относительно существования которого на диаграмме состояния системы Nb—N1 долгое время не было установившегося мне- [c.112]Нагревание хрома на воздухе вызывает образование на его поверхности ромбоэдрической модификации окиси хрома а-СгаОз- По диаграмме состояния система СгаОд—А12О3 имеет непрерывный ряд твердых растворов [5]. На никеле при нагреве в тех же условиях возникает закись никеля N 0, образующая с А1гОз соединение со структурой шпинели К1А1204. [c.228]
На рйс. 63 представлен изо-гермичёский разрез тройной диаграммы состояния Ni— r—Mp, из которого следует, что при 1200° С в никеле растворяется одновременно до 20% Сг и 20% Мо. С понижением температуры растворимость их уменьшается. При 800° С одновременно в твердом растворе может быть растворено в сумме, до 20% хрома и молибдена, [c.147]
mash-xxl.info
Система медь — никель - Энциклопедия по машиностроению XXL
| Рис. 403. Политермический разрез медного угла системы медь — алюминий — никель при постоянном содержании никеля 3% | 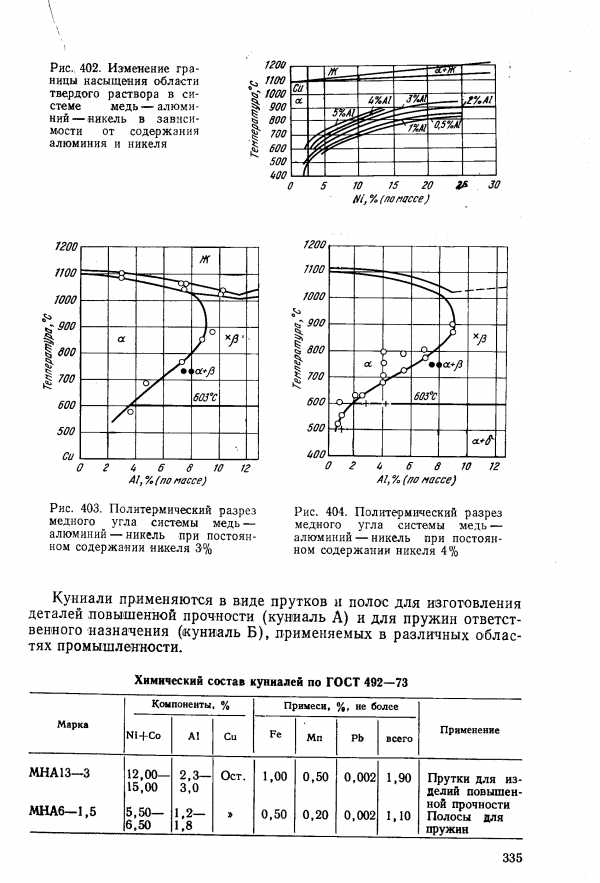 |
Металлы, кристаллизующиеся в системе куба с центрированными гранями (медь, алюминий, никель, серебро, золото и др.), не обнаруживают хладноломкости ни при каком понижении температуры. Например, алюминий при температуре жидкого азота (—196 С) увеличивает прочность приблизительно в 2 раза, увеличивая одновременно относительное удлинение в 4 раза. Аналогично ведут себя медь и никель. Многие сплавы алюминия, меди, а также некоторые стали не обладают свойством хладноломкости. [c.118]
Опыт эксплуатации теплообменников из сплава 70—30 на 20 эсминцах ВМС США показал, что после 20-летней эксплуатации забивается в среднем лишь 0,37 % конденсаторных трубок. Некоторые из трубок разрушились со стороны, находящейся в контакте с паром. Еще более высокая стойкость сплава 70—30 отмечается на береговых установках, использующих чистую морскую воду. При использовании загрязненной воды скорость забивания трубок продуктами коррозии примерно в 9 раз выше, однако и в этом случае результаты значительно лучше, чем для других медных сплавов. В более агрессивных условиях из двух рассматриваемых сплавов системы медь — никель чаще используется сплав 70—30, обладающий более высокой общей коррозионной стойкостью. В то же время в стоячей морской воде этот сплав характеризуется большей склонностью к питтингу, чем сплав 90—10. [c.114]
Общее количество вод, сбрасываемых после химических очисток и консервации теплосилового оборудования, в системе Минэнерго превышает 2,5 млн. м в год [24]. Залповый характер образования промывочных вод требует наличия емкостей, рассчитанных на трехкратное разбавление стоков. Обработка стоков от химической очистки оборудования включает нейтрализацию кислотной смеси, осаждение гидратов оксидов железа, меди, цинка, никеля и т. д. В случае применения трилона при нейтрализации до рН>9 осаждается только железо. Для разрушения прочных комплексов меди, цинка и никеля в жидкость вводят сер- [c.21]
Подготовим серию образцов сплавов системы медь — никель ) разной концентрации и приступим к эксперименту (рис. 7). [c.39]
Диаграмма состояния для случая полной взаимной растворимости компонентов в твердом состоянии. Этот тип диаграммы относится к системам, компоненты которых обладают полной взаимной растворимостью как в жидком, так и в твердом состоянии. Практическим примером таких диаграмм является диаграмма состояния сплавов меди с никелем. Эта диаграмма строится на основании анализа кривых охлаждения, полученных опытным путем, одна из которых изображена на фиг. 57 (слева). Кривые охлаждения чистых металлов имеют только по одной температурной остановке для никеля — при 1452° С (точка В), для меди — при 1083° С (точка А). [c.92]
В системе медь — никель — железо имеется ряд сплавов, которые после термической обработки и холодной деформации могут приобрести высокие магнитные свойства В = 6 кгс при Не 500 э). [c.561]
Система медь — никель. Еще одним примером может являться сплав Си—N1. Ю. М. Полукаров и К. М. Горбунова [19], исследуя структуру сплавов Си—N1 при осаждении из сернокислых растворов, показали, что наряду с фазой твердого раствора образуется фаза чистого никеля. [c.15]
Этот тип диаграммы относится к системам, составные части которых обладают полной взаимной растворимостью в жидком и твердом состояниях. Примером таких диаграмм является диаграмма состояния сплавов меди с никелем. Эта диаграмма также построена на основании кривых охлаждения, полученных опытным путем. Одна из кривых показана на рис. 8 слева. Кривые [c.25]
Система может состоять из одного или нескольких компонентов, например, система медь — никель состоит из двух компонентов меди и никеля. [c.81]
Карбидная фаза. Легирующие элементы, расположенные в периодической системе правее железа (никель, кремний, алюминий, медь, кобальт и т. д.), не образуют карбидов, они только растворяются в феррите или аустените. [c.215]Диаграмма состояния П типа. Диаграмму состояния для компонентов, неограниченно растворимых друг в друге как в жидком, так и в твердом состоянии и образующих при кристаллизации твердый раствор, называют диаграммой состояния II типа. Диаграмма состояния сплавов меди с никелем, кристаллизующихся по этому типу, приведена на фиг. 53. Компонентами в этой системе являются медь и никель число фаз две жидкий раствор и твердый раствор переменной концентрации. Выше линии ликвидуса сплавы находятся в жидком состоянии, ниже линии солидуса — в твердом состоянии, образуя непрерывный ряд твердых растворов никеля и меди разной концентрации. [c.123]
Диаграмма состояния для случая полной взаимной растворимости компонентов в твердом состоянии. Этот тип диаграммы относится к системам, компоненты которых обладают полной взаимной растворимостью как в жидком, так и в твердом состоянии. Практическим примером таких диаграмм является диаграмма состояния сплавов меди с никелем. Эта диаграмма также построена на основании анализа кривых охлаждения, полученных опытным путем, одна из которых изображена на [c.57]
При пайке стали 03 ВД и стали СтЗ самофлюсующим припоем ВПр4 (система медь—марганец—никель) актив, по протекает процесс взаимодействия окисной пленки с содержащимися в припое В, Р, Si, Li, К, Na, В результате окисная пленка удаляется с поверхности паяемого металла и образуется легкоплавкий шлак, который при металлографическом исследовании просматривается в шве в виде каплевидных включений (рис. 16). На одной из соединяемых поверхностей видны остатки окисной пленки, не связанные флюсующими компонентами в шлак, что объясняется недостаточным количеством активных составляющих припоя для связывания в легкоплавкий шлак всей окисной пленки. [c.27]
| Рис. 404. Политермический разрез медного угла системы медь — алкуминий — никель при постоянном содержании никеля 4% | 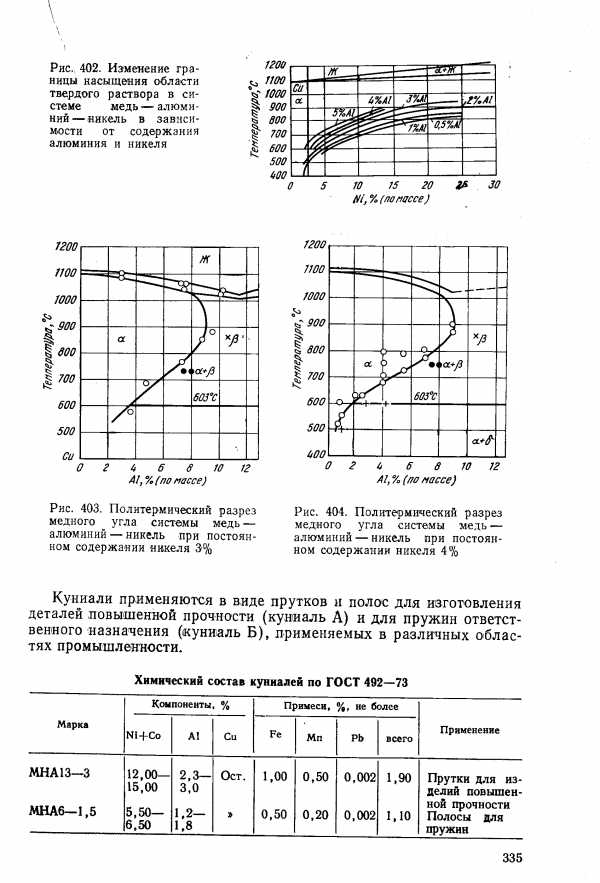 |
Один из способов снижения наводороживания - нанесение подслоя из другого металла, обладающего более низкой водородопроницае-мостью. Эффективно в качестве подслоя при кадмировании использовать медь или никель. Оба металла снижают степень наводороживания стали, но не исключают его полностью. Кроме того, подслой меди и никеля может вызвать в некоторых агрессивных средах развитие контактной коррозии, ухудшающей коррозионное состояние изделия. Поэтому при выборе металла подслоя необходимо учитывать поведение системы в целом. [c.104]
В работе [36 ] содержатся многочисленные примеры, иллюстрирующие широкие возможности, которые дает использование нагревательной камеры Вакутерм при исследовании мартенситного превращения в стали, полиморфных а = у-превращений в сплавах на железной основе, изменения величины зерна аустенита, Р а-превращения в чистом титане, процессов спекания в системе медь—никель, плавления и затвердевания на поверхности изучаемых образцов, исследования керамических материалов и т. д. [c.106]
Никель обладает высокой стойкостью в морских атмосферах [39]. В то же время в условиях погружения в морскую воду коррозионное поведение никеля может быть различным. В движущейся воде пассивность металла может сохраняться, а в неподвижной воде наблюдается склонность к местному разрушению пассивной пленки, в результате чего возникает ниттинг [40]. В основном никель используется в качестве одного из компонентов сплавов, применяемых в морских условиях. Хорошей стойкостью к морским средам обладают широко применяемые сплавы никель — медь, например Монель 400, а также сплавы системы медь — никель. [c.75]
Формулы Даркена справедливы, если вакансии находятся в равновесии и не образуются поры. Однако это противоречит наблюдениям. Зейт и Коттман в большом числе систем, в частности в системах медь — латунь и медь — никель, обнаружили пористость вблизи поверхности раздела — там, где диффузионная подвижность выше на стороне латуни в системе медь — латунь и на стороне меди в системе медь — никель, а в системе золото — серебро—на стороне серебра [89] (рис. 43). Поры, очевидно, возникают в результате коагуляции вакансий (эффект Френкеля). [c.113]В работе [8] сообщается о разработке метода электролитического осаждения на углеродный жгут различных металлических покрытий — никеля, алюминия, свинца и меди. При электроосаждении никеля из сульфатных электролитов хорошие результаты получаются лишь для углеродных жгутов с числом элементарных волокон не более 2500, увеличение числа элементарных воло1 он в жгуте до 5000 приводит к формированию неоднородного по толщине никелевого покрытия и даже к отсутствию покрытия в центральной части н гута вследствие плохой рассеивающей способности электролита. Образцы композиционного материала содержали до 50 об. % углеродных волокон. Компактные образцы получали прессованием через жидкую фазу пакета волокон с матричным покрытием и топким слоем сплава системы медь — серебро, обеспечивающим формирование жидкой фазы в процессе прессования. Свойства композиционного материала в работе [81 не сообщаются. [c.400]
Патент США, № 3971734, 1976 г. Описываются композиции и водные растворы, содержащие соединения сульфита. Примером могут служить сульфиты и бисульфиты щелочного металла или аммония и по крайней мере одного растворимого в воде, стабилизированного органического фосфоната, содержащего, как минимум, две фос-фоновые кислотные группы в молекуле. Описывается метод снижения скорости окисления растворов сульфита за счет атмосферного кислорода и метод замедления коррозии черных металлов в водных системах, содержащих растворенный кислород-и по крайней мере один двухвалентный катион из группы железо, кобальт, медь, магний, никель. [c.70]
Биникелевые покрытия часто используют в качестве промежуточного слоя при получении защитно-декоративных покрытий вместо системы медь—никель—хром применяют систему никель полу блестящий—никель блестящий—хром). [c.686]
Среди сплавов этой системы лучшими свойствами обладает сплав, содержащий 60% меди, 20% никеля и 20% железа, называемый кунифе (рис. 28.103, табл. 28.41J. [c.561]
Медь и никель являются наиболее широко используемыми элементами для легирования спеченных сплавов на основе железа. Это является, главным образом, следствием того, что никель так же, как и медь, имеет низкое сродство к кислороду и увеличивает прокали-ваемость сталей. Однако никель увеличивает усадку детали, в противоположность меди, но повышает ударную вязкость спеченных деталей. Скорость диффузии никеля в железе низка, потому что он образует с железом твердый раствор замещения. На самом деле, когда порошковый материал спекают при очень высокой температуре или в течение очень продолжительного времени, система должна приближаться к равновесным условиям. Установлено [49], что максимальная гомогенизация была достигнута при использовании тонко измельченного порошка никеля (обычно частицы карбонильного порошка имеют размер 1 мкм) и температуры спекания приблизительно 1300 "С. Никель способствует стабилизации аустенита. Микрс структурные [c.85]
При исследовании системы Си—N1, представляющей непрерывный ряд твердых растворов, наблюдалось монотонное уменьшение Т1н+ от меди к никелю [13]. Результаты, полученные при иссле-Ш,вес.°/о довании системы N1 — Сг в 1 н. рас- [c.138]
Анодное пассивирование облегчается, если медь легирована никелем. Нижний предел содержания никеля, при котором медноникелевые сплавы становятся пассивными, составляет 35—40 вес.%. При дальнейшем увеличении содержания никеля плотности анодного тока, необходимые для пассивирования системы Си—N1 (например, в 3% растворе Ыаг504 при комнатной температуре), быстро падают до малых значений и при содержании никеля [c.254]
В последнее время хромовые покрытия с микропорами и микротрещинами применяют в защитных системах медь — никель — хром или никель — хром для повышения антикоррозионной стойкости стальных деталей при эксплуатации их в различных климатических условиях. Более высокая антикоррозионная стойкость такого покрытия по сравнению с обычным объясняется тем, что при наличии множества пор или микротрещин в хромовом покрытии коррозионный ток, вызванный действием микрогальваноэлементов N1—Сг, распределяется по большой поверхности и скорость коррозии на единицу площади значительно уменьшается [29]. [c.316]Из рассмотрения особенностей окисления сплавов системы медь -- никель вытекает, что область концентраций, в которой образуется чистый окисел менее благородного металла, существенным образом зависит от разности упругостей диссоциации окислов сплавообразующих металлов или от разности свободных энергий образования этих окислов. Никель относится к оравни-гельно благородным металлам, но в оплаве могут содержаться в малых количествах и менее благородные металлы, которые бу- [c.181]
Увеличение содержания меди в никеле снижает его окалиностойкость [50]. Рентгеновский анализ показал, что окисные пленки сплавов, содержащих менее 60% Си, состоят из СиО и N 0 окисные пленки сплавов, содержащих более 60% Си, состоят из Си20, СиО и N 0. Химический анализ отделенных пленок обнаружил, что соотношение меди и никеля в них такое же, как и в самом сплаве. Параметр решетки сплава после окисления при 700 и 800° не изменялся. Все это дало возможность заключить [50], что в системе N1 — Си и один из компонентов не подвержен предпочтительному окислению. [c.105]
Третий электролит предназначается исключительно для получения защитно декоративных покрытий системы медь—никель— хром. Хромовые покрытия, легированные молибденом, обладают более высокой способностью к пассивации и при переходе микроколичеств молибдена в коррозионную среду соединения молибдена выполняют ингибирующую роль по отношению к трехслойному защитному покрытию и основному металлу. [c.240]
Литейные алюминиевые сплавы отличаются малым удельным весом, высокой удельной прочностью при нормальной температуре (в термообработанном состоянии) и в основном хорошими литейными свойствами. К ним относятся сплавы на основе системы алюминий—кремний (АЛ2, АЛ4 и АЛ9), системы алюминий—магний (АЛ8), системы алюминий—медь (А.П7 и АЛ9), системы алюминий—кремний—медь (АЛЗ, А.Г15 и АЛ6), системы алюмнннй—кремний—магний (АЛ13 и ВИ-11-3), систем ,1 алюминий—медь—магний—никель (ЛЛ1 и ВЗОО), системы алюминий—кремний—медь—магний—железо (В14А].. . . [c.229]
Ход процесса спекания многокомпонентных систем в значительной мере определяется характером диаграмм состояния их компонентов. В системах с неограниченной взаимной растворимостью (Си — N1, Ре — N1, Со—N1, Си — Аи, Ш — Мо, Сг — Мо, Со — N1 — Си, Ре — N1 — А1 и др.) наибольшее значение имеет объемная диффузия. При спекании таких систем усадка меньше суммарной усадки исходных компонентов и зависит от концентрации элементов. Это объясняется более низкой подвижностью атомов в твердых растворах по сравнению с чистыми металлами и невозможностью получения при смешивании абсолютно однородной смеси, в результате чего при спекании наблюдается большое количество контактов, скорость диффузии через которые неодинакова. Так, в системе Си—N1 по мере повышения содержания никеля в меди (или наоборот) усадка уменьшается и даже наблюдается рост образцов (рис. 156). Это связано с тем, что коэффициент диффузии меди в никель больше, чем коэффициент диффузии никеля в медь, и поэтому в частицах меди образуются избыточные вакансии, коалесцирую-щие в поры, а частицы никеля увеличиваются в размерах из-за преобладания притока атомов меди над оттоком атомов никеля [6]. Характер протекания усадки и степень гомогенизации спекаемых компонентов (т. е. выравнивание состава сплава) определяют конечные свойства спеченных материалов. Гомогенизация шихты перед прессованием обеспечивает при спекании более полную и однородную усадку, а также более однородный состав и свойства изделий по всему объему. Однако полная гомогенизация необходима не во всех случаях и зачастую оказывается достаточной частичная гомогенизация. Больший эффект достигается при применении вместо порошковой смеси порошка, представляющего собой гомогенный сплав заданного состава. [c.315]
mash-xxl.info