Содержание
Электроды ЦЛ-11 применение и характеристики
Все, комы приходилось периодически сваривать заготовки из нержавейки, наверняка знают об электродах ЦЛ-11. Они востребованы не только для работы с нержавейкой, но и всеми остальными металлами, которые устойчивы к коррозии. Имея хорошие технические показатели, эти электроды широко используются как любителями, так и профессионалами. Они нашли свое применение и в гаражах, и на крупных производственных объектах. Электроды ЦЛ-11 при грамотном использовании образуют прочный, устойчивый к воздействию влаги шов.
СОДЕРЖАНИЕ
- Применение электродов ЦЛ-11
- Технические характеристики электродов ЦЛ-11
- Правила применения
Применение электродов ЦЛ-11
Расходные материалы используются при работе с заготовками из нержавеющего, хромоникелевого и устойчивого к коррозии металла, марок: 12Х18Н10Т, 08Х18Н12Б, 08Х18Н12Т, 12Х18Н9Т.
Уникальные свойства электродов способствуют получению высококачественного сварного соединения, которое устойчиво против коррозии. При соединении металлов из высокими противокоррозионными характеристиками это важное и даже решающее условие. Ведь если защита от влаги будет нарушена хотя бы в одном месте, включая стык, ржавчина последовательно уничтожит всю конструкцию.
При соединении металлов из высокими противокоррозионными характеристиками это важное и даже решающее условие. Ведь если защита от влаги будет нарушена хотя бы в одном месте, включая стык, ржавчина последовательно уничтожит всю конструкцию.
Стержень электрода выполнен из высоколегированной стали марки СВ08Х19Н10Б. Поэтому при выполнении сварочных работ все элементы нержавейки, которые выгорают, замещаются новыми. Это и делает сварной шов антикоррозионным. Плюс ко всему в электродах присутствует фтористо-кальциевое покрытие, которое исключает воздействие на шов вредных внешних факторов.
Технические характеристики электродов ЦЛ-11
Грамотно подобрать режим выполнения сварочных работ невозможно, если не знать в деталях особенности и характеристики электродов. Тем более, когда речь идет о работе с металлами, устойчивыми к ржавчине. Расходники ЦЛ-11 позволяют сварщика выполнить работу в любом пространственном положении.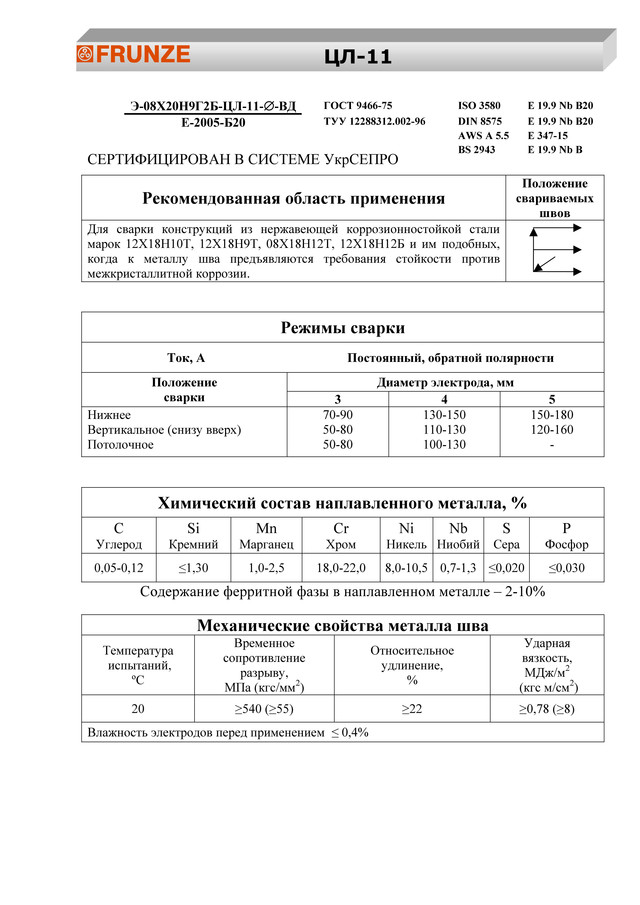 Исключается только строго вертикальное положение электрода по направлению сверху-вниз.
Исключается только строго вертикальное положение электрода по направлению сверху-вниз.
Для работы следует обзавестись инвертором, который сможет давать постоянный ток. Способ подключения – обратная полярность.
Основные характеристики ЦЛ-11:
- основное покрытие;
- производительность наплавки расходными материалами диаметром 4 мм составляет 1,5 кг металла за час работы;
- коэффициент наплавки – 11 г/А·ч;
- расход электродов из расчета на килограмм наплавленного металла составляет 1,7 кг.
Для улучшения качества и увеличения скорости работ, вы всегда можете воcпользоваться нашими верстаками собственного производства от компании VTM.
Характеристики сварного соединения:
- ударная вязкость составляет 120 Дж/см²;
- показатель сопротивления на разрыв – 660 Мпа;
- предел текучести – 420 Мпа;
- относительное удлинение – 34%.
Состав шва, выполненного при с использованием электродов ЦЛ-11:
- S (Сера) — 0,011%;
- P (Фосфор) — 0,02%;
- Nb (Ниобий) — 0,99%;
- С (углерод) — 0,1%;
- Mn (марганец) — 1,8%;
- Si (кремний) — 0,53%;
- Ni (Никель) — 9,8%;
- Cr (Хром) — 20,8%.

Приведенные данные носят условный характер и могут отличаться в зависимости от производителя. Ведь каждый из них имеет собственные секреты, которые вносят изменения в том числе и в состав электродов. Поэтому приведенные данные по составу шва можно рассматривать как стандарт, но не для конкретного частного случая.
Правила применения
Запрещено длительное хранение электродов в помещениях с высокой степенью влажности. Сырые электроды практически непригодны для использования и вызывают немало проблем. К примеру, они часто залипают, а сварочная дуга получается очень нестабильной.
Если уж сварочные электроды ЦЛ-11 отсырели, то сушить их желательно в специальной печи для прокалки. При этом нужно выдерживать режим сушки: температура удерживается в 320 градусов Цельсия, а продолжительность составляет 1-1,5 часа. Необходимо учесть, что подобную процедуру для одних и тех же электродов можно проделывать только два раза. В противном случае вряд ли удастся избежать осыпания обмазки.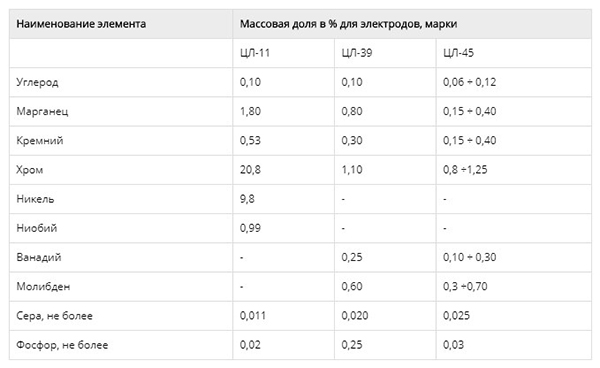
Во время работы электродами ЦЛ-11 следует выдерживать короткую дугу. Тогда будет лучше прогреваться металл и его текучесть, следовательно, будет выше. В то же время важно помнить, что нержавеющая сталь очень чувствительная к резкому перепаду температуры. Поэтому не стоит подвергать сварочный шов быстрому охлаждению. Далее приведены ориентировочные показатели силы сварочного тока для электродов разного диаметра и в зависимости от пространственного расположения:
- 2 мм: потолочный и вертикальный – 30-40, нижний – 40-55 Ампер;
- 2,5 мм: вертикальный и потолочный – 40-50, нижний – 55-65 Ампер;
- 3 мм: потолочный и вертикальный – 50-80, нижний – 70-90 Ампер;
- 4 мм: вертикальный и потолочный – 110-130, нижний – 130-150 Ампер;
- 5 мм: потолочный и вертикальный – 120-160, нижний – 150-180 Ампер.
С точки зрения специалистов, применение электродов ЦЛ-11 является сложным процессом по сравнению с использованием других типов электродов. Поэтому работать с ними могут уже опытные специалисты. Новичкам учиться лучше на более простых расходных материалах и обычных стальных заготовках.
Поэтому работать с ними могут уже опытные специалисты. Новичкам учиться лучше на более простых расходных материалах и обычных стальных заготовках.
Читайте также: Электроды для сварки нержавейки
Сварочные электроды ЦЛ-11
Оцените, пожалуйста, статью
12345
Всего оценок: 15, Средняя: 2
Сварочные электроды ЦЛ-11. | МеханикИнфо
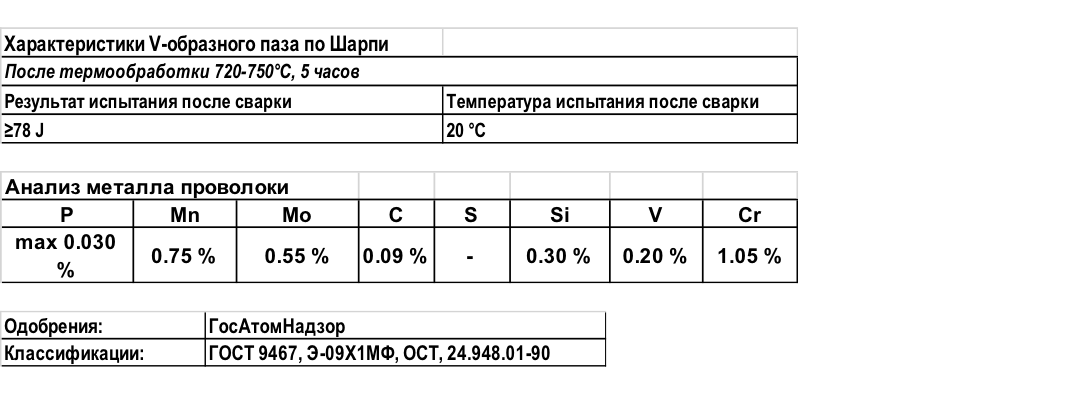
Сварочные электроды марки ЦЛ-11 предназначены для сварки различных металлов и металлоконструкций из нержавеющих сортов стали (1Х16Н13Б, 1Х21Н5Т, 12Х18Н9Т, 08Х18Н12Т, 08Х18Н12Б, 09Х18Н12Т, 12Х18Н10Т, Х14Г14Н3Т и других марок), находящиеся в условиях агрессивных сред. Основное достоинство данного вида сварочных электродов в том, что образуемый при сварке шов противостоит межкристаллитной коррозии. Поэтому к ним и предъявляются жесткие требования по качеству, составу и покрытию.
Технические характеристики:
Тип сварки: ручная, дуговая;
Покрытие: основное (карбонаты и фтористые соединения);
Ток: постоянный обратной полярности;
Коэффициент наплавки: 11 г/А·ч;
Положения при сварке: почти все пространственные положения, кроме сверху-вниз;
Расход электродов: на 1 кг металла тратиться порядка 1.7~1.8 кг электродов.
Таблица 1.
Технические характеристики сварочных электродов ЦЛ-11.
| Диаметр, мм | Длина, мм | Вес электрода, г | Количество электродов в упаковке, шт. | ||
| Упаковка 1 кг. | Упаковка 2.5 кг | Упаковка 5 кг | |||
| 2,00 | 300 | 9-10 | 100-111 | 250-277 | — |
| 2,50 | 350 | 18-19 | 52-55 | 131-138 | — |
| 3,00 | 350 | 27-28 | 35-37 | 89-92 | 178-185 |
| 4,00 | 350 | 47-48 | — | 52-53 | 104-106 |
| 5,00 | 450 | 98 | — | 25 | 51 |
Данная марка электродов имеет устойчивое горение дуги, очень маленькое разбрызгивание металла до 4 ~5 % и отменное формирование сварочного шва. Образуемый шов не должен содержать поверхностных и внутренних трещин, а его валики должны быть хорошо сформированы. Все эти технологические свойства электродов выводят их на первое место среди конкурентов.
Образуемый шов не должен содержать поверхностных и внутренних трещин, а его валики должны быть хорошо сформированы. Все эти технологические свойства электродов выводят их на первое место среди конкурентов.
Читайте также:
Самые распространенные электроды в строительстве. Электроды тип э 42 46 50.;
Электроды ОК 46.00 технические характеристики.;
Электроды УОНИ-13/55 технические характеристики.
Сварочные электроды АНО-4 технические характеристики.
Таблица 2.
Тип электродов ЦЛ-11. Силы тока при разных положениях шва.
| Диаметр, мм | Сила тока, А | ||
| нижнее | вертикальное | потолочное | |
| 2.0 | 40-60 | 30-50 | 30-50 |
2. 5 5 | 50-70 | 40-60 | 40-60 |
| 3.0 | 70-90 | 50-80 | 50-80 |
| 4.0 | 130-150 | 110-130- | 110-130 |
| 5.0 | 150-180 | 120-160 | — |
Сварочные электроды ЦЛ-11 технические характеристики.
Сварку производят на короткой дуге. Выпускаемые диаметры не имеют существенных отличий от сварочных электродов марок АНО-4 и УОНИ-13/55 и составляют: 2, 2.5, 3, 4, 5 мм. Наиболее популярные из них: 3, 4, 5 мм.
Сварочные электроды поставляются заказчику в герметичной упаковке. Это необходимо для того, чтобы не было потерь качества. Такие упаковки возможны для дальнейшего хранения и транспортировки, при соблюдении надлежащих условий.
Таблица 3.
Массовая доля химических элементов в сварочном шве.
| Углерод, C | Марганец, Mn | Кремний, Si | Никель, Ni | Хром, Cr | Ниобий, Nb | Сера, S | Фосфор, P |
| не более | |||||||
| 0,05-0,12 | 1,0-2,5 | 0,4-1,3 | 8,0-10,5 | 18,0-22,0 | 0,7-1,3 | 0,020 | 0,030 |
При выполненной работе сварочный шов содержит все химические элементы, указанные в таблице 3, в процентах.
Аналоги сварочных электродов ЦЛ-11: OK 61.85, FOX SAS 2-A, ОЗЛ-7, ЛЭЗ.
ЧИТАЙТЕ ТАКЖЕ:
Стандартный электродный потенциал – определение, расчет, использование и ограничения
Согласно ИЮПАК электродный потенциал определяется следующим образом:
В электрохимии электродный потенциал – это электродвижущая сила ячейки, состоящей из двух электродов.
Обозначается знаком E. Непосредственно точно измерить абсолютное значение потенциала отдельного электрода невозможно. Экспериментально можно измерить только разность потенциалов между двумя электродами. Так, в эксперименте по измерению электродного потенциала в ячейке в качестве электрода сравнения используется один электрод, потенциал которого уже известен, а другой электрод используется с неизвестным потенциалом. Экспериментально измеряется потенциал клетки, равный сумме потенциалов на двух электродах.
ECell = ECathode + EAnode
Ecell измеряется вольтаметром экспериментально, электродный потенциал одного электрода уже известен, поэтому можно рассчитать электродный потенциал другого (электрода с неизвестным электродным потенциалом).
Что такое стандартный электродный потенциал?
Потенциал полуреакции (полуэлемента), измеренный относительно стандартного водородного электрода в стандартных условиях, называется потенциалом стандартного электрода для этого полуэлемента или полуреакции. В стандартных условиях средняя температура 298К, давление должно быть 1 атм, концентрация используемого электролита должна быть 1М. Измеряется относительно стандартных водородных электродов.
В стандартных условиях средняя температура 298К, давление должно быть 1 атм, концентрация используемого электролита должна быть 1М. Измеряется относительно стандартных водородных электродов.
Стандартный водородный электрод представляет собой газоионный электрод. Используется в качестве электрода сравнения для определения стандартного электродного потенциала элементов и других полуэлементов. Он может действовать как анодный полуэлемент, а также как катодный полуэлемент. Значение его стандартного потенциала восстановления и стандартного потенциала окисления всегда равно нулю при 25℃ или 298K. Это основа термодинамической шкалы окислительно-восстановительных потенциалов.
Стандартный электродный потенциал обозначается E0. Стандартный потенциал восстановления или стандартный потенциал окисления можно рассчитать для электрода с использованием стандартного водородного электрода. Стандартный клеточный потенциал представляет собой разность между стандартными восстановительными потенциалами двух полуклеток или полуреакций. Его можно представить в виде –
Его можно представить в виде –
E0cell = Ecathode – Eanode
Расчет стандартного восстановительного потенциала для цинкового электрода
Конструкция стандартного водородного электрода. Чтобы построить стандартный водородный электрод, мы берем 1M раствор хлороводорода в стакане стакан. Теперь в химический стакан погружают платиновый инертный электрод с платиновой черной фольгой на одном конце и держат на нем стеклянную рубашку для предотвращения проникновения кислорода. Он имеет вход для чистого газообразного водорода (1 атм) для входа в раствор. Температура поддерживается на уровне 25℃. Рисунок стандартного водородного электрода показан ниже.0003
(Изображение будет загружено в ближайшее время)
Эта половина ячейки стандартного водородного электрода соединена с половиной ячейки цинкового электрода.
 Для этого в мензурку берут сульфат цинка и опускают в него цинковый стержень. Берется 1М концентрация электролита сульфата цинка. Температура поддерживается на уровне 25℃. Теперь этот цинковый электрод соединяется со стандартным водородным электродом с помощью вольтметра, который будет измерять электродный потенциал ячейки. Также используется солевой мостик, который предотвращает смешивание растворов и поддерживает электрическую нейтральность растворов. В качестве катода используется цинковая полуэлемент, а в качестве анода — водородный полуэлемент.
Для этого в мензурку берут сульфат цинка и опускают в него цинковый стержень. Берется 1М концентрация электролита сульфата цинка. Температура поддерживается на уровне 25℃. Теперь этот цинковый электрод соединяется со стандартным водородным электродом с помощью вольтметра, который будет измерять электродный потенциал ячейки. Также используется солевой мостик, который предотвращает смешивание растворов и поддерживает электрическую нейтральность растворов. В качестве катода используется цинковая полуэлемент, а в качестве анода — водородный полуэлемент.
(Изображение будет загружено в ближайшее время)
Значение стандартного восстановительного потенциала ячейки измеряется показаниями используемого вольтметра. Таким образом, по эксперименту мы знаем значение E0cell, а значение E0H+/h3 уже известно. Итак, по уравнению (1) мы можем рассчитать значение E0Zn2+/Zn.
Таким же методом мы можем рассчитать стандартный восстановительный потенциал медного электрода, используя полуэлемент с медным электродом и электролитом из сульфата меди вместо цинкового электрода и электролита из сульфата цинка.
 По опыту получается значение E0Cu2+/Cu +0,34В.
По опыту получается значение E0Cu2+/Cu +0,34В.
E0элемент = E0катод – E0анод
E0элемент = E0Cu2+/Cu – E0Zn2+/Zn
(если вы используете знак + вместо – в уравнении, то вы должны написать цинковый электрод как электрод окисления, это означает, что он будет записывается как E0cell = E0Cu2+/Cu + E0Zn2+/Zn )
E0cell = +0,34 – (-0,76)
E0cell = 1,1 В
Таким образом, ЭДС или стандартный потенциал ячейки Даниэля составляет 1,1 В.
Стандартный водородный электрод, используемый в качестве электрода сравнения, не должен зависеть от свойств анализируемого раствора и должен быть физически изолирован. Помимо стандартных водородных электродов, в качестве электродов сравнения используются многие другие электроды, такие как каломельные электроды, хингидронные электроды и т. д.
Электрохимический ряд
Расположение элементов в соответствии со стандартными значениями электродного потенциала называется электрохимическим рядом. Его также называют серией действий. Элементы, имеющие более высокий стандартный электродный потенциал, размещаются над элементами, имеющими более низкий стандартный электродный потенциал. Элементы, расположенные в верхней части ряда, имеют тенденцию легко уменьшаться. В то время как элементы, расположенные внизу, имеют наименьшую тенденцию к сокращению.
Его также называют серией действий. Элементы, имеющие более высокий стандартный электродный потенциал, размещаются над элементами, имеющими более низкий стандартный электродный потенциал. Элементы, расположенные в верхней части ряда, имеют тенденцию легко уменьшаться. В то время как элементы, расположенные внизу, имеют наименьшую тенденцию к сокращению.
Фтор имеет максимальную склонность к восстановлению, поскольку он имеет самый высокий стандартный электродный потенциал. В то время как литий имеет наименьшую тенденцию к восстановлению, так как у него самое низкое значение стандартного электродного потенциала. Таким образом, фтор является сильным окислителем, а литий — сильным восстановителем.
Использование стандартных электродных потенциалов
Использование стандартных электродных потенциалов указано ниже –
Ограничение стандартных электродных потенциалов
Стандартные электродные потенциалы можно применять только к водному равновесию. Мы можем предсказать возможности реакции, но мы не можем предсказать скорость реакции, используя стандартные электродные потенциалы.
Мы можем предсказать возможности реакции, но мы не можем предсказать скорость реакции, используя стандартные электродные потенциалы.
Это краткое описание стандартного электродного потенциала и пояснение его расчетов с примерами. Сосредоточьтесь на концепции и поймите, как она рассчитывается.
Окислительно-восстановительные реакции и электродные процессы
Окислительно-восстановительные реакции представляют собой окислительно-восстановительные химические реакции, в которых изменяются степени окисления реагентов. Термин «окислительно-восстановительный» относится к процессу восстановления-окисления. Все окислительно-восстановительные реакции можно разделить на два типа реакций: восстановление и окисление. В окислительно-восстановительной реакции или окислительно-восстановительном процессе реакции окисления и восстановления всегда происходят одновременно. Окислитель — это вещество, которое восстанавливается в химическом процессе, а восстановитель — это вещество, которое окисляется.
Гальванический элемент/гальванический элемент
Гальванический элемент, также известный как элемент Вольта, представляет собой электрохимический элемент, который вырабатывает электрическую энергию посредством окислительно-восстановительной реакции или окислительно-восстановительного процесса.
Гальванический элемент состоит из двух полуэлементов, которые выполняют процессы восстановления или окисления. Левая и правая полуклетки — это две полуклетки. Медный металлический стержень/полоса, смоченный в растворе сульфата меди (II), образует правую полуэлемент, а цинковый металлический стержень/полоса, смоченный в растворе сульфата цинка, образует левую полуэлемент. Металлические полоски называются электродами и служат проводником в цепи. Он способствует передаче электронов от полосок к растворам электролитов, в которые они погружены.
Два электрода на схеме выше соединены металлической проволокой. Цепь размыкается и замыкается с помощью переключателя. Пористая мембрана, соединяющая две половинки (полуклетки), способствует замыканию цепи. Использование цинково-медного элемента в качестве примера — лучший способ продемонстрировать электрохимический процесс в гальваническом элементе. Итак, давайте посмотрим на окислительно-восстановительный процесс цинк-медь.
Пористая мембрана, соединяющая две половинки (полуклетки), способствует замыканию цепи. Использование цинково-медного элемента в качестве примера — лучший способ продемонстрировать электрохимический процесс в гальваническом элементе. Итак, давайте посмотрим на окислительно-восстановительный процесс цинк-медь.
Окислительно-восстановительный процесс (реакция окисления и восстановления) цинка и меди
Два электрода на схеме выше соединены металлической проволокой. Цепь размыкается и замыкается с помощью переключателя. Пористая мембрана, соединяющая две половинки (полуклетки), способствует замыканию цепи. Использование цинково-медного элемента в качестве примера — лучший способ продемонстрировать электрохимический процесс в гальваническом элементе. Итак, давайте посмотрим на окислительно-восстановительный процесс цинк-медь.
(Анод) Полуреакция окисления
Zn(s) → Zn 2+ +2e –
(катод) Восстановительная полуреакция
Cu 2+ +2e – → Cu(s)
Для получения металлической меди цинк теряет электроны, которые захватываются ионами меди. Полная окислительно-восстановительная реакция между цинком и медью:
Полная окислительно-восстановительная реакция между цинком и медью:
Cu 2+ +Zn(s) → Cu(s)+Zn 2+
Наблюдался окислительно-восстановительный процесс в цинковых и медных элементах.
Поскольку цинк занимает более высокое место в ряду активности, чем медь, и окисляется легче, чем медь, цинковый электрод служит анодом в гальваническом элементе.
Zn(s) → Zn 2+ +2e –
Из-за потери металлического цинка цинковый анод постепенно деградирует, а концентрация ионов цинка растет за счет образования электронов на аноде.
Электрон перемещается от цинкового анода к медному электроду по внешнему проводу, где он реагирует с ионами меди в растворе с образованием металлической меди.
Cu 2+ +2e – → Cu(s)
Восстановление происходит на катоде, который представляет собой медный электрод. За счет образования металлической меди масса катода увеличится, а концентрация ионов меди (II) уменьшится.
Движение ионов через мембрану способствует нейтральности клетки.
Элемент Daniel
Электрохимический/гальванический элемент аналогичен элементу Daniel. Он состоит из цинкового стержня, погруженного в раствор сульфата цинка, и медного стержня, погруженного в раствор сульфата меди. Солевой мост связывает два решения вместе. Две полуэлемента цинка и меди будут подвергаться окислению и восстановлению с образованием окислительно-восстановительной пары. Окислительно-восстановительная пара в ячейке Даниэля представляет собой Zn 9.0111 2+ /Zn и Cu 2+ /Cu.
В окислительно-восстановительной паре присутствует вещество, подвергающееся окислению и восстановлению. В окислительно-восстановительной паре вертикальная линия действует как разделитель или интерфейс между окисленной и восстановленной формами. Интерфейс может принимать форму твердого тела или раствора.
Солевой мостик представляет собой U-образную трубку, заполненную раствором хлорида калия или аммиачной селитры. Кипячение раствора с агар-агаром и охлаждение его до желеобразной консистенции затвердевает.
Кипячение раствора с агар-агаром и охлаждение его до желеобразной консистенции затвердевает.
Электрический контакт между растворами устанавливается соляным мостиком. В то же время это помогает в разделении раствора. Медный и цинковый стержни соединены металлической проволокой, амперметром и переключателем. Вся установка Даниэля Селла является иллюстрацией его работы. При выключении переключателя отсутствует реакция и ток не течет. Однако, как только переключатель включен, мы можем увидеть следующее.
Наблюдения Дэниэла Селла
Электронный перенос происходит по металлической проволоке, проходящей между стержнями. Направление тока указано стрелкой. Поток электричества вызывается переходом ионов из одного раствора стакана в другой через солевой мостик. С другой стороны, ток невозможен до тех пор, пока между двумя электродами (медным и цинковым стержнями) не будет разности потенциалов.
На электродах наблюдались полуреакции. В результате анод представляет собой электрод, который подвергается окислению, а катод подвергается восстановлению. Весь потенциал на каждом электроде называется электродным потенциалом.
Весь потенциал на каждом электроде называется электродным потенциалом.
Электродный потенциал
В электрохимии понятие электродного потенциала имеет решающее значение. Это помогает в прогнозировании и контроле направления и интенсивности электрохимического процесса (например, коррозии).
Стандартный потенциал электрода
Разность потенциалов между металлом и его раствором называется потенциалом электрода. Если концентрация веществ, участвующих в электродной реакции, равна единице и реакция происходит при 298 К, электродный потенциал называется стандартным электродным потенциалом (E 0 ).
Стандартный электродный потенциал (E 0 ) газообразного водорода, в случае условности, составляет 0,00 вольт. Окислительно-восстановительная пара является более сильным восстановителем, чем H + /H 2 пара, когда стандартный электродный потенциал отрицателен. С другой стороны, положительный потенциал стандартного электрода предполагает, что окислительно-восстановительная пара является более слабым восстановителем, чем пара H + /H 2 .
Расчет потенциала электрода
Потенциал электрода можно рассчитать по следующей формуле:
E ∘ ячейка = E ∘ – 10 красный 0199 оксид
Полуэлемент с большим восстановительным потенциалом проходит процесс восстановления, а полуэлемент с меньшим восстановительным потенциалом проходит процесс окисления.
Использование электродного потенциала
- Его можно использовать для исследования таких процессов, как коррозия и питтинг, а также для контроля процесса реакции.
- Потенциал электрода можно использовать для выбора материалов и оборудования для контроля реакции.
- С помощью этого инструмента можно прогнозировать коррозию, вызванную электрохимическими и химическими реакциями и процессами.
Примеры вопросов
Вопрос 1. Какие процессы участвуют в окислительно-восстановительных реакциях?
Ответ
Окислительно-восстановительный процесс представляет собой реакцию переноса электронов, которая включает как восстановление, так и окисление, при этом восстановление представляет собой поглощение электронов, а окисление — высвобождение электронов.
Вопрос 2: Как в окислительно-восстановительной реакции образуется электричество?
Ответ
Гальванический элемент, также известный как элемент Вольта, представляет собой электрохимический элемент, который вырабатывает электрическую энергию посредством окислительно-восстановительной реакции или окислительно-восстановительного процесса. Вольтов элемент состоит из двух полуэлементов, которые выполняют процессы восстановления или окисления.
Вопрос 3: Как электролиз является примером окислительно-восстановительной реакции?
Ответ
Электролиз является окислительно-восстановительной реакцией, поскольку восстановление происходит на катоде, а окисление — на аноде, и обе эти реакции протекают одновременно.
Вопрос 4: Что делает процесс редукции?
Ответ
Химические вещества теряют электроны в процессе восстановления, что снижает их степень окисления.

 Для этого в мензурку берут сульфат цинка и опускают в него цинковый стержень. Берется 1М концентрация электролита сульфата цинка. Температура поддерживается на уровне 25℃. Теперь этот цинковый электрод соединяется со стандартным водородным электродом с помощью вольтметра, который будет измерять электродный потенциал ячейки. Также используется солевой мостик, который предотвращает смешивание растворов и поддерживает электрическую нейтральность растворов. В качестве катода используется цинковая полуэлемент, а в качестве анода — водородный полуэлемент.
Для этого в мензурку берут сульфат цинка и опускают в него цинковый стержень. Берется 1М концентрация электролита сульфата цинка. Температура поддерживается на уровне 25℃. Теперь этот цинковый электрод соединяется со стандартным водородным электродом с помощью вольтметра, который будет измерять электродный потенциал ячейки. Также используется солевой мостик, который предотвращает смешивание растворов и поддерживает электрическую нейтральность растворов. В качестве катода используется цинковая полуэлемент, а в качестве анода — водородный полуэлемент. По опыту получается значение E0Cu2+/Cu +0,34В.
По опыту получается значение E0Cu2+/Cu +0,34В.