Содержание
Свойства меди, ее получение и область применения
- Интересное о меди
- Физические свойства
- Химические свойства
- Области применения меди
Свойства меди, которая в природе встречается и в виде достаточно крупных самородков, люди изучили еще в древние времена, когда из этого металла и его сплавов делали посуду, оружие, украшения, различные изделия бытового назначения. Активное использование данного металла на протяжении многих лет обусловлено не только его особыми свойствами, но и простотой обработки. Медь, которая присутствует в руде в виде карбонатов и окислов, достаточно легко восстанавливается, что и научились делать наши древние предки.
Медный слиток
Интересное о меди
Изначально процесс восстановления этого металла выглядел очень примитивно: медную руду просто нагревали на кострах, а затем подвергали резкому охлаждению, что приводило к растрескиванию кусков руды, из которых уже можно было извлекать медь. Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
Дальнейшее развитие такой технологии привело к тому, что в костры начали вдувать воздух: это повышало температуру нагревания руды. Затем нагрев руды стали выполнять в специальных конструкциях, которые и стали первыми прототипами шахтных печей.
О том, что медь используется человечеством с древних времен, свидетельствуют археологические находки, в результате которых были найдены изделия из данного металла. Историками установлено, что первые изделия из меди появились уже в 10 тысячелетии до н.э, а наиболее активно она стала добываться, перерабатываться и использоваться спустя 8–10 тысяч лет. Естественно, предпосылками к такому активному использованию данного металла стали не только относительная простота его получения из руды, но и его уникальные свойства: удельный вес, плотность, магнитные свойства, электрическая, а также удельная проводимость и др.
В наше время уже сложно найти медь в природе в виде самородков, обычно ее добывают из руды, которая подразделяется на следующие виды.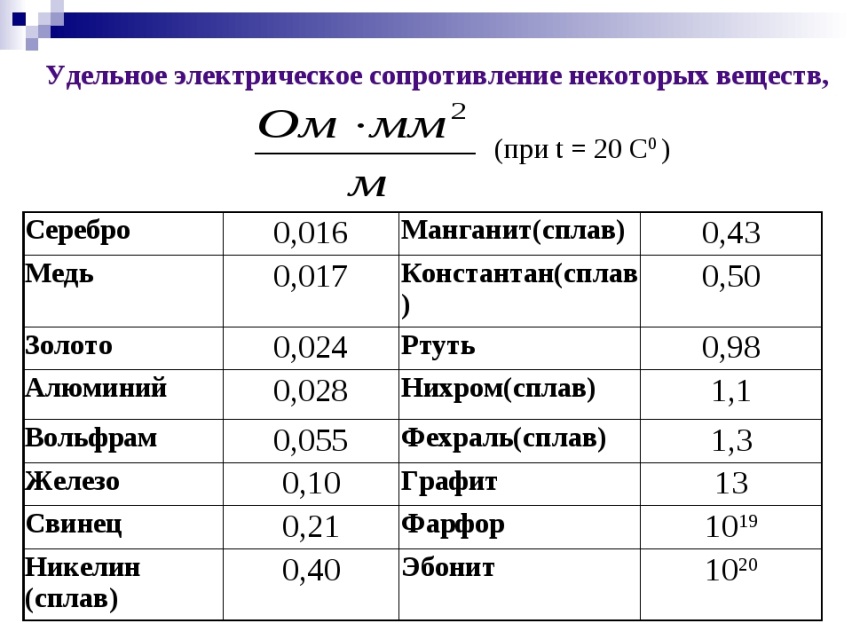
- Борнит — в такой руде медь может содержаться в количестве до 65%.
- Халькозин, который также называют медным блеском. В такой руде меди может содержаться до 80%.
- Медный колчедан, также называемый халькопиритом (содержание до 30%).
- Ковеллин (содержание до 64%).
Халькопирит
Медь также можно извлекать из множества других минералов (малахит, куприт и др.). В них она содержится в разных количествах.
Физические свойства
Медь в чистом виде представляет собой металл, цвет которого может варьироваться от розового до красного оттенка.
Радиус ионов меди, имеющих положительный заряд, может принимать следующие значения:
- если координационный показатель соответствует 6-ти — до 0,091 нм;
- если данный показатель соответствует 2 — до 0,06 нм.
Радиус атома меди составляет 0,128 нм, также он характеризуется сродством к электрону, равном 1,8 эВ. При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
При ионизации атома данная величина может принимать значение от 7,726 до 82,7 эВ.
Медь — это переходный металл, показатель электроотрицательности которого составляет 1,9 единиц по шкале Полинга. Кроме этого, его степень окисления может принимать различные значения. При температурах, находящихся в интервале 20–100 градусов, его теплопроводность составляет 394 Вт/м*К. Электропроводность меди, которую превосходит лишь серебро, находится в интервале 55,5–58 МСм/м.
Так как медь в потенциальном ряду стоит правее водорода, она не может вытеснять этот элемент из воды и различных кислот. Ее кристаллическая решетка имеет кубический гранецентрированный тип, величина ее составляет 0,36150 нм. Плавится медь при температуре 1083 градусов, а температура ее кипения — 26570. Физические свойства меди определяет и ее плотность, которая составляет 8,92 г/см3.
Самородная медь
Из ее механических свойств и физических показателей стоит также отметить следующие:
- термическое линейное расширение — 0,00000017 единиц;
- предел прочности, которому медные изделия соответствуют при растяжении, составляет 22 кгс/мм2;
- твердость меди по шкале Бринелля соответствует значению 35 кгс/мм2;
- удельный вес 8,94 г/см3;
- модуль упругости составляет 132000 Мн/м2;
- значение относительного удлинения равно 60%.

Совершенно уникальными можно считать магнитные свойства данного металла, который является полностью диамагнитным. Именно эти свойства, наряду с физическими параметрами: удельным весом, удельной проводимостью и другими, в полной мере объясняют широкую востребованность данного металла при производстве изделий электротехнического назначения. Похожими свойствами обладает алюминий, который также успешно используется при производстве различной электротехнической продукции: проводов, кабелей и др.
Основную часть характеристик, которыми обладает медь, практически невозможно изменить, за исключением предела прочности. Данное свойство можно улучшить практически в два раза (до 420–450 МН/м2), если осуществить такую технологическую операцию, как наклеп.
Химические свойства
Химические свойства меди определяются тем, какое положение она занимает в таблице Менделеева, где она имеет порядковый номер 29 и располагается в четвертом периоде. Что примечательно, она находится в одной группе с благородными металлами. Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Это лишний раз подтверждает уникальность ее химических свойств, о которых следует рассказать более подробно.
Оттенки медных сплавов
В условиях невысокой влажности медь практически не проявляет химическую активность. Все меняется, если изделие поместить в условия, характеризующиеся высокой влажностью и повышенным содержанием углекислого газа. В таких условиях начинается активное окисление меди: на ее поверхности формируется зеленоватая пленка, состоящая из CuCO3, Cu(OH)2 и различных сернистых соединений. Такая пленка, которая называется патиной, выполняет важную функцию защиты металла от дальнейшего разрушения.
Окисление начинает активно происходить и тогда, когда изделие подвергается нагреву. Если металл нагреть до температуры 375 градусов, то на его поверхности формируется оксид меди, если выше (375-1100 градусов) — то двухслойная окалина.
Медь достаточно легко реагирует с элементами, которые входят в группу галогенов. Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Если металл поместить в пары серы, то он воспламенится. Высокую степень родства он проявляет и к селену. Медь не вступает в реакцию с азотом, углеродом и водородом даже в условиях высоких температур.
Внимание заслуживает взаимодействие оксида меди с различными веществами. Так, при его взаимодействии с серной кислотой образуется сульфат и чистая медь, с бромоводородной и иодоводородной кислотой — бромид и иодид меди.
Иначе выглядят реакции оксида меди с щелочами, в результате которых образуется купрат. Получение меди, при котором металл восстанавливается до свободного состояния, осуществляют при помощи оксида углерода, аммиака, метана и других материалов.
Медь при взаимодействии с раствором солей железа переходит в раствор, при этом железо восстанавливается. Такая реакция используется для того, чтобы снять напыленный медный слой с различных изделий.
Одно- и двухвалентная медь способна создавать комплексные соединения, отличающиеся высокой устойчивостью. Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Такими соединениями являются двойные соли меди и аммиачные смеси. И те и другие нашли широкое применение в различных отраслях промышленности.
Бухты медной проволоки
Области применения меди
Применение меди, как и наиболее схожего с ней по своим свойствам алюминия, хорошо известно — это производство кабельной продукции. Медные провода и кабели, характеризуются невысоким электрическим сопротивлением и особыми магнитными свойствами. Для производства кабельной продукции применяются виды меди, характеризующиеся высокой чистотой. Если в ее состав добавить даже незначительное количество посторонних металлических примесей, к примеру, всего 0,02% алюминия, то электрическая проводимость исходного металла уменьшится на 8–10%.
Невысокий вес меди и ее высокая прочность, а также способность поддаваться различным видам механической обработки — это те свойства, которые позволяют производить из нее трубы, успешно использующиеся для транспортировки газа, горячей и холодной воды, пара. Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Совершенно не случайно именно подобные трубы применяются в составе инженерных коммуникаций жилых и административных зданий в большинстве европейских стран.
Медь, кроме исключительно высокой электропроводности, отличается способностью хорошо проводить тепло. Благодаря этому свойству она успешно используется в составе следующих систем:
- тепловые трубки;
- кулеры, использующиеся для охлаждения элементов персональных компьютеров;
- системы отопления и охлаждения воздуха;
- системы, обеспечивающие перераспределение тепла в различных устройствах (теплообменники).
Металлические конструкции, в которых использованы медные элементы, отличаются не только небольшим весом, но и исключительной декоративностью. Именно это послужило причиной их активного использования в архитектуре, а также для создания различных интерьерных элементов.
Шина электротехническая медная
Характеристика меди — химические и физические свойства
Свойства меди, металла, который встречается и в виде довольно больших самородков, люди изучали еще в древности. Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения. Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности. В этой статье поговорим о свойствах меди и методах ее определения.
Тогда из меди и его сплавов создавали предметы посуды, оружие, украшения, разные предметы бытового назначения. Столь высокая популярность этого металла на протяжении столетий была обусловлена не только его особыми качествами, но и легкостью обработки. Медь, присутствующую в руде в форме карбонатов и окислов, довольно легко восстановить, что и научились делать наши предки в древности. В этой статье поговорим о свойствах меди и методах ее определения.
Физические свойства меди
Чистая медь – это металл, цвет которого варьируется от розового до красного оттенка. Радиус положительно заряженных ионов меди, может принимать такие значения:
- при координационном показателе равном 6-ти — до 0,091 нм
- при координационном показателе равном 2 — до 0,06 нм.
Радиус атома меди равняется 0,128 нм. Величина сродства к электрону достигает 1,8 эВ. Процесс ионизации данного атома увеличивает сродство к электрону от 7,726 до 82,7 эВ.
Медь является переходным металлом. Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга. Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м.
Величина показателя его электроотрицательности достигает 1,9 единиц по шкале Полинга. Стоит отметить, что степень окисления способна принимать разные значения. В условиях температуры в пределах от 20 до 100 градусов, показатель теплопроводности равен 394 Вт/м*К. показатель электропроводности меди, уступает по которому она только серебру, колеблется в пределах 55,5–58 МСм/м.
Поскольку медь в потенциальном ряду расположена справа от водорода, то она не способна вытеснять этот элемент из воды и разного типа кислот. Медь имеет кристаллическую решетку кубического гранецентрированного типа, а ее величина достигает 0,36150 нм. Плавление меди начинается при температуре 1083 градусов, а закипает она при 26570 градусах. Плотность меди определяется ее физическими свойствами и составляет 8,92 г/см3.
Кроме вышеперечисленных, стоит выделить еще и такие физические и механические свойства меди:
- показатель термического линейного расширения составляет 0,00000017 единиц
- показатель предела прочности на растяжение достигает 22 кгс/мм2
- уровень твердости меди по шкале Бринелля равен 35 кгс/мм2
- удельная масса составляет 8,94 г/см3
- показатель упругости равен 132000 Мн/м2
- относительное удлинение равняется 60%.

Абсолютно неповторимыми можно назвать магнитные свойства этого металла, который является полностью диамагнитным. Именно благодаря этим показателям, вместе с физическими свойствами, к примеру, удельным весом и удельной проводимостью, можно объяснить такую широкую популярность этого металла в производстве изделий электротехнической отрасли. Несколько похожие свойства имеет алюминий, который тоже активно применяется в изготовлении различной электротехнической продукции, к примеру, проводов, кабелей и прочего.
Единственная характеристика меди, которую можно изменить — это предел прочности. Этот показатель может быть улучшен почти в два раза (до 420–450 МН/м2), путем специальной технологической операции, называемой наклеп.
Химические свойства меди
Химическая характеристика меди определяется ее расположением в периодической таблице элементов Менделеева, где ей присвоен порядковый номер 29. Находится она в четвертом периоде и в одной группе с благородными металлами. Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Таким образом, лишний раз подтверждается уникальность ее химических качеств, о которых дальше мы расскажем более детально.
Если уровень влажный не высокий, то медь почти не проявляет химической активности. Однако, все кардинально меняется, когда изделия помещают в условия высокой влажности и повышенного содержания углекислого газа. Именно такие условия являются идеальными для начала активного окисления меди. В процессе окисления на поверхности медного предмета создается зеленоватая пленка, которая состоит из CuCO3, Cu(OH)2, а также разных сернистых соединений. Эту пленку называют патиной и она очень важна, поскольку защищает металл от дальнейшего разрушения.
Кроме влажности, процесс окисления запускает и нагревание. В условиях нагревания до температуры 375 градусов, на поверхности предмета формируется оксид меди, если температуру поднять до 1100 градусов, то формируется двухслойная окалина.
Медь довольно легко вступает в реакции с элементами, находящимися в группе галогенов. Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Под действием паров серы металл воспламеняется. Высокий уровень родства медь демонстрирует и к селену. Общие свойства меди не позволяют ей вступить в реакцию с азотом, углеродом и водородом даже при нагревании.
Взаимодействие с кислотами:
- результатом реакции с серной кислотой является сульфат и чистая медь
- с бромоводородной и иодоводородной кислотой соответственно образуются бромид и иодид меди.
А вот взаимодействие со щелочами позволяет получить купрат. Реакции получения меди, при которых происходит восстановление металла до свободного состояния, невозможны без присутствия оксида углерода, аммиака, метана и некоторых других веществ.
Основные свойства меди позволяют ей вступать во взаимодействие с раствором солей железа. Результатом такой реакции является восстановление железа. Эту реакцию применяют для снятия ранее напыленного медного слоя с разных изделий.
Свойства солей меди
Одно- и двухвалентная медь может формировать комплексные соединения, которые выделяются высоким уровнем устойчивости. К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.
К подобным соединениям можно отнести двойные соли меди и аммиачные смеси. Они активно используются в различных отраслях промышленности.
Сульфат меди (II) — CuSO4 в безводном состоянии является белым порошком. При добавлении воды он приобретает синюю окраску. Поэтому его используют для выявления остатков воды в органических жидкостях. Водный раствор сульфата меди отличается сине-голубым оттенком. За этот цвет отвечают гидратированные ионы [Cu(h3O)4]2+, следовательно, такого же цвета и все остальные разбавленные растворы солей меди (II). Исключением являются растворы с содержанием окрашенных анионов.
Из водного раствора сульфат меди кристаллизуется с пятью молекулами воды, путем формирования прозрачных синих кристаллов медного купороса. Полученное соединение используется:
- в процессе электролитического нанесения меди на металлы
- для создания минеральных красок
- как исходный материал для получения прочих соединений меди.
В сельскохозяйственной отрасли разбавленный раствор медного купороса очень популярен для опрыскивания растений и замачивания семян перед посевом, потому что он уничтожает споры вредных грибов.
Хлорид меди (II) — CuCl2. 2h3O. Это легко растворимое в воде соединение темно-зеленого цвета. Высокая концентрация хлорида меди позволяет получить растворы зеленого цвета, а разбавление приводит к окраске в сине-голубой оттенок.
Нитрат меди (II) — Cu(NO3)2.3h3O. Его получают путем растворения меди в азотной кислоте. В процессе нагревания синие кристаллы нитрата меди сначала отдают воду, после чего с легкостью разлагаются, выделяя кислород и бурый диоксид азота, становясь оксидом меди (II).
Гидроксокарбонат меди (II) — (CuOH)2CO3. Данное вещество можно встретить в природе в виде минерала малахита, который отличается красивым изумрудно-зеленым цветом. В лабораторных условиях его можно создать при помощи действия Na2CO3 на растворы солей меди (II).
2CuSO4 + 2Na2CO3 + h3O = (CuOH)2CO3↓ + 2Na2SO4 + CO2↑
Кроме этого, его используют, чтобы получить хлорид меди (II), а также приготовить синие и зеленые минеральные краски.
Ацетат меди (II) — Cu (Ch4COO)2.h3O. Это соединение можно получить, если провести обработку металлической меди или оксида меди (II) раствором уксусной кислоты. Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Чаще всего – это смесь основных солей разного состава и цвета (от зеленого до сине-зеленого).
Помните, что все без исключения соли меди являются ядовитыми. По этой причине, во избежание формирования медных солей, вся медная посуда должна быть изнутри покрыта слоем олова.
Методы определения меди
Определение меди может проводиться такими методами:
- химическими
- количественными
- фотометрическими.
Различные химические составы способны оказывать влияние на расщепление молекул и атомов вещества, следовательно, можно выделить его составные части. Химический метод определения количества заключается в электролитическом методе измерения медной части в сплавах других металлов. Его осуществляют при помощи таких элементов:
- ацетилен
- винная кислота
- водный аммиак
- азотнокислый аммоний
- динатриевая соль
- этиловый спирт
- купризон.
Прежде всего, происходит взвешивание медного состава (навески). После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
После этого ее отправляют в подготовленный раствор реактивов. В этом растворе навеска должна полностью раствориться. Далее весь раствор нужно нагреть, так как в процессе нагревания удаляются окиси азота. Очищенный раствор необходимо разбавить водой и снова нагреть до 40 оС. Теперь массу можно подвергать процессу электролиза. Электроды, погружаемые в раствор создают из платины. Далее включается ток силой 2,2 В и в условиях постоянного помешивания происходит выделение меди.
Контрольным испытанием является повторный процесс электролиза. Необходимо электроды погрузить в раствор, ниже уровня выделенной меди и подключить ток. При правильном проведении первой реакции, во время контрольной процедуры вы не увидите налета металла. Полученный таким образом медный катод нужно промыть водой, не отключая электроток, а потом обработать этиловым спиртом и высушить. После этого катод необходимо взвесить, и сопоставить массу с первоначальным весом. Итак, вы получите удельный вес меди в соединении.
Разработано большое количество видов химических растворов для очистки медных изделий.
Количественное определение массы меди в общем объеме металла целесообразно использовать для сплавов с никелем, бронзой или цинком. При воздействии на вещество происходит осаждение меди и в таком виде ее можно измерить. Осаждение может быть осуществлено неорганическими и органическими элементами. Из неорганических веществ можно выделить:
- тетрароданодиаминхромиат аммония, называемый солью Рейнеке
- тиокарбонат калия способен осадить медь при температуре выше 80 оС
- уксусной кислотой можно осадить медный оксалат.
Из органических веществ применяются:
- оксихинолин-8, который способен осадить медь в комплексе с аммиачным и щелочным раствором. Нагревание осадка приводит к образованию оксида меди
- α-бензоиноксим при участии спирта может осадить металл в форме хлопьев. Реакция невозможна, если в составе есть никель
- йодид калия применяют в нейтральной и кислой среде. Нет смысла использовать его, когда в сплаве имеется железо, сурьма и мышьяк.

Достоинства фотометрического метода заключаются в высоком показателе точности измерения количества меди, а также простота применения. Для реализации этого метода потребуются такие соединения:
- купризон
- диэтилдитиокарбамат свинца.
Смысл фотометрического метода определения меди состоит в фиксации интенсивности цвета материала, прошедшего через концентрированный раствор. Раствор состоит из:
- аммиака
- лимоннокислого раствора аммония
- диэтилдитиокарбамата свинца
- сернокислого натрия.
Вещество, в котором нужно выявить количество меди пропускают через указанные выше растворы. Отметим, что здесь важно соблюдать пропорции. Далее происходит процесс фотометрии.
Определение меди возможно также и в сточных, канализационных, речных, морских водах, и в составе почве. Существует три способа:
- атомноабсорбционный прямой
- атомноабсорбционный при участии хелатообразования
- атомноабсорбционный, подразумевающий использование графитовой печи.

Чтобы определить количество меди в почве самым надежным методом является метод с использованием графитной печи.
Для этого пробу почвы нужно поместить в графитовую трубу, обезводить при помощи сжигания и распылить. Процедура распыления сопряжена с разделением вещества на атомы, с последующей фильтрацией и выделением из них нужного металла. Чтобы оценить пробу грунта можно воспользоваться любым фотометрическим методом определения меди.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21742
Цели обучения
- Понять основные свойства, отличающие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которая не может быть разделена на более простые вещества или построена из более простых веществ любым обычным химическим или физическим методом. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные получены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их положением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Неблестящий, различных цветов |
| Ковкий и пластичный (гибкий) в виде твердых тел | Хрупкий, твердый или мягкий |
| Проведение тепла и электричества | Плохие проводники |
| Оксиды металлов основные, ионные | Оксиды неметаллов кислотные, ковалентные |
| Форма катионов в водном растворе | Образуют анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, образующие положительные ионы за счет потери электронов в ходе химических реакций, называются металлами.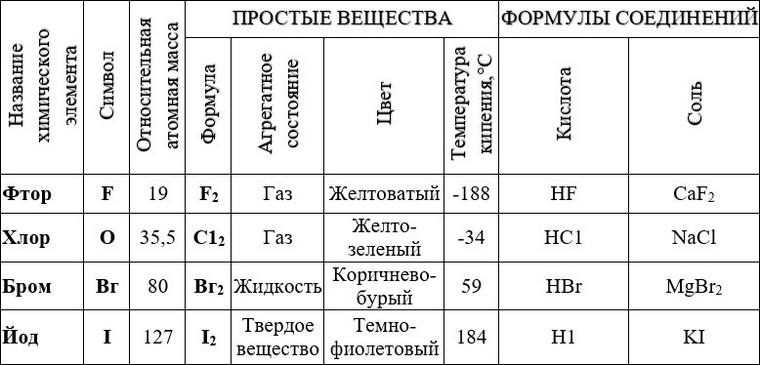 Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать звук и являются отличными проводниками тепла и электричества. Металлы в нормальных условиях являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, ковкие, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы являются твердыми при комнатной температуре, за исключением ртути, которая при комнатной температуре находится в жидком состоянии (галлий жидкий в жаркие дни).
- Блеск : Металлы обладают способностью отражать свет от своей поверхности и могут полироваться, например, золото, серебро и медь.
- Ковкость: Металлы обладают способностью выдерживать удары молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле. - Пластичность: Металлы можно вытягивать в проволоку. Например, 100 г серебра можно вытянуть в тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и могут резаться ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на самой внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь являются двумя лучшими проводниками тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые. Иридий и осмий имеют самую высокую плотность, тогда как литий имеет самую низкую плотность.

- Температуры плавления и кипения : Металлы имеют высокие температуры плавления и кипения. У вольфрама самые высокие температуры плавления и кипения, а у ртути самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы представляют собой электроположительные элементы, которые обычно образуют основные или амфотерные оксиды с кислородом. Другие химические свойства включают:
- Электроположительный характер : Металлы, как правило, имеют низкую энергию ионизации, и обычно теряют электроны (т.е. окисляются ), когда подвергаются химическим реакциям Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в с подоболочкой)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 9{-}} \label{1.
 3} \]
3} \]Соединения металлов с неметаллами, как правило, ионные по своей природе. Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\[\ce{Na2O(s) + h3O(l) \rightarrow 2NaOH(aq)}\label{1.4} \]
\[\ce{CaO(s) + h3O(l) \rightarrow Ca(OH)2(aq)} \label{1.5} \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислоты 9{2-}\), таким образом, \(Al_2O_3\).
Пример \(\PageIndex{2}\)
Как вы думаете, будет ли он твердым, жидким или газообразным при комнатной температуре?
Растворы
Оксиды металлов обычно твердые при комнатной температуре
Пример \(\PageIndex{3}\)
Напишите сбалансированное химическое уравнение для реакции оксида алюминия с азотной кислотой:
Раствор
0
0 Оксид металла + кислота -> соль + вода
\[\ce{Al2O3(s) + 6HNO3(aq) \rightarrow 2Al(NO3)3(aq) + 3h3O(l)} \nonumber \]
Неметаллы
Элементы, которые имеют тенденцию приобретать электроны с образованием анионов во время химических реакций, называются неметаллами.
 Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газообразное (кислород) и твердое тело (углерод). Только бром существует в виде жидкости при комнатной температуре.
- Нековкий и пластичный : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Проводимость : Плохие проводники тепла и электричества.
- Блеск: Не имеют металлического блеска и не отражают свет.
- Точки плавления и кипения : Точки плавления неметаллов обычно ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \(\ce{h3(g)}\), \(\ce{N2(g)}\), \(\ce{O2(g) }\), \(\ce{F2(g)}\), \(\ce{Cl2(g)}\), \(\ce{Br2(l)}\), \(\ce{I2( с)}\).

Химические свойства неметаллов
Неметаллы имеют тенденцию приобретать или делиться электронами с другими атомами. Они электроотрицательны по характеру. Неметаллы, реагируя с металлами, имеют тенденцию приобретать электроны (обычно приобретают электронную конфигурацию благородного газа) и становятся анионы:
\[\ce{3Br2(l) + 2Al(s) \rightarrow 2AlBr3(s)} \nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами. Обычно они образуют кислотные или нейтральные оксиды с кислородом, которые растворяются в воде с образованием кислот:
\[\ce{CO2(g) + h3O(l)} \rightarrow \underset{\text{угольная кислота}}{\ce {h3CO3(aq)}} \nonumber \]
Как вы знаете, газированная вода слабокислая (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\[\ce{CO2(g) + 2NaOH(aq) \rightarrow Na2CO3(aq) + h3O(l)} \nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.
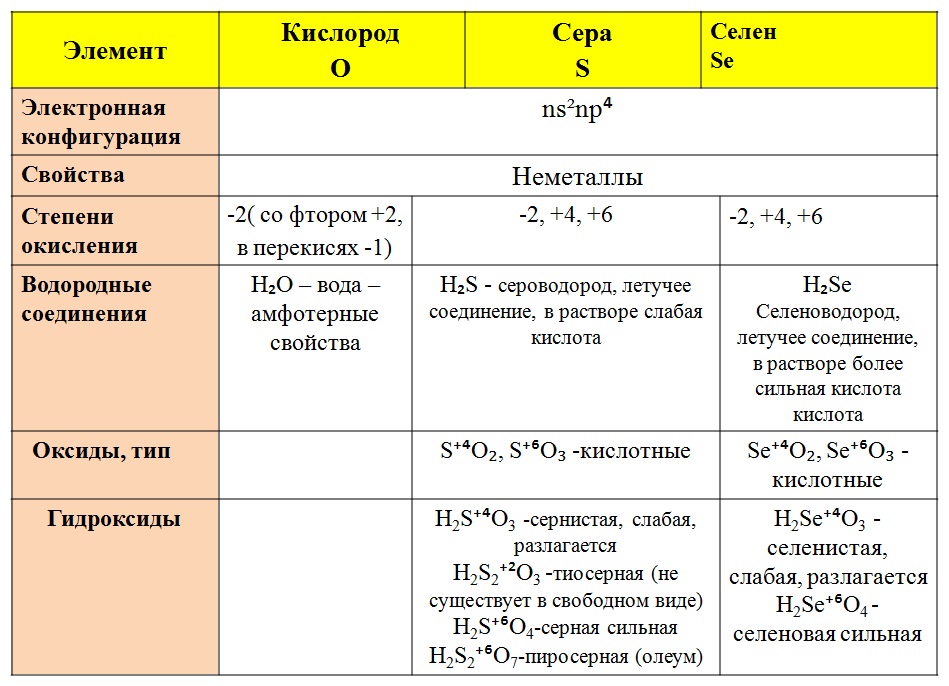
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.Таблица \(\PageIndex{2}\): Элементы, разделенные на металлы, неметаллы и металлоиды. Металлы Неметаллы Металлоиды Золото Кислород Кремний Серебро Углерод Бор Медь Водород Мышьяк Железо Азот Сурьма Меркурий Сера Германий Цинк Фосфор Тенденции металлических и неметаллических свойств
Металлический характер наиболее силен для элементов в крайней левой части периодической таблицы и имеет тенденцию к уменьшению по мере продвижения вправо в любой период (неметаллический характер увеличивается с увеличением электроотрицательности и ионизации).
 энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.Неметаллический характер увеличивается снизу вверх и слева направо с наибольшим количеством неметаллических элементов в правом верхнем углу. металлический характер демонстрирует противоположную тенденцию: самый металлический элемент находится внизу слева.
Участники и ссылки
Майк Блабер (Университет штата Флорида)
Бинод Шреста (Университет Лотарингии)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.

- Теги
- сплав
- металл
- металлический символ
- металлоид
- неметалл
Части периодической таблицы
Когда элементы объединяются в соединения, существует два основных типа
склеивание, которое может возникнуть. Ионные связи образуются при наличии
перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы
обмениваются электронами для образования нейтральных молекул. В общем
металл и неметаллы объединяются, образуя ионные соединения , а
неметаллы соединяются с другими неметаллами, образуя ковалентные соединения
(молекулы).
Поскольку металлы находятся левее в таблице Менделеева, они
имеют низкую энергию ионизации
и низкое сродство к электрону,
поэтому они относительно легко теряют электроны и с трудом приобретают их.
У них также относительно мало валентных электронов, и они могут образовывать ионы (и
тем самым удовлетворяют правилу октета) легче, теряя свою валентность
электронов с образованием положительно заряженных катионов .- Металлы основной группы обычно образуют заряды, такие же, как
номер их группы: то есть металлы группы 1А, такие как
натрий и калий образуют заряды +1, металлы группы 2А, такие как
магний и кальций образуют заряды 2+, а металлы группы 3А, такие как
так как алюминий образует заряды 3+. - Металлы, которые следуют за переходными металлами (в сторону
нижняя часть групп 4A и 5A) могут потерять либо крайние , либо
и p электронов, образующих заряды, идентичные своим
номер группы, или они могут потерять только p электронов, в то время как
сохраняя свои два s электронов, образуя заряды, которые являются
номер группы минус два. Другими словами, олово и свинец в Группе
Другими словами, олово и свинец в Группе
4А может образовывать 4+ или 2+ заряда, тогда как висмут из группы 5А может
образуют заряд 5+ или 3+. - Переходные металлы обычно способны образовывать 2+ заряда
потеряв свою валентность с электронов, но может и потерять
электроны со своих d орбиталей, чтобы сформировать другие заряды.
Большинство переходных металлов могут образовывать более одного возможного заряда.
в ионных соединениях.
Неметаллы находятся правее в периодической таблице и имеют
высокая энергия ионизации и
высокое сродство к электрону, поэтому
они относительно легко приобретают электроны и с трудом их теряют.
Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы
которые имеют заряды, равные номеру группы минус восемь. То есть,
То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.Ионные соединения удерживаются вместе в правильном порядке, называемом кристалл
решетки силами притяжения между противоположно заряженными
катионы и анионы. Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (За
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054°C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
Когда неметаллы объединяются с другими неметаллами, они, как правило, разделяют
электроны в ковалентных связях вместо образования ионов, что приводит к
образование нейтральных молекул. (Имейте в виду, что поскольку водород
тоже неметалл, соединение водорода с другим неметаллом
также будет образовывать ковалентную связь.) Молекулярные соединения могут быть
газами, жидкостями или твердыми веществами с низкой температурой плавления и включают широкий спектр
веществ. (См.
Галерея молекул для
примеры.)Когда металлы соединяются друг с другом, связь обычно описывается
как металлическая связка (вы могли догадаться). В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы.


 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, который покроет футбольное поле.
 3} \]
3} \] Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Это электроотрицательные элементы с высокими энергиями ионизации. Они неблестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
 Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится.
Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, при определенных условиях могут вести себя как электрические проводники, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но имеет не ковкий и не пластичный (это хрупкий — свойство некоторых неметаллов). Это гораздо худший проводник тепла и электричества, чем металлы. Физические свойства металлоидов имеют тенденцию быть металлическими, но их химические свойства имеют тенденцию быть неметаллическими. Степень окисления элемента этой группы может составлять от +5 до -2, в зависимости от группы, в которой он находится. энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.
энергетические ценности). Внутри любой группы элементов (столбцов) металлический характер возрастает сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается для переходных металлов.

 Другими словами, олово и свинец в Группе
Другими словами, олово и свинец в Группе То есть,
То есть,