Тема 1. Предмет химии. Вещества. Химия 8 класс характерные свойства меди и серы
Сера — урок. Химия, 8–9 класс.
Химический элемент
Сера — химический элемент № \(16\). Она расположена в VIА группе третьем периоде Периодической системы.
S16+16)2e)8e)6e
На внешнем слое атома серы содержатся шесть валентных электронов. До завершения внешнего слоя не хватает двух электронов. Поэтому в соединениях с металлами и водородом сера проявляет степень окисления \(–2\). При взаимодействии с более элетроотрицательными элементами (кислородом, галогенами) сера образует соединения, в которых её степень окисления положительная (\(+4\) или \(+6\)).
В земной коре сера встречается в самородном виде или в виде минералов и горных пород: (пирит — FeS2, цинковая обманка — ZnS, свинцовый блеск — PbS, гипс — CaSO4⋅2h3O, глауберова соль — Na2SO4⋅10h3O).

Самородная сера

Свинцовый блеск
Сера относится к макроэлементам живых организмов. Она содержится в белках. Особенно много серы в белках волос, рогов, шерсти. Входит она также в состав некоторых витаминов и гормонов.
Простое вещество
Сера образует несколько аллотропных модификаций. Обычно мы имеем дело с кристаллической серой, которая состоит из восьмиатомных циклических молекул.
Молекулы образуют кристаллы разного строения, и поэтому существуют аллотропные видоизменения: ромбическая и моноклинная сера. Обе модификации представляют собой жёлтые легкоплавкие вещества. Температуры плавления их несколько различаются (\(+112,8\) °С и \(+119,3\) °С).

При нагревании сера плавится, превращается в лёгкую жидкость, а затем начинает темнеть и становиться вязкой. Образуется пластическая сера, состоящая из длинных линейных молекул.
В воде сера не растворяется и ею не смачивается. Поэтому порошок серы не тонет в воде, несмотря на более высокую плотность (\(2,07\) г/см³). Такое явление называется флотацией.
Подожжённая сера реагирует с кислородом, и образуется сернистый газ. Сера в этой реакции — восстановитель.
S0+O20=tS+4O2−2.
Окислительные свойства сера проявляет в реакциях с металлами и водородом.
С активными металлами и ртутью реагирует при комнатной температуре:
Hg0+S0=Hg+2S−2.
При нагревании сера вступает в реакцию с большинством металлов — железом, алюминием, цинком и другими, кроме золота и платины.
2Al0+3S0=tAl+32S−23.
В реакциях с металлами образуются сульфиды.
При повышенной температуре сера реагирует с водородом. Образуется сероводород:
h30+S0=th3+1S−2.
Применение серы
- Используется в химической промышленности для производства серной кислоты;
- находит применение в сельском хозяйстве для обеззараживания помещений;
- входит в состав некоторых мазей;
- используется в производстве спичек и бумаги;
- с её помощью каучук превращают в резину;
- входит в состав взрывчатых веществ.
Тема 1. Предмет химии. Вещества. Рабочая тетрадь по химии Габриелян Сладков 8 класс
Главная › 8 класс › Химия › Рабочая тетрадь по химии Габриелян Сладков 8 классЧасть I
1. Химия изучает:
- вещества- их строение- их свойства
2. Вещество – это то, из чего сделаны физические тела.
3. Признаки, по которым одни вещества отличаются от других, - это свойства, например: водород – газ, лёгкий, без запаха, цвета, вкуса.
4. Существует взаимосвязь: свойство вещества – применение вещества.Например, для стекла:
1) прозрачное – используют в качестве оконных стёкол2) изготовление хрусталя3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определённый вид атомов называют химическим элементом. Всего известно 119 химических элементов.
6. Химический элемент существует в трёх формах.
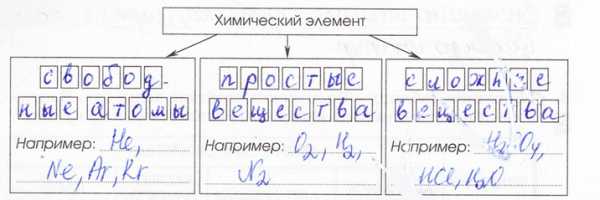
Простые вещества – это вещества, образованные атомами одного и того же химического элемента.
Вещества, образованные из двух и более химических элементов, называются сложными.
Часть II
1. Установите соответствие между понятием и примером.

Ответ:
А – 1, 3, 5.Б – 2, 4, 6.
2. Вычеркните «лишнее»:
Колба, пробирка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда, сделанная из стекла.
3. Составьте задание, аналогичное предыдущему.
Вычеркнуть лишнее: пипетка, пробирка, резиновая груша, фильтровальная бумага, мерная колба, мензурка.
4. Заполните таблицу «Физические свойства веществ». В качестве примеров опишите вещества, используемые на кухне.
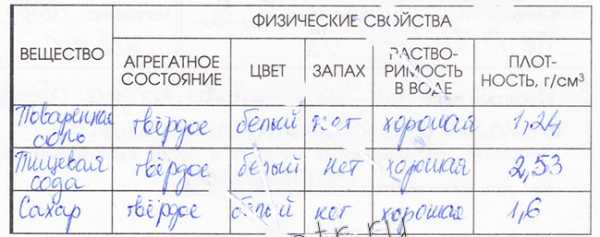
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая3) бесцветная4) прозрачная
6. Заполните таблицу «Сравнение физических свойств газообразных веществ».

7. Заполните таблицу «Сравнение физических свойств меди и железа».
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).
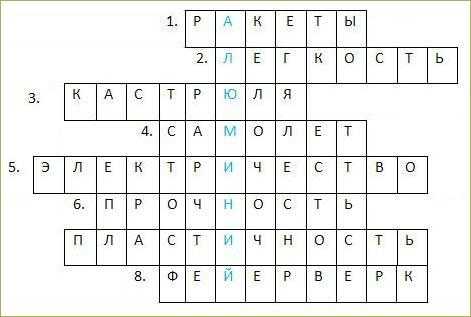
1. Аппарат, при производстве которого используются сплавы алюминия.2. Физическое свойство алюминия, которое позволяет использовать его сплавы в самолетостроении.3. Емкость для приготовления пищи методом варки, сделанная из алюминия.4. Воздушное судно, предназначенное для полетов в атмосфере, при производстве которого используются сплавы алюминия.5. Благодаря теплопроводности и способности проводить это, алюминий используется для изготовления электрических проводов.6. Физическое свойство алюминия, которое наряду с легкостью, позволяет использовать его сплавы в ракето- и самолетостроении.7. Это физическое свойство металла позволяет делать из алюминия фольгу.8. Свойство алюминия гореть ослепительным пламенем применяется для получения этих декоративных праздничных огней.
9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируйте её, используя слова и рисунки моделей частиц.
3) Вещество – это то, из чего состоят физические тела.1) Атом – это химически неделимая частица.2) Молекула – это наименьшая частица вещества, обладающая его свойствами.
10. Выражения, являющиеся синонимами понятия «химический элемент».
1) вид одинаковых атомов3) вид атомов, имеющих одинаковые свойства.
11. Установите соответствие между формой существования химического элемента и рисунками моделей частиц.

Ответ:
А-2; Б-1, 4; В-3, 5.
12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.
2) сера входит в состав молекул серной кислоты - Х 3) некоторые белки содержат серу - Л5) молекулы сероводорода образованы серой и водородом - О7) молекулы серы состоят из 8 атомов - Р
В тех фразах, которые вы не выбрали, речь идёт о сере как о простом веществе.
Тема 27. Химические уравнения.Тема 28. Расчёты по химическим уравнениям.dourokov.ru
Сера
Электронное строение атома.Сера относится к элементу, находящемуся в VI-й группе главной подгруппы периодической системы Д.И.Менделеева. Его электронная конфигурация атома 1s22s22p63s23p4.
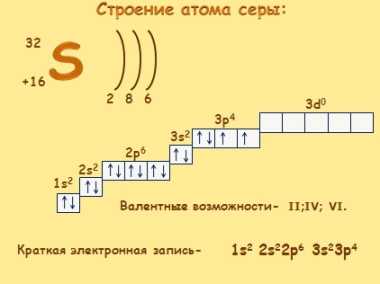
Нахождение в природе.
В обычных условиях сера представляет собой лёгкие, жёлтые кристаллы, нерастворимые в воде, но хорошо растворимые в сероуглероде. Кристаллическая решётка серы – молекулярная, в узлах которой находится циклическая молекула S8. Сера имеет ряд аллотропных модификаций.
Вышеуказанная форма серы называется моноклинной серой, при охлаждении которой переходит в устойчивые кристаллы ромбической серы.
Если расплавленную серу влить в холодную воду, то образуется ещё одна аллотропная модификация – пластическая сера. Температура кипения серы +445оС. В парах расплавленной серы содержатся молекулы S8, S6, S4, S2.
В природе сера встречается в трёх формах:

1) Самородная сера
2) Сульфидная сера:
FeS2 – серный или железный колчедан, пирит.CuS – медный блеск.CuFeS2 – халькопирит или медный колчедан.PbS – свинцовый блеск.ZnS – цинковая обманка.HgS – киноварь.
3) Сульфатная сера:
CaSO4x2h3O – гипс.CaSO4xh3O – алебастр.Na2SO4x10h3O – глауберова соль.MgSO4x 7h3O – горькая соль.
Химические свойства.
1. Свойства простого вещества.
Сера может проявлять как окислительные, так и восстановительные свойства. Окислителем сера является в первую очередь по отношению к металлам:
S + 2Na = Na2SS + Ca = CaS3S +2Al = Al2S3
В качестве окислителя сера проявляет свои свойства и при взаимодействии с неметаллами:
S + h3 = h3S3S + 2P = P2S3 2S + C = CS2
Однако с неметаллами, имеющими электроотрицательность бóльшую, чем у серы, она реагирует в качестве восстановителя:
S +3F2 = SF6S + Cl2 = SCl2
Сера реагирует со сложными веществами, как правило, окислителями. Причём азотная кислота окисляет её до серной кислоты:
S + 6HNO3 = h3SO4 + 6NO2 + 2h3O
Другие окислители окисляют серу до степени окисления (+4):
S + 2h3SO4 = 3SO2 + 2h3O3S + 2KClO3 = 3SO2 + 2KCl
По механизму реакции ДИСПРОПОРЦИОНИРОВАНИЯ сера реагирует с щелочами. В процессе этой реакции образуются соединения серы (-2) и (+4):
3S + 6KOH = K2SO3 + 2K2S + 3h3O
Непосредственно с водой сера не реагирует, однако при нагревании подвергается дисмутации в атмосфере водяного пара.
Сера может быть получена в процессе реакций:
SO2 + 2CO = S + 2CO2Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
2. Соединения серы (-2).
У серы в степени окисления (-2) соединения называются сульфидами. Это бинарные соединения, в которых одним из элементов является металл: Na2S, ZnS, Al2S3, PbS2 и др.
Соединение серы (-2) с водородом называется сероводород – h3S. Сероводород – газ без цвета, неприятного запаха, тяжелее воздуха, очень ядовит, мало растворим в воде. Сероводород можно получить различными способами. Oбычно, в лаборатории, сероводород получают, действуя на сульфиды сильными кислотами:
FeS + 2HCl = FeCl2 + h3S
Для сероводорода и его солей характерны восстановительные свойства:
h3S + SO2 = 3S + 2h3O
В указанной реакции сера образуется по механизму конпропорционирования ( из двух атомов серы, имеющих различные степени окисления (-2) и (+4) образуется соединение серы со степенью окисления (0).
SO2 + 2CO = S + 2CO2Na2S2O3 + 2HCl = S + SO2 + 2NaCl + h3O
В лаборатории сероводород получают:
FeS + 2HCl = FeCl2 + h3S
При сгорании в кислороде он образует различные продукты:
2h3S + O2 = 2h3O + 2S (недостаток кислорода)2h3S + 3O2 = 2h3O + 2SO2 (избыток кислорода)
Cероводород легко окисляется галогенами, оксидом серы, хлоридом железа (III):
h3S + Cl2 = 2HCl + S2h3S + SO2 = 2h3O + 3Sh3S + 2FeCl3 = 2FeCl2 + S + 2HCl
На воздухе сероводород окисляет серебро, чем и объясняется почернение серебряных изделий со временем:
2h3S + 4Ag + O2 = 2Ag2S + 2h3O
Водные растворы сероводорода являются слабой кислотой. Диссоциирует в две стадии, образует два типа солей: гидросульфиды и сульфиды:
h3S ↔ HS-1 + H+HS-1 ↔ H+ + S-2
Сульфиды большинства металлов нерастворимы и имеют различную окраску. Это является фактором, благодаря которому можно распознавать те или иные катионы в растворах:
Чёрные – HgS, Ag2S, PbS, CuS, FeS, NiS;
Коричневые – SnS, Bi2S3;
Оранжевые – Sb2S3, Sb2S5;
Жёлтые – As2S3, As2S5, SnS2, CdS;
Розовые - MnS
Белые – ZnS, Al2S3, BaS, CaS;
Cульфиды в водной среде проявляют восстановительные свойства, обычно окисляясь до серы: 
3h3S + 2KMnO4 = 3S + 2MnO2 + 2KOH + 2h3O
h3S + 2HNO3 = S + 2NO2 + 2h3O3h3S + 2FeCl3 = S + FeS + 6HClh3S + J2 = S + 2HJ
При взаимодействии с более сильными окислителями сульфиды окисляются до соединений со степенью окисления (+6):
h3S + 4h3O + Cl2 = h3SO4 + 8HClMnS + 3HNO3 = MnSO4 + 8NO2 + 4h3OPbS + 4h3O2 = PbSO4 + 4h3O
3. Соединение серы (+4).
Из соединений серы со степенью окисления (+4) наиболее характерны оксид серы (SO2) или сернистый газ и сернистая кислота (h3SO3) и её соли. Оксид серы представляет собой газ с резким запахом, бесцветный, тяжелее воздуха, хорошо растворяется в воде. Получают при неполном горении сероводорода или при окислении сульфидов. В лаборатории его получают при взаимодействии меди с концентрированной серной кислотой:
Cu + h3SO4 = CuSO4 + SO2 + h3ONa2SO3 + 2HCl = 2NaCl + SO2 + h3O
Для оксида серы (+4) характерны как окислительные:
SO2 + h3S = 3S + 2h3O
так и восстановительные свойства:
2SO2 + O2 = 2SO3 2SO2 + 2h3O + Br2 = h3SO4 + 2HBrSO2 + Cl2 = SO2Cl2SO2 + 2HNO3 = h3SO4 + 2NO2
Оксид серы (+4) – типичный кислотный оксид, он реагирует с основания-ми с образованием солей, с водой образует сернистую кислоту:
SO2 + 2NaOH = Na2SO4 + h3OSO2 + h3O = h3SO3
Сернистая кислота – слабая кислота, диссоциирует в две стадии, образует два типа солей: кислые - гидросульфитыи средние -сульфиты :
h3SO3 ↔ HSO3- + H+HSO3-↔ SO32- + H+
Соли сернистой кислоты неустойчивы, разлагаются при действии более сильных кислот и при нагревании:
Na2SO3 + HNO3 = 2NaNO3 + SO2 + h3O K2SO3 = K2O + SO2
В растворах сульфит-ионы проявляют чаще всего восстановительные свойства:
Na2SO3 + 2KOH + KMnO4 = Na2SO4 + 2K2MnO4 + h3O
4. Соединения серы (+6)
Из соединений серы в степени окисления (+6) наиболее характерны оксид серы - SO3 или серный ангидрид и h3SO4 - cерная кислота. SO3 - бесцветный газ с характерным резким запахом, тяжелее воздуха, хорошо растворим в воде.
Оксид серы (+6) получают окислением оксида серы (+4) в присутствии катализатора и высоком давлении:
2SO2 + O2 = 2SO3SO3 + h3O = h3SO4
Оксид серы (+6) является сильным окислителем:
SO3 + 2KJ = J2 + K2SO3SO3 + h3S = 4SO2 + h3O25SO3 + 2P = P2O5 + 5SO2
Кроме того, он проявляет кислотные свойства, так как является кислотным оксидом:
SO3 + ZnO = ZnSO4SO3 + KOH = KHSO4SO3 + 2KOH = K2SO4 + h3O
Серная кислота, её соли.
Серная кислота представляет собой бесцветную маслообразную жидкость, максимальная плотность которой 1,84 г/мл. Исходным сырьём для получения серной кислоты является серный колчедан или пирит:
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Далее, под воздействием катализатора - V2O5 происходит окисление оксида серы (+4) до оксида серы (+6):
2SO2 + O2 = 2SO3
Полученная безводная серная кислота называется олеум, т.к. в действительности, оксид серы (+4) растворяют в 98%-ной серной кислоте.
SO3 + h3O = h3SO4
Концентрированная серная кислота проявляет сильное водоотнимающее действие. Это свойство положено в основу многочисленных химических процессов, особенно в органической химии (получение спиртов, простых и сложных эфиров, альдегидов и т.д.). Концентрированная серная кислота является сильным окислителем. Например, при взаимодействии с просты-ми веществами, она окисляет их до кислот или оксидов:
2P + 5h3SO4 = 2h4PO4 + 5SO2 + 2h3OC + h3SO4 = 2SO2 + CO2 + 2h3O
При обычной температуре она окисляет галогенводороды и сероводород:
h3SO4 + 8HJ = 4J2 + h3S + 4h3Oh3SO4 + 2HBr = Br2 + SO2 + 2h3O h3SO4 + h3S = S + SO2 + 2h3O
Серная кислота термически устойчива и не летуча, поэтому способна вытеснять другие кислоты из их солей:
h3SO4 + KClO3 = KHSO4 + HClO4
Cерная кислота диссоциирует в две стадии, образует два типа солей:
кислые – гидросульфатыи средние – сульфаты:
h3SO4 ↔ HSO4- + H+
HSO4- ↔ SO42- + H+
Серная кислота проявляет свойства, характерные для остальных кислот: она реагирует с металлами, оксидами металлов, гидроксидами, солями слабых кислот. Качественной реакцией на сульфат-ионы в растворах является взаимодействие её с ионами бария Ва2+, в результате чего выпадает белый осадок:
Ba2+ + SO42- = BaSO4
При прокаливании сульфаты разлагаются на различные классы соединений в зависимости от металла, входящего в состав соли. Сульфаты щелочных металлов плавятся без разложения. Сульфаты металлов средней активности разлагаются на соответствующие оксиды:
ZnSO4 = ZnO + SO3
Сульфат железа (II) разлагается по механизму внутримолекулярной ОВР:
4FeSO4 = 2Fe2O3 + 4SO2 + O2
Сульфаты наиболее тяжёлых или малоактивных металлов разлагаются с образованием простых веществ – металла и кислорода:
HgSO4 = Hg + SO2 + O2
Некоторые сульфаты, являясь окислителями, реагируют с простыми веществами:
CaSO4 + C = CaO + SO2 + COBaSO4 + 4C = BaS + 4CO
Большое значение в промышленности, лабораторных исследованиях имеет взаимодействие серной кислоты с металлами. Эта тема заслуживает особого внимания, т.к. образуются различные продукты реакции в зависимости от положения реагируемого металла в ряду напряжений, степени разбавленности кислоты, температуры, катализаторов.
Разбавленная серная кислота с металлами, стоящими в ряду активности до водорода, при обычной температуре образует соль и водород:
h3SO4 + Zn = ZnSO4 + h3
Разбавленная кислота не реагирует с металлами, стоящими в ряду активности после водорода (медь, серебро, ртуть), но концентрированная кислота образует с ними соль, оксид серы (+4) и воду:
h3SO4 + Cu = CuSO4 + SO2 + h3O
Такие же продукты реакции концентрированная серная кислота образует при взаимодействии с металлами, стоящими в ряду активности до водорода:
2h3SO4 + Zn = ZnSO4 + SO2 + 2h3O
Однако, концентрированная серная кислота реагирует не со всеми металлами. Алюминий, железо, свинец и олово она пассивирует с образованием на их поверхности тонких оксидных плёнок, предотвращающих дальнейшее растворение металла:
h3SO4 + Al = Al2O3 + SO2 + h3O
Активные щелочные и щелочноземельные металлы могут образовывать с разбавленной кислотой не только водород. Например, магний с очень разбавленной серной кислотой на холоду образует соль, серу и воду:
h3SO4 + Mg = MgSO4 + S + h3O
Натрий при обычной температуре с очень разбавленной серной кислотой образует соль, серу и воду:
h3SO4 + Na = Na2SO4 + S + h3O,
а при охлаждении образует сероводород:
h3SO4 + Na = Na2SO4 + Н2S + h3O
Соли серной кислоты находят большое применение в промышленности, сельском хозяйстве, в быту.
Na2SO4x 10h3O – глауберова соль, применяется в медицине в качестве слабительного,(Nh5)2SO4 – азотное удобрение для сельского хозяйства,CaSO4 – безводный гипс, применяется в строительстве.CaSO4x 2h3O – водный гипс,2CaSO4 xh3O – алебастр, продукт получения гипса,MgSO4 – горькая соль, применяется в медицине как слабительное и гипотензивное средство,BaSO4 – баритова каша, средство, применяемое как рентгеноконтрастное средство.CuSO4 x 5h3O – медный купорос, применяется в строительстве,FeSO4x 7h3O – железный купорос,ZnSO4 x 7h3O – цинковый купорос,KАl(SO4)2 x 12h3O – алюмокалиевые квасцы.
© blog.tutoronline.ru, при полном или частичном копировании материала ссылка на первоисточник обязательна.
blog.tutoronline.ru
Химия 8 класс | Социальная сеть работников образования
Урок1
Тема урока: Предмет химии. Ее истоки.
Чему бы жизнь нас не учила,
Но сердце верит в чудеса…
Ф. Тютчев
Цель урока: дать представление о химии, как о науке, ее задачах, целях, рассказать об истории возникновения химии. Урок-лекция, коллективная форма работы.
1.Организационный момент
-знакомство,
- учебник, задачник
-тетради ( 96листов, 2тетради по 12 листов,1 половинку)
-требования
(оценка, правила выживания в химической лаборатории)
2.Изучение нового материала
1) А)Что же такое химия?
Химия – наука, изучающая формы, структуру. Свойства веществ, а также законы, по которым происходят превращения одних веществ в другие, вероятность, энергетику,скорость и механизмы этих прцессов. Таким образом, объектом изучения химии становится вся вселенная, а равно и новые вещества, получаемые искусственным путем.
Б)Давно ли появилось слово «химия»?
Слово “химия” возникло, видимо, еще за 3000 лет до новой эры, если судить по тексту клинописных таблиц, найденных при раскопках древних городов Египта и Малой Азии. Установить происхождение этого слова очень трудно. Алхимик 4в. н. Э. Зосима из Панополиса в Греции считал, что слово “химия” произошло от слова “Хемес”- сокращенного имени Гермеса Трисмегиста- лнгендарного мудреца, получившего знания в виде божественного откровения. По преданию, воины Александра Македонского нашли могилу Гермеса Трисмегиста с каменной плитой , названной “Изумрудной Скрижалью Гермеса”. На ней была надпись, в которой будто 6ы сообщалось о способе получения удивительного вещества-“философского камня”. Некоторые историки считают, что слово “химия” связано с древнегреческим “хима”, означающим искусство выплавки металлов. Свида, византийский лексикограф, живший в 10-11в, понимал под химией искусственное приготовление золота и серебра. На древнекитайском языке “ким” означало “золото”.
Чаще всего слово “химия” связывают с названием Древнего Египта- “Хеми”,так как жрецы этой страны были выдающимися химиками. Поэтому по смыслу слово “химия” является тождественным выражению “египетская наука”. В 3в. до н.э. в Александрии уже была основана Академия наук , и священному искусству- химии- было отведено даже особое здание, храм Сераписа. Современное название “химия” производится от позднелатинскогослова Chimia и является интернациональным словом: немецкое chemie, французское chimie, английское chemistry
В)Алхимия- древнейший прообраз химии.
Понятие «алхимия» было введено арабами, которые прибавили к греко-египетскому названию «химия» арабскую приставку «ал». Алхимия- древнейший прообраз химии. Алхимия была связана со всеми областями химических ремесел. Людей, занимавшихся алхимией называли алхимиками. Многие алхимики в течение более тысячи лет с поразительным упорством пытались получить золото или серебро из неблагородных металлов с помощью «философского камня»- гипотетического вещества, либо «алкагеста»- никем никогда неполученного универсального растворителя. Занимались «алхимики» и поисками «эликсира жизни»- жидкости, которая должна дать людям возможность сохранять вечную молодость. Алхимией занимались не только ученые, но и всякого рода мошенники и неудачливые пророки. В 18 веке в ходу было такое четверостишие:
Алхимию постигнуть каждый рад:
Безмозглый идиот, старик и юный фат,
Портной, старуха, юркий адвокат,
Монах плешивый, пастырь и солдат.
Постепенно алхимия все более приобретала облик практической химии.Так знаменитый таджикский врач и философ Абу Али ал-Хусейн ибн Абдаллах ибн Сина(980-1037), известный под именем Авиценна, умел получать хлороводородную кислоту, азотную, серную. В15в. Парацельс ставил задачу алхимии получение лекарств для лечения больных. Алхимия как область человеческой деятельности перестала существовать после18века.
2).Нас окружают тела, а тела состоят из веществ. Вещества имеют определенные свойства: физические (температуру плавления, кипения, агрегатное состояние, цвет, запах, плотностьэлектропроводность и теплопроводность) и химические. Тела имеют форму и размер.
Свойства веществ - признаки по которым можно отличить одни вещества от других или установить сходство между ними.
Задание: определить тела и вещества: капля росы, медь, золото, электрический провод, медный колокол, снежинка, алюминий, кастрюля, химическая колба, кусочек мела, уксусная кислота, стекло, пробирка, капрон, тетрадь, бумага, фарфоровая чашка, вода.
Вещества делятся на простые и сложные, простые вещества делятся на металлы и неметаллы
.
Какими сходными и отличительными свойствами обладают следующие вещества
А)поваренная соль и сахар Б)уксусная кислота и вода?
Д/з: $1,2,3, тетради Дать характеристику меди и сере( цвет, запах, электро- и теплопроводность, плотность, температура плавления
СОЛЬ | ВОДА |
САХАР | Уксусная кислота |
nsportal.ru
Предмет химии. Вещества - ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
Часть 1
1. Химия изучает:
- вещества
- их строения
- их свойства
2. Вещество это -
то, из чего состоят физические тела.
3. Признаки, по которым одни вещества отличаются от других,
- это свойства, например: агрегатное состояние, цвет, запах, плотность и т.д.
4. Существует взаимосвязь: свойство вещества - применение вещества.
Например, для стекла:
1) Прозрачное - оконные стекла
2) изготовление хрусталя
3) витражное стекло
5. Вещества состоят из молекул, которые, в свою очередь, образованы из атомов. Определенный вид атомов называют химическим элементом. Всего известно 120 химический элементов.
6. Химический элемент существует в трех формах.

Часть 2
1. Установите соответсвие между понятием и примером.

2. Вычеркните лишнее:
колба, приборка, химический стакан, мензурка, ступка, мерный цилиндр, кристаллизатор.
Укажите признак, общий для оставшихся объектов.
Химическая посуда из стекла
3. Составьте задание, аналогичное предыдущему.
Вычеркните лишнее - приборка, мерная колба, цилиндр, штатив.
4. Заполните таблицу "Физические свойства вещества". В качестве примеров опишите вещества, используемые на кухне.
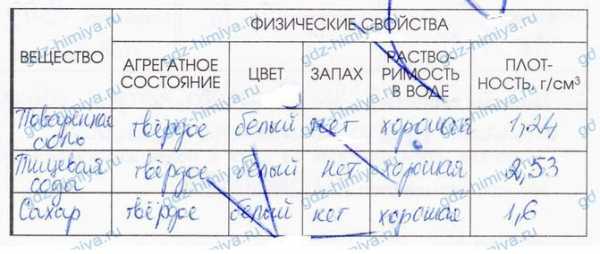
5. Укажите прилагательные, которые характеризуют свойства воды.
1) жидкая
2) пластичная
3) бесцветная
4) прозрачная
5) ароматная
6) электропроводная
Ответ: 1, 3, 4
6. Заполните таблицу "Сравнение физических свойств газообразных веществ".
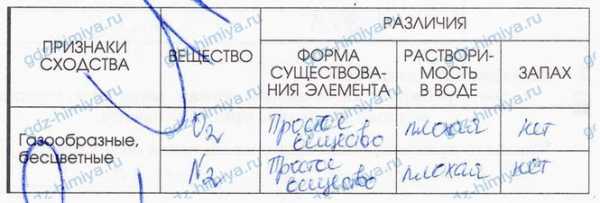
7. Заполните таблицу "Сравнение физических свойств меди и железа".
8. Составьте кроссворд о свойствах и применении какого-либо вещества (по своему выбору).

9. На примере химического элемента водорода укажите правильную последовательность (1-2-3) перечисленных понятий от единичного к общему. Конкретизируте ее, используя слова и рисунки моделей частиц.
3) Вещество - это то, из чего состоят физические тела.
1) Атом - это химически неделимая частица.
2) Молекула - это наименьшая частица вещества.
10. Выражения, являющиеся синонимами понятия "химический элемент".
1) вид одинаковых атомов
2) вид одинаковых молекул
3) вид атомов, имеющих одинаковые свойства
4) простые вещества
5) названия видов атомов
Ответ: 1, 3
11. Установите соответствие между формой существования химического элемента и рисунками моделей частиц.

12. Проанализируйте рисунки и впишите пропущенные слова.
На рисунках изображено две молекулы сложных веществ, образованных из двух химических элементов.
13. Отметьте фразы, в которых говорится о сере как о химическом элементе. Из букв, соответствующих правильным ответам, вы составите название химического элемента, соединения которого используют для обеззараживания воды: хлор.

В тех фразах, которые вы не выбрали, речь идет о сере как о простом вещества.
gdz-himiya.ru