Содержание
Сера
|
Сера / Sulphur (S) | |
|---|---|
|
Атомный номер |
16 |
|
Внешний вид простого вещества |
светло-желтое хрупкое твердое вещество, в чистом виде без запаха |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
32,066 а. е. м. (г/моль) |
|
Радиус атома |
127 пм |
|
Энергия ионизации (первый электрон) |
999,0 (10,35) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ne] 3s2 3p4 |
|
Химические свойства | |
|
Ковалентный радиус |
102 пм |
|
Радиус иона |
30 (+6e) 184 (-2e) пм |
|
Электроотрицательность (по Полингу) |
2,58 |
|
Электродный потенциал |
0 |
|
Степени окисления |
6, 4, 2, -2 |
|
Термодинамические свойства простого вещества | |
|
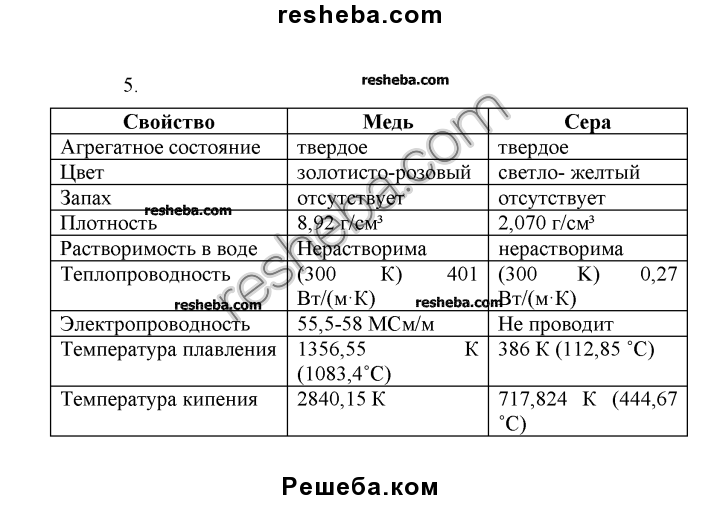
Плотность |
2,070 г/см³ |
|
Молярная теплоёмкость |
22,61 Дж/(K·моль) |
|
Теплопроводность |
0,27 Вт/(м·K) |
|
Температура плавления |
386 K |
|
Теплота плавления |
1,23 кДж/моль |
|
Температура кипения |
717,824 K |
|
Теплота испарения |
10,5 кДж/моль |
|
Молярный объём |
15,5 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
орторомбическая |
|
Параметры решётки |
a=10,437 b=12,845 c=24,369 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
n/a K |
|
S |
16 |
|
32,066 | |
|
[Ne]3s23p4 | |
|
Сера | |
Се́ра (Sulphur — обозн. «S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
«S» в таблице Менделеева) — высокоэлектроотрицательный элемент, проявляет неметаллические свойства. В водородных и кислородных соединениях находится в составе различных ионов, образует многие кислоты и соли. Многие серосодержащие соли малорастворимы в воде
Природные минералы серы
Схема атома серы
Сера является шестнадцатым по химической распространенности элементом в земной коре. Встречается в свободном (самородном) состоянии и связанном виде. Важнейшие природные соединения серы FeS2 — железный колчедан или пирит, ZnS — цинковая обманка или сфалерит (вюрцит), PbS — свинцовый блеск или галенит, HgS — киноварь, Sb2S3 — антимонит. Кроме того, сера присутствует в нефти, природном угле, природных газах и сланцах. Сера — шестой элемент по содержанию в природных водах, встречается в основном в виде сульфат-иона и обуславливает «постоянную» жёсткость пресной воды. Жизненно важный элемент для высших организмов, составная часть многих белков, концентрируется в волосах.
История открытия и происхождение названия
Сера (Sulfur, франц. Sufre, нем. Schwefel) в самородном состоянии, а также в виде сернистых соединений известна с древнейших времен. С запахом горящей серы, удушающим действием сернистого газа и отвратительным запахом сероводорода человек познакомился, вероятно, еще в доисторические времена. Именно из-за этих свойств сера использовалась жрецами в составе священных курений при религиозных обрядах. Сера считалась произведением сверхчеловеческих существ из мира духов или подземных богов. Очень давно сера стала применяться в составе различных горючих смесей для военных целей. Уже у Гомера описаны «сернистые испарения», смертельное действие выделений горящей серы. Сера, вероятно, входила в состав «греческого огня», наводившего ужас на противников.
Около VIII в. китайцы стали использовать ее в пиротехнических смесях, в частности, в смеси типа пороха. Горючесть серы, лёгкость, с которой она соединяется с металлами с образованием сульфидов (например, на поверхности кусков металла), объясняют то, что ее считали «принципом горючести» и обязательной составной частью металлических руд. Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
Пресвитер Теофил (XII в.) описывает способ окислительного обжига сульфидной медной руды, известный, вероятно, еще в древнем Египте.
В период арабской алхимии возникла ртутно-серная теория состава металлов, согласно которой сера почиталась обязательной составной частью (отцом) всех металлов. В дальнейшем она стала одним из трех принципов алхимиков, а позднее «принцип горючести» явился основой теории флогистона. Элементарную природу серы установил Лавуазье в своих опытах по сжиганию. С введением пороха в Европе началось развитие добычи природной серы, а также разработка способа получения ее из пиритов; последний был распространен в древней Руси. Впервые в литературе он описан у Агриколы. Таким образом точно происхождение серы не установлено, но как сказано выше этот элемент использовался до Рождества Христова, а значит знаком людям с давних времен.
Происхождение названия
Происхождение латинского sulfur неизвестно. Русское название элемента обычно производят от санскритского «сира» — светло-желтый. Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Возможно родство «серы» с древнееврейским «серафим» — множественным числом от «сераф» — букв. сгорающий, а сера хорошо горит. В древнерусском и старославянском «сера» — вообще горючее вещество, в том числе и жир.
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы — это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления — одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (то есть одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза — теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-h3O и ангидрита CaSО4 в серу и кальцит СаСО3.
Данная теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов — среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит ни гипса, ни ангидрита.
Разнообразие теорий и гипотез о происхождении самородной серы — результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Получение
Серу получают главным образом выплавкой самородной серы непосредственно в местах её залегания под землей. Серные руды добывают разными способами — в зависимости от условий залегания. Залежам серы почти всегда сопутствуют скопления ядовитых газов — соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
Взрывами рудный пласт дробят, после чего глыбы руды отправляют на сероплавильный завод, где из концентрата извлекают серу.
В 1890 г. Герман Фраш, предложил плавить серу под землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (113°C) температура плавления серы подтверждала реальность идеи Фраша. В 1890 г. начались испытания, приведшие к успеху.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Также сера в больших количествах содержится в природном газе в газообразном состоянии (в виде сероводорода, сернистого ангидрида). При добыче она откладывается на стенках труб и оборудования, выводя их из строя. Поэтому её улавливают из газа как можно быстрее после добычи. Полученная химически чистая мелкодисперсная сера является идеальным сырьём для химической и резиновой промышленности.
Крупнейшее месторождение самородной серы вулканического происхождения находится на острове Итуруп с запасами категории A+B+C1 — 4227 тыс. тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
тонн и категории C2 — 895 тыс. тонн, что достаточно для строительства предприятия мощностью 200 тыс. тонн гранулированной серы в год.
Производители
Основными производителями серы в России являются предприятия ОАО Газпром: ООО Газпром добыча Астрахань и ООО Газпром добыча Оренбург, получающие ее как побочный продукт при очистке газа.
Физические свойства
Природный сросток кристаллов самородной серы
Сера существенно отличается от кислорода способностью образовывать устойчивые цепочки и циклы из атомов серы. Наиболее стабильны циклические молекулы S8, имеющие форму короны, образующие ромбическую и моноклинную серу. Это кристаллическая сера — хрупкое вещество желтого цвета. Кроме того, возможны молекулы с замкнутыми (S4, S6) цепями и открытыми цепями. Такой состав имеет пластическая сера, вещество коричневого цвета. Формулу пластической серы чаще всего записывают просто S, так как она, хотя и имеет молекулярную структуру, является смесью простых веществ с разными молекулами.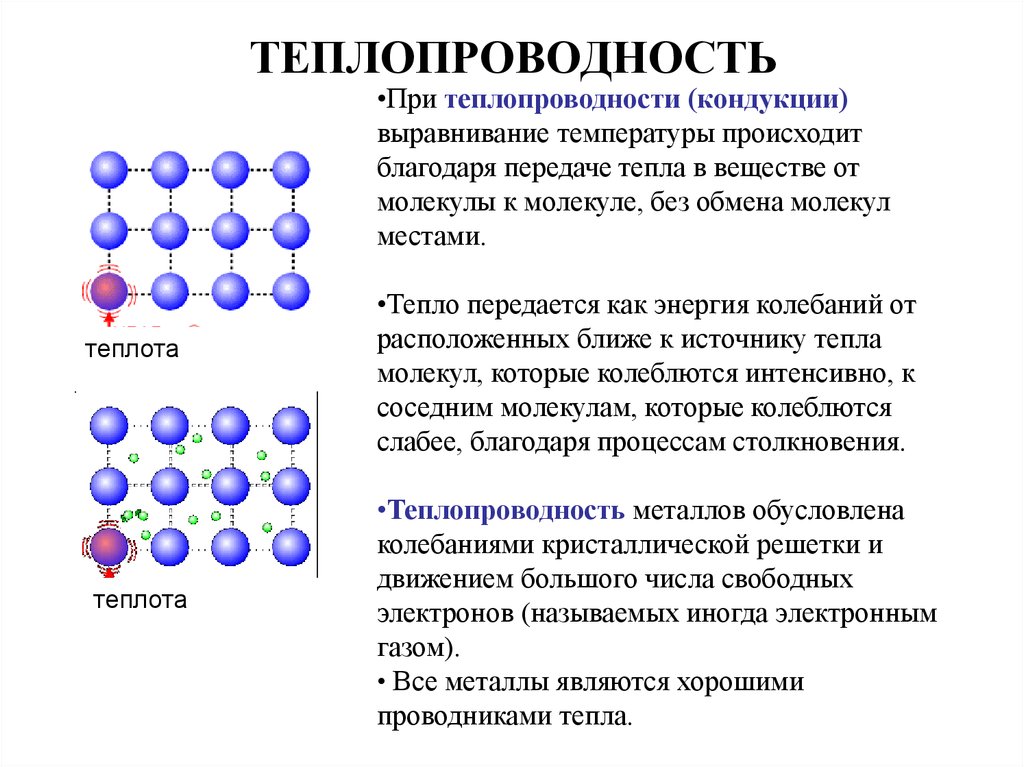 В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
В воде сера нерастворима, некоторые её модификации растворяются в органических растворителях, например сероуглероде. Серу применяют для производства серной кислоты, вулканизации каучука, как фунгицид в сельском хозяйстве и как сера коллоидная — лекарственный препарат. Также сера в составе серобитумных композиций применяется для получения сероасфальта, а в качестве заместителя портландцемента — для получения серобетона.
Химические свойства
Горение серы
При комнатной температуре сера реагирует со фтором и хлором, проявляя восстановительные свойства:
S + 3F2 = SF6
S + Cl2 = SCl2
С концентрированными кислотами-окислителями (HNO3, H2SO4) сера реагирует только при длительном нагревании, окисляясь:
S + 6HNO3(конц.) = H2SO4 + 6NO2 ↑ + 2H2O
S + 2H2SO4(конц. ) = 3SO2 ↑ + 2H2O
) = 3SO2 ↑ + 2H2O
На воздухе сера горит, образуя сернистый ангидрид — бесцветный газ с резким запахом:
S + O2 = SO2
С помощью спектрального анализа установлено, что на самом деле процесс окисления серы в двуокись представляет собой цепную реакцию и происходит с образованием ряда промежуточных продуктов: моноокиси серы S2O2, молекулярной серы S2, свободных атомов серы S и свободных радикалов моноокиси серы SO.
При взаимодействии с металлами образует сульфиды. 2Na + S = Na2S
При добавлении к этим сульфидам серы образуются полисульфиды: Na2S + S = Na2S2
При нагревании сера реагирует с углеродом, кремнием, фосфором, водородом:
C + 2S = CS2 (сероуглерод)
Сера при нагревании растворяется в щёлочах — реакция диспропорционирования
3S + 6KOH = K2SO3 + 2K2S + 3H2O
Пожароопасные свойства серы
Тонкоизмельченная сера склонна к химическому самовозгоранию в присутствии влаги, при контакте с окислителями, а также в смеси с углем, жирами, маслами. Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Сера образует взрывчатые смеси с нитратами, хлоратами и перхлоратами. Самовозгорается при контакте с хлорной известью.
Средства тушения: распыленная вода, воздушно-механическая пена.
Обнаружение горения серы является трудной проблемой. Пламя сложно обнаружить человеческим глазом или видеокамерой, спектр голубого пламени лежит в основном в ультрафиолетовом диапазоне. Горение происходит при низкой температуре. Для обнаружения горения тепловым извещателем необходимо размещать его непосредственно близко к сере. Пламя серы не излучает в инфракрасном диапазоне. Таким образом оно не будет обнаружено распространенными инфракрасными извещателями. Ими будут обнаруживаться лишь вторичные возгорания. Пламя серы не выделяет паров воды. Таким образом детекторы ультрафиолетовых извещателей пламени, использующие соединения никеля, не будут работать.
Для эффективного обнаружения пламени рекомендуется использовать ультрафиолетовые извещатели с детекторами на основе молибдена. Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Они имеют спектральный диапазон чувствительности 1850…2650 ангстрем, который подходит для обнаружения горения серы.
Так как воздух по объему состоит приблизительно из 21 % кислорода и 79 % азота и при горении серы из одного объема кислорода получается один объем SO2, то максимальное теоретически возможное содержание SO2 в газовой смеси составляет 21 %. На практике горение происходит с некоторым избытком воздуха и объемное содержание SO2 в газовой смеси меньше теоретически возможного составляя обычно 14…15 %.
Горение серы протекает только в расплавленном состоянии аналогично горению жидкостей. Верхний слой горящей серы кипит, создавая пары, которые образуют слабосветящееся пламя высотой до 5 см. Температура пламени при горении серы составляет 1820 °C
Пожары на складах серы
В декабре 1995 года на открытом складе серы предприятия, расположенного в городе Сомерсет Вест Западной Капской провинции Южно-Африканской Республики произошел крупный пожар, погибли два человека.
16 января 2006 г. около пяти вечера на череповецком предприятии «Аммофос» загорелся склад с серой. Общая площадь пожара — около 250-ти квадратных метров. Полностью ликвидировать его удалось лишь в начале второго ночи. Жертв и пострадавших нет.
15 марта 2007 рано утром на ООО «Балаковский завод волоконных материалов» произошел пожар на закрытом складе серы. Площадь пожара составила 20 кв.м. На пожаре работало 4 пожарных расчета с личным составом в 13 человек. Примерно через полчаса пожар был ликвидирован. Никто не пострадал.
4 и 9 марта 2008 года произошло возгорание серы в Атырауской области в хранилище серы ТШО на Тенгизском месторождении. В первом случае очаг возгорания удалось потушить быстро, во втором случае сера горела 4 часа. Объём горевших отходов нефтепереработки, к каковым по казахстанским законам отнесена сера, составил более 9 тысяч килограммов.
В апреле 2008 недалеко от поселка Кряж Самарской области загорелся склад, на котором хранилось 70 тонн серы. Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой.
Пожару была присвоена вторая категория сложности. К месту происшествия выехали 11 пожарных расчетов и спасатели. В тот момент, когда пожарные оказались около склада, горела еще не вся сера, а только ее небольшая часть — около 300 килограммов. Площадь возгорания вместе с участками сухой травы, прилегающими к складу, составила 80 квадратных метров. Пожарным удалось быстро сбить пламя и локализовать пожар: очаги возгорания были засыпаны землей и залиты водой.
В июле 2009 в Днепродзержинске горела сера. Пожар произошел на одном из коксохимических предприятий в Баглейском районе города. Огонь охватил более восьми тонн серы. Никто из сотрудников комбината не пострадал.
Что такое Сера — фото, описание, свойства минерала, происхождение, месторождения
Сера (с лат. sērum «сыворотка») — минерал класса самородных элементов, неметалл. Латинское название связано с индоевропейским корнем swelp — «гореть». Химическая формула: S.
Содержание
- Физические свойства и фото серы
- Химические свойства серы
- Происхождение серы
- Применение
- Месторождения серы
Физические свойства и фото серы
Сера в отличие от других самородных элементов имеет молекулярную решетку, что определяет ее низкую твердость (1,5-2,5), отсутствие спайности, хрупкость, неровный излом и обусловленный им жирный плеск; лишь на поверхности кристаллов наблюдается стеклянный блеск. Удельный вес 2,07 г/см3. Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Удельный вес 2,07 г/см3. Обладает плохой электропроводимостью, слабой теплопроводностью, невысокой температурой плавления (112,8°С) и воспламенения (248°С). Легко загорается от спички и горит голубым пламенем; при этом образуется сернистый газ, имеющий резкий удушливый запах. Цвет у самородной серы светло-жёлтый, соломенно-желтый, медово-желтый, зеленоватый; сера, содержащая органические вещества, приобретают бурую, серую, черную окраску. Вулканический сера ярко-желтая, оранжевая, зеленоватая. Местами обычно с желтоватым оттенком. Встречается минерал в виде сплошных плотных, натечных, землистых, порошковатых масс; также бывают наросшие кристаллы, желваки, налеты, корочки, включения и псевдоморфозы по органическим остаткам. Сингония ромбическая.
Отличительные признаки: для самородной серы характерны: неметаллический блеск и то, что она загорается от спички и горит, выделяя сернистый газ, имеющий резкий удушливый запах. Наиболее характерным цветом для самородной серы является светло-желтый.
Разновидность:
Вулканит (селенистая сера). Оранжево-красного, красно-бурого цвета. Происхождение вулканическое.
- Моноклинная сера
- Кристаллическая сера
- Кристаллическая сера
- Селенистая сера — вулканит
Химические свойства серы
Загорается от спички и горит голубым пламенем, при этом образуется сернистый газ, имеющий резкий удушливый запах. Легко плавится (температура плавления 112,8° С). Температура воспламенения 248°С. Сера растворяется в сероуглероде.
Происхождение серы
Встречается самородная сера естественного и вулканического происхождений. Серобактерии живут в водных бассейнах, обогащенных сероводородом за счет разложения органических остатков, — на дне болот, лиманов, мелких морских заливов. Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H2S, SО2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Лиманы Черного моря и залив Сиваш являются примерами таких водоемов. Концентрация серы вулканического происхождения приурочена к жерлам вулканов и к пустотам вулканических пород. При вулканических извержениях выделяются различные соединения серы (H2S, SО2), которые окисляются в поверхностных условиях, что приводит к восстановлению ее; кроме того, сера возгоняется непосредственно из паров.
Иногда при вулканических процессах сера изливается в жидком виде. Это бывает тогда, когда сера, ранее осевшая на стенках кратеров, при повышении температуры расплавляется. Отлагается сера также из горячих водных растворов в результате распада сероводорода и сернистых соединений, выделяющихся в одну из поздних фаз вулканической деятельности. Эти явления сейчас наблюдаются около жерл гейзеров Йеллоустонского парка (США) и Исландии. Встречается совместно с гипсом, ангидритом, известняком, доломитом, каменной и калийной солями, глинами, битуминозными отложениями (нефть, озокерит, асфальт) и пиритом. Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Также встречается на стенках кратеров вулканов, в трещинах лав и туфов, окружающих жерла вулканов как действующих, так и потухших, вблизи серных минеральных источников.
Спутники. Среди осадочных пород: гипс, ангидрит, кальцит, доломит, сидерит, каменная соль, сильвин, карналлит, опал, халцедон, битумы (асфальт, нефть, озокерит). В месторождениях, образовавшихся в результате окисления сульфидов, — главным образом пирит. Среди продуктов вулканического возгона: гипс, реальгар, аурипигмент.
Применение
Широко используется в химической промышленности. Три четверти добычи серы идет на изготовление серной кислоты. Применяется она также для борьбы с сельскохозяйственными вредителями, кроме того, в бумажной, резиновой промышленности (вулканизация каучука), в производстве пороха, спичек, в фармацевтике, стекольной, пищевой промышленности.
Месторождения серы
На территории Евразии все промышленные месторождения самородной серы поверхностного происхождения. Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Некоторые из них находятся в Туркмении, в Поволжье и др. Породы, содержащие серу, тянутся вдоль левого берега Волги от г. Самара полосой, имеющей ширину в несколько километров, до Казани. Вероятно, сера образовалась в лагунах в пермский период в результате биохимических процессов. Месторождения серы находятся в Раздоле (Львовская область, Прикарпатье), Яворовске (Украина) и в Урало-Эмбинском районе. На Урале (Челябинская обл.) встречается сера, образовавшаяся в результате окисления пирита. Сера вулканического происхождения имеется на Камчатке и Курильских островах. Основные запасы находятся в Ираке, США (штаты Луизиана и Юта), Мексике, Чили, Японии и Италии (о. Сицилия).
Физические свойства серы
Физические свойства серы в твердом состоянии не проводят заметного электричества и поэтому образуют удобный изолирующий материал для некоторых целей, хотя чаще ее используют только в качестве ингредиента изолирующих составов или смесей. При трении сера заряжается отрицательно, а под действием излучения радия заряжается положительно. Расплавленная сера в значительной степени проводит электричество, хотя примеси могут частично способствовать этому характерному поведению.5 Электропроводность жидкости увеличивается до максимума примерно при 160°С, падает до минимума примерно при 185°С, а затем увеличивается. Удельное сопротивление при 163°С составляет примерно 7,5×10 10 Ом. Диэлектрическая проницаемость твердой серы составляет примерно 2,7, хотя возможны отклонения в зависимости от оси, вдоль которой производится измерение. Для жидкости, переохлажденной между 150° и 95°С, выполняется закон Клаузиуса-Моссотти. Сера диамагнитна.
Расплавленная сера в значительной степени проводит электричество, хотя примеси могут частично способствовать этому характерному поведению.5 Электропроводность жидкости увеличивается до максимума примерно при 160°С, падает до минимума примерно при 185°С, а затем увеличивается. Удельное сопротивление при 163°С составляет примерно 7,5×10 10 Ом. Диэлектрическая проницаемость твердой серы составляет примерно 2,7, хотя возможны отклонения в зависимости от оси, вдоль которой производится измерение. Для жидкости, переохлажденной между 150° и 95°С, выполняется закон Клаузиуса-Моссотти. Сера диамагнитна.
Из-за своей низкой теплопроводности твердая сера легко разрушается при нагревании, причем неравномерного расширения, вызванного теплом руки, достаточно, чтобы вызвать слышимый звук треска. Были получены следующие значения теплопроводности серы в диапазоне температур от 20° до 210°С:
| Форма. | Температура, °С | Теплопроводность. |
| Rhombic | 20 | 0. 00065 00065 |
| Rhombic | 40 | 0.00061 |
| Rhombic | 60 | 0.00058 |
| Rhombic | 80 | 0.00055 |
| Rhombic | 95 точка перехода | 0,00054 |
| Моноклиника | 100 | 0.00037 to 0.00040 |
| Plastic | 20 | 0.0002 |
| Liquid | 115 (m.pt.) | 0.00031 |
| Liquid | 120 | 0.00031 |
| Liquid | 140 | 0,00032 |
| Жидкость | 160 — область точки перехода | 0,00033 |
| Жидкая | 165 — область переходной точки | 0.00033 |
| Liquid | 170 — Transition point region | 0.00034 |
| Liquid | 190 | 0.00036 |
| Liquid | 210 | 0. 00037 00037 |
The latent heat of fusion of твердая сера изменяется в зависимости от различных аллотропных форм и температуры; она самая низкая для октаэдрической серы; на него также влияет доля нерастворимой серы (γ- или μ-) в исходном твердом веществе и в образовавшейся жидкости. При электрическом нагреве до температуры плавления найдена скрытая теплота плавления моноклинной серы, равная 8,85 г-кал. за грамм.
Скрытая теплота испарения серы (с точностью до 2 процентов) равна 79. скорость охлаждения и температура начала кристаллизации. Иногда кристаллизация происходит ритмично, что приводит к появлению кольцеобразного вида в структуре твердой массы. Утверждается, что кристаллизация переохлажденной расплавленной серы ускоряется под действием излучения радия, вероятно, β-лучей.
В расплавленном состоянии плотность серы зависит только от температуры при условии, что достигнуто состояние равновесия между λ-серой и μ-серой; при 113°С плотность составляет 1,811, затем это значение несколько возрастает примерно до 160°С, а затем неуклонно падает до 1,480 при 446°С. Несколько исследователей измеряли коэффициент расширения, но из-за сложностей вносимые постепенной перестройкой равновесия при новых температурах, результаты не совсем согласуются между собой, хотя и дают подтверждающие доказательства существования равновесия. Средняя удельная теплоемкость подвижной серы 0,220, вязкой серы 0,29.0.
Несколько исследователей измеряли коэффициент расширения, но из-за сложностей вносимые постепенной перестройкой равновесия при новых температурах, результаты не совсем согласуются между собой, хотя и дают подтверждающие доказательства существования равновесия. Средняя удельная теплоемкость подвижной серы 0,220, вязкой серы 0,29.0.
О замечательных изменениях вязкости расплавленной серы уже упоминалось. Определенные измерения были сделаны при ряде температур методом вращающихся цилиндров, и было обнаружено, что воздействие воздуха на жидкость, особенно при температуре ниже 160°С, оказывает заметное влияние на вязкость при температуре от 160°С и выше. . Вязкость очищенной (дважды перегнанной, но не дегазированной) серы имеет значение при 123°С 0,1094 сг.с. единицы; это падает до минимума 0,0709при 150°С постепенно повышается примерно до 159°С, затем быстро возрастает выше этой температуры; однако точная точка перехода не наблюдается. Максимум для очищенной неэкспонированной (безгазовой) серы приходится примерно на 200°C и имеет значение 215 C. G.S. единицы. Для очищенной (не дегазированной) серы после длительного пребывания на воздухе максимум приходится на около 190°С и может иметь значение до 800 с.г.с. единицы. Такая высокая вязкость, по-видимому, возникает из-за примесей, главным из которых является серная кислота, образующихся в результате воздействия воздуха; заметное влияние оказывают также диоксид серы и аммиак в растворе.
G.S. единицы. Для очищенной (не дегазированной) серы после длительного пребывания на воздухе максимум приходится на около 190°С и может иметь значение до 800 с.г.с. единицы. Такая высокая вязкость, по-видимому, возникает из-за примесей, главным из которых является серная кислота, образующихся в результате воздействия воздуха; заметное влияние оказывают также диоксид серы и аммиак в растворе.
Поверхностное натяжение жидкой серы было определено при различных температурах несколькими исследователями, однако их результаты не согласуются друг с другом. Келлас, не соглашаясь с данными более ранних исследователей, утверждает, что поверхностное натяжение серы непрерывно падает от точки плавления до точки кипения, и дает следующие значения: .
Хотя сера создает заметное давление паров при обычных и слегка повышенных температурах, точка кипения достигается только при 444,60°С (при 760 мм). Эта температура является определенной константой и позволяет использовать серу в качестве растворителя для эбуллиоскопического определения молекулярного веса, причем следующие «молекулярные формулы» были определены экспериментально для соответствующих элементов, растворенных в сере: Se 2,4 , Te 1,3 , As 1,0 и Sb 1,2 . Температура кипения (£) при различных давлениях может быть получена из уравнения:
Эта температура является определенной константой и позволяет использовать серу в качестве растворителя для эбуллиоскопического определения молекулярного веса, причем следующие «молекулярные формулы» были определены экспериментально для соответствующих элементов, растворенных в сере: Se 2,4 , Te 1,3 , As 1,0 и Sb 1,2 . Температура кипения (£) при различных давлениях может быть получена из уравнения:
t = 444,60 + 0,0910(р-760) – 0,000049(р-760).
Был исследован показатель преломления жидкой серы, и было обнаружено, что он уменьшается до 160°C, а затем увеличивается выше этой температуры. Что касается спектра серы, то наиболее стойкие линии в эмиссионных спектрах имеют следующие длины волн (Å): 1807,4, 1820,5, 1826,4, 4694.2, 4695.5, 4696.3, 9212.8, 9228.2, 9237.7.
При испарении серы в охлажденном водородном пламени или при пропускании слабых электрических искр через пар, содержащийся в трубке Гейсслера, получается полосчатый спектр, состоящий из серии полос, резких в фиолетовой части, но затухающих в сторону красного и расширяющихся прямо через видимую область.
Изменения в спектре поглощения паров серы в диапазоне от 400° до 1200°С уже упоминались. В ультрафиолетовой области исследовался спектр в диапазоне от 100 до 1000°С при низких давлениях (0,5-53 мм) с использованием непрерывной искры под водой в качестве фона. Ниже 250°С непрерывное поглощение происходит между 2700 и 2300 Å, но при более высоких температурах, как S 2 появляются молекулы и менее 0,5 мм. давления появляется полоса спектра между 2927 и 2713 Å, которая с повышением температуры продолжает расширяться, пока не охватит область 3700–2475 Å. Затем он состоит из трех отдельных наборов полос, а именно:
- от 3700 до 2794 Å, полосы тонкой структуры;
- от 2794 до 2592 Å, узкие полосы без тонкой структуры;
- 2592–2475 Å, широкие непрерывные полосы.
Имеется полоса максимума поглощения при 2750 Å.
Спектр флуоресценции паров серы при возбуждении светом ртутной дуги дает серию полос, простирающихся на видимую область.
Поглощение света тонкими слоями серы (0,3 мм) при 0°С непрерывно от ультрафиолетового до 4080 А и распространяется еще на 20 А в сторону красного на каждые 10° повышения температуры до 300°C, разрыва, как можно было бы ожидать, не наблюдалось вблизи 160°C. коллоидной частицы, приближаясь к пределу, соответствующему количеству, поглощенному молекулярным раствором серы в спирте.
Сера — Термические свойства — Температура плавления — Теплопроводность
О сере
Сера широко распространена, многовалентна и неметаллична. В нормальных условиях атомы серы образуют циклические восьмиатомные молекулы с химической формулой S8. Элементарная сера представляет собой ярко-желтое кристаллическое твердое вещество при комнатной температуре. Химически сера реагирует со всеми элементами, кроме золота, платины, иридия, теллура и инертных газов.
Термические свойства серы
Сера – температура плавления и температура кипения
Температура плавления серы 112,8°C .
Температура кипения серы 444,7°C .
Обратите внимание, что эти точки связаны со стандартным атмосферным давлением.
Сера – теплопроводность
Теплопроводность Сера составляет 0,269 Вт/(м·К).
Характеристики теплопередачи твердого материала измеряются свойством, называемым теплопроводность , k (или λ), измеренная в Вт/м.K . Это мера способности вещества передавать тепло через материал за счет теплопроводности. Обратите внимание, что закон Фурье применим ко всей материи, независимо от ее состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Коэффициент теплового расширения серы
Коэффициент линейного теплового расширения Сера — мкм/(м·K)
Тепловое расширение обычно это склонность материи изменять свои размеры в ответ на изменение температуры. Обычно его выражают в виде доли изменения длины или объема на единицу изменения температуры.
Обычно его выражают в виде доли изменения длины или объема на единицу изменения температуры.
См. также: Механические свойства серы
Температура плавления элементов
Теплопроводность элементов
Тепловое расширение элементов
О температуре кипения и0232 Температура кипения
В общем, кипение является фазовым переходом вещества из жидкой фазы в газовую. температура кипения вещества — это температура, при которой происходит это фазовое превращение (кипение или испарение). Температура, при которой начинает происходить испарение (кипение) при заданном давлении, также известна как температура насыщения , и при этих условиях смесь пара и жидкости может существовать вместе. Можно сказать, что жидкость насыщена тепловой энергией. Любое добавление тепловой энергии приводит к фазовому переходу. точка кипения две фазы вещества, жидкость и пар, имеют одинаковую свободную энергию и, следовательно, с одинаковой вероятностью существуют. Ниже точки кипения жидкость является более стабильным состоянием из двух, тогда как выше предпочтительна газообразная форма. Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения . Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Ниже точки кипения жидкость является более стабильным состоянием из двух, тогда как выше предпочтительна газообразная форма. Давление, при котором начинается испарение (кипение) при данной температуре, называется давлением насыщения . Когда ее рассматривают как температуру обратного перехода из пара в жидкость, ее называют точкой конденсации.
Как видно, температура кипения жидкости варьируется в зависимости от давления окружающей среды. Жидкость в частичном вакууме имеет более низкую температуру кипения, чем когда эта жидкость находится при атмосферном давлении. Жидкость при высоком давлении имеет более высокую температуру кипения, чем при атмосферном давлении. Например, вода кипит при 100°C (212°F) на уровне моря, но при 93,4°C (200,1°F) на высоте 1900 метров (6233 фута). С другой стороны, вода кипит при 350°C (662°F) при 16,5 МПа (типичное давление PWR).
В периодической таблице элементов элемент с самой низкой температурой кипения — гелий. Обе точки кипения рения и вольфрама превышают 5000 К при стандартном давлении. Поскольку трудно точно и беспристрастно измерить экстремальные температуры, в литературе упоминаются оба вещества с более высокой температурой кипения.
Обе точки кипения рения и вольфрама превышают 5000 К при стандартном давлении. Поскольку трудно точно и беспристрастно измерить экстремальные температуры, в литературе упоминаются оба вещества с более высокой температурой кипения.
Точка плавления
В общем, плавление является фазовым переходом вещества из твердого состояния в жидкое. Температура плавления вещества — это температура, при которой происходит это фазовое превращение. Точка плавления также определяет состояние, при котором твердое тело и жидкость могут существовать в равновесии. Добавление тепла превратит твердое тело в жидкость без изменения температуры. В точке плавления две фазы вещества, жидкая и паровая, имеют одинаковую свободную энергию и поэтому с равной вероятностью существуют. Ниже точки плавления твердое состояние является более стабильным из двух, тогда как при температуре выше точки плавления предпочтительна жидкая форма. Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
Температура плавления вещества зависит от давления и обычно указывается при стандартном давлении. Когда ее рассматривают как температуру обратного перехода из жидкого состояния в твердое, ее называют точкой замерзания или точкой кристаллизации.
См. также: Депрессия точки плавления
Первая теория, объясняющая механизм плавления в объеме, была предложена Линдеманном, который использовал колебания атомов в кристалле для объяснения плавления. Твердые тела похожи на жидкости тем, что оба находятся в конденсированном состоянии, а частицы находятся гораздо ближе друг к другу, чем частицы газа. Атомы в твердом теле тесно связаны друг с другом либо в правильной геометрической решетке (кристаллические твердые тела, которые включают металлы и обычный лед), либо в неправильной (аморфное твердое тело, такое как обычное оконное стекло), и обычно имеют низкую энергию. движение отдельных атомов , ионов или молекул в твердом теле ограничивается колебательным движением вокруг фиксированной точки. Когда твердое тело нагревается, его частицы колеблются быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушительные колебания частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Когда твердое тело нагревается, его частицы колеблются быстрее , поскольку твердое тело поглощает кинетическую энергию. В какой-то момент амплитуда колебаний становится настолько большой, что атомы начинают вторгаться в пространство своих ближайших соседей и возмущать их, и начинается процесс плавления. Точка плавления – это температура, при которой разрушительные колебания частиц твердого тела преодолевают силы притяжения, действующие внутри твердого тела.
Как и в случае с точками кипения, точка плавления твердого тела зависит от силы этих сил притяжения. Например, хлорид натрия (NaCl) представляет собой ионное соединение, состоящее из множества сильных ионных связей. Хлорид натрия плавится при 801°С. С другой стороны, лед (твердый H 2 O) представляет собой молекулярное соединение, молекулы которого удерживаются вместе водородными связями, что является эффективным примером взаимодействия между двумя постоянными диполями. Хотя водородные связи являются самыми сильными из межмолекулярных сил, прочность водородных связей намного меньше, чем у ионных связей. Температура плавления льда 0°С.
Температура плавления льда 0°С.
Ковалентные связи часто приводят к образованию небольших наборов лучше связанных атомов, называемых молекулами, которые в твердых телах и жидкостях связаны с другими молекулами силами, которые часто намного слабее, чем ковалентные связи, удерживающие молекулы вместе внутри. Такие слабые межмолекулярные связи придают органическим молекулярным веществам, таким как воски и масла, их мягкий объемный характер и низкие температуры плавления (в жидкостях молекулы должны прекратить наиболее структурированный или ориентированный контакт друг с другом).
О теплопроводности
Характеристики теплопередачи твердого материала измеряются свойством, называемым теплопроводностью , k (или λ), измеряемой в Вт/м·К . Это мера способности вещества передавать тепло через материал за счет теплопроводности. Обратите внимание, что закон Фурье применим ко всей материи, независимо от ее состояния (твердое, жидкое или газообразное), поэтому он также определен для жидкостей и газов.
Теплопроводность большинства жидкостей и твердых тел зависит от температуры. Для паров это также зависит от давления. В общем:
Большинство материалов почти однородны, поэтому обычно мы можем написать k = k (T) . Аналогичные определения связаны с теплопроводностями в направлениях y и z (ky, kz), но для изотропного материала теплопроводность не зависит от направления переноса, kx = ky = kz = k.
Теплопроводность металлов
Перенос тепловой энергии в твердых телах обычно может быть обусловлен двумя эффектами:
- миграцией свободных электронов
- решеточные колебательные волны (фононы)
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, теплопроводность может быть выражена как:0236 являются твердыми телами и поэтому обладают кристаллической структурой, в которой ионы (ядра с окружающими их оболочками остовных электронов) занимают трансляционно эквивалентные позиции в кристаллической решетке. Металлы обычно имеют высокую электропроводность , высокую теплопроводность и высокую плотность. Соответственно перенос тепловой энергии может быть обусловлен двумя эффектами:
Металлы обычно имеют высокую электропроводность , высокую теплопроводность и высокую плотность. Соответственно перенос тепловой энергии может быть обусловлен двумя эффектами:
- миграцией свободных электронов
- решетчатые колебательные волны (фононы).
Когда электроны и фононы переносят тепловую энергию, приводящую к теплопроводности в твердом теле, коэффициент теплопроводности может быть выражен как: структура связана с наличием носителей заряда, в частности, электронов . Электрическая и теплопроводность металлов происходит из того факта, что их внешние электроны делокализованы . Их вклад в теплопроводность обозначается как электронная теплопроводность , k e . Фактически, в чистых металлах, таких как золото, серебро, медь и алюминий, тепловой ток, связанный с потоком электронов, намного превышает небольшой вклад, обусловленный потоком фононов. Напротив, для сплавов вклад k ph в k больше не является незначительным.
Напротив, для сплавов вклад k ph в k больше не является незначительным.
Теплопроводность неметаллов
Для неметаллические твердые вещества , k определяется, прежде всего, k ph , которое увеличивается по мере уменьшения частоты взаимодействий между атомами и решеткой. Фактически, решеточная теплопроводность является доминирующим механизмом теплопроводности в неметаллах, если не единственным. В твердых телах атомы колеблются вокруг своих положений равновесия (кристаллическая решетка). Колебания атомов не независимы друг от друга, а довольно сильно связаны с соседними атомами. Регулярность расположения решетки оказывает важное влияние на k ph , с кристаллическими (хорошо упорядоченными) материалами, такими как кварц , имеющими более высокую теплопроводность, чем аморфные материалы, такие как стекло. При достаточно высоких температурах k ph ∝ 1/T.
квантов колебательного поля кристалла называются « фононами ». Фонон — это коллективное возбуждение в периодическом упругом расположении атомов или молекул в конденсированных веществах, таких как твердые тела и некоторые жидкости. Фононы играют важную роль во многих физических свойствах конденсированного вещества, таких как теплопроводность и электропроводность. Фактически, для кристаллических неметаллических твердых тел, таких как алмаз, k ph может быть довольно большим, превышая значения k, связанные с хорошими проводниками, такими как алюминий. В частности, алмаз обладает самой высокой твердостью и теплопроводностью (k = 1000 Вт/м·К) среди всех объемных материалов.
Теплопроводность жидкостей и газов
В физике жидкость — это вещество, которое постоянно деформируется (течет) под действием приложенного напряжения сдвига. Жидкости являются подмножеством фаз материи и включают жидкости , газы , плазму и, в некоторой степени, пластичные твердые тела. Поскольку межмолекулярное расстояние намного больше, а движение молекул более хаотично для жидкого состояния, чем для твердого состояния, транспорт тепловой энергии менее эффективен. Следовательно, теплопроводность газов и жидкостей обычно меньше, чем у твердых тел. В жидкостях теплопроводность обусловлена атомной или молекулярной диффузией. В газах теплопроводность обусловлена диффузией молекул с более высокого энергетического уровня на более низкий уровень.
Поскольку межмолекулярное расстояние намного больше, а движение молекул более хаотично для жидкого состояния, чем для твердого состояния, транспорт тепловой энергии менее эффективен. Следовательно, теплопроводность газов и жидкостей обычно меньше, чем у твердых тел. В жидкостях теплопроводность обусловлена атомной или молекулярной диффузией. В газах теплопроводность обусловлена диффузией молекул с более высокого энергетического уровня на более низкий уровень.
Теплопроводность газов
Влияние температуры, давления и химических веществ на теплопроводность газа можно объяснить с точки зрения кинетической теории газов . Воздух и другие газы обычно являются хорошими изоляторами при отсутствии конвекции. Следовательно, многие изоляционные материалы (например, полистирол) функционируют просто благодаря большому количеству заполненных газом карманов , которые предотвращают широкомасштабную конвекцию . Чередование газового кармана и твердого материала приводит к тому, что тепло должно передаваться через множество поверхностей раздела, что приводит к быстрому снижению коэффициента теплопередачи.
Чередование газового кармана и твердого материала приводит к тому, что тепло должно передаваться через множество поверхностей раздела, что приводит к быстрому снижению коэффициента теплопередачи.
Теплопроводность газов прямо пропорциональна плотности газа, средней молекулярной скорости и особенно средней длине свободного пробега молекулы. Длина свободного пробега также зависит от диаметра молекулы, причем более крупные молекулы с большей вероятностью столкнутся, чем мелкие молекулы, что представляет собой среднее расстояние, пройденное энергоносителем (молекулой) до столкновения. Легкие газы, такие как водород и гелий обычно имеют высокую теплопроводность . Плотные газы, такие как ксенон и дихлордифторметан, обладают низкой теплопроводностью.
Как правило, теплопроводность газов увеличивается с повышением температуры.
Теплопроводность жидкостей
Как уже писалось, в жидкостях теплопроводность обусловлена атомной или молекулярной диффузией, но физические механизмы объяснения теплопроводности жидкостей изучены недостаточно. Жидкости, как правило, обладают лучшей теплопроводностью, чем газы, а способность течь делает жидкость подходящей для отвода избыточного тепла от механических компонентов. Тепло можно отводить, пропуская жидкость через теплообменник. Теплоносители, используемые в ядерных реакторах, включают воду или жидкие металлы, такие как натрий или свинец.
Жидкости, как правило, обладают лучшей теплопроводностью, чем газы, а способность течь делает жидкость подходящей для отвода избыточного тепла от механических компонентов. Тепло можно отводить, пропуская жидкость через теплообменник. Теплоносители, используемые в ядерных реакторах, включают воду или жидкие металлы, такие как натрий или свинец.
Теплопроводность неметаллических жидкостей обычно уменьшается с повышением температуры.
О тепловом расширении
Тепловое расширение обычно это тенденция материи изменять свои размеры в ответ на изменение температуры. Обычно его выражают в виде доли изменения длины или объема на единицу изменения температуры. Тепловое расширение характерно для твердых тел, жидкостей и газов. В отличие от газов или жидкостей, твердые материалы, как правило, сохраняют свою форму при тепловом расширении. А коэффициент линейного расширения обычно используется для описания расширения твердого тела, в то время как коэффициент объемного расширения более полезен для жидкости или газа.
Коэффициент линейного теплового расширения определяется как:
, где L – это конкретная длина, а dL/dT – скорость изменения этого линейного размера на единицу изменения температуры.
Коэффициент объемного теплового расширения является основным коэффициентом теплового расширения и наиболее важным для жидкостей. Как правило, вещества расширяются или сжимаются при изменении их температуры, причем расширение или сжатие происходит во всех направлениях.
Коэффициент объемного теплового расширения определяется как:
, где L объем материала, а dV/dT это скорость изменения этого объема на единицу изменения температуры.
В твердом теле или жидкости существует динамическое равновесие между силами сцепления, удерживающими атомы или молекулы вместе, и условиями, создаваемыми температурой. Следовательно, более высокие температуры подразумевают большее расстояние между атомами. Разные материалы имеют разную силу сцепления и, следовательно, разные коэффициенты расширения. Если кристаллическое твердое тело изометрично (имеет во всем одинаковую структурную конфигурацию), расширение будет равномерным во всех измерениях кристалла. Для этих материалов коэффициент площади и объемного теплового расширения соответственно примерно в два и три раза больше линейного коэффициента теплового расширения ( α V = 3α L ). Если он не изометричен, могут быть разные коэффициенты расширения для разных кристаллографических направлений, и кристалл будет менять форму при изменении температуры.
Разные материалы имеют разную силу сцепления и, следовательно, разные коэффициенты расширения. Если кристаллическое твердое тело изометрично (имеет во всем одинаковую структурную конфигурацию), расширение будет равномерным во всех измерениях кристалла. Для этих материалов коэффициент площади и объемного теплового расширения соответственно примерно в два и три раза больше линейного коэффициента теплового расширения ( α V = 3α L ). Если он не изометричен, могут быть разные коэффициенты расширения для разных кристаллографических направлений, и кристалл будет менять форму при изменении температуры.
Сводка
| Элемент | Сера |
| Точка плавления | 112,8 °С |
| Точка кипения | 444,7 °С |
| Теплопроводность | 0,269 Вт/мК |
| Коэффициент теплового расширения | — мкм/мК |
| Плотность | 1,96 г/см3 |
Источник: www.