Тренировочные тесты ЕГЭ по химии Вещества молекулярного и немолекулярного строения. Типы кристаллических решёток. Зависимость свойств веществ от их состава и строения.
1. Молекулярное строение имеет 1) С12 2) СаО 3) ZnCl2 4) NaBr
2. Кристаллическая решетка хлорида кальция 1) металлическая 2) молекулярная 3) ионная 4) атомная
3. Кристаллическая решетка твердого оксида углерода (IV) 1) ионная 2) молекулярная 3) металлическая 4) атомная
4. Молекулярную кристаллическую решетку имеет 1) CaF2 2) СО2 3) SiO2 4) A1F3
5. Немолекулярное строение имеет 1) Н2О 2) H2SO4 3) SiО2 4) СО2
6. 1) алмаз 2) азот 3) кремний 4) поваренная соль
7. Немолекулярное строение имеет 1) азот 2) графит 3) аммиак 4) кислород
8. Наибольшую температуру плавления имеет 1) водород 2) кислород 3) оксид углерода (IV) 4) оксид кремния (IV)
9. Ионное строение имеет 1) оксид бора 2) оксид углерода (IV) 3) оксид серы (VI) 4) оксид магния
10. Вещества с металлической кристаллической решеткой 1) хрупкие, легкоплавкие 2) проводят электрический ток, пластичные 3) обладают низкой тепло- и электропроводностью 4) обладают хорошими оптическими свойствами
11. Немолекулярное строение имеет каждое из двух веществ: 1) СО2иСl2 2) Fe и NaCl 3) СО и Mg 4) Na2CO3 и I2 (тв)
12. Вещества твердые, прочные, с высокой температурой плавления, расплавы которых проводят электрический ток, имеют кристаллическую решетку 1) металлическую 2) молекулярную 3) атомную 4) ионную
13. 1) кремний 2) оксид углерода (IV) 3) оксид кремния 4) нитрат аммония
14. Молекулярная кристаллическая решетка характерна для каждого из веществ, расположенных в ряду: 1) хлорид калия, азот, метан 2) иод, диоксид углерода, гелий 3) алюминий, бром, алмаз 4) водород, сульфат магния, оксид железа (Ш)
15. Ионную кристаллическую решетку имеет каждое из веществ, расположенных в ряду: 1) натрий, хлорид натрия, гидрид натрия 2) кальций, оксид кальция, карбонат кальция 3) бромид натрия, сульфат калия, хлорид железа (II) 4) фосфат магния, хлорид калия, оксид фосфора (V)
16. Молекулярное строение имеет 1) СO2 2) КВг 3) MgSО4 4) SiO2
17. Ионы являются структурными частицами 1) кислорода 2) воды 3) оксида углерода (IV) 4) хлорида натрия
18. 1) малахит 2) бронза 3) кремнезем 4) графит
19. Кристаллическая решетка брома 1) молекулярная 2) металлическая 3) ионная 4) атомная
20. Верны ли следующие суждения о зависимости свойств веществ от особенностей их кристаллической решетки? А. Расплавы веществ с ионной кристаллической решеткой проводят электрический ток. Б. Алмаз и кварц имеют атомную кристаллическую решетку. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
21. Немолекулярное строение имеет
22. 1) СН4 и I2 2) SO, и Н2О 3) Сl2 и NH3 4) LiF и KCl
23. Молекулярное строение имеет каждое из двух веществ: 1) NН4С1 и CH3NH3 2) Na2CO3 и HNO3 3) C2H5OH и СН4 4} H2S и CH3COONa
24. Молекулярную кристаллическую решетку имеет 1) фторид кальция 2) бромид алюминия 3) сероводород 4) хлорид меди (П)
25. Молекулярное строение имеет 1) С2Н5ОН 2) А1 3) Fe2(SO4)3 4) КСЮ3
26. Вещества только немолекулярного строения приведены в ряду 1) S8, O2(г), лед 2) Fe, NaCl (тв), алмаз 3) СО2 (г), N2 (г), А1 4) графит, Na2CO3 (тв), I2
27.
28. Кристаллическая решетка хлорида кальция
29.
30. Молекулярную кристаллическую решетку имеет
31.
Ответы: 1-1, 2-3, 3-2, 4-2, 5-3, 6-2, 7-2, 8-4, 9-4, 10-2, 11-2, 12-4, 13-2, 14-2, 15-3, 16-1, 17-4, 18-2, 19-1, 20-3, 21-3, 22-4, 23-3, 24-3, 25-1, 26-2, 27-4, 28-1, 29-2, 30-2, 31-3
|
Кристаллическая решетка — что это? Типы и свойства
Что такое кристаллическая решетка
Как известно, все вещества состоят из частиц — атомов, которые могут располагаться хаотично или в определенном порядке. У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
У аморфных веществ частицы расположены беспорядочно, а у кристаллических они образуют определенную структуру. Эта структура называется кристаллической решеткой. Она определяет такие характеристики вещества, как твердость, хрупкость, температура кипения и/или плавления, пластичность, растворимость, электропроводность и т. д.
Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами),
металлическая (металлические связи),
ионная (ионные связи).

Важно!
Не путайте эти два понятия — кристаллическая решетка и химическая связь. Тип решетки говорит о том, как расположены атомы/ионы в молекуле вещества, а тип связи — по какому принципу они между собой взаимодействуют.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.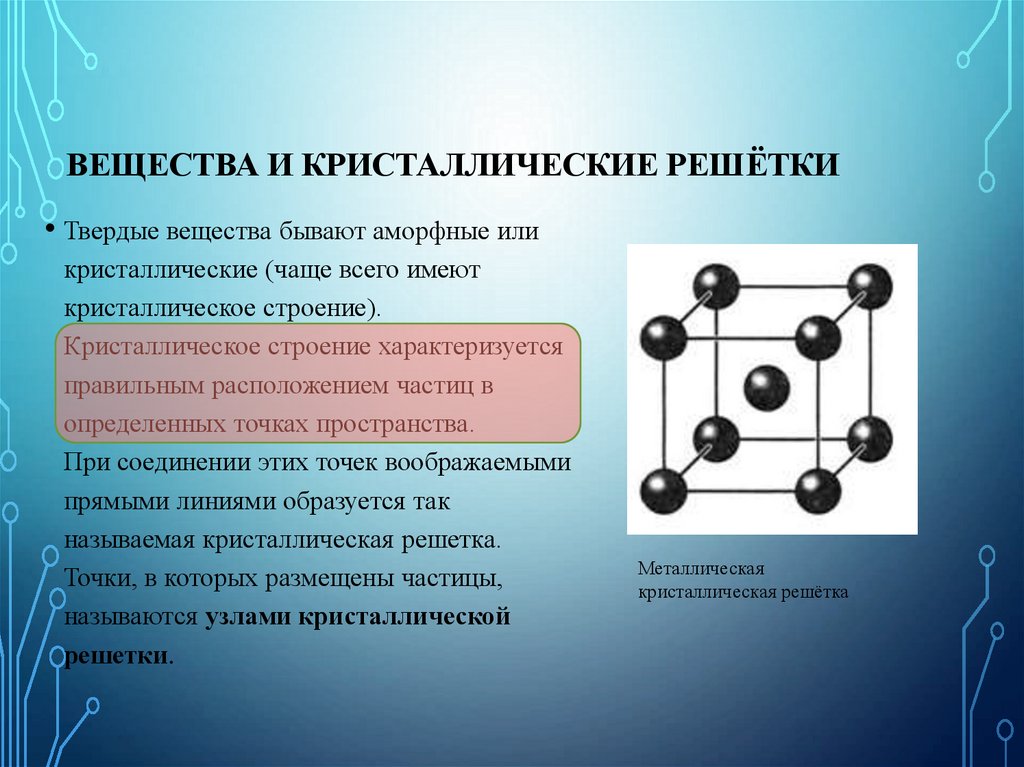
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.
Лайфхак
Если нужно рассказать о свойствах веществ с атомной кристаллической решеткой, достаточно вспомнить песок и перечислить его характеристики.
Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды.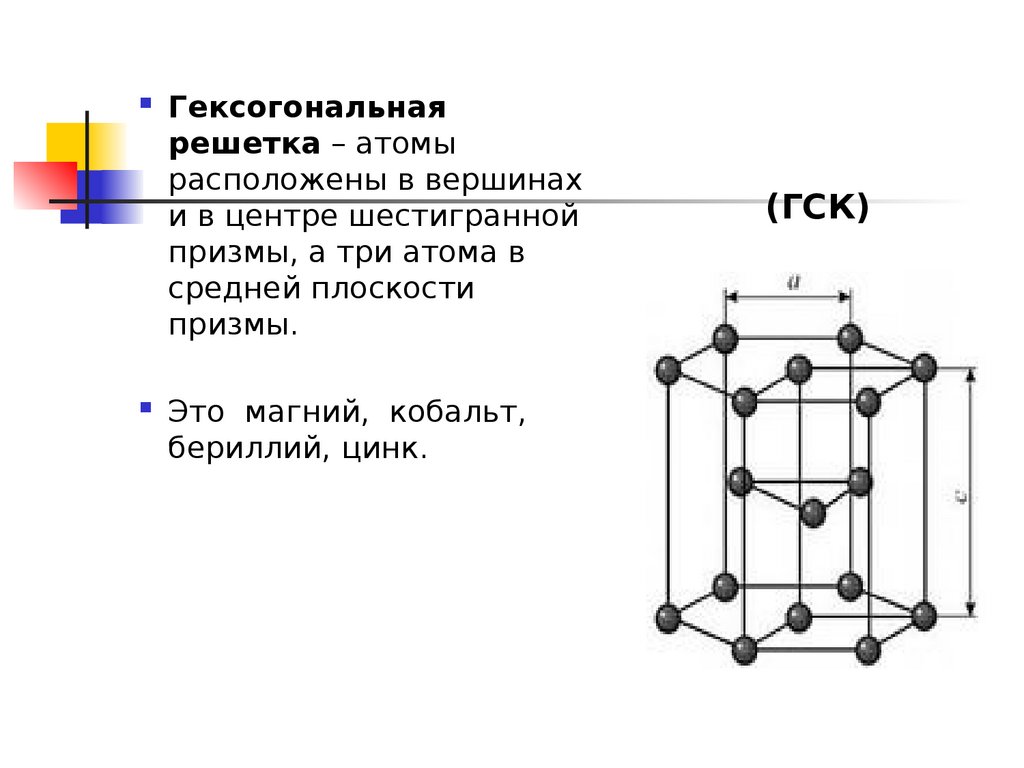 При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
Свойства молекулярных веществ:
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
Ионная кристаллическая решетка
Как известно, при ионной химической связи один атом отдает другому ионы и приобретает положительный заряд, в то время как принимающий атом заряжается отрицательно. В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
В итоге появляются разноименно заряженные ионы, из которых и состоит структура кристалла.
Ионная решетка — это кристаллическая структура, в узловых точках которой находятся ионы, связанные взаимным притяжением.
Ионную кристаллическую решетку имеют практически все соли, типичным представителем можно считать поваренную соль NaCl. О ней стоит вспомнить, если нужно перечислить физические характеристики этой группы. Также ионную решетку имеют щелочи и оксиды активных металлов.
Свойства веществ с ионной структурой:
Примеры веществ с ионной кристаллической решеткой: оксид кальция CaO, оксид магния MgO, хлорид аммония NH4Cl, хлорид магния MgCl2, оксид лития Li2O и другие.
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой:
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
Кристаллическая структура моноалюмината кальция
- Опубликовано:
- МЭРИОН В. ДУГИЛЛ 1
Природа
том 180 , страницы 292–293 (1957)Цитировать эту статью
121 доступ
50 цитирований
3 Альтметрический
Сведения о показателях
Реферат
Кристаллическая структура моноалюмината кальция (CaAl 2 O 4 ) был впервые исследован Хеллером 1 в связи с работами по вяжущим свойствам глиноземистого цемента.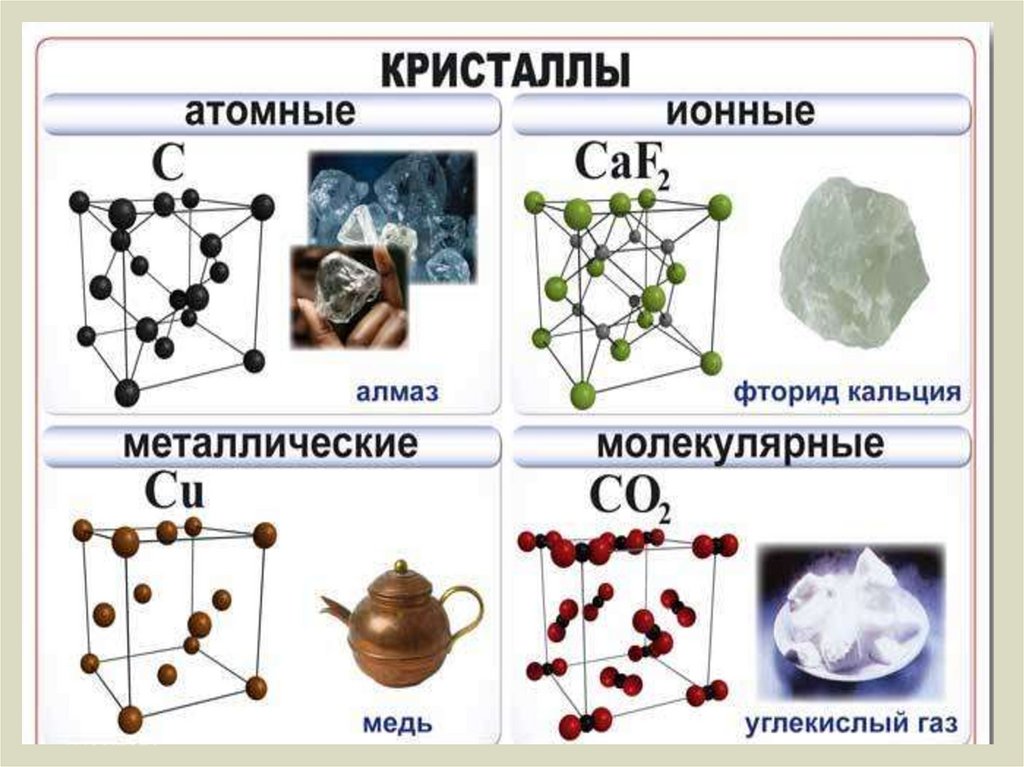 Из-за сложности приготовления монокристаллов пришлось использовать сдвоенный кристалл, и, как следствие, структура была решена лишь частично. В настоящем исследовании удалось вырезать фрагменты монокристаллов из крупных кристаллов, отобранных из образца фосфорного шлака 2 .
Из-за сложности приготовления монокристаллов пришлось использовать сдвоенный кристалл, и, как следствие, структура была решена лишь частично. В настоящем исследовании удалось вырезать фрагменты монокристаллов из крупных кристаллов, отобранных из образца фосфорного шлака 2 .
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
199,00 €
всего 3,90 € за выпуск
Подписаться
Расчет налога будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Список литературы
Хеллер, Л., диссертация, Лондонский университет (1951).
King, G.
 , 747016 Спецификация патента: Brit. Патент (1956 г.).
, 747016 Спецификация патента: Brit. Патент (1956 г.).Claringbull, G. F., and Bannister, F. A., Acta Cryst. , 1 , 42 (1948).
Артикул
Google ученый
Бюргер М.Дж., Кляйн Г.Э. и Донней. Г., амер. Мин. , 39 , 805 (1954).
Google ученый
Gibbs, RE, Proc. Рой. соц. , А, 113 , 351 (1927).
Артикул
ОБЪЯВЛЕНИЯGoogle ученый
Биверс, Калифорния, и Макинтайр, Д. Б., Мин. Маг. , 27 , 254 (1946).
КАС
Google ученый
Ссылки на скачивание
Информация об авторе
Авторы и организации
Albright and Wilson (Mfg.), Ltd., Oldbury, Birmingham
MARYON W.
 DOUGILL
DOUGILL
Авторы
- MARYON W. DOUGILL
Просмотр публикаций этого автора
PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Термолюминесцентная дозиметрия люминофоров из алюмината кальция, легированных редкоземельными элементами
- К. Мадхукумар
- К. Раджендра Бабу
- К. М. К. Наир
Бюллетень материаловедения (2006)
Состав поверхности безводного монокальциевого алюмината, CaAl2O4
- М.
 К. Болл
К. Болл - К. М. Марш
- М. К. Р. Саймонс
Журнал материаловедения (1988)
- М.
Порядок и состав скаполита: полевые наблюдения и структурная интерпретация
- В. Хайко Отердум
- Ханс-Рудольф Венк
Вклад в минералогию и петрологию (1983)
К теории упорядочения Al, Si в альбите
- Сендеров Е.
 Е.
Е.
Физика и химия минералов (1980)
- Сендеров Е.
Координация алюминия в алюминатах и оксифторалюминатах кальция по данным ИК
- Жмойдин Г.И.
- Чаттерджи А.К.
- Плюснина И.И.
Журнал прикладной спектроскопии (1972)
Комментарии
Отправляя комментарий, вы соглашаетесь соблюдать наши Условия и Правила сообщества. Если вы обнаружите что-то оскорбительное или не соответствующее нашим условиям или правилам, отметьте это как неприемлемое.
Новая кристаллическая структура карбоната кальция
Карбонат кальция образует ранее неизвестную водную кристаллическую структуру
Даже хорошо известное иногда может удивить. Карбонат кальция (CaCO 3 ), также известный в просторечии как известь или мел, представляет собой минерал, который уже был тщательно проанализирован химиками. Но книги по химии, в которых он указан как встречающийся в пяти различных кристаллических структурах, теперь нуждаются в дополнении, потому что исследователи из Института коллоидов и интерфейсов Макса Планка в Потсдаме наткнулись на другую структуру карбоната кальция в лабораторных экспериментах.
Нет недостатка в карбонате кальция. Он встречается во многих скалах и горах в виде известняка, мела или мрамора. Он является важным компонентом строительных материалов, таких как цемент и штукатурка, но также является постоянным раздражителем в повседневной жизни, когда образует отложения в кофемашинах, чайниках или душевых лейках. Но карбонат кальция встречается и в живой природе, например, в раковинах мидий, некоторых водорослях и скелетах морских ежей.
Но карбонат кальция встречается и в живой природе, например, в раковинах мидий, некоторых водорослях и скелетах морских ежей.
Именно скелет морского ежа интересует команду Питера Фратцля из Института коллоидов и интерфейсов им. Макса Планка. Вместе со своими коллегами из Института науки Вейцмана в Израиле исследователи изучают, как эти животные формируют сложные кристаллические оболочки для своих мягких тел. Было известно, что карбонат кальция первоначально находится в аморфной, т. е. неупорядоченной форме, и лишь позднее принимает правильную структуру кальцита. Исследователи хотели детально выяснить, как происходит переход, в лабораторных экспериментах, в которых они варьировали такие параметры, как температура или уровень влажности.
Не загрязнение, а новая кристаллическая структура
Чжаоюн Цзоу, в то время докторант рабочей группы в Потсдаме, а ныне профессор в Китае, однажды сделал удивительное открытие в этом контексте: при определенных условиях, образовалось нечто, не похожее на кальцит. «Сначала мы подумали, что это результат загрязнения», — вспоминает Питер Фрацл, директор Института коллоидов и интерфейсов им. Макса Планка. Тем не менее, дальнейшие эксперименты, повторенные в тех же условиях, всегда давали одинаковые результаты. Не загрязнение Исследователи, очевидно, открыли новую, ранее неизвестную фазу карбоната кальция.
«Сначала мы подумали, что это результат загрязнения», — вспоминает Питер Фрацл, директор Института коллоидов и интерфейсов им. Макса Планка. Тем не менее, дальнейшие эксперименты, повторенные в тех же условиях, всегда давали одинаковые результаты. Не загрязнение Исследователи, очевидно, открыли новую, ранее неизвестную фазу карбоната кальция.
«Определить его точную структуру было совсем не просто», — признается Фратцль. С одной стороны, попытки получить достаточно крупные кристаллы вещества для стандартного рентгеноструктурного анализа, используемого для определения химического строения, не увенчались успехом, с другой стороны, вещество оказалось слишком нестабильным для других процессов. Исследователям, наконец, удалось однозначно определить структуру неизвестной фазы карбоната кальция при содействии многочисленных партнеров в Германии и за рубежом, включая ученых из трех других институтов Макса Планка, а также экспертов по кристаллографии из Техниона (Израильского технологического института) в Хайфе. и Университет Иоганна Гутенберга в Майнце с использованием различных технологий.
и Университет Иоганна Гутенберга в Майнце с использованием различных технологий.
Они показали, что, как и в случае с двумя другими фазами карбоната кальция, вещество представляет собой кристаллическую решетку, которая также включает молекулы воды в дополнение к ионам кальция и карбоната в соотношении 0,5 молекулы воды на 1 единицу карбоната кальция. Поэтому это вещество называется полугидратом карбоната кальция, или CCHH, как говорят исследователи для простоты.
Поиск новых фаз карбоната кальция в природе
«Нечасто в жизни исследователя обнаруживается что-то совершенно неожиданное, чего он на самом деле не искал», — говорит Петер Фрацль. В своей первоначальной эйфории ученые-материаловеды даже предложили название для нового материала: Голмит — в честь района Гольм в Потсдаме, где расположен Институт Макса Планка. «Однако, — говорит Фрацль, — мы обнаружили, что тривиальные названия такого рода могут быть присвоены только в том случае, если можно доказать существование вещества в природе».
Действительно, с момента своего открытия исследователи биоматериалов задавались вопросом, может ли новая фаза карбоната кальция существовать в природе. Хотя эксперименты показали, что во влажных условиях CCHH упаковывает больше молекул воды и в конечном итоге переходит в другую фазу, были также определенные лабораторные условия, в которых вещество оставалось стабильным в течение нескольких месяцев. По Фратцлю, вполне может быть, что ККГГ играет роль промежуточной стадии в процессах биоминерализации, например, при переходе от аморфного карбоната кальция к кальциту.
Более подробный анализ этих процессов является одной из целей ученых. Соответствующие результаты также потенциально могут быть использованы в технических процессах, в которых играет роль карбонат кальция, таких как обработка строительных материалов, содержащих цемент. Однако пока это лишь предположения. Прямо сейчас соответствующие записи в учебниках и энциклопедиях должны быть дополнены, чтобы включить другую кристаллическую форму карбоната кальция.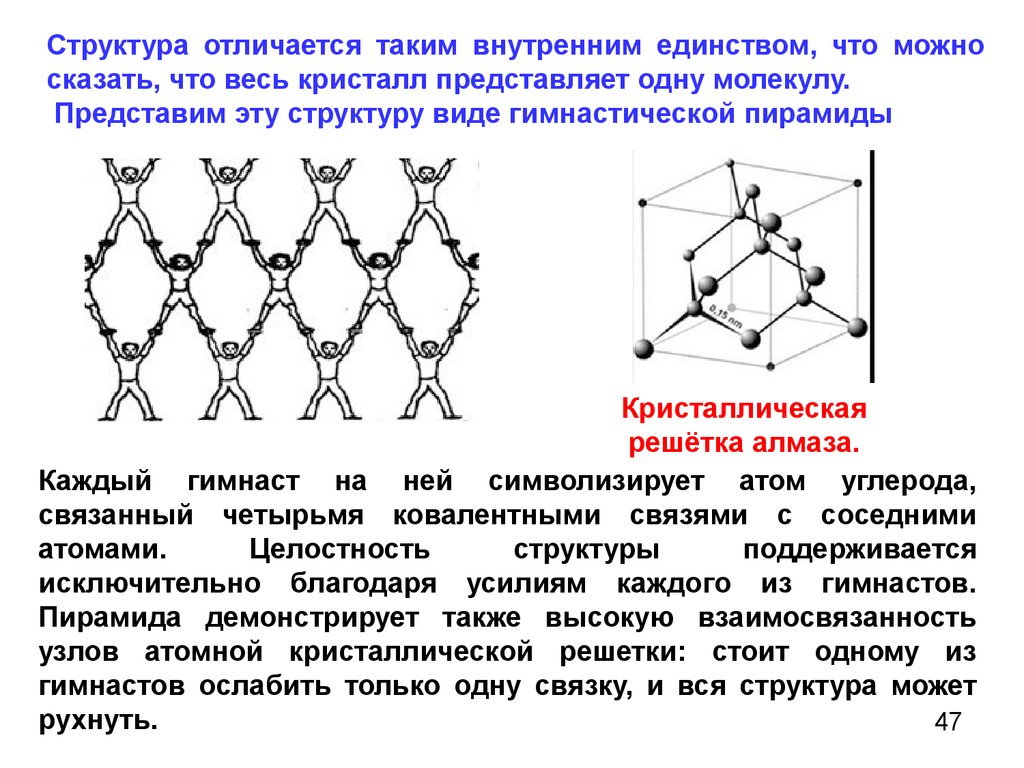
 Молекулярное строение имеет
Молекулярное строение имеет Молекулярную кристаллическую решетку имеет
Молекулярную кристаллическую решетку имеет Металлическую кристаллическую решетку имеет
Металлическую кристаллическую решетку имеет Ионы являются структурной единицей для каждого из двух веществ:
Ионы являются структурной единицей для каждого из двух веществ: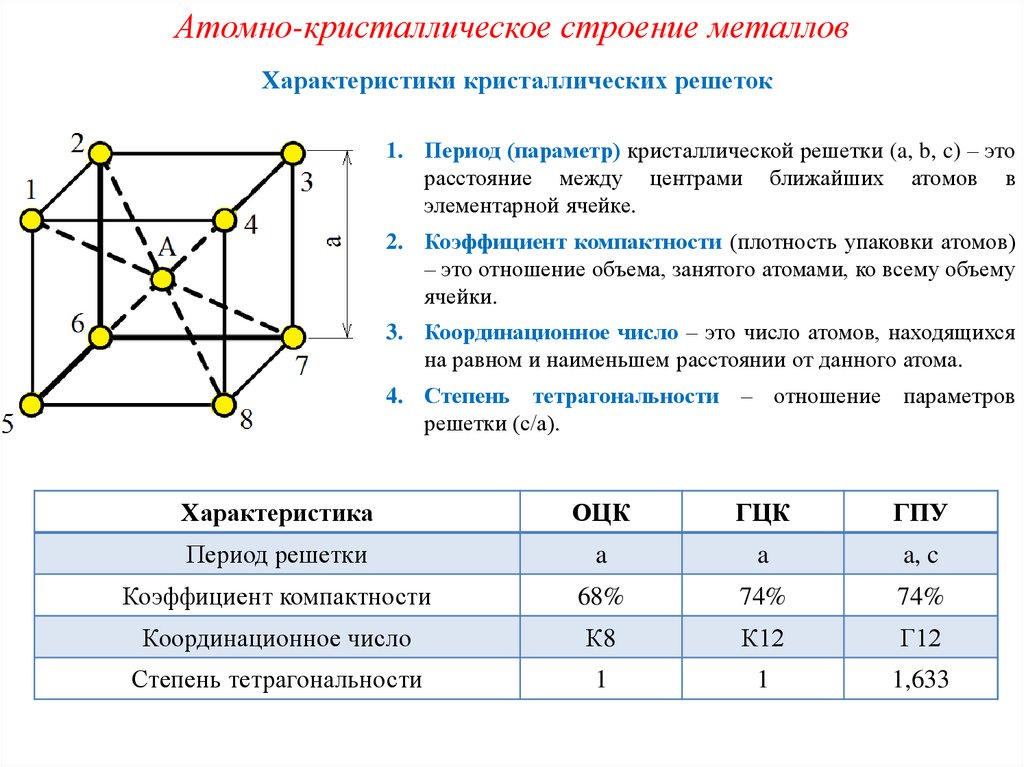 Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для
Утверждение о том, что структурной частицей данного вещества является молекула, справедливо только для Кристаллическая решетка льда
Кристаллическая решетка льда Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами
Простые вещества, имеющие одинаковый тип кристаллической решетки, образованы элементами
 , 747016 Спецификация патента: Brit. Патент (1956 г.).
, 747016 Спецификация патента: Brit. Патент (1956 г.).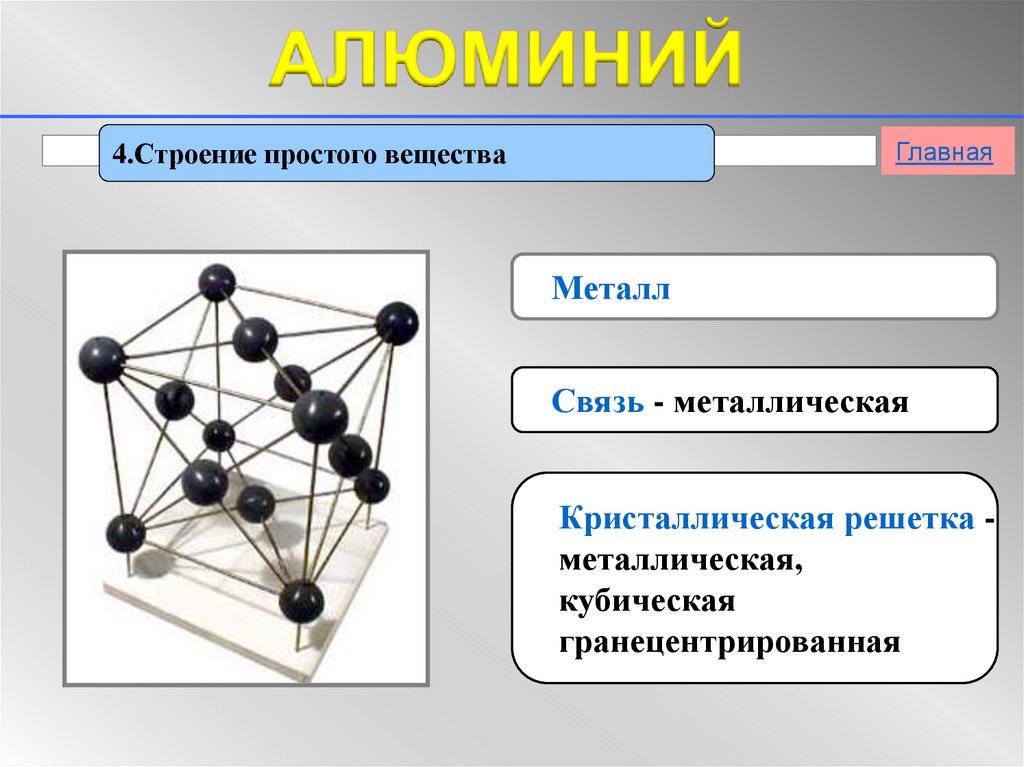 DOUGILL
DOUGILL К. Болл
К. Болл Е.
Е.