Применение меди и ее роль в природе. Медь в природе
нахождение в природе, физические и химические свойства. Медь и её сульфид, гидроксид и оксид
Этот химический элемент известен человеку давно и сегодня используется буквально повсеместно. Электрические провода, посуда, монеты, строительные материалы – в наши дни медь и сплавы на её основе применяются в самых разных отраслях промышленности. Начало применения Cu относят к «Бронзовому веку» (3 тыс. лет до н.э.). Уже тогда люди умели добывать этот розово-золотистый металл и даже получать медно-оловяные сплавы. Вместе с тем, нахождение в природе меди совсем невелико: если изучить состав земной коры нашей планеты, то элемента Cu в неё окажется всего около 0,01% (23 место).
Медь: нахождение в природе
 В природе медь встречается как в чистом виде (самородки могут достигать общего веса в несколько сотен тонн), так и в составе различных соединений. Обычно приходится иметь дело с сульфидами, сформировавшимися в осадочных горных породах, либо с субстратами. Получить медь из этих соединений легко благодаря низкой температуре плавления, чем и пользовались наши предки при изготовлении самых разных медных изделий.Что касается названия элемента – Cuprum, то историки соотносят его с наименованием некогда древнегреческого острова Кипр (Cyprus), когда-то являвшегося наиболее крупным в Европе центром выработки материала. Вполне возможно впервые выплавлять медь научились именно на Кипре.
В природе медь встречается как в чистом виде (самородки могут достигать общего веса в несколько сотен тонн), так и в составе различных соединений. Обычно приходится иметь дело с сульфидами, сформировавшимися в осадочных горных породах, либо с субстратами. Получить медь из этих соединений легко благодаря низкой температуре плавления, чем и пользовались наши предки при изготовлении самых разных медных изделий.Что касается названия элемента – Cuprum, то историки соотносят его с наименованием некогда древнегреческого острова Кипр (Cyprus), когда-то являвшегося наиболее крупным в Европе центром выработки материала. Вполне возможно впервые выплавлять медь научились именно на Кипре.
Физические свойства меди
Прежде всего, медь очень пластична, а потому крайне удобна в использовании, в частности, в плавке. Отличает этот металл и такая характеристика, как ярко выраженная окраска, которая делает материал декоративным (+ отжиг меди). Если для большинства известных металлов характерен серебристо-серый цвет, то Cu, наравне с золотом и осмием входит в число трёх с уникальной цветовой окраской. Еще одно достоинство меди – высокая электропроводность, которая предопределяет использование данного металла в составе самой разной электропроводниковой продукции. Здесь же стоит сказать и о таком свойстве Cu, как отсутствие искры при ударе. Эта уникальная особенность меди делает её отличным материалом для изготовления деталей, работающих в условиях повышенной пожароопасности.
Еще одно достоинство меди – высокая электропроводность, которая предопределяет использование данного металла в составе самой разной электропроводниковой продукции. Здесь же стоит сказать и о таком свойстве Cu, как отсутствие искры при ударе. Эта уникальная особенность меди делает её отличным материалом для изготовления деталей, работающих в условиях повышенной пожароопасности.
Химические свойства соединений меди
Особого внимания заслуживает взаимодействие Cu с кислотами. Так, этот элемент никак не реагирует на воду, растворы щелочей, соляную или разбавленную серную кислоты. При этом сильные окислители, такие как концентрированная серная или азотная кислота, очень быстро медь растворяют. Cu также называют коррозийностойким металлом, однако влажная атмосфера и углекислые газы, взаимодействуя с медью, способствуют образованию на её поверхности зеленоватого налета (карбонат меди).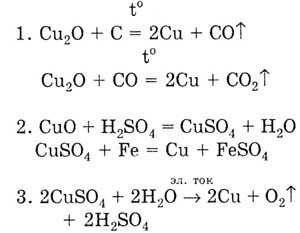 Сегодня широкое применение находят оксид (СuО), гидроксид (Си(ОН)2) и сульфид меди (CuS). Уникальное свойство сульфида меди – высокая электропроводность, позволяющая получать сверхпроводники. Химические свойства гидроксида меди позволяют легко получать оксиды (путем разложения гидроксида меди 2 при нагревании).
Сегодня широкое применение находят оксид (СuО), гидроксид (Си(ОН)2) и сульфид меди (CuS). Уникальное свойство сульфида меди – высокая электропроводность, позволяющая получать сверхпроводники. Химические свойства гидроксида меди позволяют легко получать оксиды (путем разложения гидроксида меди 2 при нагревании).
fx-commodities.ru
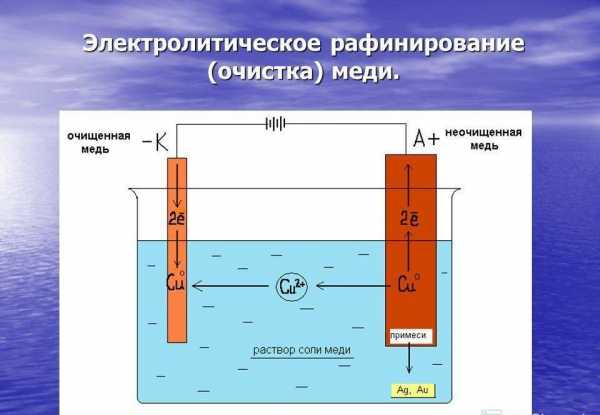
| Таблица   =>> v Медный купорос (фото сайта Википедия) Изделия из меди (фото сайта Тульские самовары) и ее сплавов: | История открытия:Латинское название меди Cuprum произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди. Слова медь и медный встречаются в древнейших русских литературных памятниках. Русское слово "медь" производят от греческого слова, означающего рудник, копь. Нахождение в природе, получение:Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн. Получение меди из сульфидных руд ведут сначала обжигая их на воздухе, а потом подвергая окислительной плавке с добавлением флюса SiO2 и продуванием воздуха. При этом сера окисляется до SO2, железо уходит в шлак в виде силиката, а медь остается в виде простого вещества. Суммарно эти несколько процессов можно выразить уравнением: 2CuFeS2 + 5 O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2Такую черновую медь окончательно очищают электролизом, где изготовленные из нее аноды растворяются, на катоде оседает чистая медь, а примеси оседают на дне в виде осадка, шлама. В состав шлама могут входить такие ценные элементы, как Au, Ag, Se, Te, поэтому его подвергают дальнейшей переработке. Физические свойства:Чистая медь - тягучий вязкий металл светло-розового цвета, легко прокатываемый в тонкие листы. Плотность 8,92 г/см3, температура плавления 1083,4°C, температура кипения 2567°C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20°C удельное сопротивление 1,68·10-3 Ом·м). Химические свойства:В химическом отношении медь является малоактивным металлом. Однако с галогенами она реагирует уже при комнатной температуре, например, с влажным хлором образует хлорид CuCl2. При нагревании медь взаимодействует и с серой, образуя сульфид Cu2S. В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется "патина" - зеленоватая пленка состава Cu(OH)2·CuCO3, содержащая также сернистые соединения меди.При нагревании на воздухе медь тускнеет и, в конце концов, чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем - оксид CuO.Находясь в ряду напряжений после водорода, медь не вытесняет его из кислот. Поэтому соляная и разбавленная серная кислоты на медь не действуют. Однако в присутствии кислорода воздуха медь растворяется в этих кислотах с образованием соответствующих солей:2Cu + 4HCl + O2 = 2CuCl2 + 2h3O. Для меди характерны соединения со степенью окисления: +1 (менее стабильная) и +2 (более стабильная). В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Важнейшие соединения:Оксид меди(I) - Cu2O, имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию: 2Cu+(водн.) Cu2+(водн.) + Cu(тв.)Хлорид меди(I) - белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Может быть получен при сильном нагревании хлорида меди(II): CuCl2(тв.) = 2CuCl(тв.) + Cl2(г.) Также существует нестабильный сульфат меди(I).Оксид меди(II) - - черное вещество, встречающееся в природе. Проявляет окислительные свойства. Нагревание с органическими веществами используется при элементном анализе органических веществ для определения содержания в них углерода и водорода.Гидроксид меди(II) - осаждается из растворов солей меди(II) в виде голубой студенистой массы при действии щелочей. Очень слабое амфотерное основание. Соли меди(II) - образуют кристаллогидраты синего и сине-зелёного цвета, растворы солей меди(II) в большинстве случаев имеют кислую реакцию в следствие гидролиза. Сульфат меди(II), CuSO4 - белый порошок, при гидратации даёт синие кристаллы медного купороса CuSO4*5h3O, используется как фунгицид. Применение:- В электротехнике - Для производства труб - катализатор полимеризации ацетилена - Для производства медно-окисных гальванических элементов и батарей. - Широко используются сплавы с использованием меди: латунь - сплав меди с цинком, бронза - сплав меди с оловом, мельхиор - сплав меди и никеля, и другие. Они применяются для чеканки разменной монеты, в судостроении, в ювелирном деле. - Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-x, который является основой для получения высокотемпературных сверхпроводников. Медь является необходимым элементом для всех высших растений и животных, входя в состав многих ферментов. В крови головоногих и некоторых брюхоногих моллюсков медь выполняет ту же роль, что и железо в крови человека. В организме взрослого человека содержится до 80 мг меди и для восполнения потерь необходимо поступление меди в количестве 0,9 мг в день. При недостатке меди в организме снижается активность ферментных систем и замедляется белковый обмен и нарушается рост костных тканей. Однако содержание меди в питьевой воде не должно превышать 1 мг/л, многие соединения меди обладают токсичными свойствами. Жерновникова А., Третьякова М. ХФ ТюмГУ, 571 группа. Источники: Википедия: http://ru.wikipedia.org/wiki/Cu,Н.А.Фигуровский "Открытие элементов и происхождение их названий". Москва, Наука, 1970. (на сайте ХФ МГУ http://www.chem.msu.su/rus/history/element/Cu.html) |
www.kontren.narod.ru
Применение меди и ее роль в живой природе

Медь и изделия из нее очень широко применяются в промышленности и повседневной жизни человека. Более половины получаемой меди идет на изготовление электротехнической продукции – проводов, кабелей и т. д. Благодаря очень высокой теплопроводности медь используется для производства эффективных теплообменных устройств.
Примерно треть производимой меди служит для получения сплавов на ее основе: бронзы, латуни, мельхиора и др.
Из молей меди наиболее широко применяется пентагидрат сульфата меди CuSO4, 5h3O, имеющий тривиальное название медный купорос: в промышленности при приготовлении растворов для электролитического меднения, получении других солей меди, в сельском хозяйстве для борьбы с вредителями растений.
В больших количествах растворимые соединения меди очень токсичны для человека и животных. В 1 дм3 питьевой воды не должно содержаться более 0,0005 грамма меди.
Вместе с тем медь играет важную роль в жизни многих живых организмов – атомы меди входят в состав более 30 ферментов и белков (оксигеназы, гидроксилазы и др.). Поэтому небольшие количества меди должны поступать с водой или пищей. В организме человека массой 70 кг содержится примерно 70 мг меди. Считается, что потребность взрослого человека в меди составляет 2-3 мг в сутки.
При дефиците меди нарушается обмен железом между плазмой крови и эритроцитами. Соединения меди важны при лечении анемии.
В крови ракообразных и головоногих медь входит в состав дыхательного пигмента гемоцианина и играет ту же роль, что и железо в составе гемоглобина. Соединяясь с кислородом, гемоцианин синеет (поэтому у улиток «голубая кровь»), а отдавая кислород тканям, – обесцвечивается. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
Медь в природе |
Медь защищает и удобряет
Содержание меди в земной коре невелико и составляет 0,01%. В растениях медь выполняет различные важные функции. Она способствует образованию белков и фотосинтезу, активизирует ряд ферментов, участвует в углеводном обмене. При недостатке меди в растениях накапливается больше нитратов, а разрушение хлорофилла происходит значительно быстрее, чем при нормальном уровне питания этим элементом. В разных растениях медь содержится в неодинаковых количествах. Например, бобовые накапливают гораздо больше меди по сравнению со злаковыми. Соответственно этому и потребность растений в этом элементе различная. Так, морковь, свекла, лук и капуста нуждаются в больших количествах меди по сравнению с картофелем и томатом.
Медь – важный микроэлемент не только для растений, но и для животных. Она участвует в кроветворении, входит в состав ферментов.

Для сельского хозяйства медь – очень важный элемент и использование его двояко. С одной стороны, некоторые соединения меди являются микроудобрениями, с другой – средствами химической защиты растений.
Дефицит меди в питании растений проявляется в виде побеления и усыхания верхушек молодых листьев. Растение приобретает светло-зеленую окраску, развитие задерживается. При сильном медном голодании могут усыхать даже стебли. Урожай при этом резко снижается или вообще не образуется. Плодовые деревья и ягодные культуры также часто испытывают недостаток меди. Ее дефицит часто совпадает с недостатком цинка и магния. Кроме того, применение высоких доз азотных удобрений может приводить к медной недостаточности, что свидетельствует о том, что медь играет большую роль в азотном обмене.
Недостаток меди в питании растений полностью устраняется внесением медных удобрений. В качестве такого микроудобрения обычно используют хорошо известный медный купорос. Годятся и другие соли меди, например, хлорид или нитрат. Используют три способа применения меди: внесение в почву (как правило, с макроудобрениями), опрыскивание растений растворами солей меди и предпосевная обработка семян.
Препараты защиты растений, содержащие медь, применяются уже давно. Причина их эффективности – фунгицидная активность меди. Поэтому используют такие препараты для борьбы с возбудителями заболеваний сельскохозяйственных культур – различными видами ложной мучнистой росы, фитофторой, паршой, пятнистостью. Самое распространенное применение – борьба с фитофторозом на картофеле и с милдью (ложная мучнистая роса) на виноградниках.
Препараты меди, конечно, эффективны, но… Как бы не были химически прочны органические пестициды, даже такие как ДДТ или гексахлоран, все равно, со временем они разлагаются в окружающей среде под действием микроорганизмов или солнечного ультрафиолетового излучения. А медь – нет. Поэтому медь, поступающая в почву со средствами защиты растений, накапливается. Особенно это актуально для виноградников, на которые ежегодно применяют большие дозы медьсодержащих препаратов.
С древних времен человек понимал, что излишек металлов не приведет ни к чему хорошему. К меди это тоже относится.
Из медьсодержащих препаратов для борьбы с болезнями растений чаще всего применяют медный купорос, хлорокись меди и старую как мир бордоскую жидкость. При работе с такими препаратами следует, однако, соблюдать меры безопасности. Соли меди в дозе 0,2 – 0,5 г вызывают серьезное отравление.
Сергей ТОРШИН,Доктор биологических наук,Москва
На сайте есть:obzor-novostei.ru
Медь Исл в природе - Справочник химика 21
При осернении раствором полисульфида образуется не одно вещество строго определенного состава, а смесь различных продуктов. Даже незначительное изменение условий осернения (соотношение реагентов, температура, длительность процесса, наличие солей железа или меди, природа растворителя) приводит к сильным изменениям оттенков и других свойств красителей. Например, увеличение количества полисульфида придает синим и черным красителям зеленоватые оттенки повышение температуры на 2—3°С нри получении синих красителей приводит к более темным (тупым) оттенкам. [c.427] В смешанных растворителях данные не вполне однозначны. Для металлов с низким перенапряжением природа растворителя играет меньшую роль. Характер изменения перенапряжения с изменением растворителя точно не установлен, хотя в литературе имеются указания на то, что для меди и никеля в спиртовых растворах оно выше, чем в водных. Влияние pH раствора на перенапряжение водорода с наибольшей полнотой изу- [c.400]По содержанию в земной коре лантаноиды не уступают таким элементам, как иод, сурьма, медь. Но они очень рассеяны в природе. [c.641]
Чтобы понять природу разности потенциалов, измеряемой между двумя электродами, погруженными в свои нулевые растворы, рассмотрим сначала процессы, происходящие между пластинками из двух различных металлов (например, меди и цинка), разделенными вакуумом. Электроны в металле обладают [c.533]
Как бы то ни было, медь и цинк в монетах, магний в фотовспышках — все вещества имеют свой, присущий им набор физических и химических свойств. В таком случае, как из миллионов имеющихся в нашем распоряжении веществ выбрать наиболее подходящее для данной конкретной цели На наше счастье, природа упростила для нас эту задачу. Все вещества состоят из относительно небольшого количества строительных блоков - атомов различных химических элементов. Знание того, в чем они сходны и чем различаются друг от друга, может в значительной степени облегчить задачу выбора используемых веществ. Химическим элементам будет посвящена следующая глава. [c.119]
Настоящие и будущие изменения в этой области хорошо можно проиллюстрировать на примере меди. Мы рассмотрим источники этого металла, в каком виде медь встречается в природе и как ее получают из руды. Наконец, мы подумаем, чем ее можно заменить. [c.147]
Первыми используемыми металлами были, вероятно, золото и серебро, поскольку их можно было найти в природ в свободном состоянии. Применяли их в основном в декоративных изделия . Медь начали использовать около 8000 лет до нашей эры для изготовления орудий труда, оружия, кухонной утвари и украшений. Около 3800 лет до нашей эры была изобретена бронза — сплав меди и олова. В результате человечество перешло из каменного в бронзовый век. Затем был найден способ выплавки железа, и начался железный век. По мере того как люди накапливали свой химический опыт, расширялся и круг полезных материалов, которые человек научился получать путем переработки самых разнообразных руд. [c.150]
Несмотря иа то что медь, серебро и золото относительно редко встречаются в природе, эти металлы начали использоваться человеком гораздо раньше, чем железо, запасы которого гораздо больше. Почему Более того, металлы, находящиеся в верхней части ряда активности, не были получены в чистом виде до 1780 года. Как вы можете это объяснить [c.151]
Медь, встречающаяся в природе, содержит 69,1% меди-63 и 30,9% меди-65. Вычислим молярную массу меди, встречающейся в природе. [c.315]
После периода индукции скорость окисления постоянна н близка к скорости неингибированного окисления. Такой тип кинетики характерен для фенольных ингибиторов окисления. Кинетические кривые поглощения кислорода в опытах с металлической медью и ингибиторами носят автокаталитический характер и спрямляются в координатах А[02] - t после некоторого времени, связанного с расходованием ингибитора (рис. 5.20). Значения параметра автоокисления Ь (Д[02] = 1>1) зависят от природы антиокислителя (табл. 5.15). [c.201]
Ко второй группе относятся кобальт, медь и никель. Добавление их к катализатору способствует существенному увеличению выхода кокса зто зависит не только от природы металла, но и от его содержания в образце (см. рис. 70). По сравнению с исходным катализатором выход кокса на образцах, содержащих 0,5— 0,7 вес. % никеля, меди и кобальта, увеличивается в 3,2—3,5 раза. [c.163]
Эта максимальная концентрация, а также максимальное ускорение регенерации катализатора зависят от природы металла. С уменьшением окислительной способности металлов максимальная концентрация возрастает. Так, если максимальная концентрация для хрома равна 0,1 вес. %, то для ванадия она равна 0,3— 0,4%, а для молибдена и меди составляет уже примерно 0,5— 0,6 вес. %. Одновременно с уменьшением способности катализировать окисление кокса уменьшается максимальное ускорение регенерации катализатора. Наши данные позволяют расположить ис- [c.168]
На рис. 2.15 показано влияние содержания различных металлов в катализаторе на время сгорания половины отложенного на катализаторе кокса. Как видно, наибольщее ускорение достигается при малом содержании металлов в катализаторе, а с увеличением их содержания эффект ускорения становится все меньше и по достижении некоторого максимального содержания металла скорость выжига коксовых отложений перестает изменяться. Это максимальное содержание, а также максимальное ускорение регенерации катализатора зависит от природы металла. С уменьщением окислительной способности металлов максимальное содержание возрастает. Так, для хрома оно составляет 0,1% (масс.), для ванадия 0,3-0,4% (масс.), а для молибдена и меди примерно 0,5-0,6% (масс.). По степени убывания воздействия металлов на скорость окисления кокса в кинетической области их можно расположить в следующий ряд хром > ванадий > литий > молибден, медь, натрий > [c.34]
Медь, отложенная на окиси церия и двуокиси кремния, применялась [45] в реакциях расщепления, изомеризации, образования кислот, гидрогенизации и гидратации. Определенный интерес представляет сопоставление активности этого катализатора при гидрировании и гидрогенолизе различных углеводов (сахарозы, глюкозы, фруктозы и др.). Глюкоза и фруктоза начинают гидрироваться при 150°С, сахароза — при 180°С, сорбит и глицерин — выше 200 °С. В отсутствие гомогенных добавок катализатор преимущественно ведет процесс гидрирования, в присутствии таких добавок — гидрогенолиз, причем степень расщепления зависит как от природы углевода, так и от количества добавки (гидроокиси кальция). [c.46]
Подобная зависимость направления реакции циклопропанирования от степени замещения кратной связи и используемой соли меди (природы аниона) четко проявляется и при циклопропанировании 2-метилоктадиена-2,7. При использовании ацетилацетоната меди преимущественно циклопропанируется более замещенная двойная связь. При конверсии 10% в реакционной смеси содержалось 86% соединения (17) и 14% соединения (18). При повышении конверсии до 90% в значительном количестве образовывался продукт двойного циклопропанирования (19) И соотношение (17) (18) (19) составляло 1 0,1 0,6 1011]. В присутствии трифлата меди соотношение (17) (18) при низких степенях конверсии исходного диена равно 1 2. При дальнейшем пропускании диазометана до 50%-й конверсии 2-метилоктадиена-2,7 соотношение продуктов (17) (18) (19) составляет соответственно 1 2,5 0,4 [Ю1Г. [c.166]
Эта теория начинается с Фалеса (640—546 до н. э.) Фалес был греческим философом. Он жил в Милете, в Ионии — на западном побережье Малой Азии (на месте нынешней Турции). Фалес, вероятно, задавал себе следующий вопрос. Если одно вещество может перейти в другое, как голубоватый камень (азурит) переходит в красную медь, то какова же истинная природа вещества Что представляет собой это вещество — камень или медь или ни то и ни другое Любое ли вещество переходит в другое вещество (хотя бы постепенно), и если любое, то не являются ли все вещества разными вариантами одного и того же основного вещества [c.13]
С этой целью (р с. 91) воздух под давлением 4—5 ат при 50—70° подают в ацетальдегид, растворенный в каком-либо растворителе — уксусном эфире, нронилацетате или бензоле. В качестве катализатора применяется, например, медь-кобальтацетат, в молярном соотношепии 10 1, в количестве около 2%, считая на ацетальдегид. Марганцевый катализатор способствует главным образом образованию уксусной кислоты. В зависимости от температуры и природы катализатора процесс направляется в сторону преимущественного образования уксусной кислоты пли ангидрида. [c.158]
Кроме природы металла и состояния его поверхности перенапряжение зависит также от плотности тока и температуры. По-иышение температуры уменьшает перенапряжение. Наоборот, с увеличением плотности тока оно увеличивается. Так, при плотности тока 0,1 а см перенапряжение водорода на меди составляет —0,85 в, тогда как при 0,01 а см оно равно —0,58 в. [c.430]
Иззестно, однако, что потенциалы отдельных пар зависят не только от природы металлов, но и от концентраций их ионов в растворе. Поэтому, изменяя концентрации путем связывания соответствующих ионов в те или иные комплексы, иногда удается изменить и порядок их выделения при электролизе. Например, выше было указано, что медь из смеси растворов USO4 и dS04 выделяется в первую очередь. Если же прибавить к раствору достаточное количество K N, то можно при напряжении 2,5 в количественно выделить на катоде кадмий, тогда как медь целиком останется в растворе. Причина этого заключается в образовании катионами обоих металлов комплексных ионов [ d( N)4] ( иест = 7,8 10" ) и [ u( N)4P" (/Снест = 5,0 10 ). Соответственно меньшей величине К ест медного комплекса концентрация [c.433]
Природа электрода, так же как и сгепень развития его поверхности, играет важную роль в кинетике процессов электрохимического восстановления и окисления особенно отчетливо это проявляется в случае сложных окислительно-восстановительных реакций. Например, при восстановлении азотной кислоты на губчатой меди получается почти исключительно аммиак, а на амальгамированном свинце — преимущественно гидроксиламин. Другим примером влияния материала электрода на процесс электровосстановления может служить реакция восстановления ацетона. В результате этого процесса получаются два основных конечных продукта — изопропиловый спирт СН3СНСН3 и пннакон (СНзСОНСНз)2. [c.432]
Из табл, 22.1 и 22.2 следует также, что значение металлического иеренаиряжения в большей стеиени определяется природой металла, чем кристаллографической ориентацией электродной поверхности. Независимо от того, на какой из граней происходит выделение металла, перенапряжение всегда выше для никеля, чем для меди, а для меди оно всегда больше, чей для олова или свинца. [c.460]
Растворимость в воде таких соединений закисной меди, а также скорость их выделения из водных растворов зависят, кроме всего прочего, от природы органического основания, координированного с атомом меди, и аниона. [c.72]
Какое из этих веществ образуется, т. е. насколько глубоко восстанавливается азотная кислота в том или ином случае, зависит от природы восстановителя и от условий реакции, прежде всего от концентрации кислоты. Чем выше концентрации HNO.3, тем менее глубоко она восстанавливается. При реакциях с концентрированной кислотой чаще всего выделяется NO2. При взяимодей ствни разбавленной азотной кислоты с малоактивными металлами, например, с медью, выделяется N0. В случае более активных металлов — железа, цинка, — образуется NjO. Сильно разбавлен-ная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием — с образованием иона аммония, дающего с кислотой нитрат аммоння. Обычно одновременно образуются несколько продуктов. [c.413]
Серебро (Argentum). Серебро распространено в природе значительно меньше, чем медь содержание его в земной коре составляет всего 10 % (масс.). В некоторых местах (например, в Канаде) серебро встречается в самородном состоя[1ии, но большую часть серебра получают из его соединений. Самой важной серебряной рудой является серебряный блеск, или аргентит, AgjS. [c.576]
Золото (Aurum), Золото встречается в природе почти исключительно в самородном сосгояг(ии, главным образом о виде мелких зерен, вкрапленных в кварц или содержащихся в кварцевом песке. В небольших количествах золото встречается в сульфидных рудах железа, свинца и меди. Следы его открыты в морской воде. Общее содержание золота в земной коре составляет всего 5-10- % (масс.) [c.579]
Титан (Titanium). Титан очень распространен в природе его содержание в земной коре составляет 0,6% (масс.), т. е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк. [c.648]
Медь, серебро и золото несколько выпадают из общей для переходных металлов закономерности по своему электронному строению с валентной конфигурацией Они характеризуются более низкими температурами плавления и кипения, чем предшествующие им переходные элементы, и являются довольно мягкими металлами. Проявление таких свойств соответствует закономерной тенденции к ослаблению металлических связей, обнаруживаемой начиная с группы У1Б(Сг-Мо- У). Эта тенденция объясняется постепенным уменьшением числа неспаренных -электронов у атомов металлов второй половины переходных рядов. Медь, серебро и золото обладают очень большой электро- и теплопроводностью, поскольку их электронное строение обусловливает высокую подвижность 5-электронов. Эти металлы ковки, пластичны и инертны и могут находиться в природе в металлическом состоянии. Они встречаются довольно редко и поэтому имеют высокую стоимость, но все же распространены значительно больше, чем платиновые металлы. Относительно большая распространенность и возможность существования этих металлов в природе в несвязанном виде послужили причиной того, что они явились первыми металлами, с которыми познакомился чёловск и кошрые иН научился обрабатывать. По-видимому, первым металлом, который стали восстанавливать из его руды, была медь. Металлургия началась с открытия того, что сплав меди с оловом (естественно встречающаяся примесь) дает намного более твердый материал - бронзу. Медные предметы были найдены [c.446]
Восстанопительная активность элементов в одной н той же да в пределах каждой декады снижается так, ссли Тг - — энергичный восстановитель, то 2п+ восстановителем не являстся. Соответствующим образом меняется и прочность аналогичных веществ. Наоборот, при Шиакс окислительная активность растет, так, ссли Т1+ и — слабые окислите.ци, то Сг+ и + — энергичные окислители. Невысокая стабильность многих соедииений подгрупп УП1Б и 1Б объясняет существование в природе ряда металлов в свободном состоянш (подгруппа меди, семейство плитины). [c.492]
Сульфиды. Из соединений меди с серой известны сульфиды Си. З и Си8, которые встречаются в природе в виде минералов. Медь может образовать также сульфид СиоЗз, который сравнительно неустойчив и изучен слабо. Свойства сульфидов меди ирн-ведеиы в табл, 35. [c.321]
Распространение и добыча меди. Содержание меди в земной коре составляет 5-10 %. Будучи слабым восстановителем, медь встречается в природе в самородном состоянии. Однако наиболее важными рудами меди являются содер кащне сульфидн[ле минера- [c.322]
При нанесении металлов на алюмосиликатный катализатор в газах крекинга возрастает количество водорода, сухого газа и уменьшается количество тяжелой его части. Абсолютные значения этих величин зависят от природы металла и его содержания на катализаторе. Наиболее резко состав газов в указанном направлении изменяется при содержании на катализаторах никеля, кобальта, меди, менее всего — при содержании железа, хрома свинца. С увеличением концентрации металла на катализаторе указанные тенденции усиливаются. Так, при содержании на катализаторе 0,16 вес. % никеля концентрация водорода в газе 10,5 вес. %, а сухого газа 42,0 вес. %, что соответственно в 35 и 14 раз больше, чем в газе крекинга, полученном на исходном ката.дизаторе. В то же время количество пропан-пропиленовой и бутан-бутиленовой фракции уменьшается в 1,2 раза. При содержании на катализаторе 0,5 вес. % никеля концентрация водорода в газе увеличивается в 50 раз, сухого газа — в 16 раз, а концентрация пропан-пропиленовой и бутан-бутиленовой фракций уменьшается соответственно в 1,2 и 1,4 раза. [c.159]
Количество водорода, десорбированного из многокомпонентных катализаторов, определяется в основном фазовым составом и природой легирующей добавки. Оно значительно уменьшается с увеличением содержания меди в исходных сплавах, так как образующийся в процессе плавления алюминид ugAU не выщелачивается. Резко увеличивают содержание водорода в катализаторах добавки индия, хрома, магния, платины и молибдена. [c.61]
Сорбционные свойства цеолита могут быть усилены путем введения в его состав определенных добавок, проявляющих склонность к химической ассоциации с извлекаемыми веществами. Так, например, в рецептуру цеолита, применяемого для выделения олефиновых углеводородов из их смесей с парафинами, целесообразно ввести соли металлов, образующих комплексы с олефинами — медь, никель, серебро и т. д. Иногда, наоборот, требуется подавить слишком интенсивное взаимодействие адсорбента и адсорбата, так как это может привести к необратимому поглощению части адсорбата и, как следствие, к потере активности цеолита. Примером такого явления может служить полимеризация непредельных углеводородов в порах цеолитов кислой природы. Для устранения этого нежелателыюго свойства цеолит приготовляют на основе нейтральных связующих (глин). [c.307]
chem21.info