Содержание
Как правильно подключить инвертор — плюсом на электрод или минусом
Содержание статьи:
Как правильно подключить инвертор — плюсом на электрод или минусом
Многие из начинающих сварщиков не знают, что инвертором можно варить по-разному. Они так до сих пор и используют, стандартное подключение — плюс на электрод, а минус на металл.
Однако если подключить инвертор по-другому, к минусу электрод, а к плюсу металл, то можно добиться лучшего углубления сварочного шва. Простыми словами, при таком подключении инвертора, основная температура будет приходиться на металл, в результате чего заготовка прогреется лучше.
Ну и, наоборот, при «стандартном» подключении инвертора, когда электрод подсоединяется к плюсу, а металл к минусу, удастся не прожечь тонкую заготовку. Как это работает и в чем смысл? Как правильно подключить инвертор, плюсом на электрод или минусом? Читайте в этом обзоре.
Подключение сварочного инвертора — плюс и минус
Как было сказано выше, многие начинающие сварщики не уделяют должного внимания полярности при сварке инвертором. А если быть точнее, то некоторые и вовсе про неё ничего не слышали.
А если быть точнее, то некоторые и вовсе про неё ничего не слышали.
В результате этого возникает масса проблем — тонкий металл быстро прожигается, а толстый, наоборот, недостаточно проплавляется. Просто попробуйте поэкспериментировать при подключении инвертора.
Для начала подсоедините держак к плюсу аппарата, и начните варить, а затем подключите инвертор, наоборот, держателем к минусу. Вы обязательно почувствуете разницу.
Все дело в полярности, поскольку сварочный инвертор в отличие от трансформатора переменного тока, выдаёт постоянный ток. И если на трансформаторных аппаратах такой разницы в подключении кабелей нет, то вот при сварке на постоянном токе, она ещё как есть, и, причём существенная.
Обратная полярность инвертора
В данном случае речь идёт о стандартном подключении сварочного аппарата. То есть, держатель с электродом подсоединяется к плюсовой клемме инвертора. Таким образом, есть возможность варить на обратной полярности. Что это даёт?
Во-первых, уменьшается разбрызгивание металла. Во-вторых, тонкий металл, менее 2 мм, толщиной, практически не прожигается, если выдерживать очень короткую дугу и использовать электроды подходящего диаметра, не более 2-3 мм.
Во-вторых, тонкий металл, менее 2 мм, толщиной, практически не прожигается, если выдерживать очень короткую дугу и использовать электроды подходящего диаметра, не более 2-3 мм.
Многие металлы, которые не терпят перегревания, варят именно на обратной полярности. Например, нержавейку.
Прямая полярность инвертора
В данном случае, держатель электрода подсоединяется к минусовой клемме, а масса к плюсовой. Таким образом, появляется возможность хорошо проварить толстый металл, углубить корень сварочного шва и добиться более качественного соединения.
При это важно знать, что основная часть тепла, будет приходиться на металл при сварке. В результате уменьшиться расход электродов, чем на прямой полярности. Связанно это с тем, что на обратной полярности, температура на кончике электрода больше, чем на прямой полярности, поэтому и сгорание электродов происходит быстрей.
Поделиться в соцсетях
плюс на электрод или минус?
Содержание:
Подключение сварочного аппарата: плюс на электрод или минус
При подключении сварочного аппарата, плюс можно подключить как к электроду, так и к металлу. Зачастую начинающие сварщики пренебрегают или не знают, что такое прямая и обратная полярность, и как её можно использовать.
Зачастую начинающие сварщики пренебрегают или не знают, что такое прямая и обратная полярность, и как её можно использовать.
Сварка постоянным током может осуществляться на обратной и прямой полярности. В первом случае к электроду подводится плюс, а к металлу минус от сварочного аппарата. При сварке на прямой полярности, все, наоборот — к электроду подсоединяется минус, а к металлу плюс.
Как влияет полярность на сварку электродом
Полярность играет большое значение при сварке постоянным током. Используя обратную и прямую полярность, как два абсолютно разных режима сварки, можно избавиться от проблемы, например, с прожиганием тонкостенных заготовок.
При сварке на конце электрода и поверхности металла образуется катодное и анодное пятно. Температура анодного пятна заметно выше, чем катодного, и составляет почти 4000 градусов. Анодное пятно образуется на плюсе, а катодное на минусе.
Таким образом, меняя полярность подключения сварочного аппарата, можно менять режимы сварки. При сварке на прямой полярности наибольшая часть тепла будет приходиться на металл, а не на кончик электрода. Такое обильное тепловыделение поспособствует лучшему провару и углублению корня сварочного шва.
При сварке на прямой полярности наибольшая часть тепла будет приходиться на металл, а не на кончик электрода. Такое обильное тепловыделение поспособствует лучшему провару и углублению корня сварочного шва.
И, наоборот, там, где нужно не прожечь металл, лучше применять сварку на обратной полярности. В таком случае электрододержатель подсоединяется к плюсовой клемме сварочного аппарата. В результате этого, самая большая температура возникнет на конце электрода, а не на металле.
Сварку на обратной полярности также рекомендуется использовать при работе с нержавейкой, высокоуглеродистыми и легированными сталями. В общем, с теми металлами, которые не терпят перегрева.
Следует знать. Что соблюдение полярности при сварке переменным током нет. Полярность можно менять только на сварочных аппаратах постоянного тока.
Основные правила сварки постоянным током
Сварка на прямой и обратной полярности это всего лишь режимы, при использовании которых следует принимать во внимание следующее:
- Сварка с использованием постоянного тока считается наиболее аккуратной среди электродной.
 При сварке постоянным током металл не так сильно разбрызгивается, сварной шов получается ровный и аккуратный;
При сварке постоянным током металл не так сильно разбрызгивается, сварной шов получается ровный и аккуратный; - В результате разных температур на катодном и анодном пятне, от выбора полярности будет зависеть количество наплавленного металла.
Какая бы полярность при сварке постоянным током не использовалась, правила остаются прежними. Для получения качественного и надежного сварочного соединения очень важно подготовить металл. На нем не должно быть грязи и следов краски.
Перед свариванием заготовки лучше всего будет зафиксировать струбцинами. Также, очень важно выбрать правильную величину сварочного тока, учитывая толщину свариваемого металла и диаметр используемых электродов.
В чем разница между положительным и отрицательным электродами, анодом и катодом: основы аккумуляторов
Тема
15 минут чтения
Последнее обновление: 13 июня 2022 г.
Аноды, катоды, положительные и отрицательные электроды: определение терминов
Значительные разработки были сделаны в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей . Эта работа помогла в 2019 г.Нобелевская премия по химии присуждается за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» получили все большее распространение.
В статьях о новых аккумуляторных электродах часто используются названия анод и катод без указания, разряжается аккумулятор или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, иногда их можно перепутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти разные термины.
- Анод – это электрод, на котором происходит реакция окисления (потеря электронов для электроактивных частиц).

- Катод — это электрод, на котором происходит реакция восстановления (приобретение электронов для электроактивных частиц).
- В батарее на одном и том же электроде могут происходить обе реакции, независимо от того, разряжается батарея или заряжается.
- При наименовании электродов лучше ссылаться на положительный электрод и отрицательный электрод.
- Положительный электрод — это электрод с более высоким потенциалом, чем отрицательный электрод.
- Во время разряда положительный электрод является катодом, а отрицательный электрод — анодом.
- Во время зарядки положительный электрод является анодом, а отрицательный электрод — катодом.
Реакции окисления и восстановления
- Реакция окисления – это электрохимическая реакция, в результате которой образуются электроны. Электрохимическая реакция, происходящая на отрицательном полюсе цинкового электрода никель-цинковой батареи при разряде: 9- \to LiCoO_2}$
– реакция восстановления.
 Редукция — это приобретение электронов.
Редукция — это приобретение электронов.Анод, катод
- Анод – это электрод, на котором протекает реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: $E_\text a(I)>E_{I=0}$ (рис. 1).
- Катод – это электрод, на котором протекает реакция восстановления. Потенциал катода, через который протекает ток, ниже его равновесного потенциала: $E_\text c(I)
Рисунок 1: $ (e_ {i \ neq 0} -e_ {i = 0}) \; i> 0 $
Положительные и отрицательные электроды
The Два два электроды батарейки или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом называется положительным, электрод с более низким потенциалом — отрицательным. Электродвижущая сила, ЭДС в В, батареи представляет собой разницу между потенциалами положительного и отрицательного электродов, когда батарея не работает.
 +$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.
+$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.
Рис. 3. Разряд/заряд вторичной батареи, представленной в виде гальванического элемента, с электронами и направлением тока.
Заключение
При нормальном использовании аккумуляторной батареи потенциал положительного электрода как при разрядке, так и при перезарядке остается выше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода меняется во время цикла разрядки/зарядки.
- Во время разряда положительным является катод, отрицательным — анод.
- Во время заряда плюс является анодом, минус катодом.
Тексты, описывающие аноды или катоды аккумуляторов, безусловно, имплицитно рассматривают случай разряда. Давайте без колебаний напишем, перефразируя Резерфорда, имплицитное есть не что иное, как плохое явное.
Узнайте больше о потенциостатах и амплификаторах аккумуляторов
Чтобы узнать больше о потенциостатах BioLogic, которые используются в исследованиях аккумуляторов и тестировании аккумуляторов, а также в других областях, представляющих интерес, щелкните нашу страницу обзора потенциостатов и страницу обзора тестирования аккумуляторов/циклов аккумуляторов.
Узнайте больше о кривых цикла работы батареи
Может быть интересна следующая статья «Как читать кривые цикла работы батареи»
батарея
анод
катод
положительный
отрицательный электрод
Дальнейшее чтение…
-
chevron_right
Сопутствующие товары
-
chevron_right
Циркулятор аккумуляторов серии BCS-800
Серия BCS-800 представляет собой модульную систему циклирования аккумуляторов, предназначенную для удовлетворения потребностей каждого уровня производственно-сбытовой цепочки аккумуляторов, от исследований и разработок до пилотного производства, от производственных испытаний до контроля качества.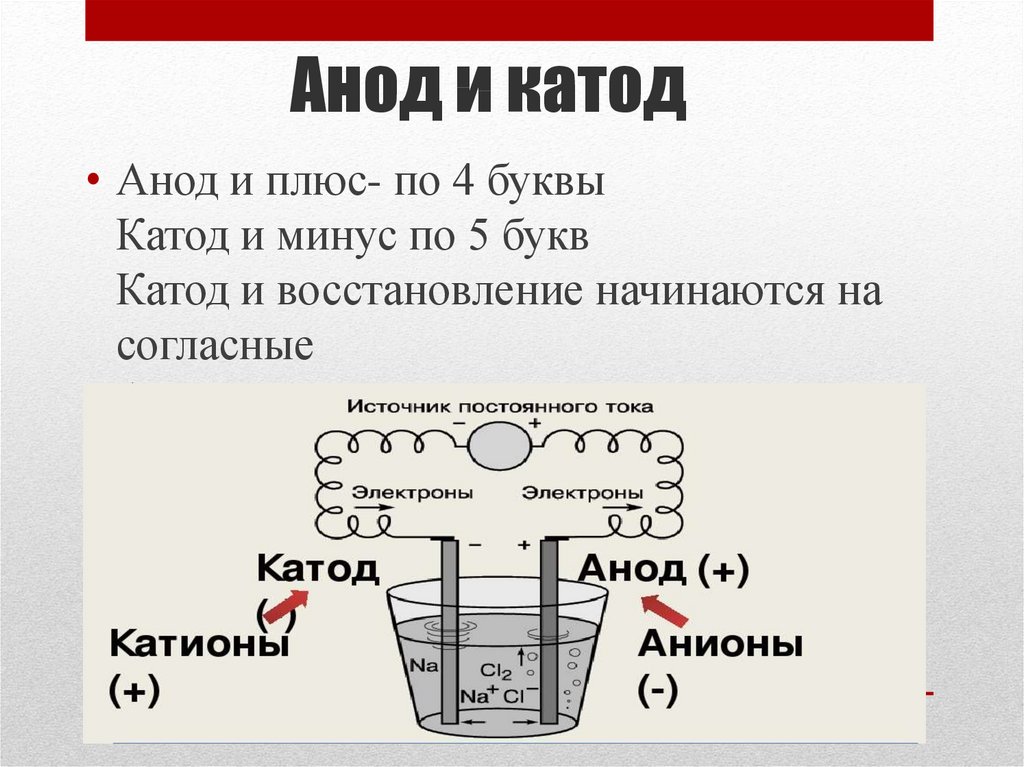 Состоящие из трех основных продуктов (BCS-805, 810 и 815), эти передовые аккумуляторные циклеры предлагают 8 независимых каналов с максимальным током ±150 мА, ±1,5 А и ±15 А соответственно на канал.
Состоящие из трех основных продуктов (BCS-805, 810 и 815), эти передовые аккумуляторные циклеры предлагают 8 независимых каналов с максимальным током ±150 мА, ±1,5 А и ±15 А соответственно на канал.
физическая химия – положительный или отрицательный анод/катод в электролитическом/гальваническом элементе
спросил
Изменено
2 года, 4 месяца назад
Просмотрено
577 тысяч раз
$\begingroup$
В гальваническом элементе анод считается отрицательным, а катод считается положительным. Это кажется разумным, поскольку анод является источником электронов, а катод — местом, куда текут электроны.
Однако в электролитической ячейке анод считается положительным, а катод теперь отрицательным.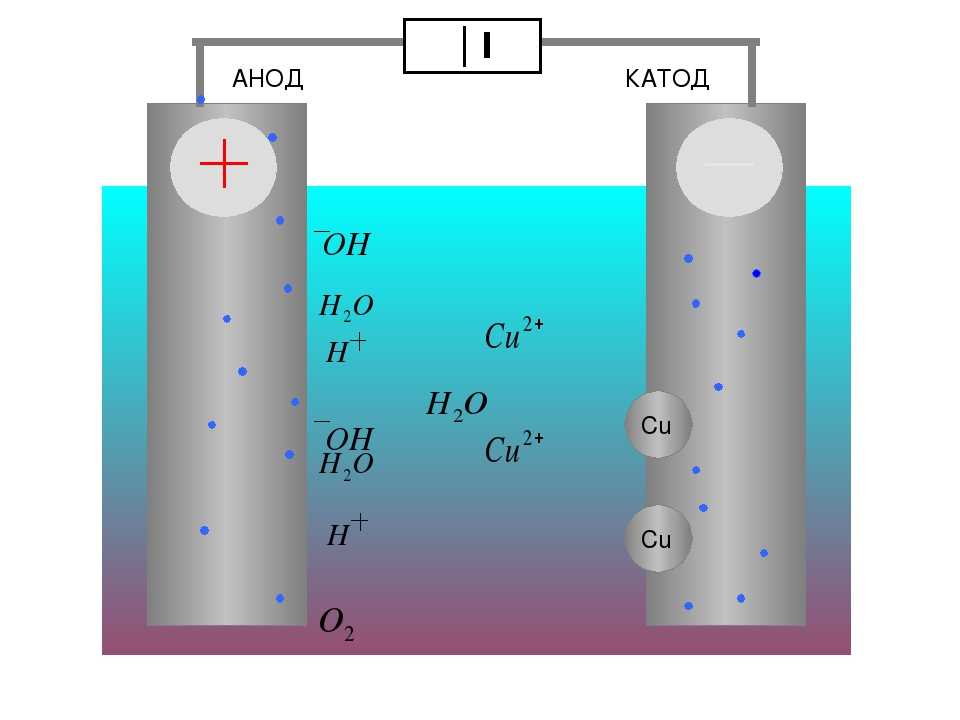 Однако реакция все еще похожа, в результате чего электроны от анода текут к положительному выводу батареи, а электроны от батареи текут к катоду.
Однако реакция все еще похожа, в результате чего электроны от анода текут к положительному выводу батареи, а электроны от батареи текут к катоду.
Так почему знак катода и анода меняется при рассмотрении электролизера?
- физико-химия
- электрохимия
$\endgroup$
$\begingroup$
Анод – это электрод, на котором протекает реакция окисления
\begin{align}
\ce{Красный -> Бык + e-}
\end{align}
имеет место, когда катод является электродом, на котором протекает реакция восстановления
\begin{align}
\ce{Бык + e- -> Красный}
\end{align}
. Вот как определяются катод и анод.
Гальванический элемент
Так вот, в гальваническом элементе реакция протекает без помощи внешнего потенциала. Поскольку на аноде идет реакция окисления, в результате которой образуются электроны, в ходе реакции накапливается отрицательный заряд до тех пор, пока не будет достигнуто электрохимическое равновесие. Таким образом, анод отрицательный.
Таким образом, анод отрицательный.
На катоде, с другой стороны, происходит реакция восстановления, которая потребляет электроны (оставляя положительные (металлические) ионы на электроде) и, таким образом, приводит к накоплению положительного заряда в ходе реакции до электрохимического достигается равновесие. Таким образом, катод положительный.
Электролитическая ячейка
В электролитической ячейке вы прикладываете внешний потенциал, чтобы заставить реакцию идти в противоположном направлении. Теперь рассуждения обратные. На отрицательном электроде, где вы создали высокий электронный потенциал с помощью внешнего источника напряжения, электроны «выталкиваются» из электрода, тем самым уменьшая окисленные частицы $\ce{Ox}$, поскольку уровень энергии электронов внутри электрода (Ферми уровень) выше энергетического уровня НСМО $\ce{Ox}$, и электроны могут понизить свою энергию, занимая эту орбиталь — так сказать, у вас очень реактивные электроны. Таким образом, отрицательный электрод будет тем, где будет происходить реакция восстановления, и, следовательно, это будет катод.
На положительном электроде, где вы создали низкий электронный потенциал с помощью внешнего источника напряжения, электроны «всасываются» в электрод, оставляя после себя восстановленные частицы $\ce{Red}$, поскольку уровень энергии электронов внутри электрода (Ферми Уровень) ниже энергетического уровня ВЗМО $\ce{Red}$. Таким образом, положительный электрод будет тем, где будет происходить реакция окисления, и, следовательно, это анод.
Сказка об электронах и водопадах
Поскольку существует некоторая путаница в отношении принципов, на которых работает электролиз, я попытаюсь объяснить это с помощью метафоры. Электроны перетекают из области высокого потенциала в область низкого потенциала подобно тому, как вода падает водопадом или течет по наклонной плоскости. Причина та же: вода и электроны могут таким образом понизить свою энергию. Теперь внешний источник напряжения действует как две большие реки, соединенные с водопадами: одна на большой высоте, которая ведет к водопаду — это будет отрицательный полюс, а другая на низкой высоте, которая уводит от водопада — это будет плюс. столб. Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод подобен краю водопада, где вода падает, а анод — точке, куда вода падает.
столб. Электроды будут похожи на точки реки незадолго до или после водопадов на этой картинке: катод подобен краю водопада, где вода падает, а анод — точке, куда вода падает.
Хорошо, что происходит при реакции электролиза? На катоде у вас есть ситуация на большой высоте. Так электроны текут к «краю своего водопада». Они хотят «упасть», потому что за их спиной река тянется к краю, оказывая какое-то «давление». Но куда они могут упасть? Другой электрод отделен от них раствором и обычно диафрагмой. Но есть молекулы $\ce{Ox}$ с пустыми состояниями, которые энергетически ниже состояния электрода. Эти пустые состояния подобны небольшим прудам, лежащим на более низкой высоте, куда может упасть немного воды из реки. Таким образом, каждый раз, когда такая молекула $\ce{Ox}$ приближается к электроду, электрон пользуется возможностью прыгнуть к ней и превратить ее в $\ce{Red}$. Но это не означает, что электроду внезапно не хватает одного электрона, потому что река немедленно заменяет «вытолкнутый» электрон.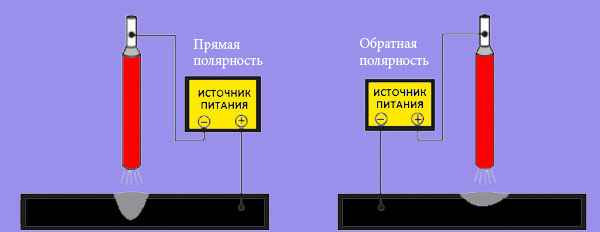 И источник напряжения (источник реки) не может исчерпать электроны, потому что он получает свои электроны из розетки.
И источник напряжения (источник реки) не может исчерпать электроны, потому что он получает свои электроны из розетки.
Теперь анод: На аноде у вас ситуация с малой высотой. Так что здесь река лежит ниже всего остального. Теперь вы можете представить ВЗМО-состояния молекул $\ce{Red}$ в виде небольших барьерных озер, лежащих на большей высоте, чем наша река. Когда молекула $\ce{Red}$ приближается к электроду, это как будто кто-то открывает шлюз плотины барьерного озера. Электроны перетекают из ВЗМО в электрод, создавая молекулу $\ce{Ox}$. Но электроны не остаются, так сказать, в электроде, их уносит река. И поскольку река представляет собой такое обширное образование (много воды) и обычно впадает в океан, добавление небольшого количества «воды» не сильно меняет реку. Он остается прежним, неизменным, так что каждый раз, когда открывается шлюз, вода из барьерного озера падает на одно и то же расстояние.
$\endgroup$
9
$\begingroup$
Электрод, на котором происходит окисление, называется анодом, а электрод, на котором происходит восстановление, называется катодом. -} $, а в 9- \длинная правая стрелка\; Бык }$.
-} $, а в 9- \длинная правая стрелка\; Бык }$.
Реакции восстановления и окисления всегда связаны друг с другом, поэтому один электрод действует как источник электронов, а другой — как приемник. В гальваническом элементе общая реакция протекает самопроизвольно, и ток течет от анода к катоду. С другой стороны, в электролитической ячейке мы управляем реакцией неспонтанно, применяя внешний потенциал (например, используя источник питания).
Я думаю, что это изображение должно прояснить работу обоих типов клеток, процессы, происходящие на каждом электроде, и соглашение о знаках.
Хотя он иллюстрирует специфическую реакцию, вы можете распространить его на другие системы.
Источником изображения является Электролиз I в Chemistry.LibreTexts.
$\endgroup$
0
$\begingroup$
Я не эксперт и не ученый, но из того, что я читаю во всех этих объяснениях, и того, что я замечаю на иллюстрации, становится очевидным. .. по крайней мере, для меня… что, как мне кажется, может прояснить полярность переключение между гальваническим элементом и электролитическим элементом для этого пользователя.
.. по крайней мере, для меня… что, как мне кажется, может прояснить полярность переключение между гальваническим элементом и электролитическим элементом для этого пользователя.
Как установлено и понятно, источник электронов и перенос ионов течет от отрицательного полюса (анод) и принимается положительным полюсом (катодом) (намеренно используя самые основные термины) анод здесь отрицательный, потому что поток исходит ИЗ электролита в лампочку, для которой, если бы клеммы лампочки были помечены, они соответствовали бы электролиту в другой ячейке, так как сила, исходящая от лампочки, толкает поток к катоду ячейки, и катод ячейки вытягивается из колбы.
В электролитической ячейке «электролит» берет на себя роль лампочки гальванической ячейки, так как электроны ПОСЫЛАЮТСЯ К нему из источника питания, и сам по себе не является ИСТОЧНИКОМ потока, но ПОДЛЕЖИТ К силе от источника потока.
ТАК так же, как анод гальванического элемента посылает на лампочку, а электролит помечен как нагрузка гальванического элемента, и передает свою поступающую отрицательную силу от источника тока, и это проталкивает электролит как поток ОТ лампочка.
Может быть проще, если вы заметите, что ИСТОЧНИК питания НЕ является электролитом и технически черный вывод источника питания является ИСТИННЫМ анодом (Передача), а красная сторона ИСТИННЫМ Катодом (Прием), но при идентификации реактивное вещество погружено/окружено электролитическим веществом, анод отдает свои ионы, которые затем присоединяются к катоду, который их получает.
Поэтому метки в электролитической ячейке указывают не на «источник потока», а на реакцию вовлеченных веществ из-за силы/потока, воздействующей на них от источника питания, но не являющегося источником питания, и поэтому не должен быть маркирован как АС один… и вариантов их маркировки всего два, и так как он не может быть изменен в источнике питания, он может быть изменен только в месте контакта с электролитом!
По крайней мере, это то, что я понял, просмотрев комментарии и иллюстрации.
Я искренне надеюсь, что это поможет прояснить причину смены меток для этого пользователя и любых других, которые борются с концепцией существования из-за того, что источник тока должен быть помечен как — Анод и + Катод. .. заставляя объект ток играет против, несмотря на их полюса и из-за направления потока.
.. заставляя объект ток играет против, несмотря на их полюса и из-за направления потока.
$\endgroup$
$\begingroup$
Знаки (+) и (-) относятся к потоку электронов в источнике питания. В гальваническом (гальваническом) элементе сама ячейка является источником питания. В электролитической ячейке ячейка подключена к внешнему источнику питания. Таким образом, в то время как обозначение анода и катода напрямую связано с направлением потока электронов в ячейке, то, как (+) и (-) относятся к аноду и катоду, зависит от того, идет ли реакция к равновесию или нет (в случае перезаряжаемых батарей, независимо от того, разряжаете вы батарею или заряжаете ее). В зависимости от направления реакции меняются метки анода и катода, а метки (+) и (-) остаются прежними.
Пример иллюстрирует это.
Вот две свинцово-кислотные батареи, соединенные вместе таким образом, что заряженная заряжает разряженную:
Обозначения (+) и (-) относятся к направлению движения электронов, если они разряжаются (конечно, разряженные батареи). аккумулятор дальше разряжаться не может, так что экспериментально не скажешь). Метки анода и катода относятся к конкретной ситуации. Поэтому, если вы подключите источник питания с более высоким напряжением к заряженной батарее вместо разряженной батареи, вы будете заряжать ее дальше. Это обратит химическую реакцию в этой батарее, и метки анода и катода придется поменять местами.
аккумулятор дальше разряжаться не может, так что экспериментально не скажешь). Метки анода и катода относятся к конкретной ситуации. Поэтому, если вы подключите источник питания с более высоким напряжением к заряженной батарее вместо разряженной батареи, вы будете заряжать ее дальше. Это обратит химическую реакцию в этой батарее, и метки анода и катода придется поменять местами.
В другом сценарии вы можете взять две 12-вольтовые батареи и соединить их последовательно (соедините (+) одной с (-) другой). Это даст вам 24-вольтовую батарею, и если вы подключите к ней потребитель, катод будет (+), а анод будет (-) для них обоих.
Для свинцово-кислотных аккумуляторов знаки (+) и (-) никогда не меняются, поэтому можно постоянно маркировать электроды. В ячейке концентрации (+) и (-) зависят от концентрации окислительно-восстановительных соединений в двух половинных ячейках, поэтому вы не можете пометить их «постоянным маркером».
$\endgroup$
$\begingroup$
Анод – это электрод, на котором протекает полуреакция окисления.
В гальваническом элементе реакция идет самопроизвольно, внешний потенциал не приложен, и когда материал анода окисляется, анод становится отрицательным электродом. В электролитической ячейке именно внешний потенциал запускает реакцию, анод — это электрод, на котором происходит реакция окисления, следовательно, на этот раз это электрод с положительным потенциалом.
$\endgroup$
1
$\begingroup$
Я просто добавляю хороший мнемонический инструмент, как запомнить соглашение об именах:
Анод = анабазис (от греческого ana = «вверх», bainein = «шагать или маршировать»), электроны будут двигаться вверх от электрод к проволоке = окисление .
Ксенофонт, Анабасис, «Марш вверх по стране»
Катод = катабазис (путешествие вниз), электроны будут двигаться вниз от провода к электроду = восстановление
Термины анабазис/катабазис применяются и в других областях.
 При сварке постоянным током металл не так сильно разбрызгивается, сварной шов получается ровный и аккуратный;
При сварке постоянным током металл не так сильно разбрызгивается, сварной шов получается ровный и аккуратный;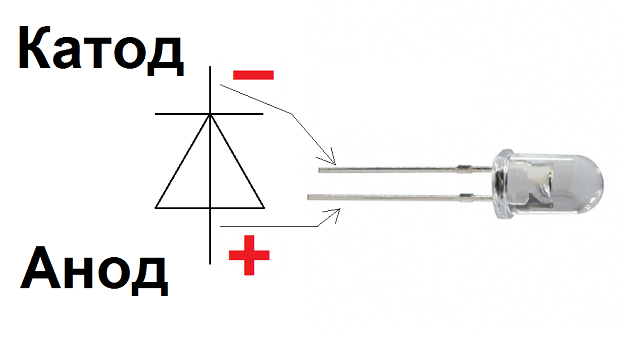
 Редукция — это приобретение электронов.
Редукция — это приобретение электронов.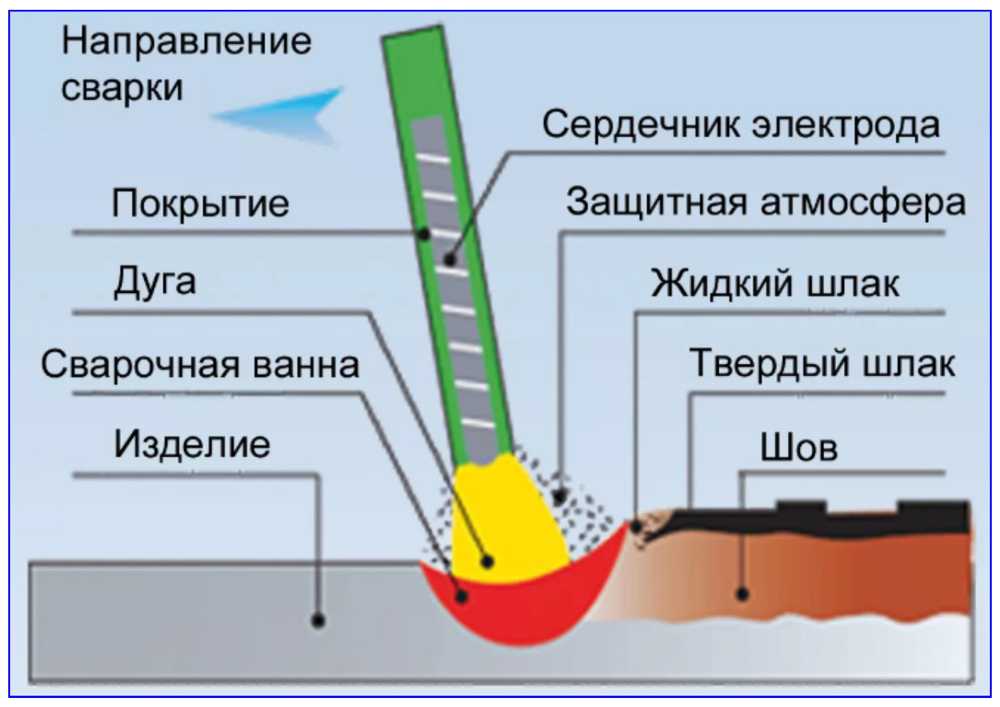 +$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.
+$ → положительный электрод является анодом. 9-$ → отрицательный электрод является катодом.