Содержание
Развитие и усовершенствование 40Ar/39Ar метода датирования
На сегодняшний день 40Ar/39Ar метод датирования является одним из наиболее востребованных методов определения возраста горных пород и минералов. Данный метод используется во многих лабораториях мира.
При 40Ar/39Ar датировании возраст образца определяется по изотопному составу содержащегося в нём аргона. Аргон выделяют поэтапно путём ступенчатого нагрева образца, на каждой ступени нагрева анализируется изотопный состав выделенного газа. В результате данной процедуры формируется зависимость значения возраста от доли выделенного 39Ar – возрастной спектр. Возрастной спектр представляют в виде ступенчатой функции, каждая ступень которой соответствует этапу выделения аргона. Возрастной спектр является одной из основных характеристик образца.
Поскольку количество ступеней выделения аргона из образца всегда ограниченно, на каждом этапе дегазации, фактически, измеряется изотопный состав аргона, усреднённый по доле выделенного газа, что приводит к искажениям возрастного спектра. На сколько данные искажения могут быть велики показывает пример представленный на рисунке 1. Сплошной чёрной линией обозначен экспериментальный возрастной спектр клинопироксена (образец предоставлен Афанасьевым В.П.), красной пунктирной линией – теоретическая модель истинного возрастного спектра того же образца согласующаяся с экспериментальными данными. Детальному измерению возрастных спектров препятствует ряд технических причин, основная трудность заключается в отсутствии возможности прогнозировать количество газа выделяемого на той или иной ступени дегазации образца. В современной литературе, как отечественной, так и зарубежной, описанная проблема не обсуждалась.
На сколько данные искажения могут быть велики показывает пример представленный на рисунке 1. Сплошной чёрной линией обозначен экспериментальный возрастной спектр клинопироксена (образец предоставлен Афанасьевым В.П.), красной пунктирной линией – теоретическая модель истинного возрастного спектра того же образца согласующаяся с экспериментальными данными. Детальному измерению возрастных спектров препятствует ряд технических причин, основная трудность заключается в отсутствии возможности прогнозировать количество газа выделяемого на той или иной ступени дегазации образца. В современной литературе, как отечественной, так и зарубежной, описанная проблема не обсуждалась.
В лаборатории изотопно-аналитических методов ИГМ СО РАН был создан специальный численный алгоритм, позволяющий по экспериментальным данным выполнять реконструкцию истинного возрастного спектра. На основе указанного алгоритма был создан новый метод измерения возрастных спектров с высоким разрешением по доле выделенного газа. Предложенный метод измерений позволяет по мере необходимости уточнять возрастной спектр или его отдельные участки, а также выделять и корректировать ступени с грубой ошибкой. На рисунке 2 в качестве примера представлен возрастной спектр долерита (образец предоставил Делпомдор Ф.). Синим обозначен возрастной спектр, полученный классическим методом, красным – возрастной спектр, полученный с помощью предложенного метода измерений. Чёрным выделены ступени с грубой ошибкой.
Предложенный метод измерений позволяет по мере необходимости уточнять возрастной спектр или его отдельные участки, а также выделять и корректировать ступени с грубой ошибкой. На рисунке 2 в качестве примера представлен возрастной спектр долерита (образец предоставил Делпомдор Ф.). Синим обозначен возрастной спектр, полученный классическим методом, красным – возрастной спектр, полученный с помощью предложенного метода измерений. Чёрным выделены ступени с грубой ошибкой.
Д.В. Алексеев, А.В. Травин Измерение и аппроксимация возрастных спектров горных пород и минералов при 40Ar/39Ar датировании // Геология и геофизика. 2017. В печати.
Д.В. Алексеев, А.В. Травин Способ измерения характеристики изотопной системы образца при поэтапном выделении анализируемого вещества (варианты) // Заявка на патент № 2015148529/15(074674)
Работа выполнена в рамках государственного задания, проект № 0330-2014-0010, при поддержке гранта РФФИ 16-35-00482 мол_а.
Рис.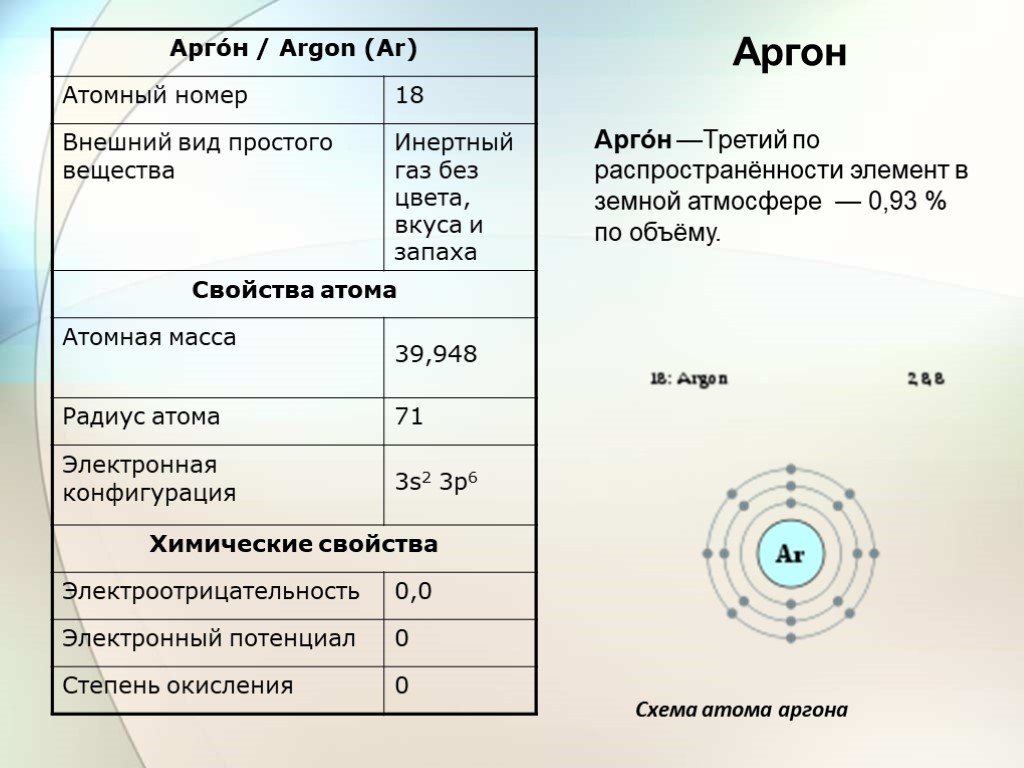 1. Возрастной спектр клинопироксена.
1. Возрастной спектр клинопироксена.
Рис. 2. Возрастной спектр долерита.
Что лучше: углекислота или сварочная смесь?
Защитные газы, применяемые при сварке, подаются к месту образования сварочного шва и обеспечивают защиту дуги и сварочной ванны от атмосферных газов. Это позволяет повысить качество соединения. К тому же защитные газы, влияя на состав шва, увеличивают его плотность и глубину провара, улучшают микроструктуру металла.
В сварочных работах используется два вида защитных газов: чистая углекислота без примесей и газовые смеси. Каждый из вариантов характеризуется своими особенностями, имеет свои достоинства и недостатки, свою область применения, которые необходимо учитывать при выборе.
От выбора защитного газа зависит и рабочий процесс, и результат работы. Следует помнить, что для разных видов сварки выбор защитного газа влияет на эффективность и качество работы. Именно выбор защитного газа сказывается на глубине плавления, пористости и надежности шва, выделении дыма и других характеристиках.
Применение углекислоты
Углекислота (двуокись углерода CO2) — единственное вещество, которое используют при сварке в чистом виде, то есть без добавления инертного газа. К тому же этот вариант защиты один из самых недорогих, поэтому он достаточно популярен в случаях, когда материальная сторона стоит на первом месте. Углекислота является наиболее часто применяемым из химически активных газов при MAG методе, используемом при сварке заготовок из не легированных, низколегированных и коррозионно-устойчивых сталей. Она позволяет получить значительный тепловой эффект, что необходимо при работе с металлическими заготовками большой толщины. Однако дуга при этом не особо стабильна, а это приводит к разбрызгиванию металла. Поэтому используют углекислоту в чистом виде только при работе на короткой дуге.
Чистый углекислый газ более плотный, чем воздух, подаваемый в зону сварки, вытесняет воздух, создавая защитную среду. Двуокись углерода можно использовать при ручной, полуавтоматической и автоматической сварке.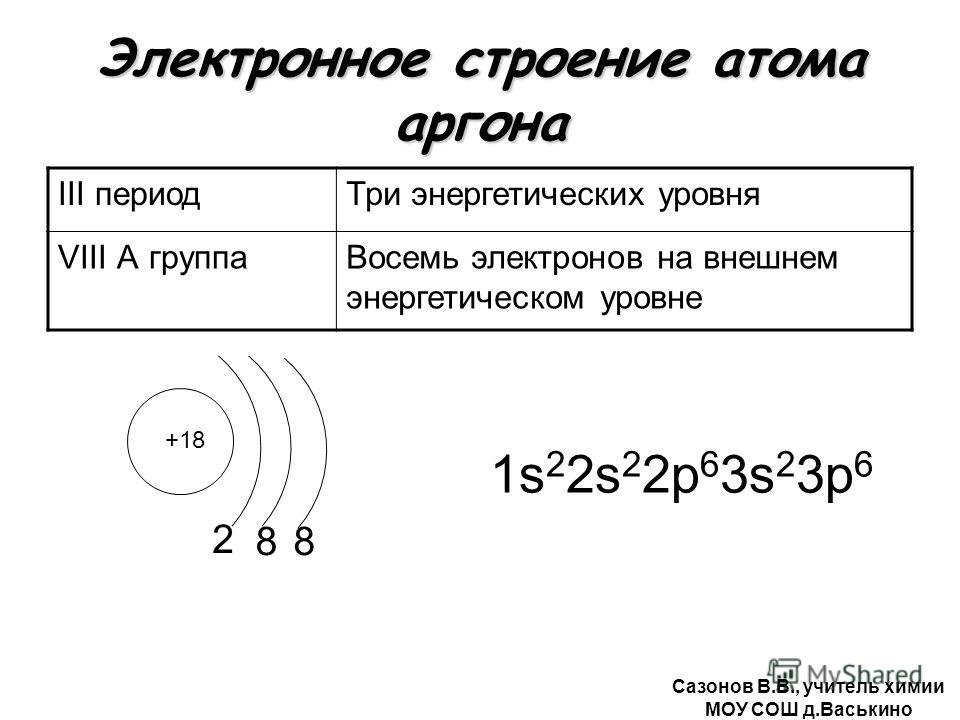 Чаще всего ее применяют при полуавтоматической сварке.
Чаще всего ее применяют при полуавтоматической сварке.
Железо и углерод, входящие в состав стали свариваемых деталей, под действием углекислого газа при сварке в его среде окисляются. Поэтому при формировании шва для предотвращения окисления металла используют специальную присадочную проволоку, содержащую марганец и кремний. Расход углекислоты зависит от: толщины соединяемых металлических деталей, диаметра присадочной проволоки и параметров подаваемого на электрод тока.
Применение сварочных смесей
Существенно повысить качество и эффективность сварочных работ позволяет применение сварочных защитных смесей, составленных в определенной пропорции. Применение правильно подобранной сварочной смеси не только повышает производительность, но и позволяет получить более качественные и надежные швы, благодаря таким особенностям:
- повышение стабильности дуги;
- возрастание скорости наплавления металла;
- снижение разбрызгивания;
- повышение пластичности и плотности шва;
- уменьшение задымленности.

Для того, чтобы сделать выбор между углекислотой и определенной сварочной смесью, необходимо учесть сложность предстоящей сварочной работы, требуемое качество шва, целесообразность и возможность материальных затрат.
Основные виды защитных газовых сварочных смесей
Основу защитных сварочных смесей составляет инертный газ аргон, который можно смешивать как с другими инертными газами, так и с газами активными. Наиболее распространенными являются следующие защитные сварочные смеси:
- Аргон с углекислотой. Применяется для сварки заготовок из низкоуглеродистых и низколегированных сталей. Смесь облегчает перенос материала электрода, позволяет получить ровный и пластичный шов, снижает образования пор;
- Аргон с кислородом (O2 до 5 %). Применяется для сварки изделий из низколегированных и легированных сталей. За счет снижения пористости металла повышается плотность шва, облегчается струйный перенос материала электрода.
 Позволяет применять присадочную проволоку более широкого ассортимента;
Позволяет применять присадочную проволоку более широкого ассортимента; - Аргон с водородом. Применяют при соединении заготовок из никелевых сплавов и нержавеющей стали методом TIG. Так же может использоваться как формовочный газ.
- Аргон с гелием. В такой абсолютно инертной среде производят сварку деталей из алюминия, титана, меди, хромоникелевой стали методами MIG и TIG.
- Аргон и активные газы. Такое сочетание обеспечивает двукратную экономию. Используется в ручной и автоматической MAG сварке легированных сталей.
- Углекислота с кислородом. Применяется при сварке из углеродистых и низколегированных сталей. Обеспечивает формирование более ровного шва за счет снижения разбрызгивания металла. Существенное повышение температуры в зоне сварки позволяет повысить производительность работ. Однако повышенное окисление металла снижает прочностные характеристики соединения.
- Универсальный защитный газ.
 Представляет собой аргон высокой частоты. Газ универсален в своем применении, но наибольшее распространение получил при сварке алюминия и других цветных металлов.
Представляет собой аргон высокой частоты. Газ универсален в своем применении, но наибольшее распространение получил при сварке алюминия и других цветных металлов.
Способы смешивания газа
Для получения газовой защитной смеси используются два способе — производственный и непосредственно на рабочем месте.
При производственном методе получения смеси используются специальные газовые смесители, позволяющие смешивать 2–3 различных компонента. Получения заданного процентного соотношения обеспечивается подбором соответствующих диаметров расходных отверстий и тарировкой самого смесителя.
Простой способ смешивания, выполняемый на рабочем месте, использует ротаметр. Состав смеси аргона и-углекислоты или углекислоты и кислорода регулируется с помощью редукторов на газовых баллонах. Регулируя расход и контролируя показания ротаметра, добиваются требуемого соотношения используемых составляющих. Однако такой метод не позволяет обеспечивает максимальной точности, что сказывается на качестве шва.
Выводы: сварочная смесь или углекислота — что же лучше?
Основные различия между чистой углекислотой и сварочными смесями:
- углекислоту можно использовать только при сварке ограниченного вида металлов — углеродистых и низколегированных сталей, а сварочные смеси имеют более широкую сферу применения — их применяют при сварке различных цветных металлов и сплавов;
- углекислота — однородный газ, а сварочные смеси получают смешиванием в определенных пропорциях разных газов, для чего нужно специальное оборудование;
- производительность сварки в защитной среде из сварочных смесей значительно выше, чем в среде углекислого газа.
Общее у этих защитных газовых сред — улучшение качества и повышение производительности сварочных работ.
Основной вывод: преимущества сварочных смесей перед углекислотой заключается в возможности работать с различными материалами, более высокая производительность и более высокое качество соединений. Однако использование углекислого газа предпочтительнее при работе с определенными материалами и полуавтоматической сварке.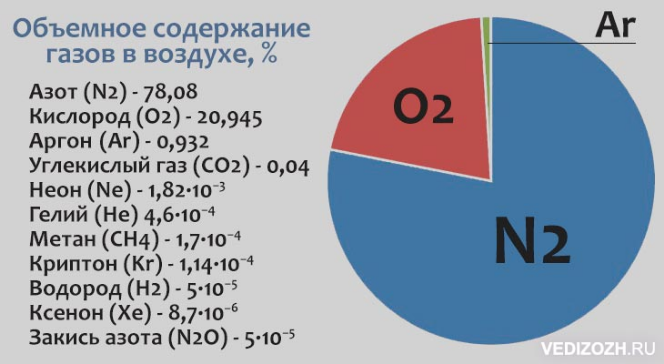
Формула газа аргона. Структура, свойства, использование, примеры вопросов
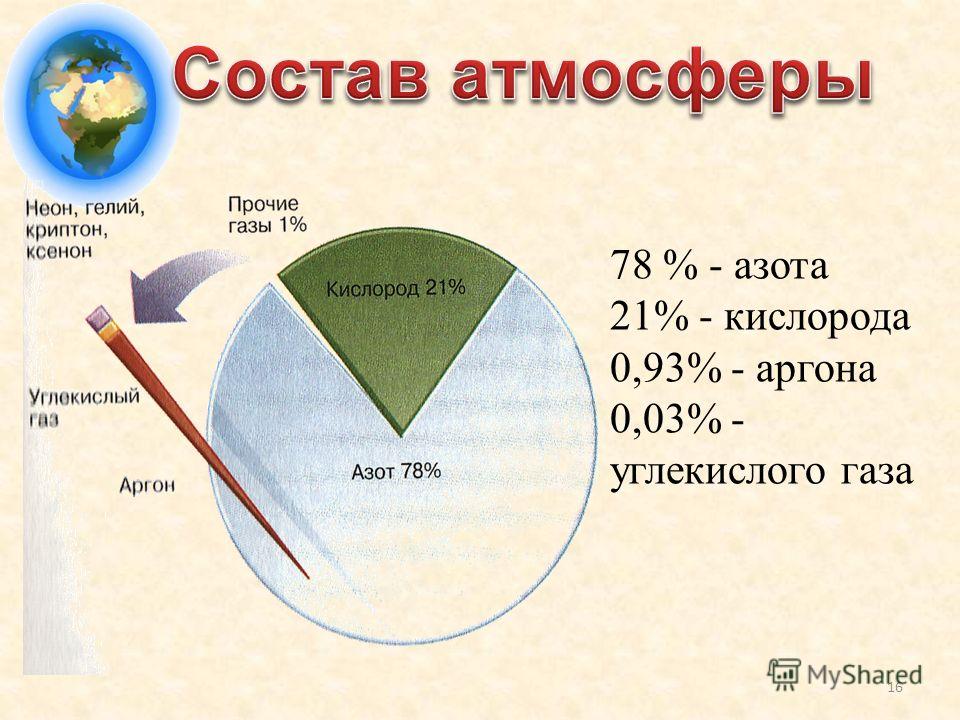
Аргон — химический элемент с атомным номером 18. Он принадлежит к 18-й группе периодической таблицы и является третьим по величине газом аргоном. Газ, используемый в люминесцентных лампах, представляет собой одноатомный аргон. Он имеет молекулярную формулу Ar. Аргон — негорючий газ, не имеющий цвета и запаха и имеющий более высокую плотность, чем воздух. Когда он подвергается сильному нагреванию или огню, материал сильно разрывается. Аргон — первый обнаруженный нобелевский газ. Его признали английский физик лорд Рэлей и шотландский ученый Уильям Рамсей в 189 г.4. Аргон происходит от греческого слова «аргос», что означает «ленивый» или «неактивный». Он имеет место с респектабельным газом и составляет около 0,93% земного воздуха. Это третий по распространенности газ в воздухе.
Формула газа аргона
Его химическая формула – Ar. Он имеет молекулярную массу 39,948 г/моль. Это стабильный газ, он не имеет цепной структуры.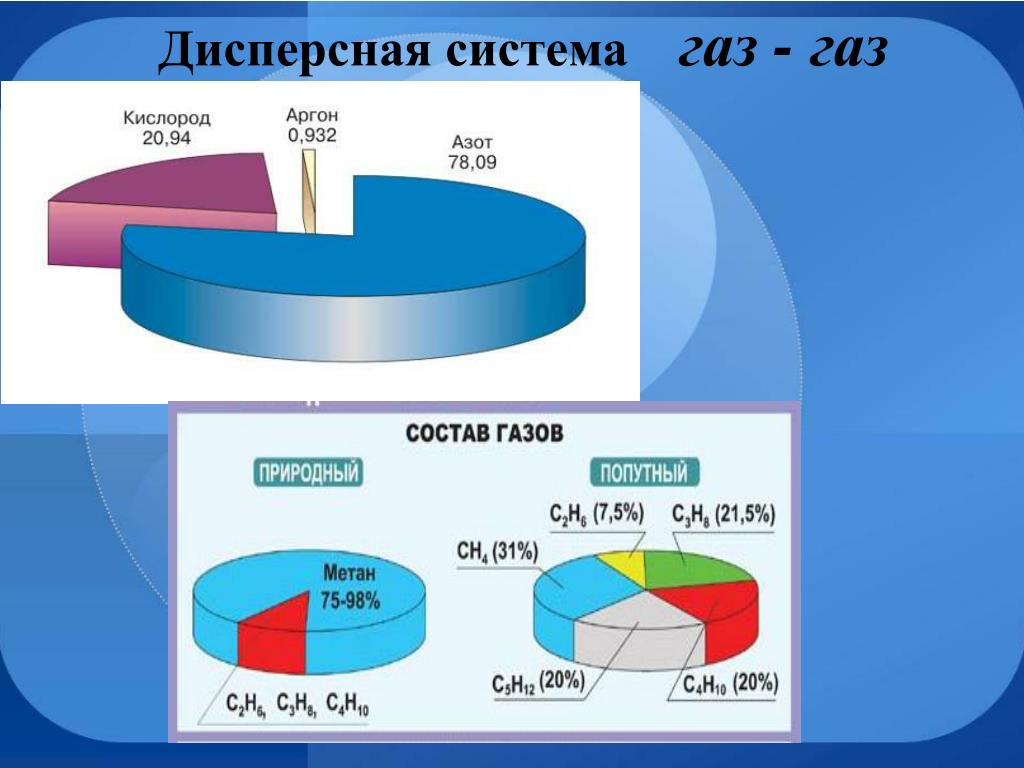 Однако существует газовая структура аргона, показывающая орбиты,
Однако существует газовая структура аргона, показывающая орбиты,
Наличие аргона
Мировой климат устанавливается на уровне около 0,934% по объему и 1,288% по массе. Кроме того, воздух является важным современным источником дезинфицирующих аргоновых изделий. С помощью фракционирования предприятия отделяют аргон от воздуха, и чаще всего криогенная частичная очистка представляет собой взаимодействие, при котором образуются другие чистые газы, такие как азот, неон, ксенон и кислород. Морская вода содержит 0,45 частей на миллион аргона, а окружающая среда содержит около 1,2 частей на миллион аргона.
Производство аргона
Механическим путем производят частичную очистку жидкого воздуха. Аргон — это инертный защитный газ, который мы по большей части используем при сварке и других современных циклах, требующих высокой температуры, при которой нормальные безжизненные вещества становятся чувствительными, как в графитовых электрических нагревателях, которые используют его, чтобы предотвратить потребление графита.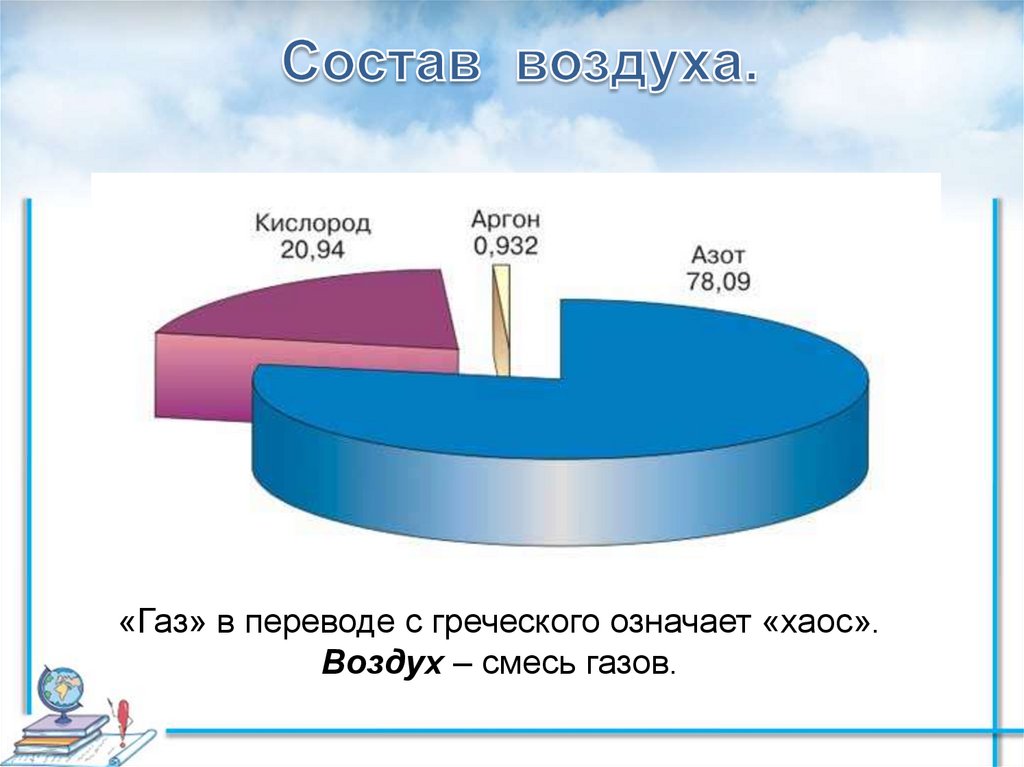
Свойства газообразного аргона
Аргон как элемент обладает набором свойств, которые отличают его от других элементов периодической таблицы и даже от других благородных газов. Эти свойства включают его атомные свойства, физические свойства и химические свойства.
Атомные свойства аргона
Атомные свойства аргона относятся к свойствам одного атома аргона. К ним относятся:
- Атомный номер: 18
- Атомная масса: 39,948
- Количество электронов: 18
- Валентность (степени окисления): 0
- Распространенные изотопы: аргон-36, аргон-403 9 004, 38
Физические свойства газообразного аргона
- Температура плавления аргона составляет -189 °С, а температура кипения -185,7 °С. Это означает, что он существует в виде газа при стандартных условиях.
- Газообразный аргон бесцветен, не имеет вкуса и запаха
- Как неметалл, агрон имеет очень низкую металличность и является плохим проводником тепла и электричества
- Плотность аргона составляет 0,00178 г на кубический сантиметр
- Аргон в 2,5 раза более растворим в воде, чем азот, и имеет одинаковую растворимость в воде с кислородом.

Химические свойства газообразного аргона
- Известно, что аргон химически неактивен. В некоторых редких случаях и в экстремальных условиях он образует слабые, сложные структуры.
- Поскольку этот элемент не проявляет никакой химической активности, его называют инертным газом.
Использование аргона
- Он используется при сварке для предотвращения горения графита.
- Используется в люминесцентных лампах и других газоразрядных лампах.
- Аргоноплазменная коагуляция использует проводящую электричество аргоновую плазму в качестве среды для подачи высокочастотного тока для коагуляции ткани. Бесконтактная функция обеспечивает быструю коагуляцию с минимальными манипуляциями и травмами ткани-мишени.
Примеры вопросов
Вопрос 1. Является ли аргон металлом или неметаллом?
Ответ:
Аргон является неметаллическим элементом.
 Он находится в группе 18 (VIIIa) периодической таблицы элементов, которую также называют группой благородных газов.
Он находится в группе 18 (VIIIa) периодической таблицы элементов, которую также называют группой благородных газов.Вопрос 2: Какова химическая формула аргона?
Ответ:
Аргон (Ar) — химический элемент, относящийся к группе 18 (благородные газы) периодической таблицы. Это самый распространенный и широко используемый благородный газ на планете.
Вопрос 3: Каковы 5 применений аргона?
ОТВЕТ:
Пять использования аргона в человеческом обществе включают следующее:
- Внутренние лампочки
- Полупроизводители Производство
- Сварка
- Medical Lasers
- 334
- Атомный номер (количество протонов в ядре): 18
- Атомный символ (в Периодической таблице элементов): Ar
- Атомный вес (средняя масса атома): 39,948
- Плотность: 0,0017837 грамм на кубический сантиметр
- Фаза при комнатной температуре: Газ
- Температура плавления: минус 308,83 градуса по Фаренгейту (минус 189,35 градуса по Цельсию)
- Температура кипения: минус 302,53 F (минус 185,85 C)
- Количество изотопов (атомов одного и того же элемента с разным числом нейтронов): 25; 3 стабильных
- Наиболее распространенные изотопы: Ar-40 (99,6035% естественного содержания), Ar-40 (0,0629% естественного содержания), Ar-36 (0,3336% естественного содержания)
- Неоновые огни, которые светятся синим, на самом деле содержат аргон, по словам Билла Конкэннона, художника по неоновой вывеске из Крокетта, Калифорния. (Сам неон излучает оранжево-красное свечение.)
- Аргон также используется в лазерных технологиях, включая эксимерный лазер на фториде аргона (ArF), используемый для проведения операций LASIK или ФРК для коррекции зрения. По данным Оптического общества, в 1981 году Рангасвами «Шри» Шринивасан из IBM испытал один из этих лазеров на оставшейся ко Дню Благодарения кости индейки и обнаружил его потенциал в качестве хирургического инструмента для деликатных операций.

- В сентябре 2014 года исследователи обнаружили, что загрязненные подземные воды в Пенсильвании и Техасе поступают не из-за метода добычи нефти, известного как гидроразрыв пласта, а из негерметичных обсадных труб. Они сделали это открытие, закачав аргон и другие индикаторы инертных газов в скважины, где они смешались с метаном.
- Аргон претерпел некоторые изменения: в 1957 году Международный союз теоретической и прикладной химии (IUPAC) изменил его атомный символ с «А» на сегодняшний «Ar».
- Лаборатория Джефферсона: Элемент Аргон
- Национальная лаборатория Лос-Аламоса: Аргон
- Королевское химическое общество: Аргон
1111111111111111111111111111111111111111111111МИНТИЯ 111111111111111111111111111111111111111МИНТИВА Вреден ли аргон для человека? Ответ: Аргон естественным образом присутствует в окружающей среде и обычно считается нетоксичным. Вопрос 5: Как рассчитать молярную массу аргона? Ответ: Масса аргона (Ar) составляет 39,948 г/моль. Формула расчета молярной массы заключается в делении массы конкретного химического элемента или химического соединения (г) на количество вещества (моль). В результате молярная масса аргона (Ar) становится равной 39,948 г/моль. Вопрос 6: Используется ли аргон в медицине? Ответ: Аргон также использовался как надежный инструмент в клинической практике. Аргоноплазменная коагуляция (APC) — это бесконтактная стратегия, в которой используется часто повторяющееся ощущение аргоновой плазмы, чтобы закрыть окружающие ткани и контролировать дренирование вокруг важных мест посредством коагуляции. Газ аргон используется при дуговой сварке. Аргон — инертный элемент без цвета и запаха — один из благородных газов. Этот элемент, используемый в люминесцентных лампах и при сварке, получил свое название от греческого слова, означающего «ленивый», в честь того, как мало он вступает в реакцию с образованием соединений. На Земле подавляющее большинство аргона представляет собой изотоп аргон-40, который возникает в результате радиоактивного распада калия-40, согласно Chemicool. Но в космосе аргон образуется в звездах, когда два ядра водорода или альфа-частицы сливаются с кремнием-32. В результате получается изотоп аргон-36. (Изотопы элемента имеют различное количество нейтронов в ядре.) Хотя аргон инертен, он далеко не редкость; по данным Королевского химического общества (RSC), он составляет 0,94 процента атмосферы Земли. По данным Национальной лаборатории линейных ускорителей Джефферсона, свойства аргона: Первый намек на существование аргона появился в 1785 году, когда британский ученый Генри Кавендиш сообщил о кажущейся инертной части воздуха, согласно RSC. Поскольку аргон инертен, он используется в промышленных процессах, требующих инертной атмосферы. Примеры, по данным газоснабжающей компании Praxair, включают сварку специальных сплавов и производство полупроводниковых пластин. Аргон также является хорошим изолятором, поэтому его часто закачивают в сухие гидрокостюмы для глубоководных погружений, чтобы согреть дайвера. Еще одно применение аргона — сохранение исторических памятников. Однако воздействие высоких концентраций аргона может снизить доступность кислорода в воздухе и, таким образом, вызвать удушье. Жидкий аргон также очень холодный и может вызвать обморожение при контакте.
Однако воздействие высоких концентраций аргона может снизить доступность кислорода в воздухе и, таким образом, вызвать удушье. Жидкий аргон также очень холодный и может вызвать обморожение при контакте.
Факты об аргоне | Живая наука
(Изображение предоставлено: chinahbzyg | Shutterstock )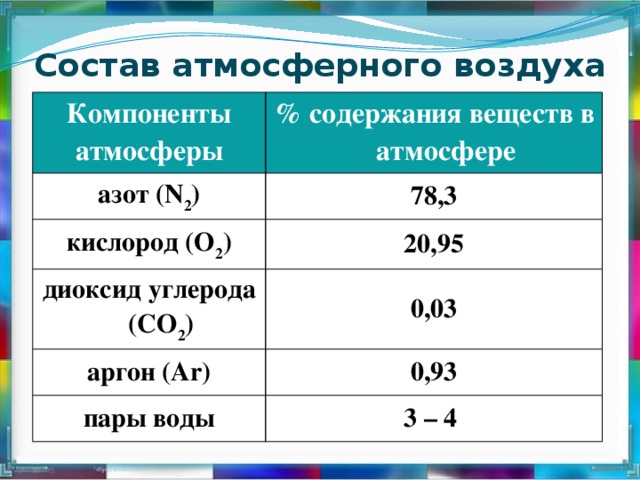 По расчетам Chemicool, это составляет 65 триллионов метрических тонн, и это число увеличивается со временем по мере распада калия-40.
По расчетам Chemicool, это составляет 65 триллионов метрических тонн, и это число увеличивается со временем по мере распада калия-40. Только факты
Использование инертного газа
 Кавендиш не мог понять, что это за таинственный 1 процент; открытие произошло более века спустя, в 1894 году. Работая одновременно и в общении с лордом Рэлеем (Джон Уильям Струтт), шотландский химик Уильям Рэмси идентифицировал и описал загадочный газ. Эти двое разделили Нобелевскую премию по химии в 1904 за открытие. Аргон также привел к другим моментам озарения для Рэмси. По данным организации, присуждающей Нобелевскую премию, при исследовании этого элемента он также обнаружил гелий. Понимая, что родственные элементы, вероятно, существуют, он быстро нашел неон, криптон и ксенон.
Кавендиш не мог понять, что это за таинственный 1 процент; открытие произошло более века спустя, в 1894 году. Работая одновременно и в общении с лордом Рэлеем (Джон Уильям Струтт), шотландский химик Уильям Рэмси идентифицировал и описал загадочный газ. Эти двое разделили Нобелевскую премию по химии в 1904 за открытие. Аргон также привел к другим моментам озарения для Рэмси. По данным организации, присуждающей Нобелевскую премию, при исследовании этого элемента он также обнаружил гелий. Понимая, что родственные элементы, вероятно, существуют, он быстро нашел неон, криптон и ксенон. Газом обрабатывают важные документы, такие как карта мира 1507 года, хранящаяся в Библиотеке Конгресса, и копия Великой хартии вольностей, хранящаяся в Национальном архиве США. В отличие от реактивного кислорода, аргон не разрушает бумагу или чернила на деликатных документах.
Газом обрабатывают важные документы, такие как карта мира 1507 года, хранящаяся в Библиотеке Конгресса, и копия Великой хартии вольностей, хранящаяся в Национальном архиве США. В отличие от реактивного кислорода, аргон не разрушает бумагу или чернила на деликатных документах.
(Изображение предоставлено: Грег Робсон/Creative Commons, Андрей Маринкас (открывается в новой вкладке) Shutterstock (открывается в новой вкладке))
Кто знал?
Текущие исследования
В течение многих лет благородный газ ксенон изучался как лечение травм головного мозга. Ксенон, однако, дорог, поэтому исследователи обращаются к его двоюродному брату благородному газу, аргону, как к потенциальной альтернативе.
Область исследований еще молода, но эксперименты на клеточных культурах и животных позволяют предположить, что однажды аргон можно будет использовать для ограничения повреждения головного мозга после травм или кислородного голодания. В одном обзоре, опубликованном в журнале Medical Gas Research в феврале 2014 года, было обнаружено, что в большинстве случаев обработка аргоном значительно снижает гибель клеток головного мозга — на 15–25 процентов, — сказал Дерек Новранги, один из авторов статьи и докторант в Лома Линда. Университетская школа медицины в Калифорнии.
В одном обзоре, опубликованном в журнале Medical Gas Research в феврале 2014 года, было обнаружено, что в большинстве случаев обработка аргоном значительно снижает гибель клеток головного мозга — на 15–25 процентов, — сказал Дерек Новранги, один из авторов статьи и докторант в Лома Линда. Университетская школа медицины в Калифорнии.
Пока никто не понимает, почему аргон имеет такой эффект. Клетки мозга общаются с помощью химических веществ, называемых нейротрансмиттерами, и нейрорецепторов, которые подходят друг к другу, как замок и ключ. Скорее всего, сказал Новранги Live Science, газ воздействует на эти нейрорецепторы, в частности, на рецептор NMDA (что означает N-метил-D-аспартат для нейротрансмиттера, который он получает) или рецептор ГАМК (что означает гамма-аминомасляная кислота). Каким-то образом аргон, поглощаемый этими рецепторами, предотвращает самоуничтожение клеток в ответ на повреждение головного мозга.
В исследованиях газообразный аргон либо непосредственно воздействуют на клетки в чашке для культивирования, которые находятся в состоянии стресса, например, в среде, лишенной кислорода и глюкозы, либо смешивают с кислородом в лицевой маске для исследований на животных. Затем исследователи подсчитывают количество клеток, погибших с обработкой аргоном и без нее.
Затем исследователи подсчитывают количество клеток, погибших с обработкой аргоном и без нее.
По мере того, как исследования аргона набирают обороты, более вероятно, что начнутся испытания на людях, сказал Новранги. Но есть предостережения: некоторые исследования показывают неоднозначные результаты или отрицательные эффекты лечения аргоном. В одном случае, по словам Новранги, мозг в целом казался защищенным аргоном, но повреждение одной области фактически увеличилось при обработке газом. Это может быть связано с тем, что аргон не проник в эту область, или с тем, что разные области мозга имеют разные типы клеток и плотность клеток.
«Это все еще требует большого количества исследований, чтобы действительно можно было применить в клинике», — сказал Новранги.
Подписывайтесь на Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
Стефани Паппас — автор статей для журнала Live Science, освещающего самые разные темы — от геонаук до археологии, человеческого мозга и поведения.

 Позволяет применять присадочную проволоку более широкого ассортимента;
Позволяет применять присадочную проволоку более широкого ассортимента; Представляет собой аргон высокой частоты. Газ универсален в своем применении, но наибольшее распространение получил при сварке алюминия и других цветных металлов.
Представляет собой аргон высокой частоты. Газ универсален в своем применении, но наибольшее распространение получил при сварке алюминия и других цветных металлов.
 Он находится в группе 18 (VIIIa) периодической таблицы элементов, которую также называют группой благородных газов.
Он находится в группе 18 (VIIIa) периодической таблицы элементов, которую также называют группой благородных газов.