Содержание
Столярный Шип 5 Букв — ответ на кроссворд и сканворд
Решение этого кроссворда состоит из 5 букв длиной и начинается с буквы Ш
Ниже вы найдете правильный ответ на Столярный шип 5 букв, если вам нужна дополнительная помощь в завершении кроссворда, продолжайте навигацию и воспользуйтесь нашей функцией поиска.
ответ на кроссворд и сканворд
Суббота, 19 Октября 2019 Г.
ШКАНТ
предыдущий
следующий
другие решения
ШКАНТ
ты знаешь ответ ?
ответ:
связанные кроссворды
- Шкант
- Вставной шип для соединения частей изделий из древесины
- Мебельный шип
- Шкант
- Мебельный шип 5 букв
- На этом шипе держится вся мебель 5 букв
- Соединительный деревянный элемент 5 букв
- Шип для соединения столярных деталей 5 букв
похожие кроссворды
- Ручной слесарный и столярный инструмент 7 букв
- Столярный инструмент для строгания желобков 7 букв
- Столярный разметочный инструмент 8 букв
- Столярный инструмент 8 букв
- Плотничий или столярный ручной режущий инструмент 8 букв
- Столярный и плотничный инструмент 8 букв
- Столярный инстр-т (угольник) 12 букв
- Ручной столярный инструмент 9 букв
- Длинный столярный рубанок 7 букв
- Ручной столярный инструмент для сверления отверстий 9 букв
- Столярный строгальный инструмент в виде деревянной колодки с широким 7 букв
- Столярный и плотничный инструмент со стальным плоским заточенным концом 8 букв
- Плотничий и столярный инструмент для долбления отверстий и углублений 6 букв
- Столярный инструмент, однажды пропитый лешим 6 букв
- Плотничий или столярный инструмент 6 букв
- Столярный молоток 6 букв
- Столярный инструмент, угольник 7 букв
- Столярный инструмент для разметки углов; приток терека 5 букв
Соединения «скользящий шип» и «вставной шип» — Национальная сборная Worldskills Россия
“
Изготовить совершенно разные столярные соединения можно, даже если у вас в арсенале имеется ограниченный набор инструментов. Изучив данный урок, вы сможете убедиться в этом сами, ведь мы с вами сделаем два распространенных соединения, использовав одни и те же инструменты.
Изучив данный урок, вы сможете убедиться в этом сами, ведь мы с вами сделаем два распространенных соединения, использовав одни и те же инструменты.
Глоссарий
Для успешного освоения материала рекомендуем вам изучить следующие понятия:
Столярный молоток, применяется в «ударной технике» при обработке дерева или камня
Разновидность фрезера для обработки кромок, выполнения скруглений
Разновидность ручной пилы, бывает разных видов в зависимости от типа обрабатываемой поверхности
Боковые стороны шипа
Открытое сверху сквозное гнездо, в которое вставляется шип
Разновидностей напильника, имеет крупные насечки и служит для обработки древесины и пластмасс
Ручной деревообрабатывающий электроинструмент для фигурной обработки кромок, вырезания пазов и сверления отверстий
Внешне похожа на сверло, используется для погружного фрезерования
Ручной деревообрабатывающий инструмент для создания небольших углублений в древесине, зачистки пазов, снятия фасок, рельефной и контурной резьбы
Один из видов вспомогательных инструментов для фиксации деталей в момент обработки либо для плотного прижатия их друг к другу
Выступ на торце бруска, является частью столярных соединений
Приспособление для шлифования поверхностей
Инструмент для закручивания и откручивания шурупов, саморезов, винтов, дюбелей и других видов крепежных изделий
Видеолекция
Конспект
Изготовление соединения «сквозной шип»
Техника безопасности
- При работе с электрифицированным инструментом нужно использовать очки и наушники, а также респиратор при шлифовке.

- Будьте аккуратны с режущим инструментом. Не допускайте его падения, а если это произойдет, ни в коем случае не ловите руками, ногами или другими частями тела.
- При выполнении работ необходимо также надеть защитную одежду и обувь с металлическим носком.
Что нам понадобится
Ручной фрезер с направляющей для фрезеровки
Кромочный фрезер
Стамески
Киянка
Ножовка
Фреза пазовая
Фреза спиральная
Фреза с подшипником
Карандаш
Линейка
Шуруповерт
Рашпиль
Шлифок
Струбцины
Кусочки МДФ
Суперклей
Самодельное приспособление
Формирование проушины
1. Устанавливаем пазовую фрезу и крепим заготовку в тисках.
Устанавливаем пазовую фрезу и крепим заготовку в тисках.
2. Фрезеруем проушину, постепенно увеличивая глубину реза.
Важно
До конца не фрезеруем деталь, а оставляем два миллиметра для дальнейшей обработки. Это нужно для того, чтобы проушина не сомкнулась и имела распорку
3. Крепим заготовку на краю верстака, струбциной фиксируем противоскольный упор и просверливаем отверстие, в которое войдет фреза 8 мм.
4. С помощью спиральной фрезы убираем лишнюю древесину и оставляем небольшую ее часть на конце проушины.
5. Прорабатываем дно проушины. Для этого крепим заготовку и с помощью стамески и киянки формируем ровное дно.
Важно
Долбление должно происходить по направлению волокон: это поможет избежать сколов и вырывов
6. Места схождения внутренних плоскостей аккуратно подрезаем стамеской.
7. Отпиливаем оставшуюся перемычку ножовкой и зачищаем проушину с помощью рашпиля и шлифка.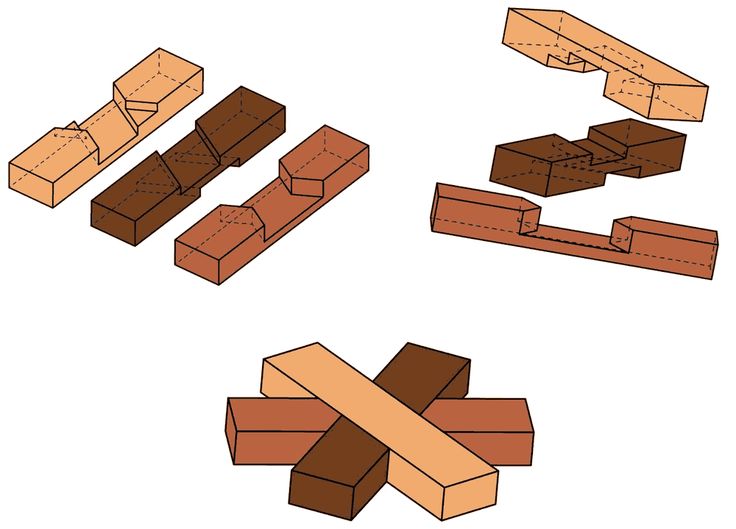
Формирование шипа
1. Крепим вторую заготовку в приспособление для фрезеровки, чтобы сформировать шип.
2. С помощью кромочного фрезера и фрезы с подшипником формируем два плеча с верхней и нижней стороны. Приспособление обеспечит их параллельность.
3. Выполняем разметку по месту. Прикладываем деталь с проушиной к сформированным плечикам гнезда и размечаем вторые плечики.
4. Закрепляем деталь в приспособлении и повторяем действия, как и с предыдущими плечиками.
5. Кромочным фрезером убираем лишнюю древесину с шипа, чтобы сделать его толщину такой же, как и ширина проушины.
6. Очищаем шип от следов фрезеровки с помощью рашпиля и шлифка.
Готовое соединение выглядит так.
Изготовление соединения «вставной шип»
Что нам понадобится
Ручной фрезер с направляющей для фрезеровки
Кромочный фрезер
Стамески
Киянка
Ножовка
Фреза пазовая
Фреза спиральная
Фреза с подшипником
Карандаш
Линейка
Шуруповерт
Рашпиль
Шлифок
Струбцины
Кусочки МДФ
Суперклей
Самодельное приспособление
Формирование гнезда
1. Закрепляем заготовку в тисках и фрезеруем гнездо ручным фрезером с пазовой фрезой.
Закрепляем заготовку в тисках и фрезеруем гнездо ручным фрезером с пазовой фрезой.
2. Прикрепляем кусочки МДФ на разметку плечиков гнезда и с помощью кромочного фрезера и спиральной фрезы формируем плечики.
3. Подрезаем уголок. После фрезеровки он круглый, а должен быть острый.
4. Формируем гнездо с помощью стамесок и киянки.
5. Очищаем гнездо от следов механической обработки.
Формирование шипа
1. Крепим деталь в приспособлении для фрезеровки. Фрезой с подшипником формируем плечики с двух сторон заготовки.
2. С помощью фрезера подгоняем шип по плотности. Он должен с натягом входить в гнездо.
3. Отпиливаем от шипа лишнюю древесину, чтобы он был такой же формы, как и гнездо.
4. Очищаем шип от следов фрезы.
Очищаем шип от следов фрезы.
Готово! Шип входит в гнездо плотно и не выпадает. Это даст нам прочное соединение после склейки.
“
В этом уроке мы изготовили наиболее распространенные столярные соединения. Узнали, что суперклей может не только склеить разбитую чашку, но и помогает в формировании плечиков соединений. Также мы научились формировать и чистить поверхности соединений для того, чтобы они плавно соединялись и крепко держались. Теперь выполните небольшое задание, чтобы проверить свои знания.
Интерактивное задание
Для закрепления полученных знаний пройдите тест
| Стартуем! |
Поперек волокон
В направлении, обратном расположению волокон
По направлению волокон
От верхней точки к нижней, вне зависимости от направления
| Дальше |
| Проверить |
| Узнать результат |
Оно обеспечивает параллельность плечиков шипа
Оно хорошо фиксирует заготовку
Оно выступает в роли тисков
Оно позволяет сформировать ровную проушину
| Дальше |
| Проверить |
| Узнать результат |
Модульный фрезер
Стамеска
Рашпиль
Кромочный фрезер
| Дальше |
| Проверить |
| Узнать результат |
К сожалению, вы ответили неправильно на все вопросы
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
К сожалению, вы ответили неправильно на большинство вопросов
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Неплохо!
Но можно лучше. Прочитайте лекцию и посмотрите видео еще раз
Прочитайте лекцию и посмотрите видео еще раз
| Пройти еще раз |
Отлично!
Вы отлично справились. Теперь можете ознакомиться с другими компетенциями
| Пройти еще раз |
Ограниченная защита, обеспечиваемая рекомбинантным вирусом болезни Ньюкасла, экспрессирующим шиповидный белок инфекционного бронхита
. 2020 март; 64(1):53-59.
дои: 10.1637/0005-2086-64.1.53.
Р А Зегпи
1
, Л Он
2
, Кью Ю
2
, K S Столяр
1
, В.Л. ван Сантен
1
, Х Торо
3
Принадлежности
- 1 Кафедра патобиологии, Колледж ветеринарной медицины Обернского университета, Оберн, AL 36830.

- 2 Министерство сельского хозяйства США, Служба сельскохозяйственных исследований, Национальный исследовательский центр США по птицеводству Афины, Джорджия 30605.
- 3 Кафедра патобиологии, Колледж ветеринарной медицины Обернского университета, Оберн, Алабама 36830, [email protected].
PMID:
32267125
DOI:
10.1637/0005-2086-64.1.53
Р. А. Зегпи и соавт.
Авиан Дис.
2020 9 марта0003
. 2020 март; 64(1):53-59.
дои: 10. 1637/0005-2086-64.1.53.
1637/0005-2086-64.1.53.
Авторы
Р А Зегпи
1
, Л Он
2
, Кью Ю
2
, K S Столяр
1
, В.Л. ван Сантен
1
, Х Торо
3
Принадлежности
- 1 Кафедра патобиологии, Колледж ветеринарной медицины Обернского университета, Оберн, AL 36830.
- 2 Министерство сельского хозяйства США, Служба сельскохозяйственных исследований, Национальный исследовательский центр США по птицеводству Афины, Джорджия 30605.
- 3 Кафедра патобиологии, Колледж ветеринарной медицины Обернского университета, Оберн, Алабама 36830, torohar@auburn.
 edu.
edu.
PMID:
32267125
DOI:
10.1637/0005-2086-64.1.53
Рекомбинантный вирус болезни Ньюкасла (NDV) LaSota (LS), экспрессирующий секретируемый тримерный шип (S)-эктодомен (Se) вируса инфекционного бронхита (IBV) (rLS/IBV.Se), был разработан и оценен на предмет защиты от заражения IBV. Белок S-эктодомена IBV, который представляет собой S, за исключением трансмембранного якоря и короткого цитоплазматического домена S2, экспрессируемый из рекомбинантного LS, соответствует IBV арканзасского (Ark) типа. В первом эксперименте цыплят примировали в 1-дневном возрасте или примировали в 1-дневном возрасте и ревакцинировали в 14-дневном возрасте 10 4 50% инфекционных доз зародыша (EID 50 )/птица rLS/IBV. Se и заражены вирулентным штаммом Ark. Однократная вакцинация оказалась совершенно неэффективной для защиты цыплят от контрольного заражения, в то время как примирование и буст-иммунизация уменьшали клинические признаки и поражения трахеи, но не снижали вирусную нагрузку в слезной жидкости. В эксперименте 2 доза вакцины была увеличена до 10 7 EID 50 на птицу, и для контрольного заражения использовали другой вирулентный штамм Ark. Кроме того, цыплят однократно иммунизировали либо на 1-й, либо на 10-й день после вылупления. Уровни антител к вирусу NDV, обнаруженные у вакцинированных цыплят, были умеренными, а титры ингибирования гемагглютинации варьировали от 4 до 5 log 9.0095 2 . Несколько более высокие уровни антител к NDV наблюдались у цыплят, вакцинированных на 10-й день, по сравнению с 1-м днем, но разница не достигала статистической значимости. Напротив, ответы антител, измеренные с использованием планшетов для ИФА, покрытых рекомбинантным белком IBV S1, были значительно выше у цыплят, вакцинированных на 10-й день, чем на 1-й день.
Se и заражены вирулентным штаммом Ark. Однократная вакцинация оказалась совершенно неэффективной для защиты цыплят от контрольного заражения, в то время как примирование и буст-иммунизация уменьшали клинические признаки и поражения трахеи, но не снижали вирусную нагрузку в слезной жидкости. В эксперименте 2 доза вакцины была увеличена до 10 7 EID 50 на птицу, и для контрольного заражения использовали другой вирулентный штамм Ark. Кроме того, цыплят однократно иммунизировали либо на 1-й, либо на 10-й день после вылупления. Уровни антител к вирусу NDV, обнаруженные у вакцинированных цыплят, были умеренными, а титры ингибирования гемагглютинации варьировали от 4 до 5 log 9.0095 2 . Несколько более высокие уровни антител к NDV наблюдались у цыплят, вакцинированных на 10-й день, по сравнению с 1-м днем, но разница не достигала статистической значимости. Напротив, ответы антител, измеренные с использованием планшетов для ИФА, покрытых рекомбинантным белком IBV S1, были значительно выше у цыплят, вакцинированных на 10-й день, чем на 1-й день. Использование более высокой дозы rLS/IBV.Se значительно повышало успех однократной вакцинации по сравнению с эксперимент 1. Признаки и повреждения трахеи уменьшались более эффективно у цыплят, вакцинированных на 10-й день после вылупления. Однако, как и в эксперименте 1, вакцинация не снижала вирусную нагрузку в слезной жидкости зараженных цыплят. Подобные результаты, в которых не наблюдалось снижения вирусной нагрузки в трахее после вакцинации rLS/IBV.S, были получены другими. Необходима дальнейшая работа, чтобы понять иммунные реакции, вызванные этим рекомбинантным вирусом, который, по-видимому, обеспечивает некоторую защиту от болезни, но не снижает вирусную нагрузку в верхних дыхательных путях.
Использование более высокой дозы rLS/IBV.Se значительно повышало успех однократной вакцинации по сравнению с эксперимент 1. Признаки и повреждения трахеи уменьшались более эффективно у цыплят, вакцинированных на 10-й день после вылупления. Однако, как и в эксперименте 1, вакцинация не снижала вирусную нагрузку в слезной жидкости зараженных цыплят. Подобные результаты, в которых не наблюдалось снижения вирусной нагрузки в трахее после вакцинации rLS/IBV.S, были получены другими. Необходима дальнейшая работа, чтобы понять иммунные реакции, вызванные этим рекомбинантным вирусом, который, по-видимому, обеспечивает некоторую защиту от болезни, но не снижает вирусную нагрузку в верхних дыхательных путях.
Protección limitada conferida por un virus recombinante de la enfermedad de Newcastle que expresa la proteína de la espícula del virus de la bronquitis infecciosa. Вирус энфермедад Ньюкасла (NDV) LaSota (LS), рекомбинантный, который экспрессирует эктодоминиальный белок эпилепсии (S), тримерику в секреторной форме (Se), вирус инфекционного бронхита (IBV) (rLS/IBV. Se ) fue desarrollado у evaluado пункт ла protección против эль desafío кон эль вирус де ла инфекционный бронхит. El ectodominio де ла белка S вируса инфекционного бронхита, который состоит в белке S корреспондента а ла Сепа Арканзас, excluyendo су anclaje transmembranario у эль доминио citoplasmático корто де ла белка S2 у экспрессада пор уна cepa LaSota recombinante. En un primer Experimento, los pollos fueron primovacunados al primer día de edad, o primovacunados al primer día y con un refuerzo a los 14 días de edad con 10 4 Infecciosas de embriones de pollo 50% (EID 50 ) на основе рекомбинантного вируса rLS/IBV.Se y desafiados con un virus virulento cepa Arkansas. Una sola vacunación demostró ser completamente ineficaz para proteger a los pollos contra el desafío, mientras que la primovacunación y el refuerzo redujeron los signos clinicos y las lesiones traqueales, pero no redujeron la carga вирусная ан лос-флюидос lagrimales. En el Experimento 2, la dosis de la vacuna se incrementó a 10 7 EID50/ave y se usó una cepa Arkansas virulenta diferente para el desafío.
Se ) fue desarrollado у evaluado пункт ла protección против эль desafío кон эль вирус де ла инфекционный бронхит. El ectodominio де ла белка S вируса инфекционного бронхита, который состоит в белке S корреспондента а ла Сепа Арканзас, excluyendo су anclaje transmembranario у эль доминио citoplasmático корто де ла белка S2 у экспрессада пор уна cepa LaSota recombinante. En un primer Experimento, los pollos fueron primovacunados al primer día de edad, o primovacunados al primer día y con un refuerzo a los 14 días de edad con 10 4 Infecciosas de embriones de pollo 50% (EID 50 ) на основе рекомбинантного вируса rLS/IBV.Se y desafiados con un virus virulento cepa Arkansas. Una sola vacunación demostró ser completamente ineficaz para proteger a los pollos contra el desafío, mientras que la primovacunación y el refuerzo redujeron los signos clinicos y las lesiones traqueales, pero no redujeron la carga вирусная ан лос-флюидос lagrimales. En el Experimento 2, la dosis de la vacuna se incrementó a 10 7 EID50/ave y se usó una cepa Arkansas virulenta diferente para el desafío. Además, los pollos se inmunizaron Individualmente al Primer día de edad o al día 10 después de la eclosión. Los niveles de anticuerpos contra el virus de NewcastleDetectados en pollos vacunados fueron moderados, con títulos de inhibición de la hemaglutinación que variaron entre 4 y 5 log 2 . Se observaron niveles de anticuerpos ligeramente Superiores contra el virus de Newcastle en pollos vacunados el día 10 en comparación con los vacunados al primer día, pero sin que la diferencia alcanzara diferencia estadística significativa. Напротив, лас respuestas де anticuerpos usando placas ELISA recubiertas con proteína recombinante S1 вируса инфекционного бронхита fueron significativamente mayores en pollos vacunados en el día 10 en comparación con los pollos vacunados en el primer día. Con el uso de una dosis más alta del virus rLS/IBV.Se se aumentó sustancialmente el éxito de una vacunación unica en comparación con el Experimento 1. Los signos y las lesiones traqueales se redujeron de manera más efectiva en los pollos vacunados en el día 10 después de la eclosión.
Además, los pollos se inmunizaron Individualmente al Primer día de edad o al día 10 después de la eclosión. Los niveles de anticuerpos contra el virus de NewcastleDetectados en pollos vacunados fueron moderados, con títulos de inhibición de la hemaglutinación que variaron entre 4 y 5 log 2 . Se observaron niveles de anticuerpos ligeramente Superiores contra el virus de Newcastle en pollos vacunados el día 10 en comparación con los vacunados al primer día, pero sin que la diferencia alcanzara diferencia estadística significativa. Напротив, лас respuestas де anticuerpos usando placas ELISA recubiertas con proteína recombinante S1 вируса инфекционного бронхита fueron significativamente mayores en pollos vacunados en el día 10 en comparación con los pollos vacunados en el primer día. Con el uso de una dosis más alta del virus rLS/IBV.Se se aumentó sustancialmente el éxito de una vacunación unica en comparación con el Experimento 1. Los signos y las lesiones traqueales se redujeron de manera más efectiva en los pollos vacunados en el día 10 después de la eclosión. Sin embargo, como en el Experimento 1, la vacunación no redujo las cargas viruses en losfluidos lagrimales de los pollos desafiados. Resultados аналогичные, en los que no se observó una reducción en la carga virus en la tráquea por la vacunación con rLS/IBV.Se se han obtenido por otros Investigadores. Se requiere de más Investigacion para comprender las respuestas inmunes inducidas por este virus recombinante que parece proporcionar cierta protección contra la enfermedad, pero no reduce las cargas viruses en el tracto respiratorio Superior.
Sin embargo, como en el Experimento 1, la vacunación no redujo las cargas viruses en losfluidos lagrimales de los pollos desafiados. Resultados аналогичные, en los que no se observó una reducción en la carga virus en la tráquea por la vacunación con rLS/IBV.Se se han obtenido por otros Investigadores. Se requiere de más Investigacion para comprender las respuestas inmunes inducidas por este virus recombinante que parece proporcionar cierta protección contra la enfermedad, pero no reduce las cargas viruses en el tracto respiratorio Superior.
Ключевые слова:
Ковчег; куриные болезни; коронавирус; вирус инфекционного бронхита; рекомбинантный вирус Ньюкасла; рекомбинантная вакцина; вакцина.
Похожие статьи
Усиленная защита с помощью рекомбинантного вируса болезни Ньюкасла, экспрессирующего эктодомен вируса инфекционного бронхита и колониестимулирующий фактор куриных гранулоцитов-макрофагов.

Халид З., Хе Л., Ю К., Бридлав С., Джойнер К., Торо Х.
Халид З. и др.
Авиан Дис. 2021 сен; 65 (3): 364-372. doi: 10.1637/aviandiseases-D-21-00032.
Авиан Дис. 2021.PMID: 34427409
Вирус инфекционного бронхита S2, экспрессированный из рекомбинантного вируса, обеспечивает широкую защиту от заражения.
Торо Х., Чжао В., Бридлав С., Чжан З., Ю. К., Ван Сантен В.
Торо Х и др.
Авиан Дис. 2014 март; 58 (1): 83-9. doi: 10.1637/10641-081613-Reg.1.
Авиан Дис. 2014.PMID: 24758118
Вирус инфекционного бронхита S2 от 4/91, экспрессированный из рекомбинантного вируса, не защищает от заражения типа ковчега.
Элдемери Ф., Ли Ю., Ю К., ван Сантен В.Л., Торо Х.
Элдемери Ф. и др.
Авиан Дис. 2017 сен; 61 (3): 397-401. doi: 10.1637/11632-032017-ResNoteR.
2017 сен; 61 (3): 397-401. doi: 10.1637/11632-032017-ResNoteR.
Авиан Дис. 2017.PMID: 28957002
Разработка вакцины против тяжелого острого респираторного синдрома: опыт вакцинации против коронавируса инфекционного бронхита птиц.
Кавана Д.
Кавана Д.
Авиан Патол. 2003 Декабрь; 32 (6): 567-82. дои: 10.1080/03079450310001621198.
Авиан Патол. 2003.PMID: 14676007
Бесплатная статья ЧВК.Обзор.
Противовирусные реакции хозяина на вирус птичьего инфекционного бронхита (IBV): внимание на врожденный иммунитет.
Чжан Ю, Сюй Зи, Цао Ю.
Чжан И и др.
Вирусы. 2021 авг 26;13(9):1698. дои: 10.3390/v13091698.
Вирусы. 2021.PMID: 34578280
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Стратегия «антигенного камуфляжа и приманки» для преодоления влияния антител материнского происхождения на вакцины с вектором вируса ньюкаслской болезни: больше, чем простая комбинация.

Ху З., Лю С.
Ху Зи и др.
Фронт микробиол. 2021 27 авг;12:735250. doi: 10.3389/fmicb.2021.735250. Электронная коллекция 2021.
Фронт микробиол. 2021.PMID: 34512613
Бесплатная статья ЧВК.Аннотация недоступна.
Сравнительная защитная эффективность новых вакцин на основе птичьего парамиксовируса против вируса вирулентного инфекционного бронхита у кур.
Ширвани Э., Самал С.К.
Ширвани Э. и др.
Вирусы. 2020 28 июн;12(7):697. doi: 10.3390/v12070697.
Вирусы. 2020.PMID: 32605292
Бесплатная статья ЧВК.
использованная литература
Торо Х., Джеквуд М.В., ван Сантен В.Л. Генетическое разнообразие и отбор регулируют эволюцию вируса инфекционного бронхита.
Птичий диспансер . 56:449–455; 2012.
56:449–455; 2012.
Галлардо Р.А., ван Сантен В.Л., Торо Х. Внутрипространственная селекция популяций вируса инфекционного бронхита.
Птичий диспансер . 54:807–813; 2010.
McKinley ET, Hilt DA, Jackwood MW. Аттенуированные живые вакцины против инфекционного бронхита от коронавируса птиц подвергаются отбору субпопуляций и мутациям после вакцинации.
Вакцина . 26:1274–1284; 2008.
Ван Сантен В.Л., Торо Х. Быстрая селекция субпопуляций цыплят в вакцинах вируса инфекционного бронхита, полученных из ArkDPI.
Птичий патол . 37:293–306; 2008.
Джеквуд М.
 В., Ли Д.Х. Различные эволюционные траектории вакциноуправляемых и неконтролируемых вирусов инфекционного бронхита птиц у товарной птицы.
В., Ли Д.Х. Различные эволюционные траектории вакциноуправляемых и неконтролируемых вирусов инфекционного бронхита птиц у товарной птицы. PLoS One . 12:e0176709; 2017.
Типы публикаций
термины MeSH
вещества
Защита от вируса инфекционного бронхита с помощью шиповидной эктодоменовой субъединичной вакцины
. 2017 13 октября; 35 (43): 5864-5871.
doi: 10.1016/j.vaccine.2017.09.013.
Epub 2017 9 сентября.
Фатьма Элдемери
1
, Келли С. Джойнер
1
, Харольдо Торо
1
, Вики Л ван Сантен
2
Принадлежности
- 1 Кафедра патобиологии, Колледж ветеринарной медицины, Обернский университет, 264 Greene Hall, Auburn, AL 36849-5519, США.

- 2 Кафедра патобиологии, Колледж ветеринарной медицины, Обернский университет, 264 Greene Hall, Auburn, AL 36849-5519, США. Электронный адрес: [email protected].
PMID:
28899630
PMCID:
PMC7111290
DOI:
10.1016/j.vaccine.2017.09.013
Бесплатная статья ЧВК
Фатьма Элдемери и др.
вакцина.
.
Бесплатная статья ЧВК
. 2017 13 октября; 35 (43): 5864-5871.
2017 13 октября; 35 (43): 5864-5871.
doi: 10.1016/j.vaccine.2017.09.013.
Epub 2017 9 сентября.
Авторы
Фатьма Элдемери
1
, Келли С. Джойнер
1
, Харольдо Торо
1
, Вики Л ван Сантен
2
Принадлежности
- 1 Кафедра патобиологии, Колледж ветеринарной медицины, Обернский университет, 264 Greene Hall, Auburn, AL 36849-5519, США.
- 2 Кафедра патобиологии, Колледж ветеринарной медицины, Обернский университет, 264 Greene Hall, Auburn, AL 36849-5519, США. Электронный адрес: vanvick@auburn.
 edu.
edu.
PMID:
28899630
PMCID:
PMC7111290
DOI:
10.1016/j.vaccine.2017.09.013
Абстрактный
S1-субъединица гликопротеина шипа (S) вируса инфекционного бронхита птичьего коронавируса (IBV) опосредует прикрепление вируса к клеткам-хозяевам, а субъединица S2 отвечает за слияние мембран. Используя гистохимию белка S арканзасского типа (Ark) IBV, мы показываем, что расширение S1 с помощью эктодомена S2 улучшает связывание с тканями цыпленка. Хотя субъединица S1 является основным индуктором нейтрализующих антител, было показано, что вакцинация белком S1 обеспечивает неадекватную защиту от заражения. Продемонстрированный вклад эктодомена S2 в связывание с тканями кур предполагает, что вакцинация эктодоменом может улучшить защиту по сравнению с вакцинацией только S1. Поэтому мы иммунизировали цыплят рекомбинантным тримерным растворимым белком IBV Ark-типа S1 или S-эктодоменовым белком, полученным из кодон-оптимизированных конструкций в клетках млекопитающих. Цыплят в возрасте 12 дней праймировали эмульгированными в масле белками S1 или S-эктодомена, а затем через 21 день стимулировали. Заражение проводили вирулентным Ark IBV через 21 день после повторной вакцинации. Цыплята, иммунизированные рекомбинантным белком S-эктодомена, показали статистически значимое (P<0,05) снижение вирусной нагрузки через 5 дней после заражения как в слезах, так и в трахее по сравнению с цыплятами, иммунизированными рекомбинантным белком S1. В соответствии с вирусной нагрузкой, значительно уменьшенная (P<0,05) толщина слизистой оболочки трахеи и баллы поражения трахеи показали, что рекомбинантный белок S-эктодомен обеспечивает улучшенную защиту целостности трахеи по сравнению с белком S1.
Продемонстрированный вклад эктодомена S2 в связывание с тканями кур предполагает, что вакцинация эктодоменом может улучшить защиту по сравнению с вакцинацией только S1. Поэтому мы иммунизировали цыплят рекомбинантным тримерным растворимым белком IBV Ark-типа S1 или S-эктодоменовым белком, полученным из кодон-оптимизированных конструкций в клетках млекопитающих. Цыплят в возрасте 12 дней праймировали эмульгированными в масле белками S1 или S-эктодомена, а затем через 21 день стимулировали. Заражение проводили вирулентным Ark IBV через 21 день после повторной вакцинации. Цыплята, иммунизированные рекомбинантным белком S-эктодомена, показали статистически значимое (P<0,05) снижение вирусной нагрузки через 5 дней после заражения как в слезах, так и в трахее по сравнению с цыплятами, иммунизированными рекомбинантным белком S1. В соответствии с вирусной нагрузкой, значительно уменьшенная (P<0,05) толщина слизистой оболочки трахеи и баллы поражения трахеи показали, что рекомбинантный белок S-эктодомен обеспечивает улучшенную защиту целостности трахеи по сравнению с белком S1. Эти результаты показывают, что домен S2 играет важную роль в индуцировании защитного иммунитета. Таким образом, включение домена S2 в домен S1 может быть многообещающим для улучшения стратегии вирусной векторной и/или субъединичной вакцины.
Эти результаты показывают, что домен S2 играет важную роль в индуцировании защитного иммунитета. Таким образом, включение домена S2 в домен S1 может быть многообещающим для улучшения стратегии вирусной векторной и/или субъединичной вакцины.
Ключевые слова:
Коронавирус; Иммунизация; Инфекционный бронхит; Рекомбинантный шиповидный белок; С2; Спайковый эктодомен.
Copyright © 2017 Elsevier Ltd. Все права защищены.
Цифры
Рис. 1
Гистохимия белков, демонстрирующая рекомбинантный IBV…
Рис. 1
Гистохимия белков, демонстрирующая связывание рекомбинантного IBV Ark-типа S1 и S-эктодомена у различных кур…
рисунок 1
Гистохимия белка, демонстрирующая связывание рекомбинантного IBV Ark-типа S1 и S-эктодомена в различных тканях цыплят. Хромогенный субстрат AEC+ использовали для идентификации связанного спайкового белка, на что указывает красное окрашивание (стрелки). (A) Эктодомен S1 связывается с апикальной поверхностью эпителия трахеи, в то время как S-эктодомен (B) связывается с ресничками, эпителием трахеи и секреторными везикулами бокаловидных клеток, содержащими муцин. (C) Связывание белка S1 не было выявлено в легких. (D) Связывание S-эктодомена было обнаружено в эпителии, выстилающем легочные парабронхи и предсердия. (E) Наблюдалось минимальное окрашивание апикальной поверхности эпителия слизистой оболочки носа и слизистых желез белком S1, тогда как S-эктодомен (F) демонстрировал усиленное окрашивание эпителия слизистой оболочки носа и слизистых желез. (G) Редкое точечное связывание S1 произошло вдоль апикальной поверхности хоанального подслизистого железистого эпителия. (H) Выявлено интенсивное связывание S-эктодомена эпителиальной апикальной поверхности и секреторного продукта в хоанальных железах. (I и J) Связывание S-эктодомена было обнаружено на эпителиальной верхушке рассеянных почечных канальцев; однако связывание S1 не наблюдалось.
Хромогенный субстрат AEC+ использовали для идентификации связанного спайкового белка, на что указывает красное окрашивание (стрелки). (A) Эктодомен S1 связывается с апикальной поверхностью эпителия трахеи, в то время как S-эктодомен (B) связывается с ресничками, эпителием трахеи и секреторными везикулами бокаловидных клеток, содержащими муцин. (C) Связывание белка S1 не было выявлено в легких. (D) Связывание S-эктодомена было обнаружено в эпителии, выстилающем легочные парабронхи и предсердия. (E) Наблюдалось минимальное окрашивание апикальной поверхности эпителия слизистой оболочки носа и слизистых желез белком S1, тогда как S-эктодомен (F) демонстрировал усиленное окрашивание эпителия слизистой оболочки носа и слизистых желез. (G) Редкое точечное связывание S1 произошло вдоль апикальной поверхности хоанального подслизистого железистого эпителия. (H) Выявлено интенсивное связывание S-эктодомена эпителиальной апикальной поверхности и секреторного продукта в хоанальных железах. (I и J) Связывание S-эктодомена было обнаружено на эпителиальной верхушке рассеянных почечных канальцев; однако связывание S1 не наблюдалось. (K) Наблюдалось мультифокальное слабое окрашивание апикальной поверхности кишечного эпителия слепой кишки белком S1, тогда как S-эктодомен (L) демонстрировал диффузное усиленное окрашивание эпителия. (M и N) Наблюдалось диффузное сильное окрашивание клоакальных желез S-эктодоменом и только рассеянное слабое окрашивание белком S1. Хотя молекулярная масса рекомбинантного S-эктодомена в два раза превышает молекулярную массу рекомбинантного белка S1, его использовали в половине концентрации мкг/мл. Таким образом, молярная концентрация S-эктодомена составляла одну четвертую от концентрации S1. Таким образом, повышенная аффинность связывания S-эктодомена по сравнению с S1 даже больше, чем кажется. (Для интерпретации ссылок на цвет в легенде к этому рисунку читатель отсылается к веб-версии этой статьи.)
(K) Наблюдалось мультифокальное слабое окрашивание апикальной поверхности кишечного эпителия слепой кишки белком S1, тогда как S-эктодомен (L) демонстрировал диффузное усиленное окрашивание эпителия. (M и N) Наблюдалось диффузное сильное окрашивание клоакальных желез S-эктодоменом и только рассеянное слабое окрашивание белком S1. Хотя молекулярная масса рекомбинантного S-эктодомена в два раза превышает молекулярную массу рекомбинантного белка S1, его использовали в половине концентрации мкг/мл. Таким образом, молярная концентрация S-эктодомена составляла одну четвертую от концентрации S1. Таким образом, повышенная аффинность связывания S-эктодомена по сравнению с S1 даже больше, чем кажется. (Для интерпретации ссылок на цвет в легенде к этому рисунку читатель отсылается к веб-версии этой статьи.)
Рис. 1
Гистохимия белков, демонстрирующая рекомбинантный IBV…
Рис. 1
1
Гистохимия белков, демонстрирующая связывание рекомбинантного IBV Ark-типа S1 и S-эктодомена у различных кур…
рисунок 1
Гистохимия белка, демонстрирующая связывание рекомбинантного IBV Ark-типа S1 и S-эктодомена в различных тканях цыплят. Хромогенный субстрат AEC+ использовали для идентификации связанного спайкового белка, на что указывает красное окрашивание (стрелки). (A) Эктодомен S1 связывается с апикальной поверхностью эпителия трахеи, в то время как S-эктодомен (B) связывается с ресничками, эпителием трахеи и секреторными везикулами бокаловидных клеток, содержащими муцин. (C) Связывание белка S1 не было выявлено в легких. (D) Связывание S-эктодомена было обнаружено в эпителии, выстилающем легочные парабронхи и предсердия. (E) Наблюдалось минимальное окрашивание апикальной поверхности эпителия слизистой оболочки носа и слизистых желез белком S1, тогда как S-эктодомен (F) демонстрировал усиленное окрашивание эпителия слизистой оболочки носа и слизистых желез. (G) Редкое точечное связывание S1 произошло вдоль апикальной поверхности хоанального подслизистого железистого эпителия. (H) Выявлено интенсивное связывание S-эктодомена эпителиальной апикальной поверхности и секреторного продукта в хоанальных железах. (I и J) Связывание S-эктодомена было обнаружено на эпителиальной верхушке рассеянных почечных канальцев; однако связывание S1 не наблюдалось. (K) Наблюдалось мультифокальное слабое окрашивание апикальной поверхности кишечного эпителия слепой кишки белком S1, тогда как S-эктодомен (L) демонстрировал диффузное усиленное окрашивание эпителия. (M и N) Наблюдалось диффузное сильное окрашивание клоакальных желез S-эктодоменом и только рассеянное слабое окрашивание белком S1. Хотя молекулярная масса рекомбинантного S-эктодомена в два раза превышает молекулярную массу рекомбинантного белка S1, его использовали в половине концентрации мкг/мл. Таким образом, молярная концентрация S-эктодомена составляла одну четвертую от концентрации S1. Таким образом, повышенная аффинность связывания S-эктодомена по сравнению с S1 даже больше, чем кажется.
(G) Редкое точечное связывание S1 произошло вдоль апикальной поверхности хоанального подслизистого железистого эпителия. (H) Выявлено интенсивное связывание S-эктодомена эпителиальной апикальной поверхности и секреторного продукта в хоанальных железах. (I и J) Связывание S-эктодомена было обнаружено на эпителиальной верхушке рассеянных почечных канальцев; однако связывание S1 не наблюдалось. (K) Наблюдалось мультифокальное слабое окрашивание апикальной поверхности кишечного эпителия слепой кишки белком S1, тогда как S-эктодомен (L) демонстрировал диффузное усиленное окрашивание эпителия. (M и N) Наблюдалось диффузное сильное окрашивание клоакальных желез S-эктодоменом и только рассеянное слабое окрашивание белком S1. Хотя молекулярная масса рекомбинантного S-эктодомена в два раза превышает молекулярную массу рекомбинантного белка S1, его использовали в половине концентрации мкг/мл. Таким образом, молярная концентрация S-эктодомена составляла одну четвертую от концентрации S1. Таким образом, повышенная аффинность связывания S-эктодомена по сравнению с S1 даже больше, чем кажется. (Для интерпретации ссылок на цвет в легенде к этому рисунку читатель отсылается к веб-версии этой статьи.)
(Для интерпретации ссылок на цвет в легенде к этому рисунку читатель отсылается к веб-версии этой статьи.)
Рис. 2
Относительная РНК ИБК в (A)…
Рис. 2
Относительная РНК IBV в (A) слезах и (B) трахее кур, праймированных при…
Рис. 2
Относительная РНК IBV в (A) слезах и (B) трахее цыплят, примированных в возрасте 12 дней адъювантным тримерным рекомбинантным S1 или S-эктодоменом (Se), усиленных через 21 день и зараженных вирулентным IBV Ark-типа 21 дней после повышения. Nv/C = невакцинированные (цыплята, примированные и ревакцинированные адъювантом с PBS)/зараженные. Nv/Nc = невакцинированные/незараженные. Относительные уровни РНК ИБК определяли через 5 дней после заражения с помощью количественной ОТ-ПЦР. Линии указывают медианный журнал 10 относительные числа копий РНК, прямоугольники указывают процентили с 25-го по 75-й, а усы указывают минимальное и максимальное значения. Разные буквы указывают на существенные различия ( P < 0,05). Nv/Nc были присвоены log 10 значений 0 для включения в графики с логарифмической шкалой по осям Y.
Линии указывают медианный журнал 10 относительные числа копий РНК, прямоугольники указывают процентили с 25-го по 75-й, а усы указывают минимальное и максимальное значения. Разные буквы указывают на существенные различия ( P < 0,05). Nv/Nc были присвоены log 10 значений 0 для включения в графики с логарифмической шкалой по осям Y.
Рис. 3
Трахеальная гистоморфометрия и гистопатология 5…
Рис. 3
Гистоморфометрия и гистопатология трахеи через 5 дней после заражения вирулентным IBV Ark у цыплят…
Рис. 3
Гистоморфометрия и гистопатология трахеи через 5 дней после заражения вирулентным IBV Ark у цыплят, примированных адъювантным тримерным рекомбинантным S1 или S-эктодоменом (Se), ревакцинированных через 21 день и зараженных вирулентным IBV типа Ark через 21 день после бустер-иммунизации. (A) Толщина слизистой оболочки и (B) толщина лимфоцитарной инфильтрации по данным трахеальной гистоморфометрии. (C) Тяжесть некроза слизистой оболочки трахеи и децилирования оценивали вслепую (1 = нормальный, 2 = легкий, 3 = умеренный, 4 = отмеченный, 5 = тяжелый) для каждой курицы. На диаграммах прямоугольников и усов (A и B) линии обозначают медианную толщину, прямоугольники указывают 25-й и 75-й процентили, а усы указывают минимальное и максимальное значения. На точечной диаграмме (C) каждая точка указывает оценку поражения для отдельной курицы, а линии указывают средние оценки для каждой группы. Nv/C = невакцинированные (цыплята, примированные и ревакцинированные адъювантом с PBS)/зараженные. Nv/Nc = невакцинированные/незараженные. Разные буквы обозначают существенные различия ( P < 0,05).
(A) Толщина слизистой оболочки и (B) толщина лимфоцитарной инфильтрации по данным трахеальной гистоморфометрии. (C) Тяжесть некроза слизистой оболочки трахеи и децилирования оценивали вслепую (1 = нормальный, 2 = легкий, 3 = умеренный, 4 = отмеченный, 5 = тяжелый) для каждой курицы. На диаграммах прямоугольников и усов (A и B) линии обозначают медианную толщину, прямоугольники указывают 25-й и 75-й процентили, а усы указывают минимальное и максимальное значения. На точечной диаграмме (C) каждая точка указывает оценку поражения для отдельной курицы, а линии указывают средние оценки для каждой группы. Nv/C = невакцинированные (цыплята, примированные и ревакцинированные адъювантом с PBS)/зараженные. Nv/Nc = невакцинированные/незараженные. Разные буквы обозначают существенные различия ( P < 0,05).
Рис. 4
Антитела к ИБК в куриной сыворотке…
Рис. 4
4
Антитела к ИБК в куриной сыворотке до прививки (11 DOA), через 3 недели после прививки…
Рис. 4
IBV-антител в сыворотке цыплят перед примированием (11 DOA), через 3 недели после примирования (32 DOA), через 2 недели после бустерной вакцинации (45 DOA) и через 5 дней после заражения (59 DOA).DOA), определяемый с помощью ELISA. ELISA, специфичный для IBV (A), и ELISA, специфичный для белка S-эктодомена (B), у цыплят, примированных рекомбинантным S1, S-эктодоменом (Se), ревакцинированных через 21 день и зараженных через 21 день после ревакцинации. Nv/C = невакцинированные (цыплята, примированные и ревакцинированные адъювантом с PBS)/зараженные. Nv/Nc = невакцинированные/незараженные. Показаны средние значения поглощения и SEM. В (B) планки погрешностей настолько малы, что их закрывают символы. Группа, иммунизированная S-эктодоменом, показала значительно более высокие уровни антител (измеряемые по оптической плотности), чем группы, иммунизированные белком S1, только адъювантом и невакцинированные незараженные группы (9). 0385 P < 0,05). Статистически значимые различия для каждой временной точки после вакцинации обозначены буквами.
0385 P < 0,05). Статистически значимые различия для каждой временной точки после вакцинации обозначены буквами.
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Ограниченная защита, обеспечиваемая рекомбинантным вирусом болезни Ньюкасла, экспрессирующим шиповидный белок инфекционного бронхита.
Зегпи Р.А., Хе Л., Ю.К., Джойнер К.С., Ван Сантен В.Л., Торо Х.
Зегпи Р.А. и соавт.
Авиан Дис. 2020 март;64(1):53-59. дои: 10.1637/0005-2086-64.1.53.
Авиан Дис. 2020.PMID: 32267125
Усиленная защита с помощью рекомбинантного вируса болезни Ньюкасла, экспрессирующего эктодомен вируса инфекционного бронхита и колониестимулирующий фактор куриных гранулоцитов-макрофагов.
Халид З.
 , Хе Л., Ю К., Бридлав С., Джойнер К., Торо Х.
, Хе Л., Ю К., Бридлав С., Джойнер К., Торо Х.
Халид З. и др.
Авиан Дис. 2021 сен; 65 (3): 364-372. doi: 10.1637/aviandiseases-D-21-00032.
Авиан Дис. 2021.PMID: 34427409
Рекомбинантные вирусы инфекционного бронхита, экспрессирующие химерные шиповидные гликопротеины, индуцируют частичный защитный иммунитет против гомологичного заражения, несмотря на ограниченную репликацию In Vivo .
Эллис С., Кип С., Бриттон П., де Вит С., Бикертон Э., Вервелде Л.
Эллис С. и др.
Дж Вирол. 2018 12 ноября; 92 (23): e01473-18. doi: 10.1128/ОВИ.01473-18. Печать 2018 1 декабря.
Дж Вирол. 2018.PMID: 30209177
Бесплатная статья ЧВК.Разработка вакцины против тяжелого острого респираторного синдрома: опыт вакцинации против коронавируса инфекционного бронхита птиц.

Кавана Д.
Кавана Д.
Авиан Патол. 2003 Декабрь; 32 (6): 567-82. дои: 10.1080/03079450310001621198.
Авиан Патол. 2003.PMID: 14676007
Бесплатная статья ЧВК.Обзор.
Прогресс и проблемы в разработке вакцин против птичьего инфекционного бронхита.
Банде Ф., Аршад С.С., Бежо М.Х., Моейни Х., Омар А.Р.
Банде Ф. и др.
Дж. Иммунол Рез. 2015;2015:424860. дои: 10.1155/2015/424860. Epub 2015 14 апр.
Дж. Иммунол Рез. 2015.PMID: 25954763
Бесплатная статья ЧВК.Обзор.
Посмотреть все похожие статьи
Цитируется
Вакцины против основных вирусных болезней птиц: стратегии расширения охвата и защитной эффективности.
Равикумар Р.
 , Чан Дж., Прабакаран М.
, Чан Дж., Прабакаран М.
Равикумар Р. и соавт.
Вирусы. 2022 31 мая; 14 (6): 1195. дои: 10.3390/v14061195.
Вирусы. 2022.PMID: 35746665
Бесплатная статья ЧВК.Обзор.
Вирус инфекционного бронхита (гаммакоронавирус) в птицеводстве: вакцинация, иммунный ответ и меры по смягчению последствий.
Бхуйян М.С.А., Амин З., Родригес К.Ф., Сааллах С., Шаарани С.М., Саркер С., Сиддики С.
Бхуйян МСА и др.
Ветеринарная наука. 2021 ноябрь 12;8(11):273. doi: 10.3390/vetsci8110273.
Ветеринарная наука. 2021.PMID: 34822646
Бесплатная статья ЧВК.Обзор.
Дизайн и характеристика ДНК-вакцины на основе спайка с согласованной последовательностью нуклеотидов против вируса инфекционного бронхита.
Zuo L, Yan W, Song Z, Li H, Xie X, Gu K, Ma P, Tian Y, Zhou C, Zhao Y, Yang X, Wang H.

Цзо Л. и соавт.
Вакцины (Базель). 2021 14 января; 9(1):50. doi: 10.3390/vaccines50.
Вакцины (Базель). 2021.PMID: 33466810
Бесплатная статья ЧВК.Эволюция вируса инфекционного бронхита, диагностика и контроль.
Леньярди М., Туччароне К.М., Францо Г., Чеккинато М.
Легнарди М. и соавт.
Ветеринарная наука. 22 июня 2020 г.;7(2):79. doi: 10.3390/vetsci7020079.
Ветеринарная наука. 2020.PMID: 32580381
Бесплатная статья ЧВК.Обзор.
Экспрессия и иммунореактивность рекомбинантного многоэпитопного антигена, сконструированного на основе четырех основных структурных белков вируса инфекционного бронхита птиц.
Лю К., Ли Дж., Ли Р.Л., Ма Ю.Т., Чжоу П.Л., Гао В.В., Ма Х.Л.
Лю Кью и др.
3 Биотех. 2020 март;10(3):86. doi: 10.1007/s13205-020-2079-8. Epub 2020 4 фев.
3 Биотех. 2020.PMID: 32089981
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
использованная литература
Торо Х., Джеквуд М.В., ван Сантен В.Л. Генетическое разнообразие и отбор регулируют эволюцию вируса инфекционного бронхита. Авиан Дис. 2012; 56: 449–455.
—
пабмед
Торо Х., Пеннингтон Д., Галлардо Р.А., ван Сантен В.Л., ван Гинкель Ф.В., Чжан Дж. Субпопуляции вируса инфекционного бронхита у вакцинированных цыплят после заражения. Авиан Дис. 2012; 56: 501–508.
—
пабмед
ван Сантен В.



 edu.
edu.
 2017 сен; 61 (3): 397-401. doi: 10.1637/11632-032017-ResNoteR.
2017 сен; 61 (3): 397-401. doi: 10.1637/11632-032017-ResNoteR.
 56:449–455; 2012.
56:449–455; 2012. В., Ли Д.Х. Различные эволюционные траектории вакциноуправляемых и неконтролируемых вирусов инфекционного бронхита птиц у товарной птицы.
В., Ли Д.Х. Различные эволюционные траектории вакциноуправляемых и неконтролируемых вирусов инфекционного бронхита птиц у товарной птицы. 
 edu.
edu. , Хе Л., Ю К., Бридлав С., Джойнер К., Торо Х.
, Хе Л., Ю К., Бридлав С., Джойнер К., Торо Х.
 , Чан Дж., Прабакаран М.
, Чан Дж., Прабакаран М.

