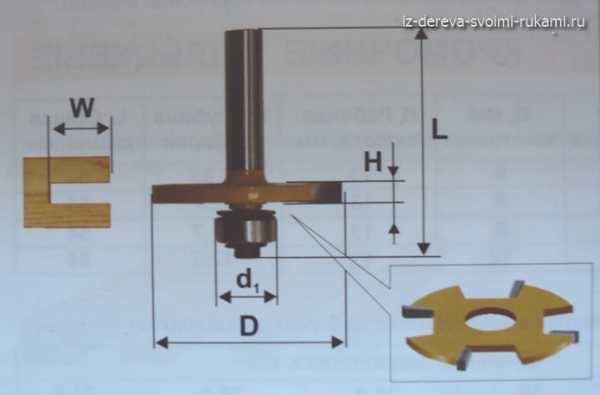
Формула кислорода. Периодическая таблица Менделеева - кислород. Температура кислорода
Формула кислорода. Периодическая таблица Менделеева
Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
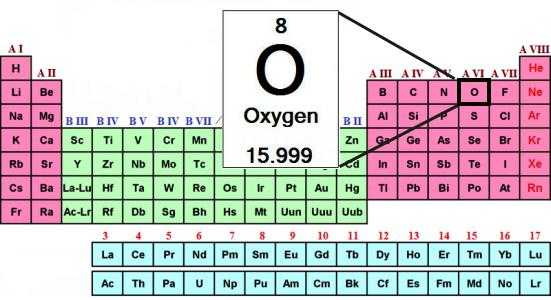
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: h3RO3, h3RO4.
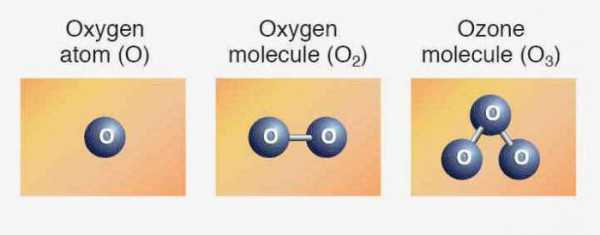
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента - озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
Строение атома кислорода
Периодическая таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
- Общее число электронов — 8.
- Электронная формула кислорода — 1s22s22p4.
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
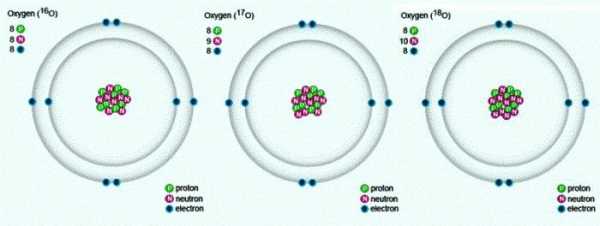
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода - разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
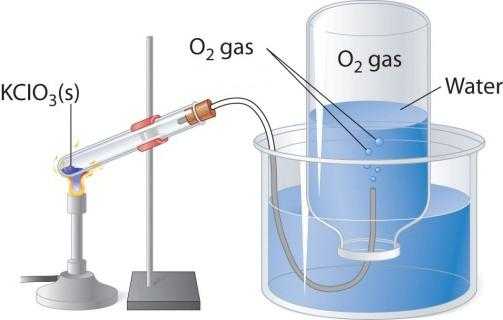
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
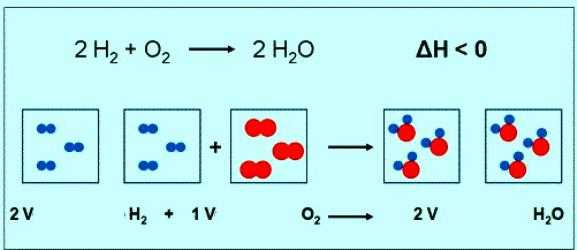
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
fb.ru
Химические и физические свойства, применение и получение кислорода
Четыре элемента-«халькогена» (т.е. «рождающих медь») возглавляют главную подгруппу VI группы (по новой классификации – 16-ю группу) периодической системы. Кроме серы, теллура и селена к ним также относится кислород. Давайте подробно разберем свойства этого наиболее распространенного на Земле элемента, а также применение и получение кислорода.
Распространенность элемента
Содержание кислорода в земной коре составляет практически 50%. Он находится в различных минералах в виде оксидов и солей.
В связанном виде кислород входит в химический состав воды – его процентное соотношение составляет порядка 89%, а также в состав клеток всех живых существ – растений и животных.
В воздухе кислород находится в свободном состоянии в виде О2, занимая пятую часть его состава, и в виде озона – О3.
Физические свойства
Кислород О2 представляет собой газ, который не обладает цветом, вкусом и запахом. В воде растворяется слабо. Температура кипения – 183 градуса ниже нуля по Цельсию. В жидком виде кислород имеет голубой цвет, а в твердом виде образует синие кристаллы. Температура плавления кислородных кристаллов составляет 218,7 градуса ниже нуля по Цельсию.
Химические свойства
При нагревании этот элемент реагирует со многими простыми веществами, как металлами, так и неметаллами, образуя при этом так называемые оксиды – соединения элементов с кислородом. Химическая реакция, в которую элементы вступают с кислородом, называется окислением.
Например,
4Na + О2= 2Na2O
S + О2 = SO2
Некоторые из сложных веществ также вступают в реакцию с кислородом, тоже образуя при этом оксиды:
СН4 + 2О2= СО2 + 2Н2О
2СО + О2 = 2СО2
Если какое-либо вещество медленно реагирует с кислородом, то такое окисление называется медленным. Например, это процессы разложения пищевых продуктов, гниение.
Получение кислорода
Этот химический элемент можно получить как в лаборатории, так и на промышленном предприятии.
Получение кислорода в лаборатории проводится несколькими способами:
1. С помощью реакции разложения бертолетовой соли (хлората калия).
2. Через разложение перекиси водорода при нагревании ее в присутствии оксида марганца, выступающего в роли катализатора.
3. Через разложение перманганата калия.
Получение кислорода в промышленности проводится такими способами:
1. Для технических целей кислород получают из воздуха, в котором обычное его содержание составляет порядка 20%, т.е. пятую часть. Для этого воздух сначала сжигают, получая смесь с содержанием жидкого кислорода около 54%, жидкого азота – 44% и жидкого аргона – 2%. Затем эти газы разделяют с помощью процесса перегонки, используя сравнительно небольшой интервал между температурами кипения жидкого кислорода и жидкого азота – минус 183 и минус 198,5 градуса соответственно. Получается, что азот испаряется раньше, чем кислород.
Современная аппаратура обеспечивает получение кислорода любой степени чистоты. Азот, который получается при разделении жидкого воздуха, используется в качестве сырья при синтезе его производных.
2. Электролиз воды также дает кислород очень чистой степени. Этот способ получил распространение в странах с богатыми ресурсами и дешевой электроэнергией.
Применение кислорода
Кислород является основным по значению элементом в жизнедеятельности всей нашей планеты. Этот газ, который содержится в атмосфере, расходуется в процессе дыхания растениями, животными и людьми.
Получение кислорода очень важно для таких сфер деятельности человека, как медицина, сварка и резка металлов, взрывные работы, авиация (для дыхания людей и для работы двигателей), металлургия.
В процессе хозяйственной деятельности человека кислород расходуется в больших количествах – например, при сжигании различных видов топлива: природного газа, метана, угля, древесины. Во всех этих процессах образуется оксид углерода. При этом природа предусмотрела процесс естественного связывания данного соединения с помощью фотосинтеза, который проходит в зеленых растениях под действием солнечного света. В результате этого процесса образуется глюкоза, которую растение потом расходует для строительства своих тканей.
fb.ru
Кислород — Мегаэнциклопедия Кирилла и Мефодия — статья
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99, 759 % по массе), 17 (0, 037%) и 18 (0, 204%). Радиус нейтрального атома кислорода 0, 066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13, 61819 и 35, 118 эВ, сродство к электрону 1, 467 эВ. Радиус иона О2-при разных координационных числах от 0, 121 нм (координационное число 2) до 0, 128 нм (координационное число 8). В соединениях проявляет степень окисления -2 (валентность II) и, реже, -1 (валентность I). По шкале Полинга электроотрицательность кислорода 3, 5 (второе место среди неметаллов после фтора).В свободном виде кислород — газ без цвета, запаха и вкуса.
История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи. В 1665 английский естествоиспытатель Р. Гук писал, что воздух состоит из газа, содержащегося в селитре, а также из неактивного газа, составляющего большую часть воздуха. О том, что воздух содержит элемент, поддерживающий жизнь, в 18 веке было известно многим химикам. Шведский аптекарь и химик Карл Шееле начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3, NaNO3) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье и другим ученым. К этому времени был открыт и азот. В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов — газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» — азота. Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бескислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47, 4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88, 8% (по массе), в атмосфере содержание свободного кислорода составляет 20, 95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры.В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10-15 МПа. Затем снова отбирают выделившуюся теплоту. Через несколько циклов «сжатие—расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (–182, 9°C) более чем на 10 градусов выше, чем температура кипения азота (–195, 8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0, 1 объемного процента.
Еще более чистый кислород можно получить при электролизе водных растворов щелочей (NaOH или KOH) или солей кислородсодержащих кислот (обычно используют раствор сульфата натрия Na2SO4). В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4:
2KMnO4 = K2MnO4 + MnO2 + O2.
Более чистый кислород получают разложением пероксида водорода Н2О2 в присутствии каталитических количеств твердого диоксида марганца MnO2:
2Н2О2 = 2Н2О + О2.
Кислород образуется при сильном (выше 600°C) прокаливании нитрата натрия NaNO3:
2NaNO3 =2NaNO2 + О2,
при нагревании некоторых высших оксидов:
4CrO3= 2Cr2O3 + 3О2;
2PbO2 = 2PbO + О2;
3MnO2 = Mn3O4 + О2.
Ранее кислород получали разложением бертолетовой соли KClO3 в присутствии каталитических количеств диоксида марганца MnO2:2KClO3 = 2KCl + 3О2.
Однако бертолетова соль образует взрывчатые смеси, поэтому ее для получения кислорода в лабораториях теперь не используют. Разумеется, сейчас никому в голову не придет использовать для получения кислорода прокаливание оксида ртути HgO, так как образующийся в этой реакции кислород загрязнен ядовитыми парами ртути.
Источником кислорода в космических кораблях, подводных лодках и т. п. замкнутых помещениях служит смесь пероксида натрия Na2O2 и супероксида калия KO2. При взаимодействии этих соединений с углекислым газом освобождается кислород:
2Na2O2 + 2CO2 = 2Na2CO3 + O2,
4КО2 + 2СО2 = 2К2СО3 + 3О2.
Если использовать смесь Na2O2 и КО2, взятых в молярном отношении 1:1, то на каждый моль поглощенного из воздуха углекислого газа будет выделяться 1 моль кислорода, так что состав воздуха не будет изменяться за счет поглощения при дыхании кислорода и выделения СО2.
Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0, 12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493, 57 кДж/моль.
При нормальных условиях плотность газа кислорода 1, 42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) –182, 9°C. При температурах от –218, 7°C до –229, 4°C существует твердый кислород с кубической решеткой (α-модификация), при температурах от –229, 4°C до –249, 3°C — β-модификация с гексагональной решеткой и при температурах ниже –249, 3°C — кубическая γ-модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
При 20°C растворимость газа О2: 3, 1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23, 1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая.
Высокая прочность химической связи между атомами в молекуле О2приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови (точнее с железом II гема), что обеспечивает перенос кислорода от органов дыхания к другим органам.Со многими веществами кислород вступает во взаимодействие без нагревания, например, с щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2O, CaO и др., пероксиды типа Na2O2, BaO2 и др. и супероксиды типа КО2, RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует со взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются различные оксиды, например:
S+O2 = SO2; С + O2 = СО2
4Fe + 3O2 = 2Fe2O3; 2Cu + O2 = 2CuO
4Nh4 + 3O2 = 2N2 + 6h3O; 2h3S + 3O2 = 2h3O + 2SO2
Если смесь кислорода и водорода хранить в стеклянном сосуде при комнатной температуре, то экзотермическая реакция образования воды
2Н2 + О2= 2Н2О + 571 кДжпротекает крайне медленно; по расчету, первые капельки воды должны появиться в сосуде примерно через миллион лет. Но при внесении в сосуд со смесью этих газов платины или палладия (играющих роль катализатора), а также при поджигании реакция протекает со взрывом.
С азотом N2 кислород реагирует или при высокой температуре (около 1500-2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II):
N2 + O2 = 2NO
Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота):
2NO + О2 = 2NO2
Из неметаллов кислород напрямую ни при каких условиях не взаимодействует с галогенами, из металлов — с благородными металлами серебром, золотом, платиной и др.
Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна –2, называют оксидами (прежнее название — окислы). Примеры оксидов: оксид углерода (IV) CO2, оксид серы (VI) SO3, оксид меди (I) Cu2O, оксид алюминия Al2O3, оксид марганца (VII) Mn2O7.Кислород образует также соединения, в которых его степень окисления равна –1. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка — О — О —. С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода –1/2. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т.д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F — +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
Применение кислорода очень разнообразно. Основные количества получаемого из воздуха кислорода используются в металлургии. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь (см. ст. Железо). Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди, никеля, свинца и др.). Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.Жидкий кислород — мощный окислитель, его используют как компонент ракетного топлива. Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах.Кислород в атмосфере Земли начал накапливаться в результате деятельности первичных фотосинтезирующих организмов, появившихся, вероятно, около 2, 8 млрд. лет назад. Полагают, что 2 млрд. лет назад атмосфера уже содержала около 1% кислорода; постепенно из восстановительной она превращалась в окислительную и примерно 400 млн. лет назад приобрела современный состав. Наличие в атмосфере кислорода в значительной степени определило характер биологической эволюции. Аэробный (с участием О2) обмен веществ возник позже анаэробного (без участия О2), но именно реакции биологического окисления, более эффективные, чем древние энергетические процессы брожения и гликолиза, снабжают живые организмы большей частью необходимой им энергии. Исключение составляют облигатные анаэробы, например, некоторые паразиты, для которых кислород является ядом. Использование кислорода, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в цепи дыхательных ферментов, привело к возникновению биохимического механизма дыхания современного типа. Этот механизм и обеспечивает энергией аэробные организмы.
Кислород — основной биогенный элемент, входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток — белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений. В каждом растении или животном кислорода гораздо больше, чем любого другого элемента (в среднем около 70%). Мышечная ткань человека содержит 16% кислорода, костная ткань — 28.5%; всего в организме среднего человека (масса тела 70 кг) содержится 43 кг кислорода. В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород). Потребность организма в кислороде определяется уровнем (интенсивностью) обмена веществ, который зависит от массы и поверхности тела, возраста, пола, характера питания, внешних условий и др. В экологии как важную энергетическую характеристику определяют отношение суммарного дыхания (то есть суммарных окислительных процессов) сообщества организмов к его суммарной биомассе.Небольшие количества кислорода используют в медицине: кислородом (из так называемых кислородных подушек) дают некоторое время дышать больным, у которых затруднено дыхание. Нужно, однако, иметь в виду, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов, нарушающих структуру и функции биополимеров. Сходным действием на организм обладают и ионизирующие излучения. Поэтому понижение содержания кислорода (гипоксия) в тканях и клетках при облучении организма ионизирующей радиацией обладает защитным действием — так называемый кислородный эффект. Этот эффект используют в лучевой терапии: повышая содержание кислорода в опухоли и понижая его содержание в окружающих тканях усиливают лучевое поражение опухолевых клеток и уменьшают повреждение здоровых. При некоторых заболеваниях применяют насыщение организма кислородом под повышенным давлением — гипербарическую оксигенацию.- Разумовский С. Д. Кислород — элементарные формы и свойства. М. 1979.
- Разумовский С. Д. Кислород - элементарные формы и свойства. М., 1979.
- Проссер Л. Кислород, дыхание и метаболизм // В кн.: Сравнительная физиология животных: пер. с англ. Т. 1. М., 1977.
- Термодинамические свойства кислорода. М., 1981.
megabook.ru
химические свойства элемента :: SYL.ru
Одним из важнейших элементов на нашей планете является кислород. Химические свойства этого вещества позволяют ему участвовать в биологических процессах, а повышенная активность делает кислород значимым участником всех известных химических реакций. В свободном состоянии это вещество имеется в атмосфере. В связанном состоянии кислород входит в состав минералов, горных пород, сложных веществ, из которых состоят различные живые организмы. Общее количество кислорода на Земле оценивается в 47% общей массы нашей планеты.
Обозначение кислорода
В периодической системе кислород занимает восьмую ячейку этой таблицы. Его международное название oxigenium. В химических записях он обозначается латинской литерой «О». В естественной среде атомарный кислород не встречается, его частички соединяются, образуя парные молекулы газа, молекулярная масса которого равна 32 г/моль.
Воздух и кислород
Воздух представляет смесь нескольких распространенных на Земле газов. Больше всего в воздушной массе азота - 78,2% по объему и 75,5 % по массе. Кислород занимает лишь второе место по объему - 20,9%, а по массе - 23,2%. Третье место закреплено за благородными газами. Остальные примеси – углекислый газ, водяной пар, пыль и прочее – занимают лишь доли процента в общей воздушной массе.
Вся масса естественного кислорода является смесью трех изотопов – 16О, 17О, 18О. Процентное содержание этих изотопов в общей массе кислорода равно 99,76%, 0,04% и 0,2% соответственно.
Физические и химические свойства кислорода
Один литр воздуха при нормальных условиях весит 1,293 г. При понижении температуры до -140⁰С воздух становится бесцветной прозрачной жидкостью. Несмотря на низкую температуру кипения воздух можно сохранять в жидком состоянии даже при комнатной температуре. Для этого жидкость нужно поместить в так называемый сосуд Дьюара. Погружение в жидкий кислород коренным образом меняет обычные свойства предметов.  Этиловый спирт и многие газы становятся твердыми предметами, ртуть приобретает твердость и ковкость, а резиновый мячик теряет свою упругость и рассыпается при малейшем ударе.
Этиловый спирт и многие газы становятся твердыми предметами, ртуть приобретает твердость и ковкость, а резиновый мячик теряет свою упругость и рассыпается при малейшем ударе.
Кислород растворяется в воде, хотя и в небольших количествах – морская вода содержит 3-5% кислорода. Но даже такое небольшое количество этого газа положило начало существованию рыб, моллюсков и различных морских организмов, которые получают кислород из воды для поддержания процессов собственного жизнеобеспечения.
Строение атома кислорода
Описанные свойства кислорода в первую очередь объясняются внутренним строением этого элемента.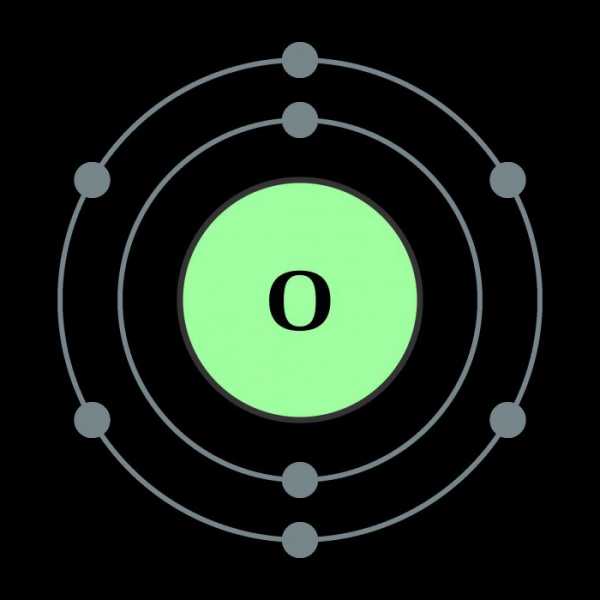
Кислород относится к главной подгруппе шестой группы элементов периодической системы. Во внешнем электронном облаке элемента находятся шесть электронов, четыре из которых занимают p-орбитали, а оставшиеся два располагаются на s-орбиталях. Такое внутреннее строение обуславливает большие энергетические затраты, направленные на разрывание электронных связей – атому кислорода проще заимствовать два недостающих электрона на внешнюю орбиталь, чем отдать свои шесть. Поэтому ковалентность кислорода в большинстве случаев равна двум. Благодаря двум свободным электронам кислород легко образует двухатомные молекулы, которые характеризуются высокой прочностью связи. Лишь при прилагаемой энергии свыше 498 Дж/моль молекулы распадаются, и образуется атомарный кислород. Химические свойства этого элемента позволяют ему вступать в реакции со всеми известными веществами, исключая гелий, неон и аргон. Скорость взаимодействия зависит от температуры реакции и от природы вещества.
Химические свойства кислорода
С различными веществами кислород вступает в реакции образования оксидов, причем эти реакции характерны и для металлов, и для неметаллов. Соединения кислорода с металлами называют основными оксидами – классическим примером служит оксид магния и оксид кальция. Взаимодействие оксидов металлов с водой приводит к образованию гидроксидов, подтверждающих активные химические свойства кислорода. С неметаллами это вещество образует кислотные оксиды – например, триоксид серы SO3. При взаимодействии этого элемента с водой получается серная кислота.
Химическая активность
С подавляющим большинством элементов кислород взаимодействует непосредственно. Исключение составляют золото, галогены и платина. Взаимодействие кислорода с некоторыми веществами значительно ускоряется при наличии катализаторов. Например, смесь водорода и кислорода в присутствии платины вступает в реакцию даже при комнатной температуре. С оглушительным взрывом смесь превращается в обычную воду, важной составной частью которой является кислород. Химические свойства и высокая активность элемента объясняют выделение большого количества света и теплоты, поэтому химические реакции с кислородом часто называются горением.
Горение в чистом кислороде происходит гораздо интенсивнее, чем в воздухе, хотя количество теплоты, выделяемой при реакции, будет приблизительно одинаковым, но процесс из-за отсутствия азота протекает гораздо быстрее, а температура горения становится выше.
Получение кислорода
В 1774 году английский ученый Д. Пристли выделил неизвестный газ из реакции разложения оксида ртути. Но ученый не связал выделенный газ с уже известным веществом, входящим в состав воздуха. Лишь несколько лет спустя великий Лавуазье изучил физико-химические свойства кислорода, полученного в данной реакции, и доказал его идентичность с газом, входящим в состав воздуха. В современном мире кислород получают из воздуха. В лабораториях использую промышленный кислород, который поставляется баллонами под давлением около 15 Мпа. Чистый кислород можно получить и в лабораторных условиях, стандартным способом его получения является термическое разложение перманганата калия, которое протекает по формуле:
Получение озона
Если через кислород или воздух пропустить электричество, то в атмосфере появится характерный запах, предвещающий появление нового вещества – озона. Озон можно получить и из химически чистого кислорода. Образование этого вещества можно выразить формулой:
3О2 = 2О3
Данная реакция самостоятельно протекать не может – для ее успешного завершения необходима внешняя энергия. Зато обратное превращение озона в кислород происходит самопроизвольно. Химические свойства кислорода и озона разнятся во многом. Озон отличается от кислорода плотностью, температурой плавления и кипения. При нормальных условиях этот газ имеет голубой цвет и обладает характерным запахом. Озон обладает большей электропроводностью и лучше растворяется в воде, чем кислород. Химические свойства озона объясняются процессом его распада – при разложении молекулы этого вещества образуется двухатомная молекула кислорода плюс один свободный атом этого элемента, который агрессивно реагирует с другими веществами. Например, известна реакция взаимодействия озона и кислорода: 6Ag+O3=3Ag2O
А вот обычный кислород не соединяется с серебром даже при высокой температуре.
В природе активный распад озона чреват образованием так называемых озоновых дыр, которые подвергают угрозе жизненные процессы на нашей планете.
www.syl.ru
Кислород
Министерство образования и науки РФ
РЕФЕРАТ
ПО ТЕМЕ
«КИСЛОРОД»
Выполнил:
Проверил:
-2007-
Общая характеристика кислорода.
КИСЛОРОД (лат. Oxygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева кислород расположен во втором периоде в группе VIA.
Природный кислород состоит из смеси трех стабильных нуклидов с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2 – при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления –2 (валентность II) и, реже, –1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора).
В свободном виде кислород — газ без цвета, запаха и вкуса.
Особенности строения молекулы О2 : атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону.
Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль.
Физические и химические свойства
Физические и химические свойства: в свободном виде встречается в виде двух модификаций О2 («обычный» кислород) и О3 (озон). О2 — газ без цвета и запаха. При нормальных условиях плотность газа кислорода 1,42897 кг/м3 . Температура кипения жидкого кислорода (жидкость имеет голубой цвет) равна –182,9°C. При температурах от –218,7°C до –229,4°C существует твердый кислород с кубической решеткой (-модификация), при температурах от –229,4°C до –249,3°C — -модификация с гексагональной решеткой и при температурах ниже –249,3°C — кубическая -модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода.
При 20°C растворимость газа О2 : 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая.
Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином крови (точнее с железом II гема), что обеспечивает перенос кислорода от органов дыхания к другим органам.
Со многими веществами кислород вступает во взаимодействие без нагревания, например, со щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2 O, CaO и др., пероксиды типа Na2 O2, BaO2 и др. и супероксиды типа КО2 , RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами.
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует с взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются различные оксиды, например:
S+O2 = SO2 ; С + O2 = СО2
4Fe + 3O2 = 2Fe2 O3 ; 2Cu + O2 = 2CuO
4Nh4 + 3O2 = 2N2 + 6h3 O; 2h3 S + 3O2 = 2h3 O + 2SO2
Если смесь кислорода и водорода хранить в стеклянном сосуде при комнатной температуре, то экзотермическая реакция образования воды
2Н2 + О2 = 2Н2 О + 571 кДж
протекает крайне медленно; по расчету, первые капельки воды должны появиться в сосуде примерно через миллион лет. Но при внесении в сосуд со смесью этих газов платины или палладия (играющих роль катализатора), а также при поджигании реакция протекает с взрывом.
С азотом N2 кислород реагирует или при высокой температуре (около 1500-2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II):
N2 + O2 = 2NO
Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота):
2NO + О2 = 2NO2
Из неметаллов кислород напрямую ни при каких условиях не взаимодействует с галогенами, из металлов — с благородными металлами серебром, золотом, платиной и др.
Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна –2, называют оксидами (прежнее название — окислы). Примеры оксидов: оксид углерода (IV) CO2 ,оксид серы (VI) SO3 , оксид меди (I) Cu2 O, оксид алюминия Al2 O3 , оксид марганца (VII) Mn2 O7 .
Кислород образует также соединения, в которых его степень окисления равна –1. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2 О2 , пероксид бария ВаО2 , пероксид натрия Na2 O2 и другие. В этих соединениях содержится пероксидная группировка — О — О —. С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода –1/2. Можно отметить, что часто формулы супероксидов записывают как К2 О4 , Rb2 O4 и т.д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2 F2 степень окисления кислорода +1, а в соединении O2 F — +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН.
История открытия
История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи. В 1665 английский естествоиспытатель Р. Гук писал, что воздух состоит из газа, содержащегося в селитре, а также из неактивного газа, составляющего большую часть воздуха. О том, что воздух содержит элемент, поддерживающий жизнь, в 18 веке было известно многим химикам. Шведский аптекарь и химик Карл Шееле начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3 , NaNO3 ) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье и другим ученым. К этому времени был открыт и азот. В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов — газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» — азота. Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бескислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс).
Нахождение в природе: кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов), приходится около 47,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры.
Получение:
В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10-15 МПа. Затем снова отбирают выделившуюся теплоту. Через несколько циклов «сжатие—расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (–182,9°C) более чем на 10 градусов выше, чем температура кипения азота (–195,8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0,1 объемного процента.
mirznanii.com
Кислород температуры - Справочник химика 21
Катализатор, низкое давление, температура 60—70 С. 2, Катализатор, высокое давление, температура 60—70 С. 3. Инициатор (следы кислорода), температура 200 °С. 4. Отсутствие инициатора и катализатора, высокие температура и давление. [c.278]Следовательно, так как при pH =4ч-10 коррозия ограничена скоростью диффузии кислорода через слой оксида, небольшие изменения состава стали, термическая и механическая обработка ее не повлекут за собой изменений коррозионных свойств металла, пока диффузионно-барьерный слой остается неизменным. Скорость реакции определяют концентрация кислорода, температура или скорость перемешивания воды. Это важно, так как pH почти всех природных вод находится в пределах 4—10. Значит, любое железо, погруженное в пресную или морскую воду, будь то низко-или высокоуглеродистая сталь, низколегированная сталь, содержащая, например, 1—2 % N1, Мп, Мо и т. д., ковкое железо, чугун, холоднокатаная малоуглеродистая сталь, будет иметь практически одинаковую скорость коррозии. Этот вывод подтверждается большим количеством лабораторных и промышленных данных для разнообразных типов железа и стали 111]. Некоторые из них приведены в табл. 6.1. Эти данные опровергают распространенное мнение, что ковкое железо, например, является более коррозионностойким, чем сталь. [c.107]
Состав реактивных топлив зависит от способа их получения (та л. 2.5). Кинетика окисления реактивных топлив в зависимости от их группового углеводородного состава, наличия и структуры гетероорганических соединений, ингибиторов окисления, концентрации кислорода, температуры, контакта с каталитически активными металлами может иметь разный характер [46]. Главной отличительной чертой этого процесса является постоянство его скорости во времени, наличие автоускорения или замедления. [c.45]Итак, при горении водорода в воздухе при стехиометрическом количестве кислорода температура разогрева достигнет 2400 К при этом равновесная конверсия водорода составит 95%- [c.126]
Кроме различий типов катализаторов на выход и селективность сильно влияют технология процесса и конструктивные особенности установок. Они определяются числом реакторов, распределением воздуха или кислорода, температурой, давлением и длительностью работы катализатора. Как правило, катализаторы без разбавителя обеспечивают несколько большие выходы и селективности. [c.278]
Стабильность свойств битума под воздействием природных факторов (света, кислорода, температуры, воды) косвенно характеризуется глубиной проникания иглы в остаток после прогрева битума при 160 °С в течение 5 ч (в % от первоначального значения). Значение этого показателя в проекте ГОСТ несколько выше, чем в ГОСТ 1544—52, и лежит в пределах 60—80%, в зависимости от марки битума. [c.163]
Измельченный уголь смешивают с водой в соотношении уголь вода -1 10 и насосами высокого давления через специальные форсунки подают в реакционное пространство газогенератора, куД подается также кислород. Температура процесса выше температуры шлакования (1100-1500 С), вследствии этого зола выводится из генератора в жидком виде, охлаждается и гра- [c.93]
В случае применения смесей этилена с воздухом рабочую температуру обычно поддерживают в пределах 260—290°. При замене воздуха кислородом температуру процесса можно понизить до 230° [8]. [c.159]
Полная насыщенность связей в силастиках делает их исключительно стойкими к действию кислорода, температур и времени. [c.637]
В замкнутом стальном цилиндре под давлением 160 атж содержатся 160 молей смеси окиси углерода и кислорода в объемном отношении 1 3. Определите молярный состав и давление газов после того, как 50% окиси углерода вступило в реакцию с кислородом. Температура в цилиндре поддерживалась постоянной, [c.15]
Температура воды, с Солержание кислорода Температура полы, С Содержание кислорода [c.134]
О 9-25. Укажите, какие из следующих высказываний верны и какие ошибочны а) горение в чистом кислороде происходит с большей скоростью, чем в атмосфере воздуха б) при сгорании данного количества вещества в кислороде температура выше, чем при сгорании его в воздухе по той причине, что в первом случае выделяется больше теплоты в) горение может происходить не только с участием кислорода г) горение происходит лишь при участии по меньшей мере двух веществ. [c.65]
Велико значение кислорода в технике и промышленности. При сжигании горючих газов в специально сконструированных горелках в токе чистого кислорода температура пламени резко повышается по сравнению с пламенем на воздухе. Пламя водорода, сжигаемого в токе кислорода, достигает 2000 °С, а ацетилена — 3000 °С. Пламенем таких горючих газов пользуются для сварки й резки металлов, для плавления платины, кварца и других очень тугоплавких материалов. Жидкий кислород или жидкий воздух, сильно обогащенный кислородном, применяют для изготовления взрывчатых смесей. [c.273]
При сгорании ацетилена в смеси с кислородом температура достигает 3200° С. Поэтому его используют для автогенной сварки металлов. Смеси ацетилена с воздухом и кислородом весьма взрывоопасны (взрываются от искры). [c.352]
Время пребывания газа в зоне реакции составляет 0,004—0,006 сек. Для предотвращения отрыва пламени производится непрерывное поджигание струи за счет кислорода, который вводится в небольшую топочную камеру 2. В топочную камеру вместе с кислородом подается небольшое количество метана. Вследствие сгорания метана в кислороде температура его повышается до 700—800° С. Смешение горячего кислорода с вытекающей из сопла газовой смесью обеспечивает ее поджигание, т. е. стабилизацию факела. Расход стабилизирующего кислорода составляет 5—10% от общего его количества. [c.120]
Темпера Вид дутья юздух Кислород Температура Сухой воздух Кислород [c.270]
Важнейшими переменными пви окислении парафиновых углеводородов для получения таюлородсодержащих продуктов являются соотношение между углеводородом и воздухом или кислородом, температура, давление и продолжительность реакции (время превращения). Окисление углеводородов связано с большой энергией активации и поэтому даже незначительные изменения температуры оказывают очень большое влияние на скорость реакции. [c.150]
Окись этилена получают также с катализатором, находящимся в исе-вдоожижепном слое [20]. При исиользоваппи в качестве окисляющего агента воздуха содерлоние этилена в газовой смесп должно быть ниже 2,9%. Температура реакции лежит между 260 и 290°, продолжительность реакции 1—4 сек. Когда работают с чистым кислородом, температура реакции может быть 230—240 . [c.185]
Поэтому перед установкой тонкой очистки целесообразно в таких случаях включать дополнительные установки для удаления указанных нежелательных загрязнений при помощи активного угля. Контакт тонкой сероочистки в отличие от массы, используемой для грубой очистки, имеет сероемкость лишь около 10%. Для обеспечения этой степени насыщения необходимо, чтобы в газе всегда содержалось необходимое количество кислорода. Температура процесса по мере отрабютки катализатора постепенно поднимается от 200 до 300°. Выходящий с установки грубой сероочистки (или с установки очистки активным углем) газ сначала подогревают в теплообменниках и затем направляют в башни тонкой очистки. Башни тонкой очистки загружают и разгружают так же, как и башни грубой очистки [22]. [c.82]
В реакторе частицы нефтяного кокса диаметром 0,1 — 1 мм поддерживаются в кипящем слое подаваемой снизу смесью пара с небольшим количеством кислорода (температура 500 °С). Поверх распределительной решетки для газового потока впрыскивается сырая нефть при 300—400 °С. В реакторе устанавливается температура 720 "С. Частицы нефтяного кокса, величина и вес которых непрерывно возрастают во время процесса, отводятся из реактора снизу. Отходящие газы охлаждаются в циклоне до 300 °С впрыском кубовых остатков из дистилляцпонной колонны, а летучие продукты фракционируются в колонне. [c.27]
Г. А. Гитцевичем [16] были определены температуры кипения отдельных фракций продуктов разложения и переработки масла, собранных в цистернах для жидкого кислорода. Температура кипения легких фракций переработанного масла оказалась 60° С, а температура замерзания — 153° К. [c.35]
Сравним материалы по их действию на кинетику окисления топлива Т-6 и накопление продуктов уплотнения в топливе при окислении в приборе ТСРТ-2. Исходя из методики проведения экспериментов, для сопоставления целесообразно взять отношения bjba и G/Go, где G и Go — соответственно суммы продуктов уплотнения при окислении топлива с металлом без нею. Отношения G/Go приведены в табл. 6.3. На рис. 6.2 показана зависимость bibo от G/Gq. Как видно из рисунка, наблюдается линейная корреляция между окисляемостью топлива и количеством образовавшихся продуктов уплотнения fe/bo=l,6+2,9 G/Gq. Это позволяет предполагать, что в исследованных условиях окисления (избыток кислорода, температура 125—150°С) действие материалов прежде всего проявляется на начальных стадиях окисления топлива Т-6. При окислении топлива РТ исследованные материалы по активности в образовании продуктов уплотнения располагаются в той же последовательности. [c.211]
Промышленный аппарат для регенерации алюмосиликатного катализатора в движуш,емся слое. Имеющиеся математические описания регенератора или включают средние для всего аппарата величины, или связывают входные и выходные величины без каких-либо предположений о внутреннем поле концентраций и температур. Так, в работе [23] экспериментальные данные описывались уравнением, связывающим среднюю скорость горения кокса со средними концентрациями кислорода, температурой процесса, концентрацией углеворода на катализаторе. В работе [24] процесс в регенераторе разбит на две стадии адиабатическую и изотермическую, и для одного случая (начальная температура катализатора —450 °С) предложены уравнения, определяющие зависююсть времени регенерации от конечной закоксованности. В работе [25] предложено определять время полной регенерации в различных предельных режимах (кинетическом, внутреннем и внешнедиффузионном) и затем суммировать их для нахождения времени реального процесса, что неоправданно. Авторам [25] пришлось ввести в предлагаемые уравнения эмпирические коэффициенты, чтобы они соответствовали экспериментальным данным. [c.323]
Печн производства желтого и красного пигментов. Общие сведения. Свинец образует с кислородом два окисла РЬО п РЬО,. Окись свинца РЬО называется в технике глетом ее молекулярная масса составляет 223,22 она содержит 92,83% РЬ и 7,17% кислорода. Температура плавления окпси свинца 880— 890 С, температура кипения 1470 "С, но уже при 1000 "С РЬО заметно испаряется. Существует РЬО в виде двух энантиотропных модификаций тетрагональной красно-коричневого цвета и ромбической желтого цвета. Переход одной модификации в другую происходит при 489 °С. [c.158]
В США и Канаде действовали несколько установок безкатализаторного окисления кислородом воздуха парафиновых углеводородов (пропана, бутана и др.) с целью получения формальдегида, ацетальдегида, уксусной кислоты и других кислородсодержащих продуктов [60]. Важнейшими факторами процесса, определяющими ход реакции, ее избирательность, являются отношение углеводорода к воздуху или кислороду, температура, давление и время реакции или время пребывания реагентов в реакторе. Однако следует отметить, что отсут- [c.126]
H ибoлee сложным представляется подогрев кислорода в связи с ростом его реакционной активности по отношению к металлам (при 400—500 °С углеродистая сталь может воспламениться в атмосфере кислорода). Температура кислорода, подаваемого в реактор, выбирается в пределах 20—300 °С. Если не хотят усложнять систему, кислород не подогревают. Безопасный подогрев кислорода до 300 °С может быть обеспечен при использовании в качестве источника тепла перегретого водяного пара. [c.108]
При оптимальных условиях процесса, то есть применении нагретого до 400—600°С 98% -ного кислорода, температуре пиролиза 1450—1500 С и времени контактирования 0,004—0,006 с, степень конверсии метана в ацетилен достигает 0,3 при общей степени превращения метана 0,9 и кислорода 0,99. Газ процесса окислительного пиролиза метана имеет состав (% об.) С2Н2 —8,0 С2Н4 — 0,5 СОа — 4,0 СО — 26,5 На — 54,0 Na — 3,0 СН4 — 4,0. Кроме того, в газе содержится 0,2—0,3% гомологов ацетилена, следы ароматических соединений и 1—3 г/м сажи и смолы. [c.254]
Эти новые и практически интересные реакции зависят от парциального давления кислорода, отноишния олефин кислород, температуры и других факторов. В оптимальных условиях из пропилена получается до 90% акролеина, 6% ацетальдегида, 2% пропио-нового альдегида и 2 % ацетона. Из зо-С Н в этих же условиях получается более 90% метакролеина. [c.202]
Использование для получения глубокого холода принципа испарения низкокипящих газов, таких, как кислород (температура кипения —183 С) или 130T (температура кипения —-196 С), также невозможно, так как наряду с низкими температурами кипения эти газы обладают очень низкими критическими температурами, выше которых нельзя перевести газ в жидкое состояние. Поэтому сжижение таких газов путем их охлаждения водой при любых давлениях исключается. [c.665]
С отходящими газами в реактор поступало 0,93-5,18 г/м органически) примесей и 1,8 ,1% об. кислорода. Температура в слое катализатора изменялась в пределах 350-450°С. В первые два дня работы реактора осуществлялось восстановление активности катализатора АП-56 за счет медленной окислительной регенерации с выжигом коксоподобных веществ, накопившихся в нем за время работы в процессе платформинга, продувкой горячим отходящим газом с расходом 1600 нм ч при 390-450°С. В последующих опытах при расходе отходящего газа 1 800- [c.93]
Рггк. 79. Завпсимость времени прохождения холодных пламен от начального давления смеси (50%-ная смесь дпэтнлового эфира с кислородом). Температура стенок сосуда указана для каждой кривой [45]. [c.223]
Судить об относительной прочности связей можно, сопоставив условия их разруслемия. Легче всего разрываются связи между молекулами водорода (у него самая низкая температура кипения). Затем по прочности следуют связи между молекулами кислорода (температура кипения выше). Прочность межмолекулярных связей воды значительно выше. В отличие от газообразп -лх водорода и кислорода вода при обычных условиях — жидкость, т. е. взаиглосвязь между ее молекулами намного прочнее. Еще более прочны связи между атомами в молекуле воды. Эти связи не разрушаются ни при ЮО С (при кипении воды), ни при дальнейшем повышении те.мпературы еще на несколько сот градусов. [c.203]
Когда энергия связи падает с ростом порядкового номера элемента в подгруппе, то температура плавления фаз, имеющих однотипную структуру, уменьшается. И, наоборот, если энергия связи возрастает, температура плавления однотипных фаз увеличивается. С этих позиций, например, в подгруппе кислорода температуру плавления полония и теллура сопоставлять не имеет смысла, так как их структура резко различается. Мы смогли обнаружить, в сущности, лишь два отклонения от указанной связи между Т л и АЯма- Температура плавления бария на 60 К ниже температуры плавления стронция, а стандартная энтальпия бария АЯзэв на 10,1 кДж больше, чем стронция. Но у стронция в отличие от бария при 862 К происходит аллотропное превращение с уменьшением объема на 2,3%. о означает, что вблизи температуры плавления энтальпия образования твердой фазы и энергия связи стронция могут быть выше, чем у бария. То же самое наблюдается для лантана и актиния. Лантан плавится при более высокой температуре, чем актиний, хотя стандартная энтальпия лантана на 26,7 кДж/моль ниже, чем у актиния. У лантана подобно стронцию при 595 С происходит аллотропное превращение с уменьшением объема на 0,5%. Таким образом, отклонение бария и лантана от упомянутой закономерности, по-видимому, кажущееся. [c.281]
Для промышленных целей азот получают фракционной перегонкой жидкого воздуха. Азот отгоняется при — 196 °С, при этом жидкость обогащается кислородом, температура кипения которого — 183 °С. Азот используют для производства аммиака, большая часть которо1 о расходуется азотнокислотной [c.461]
Поддерживая постоянными первичное напряжение тока на трансформаторе, скорость потока кислорода, температуру охлаждающей воды н скорость ее подачн, достигают постоянной концеитрацн озона в газовой смеси. [c.111]
На дыхание дрожжей при дрожжегеиерировании в спиртовом производстве расходуется значительное количество сахара —6— 15% от общего его расхода в этом процессе, или 2—5% от всех сбраживаемых сахаров, содержаи ихся в среде дрожжегенераторов. Расход сахара на дыхание при различных условиях дрожжегенерирования неодинаков и зависит от его концентрации в среде, скорости насыщения среды кислородом, температуры и других условий. Поэтому есть еще значительные резервы повышения выхода сппрта при переработке мелассы. [c.208]
chem21.info
Кислород критическая температура и давление
Диоксид, обычно называемый двуокисью угле рода, СО2 образуется при полном сгорании свободного углерода в атмосфере кислорода. Он представляет собой бесцветный газ, в связи с чем и носит тривиальное название углекислый газ . Теплота образования двуокиси углерода из графита составляет 393,7 кдж г-моль. Плотность двуокиси углерода при н.у. 1,977 г/л (по воздуху 1,53). Двуокись углерода легко сжижается ее критическая температура 31,3° С, критическое давление 72,9 атм.. При сильном охлаждении она превращается в белую снегообразную массу (сухой лед), которая при нормальном давлении возгоняется (не плавясь) при —78,5 С. При давлении 5 атм твердая двуокись углерода плавится при —56,7 С. Теплота плавления двуокиси углерода 51 дж г, теплота испарения (при —56 С) 569 5ж/г. Жидкая двуокись углерода не проводит электрического тока. Кристаллическая решетка — молекулярного типа. [c.196] В практикуме по газовой хроматографии используют различные газы. Одни газы применяют в качестве газов-носителей (водород, воздух, элементы нулевой группы, азот, диоксид углерода и др.), другие служат объектом исследования, обычно это углеводороды. Кислород, азот, водород и другие газы хранятся в стальных баллонах различной емкости под давлением. Газы, критическая температура которых лежит выше комнатной, например диоксид серы, диоксид углерода, хлор, хранятся в баллонах в жидком состоянии [c.27]Отклонения от свойств идеального газа проявляются и в других случаях. На рис..9,11 показано, что графики зависимости давления газа от его объема при температурах, близких к критической, приобретают необычный вид. При более высоких температурах (Т4 и Гд) газ приближенно подчиняется закону Бойля — Мариотта, но при более низких температурах (Т и Т ) на графиках этой зависимости появляется горизонтальный участок. Дело в том, что при перемещении вдоль изотермы Т2 изотермой называется график зависимости Р — V при постоянной температуре) от точки А к точке А обнаруживается, что в точке А возникает жидкая фаза. В области А — В одновременно существуют и паровая (газовая), и жидкая фазы, однако за точкой В возможно существование только жидкой фазы. Крутой подъем изотермы за точкой В обусловлен небольшой сжимаемостью жидкости по сравнению с газом. При температуре Т3 уменьшение объема газа приводит к появлению небольшого количества жидкости в точке С. Эта температура называется критической температурой газа, она является самой высокой температурой, при которой возможно превращение газа в жидкость. Выше этой температуры газ не превращается в жидкость при любых, сколь угодно высоких давлениях. Критическая температура кислорода равна — 120°С, [c.161]
Жидкое состояние вещества занимает определенный участок на температурной шкале. Снизу он ограничен температурой кристаллизации (или, что то же, температурой плавления). Сверху — так называемой критической температурой (существование которой установил Д. И. Менделеев). С повышением давления повышается температура, при которой жидкость находится в равновесии со своим паром. При температурах выше критической ни при каком давлении состояния жидкость и пар не различимы, остается одно полностью неупорядоченное газообразное состояние вещества. Выше этой температуры, следовательно, никаким давлением нельзя добиться конденсации газа в жидкость. Это относится, например, к основным компонентам воздуха —- азоту и кислороду, поэтому столь безуспешными были первые попытки получить жидкий воздух путем повышения давления при комнатной температуре. В табл. 7.11 приведены координаты критических точек некоторых веществ. Заметим, что ими определяется выбор жидкостей для холодильных устройств (в частности, аммиака, фреона и т. п.). [c.157]
Критическая температура различна для разных веществ и, например, для хлора равна -Ц44°С. Поэтому, применив достаточное давление, хлор можно перевести в жидкое состояние и без его охлаждения. Критические температуры основных газов воздуха лежат, наоборот, очень низко кислорода при — 118°С и азота при —147°С. Поэтому воздух можно перевести в жидкое состояние, лишь охладив его предварительно ниже указанных температур. Между тем исследователи раннего периода пытались получить жидкий воздух, применяя высокие давления, но не заботясь о достаточном охлаждении. [c.35]
Температура кипения жидкого хлора равна —34,05 °С, поэтому достаточно охладить газообразный хлор при нормальном давлении до этой температуры, чтобы он перешел в жидкое состояние. Приведенные данные указывают на то, что хлор относится к числу сравнительно легко сжижаемых газов, особенно в сравнении с такими газами, как кислород [критическая температура —118,8 °С, критическое давление 49,7-105 Па (51,3 кгс/см2), температура кипения при нормальном давлении —183,0 °С] или азот [критическая температура — 147,1°С, критическое давление 33,5-10 Па [c.15]
Для кислорода критическая температура равна — 118,8°С. и критическое давление 49,7 ат. [c.149]
Долгое время водород не удавалось ожижать из-за отсутствия подходящих хладоагентов критическая температура водорода (Гкр. = 33,24 °К) значительно ниже температуры кипения технически доступных хладоагентов— азота (77,3 °К) и кислорода (90,1 °К) при атмосферном давлении. [c.41]
Этилен — бесцветный газ, почти не обладающий запахом и горящий светящимся пламенем. Его т. пл. —169°, т. кип. —102,7°. Критическая температура 9,4°, критическое давление свыше 50,3 ат. В воде этилен растворим плохо, немного лучше — в спирте и эфире. С воздухом и кислородом образует взрывчатые смеси. [c.68]
Б практикуме по газовой хроматографии используют различные газы. Есть газы, которые применяют в качестве газов-носителей (водород, воздух, элементы нулевой группы, азот, двуокись углерода и др.), а есть такие, которые служат объектом исследования обычно это углеводороды. Кислород, азот, водород и другие газы хранятся в стальных баллонах различной емкости под давлением. Газы, критическая температура которых лежит выше комнатной, например, двуокись серы, двуокись углерода, хлор, хранятся в баллонах в жидком состоянии при выходе из баллона испаряются. Некоторые газы хранят растворенными в жидкости, например ацетилен в ацетоне. [c.224]
Вообще степень адсорбции данным адсорбентом понижается с летучестью вещества. Поскольку адсорбция, несомненно, зависит от величины межмолекулярных сил притяжения молекул, каждая физическая величина, зависящая от этого фактора (см. гл. I), должна изменяться параллельно с адсорбцией на данном адсорбенте. Такими физическими свойствами являются, например, ван-дер-ваальсовский коэфициент а, точка кипения и критическая температура , Так Дьюар установил, что количество водорода, азота и кислорода, адсорбированное при атмосферном давлении древесным углем при температурах, соответствующих точкам кипения этих веществ, приблизительно равно, составляя 260 см /г [27]. Эти правила, конечно, не лишены исключений, но для данного адсорбента степени адсорбируемости [c.84]
Критическая температура фтора равна —129 °С, критическое давление. 5.5 атм. При температуре кипения жидкий фтор имеет плотность 1,5 г/см , а теплота его испарения составляет 1,6 ккал/моль. Жидкий фтор, как и его смесь с жидким кислородом [c.241]
Газы с низкой критической температурой (водород, кислород, азот, аргон, метан, этилен) транспортируют и хранят в баллонах в газообразном состоянии под высоким давлением. Такие вещества, как аммиак, углекислоту, пропан, бутан, дивинил, критическая температура которых достаточно высока, хранят в баллонах [c.19]
Жидкий кислород представляет собой прозрачную голубоватую легко подвижную жидкость. Температура кипения при нормальном давлении минус 183° С, температура затвердевания минус 218° С. Критическая температура, т. е. температура, выше которой кислород может быть только в газообразном состоянии, минус 118° С. Критической температуре соответствует критическое давление жидкости, которое равно 49,7 кг/см . [c.29]
Газы и низкокипящие жидкости сохраняют под давлением в металлических баллонах. Газы, критическая температура которых ниже комнатной, например водород, кислород, азот, находятся в баллонах в газообразном состоянии, и их количество пропорционально давлению внутри баллона. Наоборот, вещества, критическая температура которых выше комнатной, например хлор, аммиак, углекислый газ, сернистый газ, находятся в баллонах в жидком состоянии. При отборе какого-либо газа первого типа давление в баллоне уменьшается пропорционально отобранному количеству газа. При отборе газа, находящегося в баллоне в жидком состоянии, давление внутри баллона остается постоянным до тех пор, пока не испарится вся жидкость. После этого давление понижается пропорционально отобранному количеству газа. Само собой разумеется, что в последнем случае в баллоне можно сохранять значительно большее количество вещества, чем в случае постоянных газов. [c.616]
Ацетилен — в обычных условиях газ конденсируется при —83,8°С, 0,1 МПа критическая температура 35,5 °С критическое давление 6,2 МПа. Как и другие газообразные углеводороды, он дает с воздухом и с кислородом взрывоопасные смеси. [c.262]
Понятие о критической температуре было впервые введено Д. И. Менделеевым в 1860 г. на основе изучения поверхностного натяжения жидкостей (стр. 51). Это понятие сыграло большую роль при изучении процесса сжижения газов. Еще опыты Фарадея показали, что для сжижения газа необходимы низкая температура и высокое давление. Этих двух факторов оказалось достаточно, чтобы осуществить сжижение большинства исследованных в то время газов потому, что критические температуры их были довольно высокие. Но сжижение водорода, кислорода, азота, окиси углерода и окиси азота не удавалось, так как самые низкие температуры, которые были достижимы в лабораториях, выше критических температур этих газов и, разумеется, никаким давлением нельзя было перевести эти газы в жидкое состояние После открытия существования критической температуры были разработаны методы получения весьма низких температур. Применяя их, удалось и эти газы перевести в жидкое состояние. [c.43]
В нормальных условиях кислород — газ с критической температурой —П8,8° С и критическим давлением 49,7 кГ/см . Жидкий кислород представляет собой голубоватую жидкость удельного веса 1,14, кипящую при —183° С и замерзающую при —219° С. Важнейшими преимуществами жидкого кислорода как окислителя, кроме его высоких энергетических характеристик, является неток-сичность, дешевизна изготовления и практически неограниченные сырьевые ресурсы. [c.125]
Многие газы поступают в лабораторию в стальных баллонах в сжатом или сжиженном состоянии. В сжиженном состоянии в баллоне может находиться только такой газ, критиче- ская температура которого выше обычной комнатной температуры (углекислый газ, хлор, сернистый газ, аммиак и др.). В этом случае давление газа остается постоянным, пока в баллоне еще есть жидкая фаза. Наоборот, газы (кислород, водород, азот, воздух и другие), имеющие низкую критическую температуру, не обращаются в жидкость при обыкновенных условиях и накачиваются в баллоны в сжатом состоянии под давлением в 150—200 ат по мере расходования газа давление в баллоне постепенно падает. Величины давления, под которым находятся в баллонах некоторые сжиженные газы, указаны в приложении 3. [c.97]
Большую опасность баллоны со сжатым газом представляют во время пожара, поскольку от нагревания повышается давление газа внутри баллона. При температуре 600° остаточная прочность баллонов составляет 30—40% начальной. Наиболее опасны при пожаре баллоны с ацетиленом и сжиженными газами. При критической температуре в баллонах со сжатыми газами резко повышается давление, так как весь газ переходит в газообразное состояние. В ацетиленовых баллонах при температуре 70—75° наступает резкий скачок давления, поскольку уменьшается растворимость ацетилена в ацетоне. При 100° ацетон совершенно не растворяет ацетилена. Весь ацетилен выделяется из ацетона и давление возрастает до 200 ат и выше. Разрыв ацетиленового баллона происходит при температуре около 100°. Баллоны со сжатыми газами (кислород, водород, азот) выдерживают температуру порядка 200—300° и разрываются при 400—500°. [c.253]
В нормальных условиях кислород — газ. Критические температура и давление для него соответственно равны кр = —118,8° и кр = 49,7 ат. Жидкий кислород представляет голубоватую жидкость удельного веса 1,14, кипящую при —183° и замерзающую при -219° [6, 8]. [c.643]
При давлениях выше критического охлаждающая жидкость не кипит, поскольку она находится лишь в однофазном состоянии, и расчет производят как для конвективного теплообмена. С увеличением давления температура кипения углеводородов повышается, и при критическом давлении она достигает максимального значения. При критической температуре поверхностное натяжение жидкости становится равным нулю, в связи с чем граница между жидкостью и насыщенным паром над ней исчезает. Однако нагрев охлаждаемой жидкости до критической температуры весьма опасен, так как в околокритической области температур коэффициент теплоотдачи к жидкости резко уменьшается. Наибольший эффект охлаждения достигается в условиях возможно большего недогрева жидкости до температуры ее, кипения на выходе из теплообменной системы. Обозначим теплообменную способность охлаждающей жидкости при турбулентном течении в условиях остывания горячей стенки через коэффициент А. Для воды этот коэффициент будет равен единице, для метилового спирта 0,545, этилового спирта 0,482, жидкого кислорода 0,479, а для четыреххлористого углерода лишь 0,141 [48]. Для углеводородов этот коэффициент ненамного выше коэффициента для четыреххлористого углерода. [c.86]
Газообразная фаза имеет подфазу, именуемую "паровой", которая лежит в области температур ниже критической и, таким образом, находится в таких условиях, когда для перевода в жидкую фазу ее надо лишь сжать. Для области газообразной фазы, лежащей выше критической температуры, нет специального названия. Однако в XIX в. полагали, что такие газы, как кислород и азот, в отличие, например, от углекислого газа не могут быть сжижены только лишь посредством повышения давления, и им было дано название "постоянных" ("перманентных") газов. Сейчас понятно, что это было вызвано значительным превышением рабочих температур над критическими. В наше время все подобные газы успешно сжижаются в процессах с предварительным охлаждением газа (в одну стадию или в несколько) до температур ниже критической. [c.70]
Ацетилен — в обычных условиях газ конденсируется при —83,8°С, 0,1 МПа критическая температура 35,5°С критическое давление 6,2 МПа. Как н другие гг зообразные углеводороды, ацетилен дает с воздухом и с кислородом взрывоопасные смеси, причем пределы взрывоопасной концентрации очень широки —объемное соотношение воздух С2Н2 от 1 2,0 до 1 81. Взрывоопасность ацетилена усугубляется его способностью давать с некоторыми металлами (Си, Ag) взрывоопасные соединения — ацетилиды, например СиС = ССи. [c.180]
Использование для получения глубокого холода принципа испарения низкокипящих газов, таких, как кислород (температура кипения —183 С) или 130T (температура кипения —-196 С), также невозможно, так как наряду с низкими температурами кипения эти газы обладают очень низкими критическими температурами, выше которых нельзя перевести газ в жидкое состояние. Поэтому сжижение таких газов путем их охлаждения водой при любых давлениях исключается. [c.665]
Критическая температура кислорода равна —118°С, критическое давление 50 атм. Жидкий кислород имеет плотность 1,14 г1см (при температуре кипения) и характеризуется теплотой испарения 1,63 ккал1моль. [c.49]
Закись азота (т. пл. —91, т. кип. —89 °С) является постоянной составной частью воздуха (0,00005 объемн.%). Критическая температура этого газа равна +36°С при критическом давлении 72 атм. Один объем воды поглощает при О °С около 1,3, а при 25 °С — 0,6 объема N2O. В результате охлаждения насыщенных растворов образуется кристаллогидрат N2O 6Н2О, нагревание которого может служить методом получения оч нь чистой N2O. Для наркоза обычно применяется смесь 80% закиси азота с 20% кислорода. [c.419]
Критическая температура Т р, температура, выще которой газ с повыщением давления не может быть превращен в жидкость. В природных условиях осадочной толщи в жидком состоянии не могут существовать метан, водород, кислород, но пропан, бутан, Н28 и СО2 легко превращаются в жидкости. Критическое давление Р р — давление, необходимое для конденсации пара при критической температуре. В двухкомпонентной смеси в отличие от однокомпонентной в критической точке С еще сосуществуют газовая и жидкая фазы, а Ткр и Ркр не являются максимальными. Максимальные для системы температуры и давления отмечены соответственно в точках Тщ и Р где — максимальное давление — криконденбар, при котором еще существует газовая фаза, и Тщ — максимальная температура, при которой еще сохраняется жидкая фаза — крикондентерм. Ретроградные явления испарения и конденсации происходят в узкой термобарической области, лежащей между криконденбаром и критической точкой, с одной стороны, и крикондентермом — с другой (заштрихованная область на рис. 1.18). Таким образом, газоконденсатными называются такие [c.56]
Такие газы, как водород, азот, кислород, так называемые действительные или постоянные газы, в обычных условиях приближаются к идеальным газам. Вообще при нормальных температурах и давлении отклонение от идеальных газов меньше у тех газов, у которых критическая температура очень низка, а критическое давление велико. Для таких газов почти полностью справедливо выражение PV = onst. Реальные газы следуют этому закону приблизительно, и то при низких давлениях. Для них уравнение состояния газа PV = RT является предельным, т. е. становится справедливым только при Р = 0. [c.59]
Вальта [11], изучая свечение паров фосфора в присутствии кислорода при низких давлениях, обнаружили, что при пуске кислорода в откачиваемый сосуд наступает свечение не сразу, а по достижении определенного критического давления кислорода. Даль нейшие опыты показали, что при давлениях кислорода ниже критического реакция между фосфором и кислородом практически не идет, а пои давлениях выше критического начинает бурно развиваться. Такое же изменение скорости реакции наблюдалось в результате добавления инертного газа или при малом изменении диаметра сосуда. Все эти факты резко противоречат существующим представлениям о скорости реакции как величине, непрерывно изменяющейся от изменения давления, температуры и концентрации. Н. Н. Семенов объяснил явления резкого перехода от практически полной инертности химической системы к бурно развивающемуся процессу тем, что реакция кислорода с парами фосфора является цепной, причем цепи обрываются при соударении ведущих реакцию атомов и -радикалов со стенками реакционного сосуда. Тогда отсутствие реакции при малых давлениях вызвано тем, что активные частицы, легко достигая стенок сосуда, гибнут, в результате чего происходит обрыв цепи. То же явление наблюдается в химической системе при малом диаметре сосуда. [c.68]
Рассмотрим зависимость концентрация — температура для смеси кислорода с азотом (рис. И-З). По оси ординат диаграммы отложены температуры, а по оси, абсцисс вправо доли азота в смеси. На нижней кривой указаны концентрации азота в жидкости, а на верхней — концентрации азота в парах, находящихся в равновесии с жидкостью. Так, точке / на кривой жидкостк соответствует равновесная концентрация в парах, равная 1 ,. причем концентрации азота в парах значительно выше, чем в-жидкости. При конденсации паров воздуха при атмосферном давлении первые капли жидкости будут содержать около 50% кислорода. Чем выше давление, тем мепыпе разница между составами жидкости и пара. Эта разница исчезает при достижении критических температур. Следовательно, процесс разделения воздуха ца азот и кислород целесообразно вести при пониженном давлении. [c.65]
Смеси водорода с кислородом в широком интервале концентраций самопроизвольно взрываются при температурах газа несколько выше 6(Ю и давлении не ниже 1 мм рт. ст. При температурах ниже 400° скорость реакции очень мала и взрыва не происходит, если не возбудить его действием внешнего источника, например электрической искры или раскаленной проволоки. Например, в стехиометрической смеси из 2 молей водорода и 1 моля кислорода при температуре 550° и давлении 400 мм рт. ст. будет проходить гомогенная реакция с постоянной измеримой скоростью если же давление повысить или понизить, то произойдет взрыв. Так, если происходит постепенное изотермическое понижение давления, то скорость реакции в течение некоторого времени будет падать, но при достижешии критического давления около 100 мм рт. ст. взрыв смеси произойдет самопроизвольно. Давление, при котором это происходит, носит название второго, или верхнего, предела взрыва. Если ту же начальную смесь при температуре 550° постепенно подвергать изотермическому сжатию, то скорость реакции будет медленно возрастать и опять-таки произойдет самопроизвольный взрыв при давлении около 1000 мм рт. ст. этот предел известен под названием третьего предела взрыва. Аналогично та же начальная смесь при 550°, но очень низком давлении будет медленно реагировать до тех пор, пока давление не повысится примерно до 1 мм рт. ст. при этом давлении достигается первый предел взрыва. Эти пределы самовоспламенения могут несколько колебаться в зависимости оТ соотношения компонентов в смеси и природы сосуда, в котором происходит реакция. Общее изменение пределов с температурой и давлением показано на рис. 5. Очевидно, что существование второго предела взрыва нельзя объяснить термическим взрывом, так как в случае термического [c.37]
Такие газы, как водород, кислород, а от, метан, этилен, обладающие низкой критической температурой, находятся в баллонах н сжатом состоянии под давлением около 15 МПа. Га ш, критическая температура. котг)рых выше комнатной, ия-пример диоксид углерода, пропилен, аммиак, диоксид серы, находятся в баллонах н сжиженном состоянии под давлением, соответствующим парциальному давлению их паров (табл. 53. [c.18]
Нами совместно с Клибановой [18] были определены критические условия воспламенения угольных нитей в потоке кислорода или воздуха. В этой работе исследование термического режима и критических условий было применено в качестве метода изучения кинетики реакции углерода с кислородом при атмосферном давлении. По зависимости температуры воспламенения от скорости потока определена энергия активации, по зависимости ее от концентрации кислорода — порядок реакции, который оказался ниже первого. Последнее заключение подтверждается также тем, что критические условия наблюдаются при концентрации кислорода 2,5% и исчезают лишь при 0,8%, что отвечает значению параметра [c.424]
Заслуживают интереса процессы холоднопламенного окисления углеводородов, изучавшиеся М. Б. Нейманом и др. При недостатке кислорода и температуре ниже температуры горения (около 300°) происходит характерное свечение реакционной смеси, которое получило название холодного пламени. Температура пламени поднимается всего па несколько десятков градусов. Возникновение холодного пламени вызвано протеканием ценных окислительных процессов, связанных со значительным выделением тепла. Это тепло аккумулируется продуктами реакции, которые переходят в возбужденное состояние и испускают свет. При повышении давления смеси выше пекоторои критической величины холодное иламя переходит в обычную горячую вснышку. В результате холодно-пламенного окисления гомологов метана получается значительное количество продуктов неполного окисления — альдегидов, спиртов, кетоиов и т. д. Сложность состава получающейся смеси затрудняет выделение из нее отдельных компонентов, что си.пьно ограничивает возмолшости применения этого метода. [c.321]
Жидкий кислород представляет прозрачную жидкость с голубым оттенком, уд. в. 1,14. Температура кипения жидкого кислорода равна — 183°, т. пл. — 219°. Критическая температура для кислорода— 118,8° и соответствующее ей критическое давление 49,7 атм. Вязкость жидкого кислорода (концентрации 96%) при температуре кипения составляет 0,189 сантипуаз, скрытая теплота испарения 1,632 ккал/г-моль, теплоемкость кислорода в интервале от — 173 до + 25° находится в пределах 7,0—6,9 кал/г-моль. При расчетах топлива следует учитывать затрату тепла на испарение кислорода и нагревание его паров до -fl8°. Эта величина составляет3,1 ккал/г-моль. [c.355]
Свойства. Азот — бесцветный, не имеющий запаха и вкуса газ, более легкий, чем воздух. Вес 1 л чистого азота нри 0° и 1QQ мм ртст равен 1,2505 г, а вес воздушного азота , содержащего 1,185 об. % аргона, составляет 1,2567 г вес 1 л воздуха при тех же условиях равен 1,2928 г. Азот сжижается с трудом (критическая температура — 147,1°, критическое давление 33,5 атм, критическая плотность 0,3110). Температура кипения жидкого азота равна —195,8°, температура плавления твердого азота — 210,5°. В воде азот менее растворим, чем кислород 1 л воды при 0° растворяет 23,6 мл воздушного азота или 23,2 мл чистого азота. [c.634]
Закись азота — бесцветный газ со слабым приятным запахом и сладковатым вкусом. При вдыхании его в незначительном количестве он вызывает состояние легкого опьянения и судорожный смех (отсюда название веселящий газ). При вдыхднии в больших количествах он действует как наркотическое средство. Однако при длительном вдыхании к нему необходимо примешивать кислород, так как сам по себе он не в состоянии поддерживать дыхания. Закись азота легко сжижается (температура кипения—89,5°, температура плавления —102,4°, критическая температура 36,5°, критическое давление 71,7 атм). В продажу N2O выпускают в сжиженном состоянии в стальных баллонах и применяют главным образом для наркоза. [c.637]
ДО = О, когда начальное давление кислорода соответствует парциальному, представленному в константе равновесия. В этих условиях отсутствует движущая сила реакции окисел и металл в одинаковой мере устойчивы. Если давление в условиях эксперимента станет ниже этой величины, то окисел будет диссоциировать.-Эта меняющаяся с температурой критическая величина давления называется упругостью диссоциации окисла. Если металл образует несколько окислов, например РеО, РезОз и Рез04, то все они обладает различными упругостями диссоциации. Наиболее бог1атый кислородом окисел обкчно превращается в окисел, содержащий меньше кислорода, а не непосредственно в чистый Металл, [c.13]
Газ — это пар, паходящпйся при температуре, бышо критической при этой температуре нп при каком давлении пар но может быть превращен в жидкость. Например, комнатная температура является надкрцтпчоской для кислорода, поэтому его храпят в стальных баллона. с в виде газа. Для двуокиси уг.терода критическая температура равна 4-31° и СО2 храпят в баллонах в жидком вп.те. [c.9]
chem21.info