Популярная химия. Описание диаграммы железо углерод
Углерод и железо - Популярная химия
Углерод в железе при различных условиях вызывает разные структурные состояния, определяемые количеством углерода и температурой среды.
Внедренный в железо углерод в различных соотношениях и при различной концентрации с условиями внедрения определяет массу различных свойств соединения. Это свойство нашло обширное практическое применение на производствах и в металлургической промышленности.
Различные состояния соединения железо-углерод имеют разные названия: стабильная твердая фаза - графит, затем по убыванию степени твердости цементит, аустенит, феррит и жидкая фаза.
Диаграмма железо-углерод
Начало изучению диаграммы железо-углерод положено в 1868 году инженером Обуховского металлургического завода Дмитрием Константиновичем Черновым. Ученый заметил, что у стали имеются критические точки, в которых степень сродства с углеродом резко меняется при проявляемой стабильности в другом температурном диапазоне. При этом критическая точка была вариабельна в зависимости от концентрации углерода, что обуславливало физические свойства конечного продукта.

В настоящее время диаграмма имеет диапазон температур до 1536 градусов по Цельсию. При более высокой температуре железо имеет жидкое агрегатное состояние и свободно растворяет любые количества углерода, образуя гомогенную массу. Соединения с углеродом находят практическое применение при пропорциях от 0,006% до 6,67% содержания углерода (цементит). Соединения при более высоких концентрациях нестабильны и не нашли практического применения, по этой причине шкала диаграммы ограничены концентрацией 6,67.
.
5 фаз диаграммы железо-углерод
Жидкая фаза - в этом состоянии железо растворяет углерод в любых соотношениях.
Феррит - образуется при температуре до 727 градусов. Концентрация углерода по мере увеличения температуры может возрастать от 0,006% до 0,02%. Его свойства близки к железу - мягкий, пластичный, магнитен при малом количестве углерода.
Аустенит - твердый раствор углерода в железе с кубической решеткой, где атомы углерода занимают центральное положение в решетке. Соединение обладает большей твердостью, нежели феррит. Проявляет парамагнитные свойства - то есть может быть намагниченным от внешнего магнитного поля. На практике его используют в составе сталей для придания сплаву устойчивости как к литью, так и закалке. Открытие аустенита позволило в разы ускорить процесс литья стали и ее закалки за счет повышения температурных режимов производства.
Цементит - очень твердое, но хрупкое соединение, магнитных свойств не имеет. Является результатом добавления углерода до 6,67% при темпере до 1536 градусов. Излишек углерода свыше 6,67% выделится в виде графита. Соединения считается условно стабильным, так как при длительном нагревании начинает выделять графит и уровень углерода снижается. В зависимости от условий получения, цементит может иметь различную форму - пластин, равноосные зерна, сетка и т.д. Цементин входит в различных концентрациях в состав железоуглеродистых сплавов. В промышленности цементит является основным сырьем для изготовления бетона и железобетона, которые являются самыми распространенными строительными материалами на сегодняшний день. Его уникальность заключается в его практически нулевой пластичности - он либо остается неизменной формы, либо ломается. Это объясняется сложностью строения его кристаллической решетки.
Графит - чистый углерод, не содержащий железа. Графит самый низкий по плотности из всех перечисленных фаз. Графит присутствует в соединениях чугуна и некоторых марках высокопрочной стали.
Графит находит особо широкое применение из-за его физических свойств: из него производят электроды и нагревательные элементы за счет его высокой электропроводимости и особой устойчивости к водным растворам, несвойственной ряду металлов. Его применяют также для получения синтетических алмазов, высокопроводящих клеев, наполнителя пластмасс и еще во множестве специфических сфер.

Заключение
Углерод, вступая в реакцию с железом в различных условиях, делает из железа совершенно уникальные соединения, придавая ему свойства, которые изначально и не подозревались. А доступность обоих материалов делает их ведущей основой для производства самой различной направленности
ximik.biz
Диаграмма состояния системы железо - углерод
Металлические сплавы — это сложные по составу вещества на основе металлов, сохраняющие их основные свойства: высокую электро — и теплопроводность, литейные свойства, ковкость и др. Сплав может быть в жидком и твердом состоянии. В жидком состоянии существует только одна жидкая фаза, а в твердом у сплавов может быть несколько фаз в виде твердых растворов, химических соединений и механических смесей.
Твердые растворы состоят из двух и более компонентов, в которых атомы растворимого компонента располагаются в кристаллической решетке основного компонента, замещая его атомы, либо внедрясь в кристаллическую решетку.
Химические соединения могут быть в виде металлов с неметаллами (Fe3C) или металлов с металлами (CuAl2, CuNi). Они обладают конкретными физико — механическими свойствами. Например, цементит (Fe3C) имеет высокую твердость, повышенную хрупкость и низкую электропроводность.
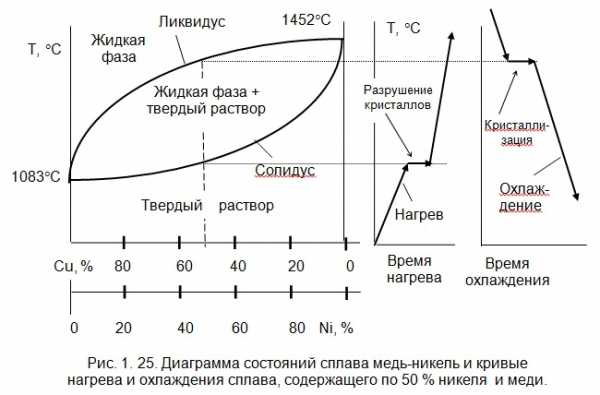
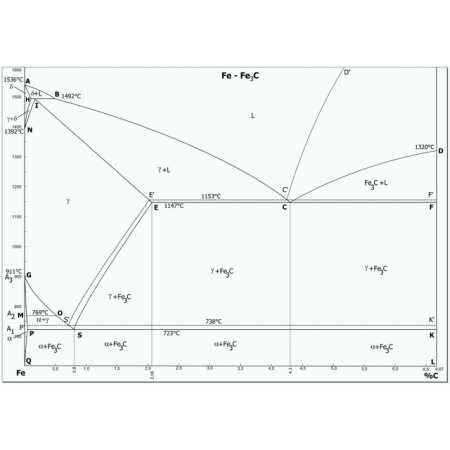
Механические смеси состоят из нескольких компонентов, которые при затвердевании (кристаллизации) не взаимодействуют друг с другом. Каждая из фаз сохраняет свою кристаллическую решетку. Например, у сталей могут одновременно быть смеси феррита и аустенита, или перлита и цементита. Диаграммы состояния строятся на основе кривых нагрева и охлаждения. Рассмотрим сплав (рис. 1.25) медь- никель (Cu — Ni). Атомы Cu и Ni могут соединяться в любых пропорциях (0…100%), образуя твердый раствор, при этом атомы Ni могут замещать в кристаллической решетке Cu все атомы. По горизонтальной оси откладывается содержание компонентов в твердом растворе, а по вертикальной- температура. Точка 1083 °C показывает температуру плавления меди, а точка 1452 °C –никеля. Нижняя линия (солидус) –это граница твердого раствора. Ниже ее оба металла и смесь находятся в твердом состоянии (в кристаллическом виде). Выше верхней линии (ликвидуса) располагается область жидкого раствора обоих этих металлов и сплавов. В «чечевице», очерченной нижней и верхней линиями, лежит область смеси кристаллов и более тугоплавкового металла с капельками более легкоплавкого.
В правой части рисунка 1.25 находятся кривые нагрева и охлаждения смеси (в данном случае представлена 50% смесь) этих металлов. На основании таких кривых, полученных для различных смесей в интервале 0…100% и построена диаграмма состояний. На кривых нагрева и охлаждения видны горизонтальные линии: при разрушении кристаллов тепло подводится, но повышения температуры нет, т.к. это тепло расходуется на разрушение кристаллов; при кристаллизации, наоборот, выделяется тепло, поэтому температура сплава по времени не снижается.
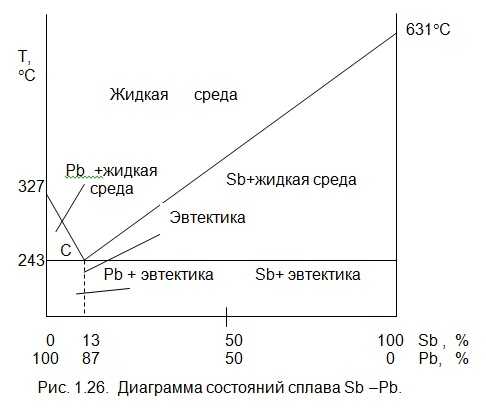
Для компонентов (пример для смеси свинец –сурьма), неограниченно растворимых в жидком состоянии и совершенно нерастворимых в твердом состоянии, с образованием механической смеси (эвтектики), диаграмма представлена на рис. 1.26.
На первом участке диаграммы ниже линии температур 327…243 °C кристаллизуется свинец, а далее на участке температур 243…631 °C — сурьма. В точке С кристаллизуется свинец и сурьма, и жидкость без промежуточных фаз переходит в твердое состояние. Эта смесь называется эвтектикой. До нее будет доэвтектический сплав (Рb + Э), а после заэвтектический сплав (Sb + Э). В точке С самая низкая температура плавления (243 °C) сплава.
Имеется связь характера диаграмм состояний со свойствами (электропроводность, твердость, прочность и т. д.). Так для первой группы сплавов –твердых растворов, с ростом концентрации компонента (например, Ni на рис. 1.25) механические свойства (твердость., прочность) увеличиваются, а для второй группы (рис. 1.26) имеется точка экстремума, т. е. сначала механические характеристики повышаются, а далее снижаются.
Структурные составляющие железо — углеродистых сплавов представлены в виде твердых растворов (рис. 1. 27) (феррит и аустенит), химического соединения (цементит) и механических смесей (перлит, ледобурит.,…).
Феррит это твердый раствор внедрение углерода в a—железо. Он очень мягкий и пластичный, хорошо проводит тепло и электричество, сильно магнитен. Углерода в нем очень мало (около 0,002%). В микроструктурах металла цементит имеет белый цвет. Углерод замещает центральный атом объемно — центрированной кубической решетки (a — железо) или вакансии кристаллической решетки.

Фазовые превращения (рис. 1.28) происходят по мере изменения температуры. При нагреве до 768 °С a — железо теряет свои магнитные свойства, но кристаллическая решетка не меняется.
При 898 °С – эта решетка превращается в гранецентрированную кубическую решетку, называемую g — железом. Аустенит это твердый раствор внедрения углерода в y –железо. Он не магнитен, сравнительно мягкий, углерода содержится в нем максимально до 2%.
При 1401 °С g — железо превращается в s — железо с объемно — центрированной решеткой, существующей до температуры плавления железа (1539 °С).
Цементит — это химическое соединение (карбид железа Fe3C), содержащее 6,67% углерода и имеющее высокую твердость и хрупкость, плохо проводящее электрический ток и тепло. Цементная сетка является светлой на микроструктурах сплава. Цементит является неустойчивым химическим соединением и при высоких температурах происходит его распад на железо и углерод:
Fe3 C ® Fe + C.
Ледебурит—это механическая смесь (эвтектика) , состоящая из аустенита и цементита и содержащая 4,3% углерода, образуется при температурах ниже 1147 °С, имеет высокую твердость и хрупкость.
Перлит – механическая смесь (эвтектоид), состоящая из тонких пластинок или зерен цементита и феррита, образуется в результате распада аустенита при температурах ниже 727 °С. Углерода в перлите 0,8%.
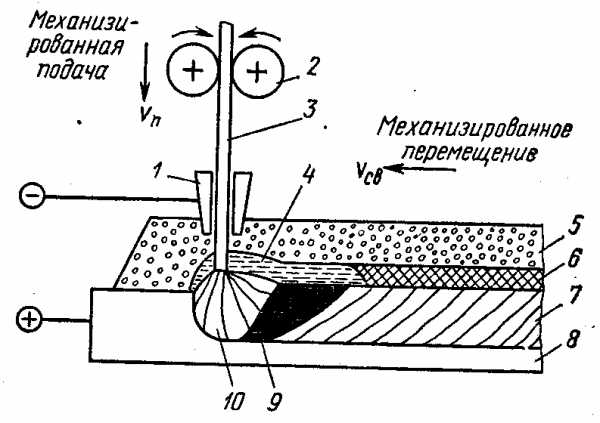
На основе кривых (рис. 1.28) охлаждения и нагрева сплавов Fe-C строится диаграмма состояний (рис.1.29) системы железо-углерод. На ней имеются линии: ликвидуса –АСД ; солидуса — AECF. Выше линии ликвидуса металл находится в жидком состоянии, а ниже линии солидуса- в твердом (кристаллическом) состоянии. Остальные линии отражают превращения в сплавах, происходящие после затвердевания. Ниже линии солидуса, при дальнейшем снижении температуры происходят структурные изменения, т.е. перекристаллизация уже в твердом состоянии (вторичная кристаллизация).
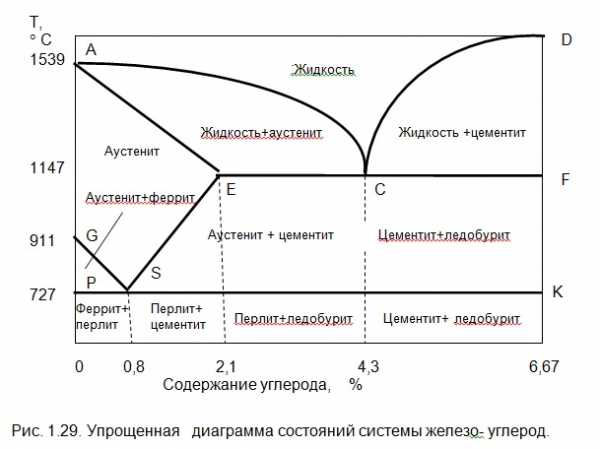
В точке S аустенит распадается на твердую однородную смесь кристаллов феррита и цемента — перлит. Сплав в точке S — эвтектоидный, при содержании углерода меньше 0,8% доэвтектоидный, а более 0,8% — заэвтектоидный. После 0,8% происходит распад аустенита с выпаданием из него вторичного цементита.
Точка А –это температура плавления чистого железа Fe, а точка Д — температура плавления цементита Fe3C. Точка Е (2,14% С) делит сплав на две группы: стали и чугуны. Левее точки Е будут стали, а правее- чугуны.
Температура плавления стали с увеличением количества углерода С в ней снижается, а чугунов после 4,3% — увеличивается.
Сразу после затвердевания структура сталей состоит из аустенита, а чугунов из смесей: аустенит + ледебурит ; цементит + ледебурит.
При охлаждении доэвтектоидных сталей (С < 0,8%, т.е. левее точки S) аустенит распадается, из него выделяется феррит.
В эвтектоидной точке С будет механическая смесь кристаллов аустенита и цементита — ледебурит. Правее точки С выделяется цементит. Сплавы чугунов левее точки С — доэвтектоидные, правее — заэвтектоидные.
Белые чугуны (белый оттенок на изломе). состоят из ледебурита и цементита Они твердые, хрупкие, трудно механически обрабатываются. Используются для передела в сталь.
Если углерод в сплаве находится в свободном состоянии, т.е. в виде графита, то это серые чугуны.
Диаграмма железо — углерод имеет большое практическое значение для инженеров. По ней можно определить температуру плавления и затвердевания сталей и чугунов, интервалы температур при обработке сталей давлением (ковка, штамповка,…) и термической обработке (закалка, отпуск,…), т.е.. она нужна металлургу, кузнецу и термисту.
www.npokz.ru
Диаграмма состояния сплавов железо-углерод Обработка металлов давлением
1. Назначение и характерные особенности диаграммы железо-углерод. Что позволяет определить диаграмма состояния сплавов; ее практическое назначение?
Диаграмма состояния железо-углерод даёт представление о строении железоуглеродистых сплавов – сталей и чугунов.
Впервые на существование в стали критических точек и на зависимость их от содержания углерода указал Дмитрий Константинович Чернов. Впоследствии свои высказывания о влиянии углерода на положение критических точек Чернов изобразил графически, воспроизведя очертание важнейших линий диаграммы железо-углерод.
Чернов определял положение критических точек на глаз, по цветам каления стали. Знаменитый французский исследователь Ф. Осмонд, воспользовавшись только что изобретённым Ле-Шателье пирометром, определил положение критических точек, описал характер микроструктурных изменений при переходе через критические точки и дал названия основных структур железоуглеродистых сплавов, употребляющихся и сейчас.
Образование твёрдых растворов при нагревании было установлено Р. Аустеном, что было доказано прямым металлографическим анализом Ле-Шателье, А.А. Байковым и Н.Т. Гудцовым.
Используя эти данные, а также разработанную теорию фазовых равновесий Д. Гиббса, голландский учёный Розебум, а также и Р. Аустен представили первый вариант диаграммы железо-углерод. Неполнота сведений, которыми располагали эти исследователи, не позволила им построить диаграмму во всех областях, отвечающих действительному фазовому равновесию. Лишь к концу XIX века немецкий учёный П. Геренс, использовавший опыт своих предшественников и новые данные по микроструктурному и термическому анализу железоуглеродистых сплавов, привёл в своей книге диаграмму железо-углерод, достаточно близко отвечающую современному варианту. Позже были внесены хоть и существенные, но не принципиальные уточнения в диаграмме железо-углерод. Дальнейшие работы по изучению диаграммы железо-углерод продолжаются и сейчас.
Диаграмма железо-углерод, как следует из названия, должна распространяться от железа до углерода. Железо с углеродом образует ряд химических соединений: Fe3C; Fe2C; FeC и др. и, следовательно, система железо-углерод должна быть отнесена к сложной форме диаграммы с химическими соединениями.
Фазы состояния сплава железо – углерод
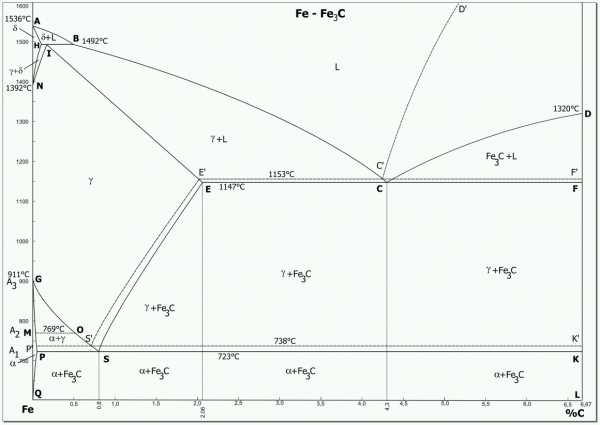
Рис. 1. Диаграмма состояния сплавов железо-углерод
В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит.
1. Жидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы.
2. Феррит – твердый раствор внедрения углерода в α-железо.
Феррит имеет переменную предельную растворимость углерода: минимальную – 0,006% при комнатной температуре (точка Q), максимальную – 0,02% при температуре 727° С (точка P). Углерод располагается в дефектах решетки.
При температуре выше 1392° С существует высокотемпературный феррит, с предельной растворимостью углерода около 0,1% при температуре около 1500 °С (точка I)
Свойства феррита близки к свойствам железа. Он мягок (твердость – 130 НВ, предел прочности -) и пластичен (относительное удлинение -), магнитен до 768° С.
3. Аустенит (γ) – твердый раствор внедрения углерода в γ-железо.
Углерод занимает место в центре гранецентрированной кубической ячейки.
Аустенит имеет переменную предельную растворимость углерода: минимальную – 0,8% при температуре 727° С (точка S), максимальную – 2,14% при температуре 1147° С (точка Е).
Аустенит имеет твердость 200…250 НВ, пластичен, парамагнитен.
При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
4. Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67% углерода.
В железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен.
Диаграмма состояния железоуглеродистых сплавов имеет большое практическое значение. Она используется для определения температур нагрева стали при различных видах термической обработки, при определении температурных интервалов для горячей обработки стали давлением (ковка, штамповка, прокатка), а также для определения температур плавления и кристаллизации стали и чугунов в литейном производстве.
2. Сущность обработки металлов давлением: ковки, штамповки, прокатки, прессования
Обработка металлов давлением – технологический процесс получения заготовок или деталей в результате силового воздействия инструмента на обрабатываемый материал.
Обработка металлов давлением основана на способности металлов в определенных условиях пластически деформироваться в результате воздействия на деформируемое тело (заготовку) внешних сил.
Если при упругих деформациях деформируемое тело полностью восстанавливает исходные форму и размеры после снятия внешних сил, то при пластических деформациях изменение формы и размеров, вызванное действием внешних сил, сохраняется и после прекращения действия этих сил. Упругая деформация характеризуется смещением атомов относительно друг друга на величину, меньшую межатомных расстояний, и после снятия внешних сил атомы возвращаются в исходное положение. При пластических деформациях атомы смещаются относительно друг друга на величины, большие межатомных расстояний, и после снятия внешних сил не возвращаются в свое исходное положение, а занимают новые положения равновесия.
Процессы обработки металлов давлением по назначению подразделяют на два вида:
1. Для получения заготовок постоянного поперечного сечения по длине (прутков, проволоки, лент, листов), применяемых в строительных конструкциях или в качестве заготовок для последующего изготовления из них деталей – только обработкой резанием или с использованием предварительного пластического формоизменения, основными разновидностями таких процессов являются прокатка и прессование;
2. Для получения деталей или заготовок (полуфабрикатов), имеющих приближённо формы и размеры готовых деталей и требующих обработки резанием лишь для придания им окончательных размеров и получения поверхности заданного качества; основными разновидностями таких процессов являются ковка и штамповка.
Прокатка заключается в обжатии заготовки между вращающими валками. Силами трения заготовка втягивается между валками, уменьшаются поперечные размеры заготовки.
Прессование заключается в продавливании заготовки, находящейся в замкнутой форме, через отверстие матрицы, причём форма и размеры поперечного сечения выдавленной части заготовки соответствуют форме и размерам отверстия матрицы.
Ковкой изменяют форму и размеры заготовки путём последовательного воздействия универсальным инструментом на отдельные участки заготовки.
Штамповкой изменяют форму и размеры заготовки с помощью специализированного инструмента – штампа (для каждой детали изготовляют свой штамп). Различают объёмную и листовую штамповку. При объёмной штамповке сортового металла на заготовку, являющуюся обычно отрезком прутка, воздействуют специализированным инструментом – штампом, причём металл заполняет полость штампа, приобретая её форму и размеры. Листовой штамповкой получают плоские и пространственные полые детали из заготовок, у которых толщина значительно меньше размеров в плане (лист, лента, полоса). Обычно заготовка деформируется с помощью пуансона и матрицы.
3. Правила работы с электролитом для кислотных аккумуляторов
1. На всех сосудах с электролитом, дистиллированной водой и нейтрализующими растворами должны быть сделаны соответствующие надписи (наименование).
www.coolreferat.com