Содержание
404. К сожалению, данная страница не найдена.
| Разделы | |
|---|---|
| Оборудование для производства пенопласта | |
| Несъемная опалубка | |
| Оборудование для производства рубероида | |
| Оборудование для фигурной резки пенопласта | |
| Станки для резки пенопласта | |
| Оборудование для производства СИП панелей | |
| СИП панели — цена. Купить СИП панели | |
| Вибропресс для шлакоблоков | |
| Оборудование для производства полистиролбетона (пенобетона) | |
| Оборудование для производства сэндвич панелей | |
| Оборудование для производства поролона | |
| Конвекторы Аккорд М | |
| Оборудование для производства ЖБИ | |
| Бетоносмеситель (бетономешалка) принудительного действия | |
| Формы для ФБС | |
Фундаментные блоки. Блоки ФБС (цена). Блоки ФБС (цена). | |
| Формы для колодезных колец | |
| Бетонные кольца для колодца (цена) | |
| Формы для ступеней из бетона ЛС | |
| Формы для перемычек | |
| Формы для бордюров | |
| Формы для дорожных плит | |
| Виброплита | |
| Вибростол | |
| Виброплощадка | |
| Малый бизнес | |
| Шинные мини пилорамы | |
| Оборудование для производства пива | |
Оборудование для производства краски | |
| Рецепты красок (технологии красок) | |
| Пеноизол | |
| Бадья для бетона | |
| Тара для раствора | |
| Карта сайта (направления
развития бизнеса) | |
| Контакты | |
| Главная | |
К сожалению, данная страница не найдена. Вы можете воспользоваться поиском по сайту или выбрать раздел в меню.
Вы можете воспользоваться поиском по сайту или выбрать раздел в меню.
Телефон: +7 473 256-46-33, +7 920 407-62-26, e-mail: [email protected]
| Формы для ФБС |
|---|
| Формы для дорожных плит |
|---|
| Формы для ступеней из бетона |
|---|
| Формы для перемычек |
|---|
| Формы для колодезных колец |
|---|
| Виброплощадка |
|---|
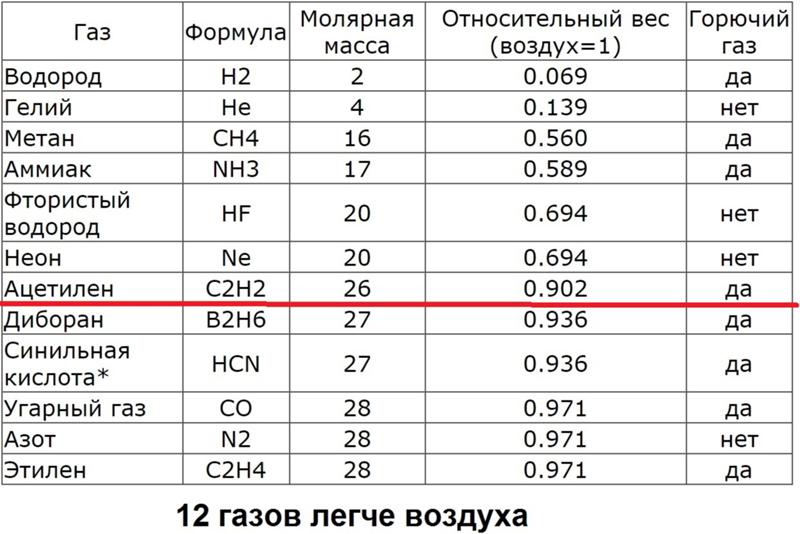
Удельный вес ацетилена.
 Вес ацетилена в 1м3
Вес ацетилена в 1м3
Газ ацетилен был открыт еще в 1836 году ученым Эдмундом Дэви вследствие воздействия водой на карбид кальция. С 1855 по 1862 год французский химик Марселен Бертло смог получить ацетилен, или как раньше его назвали «двууглеродистый водород», сразу несколькими способами, он же присвоил ему название «ацетилен».
Яркое, теплого спектра и горячее пламя ацетилена стали использовать в светильниках вместо газовых фонарей не только в домашних условиях, но и для освещения улиц и даже в качестве фонаря для велосипедов и карет.
Свойства ацетилена
Ацетилен в советское время применяли на стройках путем смешивания карбида кальция с водой. Неприятный запах, сопровождавший процесс, был обусловлен примесями аммиака и сероводорода в техническом карбиде. Сам по себе чистый ацетилен:
- газ со слабым эфирным запахом,
- легким сладковатым привкусом,
- легче воздуха,
- слаботоксичный.
В таблице ниже представлены основные значения плотности, молярной массы и веса литра газа ацетилена при нормальных условиях.
Основные значения плотности, молярной массы и веса литра и 1м3 газа ацетилена при нормальных условиях
| Вещество | Химическая формула | Удельный вес (кг/м3) | Плотность (г/см3) | Вес 1 литра (г) | Молярная масса (г/моль) |
| Ацетилен | C2h3 | 1,09 | 1,00109 | 1,0896 | 26,038 |
При естественной влажности и нормальной температуре ацетилен бесцветный газ, а при понижении температуры до -85ºС кристаллизуется.
Особой характеристикой, которая в большой степени обусловила области использования ацетилена, стала его повышенная взрывоопасность во множестве сопутствующих условий, например, при резком повышении температуры (даже в результате трения) до 450 – 500ºС.
Смесь воздуха, а тем более кислорода с ацетиленом взрывоопасна в большом диапазоне концентраций (от 2,8% и до 81%). При 335ºС происходит самовоспламенение газа. Соединения ацетилена с медью или серебром взрываются от удара.
При повышении давления на большие объемы газа выше 2 кг/см2 газ становится взрывоопасным и может детонировать даже от искры статического электричества на одежде. Взрыв сопровождается увеличением давления до 10 раз и температуры до 3000 градусов Цельсия.
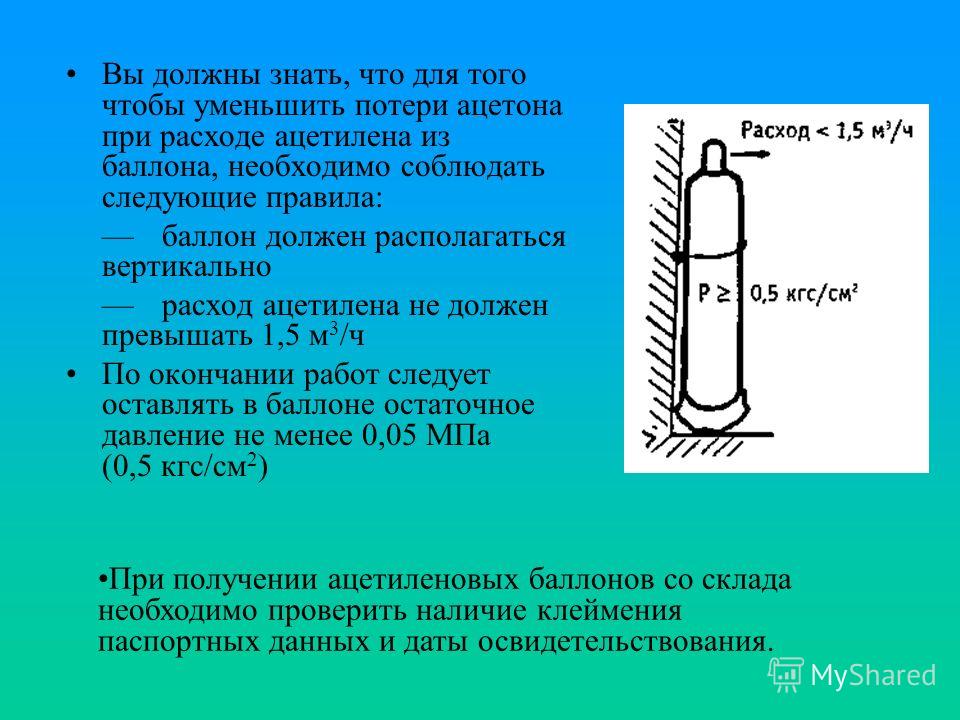
Для понижения взрывчатости ацетилен хранится и перевозится в баллонах с мелкокапиллярным пористым наполнителем либо растворяется в ацетоне, азоте, метане, пропане.
Жидкий
марка «А»марка «Б», I сорт
марка «Б», II сорт
Ацетилен — ненасыщенный углеводород C2h3. Имеет тройную связь между томами углерода, принадлежит к классу алкинов.
Физические свойства
При нормальных условиях — бесцветный газ, малорастворим в воде, легче воздуха. Температура кипения −83,8 °C. При сжатии разлагается со взрывом, хранят в баллонах, заполненных кизельгуром или активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах.Взрывоопасный. Нельзя выпускать на открытый воздух. Частицы C2h3 есть на Уране и Нептуне.
Частицы C2h3 есть на Уране и Нептуне.
Химические свойства
Ацетилено-кислородное пламя(температура «ядра» 3300 °C)
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекулавысокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен можетполимеризироваться в бензол и другие органические соединения (полиацетилен, винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метаниз эфирного раствора метилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра иодновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
История
Открыт в 1836 г. Э. Дэви, синтезирован из угля и водорода (дуговой разряд между двумя угольными электродами в атмосфере водорода) М. Бертло (1862 г.).
Способ производства
В промышленности ацетилен часто получают действием воды на карбид кальция см. видео данного процесса (Ф. Вёлер, 1862 г.), а также при дегидрировании двух молекул метана при температуре свыше 1400° Цельсия.
Применение
Ацетиленовая лампа
Ацетилен используют:
- для сварки и резки металлов,
- как источник очень яркого, белого света в автономных светильниках, где он получается реакцией карбида кальция и воды (см. карбидка),
- в производстве взрывчатых веществ (см. ацетилениды),
- для получения уксусной кислоты, этилового спирта, растворителей, пластических масс, каучука, ароматических углеводородов.

Безопасность
Поскольку ацетилен растворим в воде и его смеси с кислородом могут взрываться в очень широком диапазоне концентраций, его нельзя собирать в газометры. Ацетилен взрывается при температуре около 500 °C или давлении выше 0,2 МПа; КПВ 2,3-80,7 %, температура самовоспламенения 335 °C. Взрывоопасность уменьшается при разбавлении ацетилена другими газами, например N2, метаном или пропаном. При длительном соприкосновении ацетилена с медью или серебром образуется взрывчатая ацетиленистая медь или ацетиленистое серебро, которые взрываются при ударе или повышении температуры. Поэтому при хранении ацетилена не используются материалы, содержащие медь (например, вентили баллонов). Ацетилен обладает слабым токсическим действием. Для ацетилена нормирован ПДКм.р. = ПДК с.с. = 1,5 мг/м3 согласно гигиеническим нормативам ГН 2.1.6.1338-03 «Предельно допустимые концентрации (ПДК) загрязняющих веществ в атмосферном воздухе населенных мест». ПДКр.з. (рабочей зоны) не установлен (по ГОСТ 5457-75 и ГН 2. 2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
2.5.1314-03), т.к. концентрационные пределы распределения пламени в смеси с воздухом составляет 2,5-100%. Хранят и перевозят его в заполненных инертной пористой массой (например, древесным углем) стальных баллонах белого цвета (с красной надписью «А») в виде раствора в ацетоне под давлением 1,5-2,5 МПа.
Применение
Ацетилен – один из наиболее значимых углеводородов, активно вступающих в химические связи. Применение газа довольно широко:
- горючее для газовой резки и сварки металла,
- производство растворителей путем присоединения хлора и хлорпроизводных веществ, отщепление хлороводорода дает высококачественный растворитель, применимый для химчистки тканей,
- производство поливинилхлорида (изоляция проводов, кожзамы, трубы и пр),
- выпуск других полимеров, необходимых для создания пластмассы, различных каучуковых смесей, синтетических волокон,
- создание взрывчатых веществ.
Общие сведения
Ацетилен — ненасыщенный углеводород C 2 H 2 .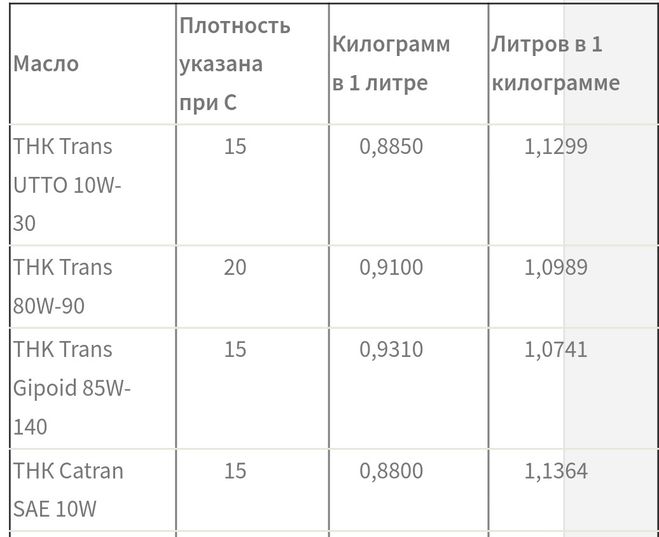 Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле практически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Имеет тройную связь между атомами углерода, принадлежит к классу алкинов. В природе на Земле практически не встречается, т.к. из-за присутствия кислорода это крайне неустойчивое соединение, получается путем синтеза. Ацетилен обнаружен в атмосфере Урана, Юпитера и Сатурна.
Впервые газообразный ацетилен получил в 1836 г. Эдмунд Дэви при разложении водой карбида калия, полученного при сплавлении металлического калия с углем: К 2 С 2 + 2Н 2 О = С 2 Н 2 + 2КОН.
С конца 19 в., когда был разработан дешевый способ получения ацетилена из карбида кальция (CaC 2 + 2H 2 O = C 2 H 2 + Ca(OH) 2 , который в свою очередь получали прокаливанием смеси угля и негашеной извести (СаО + 3С = СаС 2 + СО), этот газ стали использовать для освещения. В пламени при высокой температуре ацетилен, содержащий 92,3% углерода (это своеобразный химический рекорд), разлагается с образованием твердых частичек углерода, которые могут иметь в своем составе от нескольких до миллионов атомов углерода. Сильно накаливаясь во внутреннем конусе пламени, эти частички обуславливают яркое свечение пламени — от желтого до белого, в зависимости от температуры (чем горячее пламя, тем ближе его цвет к белому). Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Ацетиленовые горелки давали в 15 раз больше света, чем обычные газовые фонари, которыми освещали улицы. Постепенно они были вытеснены электрическим освещением, но еще долго использовались в небольших фонарях на велосипедах, мотоциклах, в конных экипажах.
Опасные факторы и меры безопасности
Ацетилен – взрывоопасный газ. С воздухом образует взрывоопасную смесь. Температура самовоспламенения ацетилена 335°С. Температура воспламенения ацетилено-воздушных смесей 305-470°С, ацетилено-кислородных 297-306°С,
При хранении ацетилена и его применении необходимо заботиться о достаточной вентиляции и учесть правила классификации электрооборудования. Открытое пламя и курение категорически запрещены.
Ацетилен обладает слабым токсическим действием. При длительном вдыхании технического ацетилена появляется рвота и головокружение.
Ацетилен взрывоопасен при следующих условиях:
– при нагреве до 450-500°С и одновременном повышении давления от 1,5 –2,0 атмосфер ацетилен взрывается без внешнего источника воспламенения;
– в смеси с воздухом, если в воздухе содержится ацетилена в пределах от 2,3–80,7% по объему;
Ацетилен
Ацетилен
Впервые ацетилен получил в 1836 году Дэви
, действуя на карбид кальция водой. Дал название ацетилену французский химик –
Дал название ацетилену французский химик –
П.Э. Бертло в 1860
году.
Ацетилен, или этин является первым представителем ненасыщенных углеводородов с тройной связью
. Его молекулярная формула С2Н2. Начиная с ацетилена, можно построить
гомологический ряд
, в котором каждый последующий углеводород отличается от предыдущего на одну группу СН2.
С3Н4 – это пропин
, С4Н6 –
бутин
. Поэтому
общая формула гомологического ряда ненасыщенных углеводородов с одной тройной связью СnНn-2
.
Общее название этого класса – алкины
.
Названия ацетилена и его гомологов образуют изменением суффикса – ан на суффикс –ин.
В отличие от этилена, имеющего плоскостное строение, ацетилен имеет линейное строение
: все четыре атома молекулы ацетилена лежат на одной прямой с углами связей, равными 1800. Каждый атом углерода образует три связи с атомами углерода и одну – с атомами водорода.
Ацетилен при обычных условиях
представляет собой бесцветный газ, смесь которого с воздухом взрывается от искры. Ацетилен плохо растворяется в воде, хорошо растворяется в ацетоне: в одном объёме ацетона при обычных условиях растворяется двадцать пять объёмов ацетилена.
Так как ацетилен содержит кратные связи, то для него характерны реакции присоединения.
Например, при присоединении водорода количеством один моль к ацетилену количеством один моль в присутствии катализатора образуется
этилен
.
В данной реакции происходит разрыв только одной ковалентной связи в молекуле ацетилена.
Этилен, в свою очередь, также может взаимодействовать с водородом в присутствии катализатора с образованием этана
. Поэтому можно написать суммарное уравнение присоединения водорода количеством два моль к ацетилену количеством один моль с разрывом двух ковалентных связей и образованием этана.
Ацетилен вступает и в реакции присоединения галогенов
.
Например, при присоединении хлора количеством 1 моль к ацетилену количеством один моль, разрывается одна ковалентная связь и образуется 1,2–дихлорэтен
, если к ацетилену присоединить сразу два моль хлора, то разрывается две ковалентные связи и образуется соединение
1,1,2,2–тэтрахлорэтан
.
Кроме галогенов, ацетилен вступает в реакции присоединения галогеноводородов.
Например, при присоединении хлороводорода количеством один моль к ацетилену количеством один моль, то разрывается только одна ковалентная связь и образуется
хлорэтен
. Если к ацетилену количеством один моль добавить два моль хлороводорода, то разрываются две связи и образуется
1,1–дихлорэтан
.
При горении ацетилена образуется углекислый газ и вода
.
В лаборатории ацетилен получают
действием воды на карбид кальция СаС2. В результате этого взаимодействия образуется ацетилен и гидроксид кальция.
Например, если на карбид кальция подействовать водой, а затем поджечь выделяющийся газ, то он горит коптящим пламенем. Это горит ацетилен.
Это горит ацетилен.
В смеси с кислородом ацетилен широко используется
для резки и сварки металлов. Ацетилен используют при получении растворителей, уксусной кислоты, клея ПВА, поливинилхлорида, а также его используют как горючее.
Решим задачу. Вычислите, какой объём ацетилена при нормальных условиях, образуется в результате взаимодействия с водой 100 г технического карбида кальция, содержащего 4% примесей.
По условию задачи нам дана масса карбида кальция 100 г и массовая доля примесей в этом техническом карбиде кальция 4%. Найти нужно объём ацетилена. Согласно уравнению, в результате этой реакции образуется газ ацетилен и гидроксид кальция. Найдём массовую долю чистого карбида кальция, для этого от 100 вычитаем 4 и получаем 96%, поэтому масса чистого карбида кальция равна произведению массы технического карбида кальция на массовую долю чистого карбида кальция. Получается нужно 100 умножить на 0,96%, получаем 96 г. Нам необходимо найти количество вещества карбида кальция, для этого необходимо его массу разделить на молярную массу. Чтобы найти молярную массу карбида кальция нужно атомную массу кальция умножить на один и сложить с произведением атомной массы углерода, умноженной на два, получается 64 г/моль. Находим количество вещества карбида кальция, для этого разделим массу на молярную массу, подставим значения: 96 г делим на 64 г/моль, получаем 1,5 моль. Найдём по уравнению реакции количество вещества ацетилена, для этого 1,5 умножим на 1 и разделим на 1, будет 1,5 моль. Теперь можно найти и объём ацетилена, для этого необходимо количество вещество умножить на молярный объём. Получается 1,5 моль умножим на 22,4 л/моль, будет 33,6 л. Поэтому, в результате данной реакции образуется 33,6 л ацетилена.
Чтобы найти молярную массу карбида кальция нужно атомную массу кальция умножить на один и сложить с произведением атомной массы углерода, умноженной на два, получается 64 г/моль. Находим количество вещества карбида кальция, для этого разделим массу на молярную массу, подставим значения: 96 г делим на 64 г/моль, получаем 1,5 моль. Найдём по уравнению реакции количество вещества ацетилена, для этого 1,5 умножим на 1 и разделим на 1, будет 1,5 моль. Теперь можно найти и объём ацетилена, для этого необходимо количество вещество умножить на молярный объём. Получается 1,5 моль умножим на 22,4 л/моль, будет 33,6 л. Поэтому, в результате данной реакции образуется 33,6 л ацетилена.
Таким образом, ненасыщенные углеводороды с одной тройной связью (алкины) образуют гомологический ряд общей формулой СnНn-2. Названия ацетилена и его гомологов образуют изменением суффикса –ан на суффикс –ин. Ацэтилен имеет линейное строение и образует угол связи равный 1800.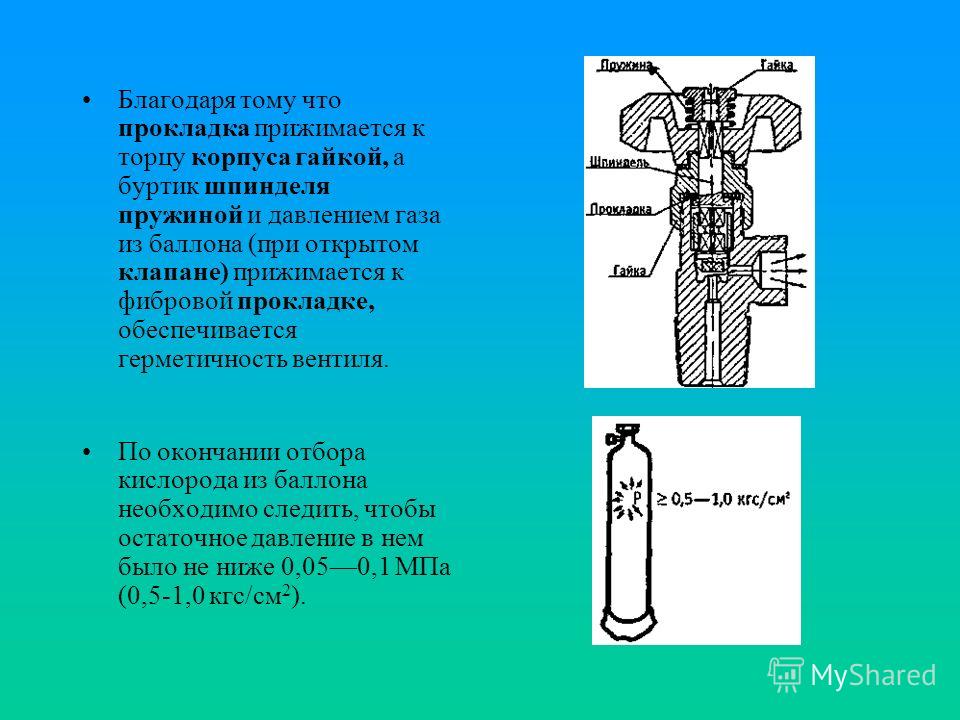 Характерными свойствами ацетилена являются реакции присоединения.
Характерными свойствами ацетилена являются реакции присоединения.
Преимущества ацетилена при газопламенной обработке металлов
Применение ацетилена для газопламенной обработки металлов испытывает сильную конкуренцию со стороны более доступных горючих газов (природный газ, пропан–бутан и тд.). Однако, преимущество ацетилена – в самой высокой температуре горения, которая достигает 3200 ° С. Именно поэтому газопламенная обработка ответственных узлов машиностроительных конструкций производится только с помощью ацетилена, который обеспечивает наивысшую производительность и качество процесса сварки.
Сравнительные характеристики пламени при сварке различным газами
| Газ | Температура пламени, °C |
| Ацетилен | 3000 – 3200 |
| МАФ | 2930 |
| Пропан | 2600-2750 |
| Водород | 2100-2500 |
| Метан | 2000-2200 |
Опыт 1. Получение ацетилена и его горение.
⇐ ПредыдущаяСтр 5 из 8Следующая ⇒
Реактивы и материалы: карбид кальция СаС2 (в кусочках). Оборудование: газоотводная трубка с оттянутым концом.
Работу с ацетиленом необходимо проводить в вытяжном шкафу, так как неочищенный ацетилен, полученный из карбида кальция, содержит вредные, неприятно пахнущие примеси.
В пробирку помещают маленький кусочек карбида кальция СаС2, добавляют 2 капли воды и закрывают пробирку пробкой с газоотводной трубкой, имеющей оттянутый конец. В пробирке бурно выделяется газообразный ацетилен.
Химизм процесса:
СаС2 + 2Н2О → НС≡СН + Са(ОН)2
Поджигают ацетилен у конца газоотводной трубки. Он горит светящимся, коптящим пламенем. Реакция взаимодействия карбида кальция с водой экзотермична.
Ацетилен, полученный из карбида кальция, содержит незначительные количества Nh4, РН3, АsН3 и других примесей и поэтому имеет характерный запах. Примеси можно удалить промыванием ацетилена водным раствором дихромата калия, подкисленного серной кислотой.
Опыт 2. Присоединение к ацетилену брома.
Реактивы и материалы: ацетилен; бромная вода, насыщенный раствор. Оборудование: газоотводная трубка.
Добавляют в пробирку с карбидом кальция (см. опыт 1) еще 2 капли воды и закрывают ее пробкой с газоотводной трубкой, коней которой опускают в пробирку с 5 каплями бромной воды. Бромная вода обесцвечивается вследствие присоединения атомов брома по месту тройной связи.
Химизм процесса:
НС≡СН + 2Вr2 → CHBr2–СНВr2
1,1,2,2-тетрабромэтан
Опыт 3. Отношение ацетилена к окислителям.
Реактивы и материалы: ацетилен; перманганат калия, 0,1 н. раствор. Оборудование: газоотводная трубка.
В пробирку помещают 1 каплю перманганата калия и 4 капли воды. В пробирку с кусочками карбида кальция добавляют еще 2 капли воды и закрывают пробкой с газоотводной трубкой, конец которой опускают в приготовленный раствор перманганата калия.
Розовый раствор быстро обесцвечивается: происходит окисление ацетилена по месту разрыва тройной связи с образованием промежуточного продукта окисления – щавелевой кислоты, которая окисляется дальше до диоксида углерода:
[O]
НС≡СН + 4[O] → HO – C – C – OH → 2CO2 + h3O
|| ||
O O
щавелевая кислота
Обесцвечивание бромной воды и раствора перманганата калия доказывает непредельность ацетилена.
Опыт 4. Образование ацетиленида серебра.
Реактивы и материалы: ацетилен; нитрат серебра, 0,2 н. раствор; аммиак, концентрированный раствор.
В пробирку вносят 2 капли раствора нитрата серебра и прибавляют 1 каплю раствора аммиака – образуется осадок гидроксида серебра. При добавлении 1-2 капель раствора аммиака осадок AgOH легко растворяется с образованием аммиачного раствора оксида серебра ([Ag(Nh4)2]OH).
Через аммиачный раствор оксида серебра пропускают ацетилен (см. опыт 1). В пробирке образуется светло-желтый осадок ацетиленида серебра, который затем становится серым.
Химизм процесса:
НС≡СН + 2[Ag(Nh4)2]ОН → AgС≡СAg↓ + 4Nh4+ 2Н2О
Опыт 5. Образование ацетиленида меди.
Реактивы и материалы: карбид кальция; хлорид меди CuCl2, аммиачный раствор. Оборудование: фильтровальная бумага (полоски размером 5*40 мм).
В сухую пробирку помещают 1-2 кусочка карбида кальция и добавляют 2 капли воды.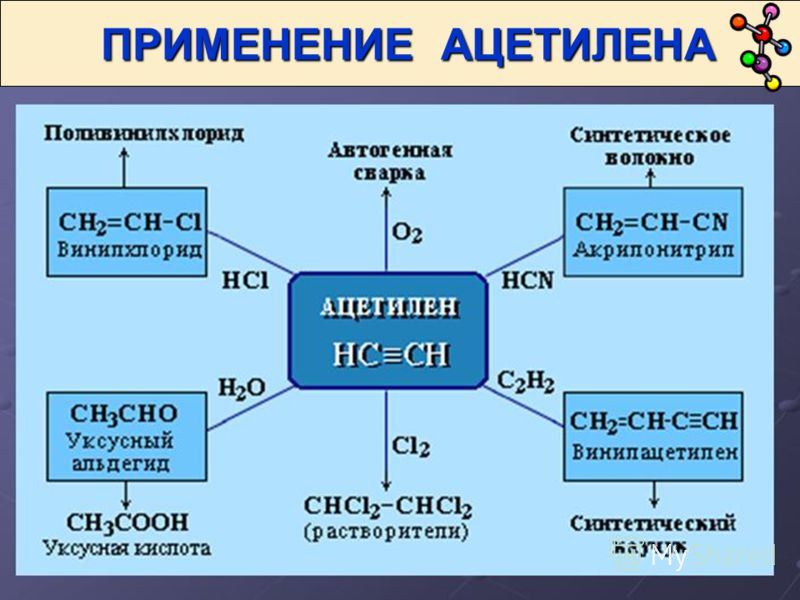 В отверстие пробирки вводят полоску фильтровальной бумаги, смоченной аммиачным раствором хлорида меди CuCl2, содержащим комплексный аммиакат состава [Cu(Nh4)2]C12. Появляется красно-бурое окрашивание вследствие образования ацетиленида меди.
В отверстие пробирки вводят полоску фильтровальной бумаги, смоченной аммиачным раствором хлорида меди CuCl2, содержащим комплексный аммиакат состава [Cu(Nh4)2]C12. Появляется красно-бурое окрашивание вследствие образования ацетиленида меди.
В водных растворах ацетилениды серебра и меди устойчивы. В сухом состоянии при нагревании или при ударе они взрываются с большой силой.
Химизм процесса:
НС≡СН + 2[Cu(Nh4)2]C1 → CuС≡СCu↓ + 2Nh5Cl + 2Nh4
Литература:
1. Аверина А.В., Снегирева А.Я. Лабораторный практикум по органической химии. М.: Высшая школа, 1980. – С. 31-33.
Лабораторная работа №5
Ароматические углеводороды.
Цель: экспериментальное получение и изучение свойств ароматических углеводородов.
⇐ Предыдущая5Следующая ⇒
Рекомендуемые страницы:
Gases — Densities
Densities, molecular weight and chemical formulas of some common gases can be found in the table below:
| Gas | Formula | Molecular weight | Density — ρ — | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (кг /м 3 ) | (LB /FT 3 ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
. 0042 2 0042 2 | 26 | 1.092 1) 1.170 2) | 0.0682 1) 0.0729 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Air | 29 | 1.205 1) 1.293 2) | 0.0752 1) 0.0806 2) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ammonia | NH 3 | 17.031 | 0.717 1) 0.769 2) | 0.0448 1) 0.0480 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Argon | Ar | 39.948 | 1.661 1) 1.7837 2) | 0.1037 1) 0.111353 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Benzene | C 6 H 6 | 78.11 | 3.486 | 0.20643 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Blast furnace gas | 1. 250 2) 250 2) | 0.0780 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Butane | C 4 H 10 | 58.1 | 2.489 1) 2.5 2) | 0.1554 1) 0.156 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Butylene (Butene) | C 4 H 8 | 56.11 | 2.504 | 0.148 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Carbon dioxide | CO 2 | 44.01 | 1.842 1) 1.977 2) | 0.1150 1) 0.1234 2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Carbon disulphide | 76.13 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Углеродной моноксид | CO | 28,01 | 1,165 1) 1,250 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) 2) | 2) 9005 1).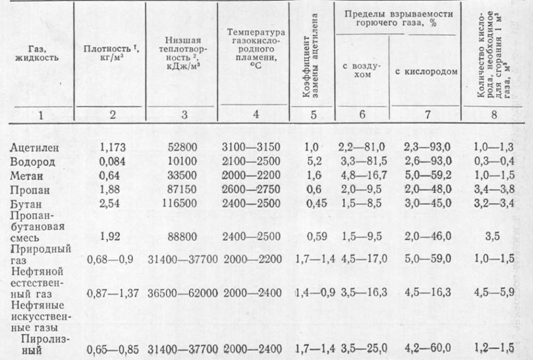 0.0727 1) | 0.0780 2) Carbureted Water Gas | 0.048 | Chlorine | Cl 2 | 70.906 | 2.994 1) | 0,1869 1) | Угольный газ | 0,58 2) | Кока -печь газ | кока.0038 0.034 2) | Combustion products | 1.11 2) | 0.069 2) | Cyclohexane | 84.16 | Digester Gas (Sewage or Biogas) | 0.062 | Ethane | C 2 H 6 | 30.07 | 1.264 1) | 0.0789 1) | Ethyl Alcohol | 46. |  07 07 Ethyl Chloride | 64.52 | Ethylene | C 2 H 4 | 28,03 | 1,260 2) | 0,0786 2) | Глия | HE | 4.02 | 0,1666666666666666666666666666666666666666666666666666666666666666669н0023 1) | 0.1785 2) 0.01039 1) | 0.011143 2) N-Heptane | 100.20 | Hexane | 86.17 | Hydrogen | H 2 | 2,016 | 0,0899 2) | 0,0056 2) | 9007 HYDORTHLORICICICICICICICICICICICICICICICICICICICICICICICICICICICICICICICICICIC | 2) | 89 2) | . |  36.47 | 1.63 2) | Hydrogen Chloride | HCl | 36.5 | 1.528 1) | 0.0954 1) | Hydrogen Sulfide | H 2 S | 34.076 | 1.434 1) | 0.0895 1) | Krypton | 3.74 2) | Methane | CH 4 | 16.043 | 0.668 1) | 0.717 2) 0.0417 1) | 0.0447 2) Methyl Alcohol | 32.04 | Methyl Butane | 72.15 | Methyl Chloride | 50.49 | Natural gas | 19. |  5 5 0.7 — 0.9 2) | 0.044 — 0.056 2) | Neon | Ne | 20.179 | 0.8999 2) | 0.056179 2) | Nitric oxide | NO | 30.0 | 1.249 1) | 0.0780 1) | Nitrogen | N 2 | 28.02 | 1.165 1) | 1.2506 2) 0.0727 1) | 0.078072 2) Nitrogen Dioxide | NO 2 | 46.006 | N-Octane | 114.22 | Nitrous Oxide | N 2 O | 44.013 | 0.114 1) | Nitrous Trioxide | NO 3 | 62. |  005 005 Oxygen | O 2 | 32 | 1.331 1) | 1.4290 2) 0.0831 1) | 0.089210 2) Ozone | O 3 | 48.0 | 2.14 2) | 0.125 | N-Pentane | 72.15 | Iso-Pentane | 72.15 | Propane | C 3 H 8 | 44.09 | 1,882 1) | 0,1175 1) | Пропен (пропилен) | Пропен (пропилен) | | Пропен (пропилен) | | .0042 3 H 6 | 42.1 | 1.748 1) | 0.1091 1) | R-11 | 137. |  37 37 R-12 | 120.92 | R-22 | 86.48 | R-114 | 170.93 | R-123 | 152.93 | R-134a | 102.03 | Sasol | 0.032 | Sulfur | S | 32.06 | 0.135 | Sulfur Dioxide | SO 2 | 64.06 | 2,279 1) | 2,926 2) 0,1703 1) 9003 0,1828 | 0,1703 1) | 0,1828 9003 1) | 0,1828 9003 1) 9003 0,1828 | 9003 9003 1) | 0,1703 1) | 0,1703 1). |  0023 2) 0023 2) Sulfur Trioxide | SO 3 | 80.062 | Sulfuric Oxide | SO | 48.063 | Toluene | C 7 H 8 | 92.141 | 4.111 | 0,2435 | Водяной пары, пара | H 2 O | H 2 O | H 2 O | H 2 O | H 2 O | H 2 O | H 2 O | H 2 O | H 2 O0039 | 18.016 | 0.804 | 0.048 | Water gas (bituminous) | 0.054 | Xenon | 5.86 2) | |
1) NTP — Нормальная температура и давление — определяется как 20 o C (293,15 K, 68 o F) и 1 атм (101,325 кН/м 2 , 101,325 кПа, 14,7 фунтов на кв. дюйм, абс. рт.ст., 760 торр)
дюйм, абс. рт.ст., 760 торр)
2) STP — Стандартная температура и давление — определяется как 0 O C (273,15 K, 32 O F) и 1 атм (101,325 кН/м 2 , 101,325 KPA, кН/м 2 , 101,325 K 14.7 psia, 0 psig, 30 in Hg, 760 torr)
- 1 lb m /ft 3 = 16.018 kg/m 3
- 1 kg/m 3 = 0.0624 lb м /ft 3
Обратите внимание, что даже если фунты на кубический фут часто используются в качестве меры плотности в США, фунты на самом деле являются мерой силы, а не массы. Слизняки — верная мера массы. Вы можете разделить фунты на кубический фут на 32.2 для приблизительного значения в слагах.
Ацетилен
Ацетилен — это горючий газ, обладающий многочисленными преимуществами при длительном использовании. Среди других заметных преимуществ ацетилен имеет самое низкое отношение кислорода к объему по сравнению с пропиленом и пропаном. Ацетилен обеспечивает самую высокую температуру пламени среди всех топливных газов и, как правило, более гибкий и простой в использовании при сварке и резке, чем альтернативные виды топлива.
Ацетилен обеспечивает самую высокую температуру пламени среди всех топливных газов и, как правило, более гибкий и простой в использовании при сварке и резке, чем альтернативные виды топлива.
Варианты поставки
Нерасфасованный ацетилен
Western International является ведущим поставщиком ацетилена высокой чистоты. Нерасфасованный ацетилен — это безопасное и экологически чистое решение для ваших важных потребностей в резке и сварке, а также для производства химического сырья. Покупатели оптовых поставок ацетилена получают многочисленные преимущества, в том числе повышение эффективности труда и снижение трудозатрат , связанных с обработкой и заменой баллонов. Наши специализированные трейлеры увеличенной вместимости перевозят более 100 000 кубических футов ацетилена, что позволяет нам доставлять от 250 000 до 100 миллионов кубических футов ацетилена каждый месяц.
Наполнение прицепов осуществляется на весах, сертифицированных государством. В качестве дополнительного удобства полностью автоматизированная система Western использует удаленный онлайн-мониторинг для повышения удобства клиентов. Западные клиенты получают повышенную производительность, удобство и ценность, покупая ацетилен оптом и в упаковках Micro Bulk Packs.
В качестве дополнительного удобства полностью автоматизированная система Western использует удаленный онлайн-мониторинг для повышения удобства клиентов. Западные клиенты получают повышенную производительность, удобство и ценность, покупая ацетилен оптом и в упаковках Micro Bulk Packs.
Ацетиленовые микроупаковки
- Готовые к поддонам микроупаковки
являются удобным и экономичным источником
высокочистого ацетилена для резки, сварки и многого другого.
Western’s Micro Bulk Pack предлагает покупателям
преимущества ацетилена в больших количествах в удобной для транспортировки,
удобной для хранения и простой в использовании предварительно упакованной системе.
- Увеличенная вместимость
Каждая упаковка содержит примерно 4500 футов 3 ацетилена. Они могут непрерывно подавать 300 футов 3 ацетилена в час, обеспечивая повышенную производительность для приложений, которые исторически требовали использования других топливных газов.
- Сокращение трудозатрат
Каждую упаковку можно перемещать вилочным погрузчиком или подъемной проушиной. Клиентам больше не нужно «прикатывать» цилиндры к месту их применения. Используя Micro Bulk Packs, клиенты смогли сократить трудозатраты и обращение с баллонами на 80%. - Простота транспортировки
Каждую упаковку можно перевозить на стандартном прицепе для баллонов, что снижает расходы на доставку. - Простота использования
Поскольку цилиндры находятся в коллекторе, у пользователей есть только одно соединение, которое нужно «закрутить и разобрать». - Безопасность
Эти баллоны полностью одобрены DOT и соответствуют всем требованиям безопасности и правилам CGA.
Нажмите здесь, чтобы получить дополнительную информацию о Micro Bulk
Баллоны с ацетиленом
Баллоны с газом Western наполняет крупных компаний и дистрибьюторов сварочной промышленности, предоставляя экономичное решение по ацетилену, которое позволяет клиентам сосредоточиться на продажах и обслуживании.
| Примечания: |
| – Стандартная резьба 3/4″-14 NGT, за исключением MC и B, которые имеют резьбу для клапана 3/8″. |
| – Все модели, кроме MC и B, оснащены защитным колпачком клапана. |
| – Вес тары включает корпус, наполнитель, растворитель, краску, насыщающий газ, клапан и плавкие заглушки. Не включает вес крышки 2 фунта (0,91 кг) |
| – Емкость баллона указана для технически чистого ацетилена при давлении 250 фунтов на кв. дюйм (17,24 бар) и температуре 70 градусов F (21 градус C). |
Данные о доставке ацетилена
| Химический символ C 2 H 2 СИНОНСКИЕ Наименование Ацетилен, растворенный Классификация DOT 2.1 (легковоспламеняющийся газ) Этикетка DOT ЛЕГКОВОСПЛАМЕНЯЮЩИЙСЯ ГАЗ | TC Отгрузочное наименование Ацетилен, растворенный TC Classification 2. 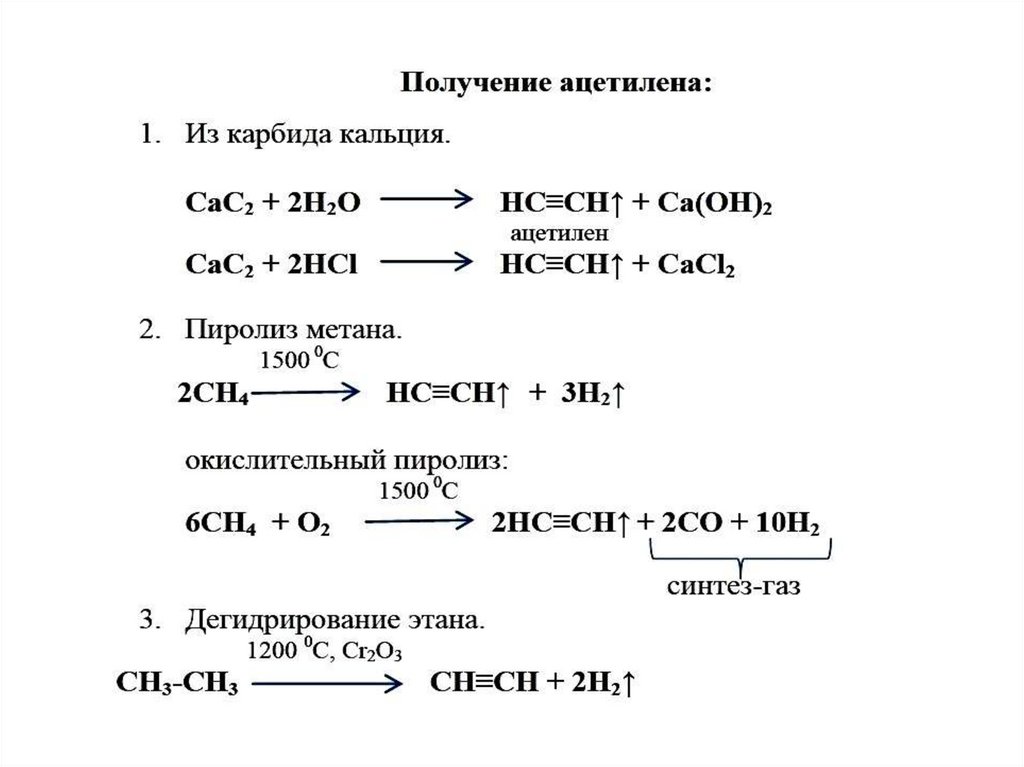 1 1 TC Label FLAMMABLE GAS UN Number UN 1001 |
Physical Properties
| US Units | SI Units | |||||||||
| Химическая формула | C 2 H 2 | C 2 H 2 | ||||||||
| Молекулярный вес0039 | 26,04 | |||||||||
| Давление паров при 70 ° F (21,1 ° C) | 635 фунтов на квадратный дюйм | 4378 кПа | ||||||||
| Плотность газа при 32 ° F (0 ° C) | ||||||||||
| . /ft 3 | 1.1716 kg/m 3 | |||||||||
| Specific gravity of the gas at 32°F and 1 atm (air=1) | 0.906 | 0.906 | ||||||||
| Specific volume of the газ a при 70°F (21,1°C) и 1 атм | 14. 7 ft 3 /lb 7 ft 3 /lb | 0.918 m 3 /kg | ||||||||
| Specific gravity of the liquid at -112°F (-80.0°C) | 0.613 | 0.613 | ||||||||
| Density of Жидкость при 70 ° F (21,1 ° C) | 24,0 фунт/фут 3 | 384 кг/м 3 | ||||||||
| Точка кипячения в 10 фунтов B (69 KPA) | 9003. 40038 9003. F | -75,2°C | ||||||||
| Температура плавления при 10 фунт/кв. дюйм изб. b (69 kPa) | -116°F | -82.2° | ||||||||
| Critical temperature | 96.8°F | 36.0°C | ||||||||
| Critical pressure | 907 psia | 6254 kPa, abs | ||||||||
| Критическая плотность | 14,4 фунт/фут 3 | 231 кг/м 3 | ||||||||
| Тройная точка | -116 ° F. 7.7, 7.7, | . | ||||||||
| Скрытая теплота парообразования в тройной точке | 264 BTU/LB | 614 кДж/кг | ||||||||
| Скрытая теплоте слияния при -114,7 ° F (-81,5 ° C) | 41,56 BTU/LB | 96,677 41,56 BTU/LB | 96,67.679.56.56/LB | 96,67.679.56.56/LB | 96,67.679.56.56.56. | 96,67.679. 51,56 BTU/LB | 96,677.56.56.56. | 900.677.56.56.56. | 41,56 млрд. газ при 60°F (15,6°C) и 1 атм | |
| C v | 0,304 БТЕ/(фунт)(°F) | 1,27 кДж/(кг)(°C) | ||||||||
| Ratio of specific heats | 1.26 | 1.26 | ||||||||
| Solubility in water vol/vol at 60°F (15.6°C) | 1.1 | 1.1 | ||||||||
| Specific volume of the gas at 60°F (15,6°C) и 1 атм | 14,5 фута 3 /фунт | 0,905 м 3 /кг | ||||||||
| 1,7 | 1,7 |
a На основе 1,171 г/л при 32°F (0°C) и 1 атм.

