Содержание
Виды ингибирования
35
Ферменты
2
Регуляция
действия ферментовМедицинские
аспекты энзимологии
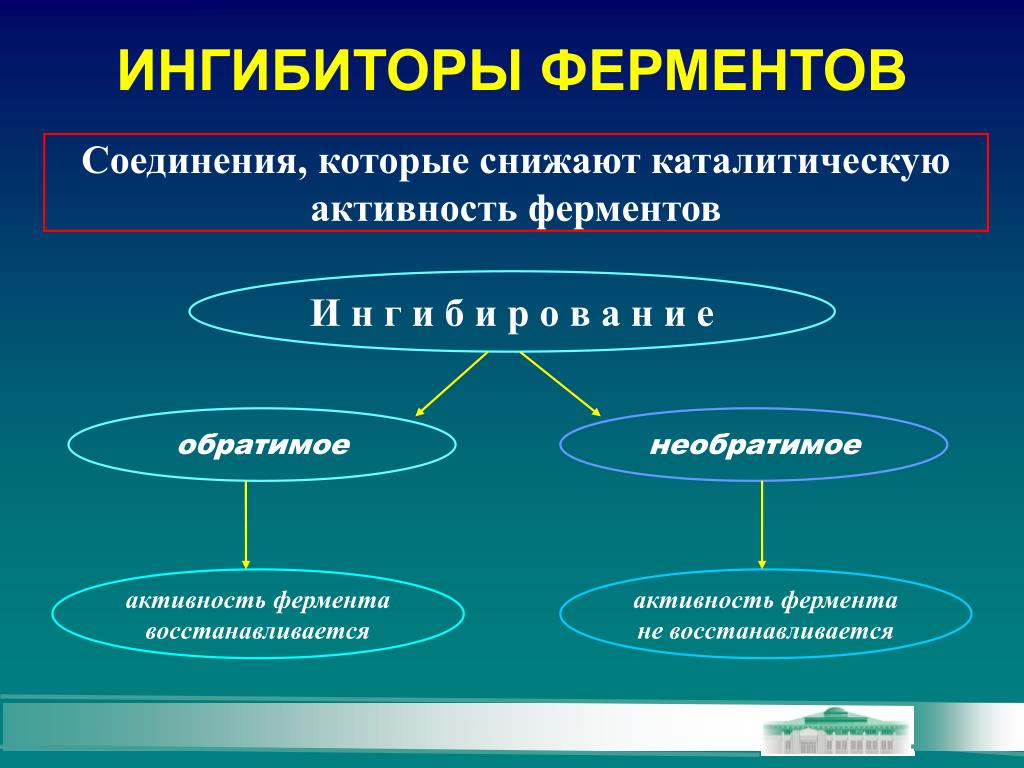
Ингибирование
– это
торможение активности фермента. При
этом денатурации ферментов не происходит.
Ингибитор
—
вещество, вызывающее специфичное
снижение активности
фермента. Неорганические кислоты и
тяжелые металлы ингибиторами не являются,
а являются инактиваторами,
так как снижают активность любых
ферментов, т.е. действуют неспецифично.Так
же денатурирующие агенты к ингибитррам
не относят.
Ингибиторы:
ионы
или небольшие молекулы, составляющие
часть ферментативной регуляторной
системы, а так же фармакологические
препараты.
1. Обратимое 2. Необратимое
А.
КОНКУРЕНТНОЕ
А. СПЕЦИФИЧЕСКОЕ
Б.
НЕКОНКУРЕНТНОЕ
Б. НЕСПЕЦИФИЧЕСКОЕ
Обратимое
ингибирование.
Большинство ингибиторов действуют
обратимо, образуя нековалентные
связи с ферментом,
и при определенных условиях диссоциируют
с восстановлением активности фермента.
Конкурентное
ингибирование. Ингибитор
похож на субстрат фермента
по своей структуре и соперничает с
субстратом за активный центр (садится
на активный центр фермента),
что приводит к уменьшению связывания
субстрата с ферментом и нарушению
катализа. В этом состоит особенность
конкурентного ингибирования – возможность
усилить или ослабить ингибирование
через изменение концентрации субстрата.
Для
конкурентного типа ингибирования
справедливы следующие уравнения:
Е
+ S ⇔
ES → E + P,
E
+ I ⇔
EI.
1.
Конкурентное взаимодействие этанола
и метанола
за активный
центр алкогольдегидрогеназы.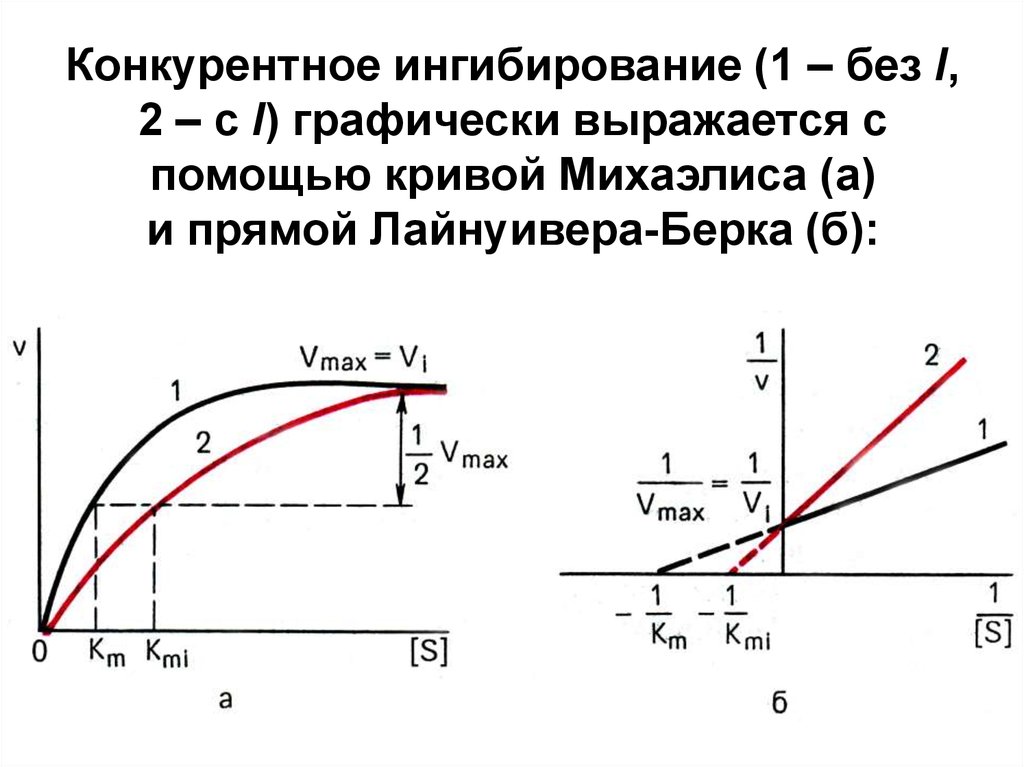
2.
Ингибирование сукцинатдегидрогеназы
малоновой кислотой,
структура которой схожа со структурой
субстрата этого фермента – янтарной
кислоты (сукцината).
Сукцинат
+ ФАД ———— Фумарат + ФАДН2
3.Также
к конкурентным ингибиторам относят
антиметаболиты или псевдосубстраты,
например, антибактериальные средства
сульфаниламиды,
схожие по структуре с п-аминобензойной
кислотой, компонентом фолиевой кислоты.
При лечении сульфаниламидами в
бактериальной клетке конкурентно
нарушается использование п-аминобензойной
кислоты для синтеза фолиевой
кислоты,
что и вызывает лечебный эффект.
Сходство строения сульфаниламидов и парааминобензойной кислоты, компонента витамина в9
Влияние
различных концентраций субстрата на
скорость реакции, катализируемой
ферментами 1 и 2(в
присутствии ингибитора):
а) гиперболическая зависимость V
от [S],
б) прямая зависимость в обратных
координатах 1/V
от 1/[S]
— Лайнуивера-Бэрка.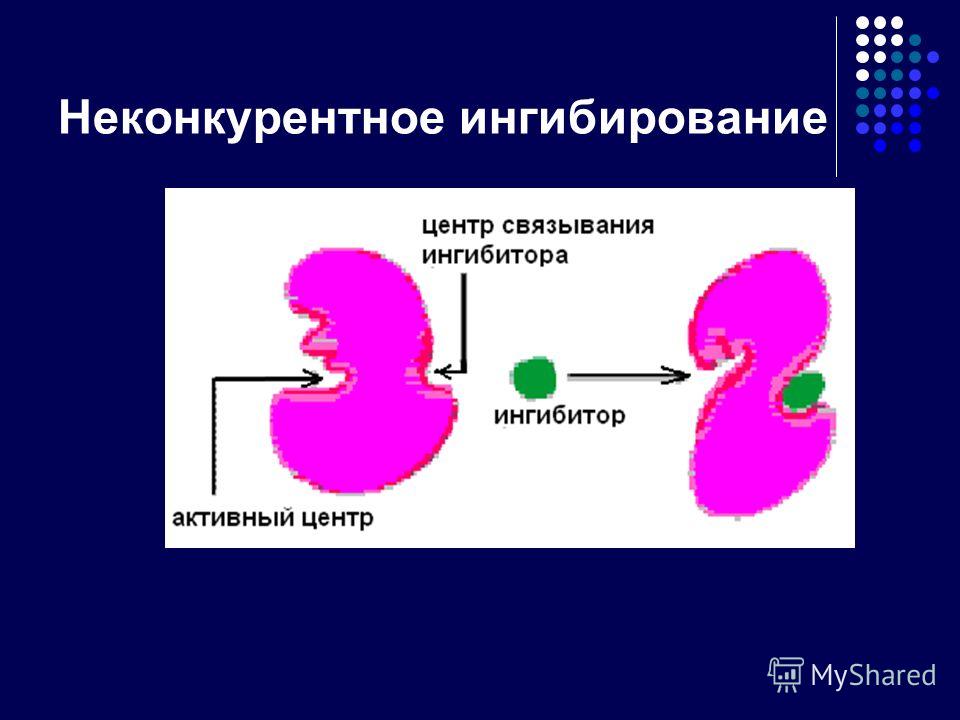
Конкурентные
ингибиторы уменьшают скорость химической
реакции.
Конкурентный ингибитор повышает Кm
для данного субстрата (уменьшает сродство
субстрата к ферменту). Это означает, что
в присутствии конкурентного ингибитора
необходима
большая концентрация субстрата
для достижения 1/2 Vmax.
Увеличение соотношения концентрации
субстрата и ингибитора снижает степень
ингибирования. При
значительно более высоких концентрациях
субстрата ингибирование полностью
исчезает,
потому что активные центры всех молекул
фермента будут находиться преимущественно
в комплексе с субстратом.
Неконкурентное
ингибирование. Ингибитор
не
имеет
структурного сходства с субстратом иприсоединеняется
не в активном центре,
а в другом месте молекулы, одновременно
с субстратом. Образуется тройной
комплекс: субстрат — фермент — ингибитор.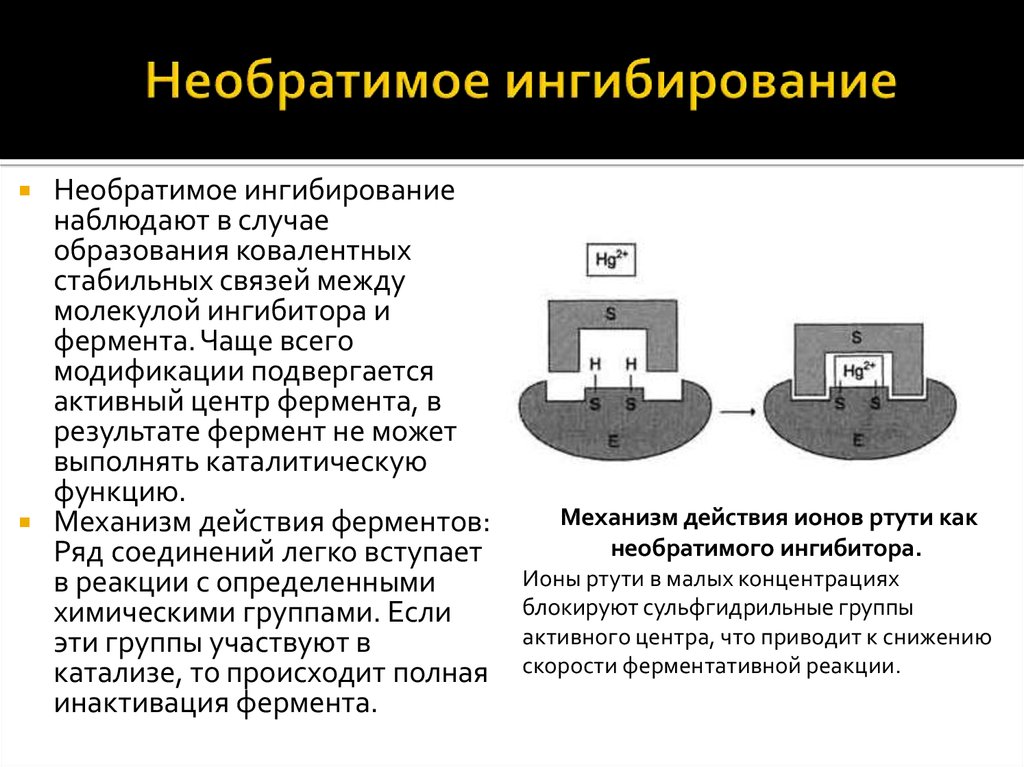
Это ведет к деформации активного центра
и каталитической активности. Например,
синильная
кислота (цианиды)
связывается с гемовым железом ферментов
дыхательной цепи и блокирует клеточное
дыхание.
Кинетическая
зависимость неконкурентного ингибирования:
характеризуется снижением Vmax
ферментативной реакции и уменьшением
сродства субстрата к ферменту, т.е.
увеличением Кm.
Неконкурентное
ингибирование в двойных обратных
координатах при различных концентрациях
ингибитора (1 — [I]=0; 2 — [I]>0; 3 — [I]>[I]2).
При
неконкурентном ингибировании константа
Михаэлиса не изменяется, а максимальная
скорость реакции уменьшается в (1 +
[I]/Ki)
раз. Поэтому в двойных обратных координатах
семейство прямых, отвечающих разным
концентрациям ингибитора, пересекается
в одной точке на оси абсцисс.Необратимое
ингибирование наблюдают в случае
образования ковалентных стабильных
связей между молекулой ингибитора и
фермента.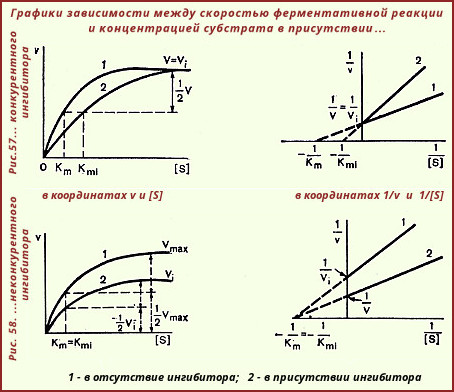 Чаще всего модификации
Чаще всего модификации
подвергается активный центр фермента,
В результате фермент не может выполнять
каталитическую функцию.
К
необратимым ингибиторам относят ионы
тяжёлых металлов, например ртути (Hg2+),
серебра (Ag+)
и мышьяка (As3+),
которые в малых концентрациях блокируют
сульфгидрильные группы активного
центра. Субстрат при этом не может
подвергаться химическому превращению
(рис. 2-26). При наличии реактиваторов
ферментативная функция восстанавливается.
В больших концентрациях ионы тяжёлых
металлов вызывают денатурацию белковой
молекулы фермента, т.е. приводят к полной
инактивации фермента.
— ингибирование — Биохимия
В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме.
Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно.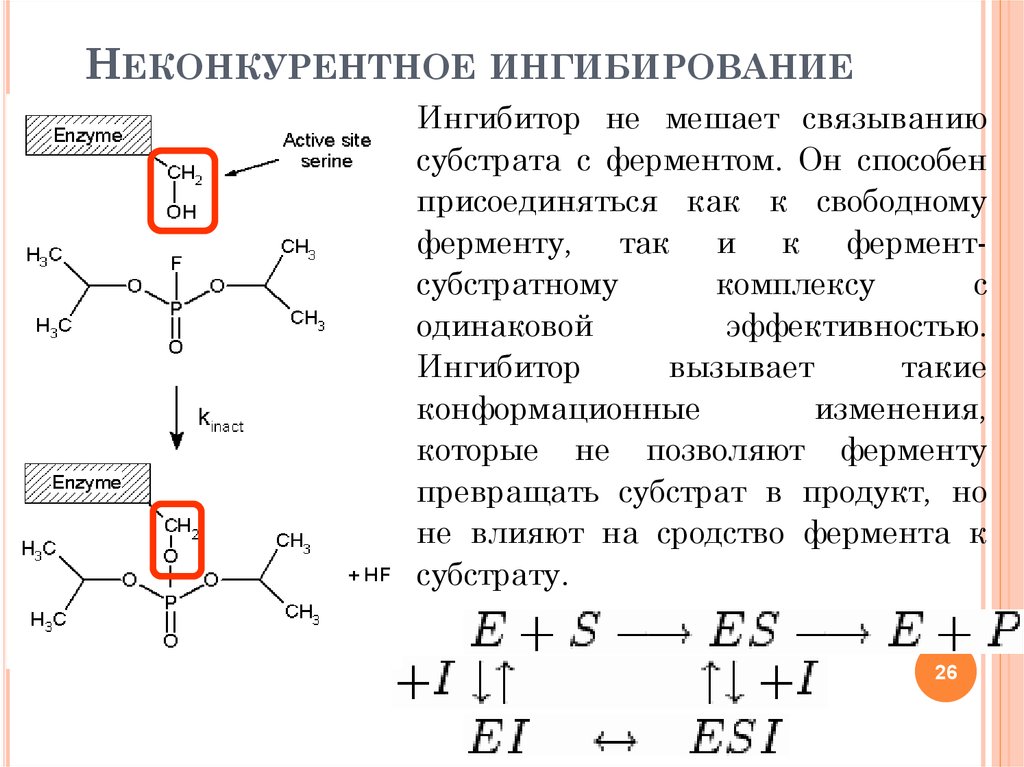 Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично.
Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность многих ферментов, т.е. действуют неспецифично.
В научной деятельности для более точного описания процессов ингибирования пользуются кинетикой Михаэлиса-Ментен и ее терминами — максимальная скорость (Vmax) и константа Михаэлиса (Km).
Можно выделить два основных направления ингибирования
- по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым.
- по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное.
Необратимое ингибирование
При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.
Например, вещество диизопропилфторфосфат прочно и необратимо связывается с гидроксигруппой серина в активном центре фермента ацетилхолинэстеразы, гидролизующей ацетилхолин в нервных синапсах. Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Ингибирование этого фермента предотвращает распад ацетилхолина в синаптической щели, в результате чего медиатор продолжает оказывать воздействие на свои рецепторы, что бесконтрольно усиливает холинергическую регуляцию.
Аналогично диизопропилфторфосфат ингибирует химотрипсин и другие протеазы, имеющие в активном центре серин (сериновые протеазы).
Диизопропилфторфосфат относится к нервно-паралитическим ядам, аналогичным образом действуют боевые фосфоорганические вещества (зарин, зоман). Сюда же относится вещество «малатион», включенный в инсектициды (карбофос, дихлофос) и превращающийся в организме насекомых в ингибитор ацетилхолинэстеразы, а в организме животных и человека разрушающийся до безвредных продуктов.
Механизм необратимого ингибирования ацетилхолинэстеразы
Еще один пример связан с ингибированием ацетилсалициловой кислотой (аспирином) ключевого фермента синтеза простагландинов – циклооксигеназы. Эта кислота входит в состав противовоспалительных средств и используется при воспалительных заболеваниях и лихорадочных состояниях.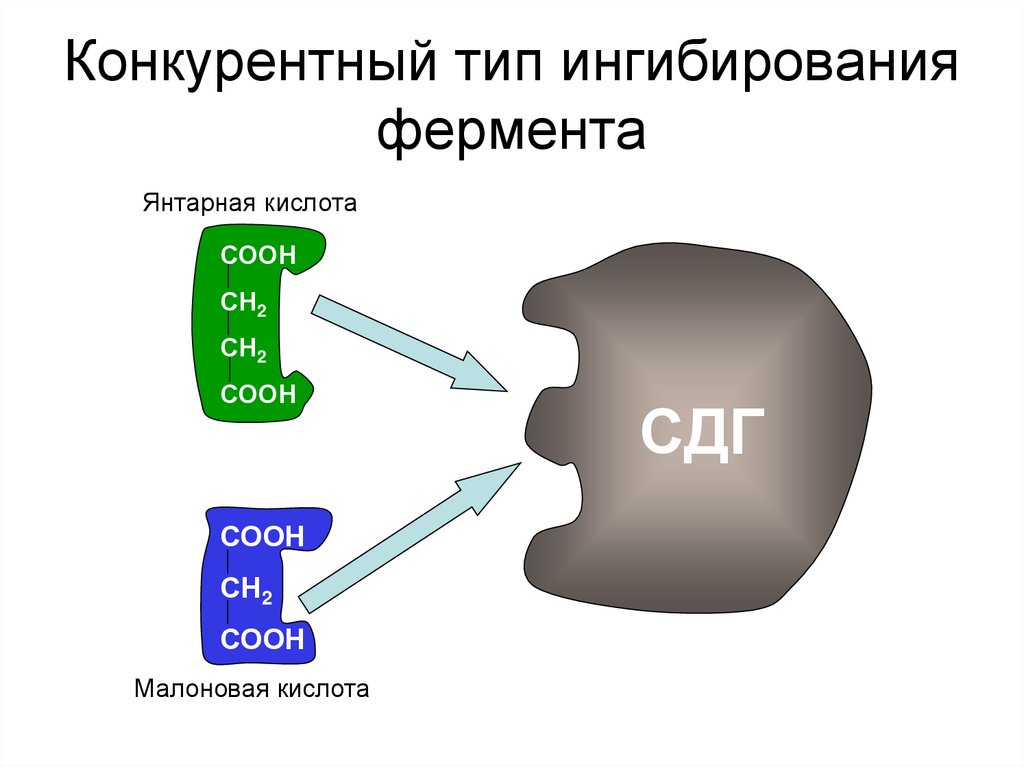 Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
Присоединение ацетильной группы к гидроксильной группе серина в активном центре фермента вызывает инактивацию последнего и прекращение синтеза простагландинов.
Механизм необратимого ингибирования циклооксигеназы
Третьим показательным примером необратимого ингибирования является влияние антибиотика пенициллина на фермент транспептидазу, сшивающую цепи пептидогликана как последний шаг в синтезе клеточной стенки бактерий.
Обратимое ингибирование
При обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.
Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.
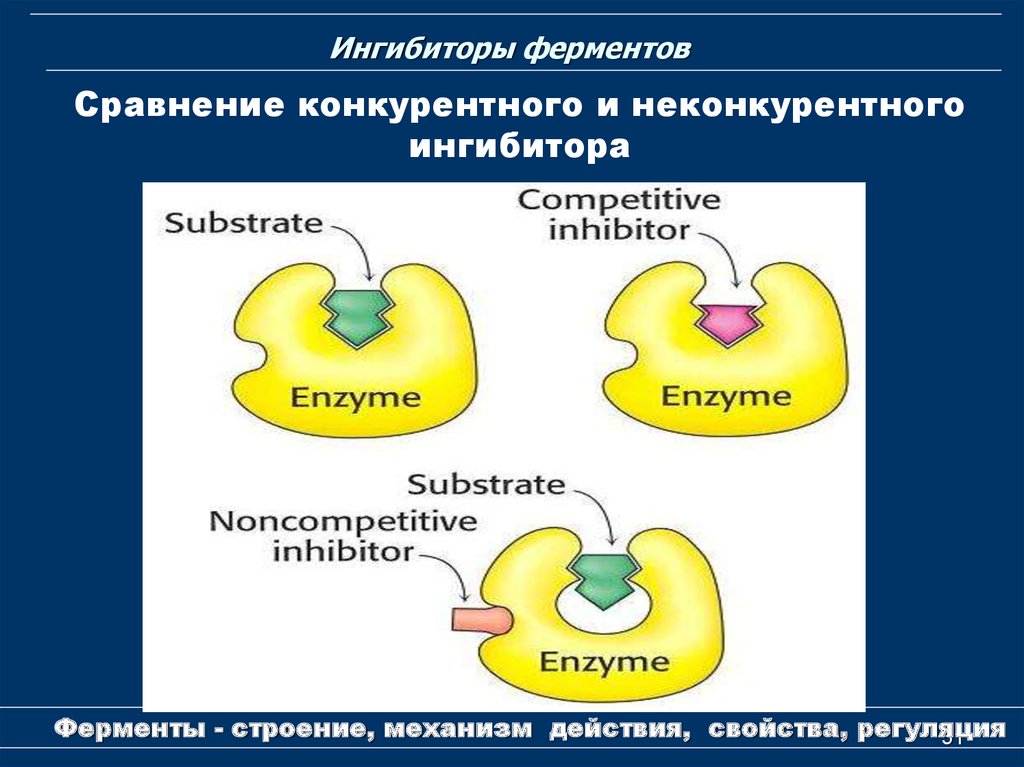
Конкурентное ингибирование
При таком виде ингибирования ингибитор по своей структуре похож на субстрат фермента. Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Поэтому он соперничает с субстратом за активный центр (за контактный участок), что приводит к уменьшению связывания субстрата с ферментом и нарушению катализа. В этом состоит особенность конкурентного ингибирования – возможность усилить или ослабить ингибирование через изменение концентрации субстрата. При данном ингибировании максимальная скорость реакции остается вполне достижимой при создании высоких концентраций субстрата.
Например:
1. Ингибирование фермента цикла трикарбоновых кислот сукцинат-дегидрогеназы малоновой кислотой, структура которой схожа со структурой субстрата этого фермента – янтарной кислоты (сукцината).
Конкурентное ингибирование сукцинатдегидрогеназы
2. Также к конкурентным ингибиторам относят антиметаболиты или псевдосубстраты, например, антибактериальные средства сульфаниламиды, схожие по структуре с пара-аминобензойной кислотой, компонентом фолиевой кислоты. При лечении сульфаниламидами в бактериальной клетке возникает конкуренция между сульфаниламидом и пара-аминобензойной кислотой при синтезе дигидрофолиевой кислоты, что и вызывает лечебный эффект.
3. В качестве других примеров лекарственных конкурентных ингибиторов можно привести
- ингибитор синтеза холестерина ловастатин, обратимо ингибирующий ГМГ-S-КоА-редуктазу,
- противоопухолевый препарат метотрексат, необратимо подавляющий дигидрофолатредуктазу,
- непрямой антикоагулянт дикумарол, конкурент витамина К,
- антигипертензивный препарат метил-ДОФА, подавляющий активность ДОФА-декарбоксилазы,
- средство для лечения подагры аллопуринол, ингибирующий ксантиноксидазу.
Примером конкуренции, но не ингибирования (!), является взаимодействие этанола и метанола за активный центр алкогольдегидрогеназы. В данном случае ингибирование, как таковое, отсутствует, но с активным центром фермента связывается тот спирт, концентрация которого больше. Данный эффект используют у пациентов с отравлением метанолом для которого этиловый спирт является антидотом.
Неконкурентное ингибирование
Данный вид ингибирования связан с присоединением ингибитора не в активном центре, а в другом месте молекулы. Но при этом меняется структура активного центра и связь с субстратом становится невозможной. Это может быть аллостерическое ингибирование, когда активность фермента снижается естественными модуляторами, или связывание с ферментом каких-либо веществ вне активного и аллостерического центра. Например:
- синильная кислота (цианиды) связывается с гемовым железом ферментов дыхательной цепи и блокирует клеточное дыхание,
- связывание ионов тяжелых металлов (Cu2+, Hg2+, Ag+) с SH-группами белков.
Также примером может служить фруктозо-1,6-дифосфат, который ингибируя аденилосукцинатсинтетазу (синтез пуриновых нуклеотидов), синхронизирует в мышце функционирование пуриннуклеотидного цикла и гликолиза, поставлющего энергию для мышечного сокращения.
Особенностью неконкурентного ингибитора является его способность связываться с ферментом независимо от субстрата, т.е. изменение концентрации субстрата никак не влияет на образование комплекса фермент-ингибитор.
Бесконкурентное ингибирование
В этом случае ингибитор связывается в активном центре с фермент-субстратным комплексом. Повышение концентрации субстрата, увеличивая количество фермент-субстратного комплекса, усиливает и связывание ингибитора с ним. Таким образом, бесконкурентное ингибирование более сложно, чем другие типы ингибирования.
В качестве примера бесконкурентного ингибирования обычно называют связывание пенициллина и фермента транспептидазы, обеспечивающей сшивку цепей пептидогликана при синтезе клеточной стенки бактерий.
Пенициллин встраивается в активный центр фермента и его лактамное кольцо мимикрирует под переходное состояние фермента — фермент-субстрат. Хотя ситуация похожа на конкурентное ингибирование, из-за одновременного снижения Vmax и Km этот случай относят к бесконкурентному.
Хотя ситуация похожа на конкурентное ингибирование, из-за одновременного снижения Vmax и Km этот случай относят к бесконкурентному.
На примере пенициллина также рассматривается т.н. суицидное ингибирование. При нем субстрат первоначально связывается с ферментом обратимо, а затем образует устойчивое ковалентное соединение с активным центром, что приводит к ингибированию активности фермента.
Смешанное ингибирование
При таком ингибировании ингибитор способен присоединяться везде – не только в активном центре, но и в других частях молекулы. Но после этого фермент еще способен частично сохранять свою активность. Примером является влияние мертиолата (ртутьорганическое вещество) на сахаразу грибов микромицетов для подавления их роста.
Ингибирование ферментов — Типы ингибирования — Аллостерическая регуляция
звездочка
звезда
звезда
звезда
Star_half
на основе 56 рейтингов
Оригинальный автор (S): Josh Turiccki
Последнее обновление: 19 сентября 2022 г.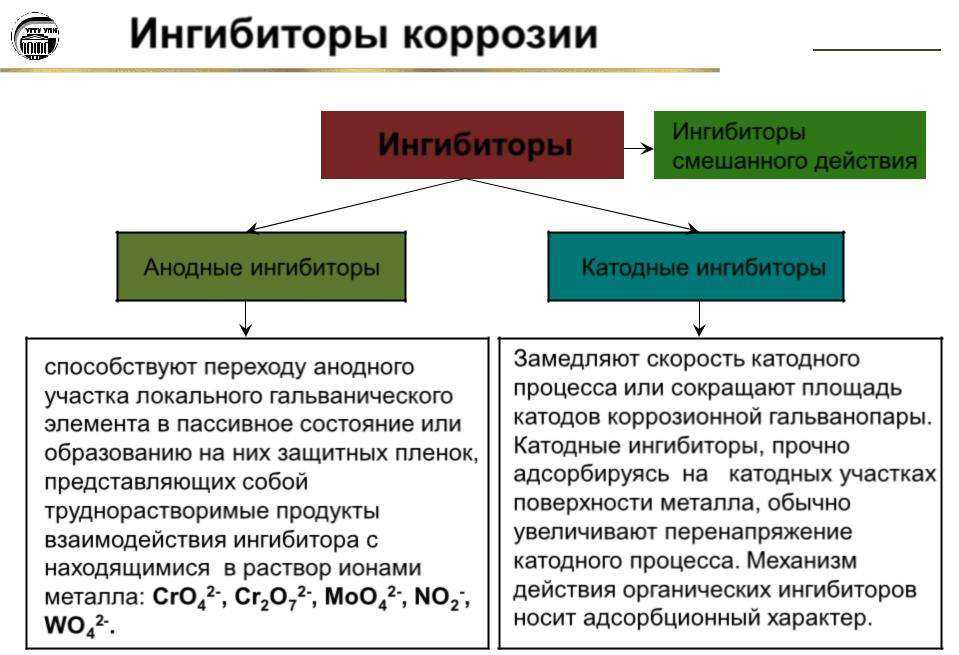
Ревизии: 18
. Последнее обновление: 19 сентября 2022 г.
Редакции: 18
format_list_bulleted Содержание
добавить
remove
- 1 Types of Inhibition
- 1.1 Competitive Inhibitors
- 1.2 Non-Competitive Inhibitors
- 2 Allosteric Inhibition
- 3 Phosphorylation
- 4 Zymogens
- 5 Clinical Relevance – Pharmacokinetics
Enzymes are required для большинства, если не для всех процессов, необходимых для жизни. Ферменты катализируют реакцию уменьшает энергию активации , необходимую для протекания реакции. Тем не менее, ферменты должны строго регулироваться, чтобы уровни продукта не повышались до нежелательных уровней. Это достигается ингибированием ферментов.
Типы ингибирования
Обратимые и необратимые ингибиторы представляют собой химические вещества, которые связываются с ферментом для подавления его активности. Один из способов добиться этого — практически постоянно связываться с ферментом. Такие ингибиторы называются необратимыми. Однако другие химические вещества могут временно связываться с ферментом. Их называют реверсивный. Обратимые ингибиторы связываются либо с активным участком (конкурентные ингибиторы), либо с другим участком фермента (неконкурентные ингибиторы).
Один из способов добиться этого — практически постоянно связываться с ферментом. Такие ингибиторы называются необратимыми. Однако другие химические вещества могут временно связываться с ферментом. Их называют реверсивный. Обратимые ингибиторы связываются либо с активным участком (конкурентные ингибиторы), либо с другим участком фермента (неконкурентные ингибиторы).
Калифорния16 (собственная работа) [CC BY-SA 4.0 (https://creativecommons.org/licenses/by-sa/4.0)], через Wikimedia Commons
Рис. — конкурентные ингибиторы ферментов.
Конкурентные ингибиторы
Конкурентные ингибиторы конкурируют с субстратом в активном центре и, следовательно, увеличивают км (постоянная Михаэлиса-Ментен). Однако Vmax не изменяется, поскольку при достаточной концентрации субстрата реакция все еще может завершиться. График зависимости активности фермента от концентрации субстрата будет смещен вправо из-за увеличения Km, в то время как график Лайнуивера-Берка будет более крутым по сравнению с отсутствием ингибитора.
Неконкурентные ингибиторы
Неконкурентные ингибиторы связываются с другим местом на ферменте и, таким образом, уменьшают В МАКС . Однако K M неизменен. Это демонстрируется более низким максимумом на графике активности фермента в зависимости от концентрации субстрата и более высоким значением точки пересечения y на графике Лайнуивера-Берка по сравнению с отсутствием ингибитора.
| Конкуренты | Неконкурентный | |
| Где действует? | Активный сайт | Альтернативный сайт |
| Изменение км | Увеличение | Без изменений |
| Изменение Vmax | Без изменений | Уменьшение |
По CNX OpenStax [CC BY 4.0 (http://creativecommons.org/licenses/by/4. 0)], через Wikimedia Commons
0)], через Wikimedia Commons
Рис. 2. Диаграмма, показывающая влияние ингибиторов ферментов на скорость реакции и как она зависит от концентрации субстрата.
Аллостерическое ингибирование
Аллостерические ферменты имеют сигмоидальную кривую , в отличие от гиперболической кривой, отображаемой ферментами Михаэлиса-Ментен. Это связано с тем, что большинство аллостерических ферментов содержат несколько субъединиц, которые могут влиять друг на друга, когда субстрат связывается с ферментом. Ингибирование может влиять либо на K 0,5, , что является концентрацией субстрата для половинного насыщения, либо на Vmax, либо на то и другое. Это приводит к смещению кривой вправо, а в случае уменьшения Vmax смещает кривую вниз.
Аллостерические ферменты имеют два состояния: состояние с низким сродством, называемое состоянием «Т», и состояние с высоким сродством «R». Ингибиторы работают, предпочтительно связываясь с состоянием Т аллостерического фермента, заставляя фермент поддерживать это состояние с низким сродством.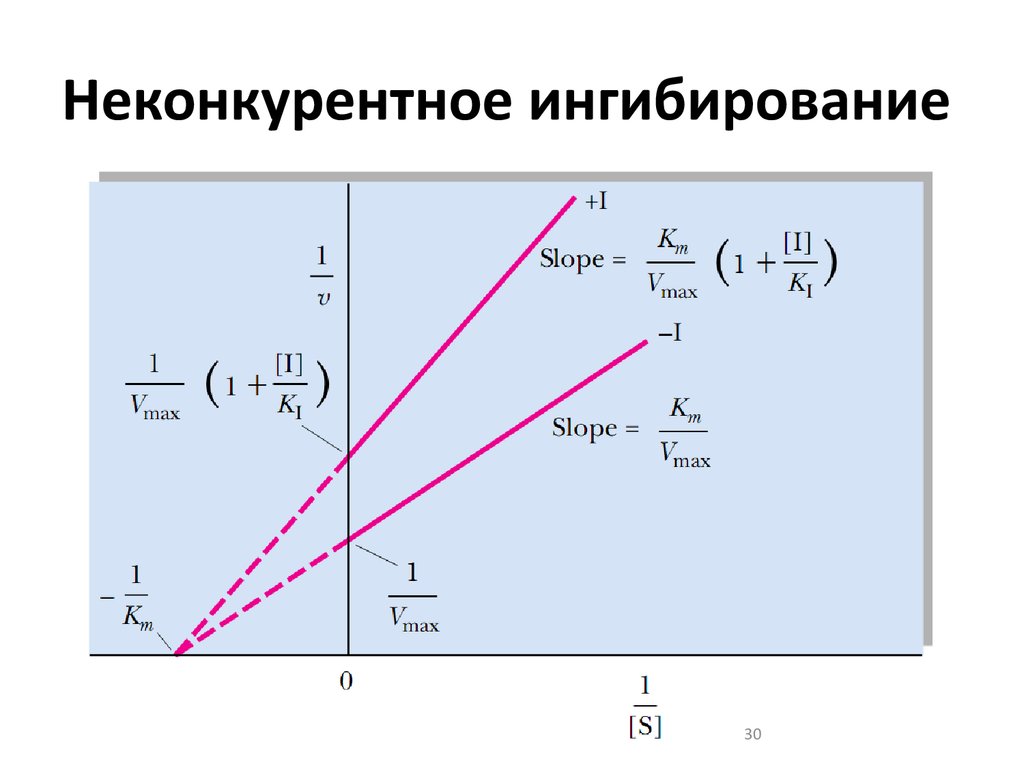
Это чрезвычайно полезно для ограничения количества продукта фермента, так как продукт затем может ингибировать тот же тип фермента, чтобы количество продукта не было чрезмерным. Это известно как подавление обратной связи . Например, АТФ аллостерически ингибирует пируваткиназу, чтобы предотвратить повышенное образование пирувата, поэтому в конечном итоге образуется меньше АТФ. Кроме того, фосфофруктокиназа аллостерически ингибируется цитратом, промежуточным продуктом цикла Кребса. Это означает, что гликолиз будет ограничен при высоком образовании АТФ в цикле Кребса.
Автор CNX OpenStax [CC BY 4.0 (http://creativecommons.org/licenses/by/4.0)], через Wikimedia Commons
Рис. 3 — Схема, показывающая механизм как аллостерического ингибирования, так и активации.
Фосфорилирование
Фосфорилирование обеспечивает еще один механизм ингибирования ферментов. Обычно это происходит под действием киназных ферментов, которые могут либо ингибировать, либо активировать фермент в зависимости от ситуации .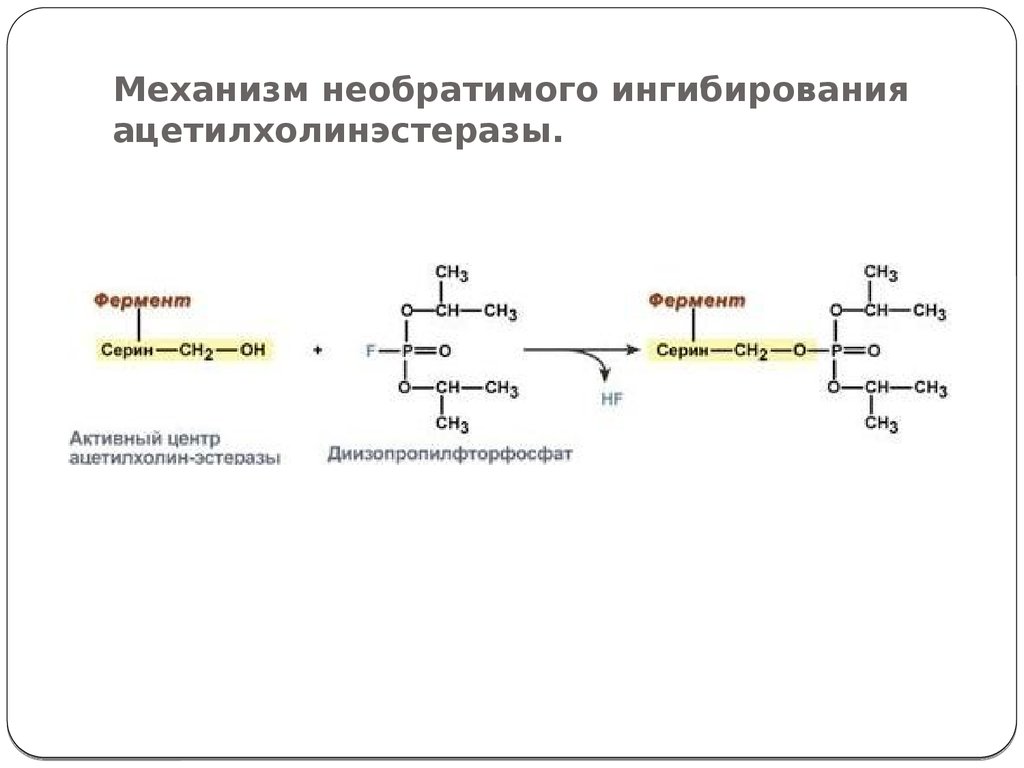 Ферменты киназы отщепляют фосфатную группу от АТФ и связывают ее с ферментом. В ситуациях, когда это приводит к увеличению активности фермента, создается реакция каскада , позволяющая генерировать сильный ответ на небольшой стимул.
Ферменты киназы отщепляют фосфатную группу от АТФ и связывают ее с ферментом. В ситуациях, когда это приводит к увеличению активности фермента, создается реакция каскада , позволяющая генерировать сильный ответ на небольшой стимул.
Зимогены
Ферменты также могут секретироваться в неактивном состоянии, известном как зимогены. Зимогены представляют собой полезный механизм, позволяющий безопасно транспортировать ферменты в разные места, при этом фермент не становится активным и не выполняет свою функцию по пути. Они остаются неактивными из-за добавления аминокислот в белок. Следовательно, чтобы активировать зимоген, другой фермент должен отщепить эти дополнительные аминокислоты. Например, химотрипсиноген синтезируется поджелудочной железой, но инактивируется и не может функционировать. По пути в кишечник другой фермент (трипсин) отщепляет дополнительные аминокислоты с образованием активированной формы, химотрипсина.
Автор Kristie.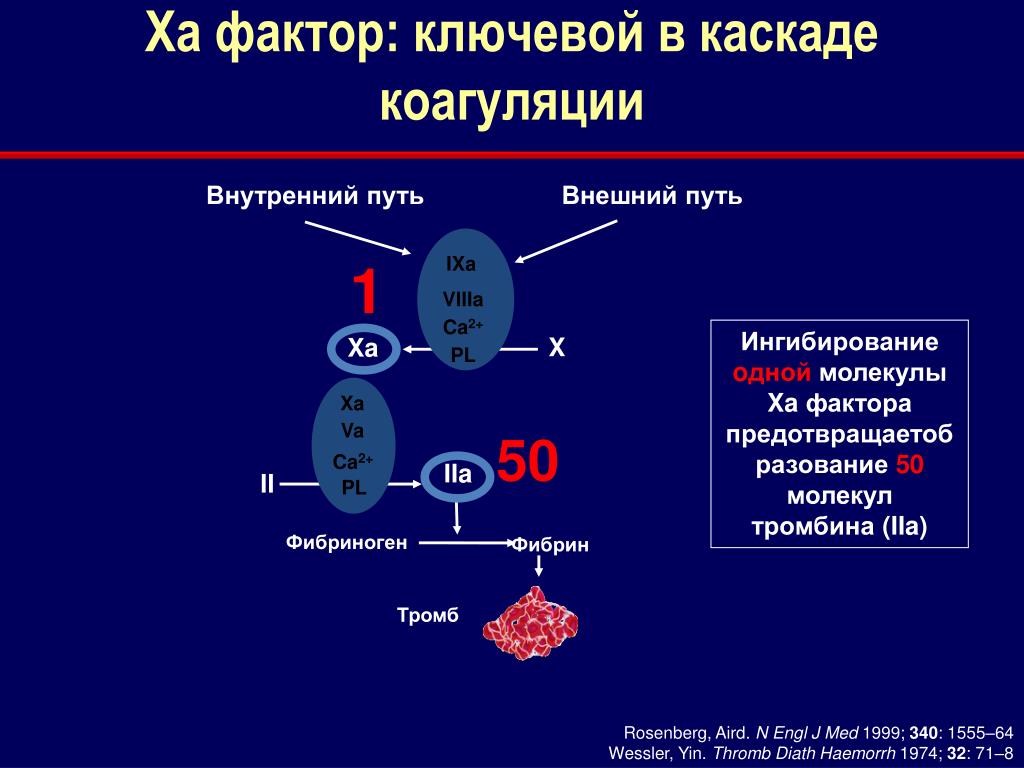 leong (собственная работа) [CC BY 3.0 (http://creativecommons.org/licenses/by/3.0)], через Wikimedia Commons
leong (собственная работа) [CC BY 3.0 (http://creativecommons.org/licenses/by/3.0)], через Wikimedia Commons
Рис. 4. Диаграмма, показывающая активацию химотрипсиногена в желудочно-кишечном тракте и ферменты, участвующие в каждой стадии.
Клиническая значимость – фармакокинетика
Наиболее важным клиническим применением ингибирования ферментов является использование фармацевтических препаратов. Ингибиторы АПФ являются распространенным средством лечения гипертонии. Ангиотензин I превращается в ангиотензин II под действием ангиотензинпревращающего фермента (АПФ). Однако ангиотензин II вызывает многочисленные эффекты, приводящие к повышению артериального давления. Таким образом, ингибиторы АПФ предназначены для конкурентного ингибирования действия АПФ, что приводит к меньшему образованию ангиотензина II и снижению артериального давления.
В качестве альтернативы пенициллин необратимо связывается с активным центром фермента, называемого DD-транспептидазой.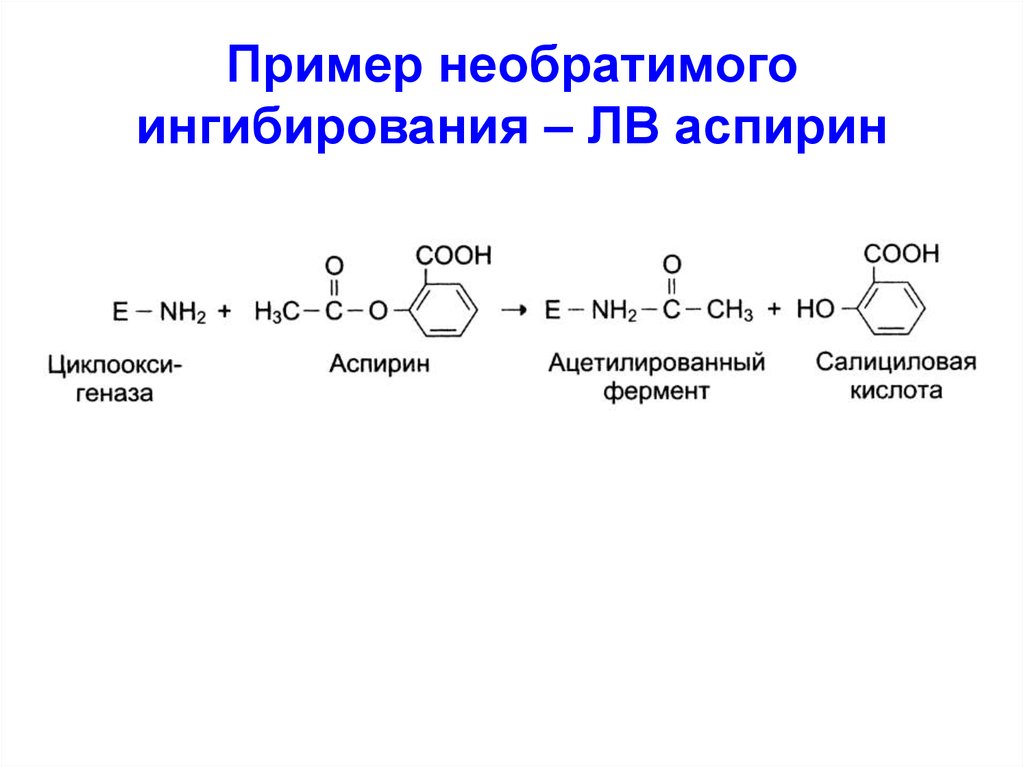 DD-транспептидаза отвечает за заключительный этап синтеза клеточной стенки бактерий. Ингибируя этот фермент, бактерии не могут синтезировать клеточную стенку и, следовательно, не могут поддерживать жизнь.
DD-транспептидаза отвечает за заключительный этап синтеза клеточной стенки бактерий. Ингибируя этот фермент, бактерии не могут синтезировать клеточную стенку и, следовательно, не могут поддерживать жизнь.
Цианид является примером неконкурентного ингибитора . Цианид связывается с последним ферментом в цепи переноса электронов и не позволяет этому ферменту катализировать реакцию перехода кислорода в воду. Это предотвращает поток электронов вниз по электрон-транспортной цепи, и АТФ не может генерироваться, что приводит к смерти.
распечатать Распечатать эту статью
Типы ингибирования — биохимия
Все ресурсы по биохимии
6 Диагностические тесты
289 практических тестов
Вопрос дня
Карточки
Learn by Concept
← Предыдущая 1 2 3 4 5 Следующая →
Биохимия Помощь »
Кинетика ферментов и ингибирование »
Типы ингибирования
Аналоги переходного состояния обычно используются в качестве ингибиторов ферментов какого типа?
Possible Answers:
Noncompetitive inhibitors
Competitive inhibitors
Allosteric effectors
Positive feedback effectors
Mixed inhibitors
Correct answer:
Competitive inhibitors
Пояснение:
Ферменты связываются с переходными состояниями и стабилизируют их.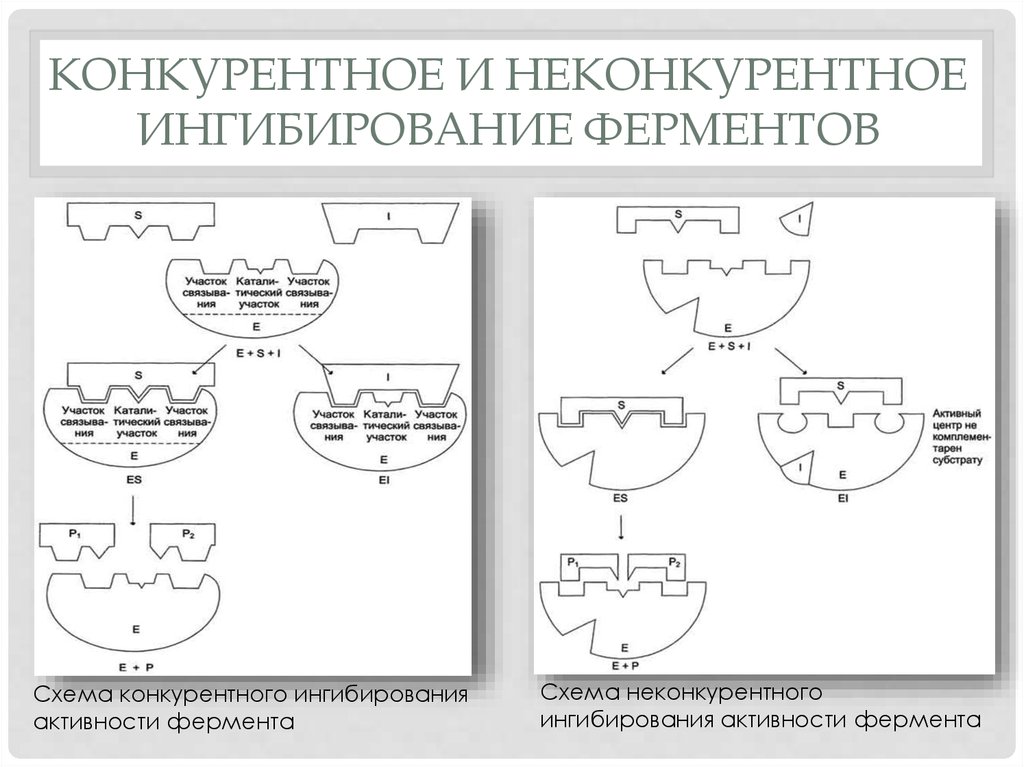 Таким образом, молекула, которая напоминает переходное состояние реакции, сможет очень легко связываться с ферментом для этой реакции и конкурировать со связыванием фактического переходного состояния. Поэтому аналоги переходного состояния являются конкурентными ингибиторами.
Таким образом, молекула, которая напоминает переходное состояние реакции, сможет очень легко связываться с ферментом для этой реакции и конкурировать со связыванием фактического переходного состояния. Поэтому аналоги переходного состояния являются конкурентными ингибиторами.
Сообщить об ошибке
CTP ингибирует CTPase, фермент, который катализирует первую реакцию на пути синтеза CTP. Что это за пример?
Возможные ответы:
Ингибирование обратной связи
Положительная обратная связь
Ингибирование зимогена
Отрицательная кооперативность
Правильный ответ:
Объяснение:
При ингибировании по принципу обратной связи вещества в конце реакции (в данном случае CTP, продукт) ингибируют предыдущую реакцию (в данном случае CTPase-реакцию). Это сообщает CTPase, что присутствует значительное количество CTP, и ей следует прекратить участие в реакции.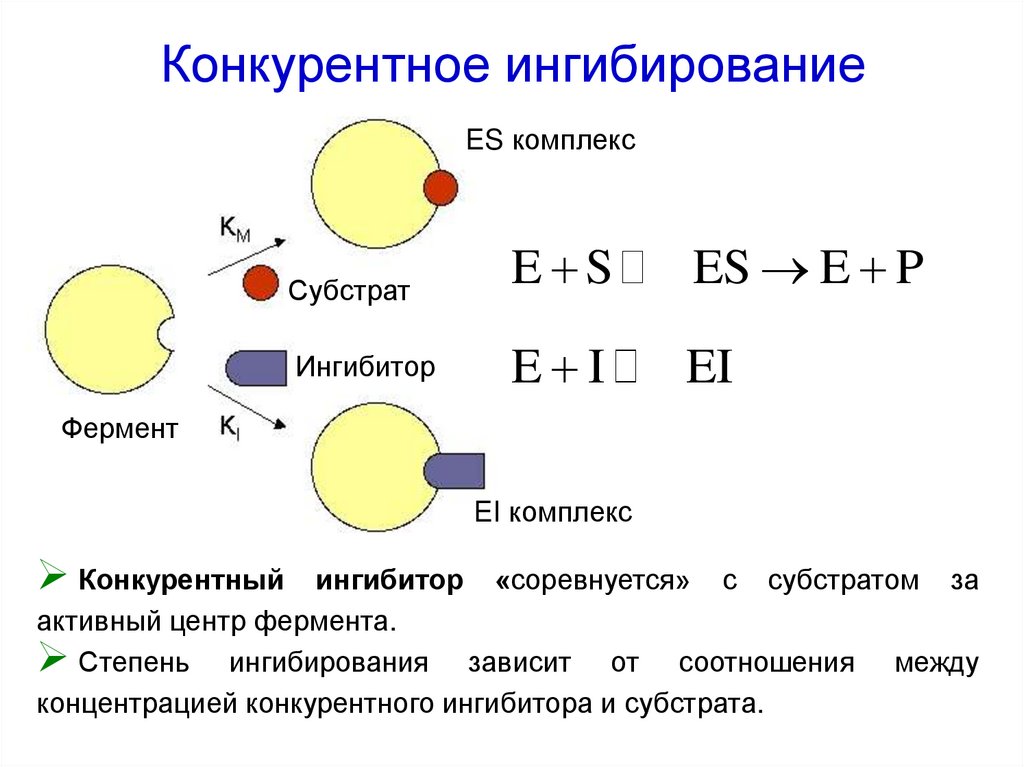 Наоборот, когда продукт метаболизма способствует дальнейшему синтезу этого продукта, это называется положительной обратной связью. Зимогены являются неактивными предшественниками ферментов, например пепсиноген и ангиотензиноген. Кооперативность относится к изменениям сродства связывания фермента с несколькими сайтами связывания с его лигандами. Например, гемоглобин имеет четыре домена, связывающих кислород; когда один кислород связан, это облегчает связывание второго, третьего и четвертого кислорода. Отрицательная кооперативность противоположна этому.
Наоборот, когда продукт метаболизма способствует дальнейшему синтезу этого продукта, это называется положительной обратной связью. Зимогены являются неактивными предшественниками ферментов, например пепсиноген и ангиотензиноген. Кооперативность относится к изменениям сродства связывания фермента с несколькими сайтами связывания с его лигандами. Например, гемоглобин имеет четыре домена, связывающих кислород; когда один кислород связан, это облегчает связывание второго, третьего и четвертого кислорода. Отрицательная кооперативность противоположна этому.
Сообщить об ошибке
Исследователь анализирует молекулу. При добавлении этой молекулы к ферментативной реакции он замечает, что реакция замедляется. Однако он способен вернуть реакцию к нормальной скорости после добавления большего количества субстратов. Какой вывод вы можете сделать об этой молекуле?
I. Является конкурентным ингибитором
II. Уменьшается
III.
Возможные ответы:
Только III
I и III
I и II
Только I
Правильный ответ:
Только I
Пояснение:
Рассматриваемая молекула классифицируется как ингибитор фермента, поскольку она ингибирует ферментативную реакцию. Есть два типа ингибиторов; конкурентные и неконкурентные ингибиторы. Конкурентные ингибиторы связываются с активным центром фермента и предотвращают связывание субстрата. Однако их можно диссоциировать добавлением большего количества субстратов. Это происходит потому, что субстраты могут диссоциировать обратимые связи между ингибитором и ферментом и связываться с активными центрами. Конкурентные ингибиторы увеличивают (или уменьшают сродство фермента и субстрата), но не изменяют его. По информации, приведенной в вопросе, можно сделать вывод, что молекула является конкурентным ингибитором.
Есть два типа ингибиторов; конкурентные и неконкурентные ингибиторы. Конкурентные ингибиторы связываются с активным центром фермента и предотвращают связывание субстрата. Однако их можно диссоциировать добавлением большего количества субстратов. Это происходит потому, что субстраты могут диссоциировать обратимые связи между ингибитором и ферментом и связываться с активными центрами. Конкурентные ингибиторы увеличивают (или уменьшают сродство фермента и субстрата), но не изменяют его. По информации, приведенной в вопросе, можно сделать вывод, что молекула является конкурентным ингибитором.
Неконкурентные ингибиторы необратимо связываются с аллостерическим центром фермента и предотвращают связывание субстрата с активным центром. Эти типы ингибиторов снижают максимальную скорость реакции, но не изменяют ее.
Сообщить об ошибке
Конкурентные ингибиторы связываются с ферментом посредством __________ связей, а неконкурентные ингибиторы связываются с ферментом посредством __________ связей.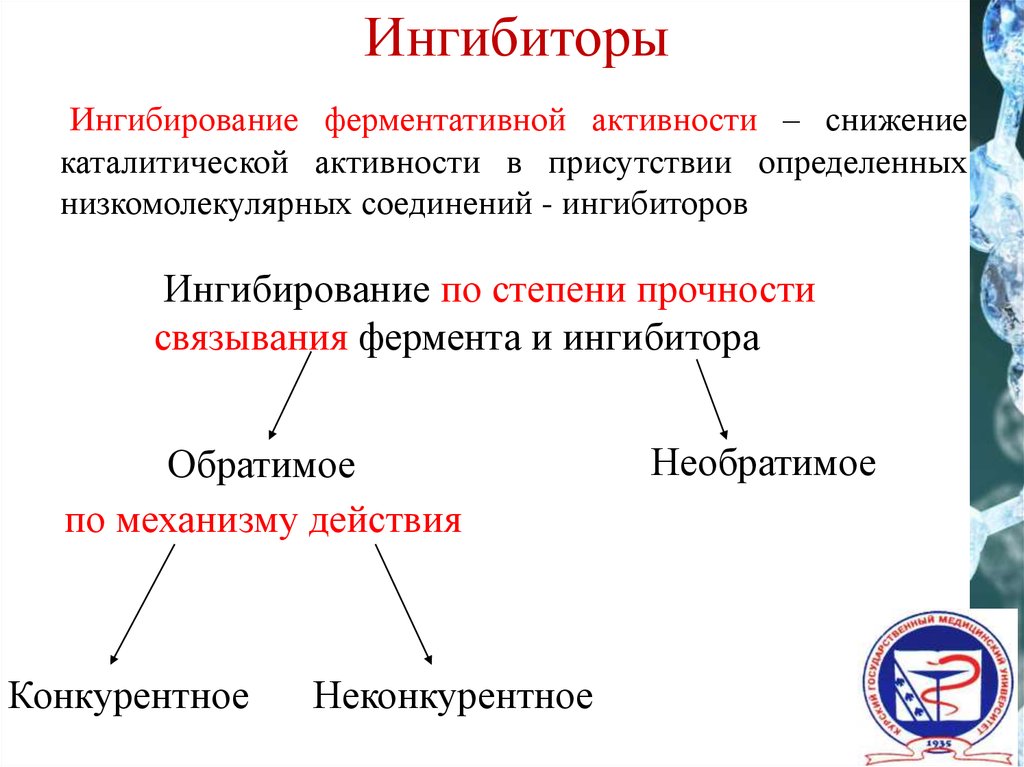
Возможные ответы:
реверсивный . . . реверсивный
реверсивный . . . необратимый
необратимый . . . обратимый
необратимый . . . необратимый
Правильный ответ:
обратимый . . . необратимый
Объяснение:
Конкурентные ингибиторы связываются с активным центром фермента посредством слабых межмолекулярных связей (таких как водородные связи и гидрофобные взаимодействия), которые легко разрушаются. Это означает, что увеличение концентрации субстрата приведет к разрыву слабых связей между конкурентным ингибитором и ферментом и, следовательно, к открытию активного центра для субстратов. Вот почему конкурентное ингибирование можно преодолеть, добавляя больше субстратов.
Неконкурентные ингибиторы, с другой стороны, связываются с аллостерическим сайтом посредством сильных ковалентных связей. После связывания неконкурентные ингибиторы изменяют форму активного центра, тем самым затрудняя связывание субстратов с ферментом. Увеличение концентрации субстрата не разрушает прочные необратимые связи между неконкурентным ингибитором и аллостерическим сайтом фермента.
После связывания неконкурентные ингибиторы изменяют форму активного центра, тем самым затрудняя связывание субстратов с ферментом. Увеличение концентрации субстрата не разрушает прочные необратимые связи между неконкурентным ингибитором и аллостерическим сайтом фермента.
Сообщить об ошибке
Сопоставьте тип запрета с соответствующим изменением в или .
Возможные ответы:
Неконкурентное ингибирование; снижение
Ингибирование конкуренции; снижение
Ингибирование конкуренции; снижение
Неконкурентное ингибирование; без изменений
Ингибирование смешанного типа; увеличение
Правильный ответ:
Неконкурентное ингибирование; уменьшение
Объяснение:
Неконкурентное ингибирование относится к ингибитору, который связывается с комплексом фермент-субстрат. Это ограничивает количество комплексов фермент-субстрат, которые могут быть превращены в продукты, и поэтому уменьшается.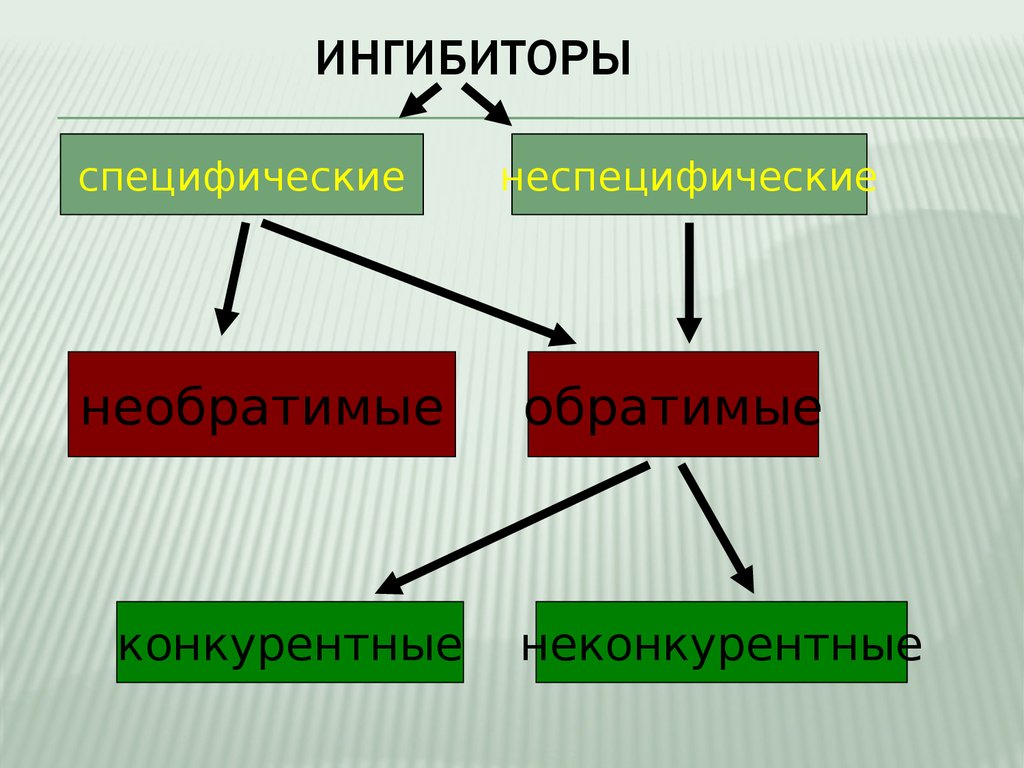 Это также снижает Km, потому что кажущееся сродство увеличивается из-за неспособности комплексов фермент-субстрат становиться несвязанными.
Это также снижает Km, потому что кажущееся сродство увеличивается из-за неспособности комплексов фермент-субстрат становиться несвязанными.
Сообщить об ошибке
Основываясь на приведенном ниже графике лайнвивер-берк, какой тип торможения имеет место?
Возможные ответы:
Конкурентное ингибирование
Смешанное ингибирование
Неправильное ингибирование
Неконкурентное ингибирование
Правильный ответ:
Правильный ответ:
Правильный ответ:
Правильный ответ:
. Правильный ответ:
.
Объяснение:
В этом вопросе нам показан график берка линейного ткача. Один из наклонов представляет кинетический профиль фермента без ингибитора, а другой наклон изображает фермент с ингибитором.
Один из наклонов представляет кинетический профиль фермента без ингибитора, а другой наклон изображает фермент с ингибитором.
Глядя на график, мы замечаем, что две линии параллельны друг другу. Это означает, что точка пересечения по оси Y меняется так же сильно, как и точка пересечения по оси X. Это очень ценная подсказка, потому что она позволяет нам понять, что скорость реакции уменьшается так же, как и эта реакция.
Поскольку мы знаем, что обе эти величины уменьшаются, нам нужно определить, какой тип торможения имеет эту характеристику. При конкурентном торможении увеличивается, а остается неизменным. Таким образом, на этом графе не может быть конкурентного ингибирования.
Кроме того, это также не может быть неконкурентным ингибированием. И, соответственно, это не может быть смешанное торможение, которое является лишь частным случаем неконкурентного торможения. При обеих этих формах торможения действительно снижается. Однако значение может увеличиваться, уменьшаться или оставаться прежним (при смешанном торможении). Значение не изменится на величину, равную изменению .
Значение не изменится на величину, равную изменению .
Единственный оставшийся вариант — неконкурентное ингибирование. Действительно, при этом типе торможения и оба уменьшаются в одинаковой степени.
Сообщить об ошибке
Рассмотрим данный график Лайнуивера-Берка, показывающий ингибирование фермента.
Основываясь на этом графике, какое из следующих утверждений является верным?
Возможные ответы:
Ингибитор является конкурентным ингибитором
Ингибитор необратимо связывается с ферментом
Ингибитор с одинаковым сродством связывается с ферментом и комплексом фермент-субстрат к активному центру фермента
Ингибитор связывается с ферментом только после того, как субстрат уже связался с ферментом
Правильный ответ:
Ингибитор связывается с ферментом и комплексом фермент-субстрат с одинаковым сродством
Объяснение:
В этом вопросе нам представлен график Лайнуивера-Берка.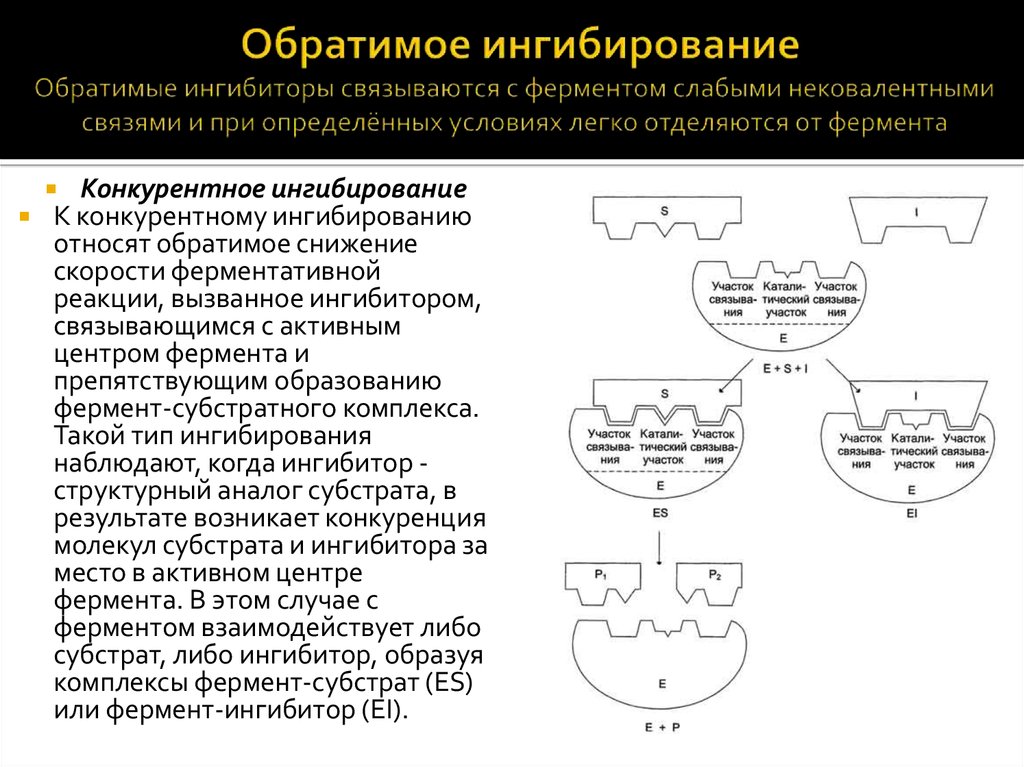 На графике показаны параметры данного фермента как в присутствии, так и в отсутствие ингибитора. Нас просят определить истинное утверждение.
На графике показаны параметры данного фермента как в присутствии, так и в отсутствие ингибитора. Нас просят определить истинное утверждение.
Для начала нам нужно понять несколько важных моментов, касающихся ингибирования ферментов. Во-первых, важно разделить торможение на его различные типы. В категории обратимого ингибирования ингибитор может определенным образом связываться с ферментом, и это будет влиять на график Лайнуивера-Берка.
При конкурентном ингибировании ингибитор связывается только с активным центром фермента. В результате субстрат не может связываться. В этом случае значение реакции не изменится, а возрастет. В сюжете, показанном в основе вопроса, это не так.
При неконкурентном ингибировании ингибитор связывается с аллостерическим участком фермента только после связывания субстрата. Другими словами, как только субстрат присоединится к активному центру фермента, ингибитор свяжется. Поскольку ингибитор может связываться только с ферментно-субстратным комплексом, как скорость, так и реакция будут пропорционально уменьшаться. В таком случае на графике будут две линии, параллельные друг другу. Это не так в сюжете, данном нам в основе вопроса.
В таком случае на графике будут две линии, параллельные друг другу. Это не так в сюжете, данном нам в основе вопроса.
При смешанном ингибировании ингибитор способен связываться как с активным центром фермента, так и с аллостерическим центром фермента. Из-за этого скорость реакции всегда будет снижаться, но скорость реакции может либо уменьшаться, либо увеличиваться в зависимости от того, имеет ли ингибитор большее сродство к одному сайту, чем к другому. Судя по графику, мы видим, что это не так.
Наконец, существует особый случай смешанного торможения, называемый неконкурентным торможением. В этом случае ингибитор связывается как с аллостерическим сайтом, так и с активным сайтом с одинаковой аффинностью. Из-за этого скорость реакции уменьшится, но скорость реакции останется неизменной. Как мы видим на графике, показанном нам в основе вопроса, это так, потому что обе линии пересекаются по оси x, а это означает, что они имеют одинаковое значение.
Сообщить об ошибке
Фермент подвергся воздействию ингибитора неизвестного типа. При тестировании эффективности фермента в присутствии ингибитора максимальная скорость фермента была снижена до 60%. Однако количество субстрата, необходимое для достижения половины максимальной скорости фермента, не зависит от ингибитора.
При тестировании эффективности фермента в присутствии ингибитора максимальная скорость фермента была снижена до 60%. Однако количество субстрата, необходимое для достижения половины максимальной скорости фермента, не зависит от ингибитора.
Основываясь на этой информации, какой тип ингибитора?
Возможные ответы:
Неконкурентный ингибитор
Суицидальный ингибитор
Конкурентный ингибитор
Неконкурентный ингибитор
Правильный ответ:
Неконкурентный ингибитор
Объяснение:
Основываясь на информации, мы видим, что для фермента это не повлияло, но для фермента было снижено. Этот тип ингибирования наблюдается с неконкурентными ингибиторами.
Сообщить об ошибке
Основываясь на приведенном ниже графике, какой тип торможения имеет место?
Возможные ответы:
Неконкурентный
Неудовлетворительный
смешанный
Ни один из этих
конкуренции
Правильный ответ:
Правильный ответ:
. Правильный ответ:
Правильный ответ:
. Правильный ответ:
.
Пояснение:
В этом вопросе нам дан график зависимости начальной скорости реакции от концентрации субстрата. Кроме того, показано протекание реакции как в отсутствие, так и в присутствии ингибитора. Нас просят определить тип торможения, которое происходит.
Самое важное, что следует отметить на этом графике, это то, что максимальная скорость для обоих одинакова. Другими словами, добавление ингибитора не влияет на максимально возможную скорость реакции. Однако максимальная скорость реакции достигается только при более высокой концентрации субстрата в присутствии ингибитора. Таким образом, мы можем классифицировать это как конкурентное торможение.
Сообщить об ошибке
При каком типе ингибирования ингибитор связывается как со свободным ферментом, так и с комплексом фермент-субстрат с одинаковым сродством?
Возможные ответы:
Конкурентное ингибирование
Неконкурентное ингибирование
ЧИЧЕСКОЕ НЕОПРЕДЕЛЕННОЕ ингибирование
НЕДВИДЕННОЕ ДЕЙСТВИЕ
Правильный ответ: 8
66666666613.