Содержание
Аллотропия металлов
аллотропический
физический свойство металл
Введение
Аллотропией, или полиморфизмом,
называют способность металла в
твердом состоянии иметь
кристаллические формы. Процесс перехода
из одной кристаллической формы в другую
называют аллотропическим превращением.
При нагреве чистого металла такое превращение
сопровождается поглощением тепла и происходит
при постоянной температуре, что связано
с необходимостью затраты определенной
энергии на перестройку кристаллической
решетки. Аллотропические превращения
имеют многие металлы: железо, олово, титан
и др. Например, железо в интервале температур
911 -1392°С имеет гранецентрированную кубическую
решетку (ГЦК) г-Fe (рис. 7). В интервалах до
911°С и от 1392 до 1539°С железо имеет объемно-центрированную
кубическую решетку (ОЦК) — б-Fe. Аллотропические
формы металла обозначаются буквами а,
в, г и т. д. Существующая при самой низкой
температуре аллотропическая форма металла
обозначается через букву б, которая в
виде индекса добавляется к символу химического
элемента металла и т. д.
д.
При аллотропических превращениях
происходит изменение свойств металлов
— изменение объема металлов (особенно
характерно для олова) и растворимости
углерода (характерно для железа).
Методы изучения строения металлов
Изучение строения металлов
и сплавов производится методами макро-
и микроанализа, рентгеновского, а также
дефектоскопии (рентгеновской, магнитной,
ультразвуковой).
Методом макроанализа изучается
макроструктура, т. е. структура, видимая
невооруженным глазом или с помощью лупы,
при этом выявляются крупные дефекты:
трещины, усадочные раковины, газовые
пузыри и т. д., а также неравномерность
распределения примесей в металле. Макроструктуру
определяют по изломам металла, по макрошлифам.
Макрошлиф — это образец металла или сплава,
одна из сторон которого отшлифована,
тщательно обезжирена, протравлена и рассматривается
с помощью лупы с увеличением в 5 -10х.
Микроанализ выявляет структуру
металла или сплава по микрошлифам,
приготовленным так же, как и для
макроанализа, но дополнительно отполированным
до зеркального блеска. Шлифы рассматривают
Шлифы рассматривают
в отраженном свете под оптическим микроскопом
при увеличении до 3000х. Из-за различной
ориентировки зерен металла они травятся
не в одинаковой степени и под микроскопом
свет также отражается неодинаково. Границы
зерен благодаря примесям травятся сильнее,
чем основной металл, и выявляются более
рельефно. В сплаве структурные составляющие
травятся также различно. В электронном
микроскопе рассматривают реплику — слепок
с особо тонкой структуры блоков, фрагментов,
дислокации при увеличениях до 100000х.
Этот важнейший анализ определяет размеры
и форму зерен, структурные составляющие,
неметаллические включения и их характер
(трещины, пористость и т. д.), качество
термической, обработки. Зная микроструктуру,
можно объяснить причины изменения свойств
металла.
С помощью рентгеновского
анализа изучают атомную
металлов, типы и параметры кристаллических
решеток, а также дефекты, лежащие
в глубине. Этот анализ, основанный
на дифракции (отражении) рентгеновских
лучей рядами атомов кристаллической
решетки, позволяет обнаружить дефекты
(пористость, трещины, газовые пузыри,
шлаковые включения и т. д.), не разрушая
д.), не разрушая
металла. В местах дефектов рентгеновские
лучи поглощаются меньше, чем в сплошном
металле, и поэтому на фотопленке такие
лучи образуют темные пятна, соответствующие
форме дефекта.
Для исследования структуры
металла и дефектов изделий широко
применяют гамма-лучи, которые проникают
в изделие на большую глубину, чем рентгеновские.
Магнитным методом исследуют
дефекты в магнитных металлах (сталь,
никель и др.) на глубине до 2 мм (трещины
различного происхождения, неметаллические
включения и т. д.). Для этого испытуемое
изделие намагничивают, покрывают его
поверхность порошком железа, осматривают
поверхность и размагничивают изделие.
Вокруг дефекта образуется неоднородное
поле, вследствие чего магнитный порошок
повторяет очертания дефекта. Другой метод
— магнитный индукционный — часто используют
для оценки полноты структурных превращений
в сплавах (изделиях) после их термической
обработки.
Ультразвуковым методом
осуществляется эффективный контроль
качества металла изделий и заготовок
практически любых размеров.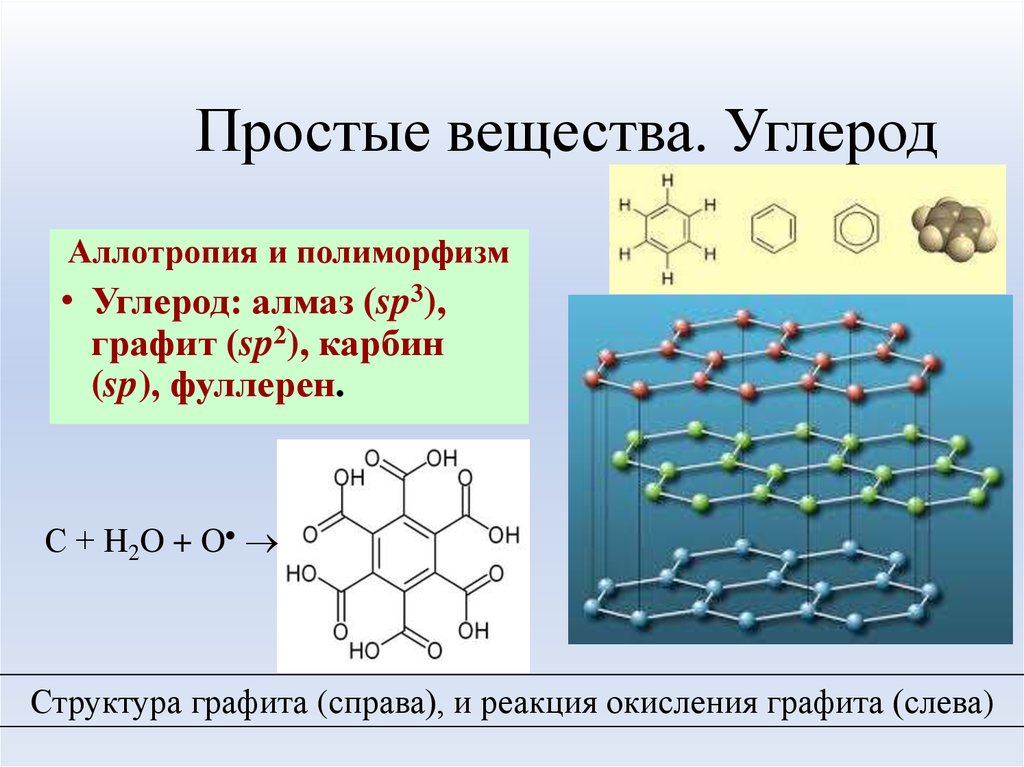 В импульсных
В импульсных
ультразвуковых дефектоскопах ультразвуковая
волна от щупа — излучателя распространяется
в контролируемом изделии и при встрече
с каким-либо дефектом отражается от него.
При этом отраженные волны принимаются,
усиливаются и передаются на показывающий
индикатор. Ультразвук используют для
контроля качества роторов, рельсов, поковок,
проката и других изделий при необходимости
сохранения целостности изделий.
Физические и
химические свойства
Физические свойства. К
физическим свойствам металлов относят
цвет, плотность, температуру плавления,
теплопроводность, тепловое расширение,
теплоемкость, электропроводность, магнитные
свойства и др.
Цветом называют способность
металлов отражать световое излучение
с определенной длиной волны. Например,
медь имеет розово-красный цвет, алюминий
— серебристо-белый.
Плотность металла характеризуется
его массой, заключенной в единице
объема. По плотности все металлы делят
на легкие (менее 4500 кг/м3) и тяжелые.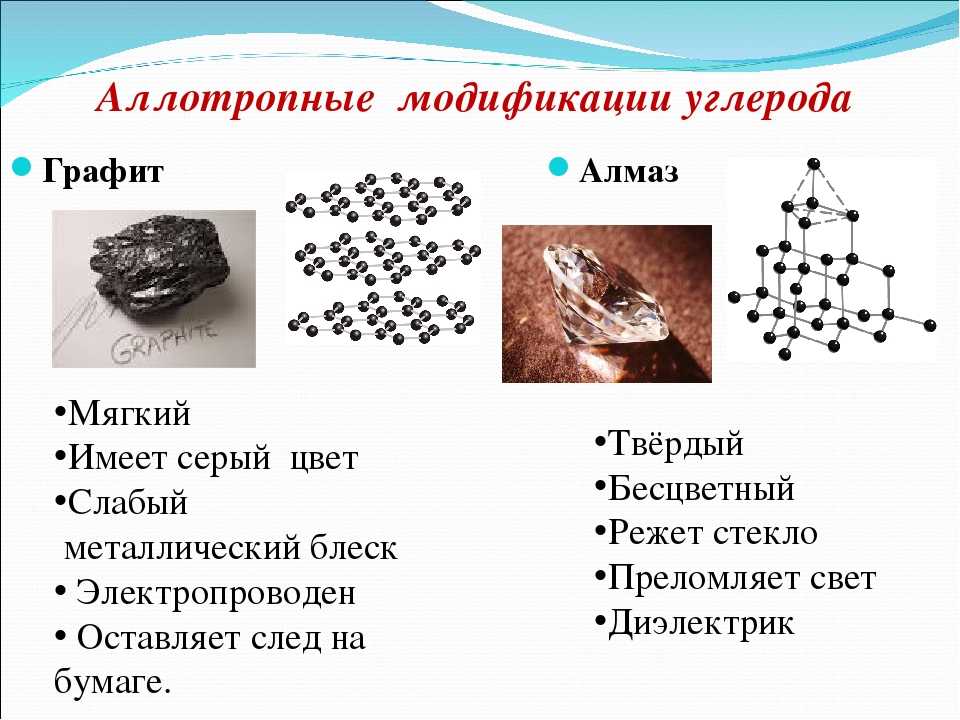
Плотность имеет большое значение при
создании различных изделий. Например,
в самолето- и ракетостроении стремятся
использовать более легкие металлы и сплавы
(алюминиевые, магниевые, титановые), что
способствует снижению массы изделий.
Температурой плавления
называют температуру, при которой
металл переходит из твердого состояния
в жидкое. По температуре плавления
различают тугоплавкие металлы (вольфрам
3416° С, тантал 2950°С, титан 1725°С. и др.) и
легкоплавкие (олово 232°С, свинец 327°С,
цинк 419,5°С, алюминий 660°С). Температура
плавления имеет большое значение при
выборе металлов для изготовления литых
изделий, сварных и паяных соединений,
термоэлектрических приборов и других
изделий. В единицах СИ температуру плавления
выражают в градусах Кельвина (К).
Теплопроводностью называют,
способность металлов передавать тепло
от более нагретых к менее нагретым участкам
тела. Серебро. медь, алюминий обладают
большой теплопроводностью. Железо имеет
теплопроводность примерно в три раза
меньше, чем алюминий, и в пять раз меньше,
чем медь. Теплопроводность имеет большое
Теплопроводность имеет большое
значение при выборе материала для деталей.
Например, если металл плохо проводит
тепло, то при нагреве и быстром охлаждении
(термическая обработка, сварка) в нем
образуются трещины. Некоторые детали
машин (поршни двигателей, лопатки турбин)
должны быть изготовлены из материалов
с хорошей тeплопpoводностью. В единицах
СИ теплопроводность имеет размерность
Вт/ (м*К).
Тепловым расширением
называют способность металлов увеличиваться
в размерах при нагревании и уменьшаться
при охлаждении. Тепловое расширение характеризуется
коэффициентом линейного расширения б
= (l2 -l 1)/ [l 1
(t 2 — t 1)], где l 1 и l
2 длины тела при температурах t 1
и t 2. Коэффициент объемного расширения
равен 3 б. Тепловые расширения должны
учитываться при сварке, ковке и горячей
объемной штамповке, изготовлении литейных
форм, штампов, прокатных валков, калибров,
выполнении точных соединений и сборке
приборов, при строительстве мостовых
ферм, укладке железнодорожных рельс.
Теплоемкостью называют способность
металла при нагревании поглощать определенное
количество тепла. В единицах СИ имеет
размерность Дж/К. Теплоемкость различных
металлов сравнивают по величине удельной
теплоемкости — количеству тепла, выраженному
в больших калориях, которое требуется
для повышения температуры 1 кг металла
на 1°С (в единицах СИ — Дж/(кг.К).
Электрическая проводимость
оценивается в системе СИ в
сименсах (См), удельная электропроводность
— в См/м.
Электросопротивление выражают
в Омах (Ом), а удельное электросопротивление
— в Ом/м.
Хорошая электропроводность
необходима, например, для токоведущих
проводов (медь, алюминий). При изготовлении
электронагревателей приборов и печей
необходимы сплавы с высоким электросопротивлением
(нихром, константан, манганин). С повышением
температуры металла его электропроводность
уменьшается, а с понижением — увеличивается.
Магнитные свойства характеризуются
абсолютной магнитной проницаемостью
или магнитной постоянной, т. е. способностью
е. способностью
металлов намагничиваться. В единицах
СИ магнитная постоянная имеет размерность
Гн/м. Высокими магнитными свойствами
обладают железо, никель, кобальт и их
сплавы, называемые ферромагнитными. Материалы
с магнитными свойствами применяют в электротехнической
аппаратуре и для изготовления магнитов.
Химические свойства. Химические
свойства характеризуют способность
металлов и сплавов сопротивляться
окислению или вступать в соединение с
различными веществами: кислородом воздуха,
растворами кислот, щелочей и др. Чем легче
металл вступает в соединение с другими
элементами, тем быстрее он разрушается.
Химическое разрушение металлов под действием
на их поверхность внешней агрессивной
среды называют коррозией.
Металлы, стойкие к окислению
при сильном нагреве, называют жаростойкими
или окалиностойкими. Такие металлы
применяют для изготовления деталей, которые
эксплуатируются в зоне высоких температур.
Сопротивление металлов коррозии,
окалине-образованию и
определяют по изменению массы испытуемых
образцов на единицу поверхности за единицу
времени.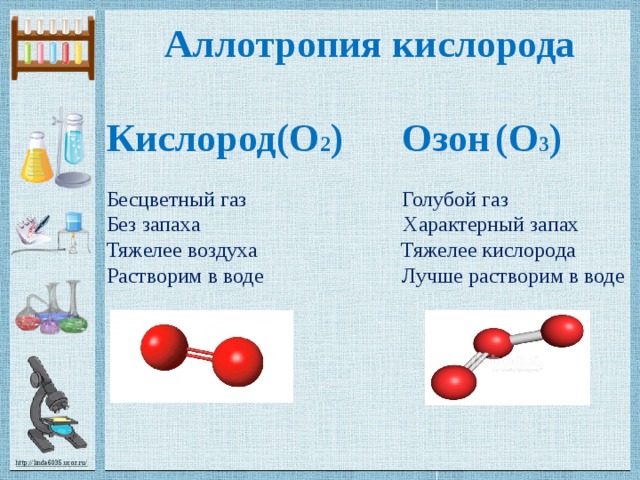
Химические свойства металлов
обязательно учитываются при
изготовлении тех или иных изделий.
Особенно это относится к изделиям
или деталям, работающим в химически
агрессивных средах.
Механические
свойства
Способность металла сопротивляться
воздействию внешних сил характеризуется
механическими свойствами. Поэтому при
выборе материала для изготовления деталей
машин необходимо прежде всего учитывать
его механические свойства: прочность,
упругость, пластичность, ударную вязкость,
твердость и выносливость. Эти свойства
определяют по результатам механических
испытаний, при которых металлы подвергают
воздействию внешних сил (нагрузок). Внешние
силы могут быть статическими, динамическими
или циклическими (повторно-переменными).
Нагрузка вызывает в твердом теле напряжение
и деформацию.
Напряжение — величина нагрузки,
отнесенная к единице площади поперечного
сечения испытуемого образца. Деформация
— изменение формы и размеров твердого
тела под влиянием приложенных внешних
сил. Различают деформации растяжения
Различают деформации растяжения
(сжатия), изгиба, кручения, среза (рис.
8).
В действительности материал
может подвергаться одному или нескольким
видам деформации одновременно.
Для определения прочности,
упругости и пластичности металлы
в виде образцов круглой или плоской
формы испытывают на статическое
растяжение. Испытания проводят на разрывных
машинах. В результате испытаний получают
диаграмму растяжения. По оси абсцисс
этой диаграммы откладывают значения
деформации, а по оси ординат — нагрузки,
приложенные к образцу.
Прочность — способность материала
сопротивляться разрушению под действием
нагрузок оценивается пределом прочности
и пределом текучести. Важным показателем
прочности материала является также удельная
прочность — отношение предела прочности
материала к его плотности. Предел прочности
у в (временное сопротивление) — это
условное напряжение в Па (Н/м2). соответствующее
наибольшей нагрузке, предшествующей
разрушению образца: у в = P max / F
о, где Рmах — наибольшая нагрузка, Н;
Fо — начальная площадь поперечного
сечения рабочей части образца, м2.
Истинное сопротивление
разрыву S к — это напряжение, определяемое
отношением нагрузки Рк в момент
разрыва к площади минимального поперечного
сечения образца после разрыва F к
(S к = Р к/ F к).
Предел текучести (физический)
у т — это наименьшее напряжение
(в МПа), при котором образец деформируется
без заметного увеличения нагрузки:
у т = Р т F о,
где Р т — нагрузка, при которой наблюдается
площадка текучести, Н.
Площадку текучести имеют
в основном только малоуглеродистая
сталь и латуни. Другие сплавы площадки
текучести не имеют. Для таких материалов
определяют предел текучести (условный),
при котором остаточное удлинение достигает
0,2 % от расчетной длины образца: у 0,2
= P 0,2 / F 0.
Упругость — способность
материала восстанавливать первоначальную
форму и размеры после прекращения действия
нагрузки Р уп оценивают пределом
пропорциональности у пц и пределом
упругости у ун.
Предел пропорциональности
у пц — напряжение (МПа), выше которого
нарушается пропорциональность между
прилагаемым напряжением и деформацией
образца у пц = Р пц / Р 0.
Предел упругости (условный)
у 0,05 — это условное напряжение
в Мпа, соответствующее нагрузке, при которой
остаточная деформация впервые достигает
0,05 %, от расчетной длины образца lo: у
0,05 = P 0,05 / F 0, где P 0,05
— нагрузка предела упругости, Н.
Пластичность, т.е. способность
материала принимать новую
и размеры под действием
сил не разрушаясь, характеризуется относительным
удлинением и относительным сужением.
Относительное удлинение (после
разрыва) д — это отношение приращения
(l k — lo) расчетной длины образца после
разрыва к его первоначальной расчетной
длине lo, выраженное в процентах: д = ((1к
-1о)/1о] 100 %.
Относительное сужение (после
разрыва) Ш — это отношение разности начальной
и минимальной площадей (Fo — Fк) поперечного
сечения образца после разрыва к начальной
площади Fo поперечного сечения, выраженное
в про центах: Ш = [( F 0
— F k) / Fо] 100%.
Аллотропия металлов
Аллотропией, или полиморфизмом, называют
способность металла в твердом состоянии
иметь различные кристаллические формы.
Процесс перехода из одной кристаллической
формы в другую называют аллотропическим
превращением. При нагреве чистого
металла такое превращение сопровождается
поглощением тепла и происходит при
постоянной температуре, что связано с
необходимостью затраты определенной
энергии на перестройку кристаллической
решетки.
Например, железо в интервале температур
911 – 1392 °С имеет гранецентрированную
кубическую решетку (ГКЦ) γ-Fe.
В интервалах до 911 ºС и от 1392 до 1539°С
железо имеет объемно-центрированную
кубическую решетку (ОЦК) ‑ α-Fe.
Металлические
сплавы — макроскопически
однородные системы, состоящие из двух
или более сортов атомов металлов (или
неметаллов), в которых доминирующими
являются атомы металла и которые обладают
металлическими свойствами. Свойства
Свойства
металлических сплавов могут быть
изменены легированием, механической,
термической, термомеханической,
радиационной и другими видами обработки.
Легирование
— введение в состав металлических
сплавов так называемых легирующих
элементов (например, в сталь — Cr,
Ni, Mo, W,
V и др.) для придания сплавам
определенных физических, химических
или механических свойств.
Классификация сплавов
по
химическому составупо
числу компонентовпо
числу фазпо
способу получения
Для изучения процессов, происходящих
в сплавах при их превращениях, а также
для описания строения сплавов в
металловедении используют понятия:
компонент, фаза, система.
Компонентами называют вещества,
образующие систему. Чистый металл
представляет собой однокомпонентную
систему, сплав двух металлов —
двухкомпонентную систему и т.д.
Компонентами могут быть металлы и
неметаллы, а также устойчивые, т. е. не
е. не
диссоциирующие на составные части в
рассматриваемых интервалах температур
вещества – химические соединения.
Фазой называют однородную часть системы,
имеющую одинаковый состав, одно и то же
агрегатное состояние и отделенную от
остальных частей системы поверхностью
раздела, при переходе через которую
химический состав или структура вещества
изменяются скачкообразно.
Совокупность фаз, находящихся в равновесии
при определенных внешних условиях
(давлении, температуре), называют
системой. Сплав называют однородным
(гомогенным), если его структура однофазна,
и разнородным (гетерогенным), если его
структура состоит из нескольких фаз.
Под структурой сплав понимают видимое
в микроскоп взаимное расположение фаз,
их форму и размеры. Компоненты, входящие
в состав сплава, могут образовывать
следующие фазы:
Металлические
жидкие растворы (расплавы)
представляют собой жидкое негомогенное
состояние металлов и их сплавов, которое
по большинству характеристик (например,
по электропроводности и теплопроводности)
ближе к твердому состоянию.
Однородные жидкие растворы характерны
почти для всех металлов, растворяющихся
друг в друге в жидком состоянии в любых
соотношениях.
В однородном жидком растворе атомы
растворимого металла (компонента)
равномерно распределены среди атомов
металла–растворителя.
Лишь немногие металлы растворяются в
жидком состоянии ограниченно. И только
очень немногие металлы из-за большой
разницы в размерах своих атомов не
растворяются друг в друге в жидком
состоянии. В процессе кристаллизации
и затвердевания сплавов взаимодействие
компонентов может быть различным.
Твердые растворы образуются в результате
перехода в твердое состояние однородных
жидких растворов.
В твердом растворе одно из веществ,
входящих в состав сплава, сохраняет
присущую ему кристаллическую решетку,
а другое в виде отдельных атомов
распределяется в кристаллической
решетке первого вещества.
Металлические твердые растворы образуются
в результате проникновения в кристаллическую
решетку основного металла атомов другого
металла или неметалла.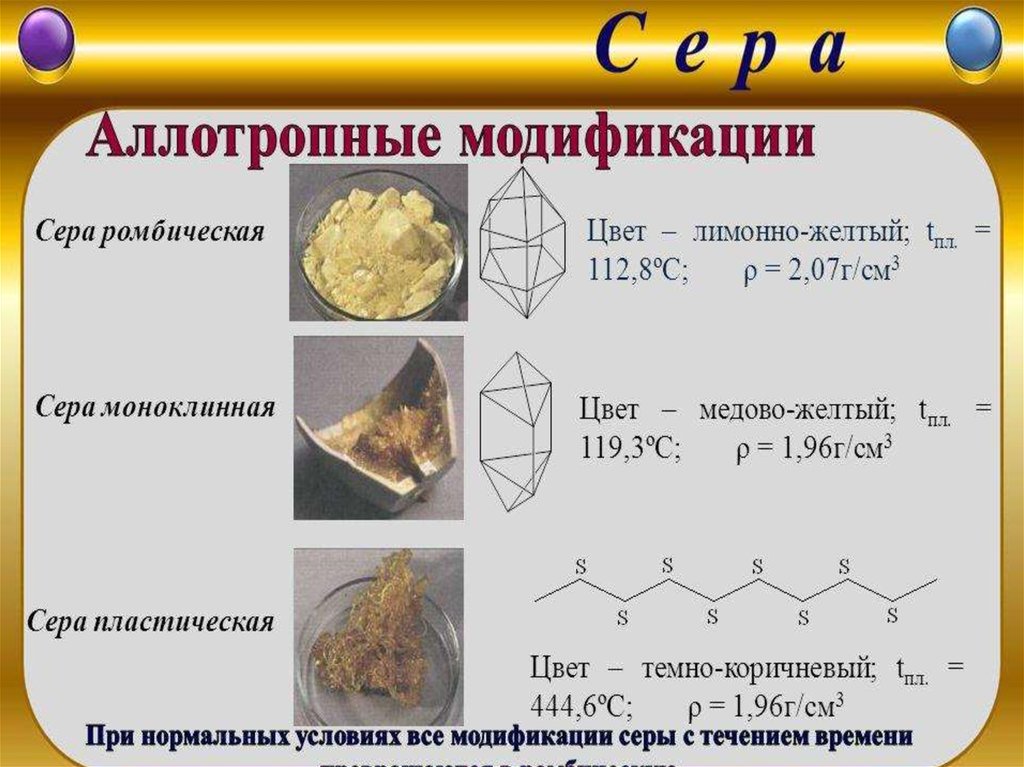 Различают твердые
Различают твердые
растворы замещения (а)
и твердые
растворы внедрения (б) (рис.
2.9).
Рис. |
Так как электронное строение и размеры
атомов основного металла (растворителя)
и растворенного компонента различны,
то при образовании металлического
твердого раствора кристаллическая
решетка всегда искажается, и периоды
ее изменяются. При образовании раствора
внедрения период решетки растворителя
всегда возрастает, а при образовании
твердого раствора замещения — может
увеличиться или уменьшиться в зависимости
от соотношения атомных радиусов
растворителя и растворенного компонента.
Большинство металлов в той или иной
степени взаимно растворяются друг в
друге в твердом состоянии. Например,
Например,
без изменения типа кристаллической
решетки в алюминии может растворяться
до 5,5 % Сu, а в меди — 39 % Zn.
Если компоненты могут замещать друг
друга в любых количественных соотношениях,
то они образуют непрерывный ряд твердых
растворов, имеющих одну и ту же
кристаллическую решетку. Образование
твердых растворов всегда сопровождается
увеличением электрического сопротивления
и уменьшением его температурного
коэффициента. Твердые растворы обычно
менее пластичны (исключение составляют
твердые растворы на основе меди) и всегда
более тверды и прочны, чем чистые металлы.
При этом в значительной мере свойства
изменяются в твердых растворах внедрения,
так как искажения решетки при их
образовании больше.
Полностью упорядоченные твердые
растворы (сверхструктуры) образуются,
когда отношение компонентов в сплаве
равно целому числу: 1:1; 1:2; 1:3 и др. (рис.
3.10.). В этом случае сплаву с упорядоченным
строением можно приписать формулу
химического соединения, например, CuAu
или Сu3Аu.
Таким образом, упорядоченные твердые
растворы можно рассматривать как
промежуточные фазы между твердыми
растворами и химическими соединениями.
Рис. 2.10. а) |
В металловедении принято обозначать:
чистые компоненты большими буквами
латинского алфавита — А, В, С и др.;
твердые растворы — малыми буквами
греческого алфавита — α, β, γ и др., a
упорядоченные твердые растворы теми
же буквами со штрихом — α’, β’, γ’ и
др.
Понятие «химическое соединение»
определяет химически индивидуальное
вещество, в котором атомы одного
(например, N2 и O2)
или различных (CuZn, Mо2C)
элементов соединены между собой тем
или иным видом химической связи. Известно
Известно
свыше 3 млн. химических соединений. В
металлических сплавах это понятие
охватывает только химические соединения,
образованные из различных компонентов
сплава.
Химические соединения, образующиеся в
металлических сплавах из различных
компонентов, отличаются от типичных
химических соединений тем, что не
подчиняются законам валентности и не
имеют постоянного состава, а от
упорядоченных твердых растворов — тем,
что сохраняют свою кристаллическую
решетку до температуры плавления.
Химические соединения
по электронному строению и свойствам
разделяют на классы: электронные
соединения, интерметаллиды,
фазы внедрения и
др.
Электронные
соединения
(электронные
фазы) чаще всего образуются между
одновалентными (Сu,
Ag,
Li,
Na
и др.) металлами или переходными металлами
(Fe,
Mn,
Со и др.) и металлами с валентностью
от 2 до 5 (Be, Mg,
Zn, Al и др.).
Интерметаллиды
(интерметаллические
соединения) — химические соединения
металлов с металлами и неметаллами
(нитриды, карбиды, гидриды и др. ), обладающие
), обладающие
металлической связью. Интерметаллические
соединения образуют переходные металлы
(Fe, Mn, Cr,
Mo и др.) с углеродом, азотом,
бором и водородом, то есть с элементами,
имеющими малый атомный радиус.
Кристаллическое строение фаз внедрения
определяется соотношением атомных
радиусов неметалла (Rx)
и металла (Rm).
Атомы металла расположены по типу одной
из простых решеток (кубической или
гексагональной), в определенные пустоты
(поры) которой внедрены атомы неметалла.
Механическая смесь двух компонентов А
и В образуется тогда, когда при
кристаллизации компоненты сплава не
способны к взаимному растворению в
твердом состоянии и не вступают в
химическую реакцию с образованием
соединения. Механическая смесь может
состоять из зерен двух насыщенных
твердых растворов или зерен твердого
раствора и химического соединения. В
этом случае сплав состоит из кристаллов
А и В, которые, если они достаточно
крупны, отчетливо выявляются на
микроструктуре.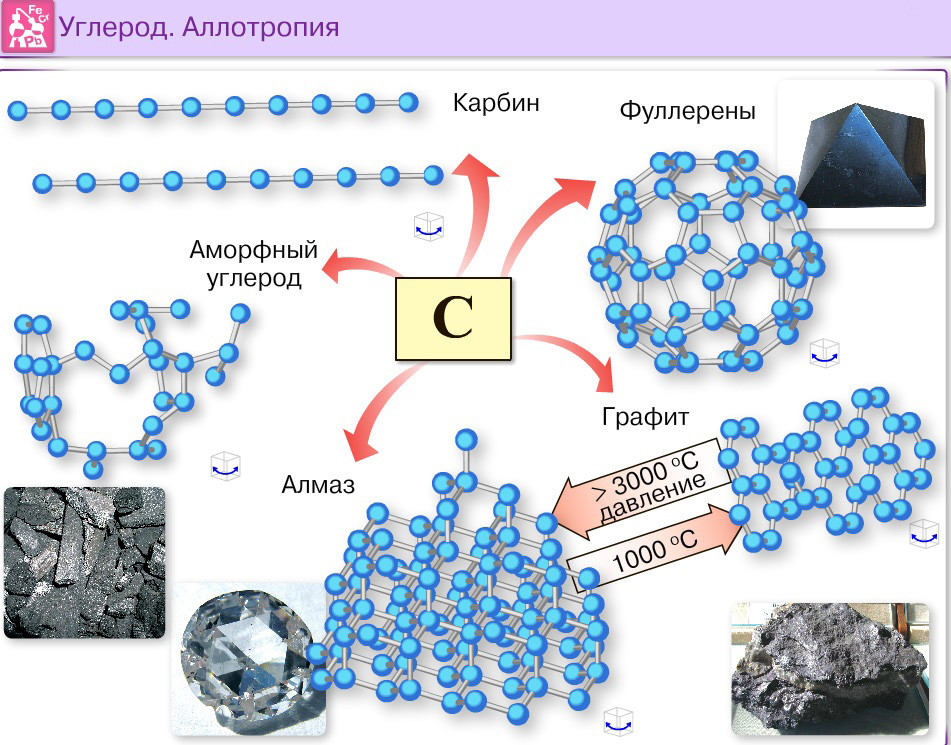 Рентгенограмма сплава
Рентгенограмма сплава
отчетливо показывает наличие двух
решеток компонентов А и В.
Разница между аллотропом и изомером
Ключевая разница — аллотроп против изомера
Некоторые элементы в периодической таблице могут встречаться в разных формулах или в разных расположениях, оставаясь при этом стабильными при комнатной температуре. Они могут быть соединением, состоящим из одного элемента, или соединением, состоящим из нескольких элементов. Аллотропы и изомеры являются хорошими примерами таких элементов. Ключевое различие между аллотропом и изомером заключается в том, что аллотропов представляют собой соединения с одними и теми же элементами, но с разной химической формулой в разном расположении , тогда как изомеры представляют собой соединения, имеющие разные элементы, но одинаковую химическую формулу в разном расположении.
СОДЕРЖАНИЕ
1. Обзор и ключевые отличия
2. Что такое аллотроп
3. Что такое изомер
Что такое изомер
4. Сравнение бок о бок – аллотроп и изомер в табличной форме
5. Резюме
Что такое аллотроп ?
Слово аллотроп можно определить как альтернативный тип. В деталях это относится к разным типам соединений, состоящих из одного и того же элемента, но с разными химическими формулами и разным расположением. Эти аллотропы существуют в одном и том же физическом состоянии в одних и тех же условиях (комнатная температура), но обнаруживают различия в своих физических и химических свойствах. Различные аллотропы можно наблюдать у металлов, неметаллов и металлоидов.
Примеры аллотропов
Аллотропы углерода
Аллотропы углерода существуют в твердом состоянии. Наиболее распространенными типами являются алмаз, графит и сажа. Здесь не так просто превратить один аллотропный тип в другую аллотропную структуру. Алмаз — чрезвычайно твердая структура, в то время как графит не такой твердый. Технический углерод существует в виде порошка.
Рисунок 01: Структура и внешний вид алмаза (слева) и графита (справа)
Аллотропы кислорода
Наиболее распространенными типами аллотропов кислорода, которые встречаются в природе, являются двухатомный кислород (O 2 ) и озон (O 3 ). Разница между ними заключается в том, что у кислорода есть два атома кислорода, связанные двойной связью, тогда как озон состоит из трех атомов кислорода, которые существуют как резонансная структура.
Разница между ними заключается в том, что у кислорода есть два атома кислорода, связанные двойной связью, тогда как озон состоит из трех атомов кислорода, которые существуют как резонансная структура.
Аллотропы серы
Аллотропы серы отличаются друг от друга числом присоединенных атомов серы и их расположением. В случае серы довольно легко превратить одну форму серы в другую.
Что такое изомер?
Изомеры – это соединения, имеющие одинаковую химическую формулу, но разное строение. Изомеры имеют одинаковое количество и типы атомов, но эти атомы расположены по-разному. Поэтому химическая структура изомеров отличается друг от друга. Изомеры делятся на две широкие категории, известные как структурные изомеры и стереоизомеры.
Рисунок 02: Классификация изомеров
Структурные изомеры
В этом типе атомы и функциональные группы присоединяются по-разному, образуя структуру. Этот тип включает цепную изомерию, изомерию положения и изомерию функциональных групп.
Стереоизомеры
Структура связи и положение функциональных групп одинаковы для изомеров, но отличаются геометрическим расположением. Стереоизомеры включают цис-транс-изомеры (=диастереомеры) и оптические изомеры (=энантиомеры).
Рисунок 03: Стереоизомеры пропиленгликоля (обратите внимание, что геометрия атома Н в двух молекулах различна).
В чем разница между аллотропом и изомером?
Аллотроп против изомера | |
| Аллотропы – это соединения с одними и теми же элементами, но с разной химической формулой в разном расположении. | Изомеры — это соединения, имеющие разные элементы, но одинаковую химическую формулу в разном расположении. |
| Количество атомов | |
| Аллотропы состоят из разного количества атомов. | Изомеры имеют одинаковое количество атомов. |
| Тип элементов | |
Аллотропы состоят из одного и того же элемента. | Изомеры состоят из различных элементов. |
| Структура | |
| Аллотропы всегда имеют разную структуру. | Изомеры могут иметь сходную или различную структуру. |
| Наличие | |
| Аллотропы можно наблюдать в металлах, неметаллах и металлоидах | Изомерию можно увидеть в органических молекулах (например, углеводород) и неорганических молекулах (например, силан). |
| Основные типы | |
| Типы аллотропов включают аллотропы металлов, аллотропы неметаллов и аллотропы металлоидов | Изомеры включают главным образом структурные изомеры и стереоизомеры. |
Резюме – Аллотропы и изомеры
И аллотропы, и изомеры могут быть определены как альтернативные типы элемента или соединения. В большинстве случаев это стабильные и встречающиеся в природе соединения. Основное различие между аллотропом и изомером заключается в том, что аллотропы представляют собой соединения с одними и теми же элементами в разных химических формулах в разном расположении, тогда как изомеры представляют собой соединения, содержащие разные элементы с одной и той же химической формулой в разных расположениях.
Основное различие между аллотропом и изомером заключается в том, что аллотропы представляют собой соединения с одними и теми же элементами в разных химических формулах в разном расположении, тогда как изомеры представляют собой соединения, содержащие разные элементы с одной и той же химической формулой в разных расположениях.
Загрузить PDF-версию аллотропов и изомеров
Вы можете загрузить PDF-версию этой статьи и использовать ее в автономном режиме в соответствии с примечаниями к цитированию. Пожалуйста, загрузите PDF-версию здесь. Разница между аллотропом и изомером.
Ссылка:
1.Хельменстин, Энн Мари. «Что такое изомер? Пересмотрите свои химические концепции». Мысль Ко. н.п., н.д. Веб. Доступна здесь. 01 июня 2017 г.
2. «Аллотропы». Химия LibreTexts. Libretexts, 21 марта 2017 г. Доступно здесь. Веб. 01 июня 2017.
Изображение предоставлено:
1. «Алмаз и графит2» Автор Diamond_and_graphite.jpg: Пользователь: Itubderivative work: Materialscientist (разговор) — Diamond_and_graphite.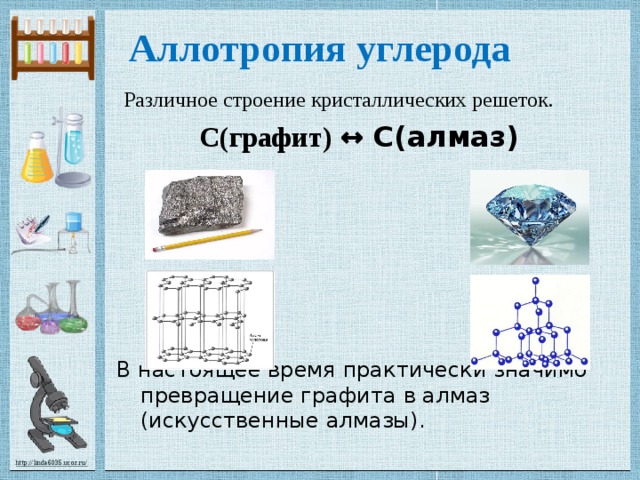 jpgФайл: Graphite-tn19a.jpg (CC BY-SA 3.0) через Commons Wikimedia
jpgФайл: Graphite-tn19a.jpg (CC BY-SA 3.0) через Commons Wikimedia
2 , «Изомерия» Владсингера — собственная работа (CC BY-SA 3.0) через Commons Wikimedia
3. «Стереоизомеры пропиленгликоля v.1» Джу — собственная работа (общественное достояние) через Commons Wikimedia
Аллотропы углерода | Введение в химию |
Цель обучения
- Описать свойства аллотропов углерода.
Ключевые моменты
- Алмаз — хорошо известный аллотроп углерода, обладающий твердостью и высокой дисперсией света. Это самый твердый из известных природных минералов, который находит применение в резке, сверлении и производстве ювелирных изделий, а также в качестве потенциального полупроводникового материала.
- Графен представляет собой одиночный слой атомов углерода, расположенных в одной плоскости; слои графена составляют графит. Графен представляет интерес из-за его высокой подвижности электронов и возможных применений в электронике.

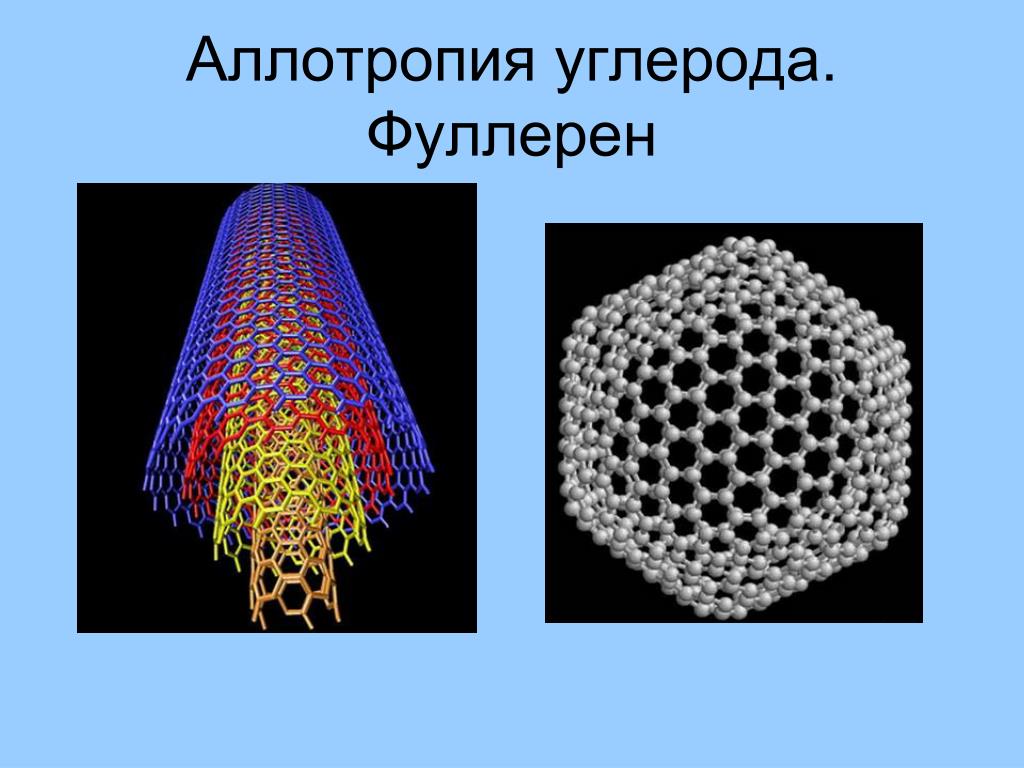
- Фуллерены представляют собой класс аллотропов углерода, в которых углерод принимает форму полой сферы, эллипсоида или трубки. Этот класс материалов включает углеродные нанотрубки, бакиболы и недавно обнаруженные нанотрубки.
Термин
- аллотропыРазличные формы химического элемента.
Аллотропия — это свойство некоторых химических элементов существовать в двух или более различных формах или аллотропах, когда они встречаются в природе. Существует несколько аллотропов углерода.
Аллотропы углерода Аллотропы углерода: а) алмаз, б) графит, в) лонсдейлит, г) С60 (бакминстерфуллерен или баккибол), д) С540, е) С70, ж) аморфный углерод и з) одноатомный углеродные нанотрубки со стенками, или бакитрубки.
Алмаз
Алмаз, вероятно, является наиболее известным аллотропом углерода. Атомы углерода расположены в решетке, которая представляет собой разновидность гранецентрированной кубической кристаллической структуры. Он обладает превосходными физическими свойствами, большая часть которых обусловлена сильной ковалентной связью между его атомами. Каждый атом углерода в алмазе ковалентно связан с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трехмерную сеть шестичленных углеродных колец в конформации кресла, что обеспечивает нулевую угловую деформацию. Эта стабильная сеть ковалентных связей и шестиугольных колец является причиной того, что алмаз невероятно прочен как вещество.
Он обладает превосходными физическими свойствами, большая часть которых обусловлена сильной ковалентной связью между его атомами. Каждый атом углерода в алмазе ковалентно связан с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трехмерную сеть шестичленных углеродных колец в конформации кресла, что обеспечивает нулевую угловую деформацию. Эта стабильная сеть ковалентных связей и шестиугольных колец является причиной того, что алмаз невероятно прочен как вещество.
В результате алмаз обладает самой высокой твердостью и теплопроводностью среди всех сыпучих материалов. Кроме того, его жесткая решетка предотвращает загрязнение многими элементами. Поверхность алмаза липофильна и гидрофобна, что означает, что он не может смачиваться водой, но может находиться в масле. Алмазы вообще не реагируют ни с какими химическими реагентами, в том числе с сильными кислотами и основаниями. Использование алмаза включает резку, сверление и шлифование; Ювелирные изделия; и в полупроводниковой промышленности.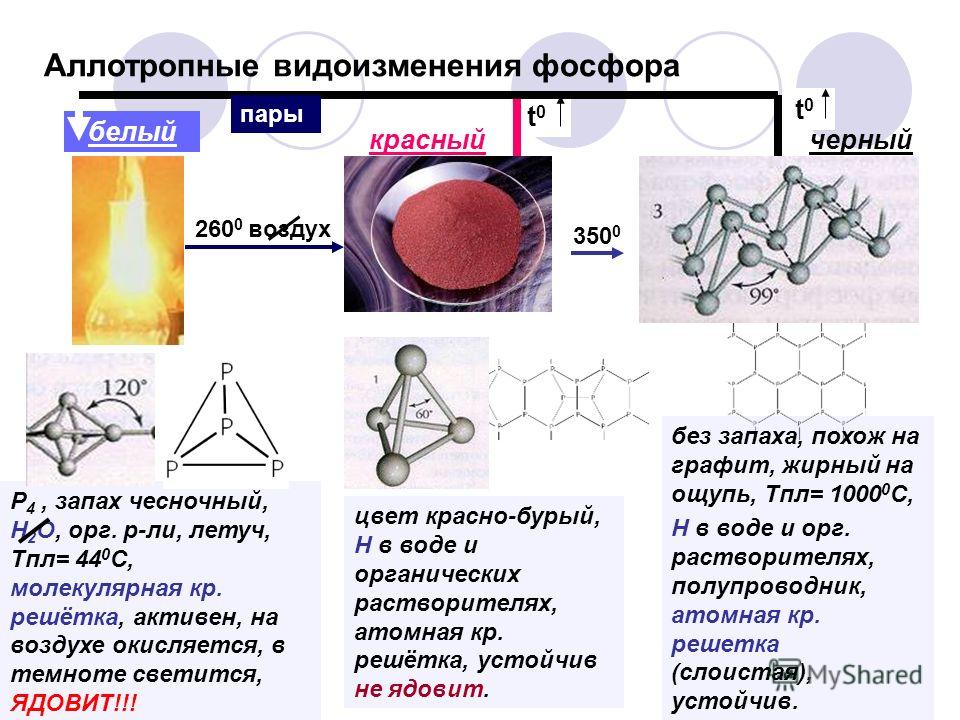
Алмаз и графит Алмаз и графит — две аллотропные формы углерода — чистые формы одного и того же элемента, различающиеся по структуре.
Графит
Графит — еще один аллотроп углерода; в отличие от алмаза, это электрический проводник и полуметалл. Графит является наиболее стабильной формой углерода при стандартных условиях и используется в термохимии в качестве стандартного состояния для определения теплоты образования соединений углерода. Существует три типа природного графита:
- Кристаллический чешуйчатый графит: изолированные, плоские, пластинчатые частицы с шестиугольными краями
- Аморфный графит: мелкие частицы, результат термического метаморфизма угля; иногда называемый метаантрацитом
- Комковатый или прожилковый графит: встречается в трещинах жилок или трещин, выглядит как разрастание волокнистых или игольчатых кристаллических агрегатов
Графит имеет слоистую плоскую структуру. В каждом слое атомы углерода расположены в гексагональной решетке с расстоянием между ними 0,142 нм, а расстояние между плоскостями (слоями) составляет 0,335 нм. Две известные формы графита, альфа (гексагональный) и бета (ромбоэдрический) имеют очень похожие физические свойства (за исключением того, что слои укладываются немного по-разному). Шестиугольный графит может быть плоским или изогнутым. Альфа-форма может быть преобразована в бета-форму посредством механической обработки, а бета-форма возвращается в альфа-форму при нагревании выше 1300 °C. Графит может проводить электричество из-за обширной делокализации электронов в углеродных слоях; поскольку электроны могут свободно двигаться, электричество движется через плоскость слоев. Графит также обладает самосмазывающимися и сухими смазывающими свойствами. Графит применяется в протезах, содержащих кровь, и термостойких материалах, поскольку он может выдерживать температуры до 3000 °C.
В каждом слое атомы углерода расположены в гексагональной решетке с расстоянием между ними 0,142 нм, а расстояние между плоскостями (слоями) составляет 0,335 нм. Две известные формы графита, альфа (гексагональный) и бета (ромбоэдрический) имеют очень похожие физические свойства (за исключением того, что слои укладываются немного по-разному). Шестиугольный графит может быть плоским или изогнутым. Альфа-форма может быть преобразована в бета-форму посредством механической обработки, а бета-форма возвращается в альфа-форму при нагревании выше 1300 °C. Графит может проводить электричество из-за обширной делокализации электронов в углеродных слоях; поскольку электроны могут свободно двигаться, электричество движется через плоскость слоев. Графит также обладает самосмазывающимися и сухими смазывающими свойствами. Графит применяется в протезах, содержащих кровь, и термостойких материалах, поскольку он может выдерживать температуры до 3000 °C.
Один слой графита называется графеном. Этот материал демонстрирует исключительные электрические, тепловые и физические свойства. Это аллотроп углерода, структура которого представляет собой единый плоский лист sp 2 связанных атомов углерода, плотно упакованных в сотовую кристаллическую решетку. Длина связи углерод-углерод в графене составляет ~0,142 нм, и эти листы складываются в графит с межплоскостным расстоянием 0,335 нм. Графен является основным структурным элементом аллотропов углерода, таких как графит, древесный уголь, углеродные нанотрубки и фуллерены. Графен представляет собой полуметалл или полупроводник с нулевой запрещенной зоной, что позволяет ему демонстрировать высокую подвижность электронов при комнатной температуре. Графен — это захватывающий новый класс материалов, уникальные свойства которого делают его предметом постоянных исследований во многих лабораториях.
Этот материал демонстрирует исключительные электрические, тепловые и физические свойства. Это аллотроп углерода, структура которого представляет собой единый плоский лист sp 2 связанных атомов углерода, плотно упакованных в сотовую кристаллическую решетку. Длина связи углерод-углерод в графене составляет ~0,142 нм, и эти листы складываются в графит с межплоскостным расстоянием 0,335 нм. Графен является основным структурным элементом аллотропов углерода, таких как графит, древесный уголь, углеродные нанотрубки и фуллерены. Графен представляет собой полуметалл или полупроводник с нулевой запрещенной зоной, что позволяет ему демонстрировать высокую подвижность электронов при комнатной температуре. Графен — это захватывающий новый класс материалов, уникальные свойства которого делают его предметом постоянных исследований во многих лабораториях.
Аморфный углерод
Аморфный углерод относится к углероду, который не имеет кристаллической структуры. Несмотря на то, что аморфный углерод можно изготовить, все еще существуют микроскопические кристаллы графитоподобного или алмазоподобного углерода. Свойства аморфного углерода зависят от соотношения гибридизованных связей sp 2 и sp 3 , присутствующих в материале. Графит состоит исключительно из sp 2 гибридизированных связей, тогда как алмаз состоит исключительно из sp 3 гибридные облигации. Материалы с высоким содержанием гибридных связей sp 3 называются тетраэдрическим аморфным углеродом (из-за тетраэдрической формы, образованной гибридными связями sp 3 ) или алмазоподобным углеродом (из-за сходства многих его физических свойств). к алмазным).
Несмотря на то, что аморфный углерод можно изготовить, все еще существуют микроскопические кристаллы графитоподобного или алмазоподобного углерода. Свойства аморфного углерода зависят от соотношения гибридизованных связей sp 2 и sp 3 , присутствующих в материале. Графит состоит исключительно из sp 2 гибридизированных связей, тогда как алмаз состоит исключительно из sp 3 гибридные облигации. Материалы с высоким содержанием гибридных связей sp 3 называются тетраэдрическим аморфным углеродом (из-за тетраэдрической формы, образованной гибридными связями sp 3 ) или алмазоподобным углеродом (из-за сходства многих его физических свойств). к алмазным).
Фуллерены и нанотрубки
Углеродные наноматериалы составляют еще один класс аллотропов углерода. Фуллерены (также называемые фуллеренами) представляют собой молекулы различных размеров, полностью состоящие из углерода, которые принимают форму полых сфер, эллипсоидов или трубок. Buckyballs и Buckytubes были предметом интенсивных исследований как из-за их уникального химического состава, так и из-за их технологических применений, особенно в материаловедении, электронике и нанотехнологиях. Углеродные нанотрубки представляют собой цилиндрические молекулы углерода, которые обладают необычайной прочностью и уникальными электрическими свойствами и являются эффективными проводниками тепла. Углеродные нанотрубки — это недавно открытые аллотропы, в которых фуллереноподобные «бутоны» ковалентно присоединены к внешним боковым стенкам углеродной нанотрубки. Таким образом, нанотрубки проявляют свойства как нанотрубок, так и фуллеренов.
Buckyballs и Buckytubes были предметом интенсивных исследований как из-за их уникального химического состава, так и из-за их технологических применений, особенно в материаловедении, электронике и нанотехнологиях. Углеродные нанотрубки представляют собой цилиндрические молекулы углерода, которые обладают необычайной прочностью и уникальными электрическими свойствами и являются эффективными проводниками тепла. Углеродные нанотрубки — это недавно открытые аллотропы, в которых фуллереноподобные «бутоны» ковалентно присоединены к внешним боковым стенкам углеродной нанотрубки. Таким образом, нанотрубки проявляют свойства как нанотрубок, так и фуллеренов.
Стеклоуглерод
Стекловидный или стеклообразный углерод представляет собой класс углерода, широко используемый в качестве электродного материала в электрохимии, а также в протезах и высокотемпературных тиглях. Его наиболее важными свойствами являются высокая термостойкость, твердость, низкая плотность, низкое электрическое сопротивление, низкое трение, низкое термическое сопротивление, чрезвычайная стойкость к химическому воздействию и непроницаемость для газов и жидкостей.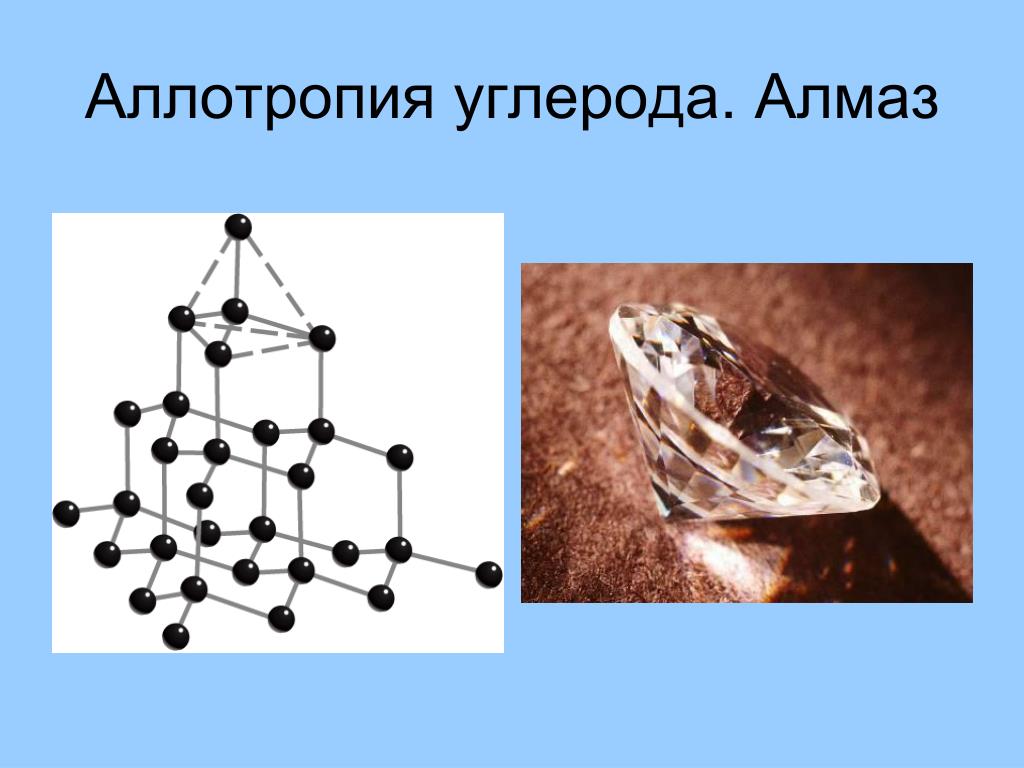
Прочие аллотропы
Другие аллотропы углерода включают углеродную нанопену, которая представляет собой кластерную сборку атомов углерода с низкой плотностью, связанных вместе в рыхлой трехмерной сети; чистый атомарный и двухатомный углерод; и линейный ацетиленовый углерод, который представляет собой одномерный углеродный полимер со структурой -(C:::C) п -.
Show Sources
Безграничный выбор и проверка высококачественного контента с открытой лицензией со всего Интернета. Данный конкретный ресурс использовал следующие источники:
«Безграничный».
http://www.boundless.com/
Безграничное обучение
CC BY-SA 3.0.
«аллотропы».
http://en.wikipedia.org/wiki/allotropes
Wikipedia
CC BY-SA 3.0.
«Стеклоуглерод».
http://en.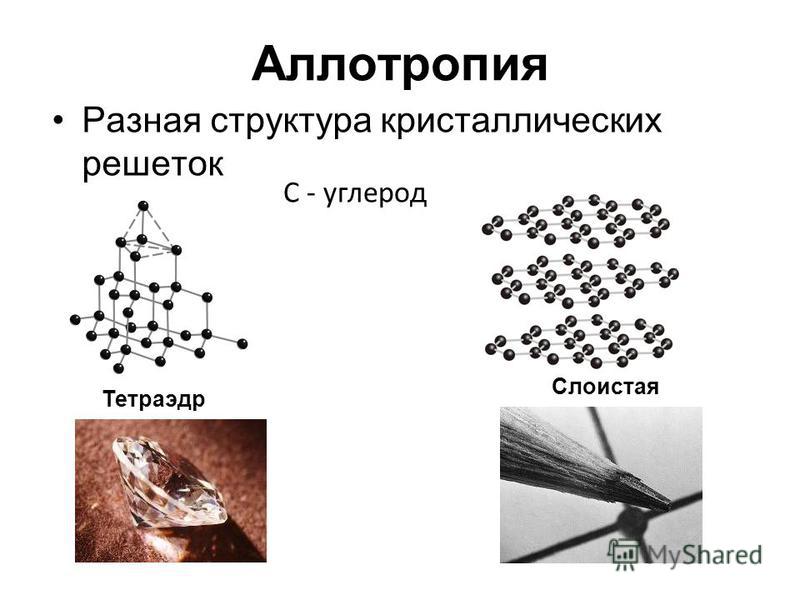 wikipedia.org/wiki/Glassy_carbon
wikipedia.org/wiki/Glassy_carbon
Википедия
CC BY-SA 3.0.
«Углерод аморфный».
http://en.wikipedia.org/wiki/Amorphous_carbon
Википедия
CC BY-SA 3.0.
«Аллотропы углерода».
http://en.wikipedia.org/wiki/Allotropes_of_carbon
Википедия
CC BY-SA 3.0.
«Аллотропия».
http://en.wikipedia.org/wiki/Аллотропия
Википедия
СС BY-SA 3.0.
«Алмаз».
http://en.wikipedia.org/wiki/Diamond
Wikipedia
CC BY-SA 3.0.
«Графит».
http://en.wikipedia.org/wiki/Графит
Википедия
CC BY-SA 3.0.
«Графен».
http://en.wikipedia.org/wiki/Graphene
Wikipedia
CC BY-SA 3.