Содержание
Кристаллическое строение металлов – кратко о типах
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
Металлы – особая группа элементов в периодической таблице Менделеева. В отличие от неметаллов элементы этой группы являются исключительно восстановителями с положительной степенью окисления, а также обладают пластичностью, твёрдостью, упругостью, что обусловлено кристаллическим строением металлов.
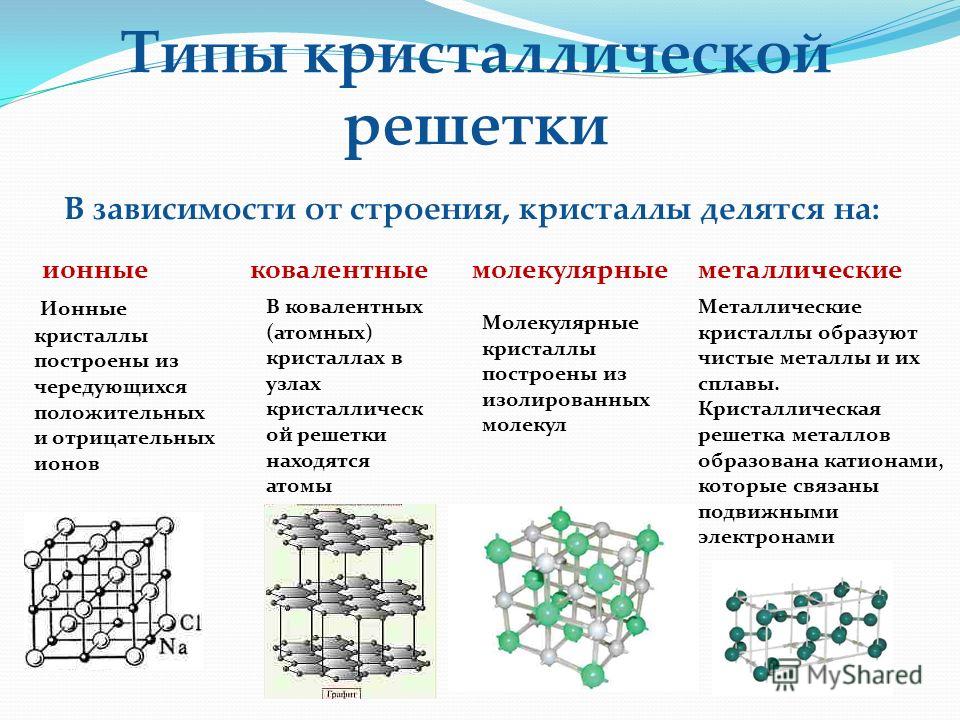
Общее строение
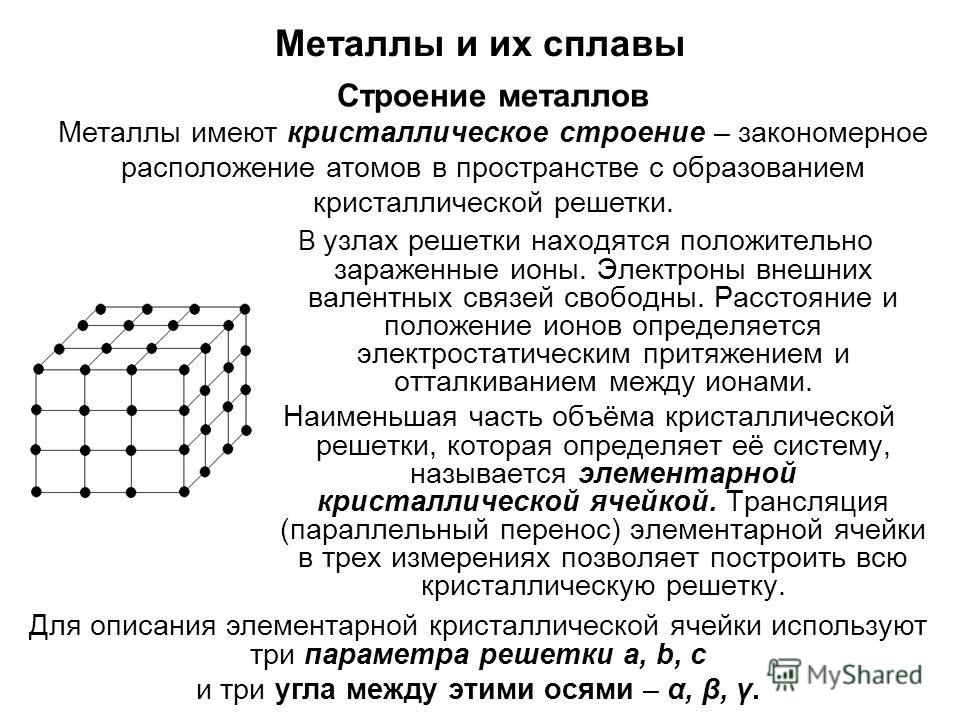
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Отрицательно заряженные электроны держат на равном расстоянии положительно заряженные электроны, предавая кристаллической решётке правильную геометрическую форму.
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
Виды решёток
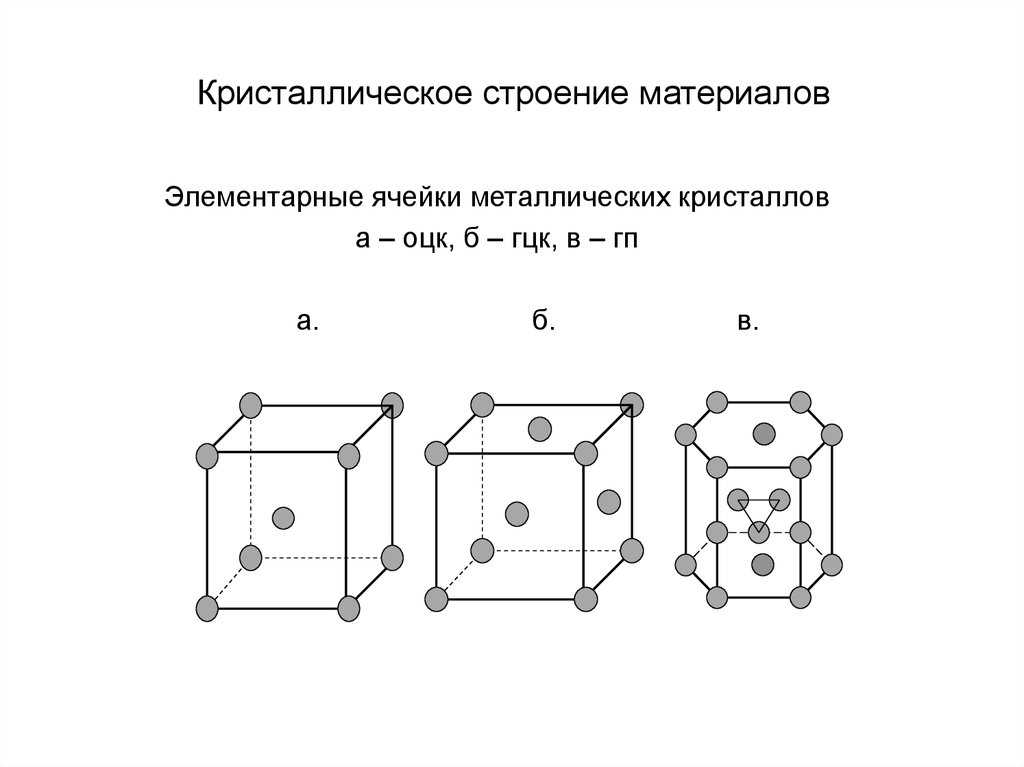
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Характеристика решётки
Кристаллические решётки характеризуются компактностью или степенью наполненности. Компактность определяют показатели:
- параметр решётки – расстояние между атомами;
- число атомов;
- координационное число – количество соседних ячеек;
- плотность упаковки – отношение объёма, занимаемого атомами, к полному объёму решётки.

При подсчёте количества атомов следует помнить, что атомы в узлах и на гранях входят в состав соседних ячеек.
Рис. 3. Кристаллические ячейки составляют решётку.
Что мы узнали?
Узнали кратко об атомно-кристаллическом строении металлов. Металлы – твёрдые кристаллические вещества. Единицей решётки является элементарная кристаллическая ячейка. Благодаря металлическим связям ионы в узлах ячеек удерживаются на одинаковом расстоянии. Различают три типа кристаллических решёток – ОЦК, ГЦК и ГПУ, отличающихся количеством атомов и геометрической формой.
Тест по теме
Доска почёта
Чтобы попасть сюда — пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 229.
А какая ваша оценка?
1.Кристаллическое строение металлов. Типы кристаллических решёток.
Все
тела состоят из атомов.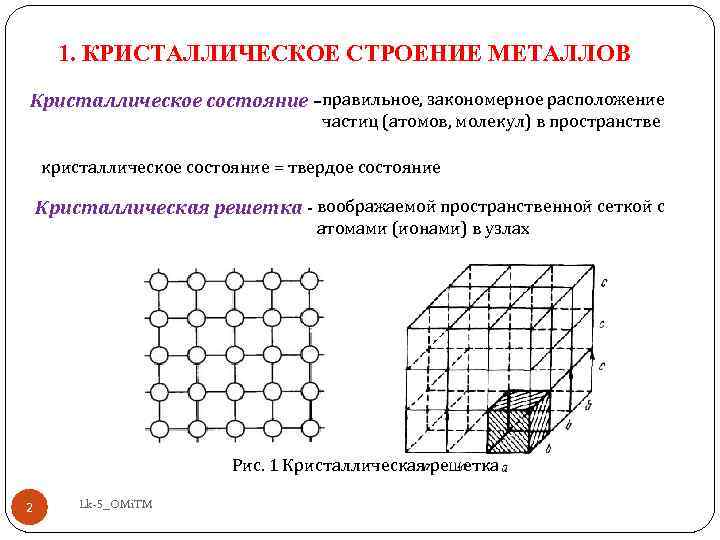 Тела, в которых
Тела, в которых
атомы расположены беспорядочно, называютаморфными(стекло, канифоль, воск,
смола и др.).Кристаллические тела(все металлы и металлические сплавы),
характеризуются упорядоченным
расположением атомов. В металлах и
металлических сплавах атомы находятся
в узлах пространственных кристаллических
решеток.
В процессе кристаллизации металлов и
сплавов могут образовываться
кристаллические решетки разного типа.
Наиболее распространенными являются
объемно-центрированная кубическая (рис.1, а) (К,V, Сr,Fеа, Мо,W),
гранецентрированная кубическая (рис.1,
б) (Аl,Fe, Ni, Сu,
Аg, Аu, Рb)
и гексагональная решетки(рис.1, а)
(Ве, Мg, Со,Zn,
Тi). Гранецентрированная
кубическая и гексагональная решетки
характеризуются наиболее плотной
упаковкой атомов и их компактным
размещением.
Расстояния между соседними атомами
в кристаллической решетке (параметр
решётки) Рис.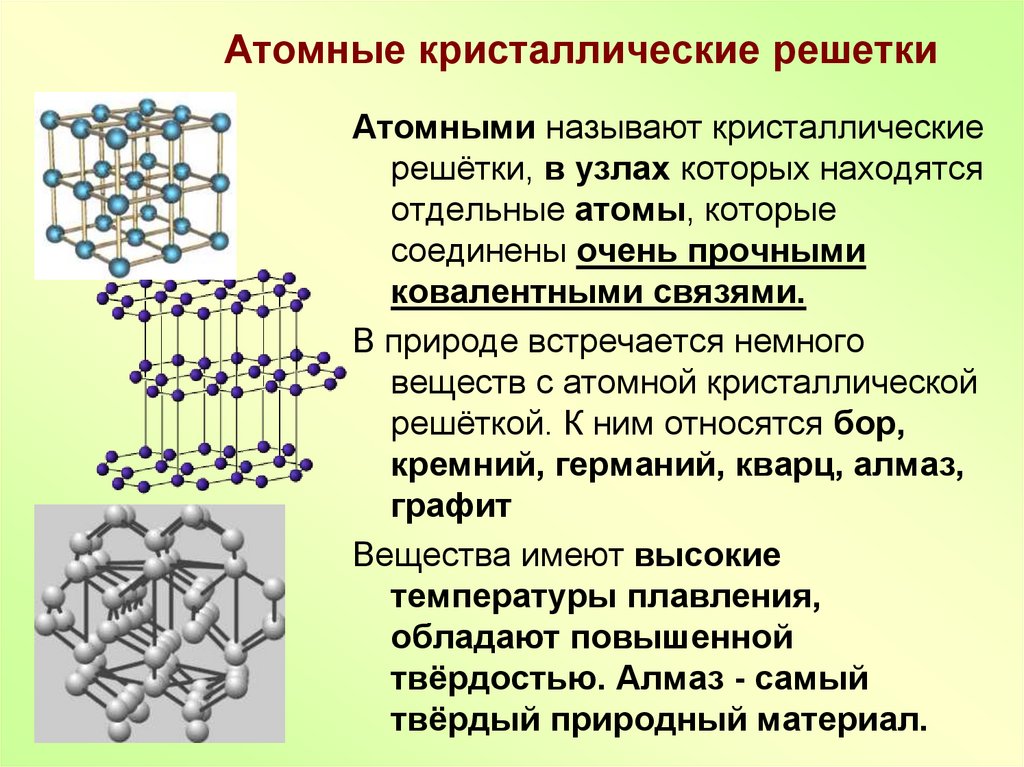 1
1
исключительно малы. Для их измерения
пользуются особой единицей — ангстремом
(А°), который равен 1А°=10-8см,
или нанометром (1 нм=10-9см).
2. Аллотропические превращения в металлах.
Некоторые металлы в твердом состоянии
(железо, марганец, кобальт и др.) в
зависимости от температуры нагрева
могут иметь кристаллические решетки
различного строения и, следовательно,
обладать различными свойствами. Это
явление называется аллотропией,
илиполиморфизмом.Кроме того,
известен полиморфизм под влиянием
температуры и давления. При нагреве до
2000 °С и давлении ~ 1010Па углерод в
форме графита перекристаллизовывается
в алмаз.
Аллотропические формы принято обозначать
буквами греческого алфавита: альфа,
бета, гамма и т. д.
К металлам, не претерпевающим
аллотропических превращений в твердом
состоянии при нагревании и охлаждении,
относятся алюминий, магний, медь и др.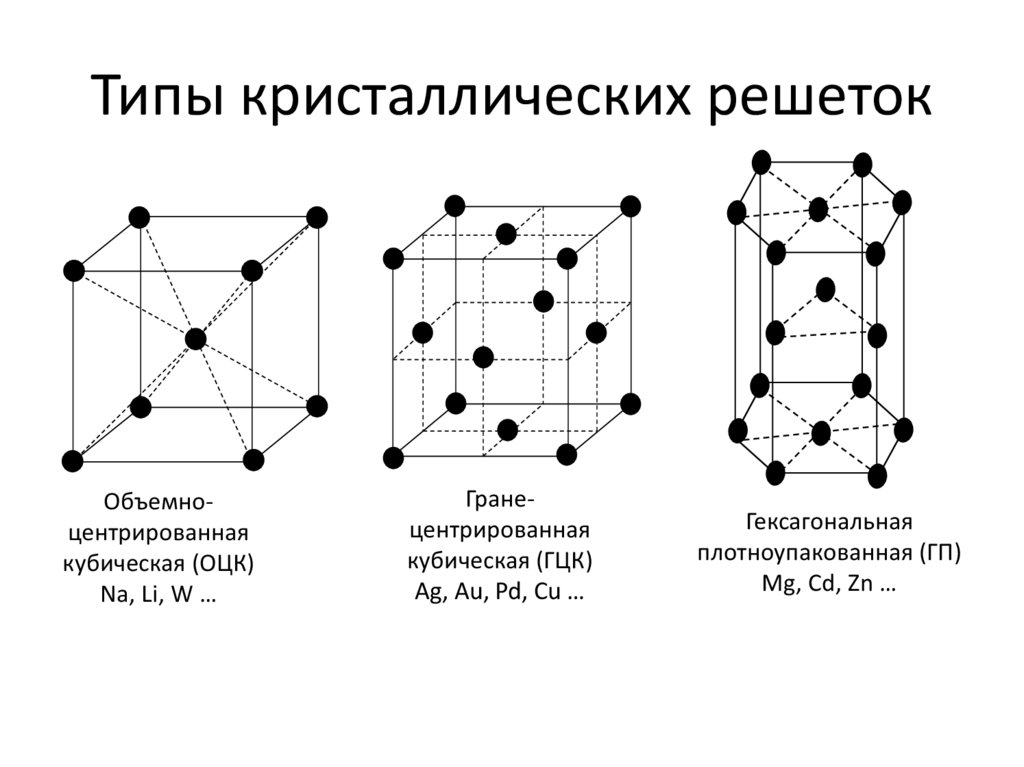
Большое число технически важных металлов
(олово, цинк, никель, кобальт и др.)
подвержено аллотропическим изменениям.
3. Процесс кристаллизации. Дефекты кристаллического строения.
Кристаллизациейназывается
образование кристаллов в металлах и
сплавах при переходе из жидкого состояния
в твёрдое (первичная кристаллизация),
а также перекристаллизация в твёрдом
состоянии (вторичная кристаллизация).
Процесс кристаллизации металла
складывается из двух элементарных
процессов: образования центров
кристаллизации (зародышей) и роста
кристаллов из этих центров. При температуре
кристаллизации в жидком металле сначала
образуются центры кристаллизации,
причем их роль играют разные примеси,
мельчайшие шлаковые и неметаллические
включения. После образования зародышей
атомы жидкого металла, расположенные
беспорядочно, начинают располагаться
вокруг этих зародышей и образуют
кристаллы правильной геометрической
формы. Так как кристаллизация начинается
одновременно во многих местах и рост
кристаллов идет по всем направлениям,
то смежные кристаллы, сталкиваясь между
собой, мешают свободному росту каждого.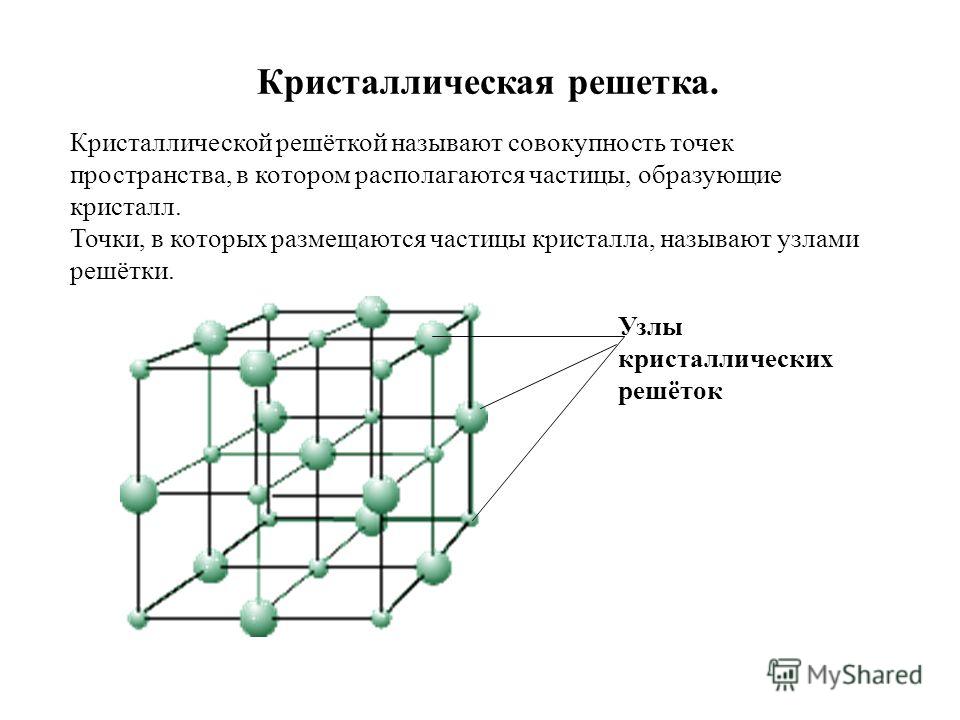
Это приводит к тому, что кристаллы
приобретают неправильную внешнюю форму,
несмотря на их упорядоченное внутреннее
строение. Кристаллы неправильной формы
принято называть кристаллитами,
полиэдрами, или зернами. Образовавшиеся
реальные кристаллы имеют те или иные
несовершенства (дефекты) кристаллического
строения, которые принято классифицировать
по характеру их измерения в пространстве
на точечные (нульмерные), линейные
(одномерные),
Рис. 2. Точечные дефекты в кристаллической
решетке:
а — вакансия; б — межузельный
атом; в — примесный атом внедрения
поверхностные (двухмерные), объемные
(трехмерные).
Наиболее распространены точечные. К
ним относят вакансии(узлы в
кристаллической решетке, свободные
от атомов),межузельные атомы (атомы,
находящиеся вне узлов кристаллической
решетки), а такжепримесные атомы(рис. 2).
2).
6.4: Кристаллические структуры металлов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 183327
- Химия 310
- Penn State University via Wikibook
Кристаллическая природа металлов
Все металлические элементы (кроме Cs, Ga и Hg) при комнатной температуре представляют собой твердые кристаллические вещества. Подобно ионным твердым телам, металлы и сплавы имеют очень сильную тенденцию к кристаллизации, независимо от того, получены ли они термической обработкой или другими методами, такими как восстановление в растворе или гальваническое покрытие. Металлы легко кристаллизуются, и трудно получить стекловидный металл даже при очень быстром охлаждении. Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Расплавленные металлы имеют низкую вязкость, и одинаковые (по существу, сферические) атомы могут очень легко упаковываться в кристалл. Однако стеклообразные металлы можно получить путем быстрого охлаждения сплавов, особенно если составляющие их атомы имеют разные размеры. Различные атомы не могут упаковаться в простую элементарную ячейку, что иногда делает кристаллизацию достаточно медленной для образования стекла.
Кубический корпус |
ГПУ (слева) и ГЦК (справа) плотная упаковка сфер |
Кристаллические структуры
Большинство металлов и сплавов кристаллизуются в одной из трех очень распространенных структур: объемно-центрированной кубической (ОЦК), гексагональной плотноупакованной (ГПУ) или кубической плотноупакованной (ГЦК, также называемой гранецентрированной кубической, ГЦК) ).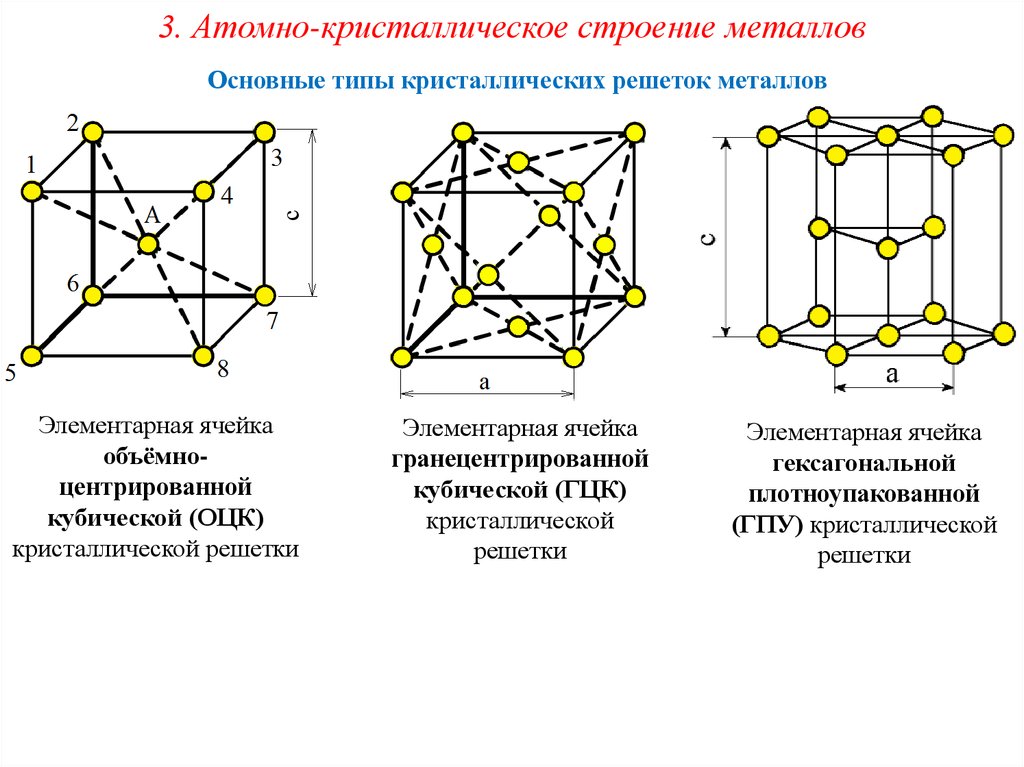 Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Во всех трех структурах координационное число атомов металла (т. е. число эквидистантных ближайших соседей) достаточно велико: 8 для ОЦК и 12 для ГПУ и ГПУ. Мы можем сравнить это с низкими координационными числами (то есть с низкими валентностями — например, 2 для O, 3 для N или 4 для C), обнаруженными у неметаллов. В ОЦК структуре ближайшие соседи находятся в углах куба, окружающего атом металла в центре. В ГПУ- и ПЦП-структурах атомы упаковываются подобно сложенным друг на друга пушечным ядрам или бильярдным шарам в слоях с шестикоординатным расположением. У каждого атома также есть еще шесть ближайших соседей из слоев выше и ниже. Последовательность укладки ABCABC… в решетке ccp и ABAB… в hcp. В обоих случаях можно показать, что сферы заполняют 74% объема решетки. Это наибольшая объемная доля, которой можно заполнить решетку из равных сфер.
Атомы в металлических кристаллах имеют тенденцию собираться в плотные структуры, которые эффективно заполняют пространство. Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Простая квадратная упаковка (выше), на которой основана простая кубическая структура, неэффективна и поэтому редко встречается среди металлических кристаллических структур. Структуры, ориентированные на тело или лицо, заполняют пространство более эффективно и чаще.
Периодические тенденции в структуре и поведении металлов
Вспомните, где мы находим металлические элементы в периодической таблице — везде, кроме правого верхнего угла. Это означает, что по мере того, как мы спускаемся по группе в р-блоке (скажем, группа IVA, группа углерода, или группа VA, группа азота), свойства элементов постепенно меняются от неметаллов к металлоидам и металлам. Углеродная группа прекрасно иллюстрирует этот переход. Начиная сверху, углерод имеет две стабильные аллотропные формы — графит и алмаз. В каждом из них валентность атомов углерода точно удовлетворяется за счет образования четырех электронных парных связей с соседними атомами. В графите у каждого атома углерода есть три ближайших соседа, поэтому имеется две одинарные связи и одна двойная связь.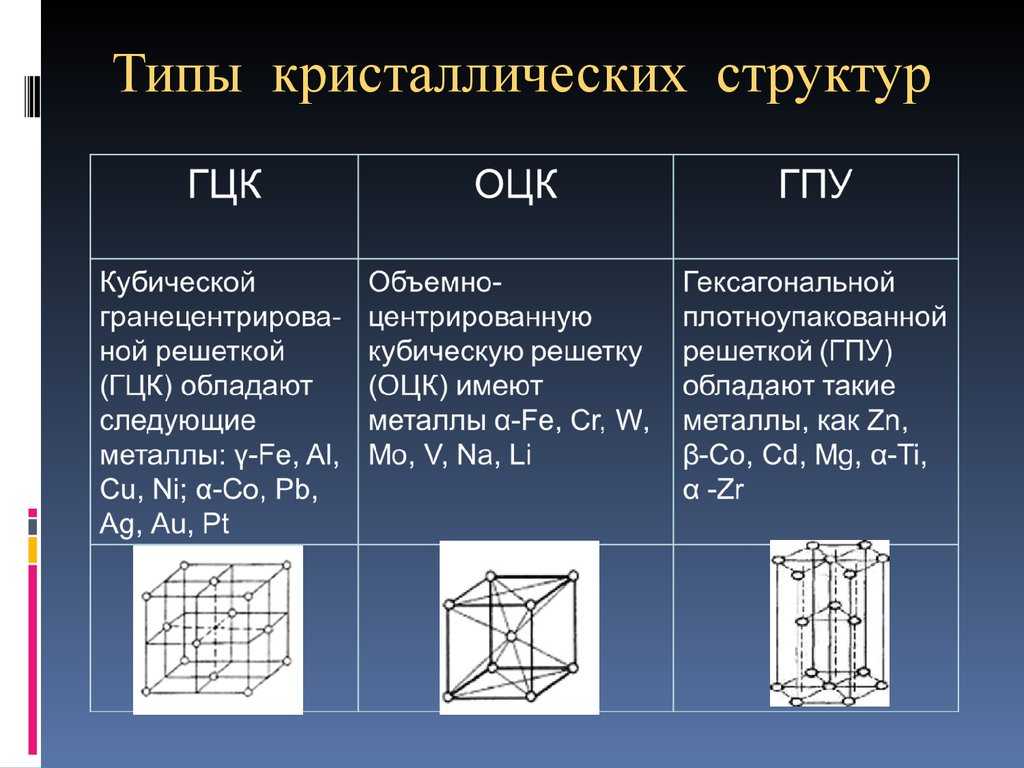 В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
В алмазе есть четыре ближайших соседа, расположенных в вершинах тетраэдра, и поэтому с каждым из них связана одинарная связь.
Два элемента, расположенные прямо под углеродом (кремний и германий) в периодической таблице, также имеют структуру алмаза (напомним, что эти элементы не могут легко образовывать двойные связи друг с другом, поэтому для Si или Ge не существует аллотропа графита). Хотя алмаз является хорошим изолятором, кремний и германий являются полупроводниками (то есть металлоидами). Механически они тверды, как алмаз. Подобно углероду, каждый атом Si и Ge удовлетворяет своей валентности, равной четырем, образуя одинарные связи с четырьмя ближайшими соседями.
Следующим элементом после германия является олово (Sn). Олово имеет две аллотропные формы: одну со структурой алмаза и одну со слегка искаженной ОЦК-структурой. Последний имеет металлические свойства (металлический блеск, ковкость) и проводимость примерно в 10 9 раз выше, чем Si. Наконец, свинец (Pb), элемент под Sn, имеет структуру ccp и также является металлическим.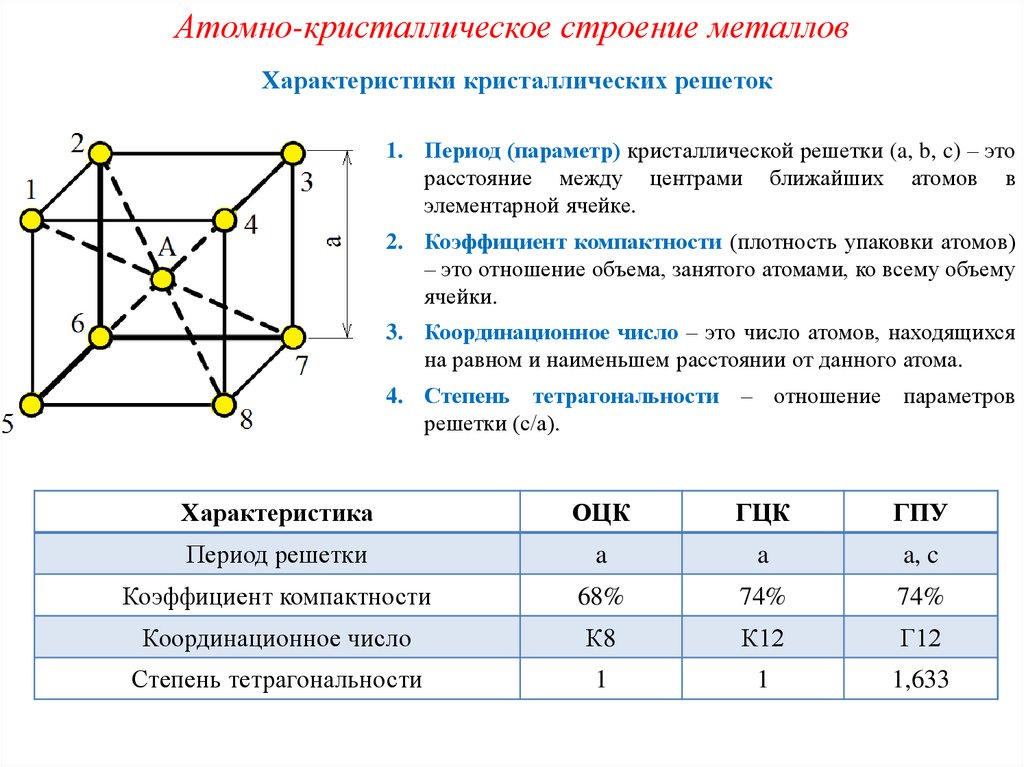 Обратите внимание на изменения координационного числа и проводящих свойств:
Обратите внимание на изменения координационного числа и проводящих свойств:
| Элемент | Структура | Координ. нет. | Проводимость |
|---|---|---|---|
| С | графит, алмаз | 3, 4 | полуметалл, изолятор |
| Си | алмаз | 4 | полупроводник |
| Ге | алмаз | 4 | полупроводник |
| Сн | алмаз, искаженный bcc | no.»> 4, 8 | полупроводник, металл |
| Пб | куб.см | 12 | металл |
Элементы C, Si и Ge подчиняются правилу октетов, и мы можем легко идентифицировать связи электронных пар в их структурах. Sn и Pb, с другой стороны, принимают структуры с высокими координационными числами. Они не имеют достаточного количества валентных электронов для создания электронных парных связей с каждым соседом (это общая черта металлов). В этом случае происходит то, что валентные электроны становятся «размазанными» или делокализованными по всем атомам в кристалле. Лучше всего думать о связи в металлах как о кристаллическом расположении положительно заряженных ядер с «морем» общих валентных электронов, склеивающих структуру. Поскольку электроны не локализованы в какой-либо конкретной связи между атомами, они могут двигаться в электрическом поле, поэтому металлы хорошо проводят электричество. Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Другой способ описать связь в металлах — ненаправленная. То есть ближайшие соседи атома окружают его во всех направлениях, а не в нескольких конкретных направлениях (как в углах тетраэдра, как мы обнаружили для алмаза). С другой стороны, неметаллы (изоляторы и полупроводники) имеют направленную связь. Поскольку связь является ненаправленной, а координационные числа высоки, относительно легко деформировать координационную сферу (т. Е. Разорвать или растянуть связи), чем в случае неметалла. Вот почему такие элементы, как Pb, гораздо более пластичны, чем C, Si или Ge.
Эта страница под названием 6.4: Кристаллические структуры металлов распространяется под лицензией CC BY-SA 4.0 и была создана, изменена и/или курирована Chemistry 310 (Wikibook) посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами Платформа LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Химия 310 Студенты
- Лицензия
- CC BY-SA
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- source@https://en.wikibooks.org/wiki/Introduction_to_Inorganic_Chemistry
Кристаллическая структура металлов
Алюминий и свинец – легкий, устойчивый к коррозии материал, обычно используемый в аэрокосмической промышленности; другой плотный, используется для блокировки рентгеновских лучей, токсичен для человека и является ужасным материалом для изготовления корпусов самолетов. Что может быть общего у этих двух невероятно разных металлов? Оба они имеют одинаковую атомно-кристаллическую структуру при комнатной температуре.
Реклама
Атомная структура металлов
Материалы состоят из множества атомных структур. Однако металлы, в частности, почти всегда имеют свои атомы, организованные в структуру кристаллической решетки. Это означает, что атомы металлов расположены в трехмерном порядке, который повторяется на больших участках металла. В группе кристаллической структуры есть ряд подгрупп, которые организуют форму этих кристаллических структур. Три наиболее распространенные кристаллические структуры в металле: гранецентрированная кубическая, объемноцентрированная кубическая и гексагональная плотноупакованная.
Это означает, что атомы металлов расположены в трехмерном порядке, который повторяется на больших участках металла. В группе кристаллической структуры есть ряд подгрупп, которые организуют форму этих кристаллических структур. Три наиболее распространенные кристаллические структуры в металле: гранецентрированная кубическая, объемноцентрированная кубическая и гексагональная плотноупакованная.
Гранецентрированная кубическая
Одной из наиболее распространенных кристаллических структур является гранецентрированная кубическая (ГЦК). Кристаллическая структура FCC получила свое название от формы куба и расположения атомов внутри этого куба. Есть восемь атомов, которые распределены между восемью углами кристаллической структуры. Каждый из этих восьми атомов также является частью других смежных кубических структур. В дополнение к атомам, расположенным по углам ГЦК-структуры, есть также шесть атомов, расположенных в центре каждой грани куба, отсюда и название гранецентрированной кубической.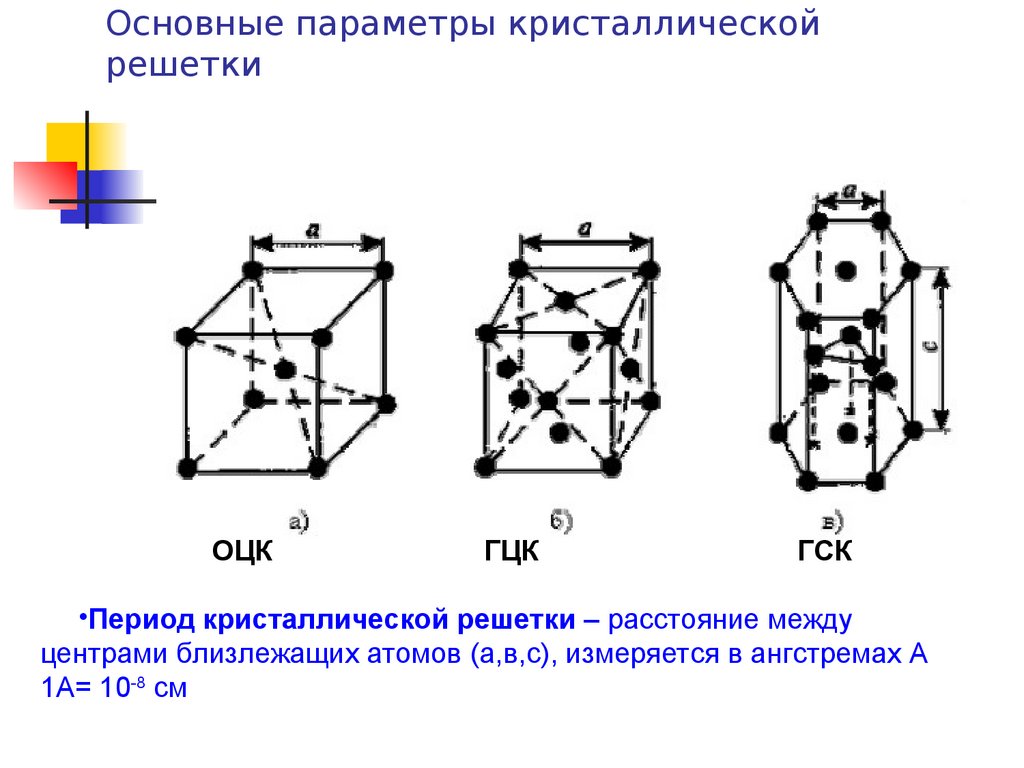
Реклама
Существует множество различных типов металлов с кристаллической структурой FCC. Два примера во введении, алюминий и свинец, представляют собой два металла, которые имеют структуру ГЦК при комнатной температуре. Никель и драгоценные металлы, такие как золото, платина и серебро, также имеют кристаллическую структуру FCC. Железо не имеет кристаллической структуры ГЦК при комнатной температуре, но при нагревании до определенной температуры типичная объемно-центрированная ферритная кубическая структура, обнаруженная в железе, начинает трансформироваться в аустенит, который действительно имеет кристаллическую структуру ГЦК. Добавление некоторых легирующих элементов (например, никеля) в сталь позволяет ей быть аустенитной и, следовательно, FCC при комнатной температуре. Примером этого является аустенитная нержавеющая сталь. (Подробнее читайте в статье Введение в нержавеющие стали.)
Объемно-центрированная кубическая
Объемно-центрированная кубическая (ОЦК) кристаллическая структура — еще один распространенный тип атомной структуры, встречающийся в металлах.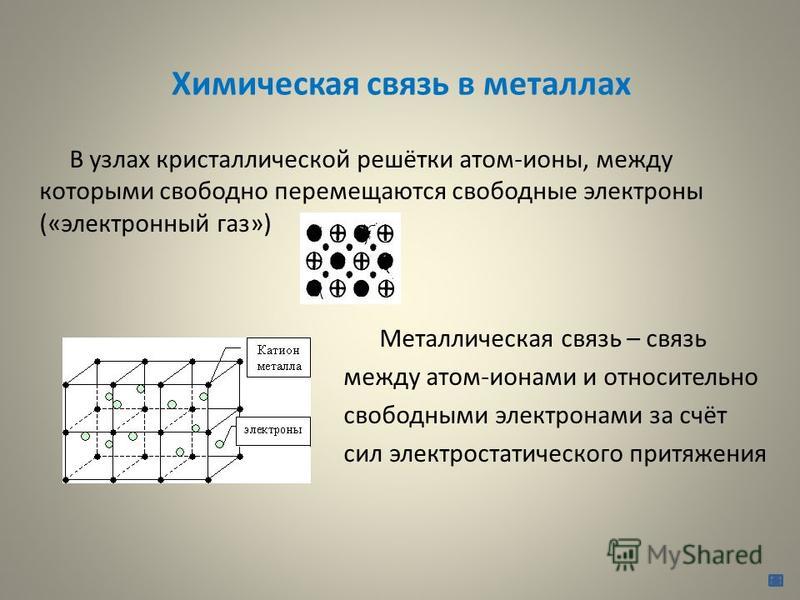 Как и кристаллическая структура FCC, кристаллическая структура BCC получила свое название из-за своей формы. Кристаллическая структура ОЦК имеет форму куба с восемью атомами, распределенными по восьми углам, подобно кристаллической структуре ГЦК. Отличие кристаллической структуры ОЦК состоит в том, что вместо того, чтобы иметь атом на каждой из шести граней, она имеет только один атом внутри куба. Этот атом находится в центре тела куба, что является причиной названия объемно-центрированного куба.
Как и кристаллическая структура FCC, кристаллическая структура BCC получила свое название из-за своей формы. Кристаллическая структура ОЦК имеет форму куба с восемью атомами, распределенными по восьми углам, подобно кристаллической структуре ГЦК. Отличие кристаллической структуры ОЦК состоит в том, что вместо того, чтобы иметь атом на каждой из шести граней, она имеет только один атом внутри куба. Этот атом находится в центре тела куба, что является причиной названия объемно-центрированного куба.
Многие металлы имеют кристаллическую структуру ОЦК. Как упоминалось ранее, железо в форме феррита является членом семейства металлов ОЦК. Также под зонтик кристаллической структуры ОЦК при комнатной температуре попадают ниобий, хром и ванадий. Калий, натрий, литий и другие щелочные металлы также обычно имеют кристаллическую структуру ОЦК.
Металлы с кристаллической структурой ОЦК обычно имеют меньшую прочность, чем металлы с кристаллической структурой ГЦК и ГПУ при комнатной температуре.
Реклама
Гексагональная плотная упаковка
Гексагональная плотная упаковка (ГПУ) представляет собой кристаллическую структуру, несколько более сложную, чем кристаллические структуры ГЦК и ОЦК. Если одну гексагональную плотноупакованную структуру отделить от других гексагональных плотноупакованных структур, примыкающих к ней, то она будет состоять из 17 атомов. В каждой вершине шестиугольника равномерно распределено шесть атомов. Дополнительные шесть атомов равномерно распределены по вершинам другого шестиугольника. Кроме того, в центре каждого из этих шестиугольников находится атом. Обе группы атомов в шестиугольниках выровнены друг с другом. Между этими двумя шестиугольниками зажата или упакована группа из трех атомов, которые не совпадают с атомами ни в одном из шестиугольников. Атомы в шестиугольниках являются общими с соседними структурами ГПУ.
Кристаллическая структура HCP встречается в нескольких различных металлах.