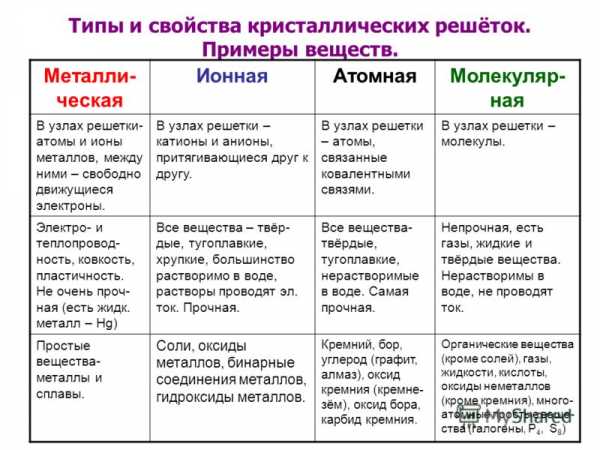
Кристаллическая решетка: понятие, виды, основные характеристики. Особенность строения кристаллической решетки металла твердость
Особенность - строение - кристаллическая решетка
Особенность - строение - кристаллическая решетка
Cтраница 1
Особенности строения кристаллической решетки играют существенную роль для характеристики качества диоксида марганца как активного вещества источника тока, катализатора, абсорбента, твердого электролита. [1]
Особенности строения кристаллической решетки играют - существенную роль для характеристики качества двуокиси марганца как активного вещества источников тока. Строение кристаллов определяют рентгенографическим способом. Расстояние между плоскостями в кристалле ( межплоскостные расстояния), измеряемые в ангстремах А, позволяют отнести образец к той или иной модификации. Расстояния между плоскостями в кристалле соответствуют промежутку между линиями на рентгенограмме. [3]
Особенность строения кристаллической решетки металлов заключается в том, что одни ее узлы заняты атомами, а другие положительными ионами. В промежутках между узлами перемещаются свободные электроны, образующие как бы электронный газ. Нахождение свободных электронов в металлических кристаллах обусловливают общие свойства металлов, их электро - и теплопроводность. Они же объясняют способность металлов к механической деформации. [5]
Особенности строения кристаллических решеток графита и алмаза приводят к заметному различию их физических и химических свойств. [6]
Ионная проводимость некоторых кристаллических тел - твердых электролитов - связана с особенностями строения кристаллической решетки и в отдельных случаях - с присутствием в ней чужеродных ионов. [7]
В настоящее время авторы многочисленных работ подтвердили, что все реакции углерода обусловлены особенностями строения кристаллической решетки графита. [9]
Высокая вязкость рассматриваемых сталей и сплавов и их значительное упрочнение в процессе обработки обусловлены особенностями строения кристаллической решетки жаропрочных материалов. Детали следует обрабатывать на мощных и жестких станках, с жестким закреплением детали и инструмента. Инструмент должен хорошо затачиваться. Нельзя применять чрезмерно малые подачи при обработке, так как из-за наклепа поверхностных слоев стойкость инструмента при малых подачах резко падает. Глубину резания также рекомендуется брать не ниже 0 3 - 0 5 мм. [10]
В [9] предложен механизм, связывающий изомеризацию АВК и юс реакции обмена с р-дикетонами и АВТ с особенностями строения кристаллической решетки. [11]
Поэтому можно предположить, что повышенная температура плавления га-хлоранилина но сравнению с температурой плавления тг-бромани-лина связана с особенностью строения кристаллической решетки последнего. [12]
Следует отметить, что наряду с конструкционной анизотропией композита существуют технологическая анизотропия, возникающая при пластической деформации изотропных материалов, и физическая анизотропия, присущая, например, кристаллам и связанная с особенностями строения кристаллической решетки. [13]
Диэлектрическая проницаемость углей зависит от степени их метаморфизма и имеет минимальное значение, что объясняется ростом электропроводимости у слабометаморфизованных углей за счет наличия в них полярных функциональных групп, а в антрацитах - за счет особенностей строения кристаллической решетки. Диэлектрическая проницаемость возрастает с повышением влажности. [14]
В минералах группы монтмориллонита связь между кремне-кислородными и гиббситовыми пакетами проходит по кислородным поверхностям и поэтому относительно слаба, она определяется ван-дер-ваальсовыми силами. Такая особенность строения кристаллической решетки позволяет молекулам воды и полярным органическим молекулам легко входить в межпакетное пространство, изменяя его размеры и вызывая набухание породы. Эти минералы характеризуются выраженными катионообменными свойствами, что проявляется в способности глины связывать определенно число катионов, причем одни из них могут быть частично или полностью заменены другими в эквивалентных количествах. Обменная емкость монтмориллонита - более 50Х Х10 - 5 моль / кг. Минералы группы монтмориллонита встречаются в глинистых породах палеогенового, мелового, юрского, пермского и каменноугольного возраста. В более ранних породах не обнаружены. [15]
Страницы: 1 2
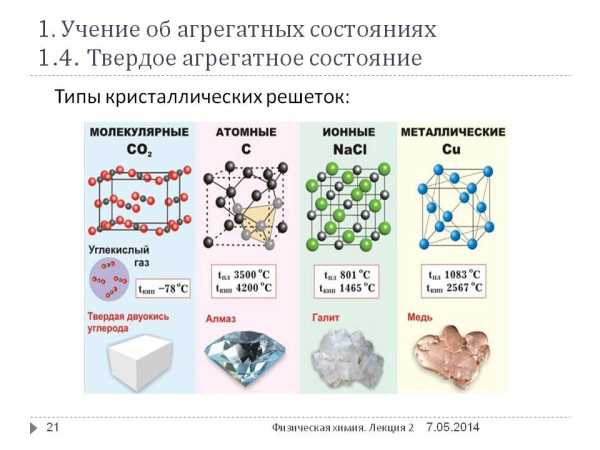
Кристаллическое строение металлов. Кристаллическая решетка металлов
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным - железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
Общее понятие о металлах
"Химия. 9 класс" - это учебник, по которому проходят обучение школьники. Именно в нем подробно изучаются металлы. Рассмотрению их физических и химических свойств отведена большая глава, ведь разнообразие их чрезвычайно велико.
Именно с этого возраста рекомендуют давать детям представление о данных атомах и их свойствах, ведь подростки уже вполне могут оценить значение подобных знаний. Они прекрасно видят, что окружающее их разнообразие предметов, машин и прочих вещей имеет в своей основе как раз металлическую природу.
Что же такое металл? С точки зрения химии, к данным атомам принято относить те, что имеют:
- малое число электронов на внешнем уровне;
- проявляют сильные восстановительные свойства;
- имеют большой атомный радиус;
- как простые вещества обладают рядом специфических физических свойств.
Основу знаний об этих веществах можно получить, если рассмотреть атомно-кристаллическое строение металлов. Именно оно объясняет все особенности и свойства данных соединений.
В периодической системе для металлов отводится большая часть всей таблицы, ведь они образуют все побочные подгруппы и главные с первой по третью группу. Поэтому их численное превосходство очевидно. Самыми распространенными являются:
- кальций;
- натрий;
- титан;
- железо;
- магний;
- алюминий;
- калий.
Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет именно кристаллическое строение металлов.

Свойства металлов
К специфическим свойствам рассматриваемых веществ относят следующие.
- Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
- Ковкость и пластичность - способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
- Электропроводность и теплопроводность - одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.

Атомно-кристаллическое строение металлов
В чем же заключается такое строение, чем характеризуется? Само название говорит о том, что все металлы представляют собой кристаллы в твердом состоянии, то есть при обычных условиях (кроме ртути, которая является жидкостью). А что такое кристалл?
Это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится красивое изображение в виде правильного геометрического тела какой-либо формы.
Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки. Химия, физика и металловедение - это науки, которые занимаются изучением особенностей строения таких структур.
Сама элементарная ячейка - это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства.
Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность - в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Типы кристаллических решеток
Четырнадцать вариантов строения решетки принято объединять в три основных типа. Они следующие:
- Объемно-центрированная кубическая.
- Гексагональная плотноупакованная.
- Гранецентрированная кубическая.
Кристаллическое строение металлов было изучено только благодаря электронной микроскопии, когда стало возможным получать большие увеличения изображений. А классификацию типов решеток впервые привел французский ученый Браве, по фамилии которого их иногда называют.

Объемно-центрированная решетка
Строение кристаллической решетки металлов данного типа представляет собой следующую структуру. Это куб, в узлах которого находится восемь атомов. Еще один располагается в центре свободного внутреннего пространства ячейки, что и объясняет название "объемно-центрированная".
Это один из вариантов наиболее простого строения элементарной ячейки, а значит, и всей решетки в целом. Такой тип имеют следующие металлы:
- молибден;
- ванадий;
- хром;
- марганец;
- альфа-железо;
- бетта-железо и другие.
Основные свойства таких представителей - высокая степень ковкости и пластичности, твердость и прочность.
Гранецентрированная решетка
Кристаллическое строение металлов, имеющих гранецентрированную кубическую решетку, представляет собой следующую структуру. Это куб, который включает в свой состав четырнадцать атомов. Восемь из них формируют узлы решетки, а еще шесть расположены по одному на каждой грани.
Подобную структуру имеют:
- алюминий;
- никель;
- свинец;
- гамма-железо;
- медь.
Основные отличительные свойства - блеск разного цвета, легкость, прочность, ковкость, повышенная устойчивость к коррозии.

Гексагональная решетка
Кристаллическое строение металлов, обладающих данным типом решетки, следующее. В основе элементарной ячейки лежит шестигранная призма. В ее узлах располагается 12 атомов, еще два по основаниям и три атома свободно лежат внутри пространства в центре структуры. Всего семнадцать атомов.
Подобную сложную конфигурацию имеют такие металлы, как:
- альфа-титан;
- магний;
- альфа-кобальт;
- цинк.
Основные свойства - высокая степень прочности, сильный серебристый блеск.
Дефекты кристаллического строения металлов
Однако все рассмотренные типы ячеек могут иметь и естественные недостатки, или так называемые дефекты. Это может быть связано с разными причинами: посторонними атомами и примесями в металлах, внешними воздействиями и прочим.
Поэтому существует классификация, отражающая дефекты, которые могут иметь кристаллические решетки. Химия как наука изучает каждый из них с целью выявления причины и способа устранения, чтобы свойства материала не были изменены. Итак, дефекты следующие.
- Точечные. Они бывают трех основных видов: вакансии, примеси или дислоцированные атомы. Приводят к ухудшению магнитных свойств металла, электро- и теплопроводности его.
- Линейные, или дислокационные. Выделяют краевые и винтовые. Ухудшают прочность и качество материала.
- Поверхностные дефекты. Влияют на внешний вид и структуру металлов.
В настоящее время разработаны методики устранения дефектов и получения чистых кристаллов. Однако совсем искоренить их не удается, идеальной кристаллической решетки не существует.

Значение знаний о кристаллическом строении металлов
Из вышеизложенного материала очевидно, что знания о тонкой структуре и строении позволяют спрогнозировать свойства материала и повлиять на них. И это позволяет делать наука химия. 9 класс общеобразовательной школы делает в процессе обучения упор на то, чтобы сформировать у учащихся четкое понятие о важном значении основополагающей логической цепочки: состав - строение - свойства - применение.
Сведения о кристаллическом строении металлов очень четко иллюстрирует эту зависимость и позволяет учителю наглядно объяснить и показать детям, насколько важно знать тонкую структуру, чтобы правильно и грамотно использовать все свойства.
загрузка...
4responsible.ru
Реальное строение металлов и дефекты кристаллических решеток
Строение реальных кристаллов отличается от строения идеальных. В реальных кристаллах всегда содержатся дефекты, которые по своим размерам подразделяются на точечные, линейные, поверхностные и объемные.
К точечным дефектам относятся вакансии, межузельные атомы основного вещества, чужеродные атомы внедрения (рис. 1.5).Все виды точечных дефектов искажают кристаллическую решетку и в определенной мере влияют на физические свойства металла (электропроводность, магнитные свойства и др.), а также на фазовые превращения в металлах и сплавах.
Вакансией называется пустой узел кристаллической решетки, т. е. место, где по той или иной причине отсутствуют атомы (рис. 1.5, а). Межузельный атом – атом, перемещенный из узла в позицию между узлами (рис. 1.5, б).
Атомы внедрения – это атомы, находящиеся в междоузлиях кристаллической решетки (рис. 1.5, в, б, г).
Вакансии и межузельные атомы появляются в кристаллах из-за тепловых колебаний атомов при любой температуре выше абсолютного нуля. Каждой температуре соответствует равновесная концентрация вакансий, а также межузельных атомов. Влияние этих дефектов на прочность металла может быть различным в зависимости от их количества в единице объема и характера.
Рис. 1.5. Точечные дефекты в кристаллической решетке
Присутствие вакансий объясняет возможность диффузии – перемещения атомов на расстояния, превышающие средние межатомные расстояния для данного металла. Вакансии являются самой важной разновидностью точечных дефектов, они ускоряют все процессы, связанные с перемещениями атомов (диффузия, спекание порошков и т. д.). Увеличение количества вакансий ведет к уменьшению плотности материала.
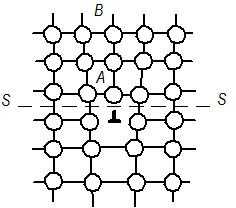
Линейные несовершенства имеют малые размеры в двух измерениях и большую протяженность в третьем измерении. Важнейшие виды линейных несовершенств – краевые и винтовые дислокации. Образуются дислокации в результате локальных или местных смещений кристаллографических плоскостей, происходящих в кристаллической решетке зерен на различных технологических этапах их формирования. Наиболее распространенной является краевая дислокация (рис. 1.6, б). Она представляет собой локализованное искажение кристаллической решетки, вызванное наличием атомной полуплоскости или экстраплоскости АВ.
 | |
| а) | б) |
Рис. 1.6. Схема образования краевой дислокации в идеальном кристалле (а)
и расположение атомов в плоскости, перпендикулярной линии дислокации
в кристаллической решетке (б)
Линию атомов нижней границы экстраплоскости АА' (рис. 1.6, а) принято называть дислокацией. Дислокацию обозначают знаком ┴ или ┬ (экстраплоскости в верхней или нижней части зерна – положительная или отрицательная). Различие между положительной и отрицательной дислокациями чисто условное. Вокруг дислокаций решетка упруго искажена. Мерой искажения служит так называемый вектор Бюргерса. Он получается, если обойти замкнутый контур в идеальном кристалле (рис. 1.7), переходя от узла к узлу, а затем этот же путь повторить в реальном кристалле, заключив дислокацию внутрь контура. Отрезок АЕ, по модулю равный параметру решетки, принято считать вектором Бюргерса. Он перпендикулярен линии дислокации.
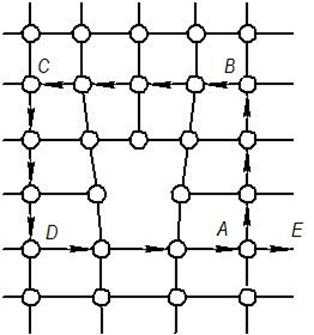
Рис. 1.7. Схема определения вектора Бюргерса
Дислокации возникают при кристаллизации, плотность их большая, поэтому они значительно влияют на свойства материалов, наряду с другими дефектами участвуют в фазовых превращениях. Они обладают высокой подвижностью, поэтому существенно уменьшают прочность металла, так как облегчают образование сдвигов в кристаллах под действием приложенных напряжений. Для оценки этого влияния используется плотность дислокаций ρ, под которой принято понимать отношение суммарной длины дислокаций к объему содержащего их металла. Плотность дислокаций измеряется в сантиметрах в минус второй степени (см−2) или метрах в минус второй степени (м−2).
Дислокации служат местом концентрации примесных атомов. Примесные атомы образуют вокруг дислокации зону повышенной концентрации – так называемую атмосферу Коттрела, которая мешает движению дислокаций и упрочняет металл.
Поверхностные дефекты. Наиболее важными являются большеугловые и малоугловые границы, дефекты упаковки, границы двойников.
Поликристаллический сплав содержит огромное число мелких зерен. В соседних зернах решетки ориентированы различно (рис. 1.8) и граница между зернами представляет собой переходный слой шириной 1–5 нм. В нем нарушена правильность расположения атомов, имеются скопления дислокаций, повышена концентрация примесей. Границы между зернами называются большеугловыми, так как соответственные кристаллографические направления в соседних зернах образуют узлы в десятки градусов (рис. 1.8, а).
 | |
| а) | б) |
Рис. 1.8. Схемы строения большеугловых (а) и малоугловых (б) границ зерна
Каждое зерно, в свою очередь, состоит из субзерен. Субзерно представляет собой часть кристалла относительно правильного строения, а его границы – стенки дислокаций, которые разделяют зерно на отдельные субзерна (рис. 1.8, б). Угол взаимной разориентации между соседними субзернами невелик (не более 5 %), поэтому такие границы называются малоугловыми.
Дефект упаковки представляет собой часть атомной плоскости, ограниченную дислокациями, в пределах которой нарушен нормальный порядок чередования атомных слоев.
Двойники. Двойникованием называют симметричную переориентацию областей кристаллической решетки. Решетка внутри двойниковой прослойки является зеркальным отображением решетки в остальной части кристалла (рис. 1.9).
Поверхностные дефекты влияют на механические и физические свойства материалов. Особенно большое значение имеют большеугловые границы зерен. Предел текучести σT связан с размером зерен зависимостью: σT = σ0 + κd–1/2, где σ0 и κ – постоянные для данного материала. То есть можно сделать вывод, что поверхностные дефекты способствуют повышению прочности металла. Чем мельче зерно, тем выше предел текучести, вязкость и меньше опасность хрупкого разрушения. Поэтому создано несколько технологических способов получения мелкозернистых сплавов.
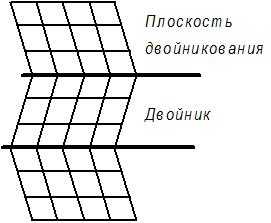 |  |
| а) | б) |
Рис. 1.9. Схема двойникования (а) и двойникование в реальном кристалле (б)
Объемные дефекты (пустоты, поры, трещины и включения) имеют значительные размеры во всех трех направлениях.Наличие данных дефектов, уменьшая плотность металла, снижает его прочность.
Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения, создаваемые в металле рабочими нагрузками. Последнее обстоятельство наиболее существенно влияет на прочность металла.
Строение сплавов
Сплавы – важные вещества, получаемые сплавлением или спеканием двух или нескольких элементов Периодической системы, называемых компонентами. Сплавы также образуются при диффузии атомов металла или неметалла в поверхностный слой металлической детали. Сплав считается металлическим, если его основу (свыше 50 % по массе) составляют металлические компоненты. Металлические сплавы обладают более высокими прочностными и другими механическими свойствами по сравнению с чистыми металлами.
В зависимости от природы сплавляемых компонентов сплавы, взаимодействуя друг с другом, могут образовать различные по строению и свойствам продукты. Характер взаимодействия компонентов при сплавлении зависит от их положения в таблице Д. И. Менделеева, особенностей строения электронных оболочек их атомов, типов и параметров их кристаллических решеток, соотношения температур их плавления, атомных диаметров и других факторов.
Компоненты при сплавлении могут образовывать смеси зерен с пренебрежимо ничтожной взаимной растворимостью, неограниченно или частично растворяться друг в друге, а также образовывать химические соединения.
Смесь образуется при взаимодействии компонентов, не способных к взаимному растворению в твердом состоянии и не вступающих в химическую реакцию с образованием соединения (рис. 1.10). В этих условиях сплав состоит из чистых зерен обоих компонентов А и В, сохраняющих присущие им типы кристаллических решеток и прочностные свойства. Механические свойства таких сплавов зависят от количественного соотношения компонентов, от размеров и формы зерен и соединения их границ.
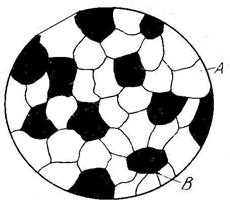
Рис. 1.10. Микроструктура смеси (схема)
Химическое соединение представляет собой зерна со специфической кристаллической решеткой, отличной от решеток обоих компонентов. При образовании химического соединения соотношение чисел атомов элементов соответствует стехиометрической пропорции, что выражается формулой АпВт, – связь между атомами в них сильнее и жестче металлической. Поэтому они являются очень твердыми и хрупкими веществами. Химическое соединение характеризуется определенной температурой плавления и скачкообразным изменением свойств.
Если химическое соединение образуется только металлическими элементами, то в узлах решеток располагаются положительно заряженные ионы, удерживаемые электронным газом, и возникает металлическая связь.
При образовании химического соединения металла с неметаллом возникает ионная связь. В результате взаимодействия элементов в этом случае атом металла отдает электроны (валентные) и становится положительным ионом, а атом металлоида принимает электроны на свою внешнюю оболочку и становится отрицательным ионом. В решетке химического соединения такого типа элементы удерживаются электростатическим притяжением.
Если образующиеся в сплавах химические соединения оказываются стойкими веществами, не диссоциирующими при нагреве вплоть до температуры плавления, и имеют широкую область существования, то их принято рассматривать в качестве самостоятельных компонентов, способных образовывать твердые растворы с компонентами сплава.
Твердый раствор образуется при растворении компонентов друг в друге, является однофазным, состоит из одного вида кристаллов, имеет одну кристаллическую решетку и существует в интервале концентраций. Обозначаются твердые растворы буквами греческого алфавита: α, β, γ и т. д.
При образовании твердого раствора сохраняется решетка одного из компонентов. В этом случае компонент называется растворителем.
Атомы растворенного вещества искажают и изменяют средние размеры элементарной ячейки растворителя. Если атомы растворенного компонента В замещают в узлах решетки атомы компонента-растворителя А, то образующийся раствор называется твердым раствором замещения. Твердые растворы замещения могут быть ограниченные и неограниченные. Неограниченные твердые растворы образуются, если компоненты имеют одинаковую кристаллическую решетку и одинаковый атомный радиус. Ограниченные твердые растворы образуются, если компоненты имеют одинаковую кристаллическую решетку, а атомные радиусы разнятся.
При образовании твердых растворов внедрения атомы растворенного вещества С располагаются между атомами А в кристаллической решетке растворителя. Следовательно, диаметр атома С должен быть невелик, а внутри решетки металла А должно быть достаточное пространство для атома С (рис. 1.11). Искажения решетки при образовании твердых растворов внедрения больше, чем при образовании твердых растворов замещения, поэтому у них более резко изменяются свойства.
Рис. 1.11. Кристаллическая решетка ОЦК:
а – неограниченный твердый раствор замещения; б – ограниченный твердый раствор замещения; в – твердый раствор внедрения
Образование твердых растворов сопровождается увеличением твердости и прочности, уменьшением температурного коэффициента электрического сопротивления, пластичности (исключение составляют твердые растворы на основе меди) по сравнению с чистыми металлами.
В сплавах, содержащих более двух элементов, возможно растворение в одном и том же растворителе и путем замещения, и путем внедрения. Например, при сплавлении железа с марганцем и углеродом получается твердый раствор, в котором марганец растворяется путем замещения, а углерод – путем внедрения.
1.5.Основные закономерности процесса кристаллизации,
Похожие статьи:
poznayka.org
понятие, виды, основные характеристики :: SYL.ru
Металлы и их значение для человеческой цивилизации
С древнейших времен металлы играют огромную роль в развитии человечества. Внедрение их в повседневную жизнь произвело настоящую революцию как в способах обработки материалов, так и в восприятии человеком окружающей действительности. Современная промышленность и сельское хозяйство, транспорт и инфраструктура невозможны без применения металлов, использования их полезных качеств и свойств. Эти качества, в свою очередь, определяются внутренней структурой данного класса химических соединений, в основе которой лежит кристаллическая решетка.
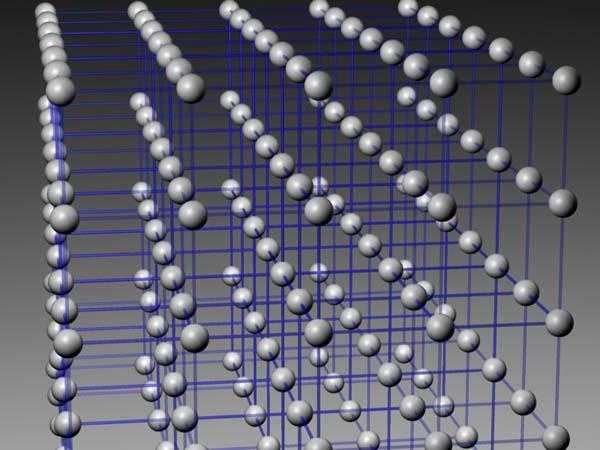
Понятие и сущность кристаллической решетки
С точки зрения внутреннего устройства любое вещество может находиться в одном из трех состояний – жидком, газообразном и твердом. При этом именно последнее характеризуется наибольшей устойчивостью, что обусловлено тем, что кристаллическая решетка подразумевает не только четкое расположение атомов или молекул в строго определенных местах, но и необходимость приложения достаточно большой силы, чтобы связи между этими элементарными частицами разорвать.
Особенности ионной решетки
Структура любого вещества, находящегося в твердом состоянии, обязательно предполагает периодическую повторяемость молекул и атомов сразу в трех измерениях. При этом в зависимости от того, что находится в узловых пунктах, кристаллическая решетка может быть ионной, атомной, молекулярной и металлической. Что касается первой разновидности, то здесь базовыми компонентами служат разнополярно заряженные ионы, между которыми возникают и действуют так называемые кулоновские силы. При этом сила взаимодействия находится в прямой зависимости от радиусов заряженных частиц.

Металлическая кристаллическая решетка
Такая решетка представляет собой сложную систему, состоящую из катионов металла, в пространстве между которыми перемещаются отрицательно заряженные электроны. Именно наличие этих элементарных частиц придает решетке устойчивость и твердость, ибо они служат своеобразными компенсаторами для положительно заряженных катионов.
Сила и слабость атомной решетки
Достаточно интересной с точки зрения строения является атомная кристаллическая решетка. Уже из названия можно сделать вывод, что в ее узлах располагаются атомы, удерживающиеся за счет ковалентных связей. Многие ученые в последние годы относят данный тип взаимодействия к семейству неорганических полимеров, так как строение данной молекулы во многом определяется валентностью входящих в ее состав атомов.
Основные характеристики молекулярной решетки
Молекулярная кристаллическая решетка является наименее устойчивой из всех представленных. Все дело в том, что уровень взаимодействия находящихся в ее узлах молекул крайне низкий, а энергетический потенциал определяется целым рядом факторов, основную роль в которых играют дисперсионные, индукционные и ориентационные силы.
Влияние кристаллической решетки на свойства объектов
Таким образом, кристаллическая решетка во многом определяет свойства того или иного вещества. Например, атомные кристаллы плавятся при чрезвычайно высокой температуре и обладают повышенной твердостью, а вещества с металлической решеткой являются прекрасными проводниками электрического тока.
www.syl.ru
Кристаллическая решетка
Твердые кристаллы можно представить как трехмерные конструкции, в которых четко повторяется один и тот же элемент структуры во всех направлениях. Геометрически правильная форма кристаллов обусловлена их строго закономерным внутренним строением. Если центры притяжения атомов, ионов или молекул в кристалле изобразить в виде точек, то получим трехмерное регулярное распределение таких точек, которое называется кристаллической решеткой, а сами точки — узлы кристаллической решетки. Определенная внешняя форма кристаллов является следствием их внутренней структуры, которая связана именно с кристаллической решеткой.
Кристаллическая решетка — это воображаемый геометрический образ для анализа строения кристаллов, который представляет собой объемно-пространственную сетчатую структуру, в узлах которой располагаются атомы, ионы или молекулы вещества.
Для характеристики кристаллической решетки используют следующие параметры:
- Энергия кристаллической решетки Екр [КДж / моль] — это энергия, выделяющаяся при образовании 1 моля кристалла из микрочастиц (атомов, молекул, ионов), которые находятся в газообразном состоянии и удалены друг от друга на такое расстояние, что исключается возможность их взаимодействия.
- Константа кристаллической решетки d [A0] — наименьшее расстояние между центрами двух частиц в соседних узлах кристаллической решетки, соединенных химической связью.
- Координационное число — количество ближайших частиц, окружающих в пространстве центральную частицу и сочетаются с ней химической связью.
Основой кристаллической решетки является элементарная ячейка, которая повторяется в кристалле бесконечное количество раз.
Элементарная ячейка — это наименьшая структурная единица кристаллической решетки, которая обнаруживает все свойства ее симметрии.
Упрощенно элементарную ячейку можно определить как малую часть кристаллической решетки, которая еще выявляет характерные особенности ее кристаллов. Признаки элементарной ячейки описываются с помощью трех правил Бреве :
- симметрия элементарной ячейки должна соответствовать симметрии кристаллической решетки;
- элементарная ячейка должна иметь максимальное количество одинаковых ребер а, b , с и одинаковых углов между ними a , b , g . ;
- при условии соблюдения первых двух правил элементарная ячейка должна занимать минимальный объем.
Для описания формы кристаллов используют систему трех кристаллографических осей а, b, с, которые отличаются от обычных координатных осей тем, что они являются отрезками определенной длины, углы между которыми a, b, g могут быть как прямыми, так и непрямыми.
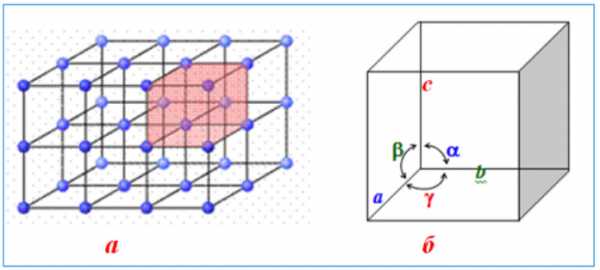 Модель кристаллической структуры: а) кристаллическая rратка с выделенной элементарной ячейкой; б) элементарная ячейка с обозначениями гранных углов
Модель кристаллической структуры: а) кристаллическая rратка с выделенной элементарной ячейкой; б) элементарная ячейка с обозначениями гранных угловФорму кристалла изучает наука геометрическая кристаллография, одним из основных положений которой является закон постоянства гранных углов: для всех кристаллов данного вещества углы между соответствующими гранями всегда остаются одинаковыми.
Если взять большое количество элементарных ячеек и заполнить ими плотно друг к другу определенный объем, сохраняя параллельность граней и ребер, то образуется монокристалл идеальной строения. Но на практике чаще всего встречаются поликристаллов, в которых регулярные структуры существуют в определенных пределах, по которым ориентация регулярности резко меняется.
В зависимости от соотношения длин ребер а, b, с и углов a, b, g между гранями элементарной ячейки различают семь систем — так называемых сингоний кристаллов. Однако элементарная ячейка может быть построенной и таким образом, что она имеет дополнительные узлы, которые размещаются внутри ее объема или на всех ее гранях — такие решетки называются соответственно объемноцентрированными и гранецентрированными. Если дополнительные узлы находятся только на двух противоположных гранях (верхний и нижний), то это базоцентрированная решетка. С учетом возможности дополнительных узлов существует всего 14 типов кристаллических решеток.
Внешняя форма и особенности внутреннего строения кристаллов определяются принципом плотной «упаковки» : наиболее устойчивой, а потому и наиболее вероятной структурой будет такая, которая соответствует наиболее плотному расположению частиц в кристалле и в которой остается наименьшее по объему свободное пространство.
Типы кристаллических решеток
В зависимости от природы частиц, содержащихся в узлах кристаллической решетки, а также от природы химических связей между ними, различаются четыре основных типа кристаллических решеток.
Ионные решетки
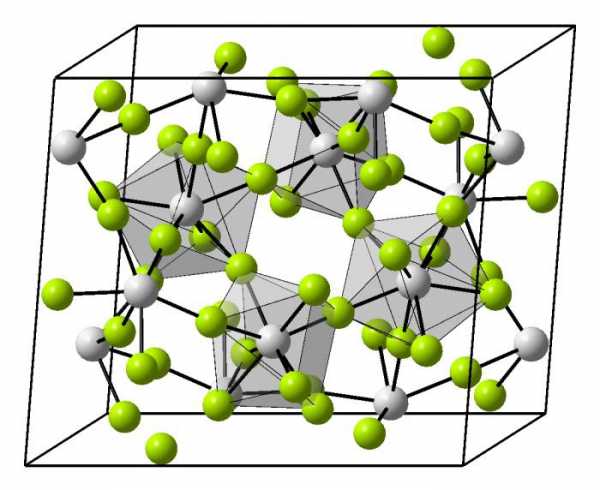
Ионные решетки построены из разноименных ионов, расположенных в узлах решетки и связанные силами электростатического притяжения. Поэтому структура ионной кристаллической решетки должна обеспечить ее электронейтральность. Ионы могут быть простыми (Na+, Cl— ) или сложными (Nh5+, NO3—). Вследствие ненасыщенности и ненаправленности ионной связи ионные кристаллы характеризуются большими координационными числами. Так, в кристаллах NaCl координационные числа ионов Na+ и Cl— равна 6, а ионов Cs+ и Cl— в кристалле CsCl — 8, поскольку один ион Cs+ окружен восемью ионами Cl—, а каждый ион — Cl — соответственно восемью ионами Cs+. Ионные кристаллические решетки образуются большим количеством солей, оксидов и оснований.
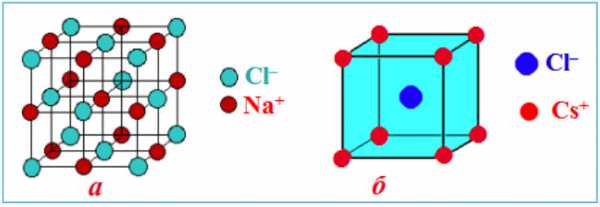 Примеры ионных кристаллических решеток: а) NaCl; б) CsCl
Примеры ионных кристаллических решеток: а) NaCl; б) CsClВещества с ионными кристаллическими решетками имеют сравнительно высокую твердость, они достаточно тугоплавкие, нелетучие. В отличие от металлов ионные соединения очень хрупкие, поэтому даже небольшой сдвиг в кристаллической решетке приближает друг к другу одноименно заряженные ионы, отталкивания между которыми приводит к разрыву ионных связей и как следствие — к появлению в кристалле трещин или к его разрушению. В твердом состоянии вещества с ионной кристаллической решеткой относятся к диэлектрикам и не проводят электрический ток. Однако при расплавлении или растворении в полярных растворителях нарушается геометрически правильная ориентировка ионов относительно друг друга, сначала ослабляются, а затем разрушаются химические связи, поэтому меняются и свойства. Как следствие, электрический ток начинают проводить как расплавы ионных кристаллов, так и их растворы.
Атомные решетки
Эти решетки построены из атомов, соединенных между собой ковалентной связью. Они, в свою очередь, делятся на три типа: каркасные, слоистые и цепочечные структуры.
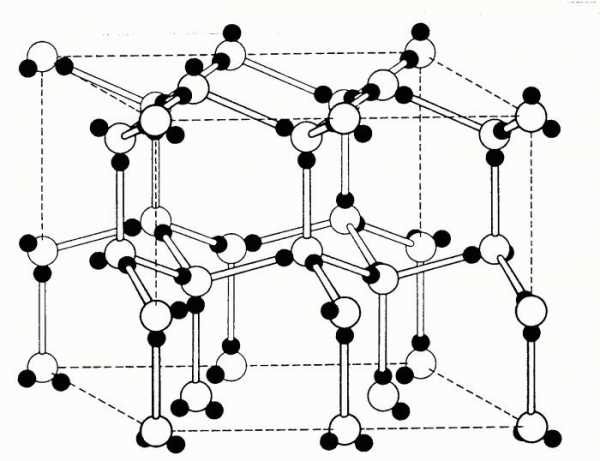
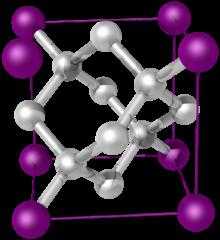
Каркасную структуру имеет, например, алмаз — одно из самых твердых веществ. Благодаря sp3 -гибридизации атома углерода строится трехмерная решетка, которая состоит исключительно из атомов углерода, соединенных ковалентными неполярными связями, оси которых размещаются под одинаковыми валентными углами (109,5o).
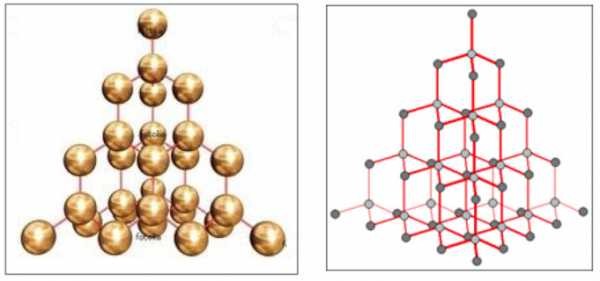 Каркасная структура атомной кристаллической решетки алмаза
Каркасная структура атомной кристаллической решетки алмазаСлоистые структуры можно рассматривать как огромные двумерные молекулы. Для слоистых структур присущи ковалентные связи внутри каждого слоя и слабое вандерваальсовское взаимодействие между соседними слоями.
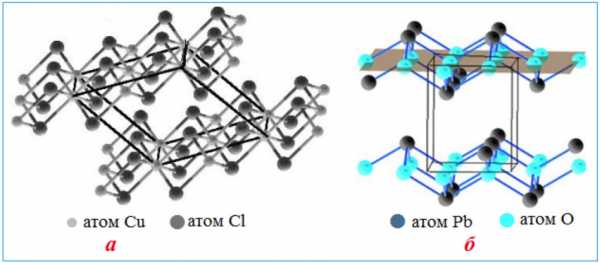 Слоистые структуры атомных кристаллических решеток: а) CuCl2 ; б) PbO. На моделях с помощью очертаний параллелепипедов выделены элементарные ячейки
Слоистые структуры атомных кристаллических решеток: а) CuCl2 ; б) PbO. На моделях с помощью очертаний параллелепипедов выделены элементарные ячейкиКлассическим примером вещества со слоистой структурой является графит, в котором каждый атом углерода находится в состоянии sp2 -гибридизации и образует в одной плоскости три ковалентные s-связи с тремя другими атомами С. Четвертые валентные электроны каждого атома углерода являются негибридизированными, за их счет образуются очень слабые вандерваальсовские связи между слоями. Поэтому при приложении даже небольшого усилия, отдельные слои легко начинают скользить друг вдоль друга. Этим объясняется, например, свойство графита писать. В отличие от алмаза графит хорошо проводит электричество: под воздействием электрического поля нелокализованные электроны могут перемещаться вдоль плоскости слоев, и, наоборот, в перпендикулярном направлении графит почти не проводит электрического тока.
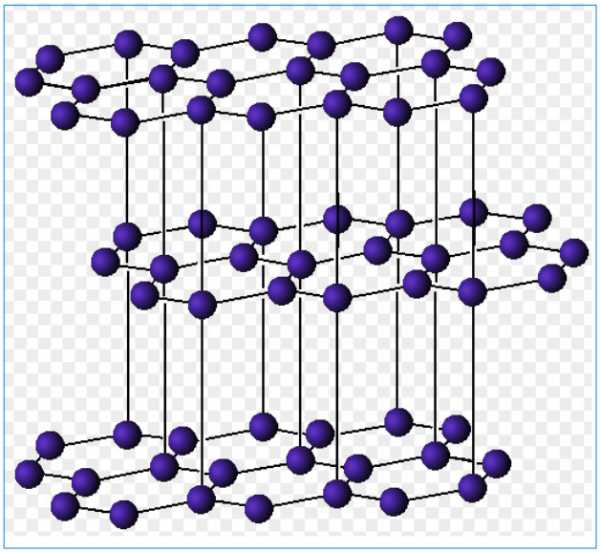 Слоистая структура атомной кристаллической решетки графита
Слоистая структура атомной кристаллической решетки графита
Цепочечные структуры характерны, например, для оксида серы (SO3)n , киновари HgS, хлорида бериллия BeCl2, а также для многих аморфных полимеров и для некоторых силикатных материалов, таких, как асбест.
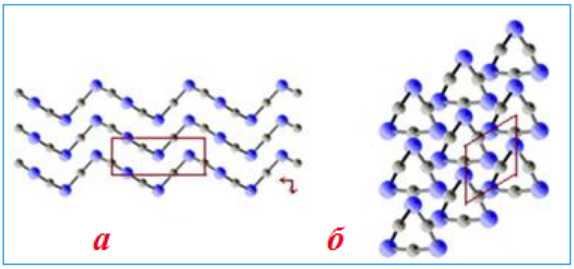 Цепная структура атомной кристаллической решетки HgS: а) проекция сбоку б) фронтальная проекция
Цепная структура атомной кристаллической решетки HgS: а) проекция сбоку б) фронтальная проекцияВеществ с атомной строением кристаллических rраток сравнительно немного. Это, как правило, простые вещества, образованные элементами IIIА- и IVA-подгрупп (Si, Ge, B, C). Нередко соединения двух разных неметаллов имеют атомные решетки, например, некоторые полиморфные модификации кварца (оксид кремния SiO2 ) и карборунда (карбид кремния SiC).
Все атомные кристаллы отличаются высокой прочностью, твердостью, тугоплавкостью и нерастворимостью практически ни в одном растворителе. Такие свойства обусловлены прочностью ковалентной связи. Вещества с атомной кристаллической решеткой имеют широкий диапазон электрической проводимости от изоляторов и полупроводников до электронных проводников.
Атомные кристаллические решетки некоторых полиморфных модификации карборунда — карбида кремния SiCМеталлические решетки
Эти кристаллические решетки содержат в узлах атомы и ионы металлов, между которыми свободно движутся общие для них всех электроны (электронный газ), которые образуют металлическую связь. Особенность кристаллических решеток металлов заключается в больших координационных числах (8-12), которые свидетельствуют о значительной плотность упаковки атомов металлов. Это объясняется тем, что «остовы» атомов, лишены внешних электронов, размещаются в пространстве как шарики одинакового радиуса. Для металлов чаще всего встречаются три типа кристаллических решеток: кубическая гранецентрированная с координационным числом 12 кубическая объемноцентрированная с координационным числом 8 и гексагональная, плотной упаковки с координационным числом 12.
Особые характеристики металлического связи и металлических решеток обусловливают такие важнейшие свойства металлов, как высокие температуры плавления, электро- и теплопроводность, ковкость, пластичность, твердость.
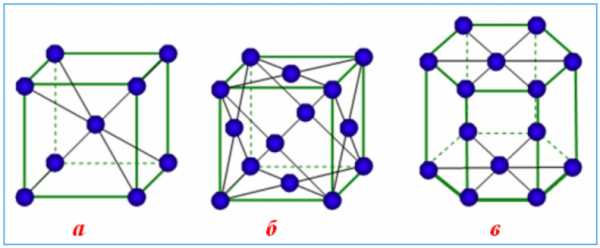 Металлические кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni, Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)
Металлические кристаллические решетки: а) кубическая объемноцентрированная (Fe, V, Nb, Cr) б) кубическая гранецентрированная (Al, Ni, Ag, Cu, Au) в) гексагональная (Ti, Zn, Mg, Cd)Молекулярные решетки
Молекулярные кристаллические решетки содержат в узлах молекулы, соединенные между собой слабыми межмолекулярными силами — вандерваальсовскими или водородными связями. Например, лед состоит из молекул воды, удерживающихся в кристаллической решетке водородными связями. К тому же типу относятся кристаллические решетки многих веществ, переведенных в твердое состояние, например: простые вещества Н2, О2, N2, O3, P4, S8, галогены (F2, Cl2, Br2, I2), «сухой лед» СО2, все благородные газы и большинство органических соединений.
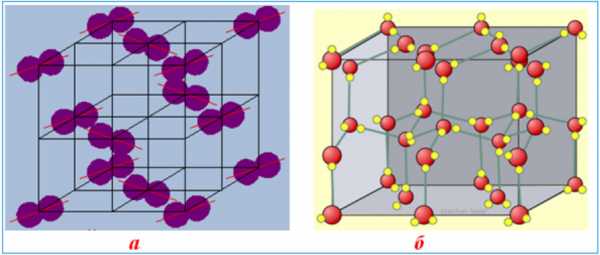 Молекулярные кристаллические решетки: а) йод I2 ; б) лед Н2О
Молекулярные кристаллические решетки: а) йод I2 ; б) лед Н2ОПоскольку силы межмолекулярного взаимодействия слабее, чем силы ковалентной или металлической связи, молекулярные кристаллы имеют небольшую твердость; они легкоплавкие и летучие, нерастворимые в воде и не проявляют электропроводности.
www.polnaja-jenciklopedija.ru
ОСНОВНЫЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЁТОК... Лекция №1 - Кристаллическое строение металлов
 Как видно на рис. 1-3-1, возможны 14 основных типов кристаллических решеток. На границах кристаллическая решетка сильно искажена. Различные типы кристаллических решеток имеют разную плотность упаковки атомов.
Как видно на рис. 1-3-1, возможны 14 основных типов кристаллических решеток. На границах кристаллическая решетка сильно искажена. Различные типы кристаллических решеток имеют разную плотность упаковки атомов.
Упорядоченное расположение атомов, когда атомы занимают в пространстве вполне определенные места, Такие вещества называются кристаллическими. Благодаря упорядоченному расположению атомов в пространстве, их центры можно соединить воображаемыми прямыми линиями.
Кристаллические твердые тела состоят из кристаллических зерен – кристаллитов. В кристаллитах соблюдаются ближний и дальний порядки. Такой тип решетки в определенных диапазонах температур имеют железо, хром, ванадий, вольфрам, молибден и др. металлы. У гексагональных решеток отношение параметра с/а всегда больше единицы. Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой.
Металлическая связь в кристаллических решетках.
Кроме того, атом А оказывается на таком же расстоянии еще от трех атомов 10, 11, 12, принадлежащих кристаллической ячейке, лежащей ниже основания. Следовательно, для ГПУ решетки координационное число равно 12(Г12).
Под анизотропией понимается неодинаковость механических и других свойств в кристаллических телах вдоль различных кристаллографических направлений. Она являетсяестественным следствием кристаллического строения, так как на различных кристаллографических плоскостях и вдоль различных направлений плотность атомов различна.
Как «упаковывается» один слой кристаллической решетки?
На плоскостях, проходящих через грани ОЦК- и ГЦК-решеток, находится меньше атомов, чем на диагональных плоскостях. Сдвиг в кристалле происходит наиболее легко вдоль атомных плоскостей с наиболее плотной упаковкой атомов. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
Кристаллическая решетка, в которой отсутствуют нарушения сплошности и все узлы заполнены однородными атомами называется идеальной кристаллической решеткой металла. В решетке реального металла могут находиться различные дефекты.
Строение первых двух кристаллических решёток можно представить следующим образом
К ним относятся дислокации, т. е. дефекты, образующиеся в решетке в результате смещений кристаллографических плоскостей. Наиболее характерной является краевая дислокация (рис. 1.10). Она образуется в результате возникновения в решетке так называемой полуплоскости или экстраплоскости. В винтовой дислокации, так же как в краевой, существенные искажения кристаллической решетки наблюдаются только вблизи оси, поэтому такой дефект может быть отнесен к линейным.
Точечные дефекты не закреплены в определенных объемах металла, они непрерывно перемещаются в кристаллической решетке в результате диффузии
На рис. 1.12 в виде кривой ABC схематически показана зависимость прочности металла от плотности дислокаций. Поэтому начиная с точки В прочность металла возрастает. Поверхностные дефекты включают в себя главным образом границы зерен (рис.1.13).
Объемные дефекты кристаллической решетки включают трещины и поры. Наличие данных дефектов, уменьшая плотность металла, снижает его прочность. Кроме того, трещины являются сильными концентраторами напряжений, в десятки и более раз повышающими напряжения создаваемые в металле рабочими нагрузками.
Объемноцентрированная (ОЦ) ячейка (рис. а) – содержит дополнительно один атом на пересечении пространственных диагоналей куба (или, в общем случае, параллелепипеда). В настоящее время выделено уже более тысячи структурных типов, однако они охватывают лишь несколько процентов известных кристаллических структур. Понятие структурный тип – один из критериев сходства или различия строения кристаллов. Обычно структурный тип относят к названию одного из веществ, кристаллизующихся в нём. Структуры кристаллов, принадлежащих к одному структурному типу, одинаковы до подобия.
Плотность кристаллической решетки, т. е. объем, занятый атомами, характеризуется коэффициентом компактности
Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами.
Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с элементами симметрии. Большинство твердых веществ имеют кристаллическую структуру, в которой частицы, из которых она «построена» находятся в определенном порядке, создавая тем самым кристаллическую решетку.
Для характеристики кристаллических решеток вводят понятия координационного числа и коэффициента компактности
Существует 3 основных типа таких структур: гексагональная плотная упаковка (ГПУ), гранецентрированная кубическая упаковка (ГКУ) и объемно центрированная кубическая упаковка (ОЦКУ). Вещества с таким типом решетки обладают высокой твердостью, они тугоплавки и малолетучи. Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).
Некоторые металлы при разных температурах могут иметь различную кристаллическую решетку. Упорядоченность кристаллического строения в пространственной решетке позволяет выделить отдельные кристаллографические направления и плоскости. В 1848 г. французский ученый Бравэ показал, что изученные трансляционные структуры и элементы симметрии позволяют выделить 14 типов кристаллических решеток.
Уже опубликовано на сайте:
labrowendosin.ru