Диаграмма состояния сплавов системы свинец – сурьма. Диаграмма свинец сурьма
5. Диаграммы состояния сплавов. Материаловедение: конспект лекций [litres]
5. Диаграммы состояния сплавов
Сплавы можно получать при соединении большинства металлов друг с другом, а также с неметаллами. Диаграммы состояния сплавов дают наглядное представление о протекающих в сплавах превращениях в зависимости от их химического состава и температуры.
При построении диаграмм состояния сплавов на оси абсцисс указывают химический состав или концентрацию сплава в процентах. Для этого горизонтальную линию определенной длины делят на сто одинаковых частей и каждое деление принимают за 1 % одного из компонентов сплава.
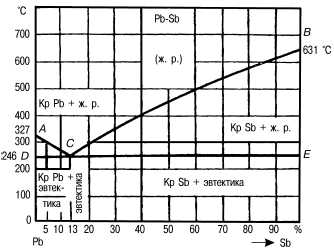
Рис. 5. Диаграмма состояния сплавов системы свинец—сурьма (Pb—Sb)
Точка А соответствует чистому свинцу, а точка В – чистой сурьме. По оси ординат в определенном масштабе указывают температуру. Для того чтобы построить диаграмму состояния сплавов, сначала строят ряд кривых охлаждения сплавов одних и тех же элементов с различной концентрацией.
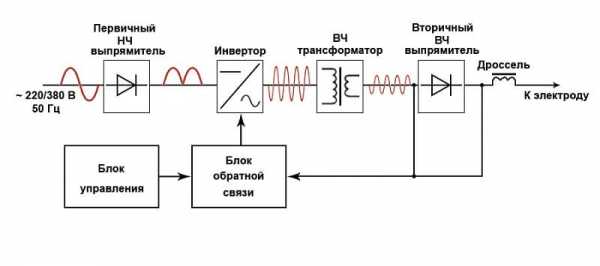
На основе этих кривых строят диаграмму. Сплавы, компоненты которых при затвердевании образуют только механические смеси, относятся к первой группе. Диаграмма этих сплавов условно называется диаграммой состояния первого рода. Диаграмма сплавов, образующих при затвердевании только твердые растворы, называется диаграммой состояния второго рода. Наиболее типичными для диаграмм первого рода являются сплавы свинца с сурьмой.
Построение диаграммы (первого рода) состояния сплавов Pb—Sb:
1) кривые охлаждения доэвтектических сплавов;
2) диаграмма состояния сплавов Pb—Sb;
3) кривые охлаждения заэвтектических сплавов. Диаграмма построена для пяти видов сплава свинца с сурьмой:
1) 5 % сурьмы и 95 % свинца;
2) 10 % сурьмы и 90 % свинца;
3) 20 % сурьмы и 80 % свинца;
4) 40 % сурьмы и 60 % свинца;
5) 80 % сурьмы и 20 % свинца.
Все они имеют две критические температуры: верхнюю и нижнюю. Изучение процессов кристаллизации этих сплавов показывает, что верхняя критическая температура соответствует началу, а нижняя – концу затвердевания сплава. Таким образом, процесс кристаллизации сплавов Pb—Sb резко отличается от кристаллизации чистых металлов. Сплавы кристаллизуются в интервале температур, а чистые металлы – при постоянной температуре.
Механическая смесь кристаллов, выделяющихся из жидкого сплава одновременно, называется эвтектикой (в переводе с греческого – «хорошо сложенный»). Сплавы указанной концентрации называют эвтектическими. Линия АСВ на диаграмме называется линией ликвидуса (в переводе с греческого – «жидкий»). Выше этой линии любой сплав свинца с сурьмой находится в жидком состоянии. Линия ДСВЕ получила название линии солидуса (в переводе с греческого – «твердый»), или эвтектической линии. Точка С показывает состав эвтектики. Сплавы, расположенные левее этой точки, называют доэвтектическими, правее ее – заэвтектическими. В структуре доэвтектических сплавов, кроме эвтектики, всегда есть некоторое количество свинца, а в заэвтектических, кроме эвтектики, – сурьмы.
Поделитесь на страничкеСледующая глава >
tech.wikireading.ru
Анализ диаграммы состояния сплава смеси системы — Мегаобучалка
Свинец — сурьма
Сплав Рb — Sb относится к сплавам смесям (I тип), составляющие которого неограниченно растворяются в жидком виде, а в твердом состоянии нерастворимы и представляют собой механическую смесь кристаллов компонентов, образующих сплав.
Общий вид диаграммы приведен на рис. 3.3. Линия ACB — ликвидус, выше которой находится область жидкого однофазного состояния (Ж). Линия DCE – солидус, ниже которой сплав находится в твердом двухфазном состоянии в виде смеси кристаллов свинца и сурьмы (Рb + Sb).
| 100%Pb 13 20 40 60 80 100%Sb %Sb |
Рис. 3.3. Диаграмма состояния системы свинец — сурьма
При охлаждении сплавов различной концентрации на линии AC из жидкого расплава выделяются кристаллы свинца, а на линии CB – кристаллы сурьмы.
На линии DCE происходит образование эвтектики, т.е. из жидкой фазы состава точки C (13% Sb) одновременно при постоянной температуре выделяются дисперсные кристаллы свинца и сурьмы. Эта линия называется линией эвтектического превращения. На ней в равновесии находятся три фазы: жидкая, кристаллы свинца и сурьмы. Точка C называется эвтектической, а сплав состава этой точки — эвтектическим (Э). Сплавы с содержанием сурьмы менее 13% называются доэвтектическими (Э+Pb), а более 13% - заэвектическими (Э+Sb).
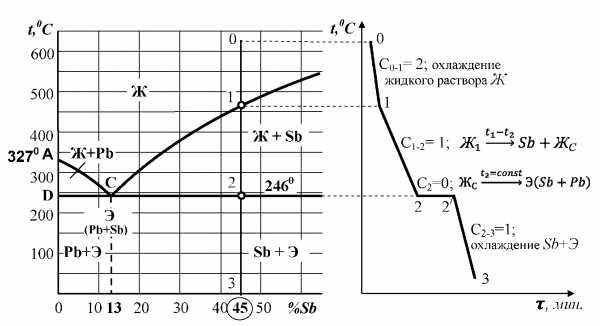
Проведение анализа сплава любой заданной концентрации, позволяет выявить закономерности структурообразования в процесс изменения температуры. По диаграмме состояния системы, пользуясь правилами фаз и отрезков, построим кривую охлаждения, например, заэвтектического сплава c концентрацией 45% Sb (рис. 3.4).
а) б)
Рис. 3.4. Построение схематической кривой охлаждения (б) сплава с
содержанием 45% сурьмы по диаграмме состояния Pb-Sb (а)
При охлаждении от исходной температуры t0 точки 0 до t1 точки 1 сплав находится в однофазном жидком состоянии. Определяем число степеней свободы С0-1 = 2 – 1+1 = 2. Скорость охлаждения сплава максимальна, что характеризуется малым наклоном участка 0-1 кривой охлаждения.
С температуры t1 начинается кристаллизация сурьмы, которая продолжается до температуры t2, соответствующей линии эвтектического превращения. Сплав находится в двухфазном состоянии Ж+Sb, число степеней свободы С1-2 = 1. Скорость охлаждения замедляется, что обусловливает больший наклон участка 1-2 кривой охлаждения. Охлаждение сплава в интервале температур t1-t2 приводит к его качественному изменению: в результате выпадения первичных кристаллов сурьмы жидкая фаза обедняется сурьмой и обогащается свинцом. Согласно правилу отрезков состав жидкой фазы меняется по линии ликвидус от точки 1 при температуре t1, до точки C при температуре t2.
Описанный процесс фазовых превращений записывают в виде уравнения металлургической реакции
На линии DCE образование первичных кристаллов сурьмы заканчивается, а из оставшейся жидкости состава точки C (13%) происходит кристаллизация эвтектики Э=(Pb+Sb). Для сплава в точке 2 конодой является линия диаграммы DCE, которая показывает одновременное существование трех фазы: жидкости, кристаллов свинца и сурьмы. Число степеней свободы С2 = 0, система безвариантна, следовательно образование эвтектики происходит при постоянной температуре. На кривой охлаждения наблюдается горизонтальный участок 2-2/. Процесс кристаллизация эвтектики описывается уравнением
После кристаллизации сплав состоит из двух структурных составляющих: крупных первичных кристаллов сурьмы и эвтектики, представляющей собой мелкозернистую смесь кристаллов сурьмы и свинца (рис. 3.5, в). Структурной составляющей называют обособленную часть структуры, имеющую при определенном увеличении микроскопа однообразное строение.
В доэвтектических сплавах в интервале температур от линии ликвидус до линии солидус из жидкой фазы выпадают первичные кристаллы свинца, а жидкость обогащается сурьмой (до 13%) и обедняется свинцом. Доэвтектические сплавы после затвердевания состоят также из двух структурных составляющих: крупных кристаллов свинца и эвтектики (рис. 3.5, а).



а) б) в)
Рис. 3.5. Микроструктуры сплавов Pb – Sb (х135, травлено):
а– доэвтектоидного; б – эвтектоидного; в – заэвтектоидного
Сплав эвтектического состава (13%) кристаллизуется при постоянной температуре, без предварительного образования кристаллов сурьмы или свинца. После затвердевания он состоит из одной структурной составляющей — эвтектики (рис. 3.5, б).
Сплавы смеси склонны к ликвации по удельному весу, т.е. к неоднородности по химсоставу в разных зонах слитка. Для предотвращения ее сплав перед разливкой интенсивно перемешивают либо вводят в него третий компонент, который образуя химическое соединение, препятствует возникновению ликвации. К таким сплавам относятся баббиты: подшипниковые сплавы системы Sb-Sn-Cu.
Применение сплавов смесей:
1. В качестве литейных, обладающих хорошей жидкотекучестью благодаря наличию в их структуре эвтектики.
2. Припои для пайки, например ПОС-61 (61% олова, остальное свинец). Сплав эвтектический, кристаллизуется при постоянной минимальной температуре 183 0С.
3. Тепловые предохранители, т.к. сплавы смеси при любой концентрации имеют одинаковую температуру начала плавления (линия солидус). Это обеспечивает точность срабатывания предохранителей при повышении температуры до заданных значений.
4. Типографские шрифты (доэвтектический сплав Pb-Sb), дающие четкий отпечаток при повышенной, по сравнению с чистым свинцом, износостойкостью.
5. Вкладыши подшипников скольжения (баббиты), представляющие собой заэвтектические сплавы, состоящие из пластичной эвтектики с включениями кристаллов твердой фазы. Мягкая основа обеспечивает хорошую прирабатываемость к валу, а твердые включения повышают износостойкость и несущую способность подшипника.
megaobuchalka.ru
Точки диаграммы состояния свинец-сурьма
| Чистый компонент, сплавы | Точки начала кристаллизации, tн, °С | Точки конца кристаллизации, tк, °С |
| 100 % Pb | ||
| 95 % Pb 5 % Sb | ||
| 90 % Pb 10% Sb | ||
| 87 % Pb 13% Sb | ||
| 75 % Pb 25 % Sb |
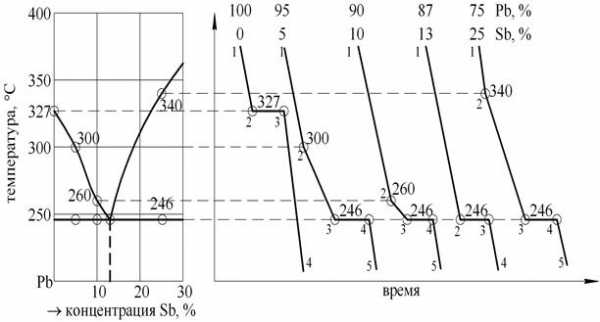
Рис. 9. Часть диаграммы состояния свинец-сурьма и кривые охлаждения
Воспользовавшись правилом фаз, найдем число степеней свободы на каждом участке полученных кривых.
Кривая охлаждения чистого Pb:
На участке 1-2, С=1–1+1=1 (компонент – Pb, фаза – жидкость). Можно изменять температуру, не изменяя агрегатное состояние.
На участке 2-3, С=1–2+1=0. В равновесии находится максимальное число фаз и нельзя изменять ни одну степень свободы без изменения фазового состава.
На участке 3-4, С=1–1+1=1, можно изменять температуру, не изменяя агрегатного состояния.
Кривая охлаждения сплава 95 % Pb 5 % Sb:
На участке 1-2, С=2–1+1=2 (компоненты – Pb и Sb, фаза – жидкая). Можно изменять температуру и концентрацию без изменения агрегатного состояния.
На участке 2-3, С=2–2+1=1 (фазы – жидкость, кристаллы Pb).
На участке 3-4, С=2–3+1=0 (фазы – жидкость, кристаллы Pb, кристаллы Sb). Одновременная кристаллизация Pb и Sb должна протекать при одной температуре - Т = 246 °С.
На участке 4-5, С=2–1+1=2. Можно изменять температуру и концентрацию без изменения агрегатного состояния.
ЗАДАЧА № 5 Найдите число степеней свободы на каждом участке кривых охлаждения сплавов олово-цинк (рис. 7). Покажите на кривых охлаждения фазовые переходы.
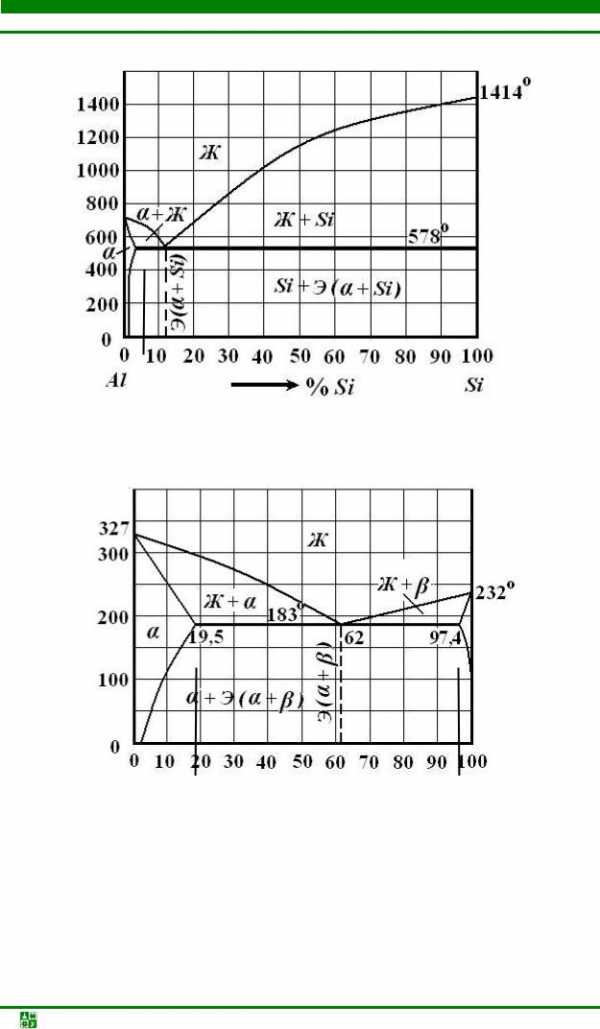
ЗАДАЧА № 6 Дана диаграмма состояния магний-кремний (рис. 10). Постройте кривые охлаждения для сплавов, содержащих 1,4 % Si 98,6 % Mg, 20 % Si 80 % Mg, 40 % Si 60 % Mg, 80 % Si 20 % Mg.
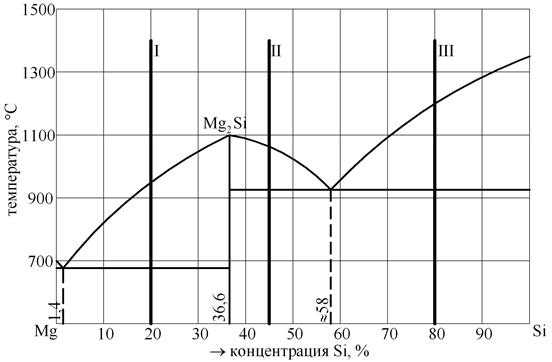
Рис. 10. Диаграмма состояния Mg-Si
ПрактическОЕ занятие № 3
Правило отрезков
В процессе кристаллизации изменяются и концентрация фаз и количество каждой фазы (при кристаллизации количество твердой фазы увеличивается, а жидкой уменьшается). В любой точке диаграммы, когда в сплаве одновременно существует две фазы можно определить количество обеих фаз и их концентрацию. Для этого служит так называемое правило рычага или правило отрезков.
1 Чтобы определить концентрации компонентов в фазах, через данную точку, характеризующую состояние сплава, проводят горизонтальную линию до пересечения с линиями, ограничивающими данную область, проекции точек пересечения на ось концентраций показывают составы фаз.
Следовательно, для сплава К при температуре t1 составы обеих фаз определяются проекциями точек b и с, так как эти точки находятся на пересечении горизонтальной линии, проходящей через точку а, с линиями диаграммы.
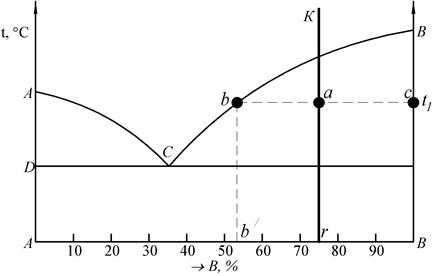
Рис. 11. Диаграмма состояния (к применению на ней правила отрезков)
2 Для определения количества каждой фазы предположим, что сплав К находится при температуре t1.
Сплав К содержит r % В и (100 – r) % А. Следовательно, если отрезок на оси абсцисс АВ определяет все количество сплава, то отрезок rА – количество В в сплаве, а отрезок rВ – количество компонента А в сплаве.
В точке а сплав состоит из кристаллов В и жидкости, концентрации b. жидкость содержит b/ % В или в жидкости количество компонента В определяется отрезком Аb/.
При общем весе сплава, равном единице, искомое количество выделившихся кристаллов равно x, а количество жидкости 1 – x. В этом случае количество компонента А, который находится только в жидкости, равно
b/B (1 - x) = b/B – x b/B = rB, x b/B = b/B – rB,
Так как b/B – rB = b/r = ba, b/B = bc, то ,
т.е. если масса сплава равна единице и изображается отрезком bc, то масса кристаллов в точке а у сплава К равна отношению ba/bc.
Количество жидкости
т.е. количество жидкости определяется отношением aс/bc.
Отношение количества твердой и жидкой фаз определяется отношением
Если точка а определяет состояние сплава, точка b – состав жидкой фазы, точка с – состав твердой фазы, то отрезок bс – определяет все количество сплава, отрезок ас – количество жидкости и отрезок bа – количество кристаллов.
Для того, чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками определяющими составы фаз, обратно пропорциональны количествам этих фаз.
Правило отрезков в двойных диаграммах состояния можно применять только в двухфазных областях. В однофазной области имеется лишь одна фаза; любая точка внутри области характеризует ее концентрацию.
При наличии одновременно трех фаз в двойной системе количество фаз нельзя определить, так как в процессе кристаллизации их количество непрерывно меняется.
ЗАДАЧА № 7 Постройте график зависимости весовой доли жидкой фазы при 2500 °С от содержания NiO в сплаве MgO-NiO.
РЕШЕНИЕ
При температуре 2500 °С твердая фаза может содержать до 40 % NiO, а жидкая – до 25 % MgO. Поэтому при 2500 °С область составов от 0 до 40 % NiO соответствует только твердой фазе, а в области составов от 75 до 100 % NiO твердая фаза вообще отсутствует.
Рис. 12. Диаграмма состояния системы MgO-NiO
Обозначим жидкую фазу через x и определим ее весовую долю для состава 60 % NiO и 40 % MgO:
Рис. 13. Зависимость весовой доли жидкой фазы от сплава при 2500 °С
ЗАДАЧА № 8 Каков состав и количество фаз сплава I в точке а, каков состав a-кристаллов сплава I после равновесной кристаллизации, в чем различия кристаллизации компонента А и сплава состава точки а/ (рис. 14)?
ЗАДАЧА № 9 Определите концентрацию компонентов в фазах и количественное соотношение фаз для сплавов II, III при Т = 1000 °С, сплава I при Т = 800 °С (рис. 10 практического занятия № 2).
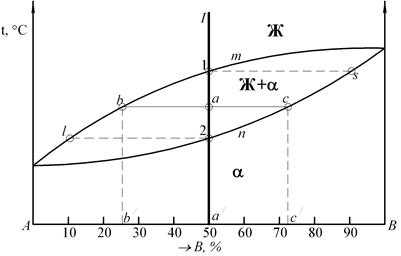
Рис. 14. Диаграмма состояния сплава А-В
Практическое занятие № 4
stydopedia.ru
Свинец диаграмма состояния системы свинец
На рис. 152 приведена диаграмма состояния системы Мд—РЬ. Эта система служит простейшим примером систем, в которых образуются химические соединения свинец образует с магнием только одно соединение М 2РЬ, а в твердом состоянии эти металлы взаимно нерастворимы. [c.551]На рис. 12.11 приведена диаграмма состояния системы Mg—РЬ. Эта система служит простейшим примером систем, в которых образуются химические соединения свинец образует с магнием только одно соединение [c.351]
По следующим данным построить диаграмму состояния системы свинец — сурьма и определить состав и температуру затвердевания эвтектики в этой системе [c.64]Для уяснения этого вопроса рассмотрим диаграмму состояния системы свинец — сурьма, представленную на рис. 164. На горизонтальной оси (абсциссе) отложено содержание свинца и сурьмы в сплавах, а по вертикальной (ординате) —температура. Эта диаграмма показывает, что сплавы выше кривой АОВ находятся в жидком состоянии, а ниже прямой СД—в твердом состоянии. Если мы возьмем сплав, В содержащий 5% 5Ь и 95% РЬ, то выше 296° (точка а) сплав будет находиться в жидком состоянии. При 296° сплав начнет кристаллизоваться и при охлаждении (до 243°) из жидкого расплава начнут выпадать кристаллы РЬ чистого свинца. При 243° О оставшаяся жидкая фаза также закристаллизуется и весь сплав будет в твердом состоянии. При каждой температуре в интервале от 296 до 243° будет выпадать вполне определенное количество свинца. Если охладить сплав до какой-либо промежуточной температуры и сделать большую выдержку, то после превращения определенного количества свинца в твердое состояние установится равновесие между выпавшими кристаллами свинца и оставшейся жидкой фазой, благодаря чему сколько бы времени не выдерживать сплав при этой температуре, все время имелись бы две фазы твердая и жидкая. Жидкая фаза, застывающая при 243°, имеет так называемый эвтектический состав (13% 5Ь и 87% РЬ) и в твердом виде представляет собой механическую смесь мельчайших кристаллов сурьмы и свинца. Эта смесь имеет определенную температуру плавления и затвердевания (243°). [c.450]
Диаграмма состояния системы свинец — олово показана на рис. 51. [c.141]
Диаграммы состояния систем, состоящих из веществ, не образующих химических соединений. На рис. 2.33 показана диаграмма состояния системы 8Ь - РЬ эти вещества неограниченно растворимы друг в друге в жидком состоянии и нерастворимы в твердом состоянии. В верхней части рисунка схематически представлен общий вид диаграммы данного типа. Точка а отвечает температуре плавления компонента А (сурьма, 631 С), точка А - температуре плавления компонента В (свинец, 327 0 кривые аЕ и > -кривые кристаллизации соответственно 5Ь и РЬ. [c.307]
На рис. 42 приведена диаграмма состояния системы олово — свинец с ограниченной растворимостью в твердом состоянии. [c.193]
Допустим, что требуется достроить диаграмму состояния системы сурьма—свинец на основе данных, приведенных в табл. 24. [c.200]
Система медь—свинец. Свинец практически нерастворим в твердой меди. По данным диаграммы состояния, растворимость свинца в меди не превышает 0,02%. [c.10]
Рассмотрим диаграмму состояния системы сурьма—свинец (рис. 55), по оси абсцисс которой отложено содержание сурьмы в сплавах, по оси ординат—температура. На этой диаграмме видно, что выше кривой [c.121]
Другим сплавом, выбранным для исследования, была свинцовистая бронза— сплав 79 /о Си +21 /о РЬ. На фиг. 10 представлена диаграмма состояния системы Си—РЬ. Так как свинец и медь друг в друге практически не растворяются, то, исходя из диаграммы состояния, можно считать, что структура выбранного сплава должна состоять из кристаллов меди, между которыми располагаются включения свинца. На фиг. 11 приведена микрофотография шлифа из приготовленного сплава, на которой видны темные включения свинца на белом фоне кристаллов меди. [c.16]
Из изложенного следует, что диаграмма состояния рассматриваемой системы делится на пять областей I — раствор // — смесь раствора, насыщенного веществом А (в данном случае сурьмой), и кристаллов этого вещества , /// —смесь раствора, насыщенного В (свинец), и кристаллов В IV — смесь эвтектики и кристаллов А (5Ь) V,—смесь эвтектики и кристаллов Б (РЬ), Кривая аВЬ [c.290]
На рис. IX. 5, а представлена диаграмма плавкости системы В1—РЬ, для которой характерна частичная растворимость в кристаллическом состоянии висмут растворяет до 10% РЬ, а свинец— до Ю7о В[. Поэтому из расплавов, в которых имеется избыток висмута по сравнению с его содержанием в эвтектической смеси, кристаллизуется не чистый висмут, а твердый раствор свинца в висмуте. [c.111]
На рис. 19, а представлена диаграмма плавкости системы В1—РЬ. Здесь имеет место частичная растворимость в кристаллическом состоянии висмут растворяет до 10% свинца, а свинец—до 10% висмута. Поэтому из расплавов, в которых имеется избыток вис- [c.93]
Система серебро—свинец. По диаграмме состояния серебро растворяет не более 1,3% РЬ. Электролитически же удается получить сплавы, значительно более богатые свинцом. [c.8]
Диаграммы состояния, подобные рассмотренной выше, образуют, например, серебро и свинец, окись кальция и окись магния, а также некоторые другие системы. Однако полная взаимная нерастворимость двух веществ в твердом состоянии встречается сравнительно редко. Чаще наблюдается образование более или менее ограниченных твердых растворов. [c.103]
На рис. 48 приводится диаграмма состояния сплавов системы свинец — сурьма. Эвтектическая смесь Е (т. пл. 247°) содержит 87% (по весу) свинца. При 247° твердый раствор а, богатый свинцом, [c.436]
На рис. 11.10 (а, б и в) приведены по данным работы [17] Р-Т-, Т-х- и Р-х-проекции диаграммы состояния для системы свинец — сера вблизи состава РЬ5. Равновесия с участием соединения занимают большую часть пространст- [c.81]
У наиболее простых двухфазных сплавов, состоящих из двух компонентов, как, например, свинец-сурьма, алюминий-кремний, диаграмма состояния представляет собой системы с эвтектикой, т. е. системы с неограниченной взаимной растворимостью компонентов в жидком состоянии при полном отсутствии растворимости в твердом состоянии. Оба металла в твердом состоянии кристаллизуются порознь и структура таких сплавов состоит из двух фаз, различных по химическому составу и физическим свойствам. [c.112]
Диаграмма плавкости этой системы представлена на рисунке 46. Здесь имеет место ограниченная взаимная растворимость в кристаллическом состоянии висмут растворяет до 10% свинца, а свинец — до 10% висмута. [c.159]
Диаграмма состояния системы свинец — сера разработава только до содержания серы, отвечающего образованию соединения PbS. [c.338]
Система уран — свинец. Диаграмма состояния этой двойной системы на рис. 10. 42 показывает наличие двух интерметаллических соединений и практически полное отсутствие растворимости в твердом состоянии. Несмотря на очень малую взаимную растворимость свинца и урана, соединение иРЬз образуется довольно легко, особенно в том случае, когда расплавленный свинец используется в качестве нагревательной среды. Поэтому выдержка урана при проведении термообработки в ваннах с расплавленным свинцом должна быть насколько возможно краткой. [c.358]
При дистилляции катодного сплава с полной или частичной отгонкой из ного кальция второй компонент сплава должен оставаться в остатке. В отличие от других возможных компонентов (цинк, магний, свинец, серебро) сплава, медь удовлетворяет этому требованию при температуре дистилляции до 1200° медь обладает малой упругостью паров и не загрязняет кальцигг. Остаток от дистилляции, так называемы бедный сплав, возвращается в процесс электролиза. Медно-кальциевый сплав (65 о кальция) имеет плотность 2,1—2,2 г см и не всплывает над расплавленным электролитом. Диаграмма состояния системы Са — Си приведена на рис. 13.19. [c.387]
Фракционирование встречается и в процессе кристаллизации некоторых металлических сплавов, компоненты которых не могут растворяться в кристаллических решетках друг друга (не образуют твердых растворов). При этом образуются механические смеси, где каждый компонент кристаллизуется самостоятельно и образует собственные зерна. Примером может являться система свинец-сурьма (РЬ-5Ь), а также другие системы, образующие диаграмму состояния сплавов I рода [13]. При искусственном и естественном старении алюминиевых сплавов происходит перераспределение атомов меди и образование из них скоплений (зоны Гинье - Пресгона). [c.22]
По данным Д. И. Лайнера [77], электролитически осажденные сплавы свинца и олова находятся в полном ссответствии с диаграммой состояния литых сплавов. Е. Рауб и В. Блюм [12] установили, что электролитически осажденные из борфтористоводородного электролита свинец и олово образуют твердый раствор олова в свинце с пределом насыщения олова, приблизительно равным 8%. Свинцовооловянный сплав с указанным содержанием олова, согласно металлографическому анализу, является однофазной системой. По структуре он представляет собой кубическую гранецентрированную решетку, аналогичную решетке свинца, но с уменьшенными на 0,2% параметрами. [c.120]
Так, электролитический сплав олово никель (60—65% Зп)" представляет собой химическое соединение N1811, которое отсутствует на диаграмме состояния, а сплав олово — свинец образует пересыщенный раствор олова в свинце с пределом насыщения 8—12% тогда как по диаграмме состояния он относится к эвтектическим системам. [c.49]
Диаграммы состояния систем элементов подгруппы германия с халькогенами изучены лучше и полнее по сравнению с системами А —В -. Объясняется это прежде всего тем, что соединения AIVBVI характеризуются более низкими температурами плавления по сравнению с А В . Теллур с элементами подгруппы германия образует только зкви-атомарные соединения А Те — монотеллуриды. Из-за небольшой электроотрицательности теллура он не может окислить германий, олово и свинец до более высоких степеней окисления, чем -f2. [c.184]
При уменьшении взаимной растворимости жидких фаз I к II (в системах с разными компонентами) ширина области гетерогенного жидкого состояния, огр аниченная бинодальной кривой, увеличивается, а части ликвидуса В Е, / и МА сжимаются до полного исчезновения при полном отсутствии взаимнсй растворимости (или, как говорят, при полном отсутствии смешиваемости жидкостей I ц II). й этом случае на диаграмме имеются всего две прямые, параллельные оси состава. Одна из этих прямых соответствует температуре плавления одного компонента, а другая — температуре плавления другого. Совершенно ясно, что так и должно быть, так как и -за полной нерастворимости компонентов и в жидком и твердом состоянии присутствие одного из них не влияет на температуру плазлензя другого . Такой преде. ьный случай наблюдается для смесей железа со свинцом, которые не растворяются один в другом ни в твердом, ни в жидком состояниях, В такой смеси свинец и железо плавятся независимо друг от друга первый — при 327,4 , а второе — при 1539°. [c.54]
chem21.info
Диаграмма состояния сплавов системы свинец – сурьма
Теория сплавов
Сплав – вещество, состоящее из двух и более элементов.
Система – совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление).
Фаза – однородная по химическому составу и внутреннему строению часть системы.
Компоненты – вещества образующие систему.
В большинстве случаев входящие в сплав элементы в жидком состоянии полностью растворимы друг в друге, т.е. представляют собой жидкий раствор. В процессе кристаллизации сплава могут образовываться следующие типы сплавов: твердые растворы, химические соединения и механические смеси.
Основное отличие кристаллизации сплавов от кристаллизации чистых металлов состоит в том, что сплавы кристаллизуются не при одной строго определенной температуре, а в интервале температур, т.е. от температуры начала кристаллизации до температуры конца кристаллизации (кроме эвтектики).
Таким образом, металлы при кристаллизации имеют одну критическую точку, а сплавы две (кроме эвтектики).
Эвтектика – сплав, который является механической смесью двух структур, выделяющихся одновременно при постоянной температуре (самой низкой для данной системы) и определенной концентрации сплава.
Диаграммы состояния двойных сплавов
Правило фаз или закон Гиббса. Состояние сплава зависит от внешних условий (температуры, давления) и характеризуется числом и химическим составом образовавшихся фаз. Возможность изменения внешних условий без изменения числа фаз, находящихся в равновесии, называется вариантностью или числом степеней свободы системы. Правило фаз определяет взаимосвязь между числом степеней свободы, числом компонентов и числом фаз, находящихся в равновесии:
С = К + 2 – Ф ,
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз, находящихся в равновесии;
2 – число внешних факторов (температура, давление).
В металлических сплавах давление мало влияет на фазовое равновесие, поэтому уравнение принимает следующий вид:
С = К + 1 – Ф ,
Если двухкомпонентная система находится в расплавленном состоянии (К=2, Ф=1), то имеем две степени свободы (С=2), т.е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы.
Для той же системы при наличии двух фаз (жидкой и твердой) имеем К=2, Ф=2 и С=1, т.е. систему моновариантную (одновариантную). С изменением температуры концентрация должна быть строго определенной.
Для той же системы при наличии трех фаз имеем К=2, Ф=3 и С=0, т.е. систему нонвариантную (безвариантную). Сплав из данного числа фаз может существовать только при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
Диаграмма состояния сплавов системы свинец – сурьма
Рассмотрим построение диаграммы системы «Pb – Sb» (рисунок 1). К системе сплавов свинец сурьма относятся все сплавы между чистым свинцом и чистой сурьмой.
Рисунок 1 – Диаграмма состояния сплавов системы «Pb – Sb»
Кривые охлаждения компонентов и сплавов представлены на рисунке 2.
Рисунок 2 – Кривые охлаждения сплавов системы «Pb—Sb»
Линия ABC – линия ликвидуса (ликвидус – от лат. «жидкий»). Ниже линии DBE все сплавы системы находятся в твердом состоянии. Линия DBE – линия солидуса (солидус – от лат. «твердый»).
В точке В при массовом содержании 13 % Sb, 87 % Pb и при температуре 246 °С кристаллизация свинца и сурьмы происходит одновременно; образуется тонкая механическая смесь кристаллов свинца и сурьмы (двух фаз). Эта смесь называется эвтектикой.
Правило отрезков. Впроцессе кристаллизации изменяется химический состав фаз и их масса (масса жидкости уменьшается, а твердой фазы — увеличивается, при этом, естественно, суммарная масса фаз остается постоянной, равной массе сплава).
Правило отрезков служит для определения химического состава фаз (т.е. содержания в них компонентов) и массового соотношения фаз в любой точке двухфазных областей диаграммы. Для их определения через точку, характеризующую положение сплава на диаграмме, проводят горизонтальную линию (коноду)до пересечения с линиями диаграммы, ограничивающими двухфазную область, в которой лежит заданная точка. Проекция точки пересечения коноды и линии диаграммы состояния на ось концентраций показывает состав той фазы, с которой граничит точка пересечения. Так, т. а' определяет концентрацию компонентов в жидкой фазе, а т. с' — концентрацию компонентов в твердой фазе (рисунок 3).
Рисунок 3 – Структурная диаграмма сплавов системы «Pb – Sb»
Для определения количественного соотношения фаз пользуются правилом рычага. Все количество сплава соответствует отрезку ас. Количество соответствующей фазы определяется противолежащим отрезком: количество жидкости — отрезком bс, а твердой фазы — отрезком ab.
student2.ru
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА

Цельработы
Ознакомиться с термическим методом исследования, научиться применять его для определения критических точек сплавов Pb–Sb.
Приборы, материалыиинструмент
Термоэлектрический пирометр; шихтовые материалы: Pb, Sb, порошок древесного угля; металлические тигли, щипцы, песочная ванна, шахтная электропечь.
Краткиетеоретическиесведения
Термический анализ основан на измерении теплового эффекта, сопровождающего все превращения (перестройки в расположении атомов, молекул) вещества при соответствующих температурах. Переход из одного агрегатного состояния в другое, изменение кристаллического строения или структурных составляющих сплава происходят с выделением тепла при охлаждении или поглощением его при нагревании. Например, при охлаждении, когда пар конденсируется в жидкости, жидкость переходит в твёрдое состояние, процессы сопровождаются выделением тепла. И, наоборот, при нагревании процессы таяния льда, испарения жидкости сопровождаются поглощением тепла.
Сущность метода термического анализа заключается в следующем: если вещество нагревать или охлаждать с заданной скоростью, изменяя непрерывно его температуру, то к моменту выделения или поглощения тепла температура вещества будет изменяться со скоростью, отличной от заданной. Это отражается на форме кривых охлаждения или нагревания, построенных в координатах температура–время.
Материаловедение. Лаб. практикум | -31- |

ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
Температура, °С
| 1 539 °С | |
Немагнитное | 1 392 °С | |
γ | ||
| ||
| 911 °С | |
| 768 °С | |
Магнитное | α | |
|
0 Время, с
Рис. 4.1. Кривые нагревания и охлаждения чистого железа
Вид кривой охлаждения (кристаллизации) для чистого железа представлен на рис. 4.1. Горизонтальный участок при температуре 1 539°С соответствует кристаллизации жидкого металла, так как отвод тепла при охлаждении компенсируется выделением скрытой теплоты кристаллизации. Тепловые эффекты на кривых охлаждения (нагревания) наблюдаются не только на переходе одного агрегатного состояния в другое, но и в твёрдом состоянии. Выделение или поглощение тепла в этом случае связано с изменением формы кристаллической решётки железа.
В твердом состоянии железо находится в двух полиморфных модификациях: α иγ.α-железособъемно-центрированнойкубической решеткой (ОЦК) существует в двух интервалах температур: от 1 539 до 1 392°С и от 911 до 0°С. В интервале 1392–911°С появляетсяγ-железос кубической гранецентрированной решеткой (ГЦК). Поэтому при охлаждении при 1 392°С происходитα → γ превращение, а при 911°Сγ → α превращение. На это указывают горизонтальные участки при соответствующих температурах.
Процесс образования новой кристаллической решётки взамен старой называется вторичной кристаллизацией, которая происходит по тем же законам, что и первичная кристаллизация жидкости. Указанные температуры на кривых охлаждения (и нагревания) принято называть критическими точками.
Металлический сплав обладает свойствами металлов и получается в результате взаимодействия двух или нескольких элементов. Основу любого металлического сплава составляют металлы. Составной частью может быть
Материаловедение. Лаб. практикум | -32- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
любой химический элемент, а также химическое соединение, не диссоциирующее при нагревании. Сплавы получают методом сплавления, порошковой металлургией, диффузией, осаждением из газовой среды различных металлов и неметаллов. В сплавах положение критических точек связано с их составом. Определение этой зависимости лежит в основе построения диаграмм состояния изучаемой системы сплавов.
Термический анализ осуществляется следующим образом: готовится несколько сплавов исследуемой системы с различными соотношениями компонентов. Сплавы помещают в огнеупорные тигли и согревают в печи. После расплавления тигли со сплавами медленно охлаждают и фиксируют скорость охлаждения с помощью термопары и секундомера. По полученным точкам строят термические кривые охлаждения в координатах температура–время.
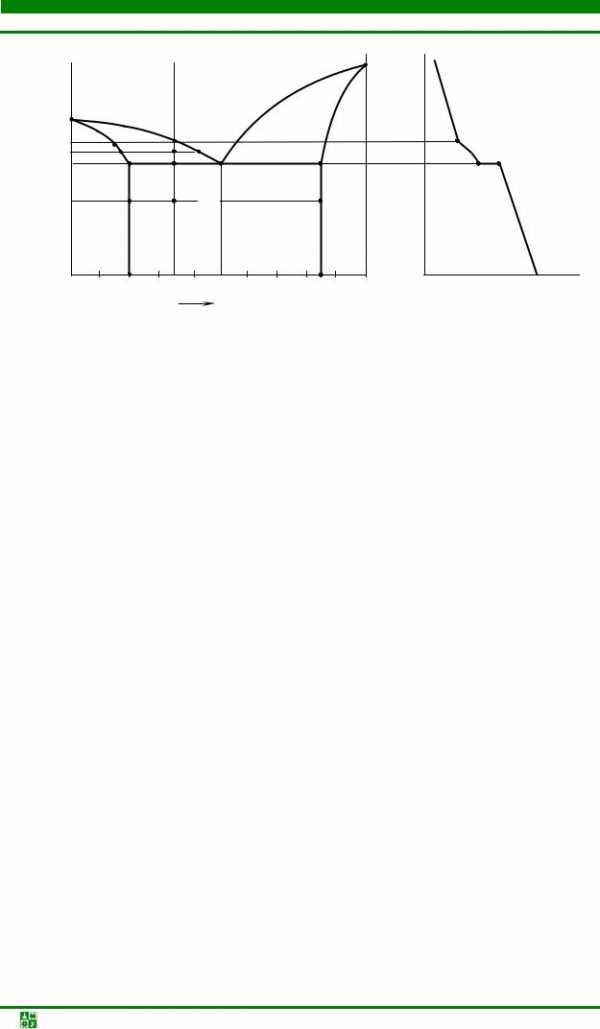
Вид кривых охлаждения чистых металлов и сплавов различных концентраций для системы Pb, Sb показан на рис. 4.2.
Кривая охлаждения III сплава с содержанием сурьмы 13 % (87 % Pb) подобна кривой охлаждения чистых металлов I (рис. 4.2).
На участке 2–2′ жидкий расплав затвердевает с образованием смеси кристаллов свинца и сурьмы. Такие смеси называютсяэвтектикой.
Кривая II на рис. 4.2 показывает охлаждение сплава с содержанием сурьмы менее 13 %. В точке 1 появляются первые зародыши кристаллов свинца, избыточного по отношению к эвтектическому составу, но т. к. процесс только начинается, на кривой охлаждения заметен лишь легкий перегиб за счет изменения скорости охлаждения. Выделение и рост зерен свинца продолжаются до точки 2 (кривая II нарис. 4.2). В точке 2 затвердевает вся оставшаяся жидкость, состав которой соответствует эвтектическому. Выделяющееся при кристаллизации тепло поддерживает температуру постоянной на участке2–2′.Ниже точки 2′ твердый сплав охлаждается с заданной скоростью. Процесс поясняет схема структур для заданной кривой (рис. 4.2).
Материаловедение. Лаб. практикум | -33- |

Температура С
°,
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
I | II | III | IV |
100 % Pb | 6 % Sb | 13 % Sb | 25 % Sb |
Ж
11′
Ж+ кр. Pb
Кр. Pb
| Ж |
|
| Ж |
| Ж |
|
|
|
|
| ||
|
|
|
|
|
| |
|
|
|
| 1 |
| Ж + кр. Sb |
|
|
|
|
|
| |
1 |
|
|
| Ж + эвт. |
|
|
|
|
|
|
|
| |
| Ж + кр. Pb |
|
| (Pb + Sb) |
|
|
|
|
|
|
|
| |
2 | 2′ | 2 | 2′ | Ж + кр. Sb + | 2 | 2′ |
|
|
|
|
|
|
+ эвт. (Pb + Sb)
Ж+ кр. Pb +
+эвт. (Pb + Sb)
Кр. Pb + эвт. | Эвт. (Pb + Sb) | Кр. Sb + эвт. | |
(Pb + Sb) | |||
(Pb + Sb) | |||
|
|
Время, с
Рис. 4.2. Кривые охлаждения чистых металлов и сплавов системы Pb–Sb
Материаловедение. Лаб. практикум | -34- |

ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Краткие теоретические сведения
В сплавах с содержанием сурьмы более 13 % (кривая IV на рис. 4.2) при кристаллизации в первую очередь выделяются избыточные зерна сурьмы (участок1–2).На участке2–2′ происходит кристаллизация эвтектики. Ниже точки 2′ идет охлаждение твердого сплава из эвтектической смеси и первичных кристаллов сурьмы (схема структур нарис. 4.2).
n1 n2
b a
Гальванометр
n0
Рис. 4.3 Схема термоэлектрического пирометра
Для термического анализа используется термоэлектрический пирометр (рис. 4.3), который представляет собой два разнородных проводника, сваренных в точкеn0 (горячий спай). Пирометр состоит из термопары и гальванометра. При нагревании горячего спая на холодных концах термопарыn1 иn2 возникает термоэлектродвижущая сила. Величина её зависит от температуры горячего спая. Если соединить проводниками холодные концы термопары с гальванометром, то через него потечет электрический ток, величина его зависит оттермо-ЭДС,а следовательно, от температуры в точкеn0. Пирометр предварительно градуируют в°С.
Порядоквыполненияработы
У каждого прибора в термической лаборатории работают два студента. В соответствии с заданием по составу сплава они получают шихтовые материалы.
1.Шихту загрузить в металлический тигель, который поместить в разогретую тигельную электропечь.
2.Сплав расплавить, нагреть до температуры 500–600°С и быстро извлечь из печи, установить на песочную ванночку, посыпать порошком древесного угля (толщиной1–1,5мм) и перемешать. Штатив приблизить к ванночке так, чтобы надёжно поддерживалась термопара, погруженная в тигель.
3.При охлаждении сплава произвести отсчет и записать показания гальванометра через каждые 15 секунд в интервале температур от 450–180
°С.
Материаловедение. Лаб. практикум | -35- |
ЛАБОРАТОРНАЯ РАБОТА 4 ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ТОЧЕК СПЛАВОВ СВИНЕЦ–СУРЬМА
Порядок выполнения работы
4.Охлажденный до 180 °С сплав термопары перенести в печь и нагревать до 600°С, затем опыт повторить.
5.После повторного охлаждения тигель с термопарой снова помес-
тить в печь, нагревать до 400 °С, после чего извлечь из сплава термопару; тигель охладить до комнатной температуры.
Содержаниеотчета
1.Кратко описать ход работы, указать состав сплава из отчетов, привести данные, полученные при охлаждении сплавов (в виде таблицы).
2.По полученным результатам построить термические кривые охлаж-
дения в масштабе: 10 °С – 5 мм; 15°С – 5 мм.
3. По кривым охлаждения определить критические точки сплава, соответствующие началу его кристаллизации и образованию эвтектики.
Материаловедение. Лаб. практикум | -36- |
studfiles.net
Диаграмма состояния сплавов системы свинец – сурьма
Теория сплавов
Сплав – вещество, состоящее из двух и более элементов.
Система – совокупность фаз, находящихся в равновесии при определенных внешних условиях (температура, давление).
Фаза – однородная по химическому составу и внутреннему строению часть системы.
Компоненты – вещества образующие систему.
В большинстве случаев входящие в сплав элементы в жидком состоянии полностью растворимы друг в друге, т.е. представляют собой жидкий раствор. В процессе кристаллизации сплава могут образовываться следующие типы сплавов: твердые растворы, химические соединения и механические смеси.
Основное отличие кристаллизации сплавов от кристаллизации чистых металлов состоит в том, что сплавы кристаллизуются не при одной строго определенной температуре, а в интервале температур, т.е. от температуры начала кристаллизации до температуры конца кристаллизации (кроме эвтектики).
Таким образом, металлы при кристаллизации имеют одну критическую точку, а сплавы две (кроме эвтектики).
Эвтектика – сплав, который является механической смесью двух структур, выделяющихся одновременно при постоянной температуре (самой низкой для данной системы) и определенной концентрации сплава.
Диаграммы состояния двойных сплавов
Правило фаз или закон Гиббса. Состояние сплава зависит от внешних условий (температуры, давления) и характеризуется числом и химическим составом образовавшихся фаз. Возможность изменения внешних условий без изменения числа фаз, находящихся в равновесии, называется вариантностью или числом степеней свободы системы. Правило фаз определяет взаимосвязь между числом степеней свободы, числом компонентов и числом фаз, находящихся в равновесии:
С = К + 2 – Ф ,
где С – число степеней свободы;
К – число компонентов;
Ф – число фаз, находящихся в равновесии;
2 – число внешних факторов (температура, давление).
В металлических сплавах давление мало влияет на фазовое равновесие, поэтому уравнение принимает следующий вид:
С = К + 1 – Ф ,
Если двухкомпонентная система находится в расплавленном состоянии (К=2, Ф=1), то имеем две степени свободы (С=2), т.е. систему бивариантную (двухвариантную). В этом случае существуют различные температуры и концентрации, при которых не изменяется число фаз и равновесие системы.
Для той же системы при наличии двух фаз (жидкой и твердой) имеем К=2, Ф=2 и С=1, т.е. систему моновариантную (одновариантную). С изменением температуры концентрация должна быть строго определенной.
Для той же системы при наличии трех фаз имеем К=2, Ф=3 и С=0, т.е. систему нонвариантную (безвариантную). Сплав из данного числа фаз может существовать только при постоянной температуре и определенном составе всех находящихся в равновесии фаз. Это означает, что превращение начинается и заканчивается при одной постоянной температуре.
Диаграмма состояния сплавов системы свинец – сурьма
Рассмотрим построение диаграммы системы «Pb – Sb» (рисунок 1). К системе сплавов свинец сурьма относятся все сплавы между чистым свинцом и чистой сурьмой.
Рисунок 1 – Диаграмма состояния сплавов системы «Pb – Sb»
Кривые охлаждения компонентов и сплавов представлены на рисунке 2.
Рисунок 2 – Кривые охлаждения сплавов системы «Pb—Sb»
Линия ABC – линия ликвидуса (ликвидус – от лат. «жидкий»). Ниже линии DBE все сплавы системы находятся в твердом состоянии. Линия DBE – линия солидуса (солидус – от лат. «твердый»).
В точке В при массовом содержании 13 % Sb, 87 % Pb и при температуре 246 °С кристаллизация свинца и сурьмы происходит одновременно; образуется тонкая механическая смесь кристаллов свинца и сурьмы (двух фаз). Эта смесь называется эвтектикой.
Правило отрезков. В процессе кристаллизации изменяется химический состав фаз и их масса (масса жидкости уменьшается, а твердой фазы — увеличивается, при этом, естественно, суммарная масса фаз остается постоянной, равной массе сплава).
Правило отрезков служит для определения химического состава фаз (т.е. содержания в них компонентов) и массового соотношения фаз в любой точке двухфазных областей диаграммы. Для их определения через точку, характеризующую положение сплава на диаграмме, проводят горизонтальную линию (коноду)до пересечения с линиями диаграммы, ограничивающими двухфазную область, в которой лежит заданная точка. Проекция точки пересечения коноды и линии диаграммы состояния на ось концентраций показывает состав той фазы, с которой граничит точка пересечения. Так, т. а' определяет концентрацию компонентов в жидкой фазе, а т. с' — концентрацию компонентов в твердой фазе (рисунок 3).
Рисунок 3 – Структурная диаграмма сплавов системы «Pb – Sb»
Для определения количественного соотношения фаз пользуются правилом рычага. Все количество сплава соответствует отрезку ас. Количество соответствующей фазы определяется противолежащим отрезком: количество жидкости — отрезком bс, а твердой фазы — отрезком ab.
studlib.info