Содержание
Медь. Серебро. Золото | АЛХИМИК
Автор Jeremiah На чтение 11 мин Просмотров 1.2к. Опубликовано
Медь, серебро и золото – эти металлы были в числе первых, освоенных человеком. Из них чеканили монеты, изготовляли предметы домашнего обихода, орудия труда и украшения.
Со временем серебро и особенно золото стали универсальным мерилом материальных ценностей. Получение золота из других металлов составляло предмет алхимии – ярчайшей страницы в истории человеческой мысли, давшей начало современной химии. С тех пор жизнь людей почти до неузнаваемости изменилась, а золото по-прежнему является символом богатства и эталоном ценности…
Содержание
Медь
Медь
Латинское наименование меди – Cuprum – происходит от названия острова Кипр, где уже в III в до н.э. существовали медные рудники. Русское «медь», вероятно, восходит к слову «смида», обозначавшему металл у древних германцев.
Хоть медь иногда встречается в природе в виде самородков (самый большой из найденных весил 420 т), основная её часть входит в состав сульфидных руд, например халькопирита CuFeS2. Реже встречается минерал малахит – зеленый основной карбонат меди (CuOH)2CO3.
В первых металлургических процессах использовались не сульфидные руды, а именно малахит, не требующий предварительного обжига. Восстановительную плавку проводили в глиняных сосудах, заполненных рудой и углем и помещенных в небольшую яму. Оксид углерода (II), образуется при неполном сгорании угля, восстанавливая малахитовую руду:
2CO + (CuOH)2CO3 → 3CO2 + 2Cu + H2O.
Развивающаяся при этом температура (1100 – 1200оС) позволяет получить расплавленную медь (tпл = 1083оС).
Медь весьма мягкий металл, поэтому начиная с III тысячелетия до н.э. на смену медным изделиям стали приходить бронзовые – более твёрдые и прочные. Скорее всего, бронзу (сплав меди с оловом) впервые получили случайно, при обработке руды, содержащей оба металла. На протяжении двух тысяч лет (до начала I тысячелетия до н.э.) бронза являлась основным материалом для производства орудий труда. Археологи называют эту эпоху бронзовым веком.
Скорее всего, бронзу (сплав меди с оловом) впервые получили случайно, при обработке руды, содержащей оба металла. На протяжении двух тысяч лет (до начала I тысячелетия до н.э.) бронза являлась основным материалом для производства орудий труда. Археологи называют эту эпоху бронзовым веком.
Малахит
Чистая медь очень хорошо проводит электрический ток, уступая в этом лишь серебру, поэтому из нее делают провода. Сплав меди с никелем – константан (60% Cu,40% Ni), напротив, отличается высоким сопротивлением – он служит основой реостатов. Бронзы (90% Cu, 10% Sn) и латуни (20 – 80% Cu, остальное Zn) твёрже меди, стойки к окислению, обладают малым коэффициентом трения. Они используются в химическом машиностроении и для изготовления подшипников, шестерен, редукторов. Нейзильбер — сплав состава 50% Cu, 25% Zn, 25% Ni – применяется в производстве медицинского оборудования и в ювелирном деле. Медно-никелевый сплав мельхиор (80% Cu, 20% Ni) идет на изготовление медицинских инструментов, монет, посуды.
Медь применяют в гальванопластике – получении точных металлических копий различных предметов путем электролитического осаждения металла на поверхности гипсовой формы.
Ежегодно в мире выплавляют приблизительно 10 млн тонн меди, и потребность в этом металле постоянно возрастает.
В отличие от своих соседей по подгруппе – серебра и золота,- медь непосредственно реагирует с кислородом. При нагревании на воздухе изделия чернеют, покрываясь слоем оксида меди (II) CuO. А при температуре свыше 1000оС образуется другой оксид – Cu2O.
Находясь долгое время на воздухе, медь покрывается плёнкой малахита, образующегося по реакции 2Cu + O2 + H2O + CO2 = (CuOH)2CO3. Именно этому веществу обязаны своим цветом бронзовые памятники и старые крыши городов Западной Европы.
В ряду напряжений медь стоит правее водорода, поэтому реагирует только с кислотами-окислителями: азотной, концентрированной серной. Исключение составляет йодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I) H[CuI2].
Исключение составляет йодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I) H[CuI2].
Пожалуй, самое известное соединение меди – медный купорос, или пятиводный сульфат меди (II), CuSO4∙5H2O. В древности это вещество получали при кристаллизации растворов, образующихся в медных рудниках во время дождя. Медный купорос применяли для чернения кожи, в медицине, производстве окрашенных стекол. В наше время медный купорос используется в сельском хозяйстве для борьбы с вредителями растений, вытеснив значительно более ядовитую соль 3Cu(AsO2)2∙Cu(CH3COO)2 – швейнфуртскую зелень.
Медь играет важную роль в процессах жизнедеятельности организмов – она входит в состав некоторых ферментов, участвующих в реакциях окисления органических соединений. Медьсодержащий фермент цитохромоксидаза катализирует процессы тканевого дыхания. Белки, в состав которых входит медь, оказывают влияние на углеводный обмен, синтез жиров, образование витаминов Р и В. Ежедневная потребность меди для человека составляет около 2 -3 мг. Особенно богаты этим элементом молоко и дрожжи. Однако в больших количествах соединения меди вредны: приём внутрь 2 г медного купороса может привести к смерти.
Ежедневная потребность меди для человека составляет около 2 -3 мг. Особенно богаты этим элементом молоко и дрожжи. Однако в больших количествах соединения меди вредны: приём внутрь 2 г медного купороса может привести к смерти.
Серебро
Серебро в слитках
Латинское название серебра – Argentum – связано с цветом этого металла; оно восходит к греческому «аргос» — «белый», «блестящий». Русское слово «серебро», как считают учёные, происходит от слова «серп» (серп луны). Блеск серебра напоминает таинственное лунное сияние и алхимикам, использовавшим в качестве символа элемента знак луны.
Древнейшие серебряные изделия, обнаруженные в Передней Азии, датируются V тысячелетием до н.э. Они изготовлены из самородного серебра. Часто такие самородки окрашены в светло-желтый цвет, так как представляют собой не чистое серебро, а сплав с золотом (греки называли его «электрон»). Находки серебряных самородков чрезвычайно редки, поэтому неудивительно, что вплоть до конца I тысячелетия до н. э. серебро стоило дороже остальных металлов, даже золота. Ситуация изменилась лишь после того, как примерно в VI в. до н.э. древние умельцы освоили процесс выделения серебра из свинцовых руд.
э. серебро стоило дороже остальных металлов, даже золота. Ситуация изменилась лишь после того, как примерно в VI в. до н.э. древние умельцы освоили процесс выделения серебра из свинцовых руд.
Некоторые свинцовые сульфидные руды, например галенит PbS, содержат значительные примеси сульфида серебра Ag2S. При обжиге такой руды на воздухе PbS переходит в оксид Pb3O4, а серебро выделяется в свободном виде:
Ag2S + O2 = 2Ag + SO2↑.
В наши дни основную массу серебра также получают при переработке свинцово-цинковых и медных руд. Часто такая руда содержит всего 0,15 – 0,25% Ag. Выплавленный из свинцово-цинковой руды жидкий металл разделяется на два слоя: в нижнем содержится свинец, а в верхнем – цинк с примесью серебра. При нагревании этого слоя летучий цинк отгоняется в виде паров, а серебро остается.
Серебро – блестящий, серебристо-белый металл (tпл = 962оС), ковкий и пластичный, легко поддающийся обработке, лучший среди металлов проводник тепла и электричества. В старину из него изготовляли монеты, вазы, кубки, ювелирные изделия, тончайшими серебряными пластинами украшали ларцы и одеяния. На Руси из серебра делали церковные сосуды, оклады икон. В настоящее время применение серебра не ограничивается ювелирным делом – оно идет на производство зеркал, электрических контактов, аккумуляторов, используется в стоматологии.
В старину из него изготовляли монеты, вазы, кубки, ювелирные изделия, тончайшими серебряными пластинами украшали ларцы и одеяния. На Руси из серебра делали церковные сосуды, оклады икон. В настоящее время применение серебра не ограничивается ювелирным делом – оно идет на производство зеркал, электрических контактов, аккумуляторов, используется в стоматологии.
Серебряная посуда
Серебро не окисляется кислородом, однако, по словам Плиния Старшего, «тускнеет от лечебных вод и от солёных ветров», покрываясь чёрным слоем сульфида серебра:
4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
В ряду напряжений серебро стоит правее водорода, поэтому оно взаимодействует лишь с кислотами-окислителями, легче всего – с азотной кислотой:
Ag + 2HNO3(конц) = AgNO3 + NO2↑ + H2O
Нитрат серебра (ляпис) прекрасно растворим в воде и является исходным веществом для получения других соединений серебра. При 209оС он плавится, а при нагревании до 300оС разлагается, образуя серебро: 2AgNO3 = 2Ag + 2NO2↑ + O2↑. Ляпис оказывает на кожу прижигающее и вяжущее действие, его используют в медицине в виде ляписных карандашей.
Ляпис оказывает на кожу прижигающее и вяжущее действие, его используют в медицине в виде ляписных карандашей.
Гидроксид серебра AgOH является сильным основанием, однако, он настолько неустойчив, что при действии на раствор AgNO3 щёлочи выпадает не AgOH, а бурый осадок оксида Ag2O. Бесцветный раствор, образующийся при взаимодействии Ag2O с раствором аммиака: Ag2O + 2NH3 + H2O = 2[Ag(NH3)2]OH, уже в XVII в. использовали для серебрения зеркал.
В 1727 г. немецкий учёный И.Г.Шульце обнаружил, что некоторые соли серебра, например хлорид AgCl, на свету разлагаются с образованием металла. Еще легче этому подвержены AgI и AgBr – они входили в состав эмульсии чёрно-белой фотопленки.
Замечено, что болезнетворные бактерии в воде погибают уже при содержании в ней серебра 10-9 г/л – такая концентрация ионов Ag+ создаётся при внесении в воду серебряных предметов.
Золото
Золотой самородок
Еще в глубокой древности золотистый цвет металла ассоциировался в сознании людей с цветом солнца. Так, по одной из версий, русское название металла происходит от слова «солнце». Латинское название элемента (Aurum) в переводе означает «жёлтый».
Так, по одной из версий, русское название металла происходит от слова «солнце». Латинское название элемента (Aurum) в переводе означает «жёлтый».
Золото, не изменяющееся при хранении на воздухе, не поддающееся ржавлению, являлось символом вечности. Алхимики называли его царем металлов, совершеннейшим из всех веществ. Превращение неблагородным металлов в золото было заманчивой мечтой многих средневековых ученых. Интересно, что сегодня это превращение стало возможным с помощью ядерных реакций, однако искусственное золото оказывается намного дороже природного. Образец такого золота, полученный при облучении нейтронами изотопа ртути 196Hg, хранится в Чикаго в Музее науки и промышленности. Алхимики удивились бы еще сильней, узнай они, что само золото в ядерных реакциях служит сырьем для получения изотопов франция и астата – элементов, которых практически нет в природе.
Золото представляет собой золотисто-желтый металл (tпл = 1064оС), настолько мягкий и пластичный, что легко раскатывается в тончайшую фольгу, которую можно растереть в порошок. «Золото через свой изрядно жёлтый цвет и блещущую светлость от прочих металлов отлично», — писал о нем М.В.Ломоносов.
«Золото через свой изрядно жёлтый цвет и блещущую светлость от прочих металлов отлично», — писал о нем М.В.Ломоносов.
В природе золото встречается в виде мелких зёрен, перемешанных с песком или гравием – продуктами разрушения золотоносных пород. Правда, иногда находят и крупные самородки – массой несколько десятков килограммов.
Древние египтяне выделяли золото из золотоносных жил, пронизывающих кварцевые породы. Многократно раскаляя скалу в огне и обливая ее холодной водой, люди дробили камень, затем толкли его в ступах, мололи и лишь после этого промывали водой, раскладывая на наклонной плоскости. Отмытое золото сплавляли в слитки. Во времена Древнего Рима главным поставщиком золота была Испания, где его вымывали из земли, извлекаемой из рудников.
Золотая маска Тутанхамона
Добычу золота в Средние века подробно описал немецкий ученый Георг Агрикола. Золотоносную руду перемалывали в муку и перемешивали в специальных бочках, на дне которых находилась ртуть. Ртуть смачивала и частично растворяла золото с образованием амальгамы. Её отделяли от остальной породы и разлагали нагреванием. Ртуть при этом улетучивалась, а золото оставалось в перегонном аппарате.
Её отделяли от остальной породы и разлагали нагреванием. Ртуть при этом улетучивалась, а золото оставалось в перегонном аппарате.
С XIX в. для извдечения драгоценного металла стали применять цианистый метод: на воздухе золото взаимодействует с раствором цианида натрия, образуя комплексную соль – дицианоаурат (I) натрия:
4Au + 8NaCN + 2H2O + O2 = 4Na[Au(CN)2] + 4NaOH,
а при обработке такого раствора цинком выделяется в свободном виде:
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au↓.
Сегодня золотоносными считаются породы с содержанием золота более 0,0001%. Ученые установили, что некоторые микроорганизмы способны поглощать золото. На этом открытии основан перспективный биохимический метод извлечения золота из отвальных пород.
Около половины производимого в мире золота используется в ювелирном деле. Ювелиры никогда не работают с чистым металлом, ведь он настолько мягок, что легко царапается и деформируется. Золото, содержащее примеси других металлов – меди, серебра, железа, — часто имеет тот или иной цветовой оттенок: от жёлтого и красновато-коричневого до розоватого или даже зеленоватого.
Золото, содержащее примеси других металлов – меди, серебра, железа, — часто имеет тот или иной цветовой оттенок: от жёлтого и красновато-коричневого до розоватого или даже зеленоватого.
Благодаря высокой электропроводности и химической инертности золото активно используется в современной технике: тонким слоем этого металла покрывают контакты, электронагреватели, корпусы часов. На изготовление американского космического корабля «Колумбия» было израсходовано около 40 кг золота.
Еще одна область применения этого металла – медицина. В конце XIX в. немецкий микробиолог Роберт Кох обнаружил, что тетрацианоаурат (III) калия K[Au(CN)4] прекращает рост туберкулезных бактерий, а с 20-х гг. XX в. препараты золота, например санокризин Na3[Au(S2O3)2]∙2H2O, стали применять для лечения туберкулёза, артрита, а также в качестве противоспалительного средства.
Золото необычайно устойчиво к действию большинства окислителей: оно не реагирует с кислородом и не вытесняет водород из кислот.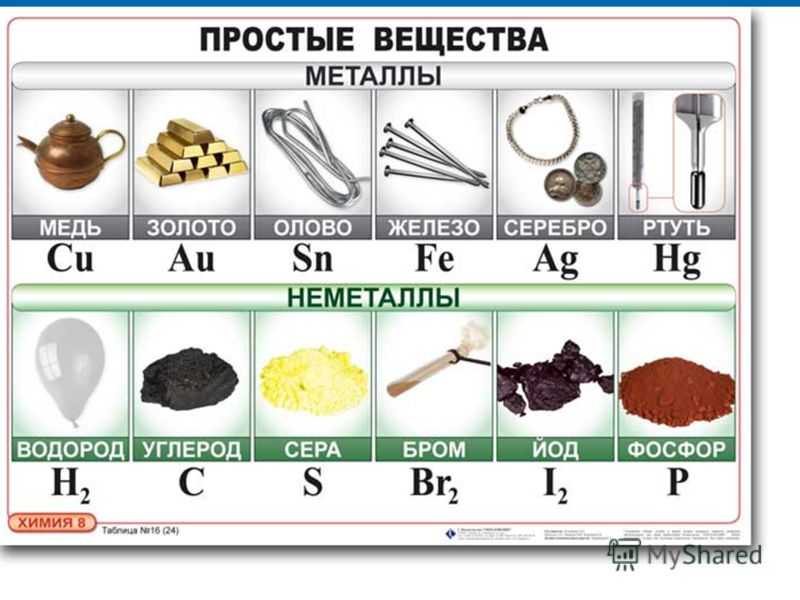 Однако говорить о полной инертности золота неверно: о его способности взаимодействовать с царской водкой знали уже алхимики. Наиболее традиционным методом окисления золота является обработка золотой фольги хлором в среде концентрированной соляной кислоты: 2Au + 3Cl2 + 2HCl = 2H[AuCl4]. Из образующейся при этом золотохлороводородной кислоты получают другие соединения золота. Все они легко могут быть восстановлены до металла.
Однако говорить о полной инертности золота неверно: о его способности взаимодействовать с царской водкой знали уже алхимики. Наиболее традиционным методом окисления золота является обработка золотой фольги хлором в среде концентрированной соляной кислоты: 2Au + 3Cl2 + 2HCl = 2H[AuCl4]. Из образующейся при этом золотохлороводородной кислоты получают другие соединения золота. Все они легко могут быть восстановлены до металла.
Скачать:
Скачать бесплатно реферат на тему: «Медь» [download id=»1549″]
Скачать бесплатно реферат на тему: «Золото» [download id=»1418″]
Скачать бесплатно реферат на тему: «Золото и его переработка» [download id=»1415″]
Скачать бесплатно реферат на тему: «Серебро» [download id=»1741″]
Скачать рефераты по другим темам можно здесь
Какие металлы помимо меди используются в сплаве при производстве столового серебра
Главная \ Статьи \ Какие металлы помимо меди используются в сплаве при производстве столового серебра, и почему серебро 925-й пробы считается самым лучшим для серебряной посуды?
« Назад
Какие металлы помимо меди используются в сплаве при производстве столового серебра, и почему серебро 925-й пробы считается самым лучшим для серебряной посуды? 21. 03.2022 00:00
03.2022 00:00
Чистое серебро… Согласитесь, идея получить в подарок или хотя бы купить серебряную, скажем, чашку, изготовленную из чистого металла, идея очень и очень заманчивая. Заманчивая, но по факту неосуществимая на практике. А все потому, что серебряная посуда, как и любая другая, требует по определению некоторой (и достаточно значительной) степени прочности. В случае же с чистым серебром это по определению невозможно. И совсем не потому, что такое серебро имеет высокую стоимость, а, исходя из его физических свойств. Даже серебряная филигрань не является стопроцентным серебром, не говоря уже о более прочных предметах.
Главный плюс работы с серебром для ювелира — это удивительная пластичность данного металла, но он же одновременно является и минусом, поскольку оборотная сторона пластичности — мягкость. Стопроцентному серебру крайне сложно придать сколько-нибудь устойчивую форму. Вот потому-то оно не используется не только для производства посуды, но и для других менее «эксплуатируемых» в быту форм. Легирование — это насущная необходимость, а совсем не прихоть и уж точно не способ удешевить производство. А вот доля легирующего металла и качество этого металла в сплаве — это вопрос очень многогранный, который волновал человечество испокон веков и продолжает волновать поныне.
Легирование — это насущная необходимость, а совсем не прихоть и уж точно не способ удешевить производство. А вот доля легирующего металла и качество этого металла в сплаве — это вопрос очень многогранный, который волновал человечество испокон веков и продолжает волновать поныне.
Самым распространенным серебром и в ювелирном производстве, и в производстве серебряных приборов является серебро 925-й пробы. Это означает, что количество примесей при этом в сплаве не будет превышать семи с половиной процентов.
Что же касается меди, то, ее можно считать самой древней лигатурой. Еще до того, как свойства серебра были обнаружены и изучены научно, ювелиры прошлого опытным путем поняли, что медь по своим «металлическим» характеристикам очень схожа с серебром, а значит, подходит ему оптимально. К тому же применение меди позволяет создать сплав, который достаточно эффективно противостоит окислительным процессам.
Кроме меди, и не стоит этому удивляться, даже в сплавах высоких проб можно увидеть и цинк, и платину, и германий и даже кремний. Тем не менее, такие «эксперименты» в большинстве своем касаются декоративных серебряных изделий. Серьезные производители, как правило, не идут на риск при производстве посуды из серебра, поскольку она непосредственно контактирует с пищей, и здесь есть необходимость быть уверенными в безопасности продаваемого товара.
Тем не менее, такие «эксперименты» в большинстве своем касаются декоративных серебряных изделий. Серьезные производители, как правило, не идут на риск при производстве посуды из серебра, поскольку она непосредственно контактирует с пищей, и здесь есть необходимость быть уверенными в безопасности продаваемого товара.
Комментариев пока нет
Свойства золота, серебра и меди
Jupiterimages/Photos.com/Getty Images
Автор: Wilkie Collins Обновлено 12 апреля 2017 г. начиная от производства ювелирных изделий и заканчивая производством электроники. Эти металлы обычно добываются на крупных горнодобывающих предприятиях в Африке и Азии, а затем экспортируются в остальной мир для коммерческого и промышленного использования.
Свойства золота
Золото имеет ярко-желтый цвет, когда его находят в массе, но может приобретать такие цвета, как рубин, черный и фиолетовый, если его разделить на более мелкие фрагменты. Золото — самый ковкий из металлов, один грамм которого можно отбить на расстоянии до 300 футов. Он также является эффективным проводником электричества и тепла и не портится при контакте с воздухом или другими реагентами. Наиболее часто встречающиеся соединения, обнаруженные в золоте, включают золотохлористоводородную кислоту и хлорид золота. Согласно веб-сайту Lenntech Water Treatments, использование золота восходит к 3000 г. до н. э. Атомный номер золота 79.; он имеет температуру плавления 1062 градуса по Цельсию и температуру кипения около 2000 градусов.
Он также является эффективным проводником электричества и тепла и не портится при контакте с воздухом или другими реагентами. Наиболее часто встречающиеся соединения, обнаруженные в золоте, включают золотохлористоводородную кислоту и хлорид золота. Согласно веб-сайту Lenntech Water Treatments, использование золота восходит к 3000 г. до н. э. Атомный номер золота 79.; он имеет температуру плавления 1062 градуса по Цельсию и температуру кипения около 2000 градусов.
Свойства серебра
Серебро имеет сияющий белый металлический цвет, немного тверже и устойчивее, чем золото. Устойчив к воздействию воды и воздуха, но может повреждаться при контакте с сероводородом или воздухом, содержащим серу; вот почему серебряные предметы необходимо регулярно чистить и полировать, чтобы сохранить их блеск. Серебро является самым проводящим металлом с точки зрения тепла и электричества, с температурой плавления 9.62 градуса по Цельсию и температура кипения 2212 градусов. Несмотря на его электропроводность, высокая стоимость серебра не позволяет использовать его в коммерческих целях. Серебро используется с древних времен и, как правило, является одновалентным, то есть содержит только один вид соединения в своей структуре.
Серебро используется с древних времен и, как правило, является одновалентным, то есть содержит только один вид соединения в своей структуре.
Свойства меди
Медь — очень ковкий металл, которому можно придавать форму и гнуться, не ломаясь ни в холодном, ни в горячем состоянии. Медь использовалась на протяжении тысячелетий и является очень пластичным металлом, а это означает, что ее можно растянуть в тонкую проволоку. Медь имеет красноватый цвет, обычно имеет кристаллическую структуру и относится к категории «Ib» периодической таблицы вместе с серебром и золотом. Медь вступает в реакцию при контакте с влажным воздухом, вызывая образование на ее поверхности зеленой пленки; это покрытие защищает металл от повреждений. По электропроводности медь уступает только серебру, но она слишком дорога для промышленного использования. Медь является эффективным проводником тепла с температурой плавления 1084 градуса.
Использование золота
Золото чаще всего используется в слитках, производстве ювелирных изделий (на долю которого приходится около 75 процентов добываемого золота) и в качестве второстепенных электрических компонентов в различных устройствах. Металлическое золото также иногда наносят на большие окна зданий в виде тонкой пленки, помогающей отражать тепло солнечных лучей. В электронной промышленности золото используется при гальванике для защиты медных компонентов от повреждений.
Металлическое золото также иногда наносят на большие окна зданий в виде тонкой пленки, помогающей отражать тепло солнечных лучей. В электронной промышленности золото используется при гальванике для защиты медных компонентов от повреждений.
Использование серебра
Серебро также широко используется в производстве ювелирных изделий, а также в фотографии. Серебро содержит соли галогенидов, в том числе нитрат серебра, которые используются в фотопроявлении. Серебро также используется в качестве декоративного обрамления зеркал и для производства предметов роскоши. Электронная промышленность также использует краски на основе серебра для защиты печатных плат от повреждений.
Использование меди
Медь широко используется в производстве электрооборудования, а также в строительстве, сантехнике и кровельных работах. Сплавы меди, такие как медь-олово-цинк, также используются в производстве пушек и ружей, что объясняет его сленговое название «оружейный металл». Медь также используется в производстве кухонной посуды и холодильников — благодаря своим токопроводящим свойствам — и в металлической проводке.
Ссылки
- Материалы от А до Я: Серебро: Применение и свойства серебра
- Lenntech Water Treatments: Gold (Au) – химические свойства, влияние на здоровье и окружающую среду
- Lenntech Water Solutions: Silver – химические свойства, воздействие на здоровье и окружающую среду
- University of Nevada, Reno: Properties of Copper
Writer Bio
Уилки Коллинз начала профессионально писать в 2007 году. Она подавала работы в такие организации, как Venue, веб-сайт, посвященный искусству и культуре Бристоля и Бата (Великобритания), и технологический журнал Sound and Vision. Коллинз имеет степень бакалавра искусств в области журналистики и медиа-исследований Бристольского университета.
Похожие статьи
серебро | Факты, свойства и использование
серебряный самородок
Просмотреть все материалы
- Похожие темы:
- химический элемент
обработка серебра
золото
изделия из серебра
серебрение
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
серебро (Ag) , химический элемент, белый блестящий металл, ценимый за его декоративную красоту и электропроводность. Серебро находится в группе 11 (Ib) и периоде 5 периодической таблицы, между медью (период 4) и золотом (период 6), а его физические и химические свойства занимают промежуточное положение между этими двумя металлами.
Серебро находится в группе 11 (Ib) и периоде 5 периодической таблицы, между медью (период 4) и золотом (период 6), а его физические и химические свойства занимают промежуточное положение между этими двумя металлами.
| атомный номер | 47 |
|---|---|
| атомный вес | 107,868 | melting point | 960.8 °C (1,861.4 °F) |
| boiling point | 2,212 °C (4,014 °F) |
| specific gravity | 10.5 (20 °C [68 °F]) |
| oxidation states | +1, +2, +3 |
| electron configuration | [Kr]4 d 10 5 s 1 |
Properties, uses, и местонахождение
Вместе с золотом и металлами платиновой группы серебро относится к так называемым драгоценным металлам. Из-за своей сравнительной редкости, ярко-белого цвета, ковкости, пластичности и стойкости к атмосферному окислению серебро уже давно используется в производстве монет, украшений и ювелирных изделий. Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов.
Из-за своей сравнительной редкости, ярко-белого цвета, ковкости, пластичности и стойкости к атмосферному окислению серебро уже давно используется в производстве монет, украшений и ювелирных изделий. Серебро обладает самой высокой из всех известных металлов электро- и теплопроводностью и используется при изготовлении печатных электрических схем и в качестве осажденного из паровой фазы покрытия для электронных проводников; он также легирован такими элементами, как никель или палладий, для использования в электрических контактах. Серебро также находит применение в качестве катализатора благодаря своей уникальной способности превращать этилен в оксид этилена, который является предшественником многих органических соединений. Серебро — один из самых благородных, то есть наименее химически активных переходных элементов.
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Серебряные украшения и украшения были найдены в царских гробницах, датируемых 4000 г. до н.э. Вполне вероятно, что и золото, и серебро использовались в качестве денег к 800 г. до н. э. во всех странах между Индом и Нилом.
до н.э. Вполне вероятно, что и золото, и серебро использовались в качестве денег к 800 г. до н. э. во всех странах между Индом и Нилом.
Серебро широко распространено в природе, но его общее количество довольно мало по сравнению с другими металлами; металл составляет 0,05 части на миллион земной коры. Практически все сульфиды свинца, меди и цинка содержат некоторое количество серебра. Серебросодержащие руды могут содержать количество серебра от следов до нескольких тысяч тройских унций на тонну эвердупуа, или около 10 процентов.
В отличие от золота, серебро присутствует во многих природных минералах. Для серебра более важными коммерческими месторождениями являются такие соединения, как минералы тетраэдрит и аргентит (сульфид серебра, Ag 2 S), которые обычно связаны с другими сульфидами, такими как сульфиды свинца и меди, а также с некоторыми другими сульфидами, некоторые из которых также содержат сурьму. Серебро обычно встречается в свинцовых рудах, медных рудах и рудах арсенида кобальта, а также часто связано с золотом в природе. Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Большая часть серебра получается как побочный продукт из руд, которые добываются и обрабатываются для получения этих других металлов. Месторождения самородного (химически свободного или несвязанного) серебра также имеют промышленное значение.
Поскольку большинство руд, содержащих серебро, также содержат такие важные металлы, как свинец, медь или цинк или их комбинацию, серебросодержащая фракция этих руд часто извлекается как побочный продукт производства меди и свинца. . Затем из сырой фракции извлекают чистое серебро путем плавки в сочетании с огневым или электрорафинированием. (Что касается восстановления и аффинажа серебра, см. обработка серебра.)
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
| страна | добыча на руднике в 2016 г. (метрические тонны)* | % мировой добычи полезных ископаемых | доказанные запасы 2016 г. (метрические тонны)* (метрические тонны)* | % мировых доказанных запасов** |
|---|---|---|---|---|
| *Оценивать. | ||||
| ** Включая серебро, получаемое из руд цветных металлов. | ||||
| *** Детали не добавляются к общему количеству из-за округления. | ||||
| Источник: Министерство внутренних дел США, Сводные данные о минеральном сырье, 2017 г. | ||||
| Мексика | 5600 | 20,7 | 37000 | 6,5 |
| Перу | 4100 | 15.2 | 120 000 | 21.1 |
| Китай | 3600 | 13. 3 3 | 39000 | 6,8 |
| Чили | 1500 | 5.6 | 77000 | 13,5 |
| Австралия | 1400 | 5.2 | 89000 | 15,6 |
| Польша | 1400 | 5.2 | 85 000 | 14,9 |
| Россия | 1400 | 5.2 | 20 000 | 3,5 |
| Боливия | 1300 | 4,8 | 22000 | 3,9 |
| Соединенные Штаты | 1100 | 4. 1 1 | 25000 | 4.4 |
| другие страны | 5400 | 20 | 57000 | 10 |
| мировой итог | 27000 | 100*** | 570 000 | 100*** |
Исторически сложилось так, что серебро в основном использовалось в денежной форме в виде резервов серебряных слитков и монет. Однако к 1960-м годам спрос на серебро для промышленных целей, в частности для фотоиндустрии, превысил общий годовой мировой объем производства. В начале 21 века цифровые камеры вытеснили те, в которых использовалась пленка, но спрос на серебро в других секторах, таких как столовое серебро и изделия из серебра с покрытием, украшения, ювелирные изделия, монеты, электронные компоненты и фотогальванические элементы, продолжал оставаться важным.
Сплавы серебра с медью тверже, прочнее и легче плавятся, чем чистое серебро, и используются для ювелирных изделий и чеканки монет. Доля серебра в этих сплавах указывается в пробе, что означает количество частей серебра на тысячу сплава. Стерлинговое серебро содержит 92,5 процента серебра и 7,5 процента другого металла, обычно меди; т. е. оно имеет пробу 925. Ювелирное серебро представляет собой сплав, содержащий 80 процентов серебра и 20 процентов меди (чистота 800). Желтое золото, используемое в ювелирных изделиях, состоит из 53 процентов золота, 25 процентов серебра и 22 процентов меди. (Для рассмотрения использования серебра в декоративных и бытовых предметах, см. металлоконструкции.)
Серебро природное состоит из смеси двух стабильных изотопов: серебра-107 (51,839%) и серебра-109 (48,161%). Металл не реагирует с влажным воздухом или сухим кислородом, а поверхностно окисляется влажным озоном. Он быстро тускнеет при комнатной температуре из-за воздействия серы или сероводорода. В расплавленном состоянии серебро может растворять до 22-кратного объема кислорода; при затвердевании большая часть кислорода удаляется, явление, известное как выплескивание серебра. Это можно контролировать, добавляя в расплавленное серебро раскислитель, такой как древесный уголь. Серебро легко растворяется в азотной кислоте и в горячей концентрированной серной кислоте. Металл также растворяется в окисляющих кислотах и в растворах, содержащих ионы цианидов, в присутствии кислорода или перекисей. Растворение в растворах цианидов связано с образованием очень стабильного дицианоаргентата [Ag(CN) 2 ] − , ион.
В расплавленном состоянии серебро может растворять до 22-кратного объема кислорода; при затвердевании большая часть кислорода удаляется, явление, известное как выплескивание серебра. Это можно контролировать, добавляя в расплавленное серебро раскислитель, такой как древесный уголь. Серебро легко растворяется в азотной кислоте и в горячей концентрированной серной кислоте. Металл также растворяется в окисляющих кислотах и в растворах, содержащих ионы цианидов, в присутствии кислорода или перекисей. Растворение в растворах цианидов связано с образованием очень стабильного дицианоаргентата [Ag(CN) 2 ] − , ион.
Подобно меди, серебро имеет единственный электрон s вне завершенной оболочки d , но, несмотря на сходство электронных структур и энергий ионизации, между серебром и медью мало сходства.
Соединения
Для серебра наиболее важной степенью окисления во всей его обычной химии является состояние +1, хотя известны состояния +2 и +3.