Виды реактивов для золота и способы их использования. Хлорное золото
Хлорное золото: определение пробы золота
Хлорное золото является одним из определителей чистоты состава материала, используемого для производства ювелирной продукции. Проведение контроля качества сплава производится предприятиями, изготавливающими ювелирную продукцию, мастерскими, имеющими лицензию на работу с драгметаллами, и ломбардами.

Методы идентификации пробы золота
Выпущенные изделия из благородных сплавов перед нанесением клейма соответствующей пробы тщательно проверяются на предприятиях, контролирующих соответствие качества продукции установленным стандартам. Содержание драгоценных компонентов определяют с помощью специальных методов анализа, позволяющих не разрушать состав или производить над ним манипуляции, связанные с разрушением первозданного вида. Опробование производится не только на ювелирных заводах, но и:
- на предприятиях розничной торговли;
- в ювелирных мастерских;
- в учреждениях, выдающих кредиты под залог ювелирных изделий.
Наиболее распространен способ проверки соответствия на кремнистом сланце (пробирном камне). Конечно, у этого метода есть свои недостатки, он является приближенным, но:
- позволяет сохранить целостность изделия;
- отличается простотой в использовании;
- применяется для определения любого вида сплава;
- отличается скоростью проведения анализа.
Использование пробирных иголок, то есть полосок сплавов, соответствующих определенному составу материала и наличию лигатурных компонентов. Чем больше ассортимент используемых материалов входит в стандарт пробы, тем полнее комплект иголок.
Применение химических реактивов относится к разрушающему способу определения состава. Их действие на сплавы однотипно. Если материал содержит высшее количество драгметалла, то реагент не оставит на изделии следа. Если количество лигатурных добавок выше нормы, предусмотренной стандартами, то появится легкая тень. Образованное пятно в опробованном месте укажет на заметную разницу в составе материала.
Несмотря на то что реактивы используются для определения практически всех проб золота, наиболее широко применяемым является специальный кислотный раствор.
Для установления соответствия нанесенного на ювелирное изделие клейма более точный результат покажет используемый реактив хлорное золото. Несмотря на узкую направленность действия данного реагента, его использование позволят определять сплавы широкого спектра, устанавливая наличие долевого содержание золота в составе материала по степени окисления и насыщенности цвета.
Хлористое золото различно действует на разные составы. При навыках работы с реагентом можно определять серебро среди других белых металлов.
Для проверки чистоты сплава реагент наносится на поверхность. Материал от 999 до 585 пробы с реактивом не взаимодействует, а на 583 — оставляет едва заметный след. На сплаве, содержащем 50 % солнечного металла, остается светлое коричневое пятно. Для материала, в состав которого входит 37,5 % драгметалла, реакция на хлорное золото проявляется в виде темного коричневого осадка. Чем ниже проба, тем насыщенней осадок и цвет пятна.
Хлорное золото не вступает в реакцию с химическими элементами платиновой группы и некоторыми видами нержавеющей стали.
Использование чистой азотной кислоты является самым доступным и распространенным способом для идентификации содержания драгметалла в составе материала. При попадании на золото, проба которого ниже 583, происходит реакция с выделением газа. Чем ниже содержание благородного металла, тем интенсивней выделяются пузырьки под каплей кислоты.
Диагностика состава материала
Давно известен факт, что золото не подвергается воздействию внешней среды и устойчиво к любым реагентам. Но купание благородного металла в царской водке способно полностью растворить благородный химический элемент. Такое свойство металла установлено в процессе опытов с разнообразными реагентами.
Как раз реакция на воздействие определенных растворов заложена в методе, позволяющем установить компонентное содержание состава. Действие кислотных реагентов предоставляет возможность провести определение пробы золота от 333 до 900. Кислотные реактивы имеют расширенные стандарты для сплавов, различающихся компонентным содержанием и цветом.
Например, материал 585 пробы в зависимости от содержания лигатурных компонентов может отличаться по цвету. Соответственно реакция состава материала на реагент будет разная.
Осуществить проверку пробы золота кислотным реактивом можно в следующей последовательности:
- механическим способом натереть небольшую пробу из изделия на специальном камне;
- с помощью стеклянной палочки нанести реагент на материал;
- визуально сравнить, как выглядит результат химической реакции с установленными стандартами.
Экспертную проверку пробы сплава драгметалла можно провести, воспользовавшись услугами специальной службы, которая обеспечит получение достоверной информации.
Подтвердить соответствие 585 пробы в изделии можно с помощью специального определителя. Цифровой портативный детектор позволяет в течение нескольких секунд установить содержание состава в диапазоне от 6 до 18 карат.
Подтвердить подлинность 585 пробы можно в домашних условиях с помощью обыкновенного спиртового раствора йода. Для этого в незаметном месте (лучше с обратной стороны ювелирного украшения) необходимо чуть протереть изделие наждаком и в этом месте смазать йодом.Если сплав 585 пробы, то йодный раствор оставит на протертом участке украшения темное пятно. Для сравнения можно провести эксперимент с изделиями, внешне сходными с золотыми (из латуни, меди, бронзы). После проведенных манипуляций на них не останется следа.
tozoloto.ru
Реактив на золото и методы его применения
В этой статье:
Одним из точных методов апробирования золота является метод с нанесением реактивов. Реактив на золото — это вещество, по реакции которого можно определить наличие и количество золота в сплаве. В зависимости от пробы золота, реактив также может понадобиться разный. Более того, для более точного определения часто есть необходимость провести опыт несколько раз, используя разные реактивы.
Методика применения реактивов
Для апробирования золота используется три типа реактивов:
- кислотные, или стандартные;
- хлорное золото;
- йодистый калий.
В зависимость от используемого реактива для определения пробы понадобится разное время. Быстрее всего действует йодистый калий — 2–5 сек. Самой медленной является реакция для кислотного реактива, предназначенного для пробы золота выше 750 и самого металла.
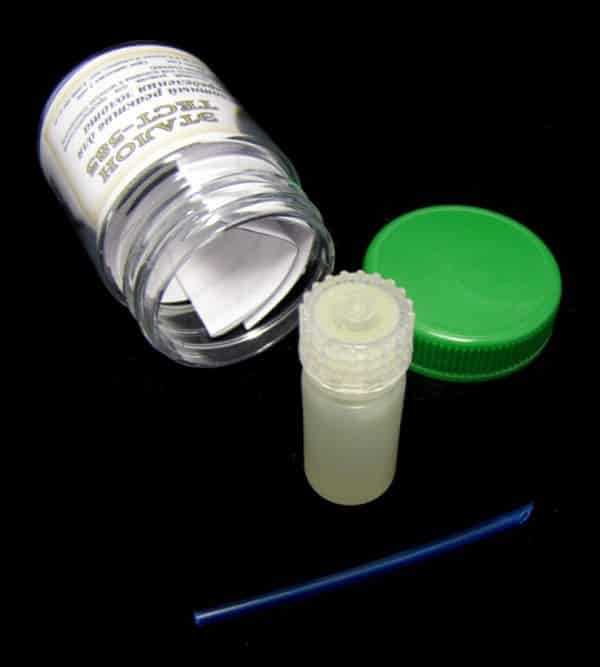 Кислотный реактив для определения золота и платины
Кислотный реактив для определения золота и платиныДля того чтобы на глаз определить, какой понадобится реактив, нужно знать некоторые характеристики золота. Чем выше проба, тем металл мягче. Плотность будет выше у золота более высокой пробы. Для того чтобы определить плотность металла, необходимо взвесить изделие на весах, а потом в жидкости. Если разделить одно значение на другое мы и получим плотность. Далее для определения пробы пользуются методикой:
- Если золота содержится около 37 процентов, что соответствует 375 пробе, то металл сначала апробируется хлоридом золота, после чего реактивом для 375 пробы.
- Для 500 пробы используется такой же порядок — хлорид золота, далее реактив для этой пробы. Так как 500 проба чаще всего представляет 585 пробу, но немного загрязненную, поэтому дополнительно может быть проверена кислотным реактивом для этой пробы.
- Золотые сплавы, имеющие белый цвет, в которых золота содержится предположительно до 60 %, — хлоридом золота.
- Золотые сплавы 750 пробы, включая белое золото, — реактивом до 750 пробы, можно уточнить хлоридом золота, не является ли изделие грубой подделкой.
- Сплавы, в которых золота содержится более 80 %, — раствором йодистого калия, так же как и при 750 пробе возможно уточнение при помощи хлорида золота.
Кислотные реактивы
Все кислотные реактивы имеют однотипное действие, они оставляют светлое пятно на металле той пробы, для которой они предназначены, или никак не реагируют. На металл более высокой пробы тоже не реагируют и оставляют коричневое пятно, если проба меньше той, для которой предназначен реактив. В его приготовлении используются:
- азотная кислота плотностью 1,4;
- соляная кислота, плотностью 1,19;
- дистиллированная вода.
Для разных проб золота готовятся растворы в таких пропорциях:
| 375 | 0.595 | 0.405 | |
| 500 | 1 | ||
| 583/585 | 0.46 | 4 капли | 0.54 |
| 750 | 0.593 | 0.011 | 0.396 |
| 833 | 0.687 | 0.013 | 0.3 |
| 900 | 0.692 | 0.013 | 0.295 |
| 958 | 0.787 | 0.02 | 0.193 |
Кислотный реактив на 500 пробу золота можно также считать универсальным для любой пробы. Он представляет собой чистую азотную кислоту, которая будет реагировать на все виды золота, проба которых ниже 583. Он является наиболее дешевым и доступным. На всех сплавах, содержащих золота менее половины, под каплей будут выделяться пузырьки. Чем ниже проба, тем выделение будет интенсивнее.
Если золота не содержится вовсе, реакция произойдет мгновенно и появится зеленая пена, которая будет сопровождаться шипением. На серебре невысокой пробы она оставит сероватое пятно, а при пробе ниже 800 реакция будет такая же, с пузырьками. На серебре ниже 600 пробы азотная кислота будет кипеть. Такой реактив часто применяется как начальный для приблизительного определения исследуемого металла.
Хлорное золото
Хлорное золото часто используется для апробирования изделий, проба и состав которых неизвестны. Наибольшую эффективность оно имеет, когда нужно определить подделки, например, если изделие только покрыто слоем золота или этого металла и вовсе нет. Этот реактив применяется, если необходимо апробировать 500 и 583/585 пробы золота.
 Хлорное золото
Хлорное золотоРеактив хлорное золото — не только для определения золота, с его помощью определяют и другие разновидности драгоценных металлов и сплавов. Для того чтобы провести такой анализ, на поверхность исследуемого металла наносят каплю реактива и ожидают. Спустя некоторое время, образуется пятно определенного цвета, по которому и определяют, с каким металлом имеют дело.
| Белый | Темно-зеленый | До 2 сек. | Серебро высокой пробы |
| От желтого до темно-желтого, сопровождается выделением газа | До 2 сек. | Алюминий | |
| Черный | Приблизительно полминуты | Олово | |
| Серовато-белый | Не оказывает действия | 30–40 сек. | Платина |
| От желтого, быстро становится очень темным | До 2 сек. | Цинк | |
| Синевато-белый | Грязно-желтый | До 2 сек. | Свинец |
| Желтый | Не оказывает действия | До 2 сек. | Высокопробное золото в сплаве с серебром |
| Каштановый | До 6 минут | Низкопробные сплавы золота с серебром и медью | |
| Черный | До 2 сек. | Латунь | |
| Бледно-желтый | Черный | До 2 сек. | Низкопробное серебро, в лигатуре — медь |
| Красный | Не оказывает действия | До 2 сек. | Высокопробный сплав золота. В лигатуре — медь |
| Золотистый | До 6 минут | Низкопробное золото в сплаве с медью | |
| Черный | До 2 сек. | Медь |
Чем ниже проба золота, тем темнее будет выглядеть пятно на поверхности металла. На золоте стандартной и самой распространенной у нас пробы 585 хлорид золота даст коричневое пятно, на белом золоте той же пробы — оранжевое. На 500 — темно-каштановое, на 375 пробе хлорид золота оставит зеленое пятно. Данный реактив хорошо взаимодействует с золотом и серебром и не оказывает никакого влияния на платину и металлы платиновой группы. Также он плохо реагирует с некоторыми видами стали.
Раствор йодида калия
Этот раствор применяется для проверки сплавов золота с высокой пробой, а также определения хороших подделок, то есть тех, которые сделаны из сплавов, инертных к большинству веществ. Действует раствор так:
- На сплаве с содержанием золота выше 90 % реактив образует яркое красное пятно.
- На золотых сплавах с содержанием золота от 80 до 90 % — бордовое пятно. Такой сплав золота часто содержится в ломе, который остался после коронок или протезов для зубов.
- На подделках из сплавов, которые имеют высокую устойчивость, образуется черное или зеленое, но чернеющее пятно. Реакция сопровождается выделением пузырьков.
Описание реакций для проб
Таким образом, можно считать, что проба определена, когда для нее наблюдаются такие реакции:
- 375: при реакции с хлоридом золота образуется пятно зеленовато-коричневого цвета, реакция при взаимодействии с реактивом из кислоты для этой пробы отсутствует.
- 500: при взаимодействии с хлоридом золота образуется светло-коричневое пятно, со стандартным реактивом — прозрачная капля. Если для уточнения был использован реактив для 585 пробы, на 500 пробе будет пятно каштанового цвета.
- 500, белое: от хлорида золота — пятно коричневого цвета.
- 585: от хлорида золота — прозрачная капля, от реактива — светлое пятно.
- 585, белое: от хлорида золота останется пятно золотистого цвета.
- 750: едва уловимое пятно от хлорида золота, то же самое и для реактива из кислот.
- 750, белое: от реактива — светло-коричневое пятно.
- 800: темно-красное пятно — от йодида калия.
- Выше 900: красное пятно — от йодида калия.
Порядок проведения апробации.
Прежде всего, проводится осмотр изделия. Внимание обращается на клеймо; иногда, если оно фальшивое, это можно определить визуально. Например, могут быть асимметричные символы, а сами формы и изображения — выглядеть кривыми. Далее необходимо определить принадлежность сплава к группе высокопробного или низкопробного золота.
Перед началом исследования поверхность изделия на небольшой площади зачищается, так как оно может быть покрыто слоем из другого металла, например, быть просто позолоченным или родированным. Зачистка проводится аккуратно, далеко от пробирного клейма, с внутренней стороны изделия.
На зачищенную поверхность наносится капля вещества. Она должна очень аккуратно лечь на украшение. При определении результатов важно точно соблюдать все рекомендации и следить за временем нахождения капли на поверхности изделия. После того как реакция закончилась, каплю реактива удалить.
Использование реактивов на золото — не единственный метод для определения его пробы. Это исследование также можно провести с использованием пробирного камня и пробирных игл. Существует также и специальный прибор для апробирования золота. Но реактивы обладают достаточной точностью и удобны в использовании, скажем, в небольших мастерских.
hochuzoloto.com
Раствор - хлорное золото - Большая Энциклопедия Нефти и Газа, статья, страница 1
Раствор - хлорное золото
Cтраница 1
Раствор хлорного золота выпаривают с соляной кислотой и золото выделяют сернистым газом. Желтая окраска раствора, полученного от обработки серебряного королька азотной кислотой, указывает на присутствие платины, а коричневатая - палладия. Раствор выпаривают досуха, нитрат серебра сплавляют, затем извлекают горячей водой и фильтруют. Коричневый или черный осадок отмывают от серебра, возвращают обратно в стакан и растворяют в нескольких кашшх царской водки; присоединяют фильтрат от выделения золота и удаляют азотную кислоту двукратным выпариванием с небольшим избытком соляной кислоты. Остаток растворяют в нескольких миллилитрах воды и раствор фильтруют через маленький тампон из фильтробумажной массы, который повторно промывают несколькими каллями воды. Фильтрат может быть окрашен в желтый или оранжевый цвет, его выларивают почти досуха с очень небольшим количеством хлористого аммония: образование желтого осадка кристаллов октаэдрической системы доказывает присутствие платины. Фильтрат от осадка хлороплатината аммония, если он окрашен в коричневато-желтый цвет, содержит палладий, который идентифицируют чувствительной реакцией с диметилглиок-симом. [1]
В раствор хлорного золота вводят весьма высокодисперсный зародышевый золь золота, полученный восстановлением хлорного золота эфирным раствором фосфора. Последующее добавление восстановителя, например формальдегида, приводит к росту частиц на введенных зародышах. Монодисперсность системы обеспечивается постоянством скорости роста частиц. [2]
Действие раствора хлорного золота на некоторые металлы вызывает характерные явления. [3]
При прибавлении раствора хлорного золота к солянокислому раствору основания выпадает кристаллический осадок. [4]
При восстановлении растворов хлорного золота в определенных условиях оно выпадает в коллоидном состоянии, окрашивая раствор в рубиново-красный цвет. Образование коллоидного золота используют при производстве стекла. [5]
Если к раствору хлорного золота прибавить едкого кали, то сперва образуется осадок, который в избытке щелочи вновь растворяется. Раствор их имеет резкую щелочную реакцию. Но она в этом случае содержит еще подмесь щелочей, при растворении же в азотной кислоте и разбавлении водою получается в чистом виде и тогда дает бурый порошок, разлагающийся ниже 250 на золото и кислород. Она нерастворима ни в воде, ни во многих кислотах, но растворяется в щелочах, что и показывает кислотный характер окиси золота. [6]
В результате прибавления раствора хлорного золота к водному раствору хлоргидрата софоридина выпадает светло-желтый кристаллический осадок. Из большого количества метилового спирта кристаллизуется в мелкие, светло-желтые иголки. [7]
При действии тиомочевины на раствор хлорного золота выделяется свободный хлор, и в результате реакции получается соединение одновалентного золота [ Au2SC ( Nh3) 2 ] Cl, водные растворы которого дают щелочную реакцию. [8]
Кривые при потен-циометрическом титровании растворов хлорного золота с золотым, хлорной меди с медным электродом. [9]
Затем добавляют необходимое количество раствора хлорного золота ( 0 001 г Аи) и раствор разбавляют до 50 мл водой. Полученный осадок отфильтровывают, высушивают и растирают в агатовой ступке. [10]
Порошкообразное золото получают из раствора хлорного золота путем осаждения железным купоросом. [11]
Хлораурат получается при прибавлении раствора хлорного золота к солянокислому раствору основания, в в иде светло-желтого кристаллического осадка. При нагревании последний переходит в раствор и выпадает при охлаждении в виде красивых, блестящих желтых плоских игл. [12]
Электролитом для аффинажа золота служит раствор хлорного золота и соляной кислоты. Для предупреждения накопления в электролите примесей, затрудняющих электролиз, его периодически обновляют. [13]
Золото вводится в эталоны в виде раствора хлорного золота. Бор может применяться в виде борной кислоты, однако целесообразнее применять буру, в особенности, если растворы, содержащие бор, предназначены для эталонирования окисей: существуют указания, что во время дегидратации борной кислоты путем нагревания происходит частичная потеря бора, если даже нагрев ведется только до 500 - 600 С, когда В2О3 заведомо не испаряется [87], Присутствие в буре натрия обычно не влияет на результаты анализа, так как бор в атомных материалах приходится обычно определять при концентрациях 10 - 4 - 10 - 5 %; при этом натрий содержится в пробах чаще всего в 100 - 1000 раз больших количествах. Если концентрация натрия в анализируемом материале мала, то его количество, введенное в эталоны вместе с бором, легко учесть. [14]
Затем вводят определенное количество зародышевого золя в раствор хлорного золота и производят его восстановление, добавляя, например, формальдегид. Золото, выделяющееся при таком восстановлении, кристаллизуется и равномерно распределяется на уже имеющихся в системе частицах. Величина частиц получаемого при этом монодисперсного золя будет тем больше, чем меньше зародышей было введено в раствор перед его восстановлением. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Хлорное золото - Большая Энциклопедия Нефти и Газа, статья, страница 1
Хлорное золото
Cтраница 1
Хлорное золото хлорирует бензол и восстанавливается при этом до хлорида одновалентного золота. [1]
Хлорное золото АиС13 - 2Н2О получается растворением металлического золота в царской водке ( 3 вес. Растворение производится при нагревании смеси на песочной бане при 70 - 80 до прекращения выделения бурых паров и образования густой темной маслянистой массы. [2]
Хлорное золото АиС13 - 2Н2О получают растворением металлического золота в царской водке ( 3 вес. Растворение ведут при нагревании смеси на песочной бане при 70 - 80, пока не прекратится выделение бурых паров и не образуется густая темная маслянистая масса. [3]
Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. [4]
Хлорное золото разбавляют пятикратным количеством воды п переводят в гремучее золото добавлением 25 % - ного аммиака из расчета 10 мл NH ( OH на 1 г Аи с последующим нагреванием раствора для удаления избытка аммиака. Осадок гремучего золота состава [ Аи ( ЫНз) з ( ОН) з) отстаивают, промывают через фильтр горячей водой ( нельзя высушивать, осадок взрывоопасен. [5]
Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. [6]
Иногда хлорное золото переводят в гремучее золото. Для этого к раствору хлорного золота добавляют по 10 мл 25 % - ного раствора аммиака на каждый грамм растворенного золота. Его отстаивают, отфильтровывают, несколько раз промывают кипящей водой и во влажном состоянии вводят в раствор цианистого калия. Необходимо помнить, что гремучее золото в сухом виде взрывоопасно. [7]
Безводное хлорное золото металлирует ароматич. [8]
Сколько хлорного золота образуется при растворении в царской водке Юг-атом золота; 1 97 кг золота. [9]
Раствор хлорного золота выпаривают с соляной кислотой и золото выделяют сернистым газом. Желтая окраска раствора, полученного от обработки серебряного королька азотной кислотой, указывает на присутствие платины, а коричневатая - палладия. Раствор выпаривают досуха, нитрат серебра сплавляют, затем извлекают горячей водой и фильтруют. Коричневый или черный осадок отмывают от серебра, возвращают обратно в стакан и растворяют в нескольких кашшх царской водки; присоединяют фильтрат от выделения золота и удаляют азотную кислоту двукратным выпариванием с небольшим избытком соляной кислоты. Остаток растворяют в нескольких миллилитрах воды и раствор фильтруют через маленький тампон из фильтробумажной массы, который повторно промывают несколькими каллями воды. Фильтрат может быть окрашен в желтый или оранжевый цвет, его выларивают почти досуха с очень небольшим количеством хлористого аммония: образование желтого осадка кристаллов октаэдрической системы доказывает присутствие платины. Фильтрат от осадка хлороплатината аммония, если он окрашен в коричневато-желтый цвет, содержит палладий, который идентифицируют чувствительной реакцией с диметилглиок-симом. [10]
Действие раствора хлорного золота на некоторые металлы вызывает характерные явления. [11]
При введении хлорного золота в эмульсию наблюдается соответствие между ходом монохроматических кривых примесного спектрального поглощения и кривой относительной интегральной светочувствительности: максимальные значения обеих величин достигаются при одной и той же концентрации введенного раствора хлорного золота. Введение же в липмановскую эмульсию роданида золота приводит к непрерывному повышению светочувствительности при неоднозначном изменении примесного спектрального поглощения. Обнаруженная картина изменения поглощения связана, вероятно, с эволюцией образующихся примесных центров, а именно с различием скоростей их накопления и коагуляции. При введении небольших концентраций раствора хлорида и роданида золота ( до 0 02 %) скорость накопления центров, вероятно, превышает скорость их коагуляции; при увеличении же концентрации золота ( до 0 04 %) превалирует скорость коагуляции, что и вызывает снижение величины спектрального поглощения. [13]
В раствор хлорного золота вводят весьма высокодисперсный зародышевый золь золота, полученный восстановлением хлорного золота эфирным раствором фосфора. Последующее добавление восстановителя, например формальдегида, приводит к росту частиц на введенных зародышах. Монодисперсность системы обеспечивается постоянством скорости роста частиц. [14]
При нагревании хлорного золота до 190 оно разлагается и образует хлористое золото. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Хлорное золото - Большая Энциклопедия Нефти и Газа, статья, страница 1
Хлорное золото
Cтраница 1
Хлорное золото хлорирует бензол и восстанавливается при этом до хлорида одновалентного золота. [1]
Хлорное золото АиС13 - 2Н2О получается растворением металлического золота в царской водке ( 3 вес. Растворение производится при нагревании смеси на песочной бане при 70 - 80 до прекращения выделения бурых паров и образования густой темной маслянистой массы. [2]
Хлорное золото АиС13 - 2Н2О получают растворением металлического золота в царской водке ( 3 вес. Растворение ведут при нагревании смеси на песочной бане при 70 - 80, пока не прекратится выделение бурых паров и не образуется густая темная маслянистая масса. [3]
Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. [4]
Хлорное золото разбавляют пятикратным количеством воды п переводят в гремучее золото добавлением 25 % - ного аммиака из расчета 10 мл NH ( OH на 1 г Аи с последующим нагреванием раствора для удаления избытка аммиака. Осадок гремучего золота состава [ Аи ( ЫНз) з ( ОН) з) отстаивают, промывают через фильтр горячей водой ( нельзя высушивать, осадок взрывоопасен. [5]
Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. [6]
Иногда хлорное золото переводят в гремучее золото. Для этого к раствору хлорного золота добавляют по 10 мл 25 % - ного раствора аммиака на каждый грамм растворенного золота. Его отстаивают, отфильтровывают, несколько раз промывают кипящей водой и во влажном состоянии вводят в раствор цианистого калия. Необходимо помнить, что гремучее золото в сухом виде взрывоопасно. [7]
Безводное хлорное золото металлирует ароматич. [8]
Сколько хлорного золота образуется при растворении в царской водке Юг-атом золота; 1 97 кг золота. [9]
Раствор хлорного золота выпаривают с соляной кислотой и золото выделяют сернистым газом. Желтая окраска раствора, полученного от обработки серебряного королька азотной кислотой, указывает на присутствие платины, а коричневатая - палладия. Раствор выпаривают досуха, нитрат серебра сплавляют, затем извлекают горячей водой и фильтруют. Коричневый или черный осадок отмывают от серебра, возвращают обратно в стакан и растворяют в нескольких кашшх царской водки; присоединяют фильтрат от выделения золота и удаляют азотную кислоту двукратным выпариванием с небольшим избытком соляной кислоты. Остаток растворяют в нескольких миллилитрах воды и раствор фильтруют через маленький тампон из фильтробумажной массы, который повторно промывают несколькими каллями воды. Фильтрат может быть окрашен в желтый или оранжевый цвет, его выларивают почти досуха с очень небольшим количеством хлористого аммония: образование желтого осадка кристаллов октаэдрической системы доказывает присутствие платины. Фильтрат от осадка хлороплатината аммония, если он окрашен в коричневато-желтый цвет, содержит палладий, который идентифицируют чувствительной реакцией с диметилглиок-симом. [10]
Действие раствора хлорного золота на некоторые металлы вызывает характерные явления. [11]
При введении хлорного золота в эмульсию наблюдается соответствие между ходом монохроматических кривых примесного спектрального поглощения и кривой относительной интегральной светочувствительности: максимальные значения обеих величин достигаются при одной и той же концентрации введенного раствора хлорного золота. Введение же в липмановскую эмульсию роданида золота приводит к непрерывному повышению светочувствительности при неоднозначном изменении примесного спектрального поглощения. Обнаруженная картина изменения поглощения связана, вероятно, с эволюцией образующихся примесных центров, а именно с различием скоростей их накопления и коагуляции. При введении небольших концентраций раствора хлорида и роданида золота ( до 0 02 %) скорость накопления центров, вероятно, превышает скорость их коагуляции; при увеличении же концентрации золота ( до 0 04 %) превалирует скорость коагуляции, что и вызывает снижение величины спектрального поглощения. [13]
В раствор хлорного золота вводят весьма высокодисперсный зародышевый золь золота, полученный восстановлением хлорного золота эфирным раствором фосфора. Последующее добавление восстановителя, например формальдегида, приводит к росту частиц на введенных зародышах. Монодисперсность системы обеспечивается постоянством скорости роста частиц. [14]
При нагревании хлорного золота до 190 оно разлагается и образует хлористое золото. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Как позолотить металл в домашних условиях?
В этой статье:
Изделия из позолоченных металлов всегда обладали большой популярностью. При бережном обращении они имели прекрасный вид и стоили недорого. Поэтому многие могли себе позволить менять украшения часто и подбирать к соответствующим нарядам. Однако со временем позолота стиралась, а золочение в ювелирной мастерской стоит даже дороже самого изделия. Поэтому многие задумываются, как позолотить металл в домашних условиях.
Растворы для золочения
Для нанесения на предмет слоя золота его необходимо растворить. Золото — металл, который обладает химической инертностью, почему и ценится, и именно поэтому сделать это не так-то просто. Растворителем для золота может выступать только царская водка — химическое вещество, представляющее собой смесь азотной и соляной кислот. Соляной кислоты нужно взять три объемных части, а азотной — одну.
 Позолоченное кольцо
Позолоченное кольцоПосле того как золото растворится, необходимо жидкость выпарить. Только делать это нужно аккуратно, на открытом воздухе, соблюдая правила осторожности, используя респиратор и перчатки. Газы, которые испаряются при выпаривании, вдыхать категорически нельзя, иначе можно получить ожог слизистой. Необходимо также использовать очки для защиты глаз. После того как выпарится жидкость, останется хлорное золото.
Способы золочения
Чтобы позолотить изделие методом натирания хлоридом золота, последний необходимо растворить в цианистом калии, после чего размешать с отмученным мелом до кашеобразного состояния. Предмет покрывают этим раствором, после чего ждут некоторое время, обмывают и полируют.
Если необходимо покрыть таким слоем сталь или железо, хлорид золота растворяют в эфире. Раствор наносят на поверхность, а после того как эфир испарится, натирают тряпкой. Если делать это не кисточкой, а гусиным пером, то можно получить узор.
Цинк покрывают следующим образом. Готовят пасту, которая состоит из 60 г цианистого калия и 20 г хлорида золота, разбавляют их в 100 г воды и взбалтывают. После чего фильтруют и добавляют смесь винного камня и мела, соответственно 5 г и 100 г, до консистенции кашицы. На металл паста наносится кисточкой или щеткой.
Золочение серебра делается несколько другим способом. Золото растворяют в разбавленной водой царской водке, после этого добавляют поташ и выливают в котел из железа, где уже кипятятся два литра воды. В течение 120 минут эту жидкость кипятят.
Серебряные предметы, которые хотят позолотить, прокаливают и травят раствором серной кислоты. После этого на короткий промежуток времени их отправляют в азотную кислоту. Потом связывают проволокой из латуни и быстро отправляют в жидкость, которая представляет собой смесь трех кислот — азотной, серной и соляной, вынимают сразу же. Затем изделия ополаскиваются водой, погружаются в ртуть и воду, а через полминуты в ванну с жидкостью, которая состоит из 10 г золота, по 25 г азотной и соляной кислот, 25 г воды и 300 г поташа.
После золочения изделия промывают и просушивают в опилках. Если во время того как изделия погружены в ванну с раствором для золочения, к ним прикоснуться цинковой палкой, то слой золота будет больше.
Если необходим контакт с цинком, то используют такой раствор:
- 15 г хлорида золота;
- 65 г поташа;
- 65 г калия железистосинеродистого, или желтой кровяной соли;
- 2 л воды.
Для того чтобы покрыть изделия таким раствором, очищенные и обезжиренные предметы помещают в подогретый раствор и используют палочку из цинка для контакта.
Если необходимо покрыть золотом медь или ее сплавы, то в 1,5 литра воды растворяют 10 г фосфоронатриевой соли и 6 г гидроксида калия. Отдельно в 0,5 литра воды растворяют 2 г хлорида золота и 32 г цианида калия и перемешивают растворы. При золочении смесь необходимо будет довести до кипения.
Чтобы позолотить таким способом железо, сталь, цинк или олово, их предварительно покрывают слоем меди.
Если требуется нанести покрытие на металлическую проволоку, то она должна быть предварительно помещена в раствор из одной части серной кислоты на 10 частей воды. После этого ее вымачивают в азотной кислоте и опускают в раствор из меди. Далее подготавливают растворы для золочения: 150 г калия на 5 л воды и 10 г хлорида золота в одной емкости и 50 г гидрофосфата натрия на 5 л воды и 50 г гидроксида калия. Растворы перемешиваются и доводятся до кипения, после чего туда опускается пропитанная медью проволока.
Золочение методом гальваники
Чтобы позолотить изделие этим методом, понадобятся:
- 60 г гидрофосфата натрия;
- 1 л воды;
- 3 г хлорида золота;
- 1 г цианида калия;
- 10 г двусернокислого натрия.
Гидрофосфат натрия смешивается с водой комнатной температуры (0,7 л) и находится в ней до полного растворения. В другой емкости растворяется в 150 мл воды 2,5 г хлорида золота. После этого в 150 мл воды растворяется еще 1 г цианистого калия и 10 г двусернокислого натрия. Первые две массы смешиваются между собой, после чего добавляется и третья. Для золочения используют платиновый катод. Когда раствор истощается, добавляют еще хлорного золота.
 Гальваническое нанесение позолоты
Гальваническое нанесение позолотыЗолочение металлов: серебра, железа, меди и других — проходит с предварительным нанесением другого металла, без прокладки делается с использованием ванны по Зельми. Для этого берут 1 г кальцинированной соды и доводят в чашке из фарфора до кипения с таким же количеством калия железистосинеродистого и 30 г воды. Далее добавляют золото, которое было получено путем осаждения аммиаком, 50 г хлорида золота и кипятят 12 минут. По истечении этого времени должен образоваться осадок красного цвета, а жидкость должна принять золотистый цвет. После этого ее фильтруют и используют для гальваники.
Покрыть золотом металлы нетрудно, реактивы для этого имеют вполне доступную стоимость. Это вполне может стать актуальным, если вы хотите регулярно покрывать благородным металлом большие объемы изделий или открыть свою мастерскую.
hochuzoloto.com
Хлорное золото - Технический словарь Том VII
Хлорное золото хлорирует бензол и восстанавливается при этом до хлорида одновалентного золота. Хлорное золото АиС13 - 2Н2О получается растворением металлического золота в царской водке ( 3 вес. Растворение производится при нагревании смеси на песочной бане при 70 - 80 до прекращения выделения бурых паров и образования густой темной маслянистой массы. Хлорное золото АиС13 - 2Н2О получают растворением металлического золота в царской водке ( 3 вес. Растворение ведут при нагревании смеси на песочной бане при 70 - 80, пока не прекратится выделение бурых паров и не образуется густая темная маслянистая масса. Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. Хлорное золото разбавляют пятикратным количеством воды п переводят в гремучее золото добавлением 25 % - ного аммиака из расчета 10 мл NH ( OH на 1 г Аи с последующим нагреванием раствора для удаления избытка аммиака. Осадок гремучего золота состава [ Аи ( ЫНз) з ( ОН) з) отстаивают, промывают через фильтр горячей водой ( нельзя высушивать, осадок взрывоопасен. Хлорное золото при обыкновенной температуре - восстанавливается до металла, выделяя кислород. Иногда хлорное золото переводят в гремучее золото. Для этого к раствору хлорного золота добавляют по 10 мл 25 % - ного раствора аммиака на каждый грамм растворенного золота. Его отстаивают, отфильтровывают, несколько раз промывают кипящей водой и во влажном состоянии вводят в раствор цианистого калия. Необходимо помнить, что гремучее золото в сухом виде взрывоопасно. Безводное хлорное золото металлирует ароматич. Сколько хлорного золота образуется при растворении в царской водке Юг-атом золота; 1 97 кг золота. Раствор хлорного золота выпаривают с соляной кислотой и золото выделяют сернистым газом. Желтая окраска раствора, полученного от обработки серебряного королька азотной кислотой, указывает на присутствие платины, а коричневатая - палладия. Раствор выпаривают досуха, нитрат серебра сплавляют, затем извлекают горячей водой и фильтруют. Коричневый или черный осадок отмывают от серебра, возвращают обратно в стакан и растворяют в нескольких кашшх царской водки; присоединяют фильтрат от выделения золота и удаляют азотную кислоту двукратным выпариванием с небольшим избытком соляной кислоты. Остаток растворяют в нескольких миллилитрах воды и раствор фильтруют через маленький тампон из фильтробумажной массы, который повторно промывают несколькими каллями воды. Фильтрат может быть окрашен в желтый или оранжевый цвет, его выларивают почти досуха с очень небольшим количеством хлористого аммония: образование желтого осадка кристаллов октаэдрической системы доказывает присутствие платины. Фильтрат от осадка хлороплатината аммония, если он окрашен в коричневато-желтый цвет, содержит палладий, который идентифицируют чувствительной реакцией с диметилглиок-симом. Действие раствора хлорного золота на некоторые металлы вызывает характерные явления. Зависимость относительной светочувствительности. При введении хлорного золота в эмульсию наблюдается соответствие между ходом монохроматических кривых примесного спектрального поглощения и кривой относительной интегральной светочувствительности: максимальные значения обеих величин достигаются при одной и той же концентрации введенного раствора хлорного золота. Введение же в липмановскую эмульсию роданида золота приводит к непрерывному повышению светочувствительности при неоднозначном изменении примесного спектрального поглощения. Обнаруженная картина изменения поглощения связана, вероятно, с эволюцией образующихся примесных центров, а именно с различием скоростей их накопления и коагуляции. При введении небольших концентраций раствора хлорида и роданида золота ( до 0 02 %) скорость накопления центров, вероятно, превышает скорость их коагуляции; при увеличении же концентрации золота ( до 0 04 %) превалирует скорость коагуляции, что и вызывает снижение величины спектрального поглощения. В раствор хлорного золота вводят весьма высокодисперсный зародышевый золь золота, полученный восстановлением хлорного золота эфирным раствором фосфора. Последующее добавление восстановителя, например формальдегида, приводит к росту частиц на введенных зародышах. Монодисперсность системы обеспечивается постоянством скорости роста частиц. При нагревании хлорного золота до 190 оно разлагается и образует хлористое золото.При облучении хлорного золота нейтронами в растворе, содержащем коллоидное золото, радиоактивное золото собирается на коллоидных частицах и по окончании процесса может быть скоагулировано.В присутствии бромид-ионов хлорное золото приобретает буроватый оттенок. Метод широко применяется в клинических лабораториях для анализа крови больных при бромидной терапии. Метод, хотя и быстрый и простой, однако не точен и не чувствителен.Выяснено, что хлорное золото при концентрации 1: 30 000 начинает тормозить спиртовое брожение, при соотношении 1: 3900 - угнетает, а при 1: 200 - полностью останавливает его. Это может быть использовано при лечении некоторых специфических заболеваний.При непосредственном растворении хлорного золота с остатками кислоты в цианистом калии выделяется синильная кислота. Этот процесс опасен и не может быть рекомендован. Поэтому к полученному раствору хлорного золота добавляют на каждый грамм растворенного золота 10 см3 25 % - ного раствора аммиака, в результате чего выпадает осадок гремучего золота. Осадку дают отстояться несколько часов, промывают неоднократно теплой водой и отфильтровывают. При фильтрации и промывке необходимо следить за тем, чтобы осадок не оставался сухим, так как в сухом состоянии гремучее золото может взорваться.В результате прибавления хлорного золота к солянокислому раствору основания хлораурат тотчас же выпадает в виде кристаллического желтого осадка.При прибавлении раствора хлорного золота к солянокислому раствору основания выпадает кристаллический осадок.При восстановлении растворов хлорного золота в определенных условиях оно выпадает в коллоидном состоянии, окрашивая раствор в рубиново-красный цвет. Образование коллоидного золота используют при производстве стекла.Если к раствору хлорного золота прибавить едкого кали, то сперва образуется осадок, который в избытке щелочи вновь растворяется. Раствор их имеет резкую щелочную реакцию. Но она в этом случае содержит еще подмесь щелочей, при растворении же в азотной кислоте и разбавлении водою получается в чистом виде и тогда дает бурый порошок, разлагающийся ниже 250 на золото и кислород. Она нерастворима ни в воде, ни во многих кислотах, но растворяется в щелочах, что и показывает кислотный характер окиси золота.Двойные соли с хлорным золотом имеют особую важность в раду алкалоидов. Как правило, они отвечают формуле R - Nh3 НС1 AuCls. Они легко теряют хлористый водород при перекристаллизации, почему и рекомендуется при кристаллизация добавлять в растворитель хлористый водород.Двойная соль с хлорным золотом C H7OCl AuCI3 образует коричневато-желтые микроскопические иглы. Эти же соли получаются и в том случае, если 2 молекулы салицилового альдегида и 1 молекулу ацетальдегида встряхивать с 5-кратным количеством 70 % - ной серной кислоты и затем нагревать в течение s / 4 часа на водяной бане с обратным холодильником. Смолистые побочные продукты выделяют соляной кислотой, а ттер-дым хлорным железом осаждают уже описанную железную двойную соль. На влажном воздухе это соединение окисляется, образуя кумарин.Для получения гремучего золота хлорное золото предварительно растворяют в кипятке, затем добавляют к нему десятикратное количество аммиака. На дно сосуда выпадает желто-бурый осадок, который и является гремучим золотом. Осадок отфильтровывают и многократно промывают горячей водой, следя за тем, чтобы золото ( во избежание взрыва) все время находилось во влажном состоянии.Выяснено также, что хлорное золото при концентрации 1: 30 000 начинает тормозить спиртовое брожение, с повышением концентрации до 1: 3900 - уже значительно угнает его, а при концентрации 1: 200 - полностью останавливает.В результате прибавления раствора хлорного золота к водному раствору хлоргидрата софоридина выпадает светло-желтый кристаллический осадок. Из большого количества метилового спирта кристаллизуется в мелкие, светло-желтые иголки.Зависимость относительной интегральной светочувствительности и примесного спектрального поглощения от времени купания в растворе соли золота ( а и от введения хлорного золота ( б после травления бромидом ( / и роданидом ( / / калия.При введении различных количеств хлорного золота в эмульсию после травления наблюдаются те же характерные особенности химической сенсибилизации, что и при купании ( рис. VI.17, б), а именно: существует оптимальная концентрация хлорного золота, при которой светочувствительность достигает наибольшего значения.Затем добавляют необходимое количество раствора хлорного золота ( 0 001 г Аи) и раствор разбавляют до 50 мл водой. Полученный осадок отфильтровывают, высушивают и растирают в агатовой ступке.При действии тиомочевины на раствор хлорного золота выделяется свободный хлор, и в результате реакции получается соединение одновалентного золота [ Au2SC ( Nh3) 2 ] Cl, водные растворы которого дают щелочную реакцию.Порошкообразное золото получают из раствора хлорного золота путем осаждения железным купоросом.Электролит может быть приготовлен из хлорного золота, которое выпускается промышленостью. Такой способ приготовления связан с меньшими потерями драгоценного металла и меньшей затратой времени.Хлораурат получается при прибавлении раствора хлорного золота к солянокислому раствору основания, в в иде светло-желтого кристаллического осадка. При нагревании последний переходит в раствор и выпадает при охлаждении в виде красивых, блестящих желтых плоских игл.Третий способ - непосредственного растворения хлорного золота заключается в том, что раствор хлорного золота нейтрализуют раствором поташа до прекращения выделения пузырьков СС2 и в нейтрализованный раствор добавляют цианистый калий из расчета 3 - 4 г па I г золота.При действии тиомочевины на раствор хлорного золота выделяется свободный хлор, и в результате реакции получается соединение одновалентного золота [ Au2SC ( Nh3) 2 ] Cl, водные растворы которого дают щелочную реакцию.Кривые при потен-циометрическом титровании растворов хлорного золота с золотым, хлорной меди с медным электродом.Сложные эфиры токоферолов не окисляются хлорным золотом; наличие; больших количеств каротиноидов препятствует проведению определения.Для приготовления железистосинеродистого электролита сначала приготовляют хлорное золото по способу, описанному выше.Электролитом для аффинажа золота служит раствор хлорного золота и соляной кислоты. Для предупреждения накопления в электролите примесей, затрудняющих электролиз, его периодически обновляют.Схема электролизера для получения водорода или кислорода. Получение чистого хлора основано на разложении сухого хлорного золота АиС13 при нагревании. Для удобства регенерации этого не совсем доступного препарата его нагревают в кварцевой трубочке, которую применяют только для данной реакции.Для приготовления цианистого электролита золочения раство ряют хлорное золото в растворе цианистого калия. Удобнее пользоваться готовым дицианоауратом калия, которое выпускается про мышленностью.
Золото вводится в эталоны в виде раствора хлорного золота. Бор может применяться в виде борной кислоты, однако целесообразнее применять буру, в особенности, если растворы, содержащие бор, предназначены для эталонирования окисей: существуют указания, что во время дегидратации борной кислоты путем нагревания происходит частичная потеря бора, если даже нагрев ведется только до 500 - 600 С, когда В2О3 заведомо не испаряется [87], Присутствие в буре натрия обычно не влияет на результаты анализа, так как бор в атомных материалах приходится обычно определять при концентрациях 10 - 4 - 10 - 5 %; при этом натрий содержится в пробах чаще всего в 100 - 1000 раз больших количествах. Если концентрация натрия в анализируемом материале мала, то его количество, введенное в эталоны вместе с бором, легко учесть.Электролиты для желто-оранжевого золочения, состоящие из хлорного золота, желези-стосернистого калия и соды, не требуют цианистых солей. Желези-стосинеродистые электролиты в связи с плохим растворением золотого анода должны иметь определенную концентрацию. Плотность тока применяется очень низкая.Из соляной кислоты кристаллизуют двойные соли с хлорным золотом и с хлорной платиной, а также некоторые солянокислые соли аминов. Многие сульфокислоты хорошо кристаллизуются из разбавленной серной кислоты. В этих случаях уменьшение растворимости в воде является следствием влияния одноименных ионов. Из разбавленного водного аммиака с успехом кристаллизуют многие аминокислоты и амиды кислот.Из соляной кислоты кристаллизуются двойные соли с хлорным золотом и с хлорной платиной, а также некоторые солянокислые соли аминов.При смешивании водного раствора солянокислой соли с хлорным золотом получается сначала желтый осадок, который окрашивается в темный цвет и разлагается с выделением золота.Из соляной кислоты кристаллизуются двойные соли с хлорным золотом и с хлорной платиной, а также некоторые солянокислые соли аминов. Многие сульфокислоты хорошо кристаллизуются из разбавленной серной кислоты. В этих случаях уменьшение растворимости в воде является следствием влияния одноименных ионов. Из разбавленного водного аммиака с успехом кристаллизуют многие аминокислоты и амиды кислот.Этот метод находит ограниченное применение, так как хлорное золото не обладает способностью окислять эфиры токоферолов и другие производные.
www.ai08.org