Алюминий и его свойства (стр. 1 из 3). Какой алюминий
Самые прочные алюминиевые сплавы
Самые прочные алюминиевые сплавы
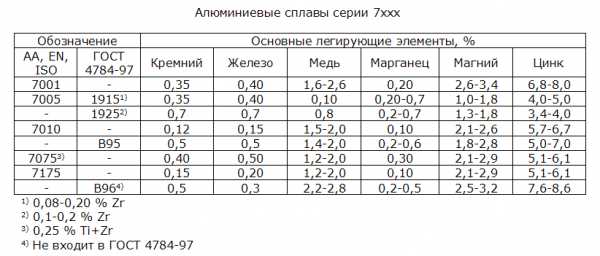
Сплавы серии 7ххх являются самыми прочными среди всех алюминиевых сплавов (рисунок 1). Однако у них есть большой недостаток — они склонны к коррозии под напряжением. Основные легирующие элементы – от 1 до 9 % цинка (чаще всего от 4 до 6 %), от 1 до 3 % магния, а также, для некоторых сплавов — до 3,0 % меди . Эти сплавы упрочняются термической обработкой.
Важные области применения этих сплавов связаны с их высокой прочностью. Это – аэрокосмическая техника, военная техника и оборудование атомной энергетики. Кроме того, они имеют применение в строительстве, а также для изготовления спортивного инвентаря, например, лыжных палок и теннисных ракеток.
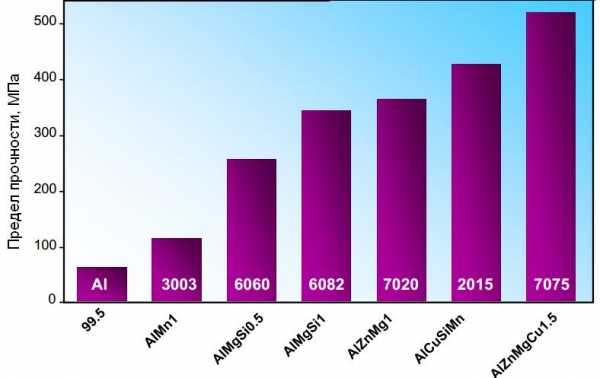 Рисунок 1 — Рейтинг прочности популярных алюминиевых сплавов
Рисунок 1 — Рейтинг прочности популярных алюминиевых сплавов
Алюминиевые сплавы серии 7ххх
Растворимость цинка в алюминии снижается от 31,6 % при 275 ºС до 5,6 % при 125 ºС (рисунок 2). Промышленные сплавы серии 7ххх содержат цинк, магний и медь с небольшими добавками марганца и хрома, а также циркония для контроля роста зерна и рекристаллизации.
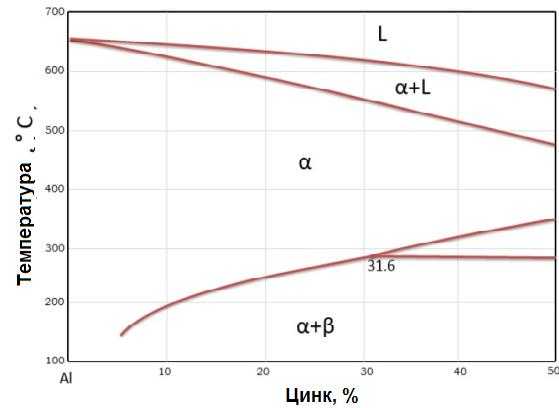
Рисунок 2 — «Алюминиевый» участок фазовой диаграммы алюминий-цинк [2]
Алюминиевые сплавы серии 7ххх применяют для изготовления несущих элементов самолетов, таких как верхние оболочки крыльев, стрингеры, горизонтальные и вертикальные стабилизаторы. Горизонтальные и вертикальные стабилизаторы имеют такие же конструкционные критерии как и крылья. Верхняя и нижняя поверхности горизонтального стабилизатора испытывают изгиб и для них критическим является сжимающее нагружение. Поэтому модуль упругости на сжатие является наиболее важным свойством. Критическими конструкционными параметрами компонентов верхней части крыла являются прочность на сжатие и сопротивление усталости.
Самые прочные сплавы серии 7ххх
Все алюминиевые сплавы системы Al-Zn-Mg-Cu проявляют самую высокую прочность. Добавление 2 % меди в комбинации с магнием и цинком значительно повышает прочностные свойства сплавов серии 7ххх.
Самые высокие величины прочности на растяжение, какие только могут быть у алюминиевых сплавов, имеют следующие сплавы:
- 7075: 5,5 % цинка – 2,5 % магния – 1,5 % меди;
- 7079: 4,3 % цинка – 3,3 % магния – 0,6 % меди;
- 7178: 6,8 % цинка – 2,7 % магния – 2,0 % меди.
Сплав 7075-Т6 имеет очень высокую отношение прочность-вес, низкую стоимость производства и хорошую механическую обрабатываемость. Поэтому он является предпочтительным при выборе материала для конструкционных элементов самолетов. Вместе с тем, сплав 7075 имеет довольно низкое сопротивление коррозии. Склонность этого сплава к коррозионному растрескиванию под напряжением может контролироваться должной термической обработкой и добавками некоторых материалов, таких как хром.
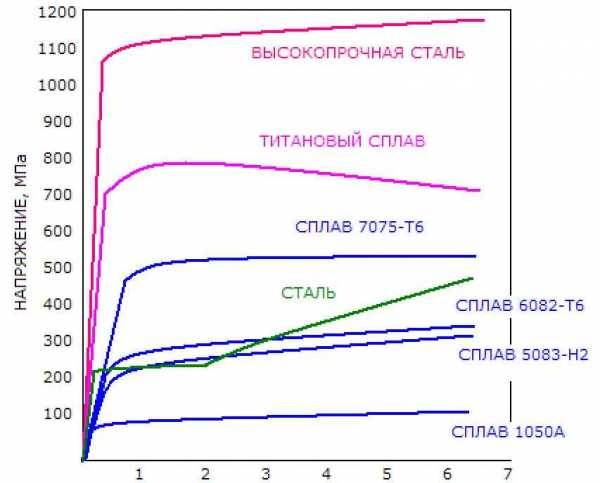
Рисунок 3 — Уровень прочности алюминиевого сплава 7075-Т6 среди других конструкционных материалов
Алюминиевый сплав 7075
Состояние Т6
Сплав 7075 – сплав Al-Zn-Mg-Cu-Cr – имеет наиболее широкое и длительное применение из всех сплавов серии 7ххх. Он был введен в Японии в 1943 году, был большим секретом и применялся для изготовления японских военных самолетов. Сплав 7075 первоначально применялся для деталей и компонентов с тонким поперечным сечением, в основном в виде листов и прессованных профилей. Для этих изделий скорость закалки обычно очень высокая и растягивающие напряжения не возникают в коротком поперечном направлении. Поэтому коррозионное растрескивание под напряжением не является проблемой для таких материалов с высокопрочном состоянии Т6.
Однако, когда сплав 7075 применяется в изделиях и деталях больших размеров и большой толщины, становится ясно, что такие изделия и детали, термически упрочненные до состояний Т6, часто не отвечают заданным требованиям. Изделия, которые получали путем большой механической обработки из крупных поковок, прессованных профилей или плит, затем подвергались длительным растягивающим напряжениям при неблагоприятной ориентации. В таких условиях в эксплуатации довольно часто возникало коррозионное растрескивание под напряжением (коррозия под напряжением).
Состояние Т73
Решением этой проблемы было введение состояния Т73 для толстых и массивных изделий из сплава 7075. термическая обработка, которая применяется для получения этого состояния, требует двухстадийного искусственного старения. Вторая стадия выполняется при более высокой температуре, чем та, которая применяется для достижения состояния Т6. Эта дополнительная термическая обработка снижает прочность до уровня ниже того, которого сплав 7075 достигает в состоянии Т6.
Состояния Т7 достигается перестариванием, что означает, что старение сплава продолжается после достижения пика значений его твердости и прочности, в отличие от состояний Т6.
Многочисленные эксперименты и длительный опыт эксплуатации подтвердили, что сплав 7075-Т73 имеет значительно более высокое сопротивление коррозии под напряжением, по сравнению со сплавом 7075-Т6.
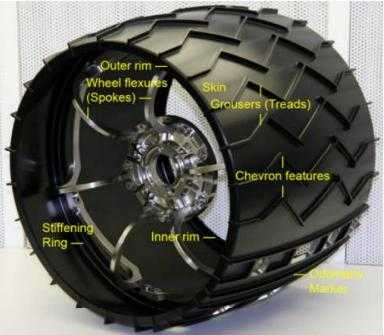
Интересно, что колеса знаменитого марсохода Curiosity сделаны из сплава 7075-Т7351 с помощью механической обработкой из цельного кованого кольца (рисунок 8).
 (а)
(а)
 Рисунок 8 – Колесо марсохода Curiosity из алюминиевого сплава 7075-Т7351:а — на Земле; б – в условиях эксплуатации на Марсе
Рисунок 8 – Колесо марсохода Curiosity из алюминиевого сплава 7075-Т7351:а — на Земле; б – в условиях эксплуатации на Марсе
Магний в алюминиевых сплавах 7ххх
Большая часть сплавов серии 7ххх включает магний для повышения эффективности механизма упрочнения за счет старения. Главной упрочняющей фазой выступают частицы MgZn2. Такие сплавы имеют среднюю прочность, но относительно легко свариваются, например, сплав 7005 (аналог 1915). Сплавы Al-Zn-Mg имеют более высокую восприимчивость к термической обработке, чем бинарные сплавы Al-Zn, что обеспечивает им более высокую прочность.
Медь в алюминиевых сплавах 7ххх
Добавление меди сплавам Al-Zn-Mg вместе с небольшими количествами хрома и марганца дает этим сплавам самую высокую прочность из всех известных алюминиевых сплавов. Сплавы четверной системы Al-Zn-Mg-Cu имеют самый высокий потенциал упрочнения старением из всех алюминиевых сплавов: у некоторых сплавов предел прочности достигает 600 МПа, как, например, у сплава В95, и даже 700 МПа, как у сплава В96. Однако чрезмерное повышение содержания цинка и магния снижает вязкие свойства и сопротивление коррозии под напряжением. В этих сплавах цинк и магний управляют процессом старения, тогда как роль меди заключается в увеличении скорости старения и повышении чувствительности к закалке. Хотя медь снижает общую стойкость к коррозии, она повышает сопротивление коррозии под напряжением.
 Источники:
Источники:
- Aluminum and Aluminum Alloys /J. R. Davis, ASM, 1993
- Trends in aluminium alloy development /R. Rajan at al — Rev. Adv. Mater. Sci. 44 (2016) 383-397
aluminium-guide.ru
Алюминий и его свойства
Алюминий - химический элемент третей группы периодической системы Д.И. Менделеева.
Марки и химический состав (%) первичного алюминия (ГОСТ 11069–74)
*Для суммы титана, ванадия, хрома и марганца.
** Допускается массовая доля железа не менее 0,18 %.
***«Е» — в марках с гарантированными электрическими характеристиками.
Алюминий технической чистоты, применяемый для изготовления полуфабрикатов и изделий путем деформации, входит в ГОСТ 4784-74
Химический состав (%) технического алюминия
* B: 0,02 %; Ti + V: 0,02 %
**B: 0,05 %; Ti + V: 0,02 %
Гарантируемые механические характеристики (не менее) листов из АД0, АД1
АЛЮМИНИЙ, химический элемент III группы периодической системы, атомный номер 13, относительная атомная масса 26,98. В природе представлен лишь одним стабильным нуклидом 27 Al. Искусственно получен ряд радиоактивных изотопов алюминия, наиболее долгоживущий – 26 Al имеет период полураспада 720 тысяч лет.
Алюминий в природе. В земной коре алюминия очень много: 8,6% по массе. Он занимает первое место среди всех металлов и третье среди других элементов (после кислорода и кремния). Алюминия вдвое больше, чем железа, и в 350 раз больше, чем меди, цинка, хрома, олова и свинца вместе взятых! Как писал более 100 лет назад в своем классическом учебнике Основы химии Д.И. Менделеев, из всех металлов «алюминий есть самый распространенный в природе; достаточно указать на то, что он входит в состав глины, чтоб ясно было всеобщее распространение алюминия в коре земной. Алюминий, или металл квасцов (alumen), потому и называется иначе глинием, что находится в глине».
Важнейший минерал алюминия – боксит, смесь основного оксида AlO(OH) и гидроксида Al(OH)3 . Крупнейшие месторождения боксита находятся в Австралии, Бразилии, Гвинее и на Ямайке; промышленная добыча ведется и в других странах. Богаты алюминием также алунит (квасцовый камень) (Na,K)2 SO4 ·Al2 (SO4 )3 ·4Al(OH)3 , нефелин (Na,K)2 O·Al2 O3 ·2SiO2 . Всего же известно более 250 минералов, в состав которых входит алюминий; большинство из них – алюмосиликаты, из которых и образована в основном земная кора. При их выветривании образуется глина, основу которой составляет минерал каолинит Al2 O3 ·2SiO2 ·2h3 O. Примеси железа обычно окрашивают глину в бурый цвет, но встречаются и белая глина – каолин, которую применяют для изготовления фарфоровых и фаянсовых изделий.
Изредка встречается исключительно твердый (уступает лишь алмазу) минерал корунд – кристаллический оксид Al2 O3 , часто окрашенный примесями в разные цвета. Его синяя разновидность (примесь титана и железа) называется сапфиром, красная (примесь хрома) – рубином. Разные примеси могут окрашивать так называемый благородный корунд также в зеленый, желтый, оранжевый, фиолетовый и другие цвета и оттенки.
Еще недавно считалось, что алюминий как весьма активный металл не может встречаться в природе в свободном состоянии, однако в 1978 в породах Сибирской платформы был обнаружен самородный алюминий – в виде нитевидных кристаллов длиной всего 0,5 мм (при толщине нитей несколько микрометров). В лунном грунте, доставленном на Землю из районов морей Кризисов и Изобилия, также удалось обнаружить самородный алюминий. Предполагают, что металлический алюминий может образоваться конденсацией из газа. Известно, что при нагревании галогенидов алюминия – хлорида, бромида, фторида они могут с большей или меньшей легкостью испаряться (так, AlCl3 возгоняется уже при 180° C). При сильном повышении температуры галогениды алюминия разлагаются, переходя в состояние с низшей валентностью металла, например, AlCl. Когда при понижении температуры и отсутствии кислорода такое соединение конденсируется, в твердой фазе происходит реакция диспропорционирования: часть атомов алюминия окисляется и переходит в привычное трехвалентное состояние, а часть – восстанавливается. Восстановиться же одновалентный алюминий может только до металла: 3AlCl 2Al + AlCl3 . В пользу этого предположения говорит и нитевидная форма кристаллов самородного алюминия. Обычно кристаллы такого строения образуются вследствие быстрого роста из газовой фазы. Вероятно, микроскопические самородки алюминия в лунном грунте образовались аналогичным способом.
Название алюминия происходит от латинского alumen (род. падеж aluminis). Так называли квасцы, двойной сульфат калия-алюминия KAl(SO4 )2 ·12h3 O), которые использовали как протраву при крашении тканей. Латинское название, вероятно, восходит к греческому «халмэ» – рассол, соляной раствор. Любопытно, что в Англии алюминий – это aluminium, а в США – aluminum.
Во многих популярных книгах по химии приводится легенда о том, что некий изобретатель, имя которого история не сохранила, принес императору Тиберию, правившему Римом в 14–27 н.э., чашу из металла, напоминающего цветом серебро, но более легкого. Этот подарок стоил жизни мастеру: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро в императорской сокровищнице.
Эта легенда основана на рассказе Плиния Старшего, римского писателя и ученого, автора Естественной истории – энциклопедии естественнонаучных знаний античных времен. Согласно Плинию, новый металл был получен из «глинистой земли». А ведь глина действительно содержит алюминий.
Современные авторы почти всегда делают оговорку, что вся эта история – не более чем красивая сказка. И это не удивительно: алюминий в горных породах чрезвычайно прочно связан с кислородом, и для его выделения необходимо затратить очень много энергии. Однако в последнее время появились новые данные о принципиальной возможности получения металлического алюминия в древности. Как показал спектральный анализ, украшения на гробнице китайского полководца Чжоу-Чжу, умершего в начале III в. н.э., сделаны из сплава, на 85% состоящего из алюминия. Могли ли древние получить свободный алюминий? Все известные способы (электролиз, восстановление металлическим натрием или калием) отпадают автоматически. Могли ли в древности найти самородный алюминий, как, например, самородки золота, серебра, меди? Это тоже исключено: самородный алюминий – редчайший минерал, который встречается в ничтожных количествах, так что древние мастера никак не могли найти и собрать в нужном количестве такие самородки.
Однако возможно и другое объяснение рассказа Плиния. Алюминий можно восстановить из руд не только с помощью электричества и щелочных металлов. Существует доступный и широко используемый с древних времен восстановитель – это уголь, с помощью которого оксиды многих металлов при нагревании восстанавливаются до свободных металлов. В конце 1970-х немецкие химики решили проверить, могли ли в древности получить алюминий восстановлением углем. Они нагрели в глиняном тигле до красного каления смесь глины с угольным порошком и поваренной солью или поташом (карбонатом калия). Соль была получена из морской воды, а поташ – из золы растений, чтобы использовать только те вещества и методы, которые были доступны в древности. Через некоторое время на поверхности тигля всплыл шлак с шариками алюминия! Выход металла был мал, но не исключено, что именно этим путем древние металлурги могли получить «металл 20 века».
mirznanii.com
Свойства алюминия – материала на все времена
Часто первые названия чего-либо – устройства, материала или изделия - наиболее точно и понятно отражают их сущность. А потом наступает период осмысления и приходит новое название, научное, в котором понятный “житейский” смысл уходит в небытие. Когда-то алюминий имел название глинозем, т.е. “глина земли”, а глина, как известно, первичная суть земли. Теперь так называют оксид алюминия. А на смену бытовавшему ранее названию “глинозем” пришло новое имя - “алюминиум” – красиво, загадочно и по-научному. Легенда о первом пришествии алюминия имеет печальный конец: мастеру, подарившему императору Тиберию удивительную чашу из доселе неизвестного металла, чтобы сохранить подарок в единственном экземпляре, на всякий случай, отрубили голову – нашел кому дарить. В те времена, в начале нашей эры, вопросы секретности решались кардинально, а благодарность за мастерство также была своеобразной. Как бы там ни было, но только через пятнадцать столетий Парацельс установил, что глинозем (квасцы), применяемый для закрепления красок в тканях и кожах, содержит окись неизвестного металла.
Чистый металл удалось получить только в 1825 г. Датский ученый Эрстед в качестве побочного эффекта своих исследований получил «кусок металла, похожий на олово», но продолжать работы не стал. Тем не менее, к середине XIX века алюминий - серебристый, легкий, простой в обработке металл - ценился больше золота. Свойства алюминия в первую очередь оценили ювелиры. На него была мода, а на выставке в Париже в 1855 году изделия из алюминия демонстрировались рядом с бриллиантами французской короны. Как известно, спрос приводит к росту предложений, поэтому технологии производства получили толчок к развитию. И к середине ХХ века алюминий стал обычным широко применяемым в технике материалом, а физические свойства алюминия были уже достаточно хорошо изучены.
Технологии промышленного производства алюминия
Основой производства алюминия является электролиз, а сырьем служит растворенный в расплаве криолита оксид алюминия Al2O3. Для электролиза применяют ванны, рабочая температура которых чуть меньше 1000°С. Жидкий алюминий собирается на дне ванны - это катод установки. Разливают его в формы и получают слитки или чушки - сырье для дальнейшей переработки.
Свойства алюминия изменяют в нужном ключе при помощи легирующих добавок. При этом добиваются повышения прочности, твердости, жаропрочности и т.д. с ориентацией на конкретное применение. Легирующие материалы для различных сплавов - медь, марганец, цинк, магний, а также (в небольших количествах) кремний, железо, никель и др. добавляют в расплав при окончательном изготовлении нужного вида готовой продукции.
Основные физические свойства алюминия
Любой материал характеризуется набором физико-химических свойств, которые и определяет его последующее использование. Свойства алюминия — пластичность, небольшой удельный вес, хорошая тепло- и электропроводность — известны всем.
С точки зрения применения в электротехнике безусловный интерес представляют магнитные свойства алюминия, по которым он относится к слабомагнитным веществам группы парамагнетиков. Этот класс материалов характерен тем, что его магнитное поле при действии внешнего поля совпадает с ним по направлению, и, хоть и очень незначительно, но усиливается.
Применение алюминия
Ценность материала определяет востребованность изделий из него. Алюминий востребован в первую очередь как конструкционный материал. Легкость обработки и коррозионная стойкость позволяют использовать изделия из алюминия в строительстве, машиностроении, для изготовления теплового, пищевого и других видов оборудования. Алюминий – это основной конструкционный материал авиации. Все более широкое применение находят алюминиевые сплавы в судостроении - корпуса судов, коммуникации, палубные надстройки, различное судовое оборудование. Широко применяются в промышленности и быту дюралюминий и силумин - некорродирующие сплавы алюминия с медью – до 7% или кремнием – до 14%.
Электропроводность алюминия незначительно уступает меди, но алюминий намного легче и дешевле, чем и обусловлено его широкое применение в электротехнике. При этом основные свойства алюминия для такого применения – малое электрическое сопротивление, вес и невысокая стоимость. Все чаще в электрооборудовании, где совсем недавно безраздельно господствовали исключительно медные проводники, применяют алюминиевые обмотки трансформаторов, катушек индуктивности, реакторов, “жилы” кабелей и др. Магистральные линии электропередач также во многом обязаны именно алюминию.
Нет сомнений, что этот удивительный металл еще не раскрыл всех своих возможностей – это предстоит сделать в будущем.
fb.ru
алюминий - это... Что такое алюминий?
АЛЮМИ́НИЙ -я; м. [от лат. alumen (aluminis) - квасцы]. Химический элемент (Al), серебристо-белый лёгкий ковкий металл с высокой электропроводностью (применяемый в авиации, электротехнике, строительстве, быту и т.п.). Сульфат алюминия. Сплавы алюминия.
АЛЮМИ́НИЙ (лат. Aluminium), Al (читается «алюминий»), химический элемент с атомным номером 13, атомная масса 26,98154. Природный алюминий состоит из одного нуклида 27Al. Расположен в третьем периоде в группе IIIA периодической системы элементов Менделеева. Конфигурация внешнего электронного слоя 3s2p1. Практически во всех соединениях степень окисления алюминия +3 (валентность III). Радиус нейтрального атома алюминия 0,143 нм, радиус иона Al3+ 0,057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5,984, 18,828, 28,44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1,5. Простое вещество алюминий — мягкий легкий серебристо-белый металл. История открытия Латинское aluminium происходит от латинского же alumen, означающего квасцы (см. КВАСЦЫ) (сульфат алюминия и калия KAl(SO4)2·12h3O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия (см. АЛЮМИНИЯ ОКСИД)) сделал еще в 1754 немецкий химик А. Маргграф (см. МАРГГРАФ Андреас Сигизмунд). Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед (см. ЭРСТЕД Ханс Кристиан). Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия. Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль (см. СЕНТ-КЛЕР ДЕВИЛЬ Анри Этьен) в 1854 предложил использовать для получения алюминия металлический натрий (см. НАТРИЙ), и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения. Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (см. ЭРУ Поль Луи Туссен) (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией. Нахождение в природе По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8,8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов (см. АЛЮМОСИЛИКАТЫ), и горных пород. Соединения алюминия содержат граниты (см. ГРАНИТ), базальты (см. БАЗАЛЬТ), глины (см. ГЛИНА), полевые шпаты (см. ПОЛЕВЫЕ ШПАТЫ) и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов (см. БОКСИТЫ) — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты (см. АЛУНИТ) и нефелины (см. НЕФЕЛИН). В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски. Промышленное получение При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается. Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит (см. КРИОЛИТ) Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий: 2Al2О3 = 4Al + 3О2. Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2. При электролизе получают металл с содержанием алюминия около 99,7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99,999% и более. Физические и химические свойства Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0,40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2,6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2,5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1,663В. Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту. С остальными кислотами алюминий активно реагирует: 6НСl + 2Al = 2AlCl3 + 3h3, 3Н2SO4 + 2Al = Al2(SO4)3 + 3h3. Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка: Al2О3 + 2NaOH + 3h3O = 2Na[Al(OH)4]. Затем протекают реакции: 2Al + 6h3O = 2Al(OH)3 + 3h3, NaOH + Al(OH)3 = Na[Al(OH)4], или суммарно: 2Al + 6h3O + 2NaOH = Na[Al(OH)4] + 3Н2, и в результате образуются алюминаты (см. АЛЮМИНАТЫ): Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число (см. КООРДИНАЦИОННОЕ ЧИСЛО) 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2]. При нагревании алюминий реагирует с галогенами: 2Al + 3Cl2 = 2AlCl3, 2Al + 3 Br2 = 2AlBr3. Интересно, что реакция между порошками алюминия и иода (см. ИОД) начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора: 2Al + 3I2 = 2AlI3. Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия: 2Al + 3S = Al2S3, который легко разлагается водой: Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S. С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений (см. АЛЮМИНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ), можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель. В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3. Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например: 3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже 3СаО + 2Al = Al2О3 + 3Са. Такой способ получения металлов называют алюминотермией (см. АЛЮМИНОТЕРМИЯ). Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yh3O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3. В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями: Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4, или за счет добавления соды к раствору соли алюминия: 2AlCl3 + 3Na2CO3 + 3h3O = 2Al(OH)3Ї + 6NaCl + 3CO2, а также добавлением раствора аммиака к раствору соли алюминия: AlCl3 + 3Nh4·h3O = Al(OH)3Ї + 3h3O + 3Nh5Cl. Применение По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65,5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия. Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (см. ДУРАЛЮМИН) (94% Al, 4% Cu, по 0,5% Mg, Mn, Fe и Si), силумина (85—90% Al, 10—14% Si, 0,1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др. Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ. Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию. При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно. Алюминий в организме В организм человека алюминий ежедневно поступает с пищей (около 2—3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.dic.academic.ru
Алюминий: применение - Популярная химия
Химический элемент алюминий – лёгкий металл серебристого цвета. Алюминий - самый распространенный в земной коре металл. Физические и химические свойства алюминия позволили ему найти широкое применение в современной промышленности и повседневной жизни.
Химические свойства алюминия

Химическая формула алюминия Аl. Атомный номер 13. Алюминий относится к простым веществам, так как его молекула содержит атом только одного элемента. Внешний энергетический уровень атома алюминия содержит 3 электрона. Эти электроны легко отдаются атомом алюминия во время химических реакций. Поэтому алюминий имеет высокую химическую активность и способен вытеснять металлы из их оксидов. Но в обычных условиях он довольно устойчив к химическому взаимодействию, так как покрыт прочной оксидной плёнкой.
С кислородом алюминий взаимодействует только при высокой температуре. В результате реакции образуется оксид алюминия. С серой, фосфором, азотом, углеродом взаимодействие также происходит при высокой температуре. А вот с хлором и бромом алюминий вступает в реакцию при обычных условиях. С йодом реагирует при нагревании, но только если катализатором выступает вода. С водородом алюминий не взаимодействует.
С металлами алюминий способен образовывать соединения, которые называются алюминиды.
В реакцию с водой вступает алюминий, очищенный от оксидной плёнки. Гидроксид, который получается в результате этой реакции, является малорастворимым соединением.
Алюминий легко взаимодействует с разбавленными кислотами, образуя соли. Но с концентрированными кислотами реагирует только при нагревании, образуя соли и продукты восстановления кислоты.
Алюминий легко реагирует со щелочами.
Физические свойства алюминия
Алюминий - прочный металл, но в то же время и пластичный, легко подвергается механической обработке: штамповке, полировке, вытягиванию.
Алюминий самый легкий из металлов. Имеет очень высокую теплопроводность. По электропроводности алюминий практически не уступает меди, но при этом он намного легче и дешевле.
Применение алюминия

Впервые металл алюминий был получен датским физиком Гансом Христианом Эрстедом в 1825 г. И в те времена алюминий считали драгоценным металлом. Модницы любили носить украшения из него.
Но промышленный способ получения алюминия был создан значительно позже - в 1855 г. французским химиком Анри Этьенн Сент-Клер Девилем.
Алюминиевые сплавы применяются практически во всех машиностроительных отраслях. Современная авиационная, космическая и автомобильная промышленность, кораблестроение не могут обходиться без таких сплавов. Наиболее известные сплавы – дюралюминий, силумин, литейные сплавы. Пожалуй, самым востребованным из этих сплавов является дюралюминий.
При переработке алюминия горячей и холодной обработкой получают профили, проволоку, трубы, ленты, листы. Алюминиевые листы или лента широко используются в современном строительстве. Так, специальную алюминиевую ленту применяют для заклеивания торцов различных строительных панелей, чтобы обеспечить надежную защиту от попадания осадков и пыли внутрь панели.
Так как алюминий обладает высокой электропроводностью, его используют для изготовления электропроводов и электротехнических шин.
Алюминий не является драгоценным металлом. Но некоторые его соединения используются в ювелирной промышленности. Наверное, не все знают, что рубин и сапфир – это монокристаллы окиси алюминия, в которые добавлены красящие окислы. Красный цвет рубину придают ионы хрома, а голубой цвет сапфира – от содержания ионов железа и титана. Чистая кристаллическая окись алюминия называется корундом.
В промышленных условиях создают искусственные корунд, рубин и сапфир.
Используется алюминий и в медицине. Он входит в состав некоторых препаратов, которые оказывают адсорбирующее, обволакивающее и обезболивающее действие.
Трудно найти такую отрасль современной промышленности, в которой не использовались бы алюминий и его соединения.

ximik.biz
Алюминий — Мегаэнциклопедия Кирилла и Мефодия — статья
Радиус нейтрального атома алюминия 0, 143 нм, радиус иона Al3+ 0, 057 нм. Энергии последовательной ионизации нейтрального атома алюминия равны, соответственно, 5, 984, 18, 828, 28, 44 и 120 эВ. По шкале Полинга электроотрицательность алюминия 1, 5.
Простое вещество алюминий — мягкий легкий серебристо-белый металл.
Латинское aluminium происходит от латинского же alumen, означающего квасцы (сульфат алюминия и калия KAl(SO4)2·12h3O), которые издавна использовались при выделке кож и как вяжущее средство. Из-за высокой химической активности открытие и выделение чистого алюминия растянулось почти на 100 лет. Вывод о том, что из квасцов может быть получена «земля» (тугоплавкое вещество, по-современному — оксид алюминия) сделал еще в 1754 немецкий химик А. Маргграф. Позднее оказалось, что такая же «земля» может быть выделена из глины, и ее стали называть глиноземом. Получить металлический алюминий смог только в 1825 датский физик Х. К. Эрстед. Он обработал амальгамой калия (сплавом калия со ртутью) хлорид алюминия AlCl3, который можно было получить из глинозема, и после отгонки ртути выделил серый порошок алюминия.Только через четверть века этот способ удалось немного модернизировать. Французский химик А. Э. Сент-Клер Девиль в 1854 предложил использовать для получения алюминия металлический натрий, и получил первые слитки нового металла. Стоимость алюминия была тогда очень высока, и из него изготовляли ювелирные украшения.Промышленный способ производства алюминия путем электролиза расплава сложных смесей, включающих оксид, фторид алюминия и другие вещества, независимо друг от друга разработали в 1886 году П. Эру (Франция) и Ч. Холл (США). Производство алюминия связано с высоким расходом электроэнергии, поэтому в больших масштабах оно было реализовано только в 20 веке. В Советском Союзе первый промышленный алюминий был получен 14 мая 1932 года на Волховском алюминиевом комбинате, построенном рядом с Волховской гидроэлектростанцией.По распространенности в земной коре алюминий занимает первое место среди металлов и третье место среди всех элементов (после кислорода и кремния), на его долю приходится около 8, 8% массы земной коры. Алюминий входит в состав огромного числа минералов, главным образом, алюмосиликатов, и горных пород. Соединения алюминия содержат граниты, базальты, глины, полевые шпаты и др. Но вот парадокс: при огромном числе минералов и пород, содержащих алюминий, месторождения бокситов — главного сырья при промышленном получении алюминия, довольно редки. В России месторождения бокситов имеются в Сибири и на Урале. Промышленное значение имеют также алуниты и нефелины.В качестве микроэлемента алюминий присутствует в тканях растений и животных. Существуют организмы-концентраторы, накапливающие алюминий в своих органах, — некоторые плауны, моллюски.
При промышленном производстве бокситы сначала подвергают химической переработке, удаляя из них примеси оксидов кремния и железа и других элементов. В результате такой переработки получают чистый оксид алюминия Al2O3 — основное сырье при производстве металла электролизом. Однако из-за того, что температура плавления Al2O3 очень высока (более 2000 °C), использовать его расплав для электролиза не удается.
Выход ученые и инженеры нашли в следующем. В электролизной ванне сначала расплавляют криолит Na3AlF6 (температура расплава немного ниже 1000 °C). Криолит можно получить, например, при переработке нефелинов Кольского полуострова. Далее в этот расплав добавляют немного Al2О3 (до 10 % по массе) и некоторые другие вещества, улучающие условия проведения последующего процесса. При электролизе этого расплава происходит разложение оксида алюминия, криолит остается в расплаве, а на катоде образуется расплавленный алюминий:2Al2О3 = 4Al + 3О2.
Так как анодом при электролизе служит графит, то выделяющийся на аноде кислород реагирует с графитом и образуется углекислый газ СО2.
При электролизе получают металл с содержанием алюминия около 99, 7%. В технике применяют и значительно более чистый алюминий, в котором содержание этого элемента достигает 99, 999% и более.
Алюминий — типичный металл, кристаллическая решетка кубическая гранецентрированная, параметр а = 0, 40403 нм. Температура плавления чистого металла 660 °C, температура кипения около 2450 °C, плотность 2, 6989 г/см3. Температурный коэффициент линейного расширения алюминия около 2, 5·10-5 К-1. Стандартный электродный потенциал Al3+/Al –1, 663В.
Химически алюминий — довольно активный металл. На воздухе его поверхность мгновенно покрывается плотной пленкой оксида Al2О3, которая препятствует дальнейшему доступу кислорода к металлу и приводит к прекращению реакции, что обусловливает высокие антикоррозионные свойства алюминия. Защитная поверхностная пленка на алюминии образуется также, если его поместить в концентрированную азотную кислоту.
С остальными кислотами алюминий активно реагирует:
6НСl + 2Al = 2AlCl3 + 3h3,
3Н2SO4 + 2Al = Al2(SO4)3 + 3h3.
Алюминий реагирует с растворами щелочей. Сначала растворяется защитная оксидная пленка:
Al2О3 + 2NaOH + 3h3O = 2Na[Al(OH)4].
Затем протекают реакции:
2Al + 6h3O = 2Al(OH)3 + 3h3,
NaOH + Al(OH)3 = Na[Al(OH)4],
или суммарно:
2Al + 6h3O + 2NaOH = Na[Al(OH)4] + 3Н2,
и в результате образуются алюминаты: Na[Al(OH)4] — алюминат натрия (тетрагидроксоалюминат натрия), К[Al(OH)4] — алюминат калия (терагидроксоалюминат калия) или др. Так как для атома алюминия в этих соединениях характерно координационное число 6, а не 4, то действительные формулы указанных тетрагидроксосоединений следующие: Na[Al(OH)4(Н2О)2] и К[Al(OH)4(Н2О)2].При нагревании алюминий реагирует с галогенами:
2Al + 3Cl2 = 2AlCl3,
2Al + 3 Br2 = 2AlBr3.
Интересно, что реакция между порошками алюминия и иода начинается при комнатной температуре, если в исходную смесь добавить несколько капель воды, которая в данном случае играет роль катализатора:2Al + 3I2 = 2AlI3.
Взаимодействие алюминия с серой при нагревании приводит к образованию сульфида алюминия:
2Al + 3S = Al2S3,
который легко разлагается водой:
Al2S3 + 6Н2О = 2Al(ОН)3 + 3Н2S.
С водородом алюминий непосредственно не взаимодействует, однако косвенными путями, например, с использованием алюминийорганических соединений, можно синтезировать твердый полимерный гидрид алюминия (AlН3)х — сильнейший восстановитель.В виде порошка алюминий можно сжечь на воздухе, причем образуется белый тугоплавкий порошок оксида алюминия Al2О3.
Высокая прочность связи в Al2О3 обусловливает большую теплоту его образования из простых веществ и способность алюминия восстанавливать многие металлы из их оксидов, например:
3Fe3O4 + 8Al = 4Al2O3 + 9Fe и даже
3СаО + 2Al = Al2О3 + 3Са.
Амфотерному оксиду Al2О3 соответствует амфотерный гидроксид — аморфное полимерное соединение, не имеющее постоянного состава. Состав гидроксида алюминия может быть передан формулой xAl2O3·yh3O, при изучении химии в школе формулу гидроксида алюминия чаще всего указывают как Аl(OH)3.
В лаборатории гидроксид алюминия можно получить в виде студенистого осадка обменными реакциями:
Al2(SO4)3 + 6NaOH = 2Al(OH)3 + 3Na2SO4,
или за счет добавления соды к раствору соли алюминия:
2AlCl3 + 3Na2CO3 + 3h3O = 2Al(OH)3↓ + 6NaCl + 3CO2,
а также добавлением раствора аммиака к раствору соли алюминия:
AlCl3 + 3Nh4·h3O = Al(OH)3↓ + 3h3O + 3Nh5Cl.
По масштабам применения алюминий и его сплавы занимают второе место после железа и его сплавов. Широкое применение алюминия в различных областях техники и быта связано с совокупностью его физических, механических и химических свойств: малой плотностью, коррозионной стойкостью в атмосферном воздухе, высокой тепло- и электропроводностью, пластичностью и сравнительно высокой прочностью. Алюминий легко обрабатывается различными способами — ковкой, штамповкой, прокаткой и др. Чистый алюминий применяют для изготовления проволоки (электропроводность алюминия составляет 65, 5% от электропроводности меди, но алюминий более чем в три раза легче меди, поэтому алюминий часто заменяет медь в электротехнике) и фольги, используемой как упаковочный материал. Основная же часть выплавляемого алюминия расходуется на получение различных сплавов. Сплавы алюминия отличаются малой плотностью, повышенной (по сравнению с чистым алюминием) коррозионной стойкостью и высокими технологическими свойствами: высокой тепло- и электропроводностью, жаропрочностью, прочностью и пластичностью. На поверхности сплавов алюминия легко наносятся защитные и декоративные покрытия.
Разнообразие свойств алюминиевых сплавов обусловлено введением в алюминий различных добавок, образующих с ним твердые растворы или интерметаллические соединения. Основную массу алюминия используют для получения легких сплавов — дуралюмина (94% Al, 4% Cu, по 0, 5% Mg, Mn, Fe и Si), силумина (85-90% Al, 10-14% Si, 0, 1% Na) и др. В металлургии алюминий используется не только как основа для сплавов, но и как одна из широко применяемых легирующих добавок в сплавах на основе меди, магния, железа, никеля и др.
Сплавы алюминия находят широкое применение в быту, в строительстве и архитектуре, в автомобилестроении, в судостроении, авиационной и космической технике. В частности, из алюминиевого сплава был изготовлен первый искусственный спутник Земли. Сплав алюминия и циркония — циркалой — широко применяют в ядерном реакторостроении. Алюминий применяют в производстве взрывчатых веществ.
Особо следует отметить окрашенные пленки из оксида алюминия на поверхности металлического алюминия, получаемые электрохимическим путем. Покрытый такими пленками металлический алюминий называют анодированным алюминием. Из анодированного алюминия, по внешнему виду напоминающему золото, изготовляют различную бижутерию.
При обращении с алюминием в быту нужно иметь в виду, что нагревать и хранить в алюминиевой посуде можно только нейтральные (по кислотности) жидкости (например, кипятить воду). Если, например, в алюминиевой посуде варить кислые щи, то алюминий переходит в пищу и она приобретает неприятный «металлический» привкус. Поскольку в быту оксидную пленку очень легко повредить, то использование алюминиевой посуды все-таки нежелательно.
В организм человека алюминий ежедневно поступает с пищей (около 2-3 мг), но его биологическая роль не установлена. В среднем в организме человека (70 кг) в костях, мышцах содержится около 60 мг алюминия.
- Беляев А. И. История алюминия, в сб. Труды Института истории естествознания и техники, т. 20, М., 1959.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Беляев А. И. Металлургия легких металлов. М., 1970.
- Промышленные алюминиевые сплавы. М., 1984.
megabook.ru
Где используется алюминий?
Алюминий – это легкий металл, который широко применяется в различных отраслях промышленности. Он отличается хорошей теплопроводностью и также проводит электричество. На его поверхности образуются оксидные пленки, имеющие высокую прочность и долговечность, поэтому материал невосприимчив к коррозии и не ржавеет, даже при длительном контакте с влагой.
Материал широко используется в:
- авиационной и космической отрасли;
- автомобилестроении;
- морском и речном транспорте;
- строительстве;
- производстве различных предметов бытового назначения.
Производители выбирают этот материал за оптимальное сочетание безопасности, надежности и его стоимости.
Применение в космосе и авиации
Из алюминия изготавливаются те элементы, которые будут подвергаться высоким нагрузкам. Так в самолетах он используется в обшивке, силовых и подкрепляющих наборах. Сплавы этого материала применялись в космических аппаратах, в том числе луноходе.
Использование в автомобильном и речном транспорте
Самые быстроходные корабли, получившие название «Метеор» и «Ракета», изготавливаются из алюминия. Корпус таких судов на подводных крыльях выдерживает высокую нагрузку и не теряет своих свойств из-за постоянного контакта с водой, в том числе соленой.
В автомобилестроении этот материал применяется не менее широко. Из него изготавливается прочные детали и различные электромеханические устройства, устанавливаемые в транспорте. Также сейчас этот алюминий широко используется в строительстве суперэкспрессов и других поездов.
Применение в строительстве
Алюминиевый круг используется в современном строительстве. Из него создаются:
- балки с низким весом и высокой прочностью;
- колонны;
- перекрытия;
- различные декоративные перила и ограждения;
- части систем вентиляции.
В рамках экспериментов со строительными материалами, алюминий пробуют класть на крышу. Такая кровля может выдерживать не только обычную воду, но и смеси серы, соединения азота и других веществ, разрушающих обычное кровельное железо.
Производство бытовых предметов
Из качественного алюминия изготавливают различные предметы, используемые людьми каждый день, включая посуду, ложки и вилки, стаканы и многое другое. Очень много этого материала уходит на производство фольги различной толщины. Этот продукт нашел широкое применения в пищевой промышленности и даже строительстве, в частности при производстве ячеистых материалов.
www.hugebuilding.ru