Большая Энциклопедия Нефти и Газа. Кислород плотность
Химические и физические свойства кислорода: малярная масса
Кислород является очень распространенным элементом. Как газ он применяется во многих областях. Это бесцветное вещество, не имеющее запаха. Сам по себе он не горючий, но при взаимодействии с защитными газами, использующимися для сварки, он существенно увеличивает температуру их горения. Благодаря этому появляется возможность проваривать металл большой величины. Из-за своей распространенности, легкому способу получения и небольшой стоимости, газ активно используется в различных областях. Он образует огромное количество соединений с другими элементами, так как обладает высокой активностью.
Применение кислорода является относительно безопасным, так как он не подвержен вероятности взрыва. Но со многими веществами он способен образовывать оксиды, что в свою очередь вредит им. При использовании в сварке такие свойства обходятся путем выполнения правил техники безопасности и использования, специальных вещей, которые разрешены при работе с кислородом. К примеру, инертные газы не вступают с ним в реакцию, поэтому, могут использоваться в качестве защитных. Также он не влияет на благородные металлы. Хранится и перевозится вещество чаще всего в жидком виде. Переходит в состояние газа только при нахождении на рабочем месте.

Кислород в баллонах
Область применения при сварке
Области применения кислорода очень широка, так как практически при каждом использовании газа, данное вещество добавляется в горелку. Оно не выполняет защитную функцию, как ацетилен или водород, химические свойства кислорода, создают такие условия, что основной функцией его является температурное воздействие. Поэтому, для того чтобы разрезать металл, а не сварить его, сварщику достаточно сделать более мощную струю кислорода, что поможет выжечь металл нужной толщины ровно и аккуратно.
В газовой сварке вещество используется в строительной сфере, где часто приходится создавать мощные металлоконструкции, рассчитанные на использование в качестве несущих, а также просто для соединения объектов. На многих из них лежит высокая ответственность, так что здесь применяются только самые надежные методы монтажа. Помимо этого, кислород применяется в различных мастерских по ремонту металлических изделий, автомобилей и прочих механизмов. На производстве в сварочных цехах он также является незаменимым веществом. Его используют практически с каждым защитным газом.
Преимущества
Химические свойства кислорода обеспечивают для этого элемента ряд преимуществ:
- Стоимость кислорода является относительно небольшой, что делает его применение намного более выгодным;
- Использование газа довольно безопасное, так как это не горячая субстанция, у которой нет высокой опасности взрыва;
- Транспортировка и хранение в жидком состоянии очень выгодно и компактно, так как после перехода в газовое состояние вещество сильно увеличивается в объеме.
Недостатки
Тем не менее, здесь есть ряд недостатков, которые вызывает опасности для жизни, сопутствующих материалов и прочих вещей. К основным негативным свойствам относятся:
- Степень окисления кислорода очень высока и большинство вещей, с которыми он вступает в реакцию, окисляются;
- Запрещается контакт с маслом, которое может быть на баллоне, перчатках, рабочей одежде, инструментах и так далее;
- При повышении концентрации вещества в воздухе образуется взрывоопасная ситуация, а это сложно вычислить, так как запах газ не издает.
Формула кислорода
Формула кислорода выглядит так – О2. Несмотря на то, что это чистый газ, состоящий из одного элемента без примесей, в формуле обозначено два атома, так как он всегда соединяется, как минимум, с одним атомом вещества.
Состав
Состав чистого кислорода соответствует его формуле. Это О2 без каких-либо примесей. В данном случае материал лучше всего проявляет свои свойства. Он наиболее эффективен и обеспечивает получение максимального коэффициента полезного действия. Снижение чистоты на несколько сотых процентов приводит не только к снижению эффективности, но и к увеличению расхода. Проблема состоит в том, что чистый материал можно получить только в лабораториях, тогда как в сварке применяют технический кислород. Здесь уже имеются определенные примеси, которые в свою очередь строго регламентированы ГОСТами. Исходя из чистоты, выделяют несколько сортов, параметры которых представлены в данной таблице:
Параметры | Сорта технического кислорода | |
| первый | второй | |
| Содержание кислорода, % | 99,7 | 99,5 |
| Содержание водяных паров, %, | 0,007 | 0,009 |
| Доля водорода в составе,% | 0,3 | 0,5 |
| Содержание углекислого газа, % | Нет нормированных данных | |
| Запах | Отсутствует | |
Расчет плотности кислорода
Плотность кислорода является скалярной величиной. Она является соотношением массы газа относительно занимаемого им объема. Естественно, что при различном давлении и прочих условиях данный показатель будет отличаться, поэтому, данная величина определяется при нормальных условиях. В отличие от плотных веществ, при вычислении газа применяются несколько иные формулы. В данном случае плотность = M/Vm.
М – это молярная масса кислорода.
Vm – это молярный объем, который в нормальных условиях будет равняться, примерно, 22,4 г/моль.
Валентность и молекулярная масса
Валентность кислорода, также как и данный параметр в других элементах, является показателем количества атомов, которые может присоединить себе этот элемент. У этого газа валентность равняется двум, что означает – один атом может присоединить к себе еще два атома других элементов, валентность которых будет равняться 1, или же один с аналогичной валентностью. Но если брать в расчет формулу вещества, которая выглядит как О2, то здесь уже один атом соединился с другим с такой же валентностью и они образуют, так называемое, «полное вещество».
Молекулярная масса выражается в атомных единицах. Численно она соответствует молярной массе, но по размерности они обладают существенными отличиями. Данный параметр у газа равен 32 атомных единицы.
Удельная теплоемкость
Удельная теплоемкость кислорода напрямую зависит от температуры. В большом температурном промежутке данные могут быть по недиссоциированному состоянию. Это обусловлено тем, что до 1227 градусов Цельсия диссоциация газа не является каким-либо существенным фактором. При температуре 27 градусов Цельсия, данный параметр равняется 0,918 кДж/(кг*градусы Цельсия).
Инструкция по использованию при сварке
Физические и химические свойства кислорода обуславливают особенности его применения, которые нужно учитывать при сварке, чтобы не возникло несчастного случая, а также все прошло согласно предусмотренной технологии. Применение кислорода осуществляется не сразу, так как здесь требуется провести ряд предварительных подготовительных работ. Это касается не только зачистки и обработке металла. Здесь нужно убрать все масляные частицы и прочие органические соединения с поверхности заготовки, баллона и рабочей одежды, чтобы не возникло риска возгорания. Далее следует убедиться, что баллон находится от источника пламени и легко возгораемых предметов на расстоянии от 5 метров и дальше.
Температура горения кислорода вместе с защитными газами является высокой, так что при необходимости в предварительном подогреве, нужно сначала пустить в горелку один газ, а затем уже подключать кислород, когда начинается сварка. Чем больше данного элемента по отношению к защитному газу, тем выше температура общего пламени. Это же нужно соблюдать и при постепенном остывании, тогда полученный шов подогревается горелкой, чтобы не резко снижать температуру.
Если применение кислорода идет для резки, то его количество подачи должно быть намного выше, чем при сварке. В данном случае подается мощная струя, в которой достаточно сильная температура для расплавки металла. Чаще всего это делается в паре с ацетиленом, так как у него наиболее высокая температура горения.
«Важно!
По технике безопасности, баллоны с веществом должны стоять в вертикальном положении и при этом быть закреплены, чтобы не было падения.»
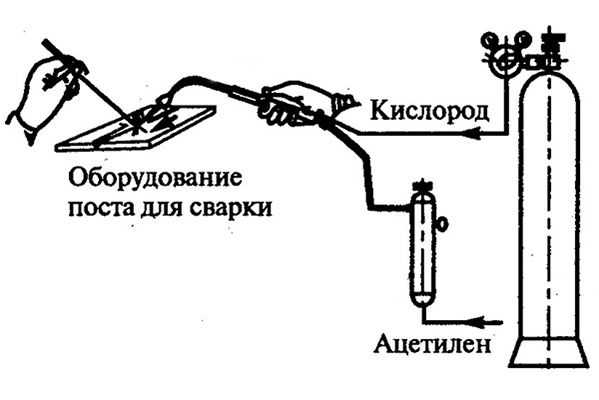
Схема использования кислорода для сварки
Заключение
Химические свойства кислорода выделяют его среди всех сварочных газов. С учетом стоимости и особенностей применения, для сварки он практически незаменим. Здесь нужно учитывать его безопасность, низкую стоимость, доступность и прочие факторы. Кислород в баллонах синего цвета присутствует практически на всех сварочных постах, где пользуются газом.
Разнообразие сортов технических разновидностей, обусловленных ГОСТами актуально преимущественно для ответственных работ. В частной сфере нередко применяют вещества не столь чисты, даже в сравнение со вторым сортом. Швы при помощи этого расходного материала получаются не столь качественными и надежными, но более дешевыми. Для ответственных соединений запрещается использовать подобные материалы.
svarkaipayka.ru
Плотность - кислород - Большая Энциклопедия Нефти и Газа, статья, страница 3
Плотность - кислород
Cтраница 3
Экспериментально установлено [5], что при пропитке с одной стороны глубина детонирующего слоя ПС-4 ( Яд) составляет - 6 мм. На глубине Яд от поверхности пластины ( см. рис. 14) плотность распределенного кислорода примерно вдвое меньше плотности, соответствующей стехиометрическому соотношению. [32]
Точность полученных данных в статье не оговорена. Это объясняется, по-видимому, тем, что Сайи и Кобаяши при калибровке установки использовали завышенные значения плотности кислорода. [33]
Найдено, что образец неизвестного углеводорода содержит 7 75 % водорода и 92 25 % углерода. Плотность паров этого углеводорода при 100 и 1 атм, как установлено, в 2 47 раза больше плотности кислорода при тех же условиях. [34]
Например, согласно представлениям Дальтона, плотность монооксида углерода как вещества, состоящего из двух атомов, должна быть больше плотности кислорода как вещества, состоящего из одного атома, однако на самом деле она была меньше. Точно так же плотность паров воды оказалась меньше плотности кислорода. [35]
Давление пара воды при 25 С равно 23 76 мм рт. ст. Вычислить: а) вес 1 л кислорода при нормальных условиях, б) плотность кислорода по водороду и в) молекулярный вес кислорода. [36]
Из этого следует, что если на несколько газов, находящихся в одном сосуде, действует внешняя сила, подобная силе тяготения, то распределение каждого газа такое же, как если бы в сосуде не было никакого другого газа. Этот результат согласуется с законом, принятым Дальтоном, согласно которому атмосферу можно рассматривать как бы состоящей из двух независимых атмосфер - атмосферы кислородной и атмосферы азотной; при подъеме плотность кислорода уменьшается быстрее, чем плотность азота. Так было бы, если бы атмосфера не испытывала никаких возмущений, но ветры перемешивают атмосферу и делают ее более однородной, чем в том случае, когда она остается в покое. [37]
Например, согласно представлениям Дальтона, плотность монооксида углерода как вещества, состоящего из двух атомов, должна быть больше плотности кислорода как вещества, состоящего из одного атома, однако на самом деле она была меньше. Точно так же плотность паров воды оказалась меньше плотности кислорода. [38]
По рис. 2, а-в, где приведены спектрограммы кислородного и азотного клатратов в области 6000 - 5500 А с разрешением 15 А при 290 К, отчетливо видно, что поглощение света около 5769 А, которое в сжатом газе трактуется как переход 232 - - 2гАд в комплексе [02] 2, полностью отсутствует. Для сравнения на рис. 3 даны спектры поглощения сжатого кислорода в слое 1180 мм ф при 290 К и разрешении 30 А. Из них следует, что упомянутая полоса без труда обнаруживается даже при плотностях кислорода, меньших чем ркл 35 амага. В силу надежно установленного единства происхождения полос так называемого спектра конденсированного кислорода в участке 12600 - 3000 А [ х ] подтверждается и правильность отнесения комплексу [02] 2 этого спектра в целом. [39]
Данные табл. XVIII относятся к аэрогелю двуокиси кремния плотности 0 05 г / см3, находящемуся в атмосферном воздухе, и помещенному внутрь аэрогеля образцу активированного угля сферической формы и радиуса R. Под действием внешнего источника ( лазерное излучение) температура угля доводится до величины Гь при которой происходит тепловой взрыв угля и его горение в воздухе, находящемся внутри аэрогеля. По мере выгорания образца и уменьшения его радиуса повышается температура горения, ибо при этом возрастает градиент плотности кислорода у поверхности образца, а следовательно, и скорость подвода кислорода. [41]
Давление пара воды при 25 С равно 23 76 мм рт. ст. Вычислить: а) массу 1 л кислорода при нормальных условиях, б) плотность кислорода по водороду и в) молекулярный вес кислорода. [42]
Исключения, которые здесь встречаются ( см. § 49), весьма малочисленны и, не мешая важному значению закона объемности, могут только служить предостережением от излишней довер-чшюсти при его приложении. К сказанному выше остается здесь еще прибавить, что для элементов исключения из закона объемности встречаются, невидимому, чаще, чем для сложных тел. Частица кислорода, с точки зрения химических реакций, может считаться равной одному паю О 16; в самом деле, эти именно 16 частей представляют наименьшее количество кислорода, входящее в реакции с частичными количествами других веществ, а плотность кислорода ведет к принятию для него частицы 02 32, так что показания химических реакций и закона объемности в этом случае расходятся. Плотность паров серы, которой пай ровно вдвое больше кислородного, также долгое время представляла исключение: вместо того, чтобы быть вдвое тяжелее кислорода, пар серы, при температурах около 500, оказался в 6 раз плотнее его, и только в новейшее время опыты, сделанные при температуре 860 и 1040, дали цифру, отвечающую теории. То, что имеет место для серы, повторяется и для некоторых органических соединений: пары их приобретают вполне газообразное состояние и удовлетворяют закону объемности только при температурах, лежащих значительно выше точки кипения. Примером такого содержания может служить уксусная кислота. [43]
Не следует только считать, что эти цифры правильно отражают весовое соотношение между компонентами. Наоборот, если плотности компонентов, взятые при одинаковых температуре и давлении, отличаются друг от друга, то весовое соотношение между ними будет совсем иным. Допустим, что первый компонент - кислород, третий - водород. Нам известно, что плотность водорода при одинаковых давлении и температуре в 16 раз меньше плотности кислорода. Поэтому, хотя по объему в смеси водорода содержится в 2 5 раза больше, чем кислорода, по весу кислорода, входящего в состав смеси, будет в 6 4 раза больше, чем водорода. [44]
Страницы: 1 2 3
www.ngpedia.ru
Чистота и плотность кислорода, важные показатели
Все мы точно знаем, что есть определенные элементы, без которых жизни бы не было как таковой и одним из этих элементов является кислород. Причем не только наличие кислорода достаточно для жизни, необходимыми условиями для жизни являются нормальная плотность кислорода, его чистота и т.п. Если хотя бы один из показателей кислорода отходит от нормы качество жизни резко снижается, а иной раз возникает угроза возникновения разных тяжелых заболеваний и летального исхода. Однако и плотность кислорода и чистота его зависит от многих влияющих условий, от температуры, от уровня загрязнения, а сам кислород может быть в виде газа, жидкого кислорода и твердого кислорода.
Кислород – это газ, прозрачный, мы его не видим, без какого-либо запаха и вкуса. Благодаря кислороду мы не только дышим, но и существуем, он входит в состав наших молекул, обеспечивает функции и нормальные структуры нуклеиновых кислот, белков, углеводов, разных низкомолекулярных соединений и липидов. Именно кислорода и в животном и в растениях больше чем какого-либо другого элемента (примерно 70%), так в человеческом организме с массой тела около 70-ти килограмм содержится примерно 43 килограмма кислорода. Большая часть кислорода поступает через органы нашего дыхания, (так называемый свободный кислород) и с водой (так называемый связанный кислород). Наша потребность в кислороде определяется интенсивностью (уровнем) обмена веществ, зависящего от возраста, массы тела, пола, поверхности тела, внешних условий, питания и тому подобного.
Кислород применяется в разных сферах человеческой жизни, не только в биологическом плане:
- кислород применяется в металлургии;
- жидкий кислород применяется как окислитель в ракетном топливе;
- как реагент для взрывов.
Кислород применяется в медицине для кислородных подушек, но слишком долгое использование обогащенного кислорода может навредить человеку, образовывая свободные радикалы и нарушая функции и структуры биополимеров. Кислород используется в лучевой терапии, вызывая кислородный эффект, также кислород используется для насыщения кислородом организма при некоторых заболеваниях.
improvehealth.ru
Плотность кислород азот - Справочник химика 21
Пример 7. Найти объемный состав с хого воздуха. Плотность кислорода, азота и их смеси (воздуха) при н. у. соответственно равна 1,43, 1,25 и 1,29 г/л. [c.48]Пример 2. Вычислить плотность азотно-кислородной смеси, состоящей по объему из 21% О2 и 79°/о N2- Плотность кислорода 1,429 г/л, азота—1,251 г/л. [c.10]
Пример 2, Подсчитать плотность р и приведенный молекулярный вес (М) воздуха, если состав его (по объему) 21% О2, 78% N2 и 1% Аг, а плотность кислорода 1,429 г/уг, азота 1,251 г/л и аргона 1,781 г/л. [c.53]
Чистый ванадий — серебристый ковкий металл, плотностью 5,96 г/см , плавящийся прн температуре около 1900 °С. Как и у титана, механические свойства ванадия резко ухудшаются нри наличии в нем примесей кислорода, азота, водорода. [c.652]Кухаренко отмечает, что гумусовые кислоты представляют собой коричневые аморфные порошки, которые при нагревании разлагаются. Их плотность варьирует от 1330 до 1448 кг/м , причем закономерно увеличивается с повышением зрелости торфов и бурых углей. Гумусовые кислоты из торфа и бурых углей значительно различаются по элементному составу. Обычно с повышением зрелости содержание углерода увеличивается, а водорода, кислорода, азота и серы уменьшается [26]. [c.146]
Чистый ванадий — голубовато-серый ковкий металл, плотностью 5,96 г/см , плавящийся при температуре около 1900 °С. Как и у титана, пластические свойства ванадия резко ухудшаются при наличии в нем примесей кислорода, азота, водорода. Эти примеси одновременно повышают твердость и хрупкость ванадия. [c.508]
Присутствие благородных газов в воздухе было постулировано (а затем открыто) У. Рамзаем в 1894 г. при сравнении плотности атмосферного азота (т. е. воздуха, из которого удален кислород), равной 1,257 г/л, с плотностью химически чистого азота (полученного термическим разложением нитрита аммония). Плотность какого азота должна быть больше Рассчитайте плотность чистого азота и покажите, что не случайно открытие благородных газов называют торжеством третьего знака после запятой . [c.232]
Физические методы. Состав воздуха может быть вычислен из плотностей чистого азота и чистого кислорода по отношению к воздуху. [c.516]
Силы отталкивания способствуют обмену кинетической и потенциальной энергий между молекулами, установлению термодинамического равновесия. Межмолекулярные химические связи возникают в результате перераспределения электронной плотности в пространстве между молекулами, частичного переноса заряда от молекулы донора к молекуле акцептора. Такой перенос электронного заряда понижает энергию системы и приводит к образованию молекулярных ассоциатов в чистых жидкостях и комплексных соединений в растворах. Разновидностью межмолекулярных химических взаимодействий является водородная связь, осуществляемая с участием водорода. Атом водорода, ковалентно связанный с атомом фтора, кислорода, азота, хлора, серы, фосфора, углерода, может образовать вторую связь с одним из таких же атомов другой молекулы. В воде, спиртах и кислотах энергия водородной связи составляет 20,9 —33,4 кДж/моль в бензоле, растворе ацетон — вода — около 4,2 кДж/моль. [c.247]
Определите плотность водорода, азота и кислорода на основании закона Авогадро при нормальных условиях Т = 273 К Р = Па. [c.19]
Введение атомов галогенов, кислорода, азота и других элементов в состав молекул органического веш,ества прежде всего вызывает перераспределение электронной плотности за счет образования полярных связей между атомами углерода и введенным атомом. Перераспределение электронной плотности между двумя атомами, входящими в состав молекулы, не может быть локализованным и влияет на распределение электронов во всей молекуле, изменяя ее свойства. [c.448]
Ванадий представляет собой серебристо-серый металл, плотность 5,96 г/см , плавится прн температуре 1920°С. Ванадий пластичен, однако его пластичность ухудшается прп наличии в металле примесей неметаллов (кислорода, азота). [c.265]
Через 1 дм" пленки полиэтилена плотностью 0,96, толщиной 0,025 лш при 20—25° нри 1 см рт. ст. перепада давления кислорода, азота и углекислоты за 24 часа проходит соответственно 10,6, 2,7 и 35 мл газа. [c.767]
Физическое теплосодержание нефтяного сырья можно най-ТИ( из зависимостей, связывающих его с плотностью и характеризующим фактором [7]. Общая теплота различных продуктов сгорания, а также значения ее для кислорода, азота и водяного пара, содержащихся в сырьевых потоках, были опубликованы ранее [8] вместе с материальными и энергетическими балансами реакторов синтез-газа, работающих на газообразных топливах. [c.187]
Сходный со смолами состав имеют асфальтены - наиболее высокомолекулярные соединения нефти. В состав асфальтенов входят углерод, водород, кислород, азот, сера, но соотношения между количеством этих атомов иное, чем в смолах. Больше в асфальтенах содержится и таких элементов, как железо, ванадий, никель и др. В специальной литературе указывается, что асфальтены представляют собой продукт конденсации молекул смол. У асфальтенов молекулярная масса выше 1 ООО. Асфальтены представляют собой черное твердое вещество с плотностью более 1. [c.3]
При повышении полярности среды это равновесие смещается влево к состоянию с большей спиновой плотностью на азоте, что приводит к росту и снижению. Изменение АЕ происходит при сольватации молекулами растворителя по л либо -орбиталям радикала. Наблюдаемое увеличение АЕ т, с ростом гидрофобности растворителя может быть связана с усилением сольватации -орбитали кислорода. [c.188]
Электронодонорные заместители проявляют +М-эффект и повышают электронную плотность в сопряженной системе. К электронодо-норным заместителям относятся гидроксильная группа —ОН и аминогруппа — НН,. Неподеленная пара электронов гетероатомов этих групп вступает в общее сопряжение с тг-электронной системой бензольного кольца и увеличивает длину сопряженной системы. Такой вид сопряжения называется р,л-сопряжением атомы кислорода, азота, серы, неподеленные пары электронов которых участвуют в р,л-сопряжении, не образуют кратных связей (по этому признаку их можно узнать в формулах веществ). Под влиянием электронодонорных заместителей происходит перераспределение электронной плотности в бензольном кольце с некоторым ее сосредоточением в орто- и /юря-положениях. [c.126]
В свободном виде — твердые, не-плавящиеся, хрупкие вешества черного или бурого цвета. В отличие от нейтральных смол А. не растворимы в петролейном эфире, легко растворимы в бензоле и его гомологах, хлороформе, сероуглероде и т. д. Плотность А. более, единицы. Кроме углерода и водорода, содержат также нек-рое количество кислорода, азота и серы. [c.64]
В составе нефтей выделяют парафиновые, нафтеновые и ароматические углеводороды, а также углеводороды смешанного строения. Кроме того, в составе нефтей имеются гетероатомные углеводородные соединения, содержащие серу, кислород, азот. Каждая из этих групп соединений состоит из большого числа индивидуальных веществ. Многие нефти содержат значительное количество легких жидких углеводородов, относящихся к бензиновой и газой-левой фракциям. Такие нефти имеют наименьшую плотность (0,70—0,80 г/см ). Если плотность нефтей более значительна, в их составе доминируют керосиновые и масляные фракции. Наконец, встречаются тяжелые нефти, плотность которых достигает 0,95—1,0. В этих нефтях содержится много смолистых веществ. [c.5]
Такое утверждение представляется нам недостаточно обоснованным. В самом деле, в возбужденном состоянии на кислороде гидроксильной группы происходит значительное понижение электронной плотности. Одновременно, как показано Веллером 165], повышается электронная плотность на азоте азометиновой группы. Усиление при этом диполь-дипольного взаимодействия должно привести не к разрыву, а, наоборот, к упрочнению внутримолекулярной водород-/ ной связи. Можно предположить, что в молекуле, поглотившей квант света, в соответствии с новым распределением электронной плотности происходит перемещение протона вдоль координаты внутримолекулярной водородной связи. Но это не полное смещение протона к, азоту азометиновой группы, а лишь частичный сдвиг, способствующий образованию наиболее прочной водородной связи. Чем прочнее водородная связь в основном состоянии, тем меньше энергетические затраты на перенос протона в возбужденном состоянии, тем меньше стоксов сдвиг и выше интенсивность флуоресценции. После излучения кванта флуоресценции в молекуле вновь происходит перераспределение электронной плотности и сдвиг протона в обратном направлении. [c.71]
Открытие в составе воздуха первого из инертных газов — аргона, вошедшее в историю химии под образным названием торжество третьего десятичного знака , состоялось лишь примерно сто лет спустя при следующих обстоятельствах. В конце XIX, в. предметом ожесточенных споров сделалась гипотеза Проута, Согласно этой гипотезе, атомы всех элементов представляют собой сочетания атомов водорода, так как по крайней мере большинство атомных весов элементов оказываются кратными от единицы. Для решения споров потребовалось повторное определение атомных весов, в частности через точное измерение удельных весов таких газов, как азот, кислород и водород. Зтой задачей и был занят английский экспериментатор Релей, когда он натолкнулся на непонятный факт азог, выделенный из воздуха путем уда-, ления из него кислорода (и СОг), имел одну плотность, а азот, выделенный из азотистых соединений, — другую, несколько меньшую (1,257 и 1251 г/л). [c.176]
Пример 2. Вычислить плотность азотно-кислородной смеси, состоящей по объему из 21°/о О2 9% N3. Плотность кислорода 1,429 г/л, азота 1,251 г л. [c.21]
Для отделения азота от кислорода нельзя воспользоваться различием в плотностях обоих газов, потому что они очень близки плотность кислорода в 16, азота в 14 раз более плотности водорода, а потому здесь нельзя употребить пористых сосудов разность во времени просачивания для обоих газов будет ничтожною. [c.438]
Пары и газы, как объяснено в главе 2, повинуются одним законам, притом лишь приближенным. Для вывода объемных законов, очевидно, должно брать во внимание только возможно совершенное состояние (удаленное от жидкого) и химическую неизменность, при которых плотность пара постоянна, т.-е. такое, при котором объем данного газа или пара изменяется, как объем водорода, воздуха или другого газа при перемене давления и температуры (тут, конечно, есть своя условность, но она неизбежна почти всюду, ибо абсолютно — недостижима). Оговорку эту необходимо сделать для того, чтобы ясно видеть, что законы газовых объемов, далее излагаемые, находятся в теснейшей связи с законами перемены объемов от давления и температуры. А как эти последние законы (гл. 2) ие строго, а только приближенно точны, то это же относится и к далее излагаемым законам. И как есть возможность найти дальнейшие, более точные (второе приближение) законы для изменения V от р к i (чему примером и служит формула. Ван-дер-Ваальса), так точно возможно и более точное выражение для соотношения между составом и плотностью паров и газов. Но чтобы в самом начале не родилось сомнения в широте и общности объемных законов, достаточно сказать, что плотность таких газов, как кислород, азот, углекислота и пр., и таких паров, как ртути или воды — по опыту — остается постоянною (в пределах точности опытов) в широких пределах температур от обыкновенной до белокалильного жара. При перемене же давлений, судя по тому, что дано в моём сочинении, 06 упругости газов (т. I, стр. 9), можно думать, что плотность сохраняется с большим постоянством даже тогда, когда отступления от закона Мариотта весьма велики. Однако, в этом последнем отношении число данных еще мало для окончательного суждения. [c.530]
Г фиий, а также искусственно полученный элемент курчатовин (№ 104). Конфигурация электронной оболочки атомов этих элементов такая же, как у титана, — d s . Аналоги титана цирконий и гафний являются тяжелыми металлами — их плотности соответственно 6,45 и 13,31 г/см температуры их плавления также выше, чем у титана 1852 и 2225°С. Цирконий и гафний образуют разнообразные соединения, в устойчивых и наиболее характерных из которых цирконий и гафний четырехвалентны. Устойчивость соединений, в которых эти элементы трех- и двухвалентны, невелика п убывает в направлении Ti—Zr — Hf. В этом же направлении возрастает металлическая активность этих элементов. Цирконий и гафний, подобно титану, существуют в двух полиморфных видо-измеР ениях — а и р. Также подобно титану цирконий и гафпин при обычных температурах химически неактивны и коррозионноустойчивы, а при высокой температуре реагируют с кислородом, азотом н другими элементарными окислителями. [c.275]
Молекулы спиртов ассоциированы за счет возникновения между ними водородных связей. Водородная связь возникает там, где есть водород и сильно электроотрицательный элемент — ( ггор, кислород, азот, хлор, сера. Так как электронная плотность от водорода смещена, то водород может взаимодейсгвовать с неподеленной электронной парой другого атома или иона. Эта связь более слабая, возникающая за счет электростатического и донорно-акцепторного взаимодействий. Для водородной связи характерны направленность в пространстве и насыщенность. [c.222]
Вследствие электростатического происхождения водородной связи ее образуют лишь атомы наиболее электроотрицательных элементов — фтора, кислорода, азота. Обычно неподеленная электронная пара притягиваемого атома наиболее тесно сближается с притягивающим ионом водорода. Вода особенно подходящее вещество для образования водородной связи, поскольку каждая молекула имеет два атома водорода и две неподеленные электронные пары, а следовательно, может образовать четыре водородные связи. Тетраэдрическое расположение поделец-ных и неподеленных электронных пар обусловливает тетраэдрическое направление этих четырех связей в пространстве и приводит к образованию характерной кристаллической структуры льда (рис. 9.8). Эта структура, в которой каждая молекула окружена только четырьмя ближайшими соседними частицами, весьма ажурна, и поэтому лед является веществом с аномально низкой плотностью. При плавлении льда тетраэдрическая структура частично разрушается и молекулы воды сближаются, вот почему плотность воды превышает плотность льда. Однако многие водородные связи сохраняются, и агрегаты молекул с тетраэдрической структурой присутствуют в воде при температуре за- [c.252]
Э. используют в полупром. масштабах для глубокой очистки металлов (Ga, In, РЗЭ) в жидкой фазе. Для РЗЭ Э. в твердом состоянии - осн. метод очистки, т. к. РЗЭ реагируют со всеми газами, кроме благородных, и здесь недоступны традиц. методы очистки, особенно от примесей кислорода, азота и углерода. Э. применяют для выращивания монокристаллов и эпитаксиальных слоев полупроводниковых соед., напр. GaAs (элжтроэпитаксия). Э. в тв дой фазе - одна из причин отказов полупроводниковых приборов и электронных устройств, работающих при высоких плотностях тока. Изучение закономерностей Э. позволяет сильно увеличить срок службы этих приборов. В области Э. можно ожидать новых открытий, особенно в случаях Э. на фанице твердых и жидких фаз, при фазовых переходах. Об этом свидетельствует факт аномально высокой подвижности примесей при зонной плавке и резании металлов (эффект Бобровского). [c.453]
Нитрилы образуют молекулярные соединения и с нуклеофильными реагентами, например с фенолом и, по-видимому, с пиридином . Ацетонитрил дает молекулярное соединение с пиколи-ном Бензонитрил в качестве апротонной кислоты образует молекулярные комплексы с органическими соединениями, содержащими атомы кислорода, азота или другие гетероатомы с неподеленной парой электронов. Считают что в случае бензонитрила в образовании комплексов с электронодонорными соединениями участвуют как нитрильная группа, так и бензольное кольцо, я-электронная плотность которого сильно понижена связанной с ним нитрильной группой. Поэтому предполагают З , что продукты взаимодействия бензонитрила с электронодонорными соединениями представляют собой комплексы с переносом заряда. [c.33]
Сила основания определяется стабильностью образующегося катиона (сопряженной кислоты). Чем стабильней катион, тем сильнее основание. Стабильность катиона определяется суммой тех же факторов, что и стабильность аниона, с той лишь разницей, что влияние этих факторов на основность противоположно тому влиянию, которое они оказывали на кислотность. Например, наличие в углеводородном радикале электронодонорных заместителей будет способствовать стабилизации катиона и, следовательно, повышать силу основания. Напротив, электроноакцетхзрные заместители будут дестабилизировать катион и уменьшать основность соединения. Исходя из природы атомов кислорода, азота и серы, можно сделать вывод, что наиболее электроотрицательный атом кислорода за счет более прочного удерживания неподеленной пары электронов менее склонен присоединять протон по сравнению, например, с атомом азота. Действительно, амины обычно более сильные основания, чем спирты. Электроны атомов азота и серы менее прочно удерживаются ядром и более доступны для связи с протоном. Однако у атома серы электронная плотность рассредоточена в большем объеме по сравнению с атомом азота и кислорода. Плотность заряда становится меньшей и атом серы слабее связывает протон. Поэтому тиолы более слабые основания, чем амины и спирты. [c.159]
С. В ядерных энергетических установках и теилообменных устройствах псиользуют газообразные Т. воздух, кислород, азот, водород, гелий, пеон, аргоп, двуокись углерода и т. д. Опи обладают высокой термической и хим. стабильностью, позволяют достигать высоких т-р при низких давлениях, их физ. св-ва незначительно изменяются в широком интервале т-р. Однако у газообразных Т. небольшая плотность, невысокая тенлоемкость и очень низкий [c.522]
ПЛОТНОСТЬ, чем азот, получаемый из химических соединений, таких, как аммиак или нитраты. Рамзай предположил, что различие в цлотности объясняется присутствием в воздухе еще одного не открытого тяжелого газа. Ему удалось после удаления кислорода пропусканием воздуха над раскаленной медью связать азот воздуха раскаленным магнием. Оставшийся газ оказался новым химическим элементом с характерным спектром. Одновременно он был выделен лордом Релеем, удалявшим азот старым методом Пристли и Кавендиша (см.стр. 635). Оба исследователя назвали новый элемент за его химическую инертность (греческое аргос [c.128]
Результаты, приведенные в разделах 5.2—5.19, показывают, что для проявления ингибирующего наводороживание действия органические молекулы должны иметь определенные функциональные группы, способные вступать во взаимодействие с поверхностью стального катода. Такими группами являются —ОН (спиртовая), >С0 (карбонильная), —СООН (карбоксильная), —МНа (аминная), —50з (сульфогруппа). Связь с поверхностью металла осуществляется через атомы кислорода, азота и серы, причем, чем больше плотность электронов у этих атомов, тем больше эффективность ингибирующего наводороживание действия органических молекул, так как тем прочнее связь адмолекул ингибитора с поверхностью металла. [c.250]
Для анализа взято 0,3358 г газовой смеси. Содер-жзние кислородз и азота соответственно 200 и 40 см при н. у. Выразите массовый состав газовой смеси в процентах, если плотность кислорода 1,4290 г/л, а плотность азота 1,2505 г/л. [c.54]
Пример 2. Вычислить плотность азото-кислородной смеси, состоящей по объему из 21% О2 и 79% N3. Плотность кислорода 1,429 кг м , азота 1,251 кг1м . [c.13]
chem21.info
Плотность - жидкий кислород - Большая Энциклопедия Нефти и Газа, статья, страница 1
Плотность - жидкий кислород
Cтраница 1
Плотность жидкого кислорода р определена здесь при температуре на входе в парогенерирующие трубы, которая практически равна температуре насыщения, соответствующей давлению в паровом пространстве аппарата Г2 95 51 К. [1]
Значительная турбулизация пограничного слоя и близкие по значению плотности жидкого кислорода и частиц твердого топлива способствуют быстрому и практически равномерному перемешиванию частиц топлива с жидким кислородом за ударной волной. [2]
При давлениях свыше 200 кГ / см опытные данные о плотности жидкого кислорода имеются лишь на двух изотермах и не отличаются точностью. Поэтому для экстраполяции до давления 500 бар был использован закон соответственных состояний и подробные р, v, Т - данные для жидкого азота, охватывающие широкий интервал приведенных параметров. [3]
Из приведенных данных следует, что плотность большинства опасных примесей меньше плотности жидкого кислорода, и поэтому они должны всплывать в жидком кислороде. [4]
Из приведенных данных следует, что плотность большинства опасных примесей меньше плотности жидкого кислорода, и поэтому они должны в нем всплывать. Визуальное наблюдение за поведением твердых частиц ацетилена в жидком кислороде показало, что в некипящем жидком кислороде частицы твердого ацетилена всплывают, а в некипящем азоте - оседают; в кипящем азоте и кислороде мельчайшие частицы твердого ацетилена распределяются равномерно по всему объему. [5]
Температура кипения жидкого кислорода при атмосферном давлении - 183 С, критическая температура кислорода равна - 119 С, а критическое давление 50 атм; плотность жидкого кислорода равна 1 13, и, таким образом, он тонет в воде, что легко демонстрировать. [7]
Озон дает полосу поглощения в красной области спектра. Он дает также спектр поглощения в ультрафиолетовой области при 2540 Айв инфракрасной области при 4 7 и 9 15 мк. Жидкий озон имеет плотность больше плотности жидкого кислорода и смешивается с ним не в любых отношениях. В твердом состоянии озон представляет собой кристаллы фиолетового, почти черного цвета. [8]
В технике азот в больших количествах получают путем сжижения и фракционированной перегонки воздуха. Так как кислород кипит при - 183 С, а азот при - 195 7 С, причем плотность жидкого кислорода 1 14, а азота 0 81, то азот испаряется раньше, чем кислород. [9]
Анализ условий, при которых возможен такой механизм образования взрывоопасных систем, показал следующее. Во-первых, в конденсаторах-испарителях с межтрубным кипением даже при отсутствии обечайки на трубном пучке происходит интенсивное перемешивание жидкости в результате ее барботажа восходящими потоками пузырьков пара. В таких условиях трудно представить, чтобы кристаллы примесей могли фиксироваться в определенной части аппарата только под действием архимедовых сил. Во-вторых, плотность кристаллов практически всех углеводородов меньше плотности жидкого кислорода, а очаги взрывов зарегистрированы по всей высоте трубок. В-третьих, в рассматриваемом в работе [42] типе установок образование кристаллов углеводородов возможно только в случае, когда их концентрация в жидком кислороде превыш зет растворимость. [10]
Страницы: 1
www.ngpedia.ru
Ответы@Mail.Ru: какова плотность кислорода?
У кислорода нет какой-то раз и навсегда заданной плотности, это - газ. В какой объём и сколько закачаешь - так и будет.
2,144 кг/м3 я ж тебе ссылку написал... там все есть
Чем холоднее тем плотнее
Вас интересует плотность или относительная плотность? Если плотность, нужно уточнить условия, если относительная-по какому газу. Если плотность- 32 г - масса 1 моль. При н. у. 1 моль- 22,4 л. Плотность рассчитываем как частное 32/22,4 ( г/л)
Высчетай по формуле плотность= обьём : на массу
touch.otvet.mail.ru
плотность кислорода при нормальных условиях
p*V = m*R*T/V - подставить н.у. - получишь плотность (m/V).<br>p = 1атм. = (примерно) 100 000 Па.<br>R = 8,31<br>Т = 300 К<br>М = 32г/моль<br>Вот только в чём объём и в чём, соответственно, получится плотность - не помню.
Вы бы лучше спросили при не нормальных условиях.
1,43 Килограммов на метр в кубе
А вот и нет! <br>1,43 - это плотность при 0 градусов по Цельсию. "Нормальными условиями" в технике считаются давление 760 мм рт. ст и температура +27 градусов (300 К). При этих условиях плотность кислорода - 1,301кг/куб. м.
Как у всех газов 1г- моль = 22.4литра . Считай сам.
touch.otvet.mail.ru