Оксид меди. Соединения меди цвета
Медь Свойства. |
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]− устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl−(водн.) → [CuCl2]− (водн.)
Хлорид меди(I) — белое нерастворимое твёрдое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)Ионы меди окрашивают пламя в зелёный цвет
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]−. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(Nh4)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
* Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода. * В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически. * Микроколичества меди в растворах определяют кинетическими методами.
Применение В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру, удельное сопротивление при 20 °C 0,01724-0,0180 мкОм·м[4]), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов. Для этих целей металл должен быть очень чистый: примеси резко снижают электрическую проводимость. Присутствие в меди 0,02 % алюминия снизит ее электрическую проводимость почти на 10 %.[5]
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.В России производство водогазопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 , а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Сплавы на основе меди
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, в которые помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз.
Для деталей машин используют сплавы меди с цинком, оловом, алюминием, кремнием и др. (а не чистую медь) из-за их большей прочности: 30-40 кгс/мм² у сплавов и 25-29 кгс/мм² у технически чистой меди. Медные сплавы (кроме бериллиевой бронзы и некоторых алюминиевых бронз) не принимают термической обработки, и их механические свойства и износостойкость определяются химическим составом и его влиянием на структуру. Модуль упругости медных сплавов (900-12000 кгс/мм² ниже, чем у стали). Основное преимущество медных сплавов — низкий коэффициент трения (что делает особенно рациональным применением их в парах скольжения), сочетающийся для многих сплавов с высокой пластичностью и хорошей стойкостью против коррозии в ряде агрессивных сред и хорошей электропроводностью. Величина коэффициента трения практически одинакова у всех медных сплавов, тогда как механические свойства и износостойкость, а также поведение в условиях коррозии зависят от состава сплавов, а следовательно, от структуры. Прочность выше у двухфазных сплавов, а пластичность у однофазных. Медноникелевые сплавы используются для чеканки разменной монеты.
Медноникелевые сплавы, в том числе и так называемый «адмиралтейский» сплав, широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Медь является важным компонентом твёрдых припоев - сплавов с температурой плавления 590-880 градусов Цельсия, обладающих хорошей адгезией к большинству металлов, и применяющихся для прочного соединения разнообразных металлических деталей, особенно, из разнородных металлов, от трубопроводной арматуры до жидкостных ракетных двигателей
Сплавы, в которых медь значима
Дюраль (дюралюминий) определяют, как сплав алюминия и меди (меди в дюрали 4,4 %).
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 .Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
Продукты богатые медью.Метаболизм меди у человека. Поступление в энтероцит с помощью транспортёра CMT1, перенос с помощью ATOX1 в сеть транс-Гольджи, при росте концентрации — высвобождение с помощью АТФ-азы ATP7A в воротную вену. Поступление в гепатоцит, где ATP7B нагружает ионами меди белок церулоплазмин, а избыток выводит в желчь.Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от её избытка».В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта.Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[9]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.
Бактерицидность
Бактерицидные свойства меди и её сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[10] (агентство подчёркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приёма внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы , на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов . Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:Компания тыс. тонн %Норильский никель 425 45 %Уралэлектромедь 351 37 %Русская медная компания 166 18 %
К указанным производителям меди в России в 2009 году присоединился Холдинг «Металлоинвест», выкупивший права на разработку нового месторождения меди «Удоканское». Мировое производство меди в 2007 году составляло [17] 15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были:
1. Чили Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), 2. Соединённые Штаты Америки США (1,170/1,310), 3. Перу Перу (1,190/1,220), 4. Китайская Народная Республика Китай (0,946/1,000), 5. Австралия Австралия (0,870/0,850), 6. Россия Россия (0,740/0,750), 7. Индонезия Индонезия (0,797/0,650), 8. Канада Канада (0,589/0,590), 9. Замбия Замбия (0,520/0,560), 10. Казахстан Казахстан (0,407/0,460), 11. Польша Польша (0,452/0,430), 12. Мексика Мексика (0,347/0,270).
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причём, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн.[источник не указан 296 дней] Наверняка медь была первым металлом, с которым познакомились древние люди[источник не указан 296 дней]. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало её пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах.Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
2CO + (CuOH)2CO3 \\mathrm{\\xrightarrow{\\Delta}}3CO2 + 2Cu + h3O.
Добычу меди называют[кто?] прабабушкой металлургии. Её добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди.На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае.В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров.Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды обнаружено на севере Читинской области.По объёму мирового производства и потребления медь занимает третье место после железа и алюминия.
Интересные факты
* В Японии медным трубопроводам для газа в зданиях присвоен статус «сейсмостойких». * Инструменты, изготовленные из меди и её сплавов не создают искр, а потому применяются там, где существуют особые требования безопасности (огнеопасные, взрывоопасные производства). * В организме взрослого человека содержится до 80 г меди. * Польские учёные установили, что в тех водоёмах, где присутствует медь, карпы отличаются крупными габаритами. В прудах или озёрах, где меди нет, быстро развивается грибок, который поражает карпов. * Поскольку медь не накапливается в организме, а выводится вместе с продуктами метаболизма, человеку ежедневно необходимо получать в составе диеты ок. 2 мг меди.
obzor-novostei.ru
Медь | Chemistry-gid.ru
Медь — это химический элемент с символом Cu (от латыни : медный ) и атомным номером 29.
Это мягкий, ковкий и пластичный металл с очень высокой теплопроводностью и электропроводностью . Свежесобранная поверхность чистой меди имеет красновато-оранжевый цвет. Медь используется в качестве проводника тепла и электричества в качестве строительного материала и как составная часть различных металлических сплавов , таких как серебро , используемое в ювелирных изделиях , медно-никелевое масло , используемое для изготовления морской техники и монет , и константан, используемый в тензодатчиках и термопарах Для измерения температуры.
Медь является одним из немногих металлов, которые встречаются в природе в непосредственно используемой металлической форме, в отличие от необходимости добычи из руды. Это привело к очень раннему использованию человеком, c. 8000 до н.э. Это был первый металл, который плавится из его руды, c. 5000 до н.э., первый металл, подлежащий отливке в форму в форме, c. 4000 до н.э. и первый металл, который должен быть сплавлен сплавом с другим металлом, оловом , для создания бронзы , c. 3500 г. до н.э.
В римскую эпоху медь была главным образом добыта на Кипре , происхождение названия металла, от айпириума (металл Кипра), позже испорчено до купрама , из которого слова медь (английский), кувёр ( французский ), Копер (Голландский) и Kupfer (немецкий). Обычно встречающиеся соединения представляют собой соли меди (II), которые часто придают синим или зеленым цветам такие минералы, как азурит , малахит и бирюза , и широко используются в качестве пигментов. Медь, используемая в зданиях, обычно для кровли, окисляется, образуя зеленый вердигр (или патину ). Медь иногда используется в декоративном искусстве , как в форме элементарного металла, так и в соединениях в качестве пигментов. Медные соединения используются в качестве бактериостатических агентов , фунгицидов и древесных консервантов.
Медь важна для всех живых организмов как дикий диетический минерал, потому что он является ключевым компонентом комплексной цитохромоксидной оксидазы с респираторным ферментом. В моллюсках и ракообразных медь является составной частью гемоцианина крови пигмента, замененного железистым комплексом гемоглобина у рыб и других позвоночных животных . У людей медь встречается главным образом в печени, мышцах и кости. Взрослый организм содержит от 1,4 до 2,1 мг меди на килограмм массы тела.
Свойства меди
Переплавленная руда меди, в полноценный металл.Медь, серебро и золото находятся в группе 11 периодической таблицы. Эти три металла имеют один s-орбитальный электрон поверх заполненной d-электронной оболочки и характеризуются высокой пластичностью и электрической и теплопроводностью. Заполненные d-оболочки в этих элементах мало способствуют межатомным взаимодействиям, в которых преобладают s-электроны через металлические связи . В отличие от металлов с неполными d-оболочками металлические связи в меди не имеют ковалентного характера и относительно слабы. Это наблюдение объясняет низкую твердость и высокую пластичность монокристаллов меди. В макроскопическом масштабе введение расширенных дефектов кристаллической решетке , таких как границы зерен, препятствует потоку материала при приложении напряжения, тем самым увеличивая его твердость. По этой причине медь обычно поставляется в мелкозернистой поликристаллической форме, которая имеет большую прочность, чем монокристаллические формы.
Мягкость меди частично объясняет ее высокую электропроводность (59,6 × 106S/м) и высокую теплопроводность, вторая по величине (вторая только серебро) среди чистых металлов при комнатной температуре. Это связано с тем, что удельное сопротивление переносу электронов в металлах при комнатной температуре происходит главным образом за счет рассеяния электронов на тепловых колебаниях решетки, которые относительно слабы в мягком металле. Максимально допустимая плотность тока меди на открытом воздухе составляет приблизительно 3,1 × 10 6А/м2 площади поперечного сечения, над которой она начинает чрезмерно нагреваться.
Медь — один из нескольких металлических элементов с естественным цветом, отличным от серого или серебристого. Чистая медь оранжево-красная и приобретает красноватый потускнение при воздействии воздуха. Характерный цвет меди обусловлен электронными переходами между заполненными 3d и полупустыми атомными оболочками 4s — разность энергий между этими оболочками соответствует оранжевому свету.
Как и для других металлов, если медь будет контактировать с другим металлом, произойдет гальваническая коррозия.
Медь не реагирует с водой, но медленно реагирует с атмосферным кислородом, образуя слой коричнево-черного оксида меди, который, в отличие от ржавчины, образующейся на железе во влажном воздухе, защищает подстилающий металл от дальнейшей коррозии ( пассивации ). Зеленый слой verdigris (медный карбонат) часто можно увидеть на старых медных структурах, таких как крыша многих старых зданий и Статуя Свободы. Медь запятнает при воздействии некоторых соединений серы, с которыми она реагирует, образуя различные сульфиды меди.
Изотопы
Учебные материалы по теме — изотопы, таблица изотопов меди.
Есть 29 изотопов меди. 63 Cu и 65 Cu стабильны, причем 63 Cu содержит приблизительно 69% встречающейся в природе меди. Оба имеют спин 3/2 . Другие изотопы являются радиоактивными , наиболее устойчивыми являются 67 Cu с периодом полураспада 61,83 часа. Было описано семь метастабильных изотопов ; 68 м Cu является наиболее долговечным с периодом полураспада 3,8 минуты. Изотопы с массовым числом выше 64 распадов на β — , тогда как те, у которых массовое число ниже 64 распадается на β + . 64 Cu , период полураспада которого составляет 12,7 часа, распадается в обоих направлениях.
62 Cu и 64 Cu имеют значительные применения. 62 Cu используется в 62 Cu-PTSM в качестве радиоактивного индикатора для позитронно-эмиссионной томографии .
Вхождение
Родная медь с полуострова Кевинай Мичиган длиной около 2,5 дюймов (6,4 см)Медь образуется в массивных звездах и присутствует в земной коре в пропорции около 50 частей на миллион (ppm). Это происходит как нативная медь , в сульфидах меди халькопирит и халькозит, в карбонатах меди азурит и малахит , а также в медном (I) оксидном минеральном куприте . Наибольшая масса элементарной меди обнаружила весом 420 тонн и была найдена в 1857 году на полуострове Кевинау в Мичигане, США. Родная медь — поликристаллическая , с самым большим монокристаллическим кристаллом, когда-либо описанным, размером 4,4 × 3,2 × 3,2 см.
Производство меди
Большинство меди добывается или добывается в виде сульфидов меди из крупных карьеров в порфировых месторождениях меди, которые содержат от 0,4 до 1,0% меди. Сайты включают Chuquicamata в Чили, рудник Bingham Canyon в штате Юта, США и рудник El Chino в Нью-Мексико, США. По данным Британской геологической службы в 2005 году, Чили была ведущим производителем меди с не менее чем третью долю в мире, за которой следовали Соединенные Штаты, Индонезия и Перу. Медь также может быть извлечена через процесс выщелачивания in-situ . Несколько сайтов в штате Аризона считаются первыми кандидатами на этот метод. Количество используемой меди увеличивается, а доступного количества едва хватает для того, чтобы все страны могли достичь развитых мировых уровней использования.
Резервы
Медь использовалась не менее 10 000 лет, но более 95% всей меди, добываемой и выплавленной, добывалось с 1900 года, а более половины добывалось за последние 24 года. Как и во многих природных ресурсах, общее количество меди на Земле огромно: около 10-14 тонн в верхнем километре земной коры, что составляет около 5 миллионов лет при нынешних темпах добычи. Однако лишь небольшая часть этих запасов экономически жизнеспособна с современными ценами и технологиями. Оценки запасов меди, доступных для добычи, варьируются от 25 лет до 60 лет, в зависимости от основных допущений, таких как темпы роста. Переработка является основным источником меди в современном мире. Из-за этих и других факторов будущее производства и поставок меди является предметом многочисленных дискуссий, в том числе концепция пиковой меди , аналогичная пиковой нефти.
Переработка
Как и алюминий , медь на 100% перерабатывается без потери качества, как из сырого состояния, так и из готовой продукции. По объему медь является третьим наиболее переработанным металлом после железа и алюминия. По оценкам, 80% всех меди, когда-либо добытых, все еще используется сегодня. Согласно докладу Международной комиссии по металлам в обществе , глобальный объем потребления меди на душу населения в мире составляет 35-55 кг. Значительная часть из них приходится на более развитые страны (140-300 кг на душу населения), а не на менее развитые страны (30-40 кг на душу населения).
Процесс утилизации меди примерно такой же, как и для извлечения меди, но требует меньше шагов. Медь с высокой степенью чистоты расплавляется в печи, а затем восстанавливается и ливается в заготовки и слитки. Мелкоочищенный лом очищается гальваническим способом в ванне с серной кислотой.
Сплавы меди
Многочисленные сплавы меди сформулированы, многие из которых используются в больших количествах. Латунь — сплав меди и цинка. Бронза обычно относится к медно-оловянным сплавам, но может относиться к любому сплаву меди, например, к алюминиевой бронзе. Медь — одна из самых важных составляющих серебра и каратского золота и карат-припоев, используемых в ювелирной промышленности, изменяя цвет, твердость и температуру плавления полученных сплавов. Некоторые бессвинцовые припои состоят из олова, легированного небольшим количеством меди и других металлов.
Сплав меди и никеля , называемый медно -никелевым сплавом, используется в монетах с низкой номинальной стоимостью, часто для наружной облицовки. Американская 5-центовая монета (в настоящее время называемая никелем ) состоит из 75% меди и 25% никеля в гомогенном составе. Сплав из 90% меди и 10% никеля, отличающийся стойкостью к коррозии, используется для различных объектов, подверженных воздействию морской воды, хотя он уязвим для сульфидов, иногда встречающихся в загрязненных гаванях и устьях рек. Сплавы меди с алюминием (около 7%) имеют приятный золотой цвет и используются в украшениях. Shakudō — японский декоративный сплав из меди, содержащий низкий процент золота, обычно 4-10%, который можно патинировать до темно-синего или черного цвета.
Соединения меди
Образец оксида медиМедь образует богатое разнообразие соединений, обычно с состояниями окисления +1 и +2, которые часто называют медь и медь соответственно.
Бинарные соединения
Как и другие элементы, простейшими соединениями меди являются бинарные соединения, т. Е. Те, которые содержат только два элемента, главными примерами которых являются оксиды, сульфиды и галогениды. Известны оба оксида меди и меди. Среди многочисленных сульфидов меди важные примеры включают сульфид меди (I) и сульфид меди (II).
Известны галогениды меди (с хлором , бромом и иодом ), а также галогениды меди с фтором , хлором и бромом . Попытки приготовить йодид меди (II) дают только йодид и йод меди.
2Cu2+ + 4I— → 2CuI + I2
Координационная химия
Медь образует координационные комплексы с лигандами . В водном растворе медь (II) существует как [Cu (h3O)6]2+ . Этот комплекс обладает самым быстрым обменным обменом воды (скорость присоединения и отсоединения водных лигандов) для любого аква -комплекса переходного металла . Добавление водного гидроксида натрия вызывает осаждение светло-синего твердого гидроксида меди (II) . Упрощенным уравнением является: Cu2+ + 2OH— → Cu (OH)2
Водный аммиак приводит к тому же осадку. При добавлении избытка аммиака осадок растворяется, образуя тетрааминокеппер (II):
Cu(h3O)4(OH)2 + 4Nh4 → [Cu(h3O)2(Nh4)4]2+ + 2h3O + 2OH—
Медь (II) дает глубокую синюю окраску в присутствии аммиачных лигандов. Используемый здесь — сульфат тетраминоцепера (II).Многие другие оксианионы образуют комплексы; Они включают ацетат меди (II), нитрат меди (II) и карбонат меди (II) . Медь (II) сульфат образует голубой кристаллический пентагидрат, наиболее знакомое соединение меди в лаборатории. Он используется в фунгициде под названием Бордо .
Полиолы, соединения, содержащие более одной спиртовой функциональной группы , обычно взаимодействуют с солями меди. Например, соли меди используются для проверки на снижение содержания сахаров . В частности, при использовании реагента Бенедикта и раствора Фелинса присутствие сахара сигнализируется изменением цвета от синего Cu (II) до красноватого оксида меди (I). Реагент Швайзера и связанные с ним комплексы с этилендиамином и другими аминами растворяют целлюлозу. Аминокислоты образуют очень стабильные хелатные комплексы с медью (II). Существует много мокрохимических тестов для ионов меди, в том числе ферроцианид калия , который дает коричневый осадок солями меди (II).
Медь (III) и медь (IV)
Медь (III) чаще всего встречается в оксидах. Простым примером является купрат калия, KCuO2, сине-черный твердый. Наиболее широко изученными соединениями меди (III) являются купратные сверхпроводники . Оксид иттриевой бариевой меди (YBa2 Cu3 O7 ) состоит из центров Cu (II) и Cu (III). Как и оксид, фторид является высокоосновным анионом и, как известно, стабилизирует ионы металлов в условиях высокого окисления. Известны как фториды меди (III), так и даже меди (IV), K3 CuF6 и Cs2 CuF6 соответственно.
Некоторые медные белки образуют оксокомплексы , в которых также присутствует медь (III). С тетрапептидами комплексы меди (III) фиолетового цвета стабилизируются депротонированными амидными лигандами.
Комплексы меди (III) также находятся в качестве промежуточных соединений в реакциях органокопперных соединений.
No votes yet.
Please wait...
Похожее
chemistry-gid.ru
Медь
| Атомный номер | 29 |
| Внешний вид простого вещества | пластичный металл золотисто-розового цвета |
| Атомная масса(молярная масса) | 63,546 а. е. м. (г/моль) |
| Радиус атома | 128 пм |
| Энергия ионизации(первый электрон) | 745,0 (7,72) кДж/моль (эВ) |
| Электронная конфигурация | [Ar] 3d10 4s1 |
| Ковалентный радиус | 117 пм |
| Радиус иона | (+2e) 72 (+1e) 96 пм |
| Электроотрицательность(по Полингу) | 1,90 |
| Электродный потенциал | +0,337 В/ +0,521 В |
| Степени окисления | 2, 1 |
| Плотность | 8,96 г/см³ |
| Молярная теплоёмкость | 24,44[1]Дж/(K·моль) |
| Теплопроводность | 401 Вт/(м·K) |
| Температура плавления | 1356,6 K |
| Теплота плавления | 13,01 кДж/моль |
| Температура кипения | 2840 K |
| Теплота испарения | 304,6 кДж/моль |
| Молярный объём | 7,1 см³/моль |
| Структура решётки | кубическая гранецентрированая |
| Параметры решётки | 3,615 Å |
| Отношение c/a | — |
| Температура Дебая | 315 K |
| Cu | 29 |
| 63,546 | |
| 3d104s1 | |
| Медь | |
Медь — элемент побочной подгруппы первой группы, четвертого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum). Простое вещество медь (CAS-номер: 7440-50-8) — это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной пленки). C давних пор широко применяется человеком.
История и происхождение названия
Схема атома медиИз-за сравнительной доступности для получения из руды и малой температуры плавления медь — один из первых металлов, широко освоенных человеком. В древности применялась в основном в виде сплава с оловом — бронзы для изготовления оружия и т. п. (см бронзовый век).
Латинское название элемента происходит от названия острова Кипр (лат. Cuprum), на котором добывали медь.
Нахождение в природе
Самородная медьМедь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2CO3(OH)2. Иногда медь встречается в самородном виде. Самый большой самородок был найден в Северной Америке, а его вес составлял 420 тонн [2]. Сульфиды меди образуются в основном в среднетемпературных гидротермальных жилах. Также нередко встречаются месторождения меди в осадочных породах — медистые песчаники и сланцы. Наиболее известные из месторождений такого типа — Удокан в Читинской области, Джезказган в Казахстане, меденосный пояс Центральной Африки и Мансфельд в Германии.
Большая часть медной руды добывается открытым способом. Содержание меди в руде составляет от 0,4 до 1,0 %.
Физические свойства
Медь — золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Медь обладает высокой тепло- и электропроводностью (занимает второе место по электропроводности после серебра). Имеет два стабильных изотопа — 63Cu и 65Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, 64Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латунь — сплав меди с цинком, бронза — сплав меди с оловом, мельхиор — сплав меди и никеля, и некоторые другие.
Химические свойства
На воздухе покрывается оксидной плёнкой.
Соединения
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu+ и намного более стабильную Cu2+, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu(B11h21)23-, полученных в 1994 году.
Карбонат меди(II) имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди(II) при гидратации даёт синие кристаллы медного купороса CuSO4∙5h3O, используется как фунгицид. Также существует нестабильный сульфат меди(I) Существует два стабильных оксида меди — оксид меди(I) Cu2O и оксид меди(II) CuO. Оксиды меди используются для получения оксида иттрия бария меди (YBa2Cu3O7-δ), который является основой для получения сверхпроводников. Хлорид меди(I) — бесцветные кристаллы (в массе белый порошок) плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди(II) сульфитом натрия в водном растворе.
Соединения меди(I)
Многие соединения меди(I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди(I) в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu+(водн.) → Cu2+(водн.) + Cu(тв.)
В то же время медь(I) встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат(I)-ион [CuCl2]- устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди(I):
CuCl(тв.) + Cl-(водн.) → [CuCl]- (водн.)
Хлорид меди(I) — белое нерастворимое твердое вещество. Как и другие галогениды меди(I), он имеет ковалентный характер и более устойчив, чем галогенид меди (II). Хлорид меди(I) можно получить при сильном нагревании хлорида меди(II):
CuCl2(тв.) → 2CuCl(тв.) + Cl2(г.)
Образует неустойчивый комплекс с CO
CuCl+CO → Cu(CO)Cl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди(II) с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение — комплексный дихлорокупрат(I)-ион [CuCl2]-. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди(I). Хлорид меди(I) реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди(I) [Cu(Nh4)2]+. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Применение
В электротехнике
Из-за низкого удельного сопротивления (уступает лишь серебру), медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов (быт: электродвигателях) и силовых трансформаторов.
Теплообмен
Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся и широко известные радиаторы охлаждения, кондиционирования и отопления.
Для производства труб
В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов: во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей: во Франции, Великобритании и Австралии для газоснабжения зданий, в Великобритании, США, Швеции и Гонконге для водоснабжения, в Великобритании и Швеции для отопления.
В России производство водопроводных труб из меди нормируется национальным стандартом ГОСТ Р 52318-2005 [3], а применение в этом качестве федеральным Сводом Правил СП 40-108-2004. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
Наиболее распространённые сплавы — бронза и латунь
В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых являются упоминавшиеся выше бронза и латунь. Оба сплава являются общими названиями для целого семейства материалов, куда помимо олова и цинка могут входить никель, висмут и другие металлы. Например, в состав так называемого пушечного металла, который в XVI—XVIII вв. действительно использовался для изготовления артиллерийских орудий, входят все три основных металла — медь, олово, цинк; рецептура менялась от времени и места изготовления орудия. В наше время находит применение в военном деле в кумулятивных боеприпасах благодаря высокой пластичности, большое количество латуни идёт на изготовление оружейных гильз. Медноникелевые сплавы используются для чеканки разменной монеты. Медноникелиевые сплавы, в том числе т. н. «адмиралтейский» сплав широко используются в судостроении и областях применения, связанных с возможностью агрессивного воздействия морской воды из-за образцовой коррозионной устойчивости.
Ювелирные сплавы
В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото очень мягкий металл и нестойко к этим механическим воздействиям.
Соединения меди
Оксиды меди используются для получения оксида иттрия бария меди YBa2Cu3O7-δ, который является основой для получения высокотемпературных сверхпроводников. Медь применяется для производства медно-окисных гальванических элементов, и батарей.
Другие сферы применения
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди из-за автозатухания процесса коррозии медного листа служат безаварийно по 100—150 лет. В России использование медного листа для кровель и фасадов нормируется федеральным Сводом Правил СП 31-116-2006 [4].
Прогнозируемым новым массовым применением меди обещает стать ее применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
Биологическая роль
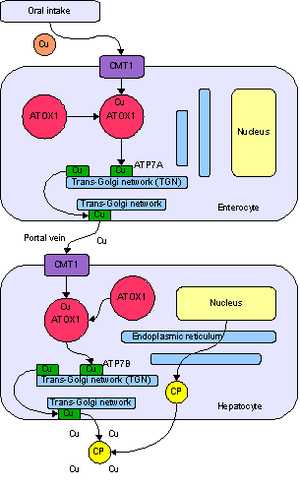
Медь является необходимым элементом для всех высших растений и животных. В токе крови медь переносится главным образом белком церулоплазмином. После усваивания меди кишечником она транспортируется к печени с помощью альбумина. Медь встречается в большом количестве ферментов, например, в цитохром-с-оксидазе, в содержащем медь и цинк ферменте супероксид дисмутазе, и в переносящем кислород белке гемоцианине. В крови большинства моллюсков и членистоногих медь используется вместо железа для транспорта кислорода.
Предполагается, что медь и цинк конкурируют друг с другом в процессе усваивания в пищеварительном тракте, поэтому избыток одного из этих элементов в пище может вызвать недостаток другого элемента. Здоровому взрослому человеку необходимо поступление меди в количестве 0,9 мг в день.
Токсичность
Некоторые соединения меди могут быть токсичны при превышении ПДК в пище и воде. Содержание меди в питьевой воде не должно превышать 2 мг/л (средняя величина за период из 14 суток), однако недостаток меди в питьевой воде также нежелателен. Всемирная Организация Здравоохранения (ВОЗ) сформулировала в 1998 году это правило так: «Риски для здоровья человека от недостатка меди в организме многократно выше, чем риски от ее избытка».
В 2003 году в результате интенсивных исследований ВОЗ пересмотрела прежние оценки токсичности меди. Было признано, что медь не является причиной расстройств пищеварительного тракта [5].
Существовали опасения, что Гепатоцеребральная дистрофия (болезнь Вильсона — Коновалова) сопровождается накоплением меди в организме, так как она не выделяется печенью в желчь. Эта болезнь вызывает повреждение мозга и печени. Однако причинно-следственная связь между возникновением заболевания и приёмом меди внутрь подтверждения не нашла[5]. Установлена лишь повышенная чувствительность лиц, в отношении которых диагностировано это заболевание к повышенному содержанию меди в пище и воде. Общее число лиц, поражённых заболеванием, например, в США, составляет ок. 35 000 человек, то есть 0,01 % от общего числа водопользователей.[источник не указан 226 дней]
Бактерицидность
Бактерицидные свойства меди и ее сплавов были известны человеку давно. В 2008 году после длительных исследований Федеральное Агентство по Охране Окружающей Среды США (US EPA) официально присвоило меди и нескольким сплавам меди статус веществ с бактерицидной поверхностью[6] (агентство подчеркивает, что использование меди в качестве бактерицидного вещества может дополнять, но не должно заменять стандартную практику инфекционного контроля). Особенно выражено бактерицидное действие поверхностей из меди (и ее сплавов) проявляется в отношении метициллин-устойчивого штамма стафилококка золотистого, известного как «супермикроб» MRSA[7]. Летом 2009 была установлена роль меди и сплавов меди в инактивировании вируса гриппа A/h2N1 (т. н. «свиной грипп»)[источник?].
Органолептические свойства
Ионы меди придают излишку меди в воде отчётливый «металлический вкус». У разных людей порог органолептического определения меди в воде составляет приблизительно 2-10 мг/л. Естественная способность к такому определению повышенного содержания меди в воде является природным механизмом защиты от приема внутрь воды с излишним содержанием меди.
Производство, добыча и запасы меди
Мировая добыча меди в 2000 году составляла около 15 млн т., a в 2004 году — около 14 млн т.. Мировые запасы в 2000 году составляли, по оценке экспертов, 954 млн т., из них 687 млн т. подтверждённые запасы, на долю России приходилось 3,2 % общих и 3,1 % подтверждённых мировых запасов. Таким образом, при нынешних темпах потребления запасов меди хватит примерно на 60 лет.
Производство рафинированной меди в России в 2006 году составило 881,2 тыс. тонн, потребление — 591,4 тыс. тонн. Основными производителями меди в России являлись:
Мировое производство меди в 2007 году составляло15,4 млн т, а в 2008 году — 15,7 млн т. Лидерами производства были: Чили (5,560 млн т в 2007 г. и 5,600 млн т в 2008 г.), США (1,170/1,310), Перу (1,190/1,220), Китай (0,946/1,000), Австралия (0,870/0,850), Россия (0,740/0,750), Индонезия (0,797/0,650), Канада (0,589/0,590), Замбия (0,520/0,560), Казахстан (0,407/0,460), Польша (0,452/0,430), Мексика (0,347/0,270).
Разведанные мировые запасы меди на конец 2008 года составляют 1 млрд т, из них подтверждённые — 550 млн т. Причем, оценочно, считается что глобальные мировые запасы на суше составляют 3 млрд т, а глубоководные ресурсы оцениваются в 700 млн т.
Способы добычи
Этот металл встречается в природе в самородном виде чаще, чем золото, серебро и железо. Однажды нашли самородок, который весил 420 т. Наверняка медь была первым металлом, с которым познакомились древние люди. Первые свои орудия делали они из кремниевой и железной руды, из меди, и уже потом научились изготовлять их из бронзы и железа. Сплав меди с оловом (бронзу) получили впервые за 3000 лет до н. э. на Ближнем Востоке. Бронза привлекала людей прочностью и хорошей ковкостью, что делало ее пригодной для изготовления орудий труда и охоты, посуды, украшений. Все эти предметы находят в археологических раскопах. Первоначально медь добывали из малахитовой руды, а не из сульфидной, так как она не требует предварительного обжига. Для этого смесь руды и угля помещали в глиняный сосуд, сосуд ставили в небольшую яму, а смесь поджигали. Выделяющийся угарный газ восстанавливал малахит до свободной меди:
2CO + (CuOH)2CO2 (t°) → 3CO2 + 2Cu + h3O.Добычу меди называют прабабушкой металлургии. Ее добыча и выплавка были налажены еще в Древнем Египте, во времена фараона Рамзеса II (1300—1200 гг. до н. э.). Древние египтяне нагнетали воздух в плавильные печи с помощью мехов, а древесный уголь получали из акации и финиковой пальмы. Они выплавили около 100 т чистой меди. На территории России и сопредельных стран медные рудники появились за два тысячелетия до н. э. Остатки их находят на Урале, в Закавказье, на Украине, в Сибири, на Алтае. В XIII—XIV вв. освоили промышленную выплавку меди. В Москве в XV в. был основан Пушечный двор, где отливали из бронзы орудия разных калибров. О нем напоминает теперешняя Пушечная улица в Москве. Сейчас известно более 170 минералов, содержащих медь, но из них только 14—15 имеют промышленное значение. Это — халькопирит (он же медный колчедан), малахит, встречается и самородная медь. В медных рудах часто в качестве примесей встречаются молибден, никель, свинец, кобальт, реже — золото, серебро. Обычно медные руды обогащаются на фабриках, прежде чем поступают на медеплавильные комбинаты. Богаты медью Казахстан, США, Чили, Канада, африканские страны — Заир, Замбия, Южно-Африканская республика. Очень крупное Удоканское месторождение медной руды сравнительно недавно обнаружено на севере Читинской области.
По объему мирового производства и потребления медь занимает третье место после железа и алюминия.
www.himsnab-spb.ru
Медь - Физические свойства
Химия - Медь - Физические свойства
01 марта 2011Оглавление:1. Медь2. История и происхождение названия3. Нахождение в природе4. Физические свойства5. Применение6. Биологическая роль7. Производство, добыча и запасы меди8. Интересные факты
Медь золотисто-розовый пластичный металл, на воздухе быстро покрывается оксидной плёнкой, которая придаёт ей характерный интенсивный желтовато-красный оттенок. Тонкие плёнки меди на просвет имеют зеленовато-голубой цвет.
Медь образует кубическую гранецентрированную решётку, пространственная группа F m3m, a = 0,36150 нм, Z = 4.
Медь обладает высокой тепло- и электропроводностью. Имеет два стабильных изотопа Cu и Cu, и несколько радиоактивных изотопов. Самый долгоживущий из них, Cu, имеет период полураспада 12,7 ч и два варианта распада с различными продуктами.
Существует ряд сплавов меди: латуни с цинком, бронзы с оловом и другими элементами, мельхиор с никелем, баббиты со свинцом и другие.
Химические свойства
Не изменяется на воздухе в отсутствие влаги и диоксида углерода. Является слабым восстановителем, не реагирует с водой, разбавленной соляной кислотой. Переводится в раствор кислотами-неокислителями или гидратом аммиака в присутствии кислорода, цианидом калия. Окисляется концентрированными серной и азотной кислотами, «царской водкой», кислородом, галогенами, халькогенами, оксидами неметаллов. Реагирует при нагревании с галогеноводородами.
На влажном воздухе медь окисляется, образуя основный карбонат меди:
Реагирует с концентрированной холодной серной кислотой:
С концентрированной горячей серной кислотой:
С безводной серной кислотой при 200 °C:
C разбавленной серной кислотой при нагревании в присутствии кислорода воздуха:
Реагирует с концентрированной азотной кислотой:
С разбавленной азотной кислотой:
С царской водкой:
C разбавленной хлороводородной кислотой в присутствии кислорода:
С газообразным хлороводородом при 500—600 °C:
С бромоводородом:
Также медь реагирует с концентрированной уксусной кислотой в присутствии кислорода:
Медь растворяется в концентрированном гидроксиде аммония, с образованием аммиакатов:
Окисляется до оксида меди при недостатке кислорода и 200 °C и до оксида меди, при избытке кислорода и температурах порядка 400—500 °C:
Медный порошок реагирует с хлором, серой и бромом, при комнатной температуре:
При 300—400 °C реагирует с серой и селеном:
C оксидами неметаллов:
Медь реагирует с цианидом калия с образованием дицианокупрата калия, щелочи и водорода:
С концентрированной соляной кислотой и хлоратом калия:
Соединения
Медный купорос
В соединениях медь бывает двух степеней окисления: менее стабильную степень Cu и намного более стабильную Cu, которая даёт соли синего и сине-зелёного цвета. В необычных условиях можно получить соединения со степенью окисления +3 и даже +5. Последняя встречается в солях купраборанового аниона Cu2, полученных в 1994 году.
Карбонат меди имеет зелёную окраску, что является причиной позеленения элементов зданий, памятников и изделий из меди. Сульфат меди при гидратации даёт синие кристаллы медного купороса CuSO4∙5h3O, используется как фунгицид. Также существует нестабильный сульфат меди Существует два стабильных оксида меди оксид меди Cu2O и оксид меди CuO. Оксиды меди используются для получения оксида иттрия бария меди, который является основой для получения сверхпроводников. Хлорид меди бесцветные кристаллы плотностью 4,11 г/см³. В сухом состоянии устойчив. В присутствии влаги легко окисляется кислородом воздуха, приобретая сине-зелёную окраску. Может быть синтезирован восстановлением хлорида меди сульфитом натрия в водном растворе.
Соединения меди
Многие соединения меди имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди все пять Зd-орбиталей заполнены парами электронов. Однако оксид Cu2O имеет красновато-коричневую окраску. Ионы меди в водном растворе неустойчивы и легко подвергаются диспропорционированию:
2Cu → Cu + Cu
В то же время медь встречается в форме соединений, которые не растворяются в воде, либо в составе комплексов. Например, дихлорокупрат-ион устойчив. Его можно получить, добавляя концентрированную соляную кислоту к хлориду меди:
CuCl + Cl →
Хлорид меди белое нерастворимое твёрдое вещество. Как и другие галогениды меди, он имеет ковалентный характер и более устойчив, чем галогенид меди. Хлорид меди можно получить при сильном нагревании хлорида меди:
2CuCl2 → 2CuCl + Cl2
Ионы меди окрашивают пламя в зелёный цвет
Образует неустойчивый комплекс с CO
CuCl+CO → CuCl разлагающийся при нагревании
Другой способ его получения заключается в кипячении смеси хлорида меди с медью в концентрированной соляной кислоте. В этом случае сначала образуется промежуточное соединение комплексный дихлорокупрат-ион. При выливании раствора, содержащего этот ион, в воду происходит осаждение хлорида меди. Хлорид меди реагирует с концентрированным раствором аммиака, образуя комплекс диамминмеди. Этот комплекс не имеет окраски в отсутствие кислорода, но в результате реакции с кислородом превращается в синее соединение.
Соединения меди
Степень окисления II наиболее стабильная степень окисления меди. Соли меди образуются при растворении меди в кислотах-окислителях. Большинство солей в этой степени окисления имеют синюю или зелёную окраску.
Соединения меди обладают слабыми окислительными свойствами, что используется в анализе.
Соединения меди и меди
Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов.
Аналитическая химия меди
- Традиционно количественное выделение меди из слабокислых растворов проводилось с помощью сероводорода.
- В растворах, при отсутствии мешающих ионов медь может быть определена комплексонометрически или потенциометрически, ионометрически.
- Микроколичества меди в растворах определяют кинетическими методами.
Просмотров: 23593
4108.ru
Оксид меди
Cuprum (Cu) относится к числу малоактивных металлов. Для него характерно образование химических соединений со степенями окисления +1 и +2. Так, например, два окисла, представляющих собой соединение из двух элементов Cu и кислорода O: со степенью окисления +1 — закись меди Cu2O и степенью окисления +2 — окись меди CuO. Несмотря на то, что состоят они из одинаковых химических элементов, но каждый из них имеет свои особые характеристики. На холоде металл очень слабо взаимодействует с кислородом воздуха, покрываясь пленкой, представляющей собой оксид меди, который препятствует дельнейшему окислению cuprum. При нагревании это простое вещество с порядковым номером 29 в таблице Менделеева полностью окисляется. При этом образуется также оксид меди (II): 2Cu + O2 → 2CuO.
Закись представляет собой коричневато-красное твердое вещество с молярной массой 143,1 г/моль. Соединение имеет температуру плавления 1235°С, температуру кипения 1800°С. Оно не растворяется в воде, но растворяется в кислотах. Разводится оксид меди (I) в растворе аммиака (концентрированном), при этом образуется бесцветный комплекс [Cu (Nh4)2]+, который легко окисляется на воздухе до аммиачного комплекса сине-фиолетового цвета [Cu (Nh4)4(h3O)2]2+, растворяющегося в соляной кислоте с образованием CuCl2. В истории полупроводниковой физики Cu2O является одним из наиболее изученных материалов.
Оксид меди (I), известный также как гемиоксид, обладает основными свойствами. Он может быть получен окислением металла: 4Cu + O2 → 2 Cu2O. Примеси, такие как вода и кислоты, влияют на скорость этого процесса, а также дальнейшее окисление до двухвалентного оксида. Закись меди может растворяться в серной кислоте, при этом образуется чистый металл и соль: h3SO4 + Cu2O → Cu + CuSO4 + h3O. По аналогичной схеме происходит взаимодействие окисла со степенью окисления металла +1 с другими кислородосодержащими кислотами. При взаимодействии гемиоксида с галогенсодержащими кислотами образуются соли одновалентного металла: 2HCl + Cu2O → 2CuCl + h3O.
Встречается оксид меди (I) в природе в виде красной руды (это устаревшее название, наряду с таким как рубиновая Cu), называемой минералом «Куприт». На его образование требуется длительное время. Он может быть получен искусственно при высоких температурах или под высоким давлением кислорода. Гемиоксид обычно используется как фунгицид, как пигмент, как противообрастающее средство в подводной или морской краске, и применяется также в качестве катализатора.
Однако воздействие этого вещества с химической формулой Cu2O на организм может быть опасным. При вдыхании вызывает одышку, кашель, а также изъязвление и перфорацию дыхательных путей. При попадании внутрь раздражает желудочно-кишечный тракт, что сопровождается рвотой, болью и диареей.
Высший оксид меди по внешнему виду представляет собой порошок от коричневого до черного цвета. В природе в чистом виде встречается как минерал «Тенорит». Температура его плавления 1326°С, температура кипения 2000°С. Он нерастворим в воде, спирте, гидроксиде аммония, растворе карбоната аммония. Растворим в водных растворах хлорида аммония и цианистого калия. Это черное твердое вещество может быть получено при нагревании Cu на воздухе. Однако в данном случае образуется также закись Cu. Получение оксида меди CuO возможно при нагревании соединений:
меди (II) нитрата 2Cu(NO3)2 → 4 NO2+ O2 + 2CuO;
меди (II) гидроксида Cu(OH)2 → h3O + CuO;
меди (II) карбоната CuCO3 → CO2 + CuO.
Cuprum (II) оксид является основным, поэтому он растворяется в минеральных кислотах (соляной, серной и азотной) с получением соответствующей соли двухвалентной Cu:
2HCl + CuO → CuCl2 + h3O;
h3SO4 + CuO → CuSO4 + h3O;
2HNO3 + CuO → Cu(NO3)2 + h3O.
Реагирует оксид меди (II) с концентрированной щелочью с образованием соли: 2 KOH + CuO + h3O → K2[Cu (OH)4].
Окисел также может быть восстановлен до металлической Cu при взаимодействии с водородом или окисью углерода:
h3 + CuO → Cu + h3O;
CO + CuO → Cu + CO2.
Используется оксид меди (II) в керамике (как пигмент) для получения глазури (синей, зеленой и красной, а иногда и розовой, серой или черной). Он также применяется в качестве пищевой добавки у животных с целью уменьшения дефицита cuprum в организме. Это абразивный материал, который необходим для полировки оптического оборудования. Он используется для производства сухих батарей, для получения других солей Cu. Соединение CuO также применяется при сварке медных сплавов.
Воздействие химического соединения CuO также может быть опасным для организма человека. При вдыхании вызывает раздражение легких. Оксид меди (II) может вызвать лихорадку металлических паров (MFF). Окись Cu провоцирует изменение цвета кожи, могут появиться проблемы со зрением. При попадании в организм, как и гемиоксид, приводит к отравлению, которое сопровождается симптомами в виде рвоты и болевых ощущений.
fb.ru
это тело или вещество? Свойства меди
Приблизительно III тысячелетие до нашей эры считается переходным от камня как основного промышленного вещества к бронзе. Период перестройки принято считать медным веком. Ведь именно это соединение на тот период времени было самым главным в строительстве, в изготовлении предметов быта, посуды и прочих процессах.
На сегодняшний день медь своей актуальности не потеряла и по-прежнему считается очень важным металлом, часто используемым в разных нуждах. Медь - это тело или вещество? Какими свойствами она обладает и для чего нужна? Попробуем разобраться далее.

Общая характеристика элемента медь
Как химический элемент, медь имеет свое местоположение в периодической системе. Оно следующее.
- Четвертый большой период, первый ряд.
- Первая группа, побочная подгруппа.
- Порядковый номер 29.
- Атомный вес - 63,546.
- Электронная конфигурация внешнего слоя выражается формулой 3d104s1.
Элемент имеет два стабильных природных изотопа с массовыми числами 63 и 65. Латинское название элемента cuprum, что объясняет его химический символ Cu. В формулах читается как "купрум", русское наименование - медь.
Медь - это тело или вещество?
Чтобы ответить на данный вопрос, следует для начала определиться с понятиями "вещество" и "тело". Они изучаются еще на школьных ступенях, так как являются основополагающими. С точки зрения науки химии и физики, веществом считаются все материалы, из которых изготавливаются те или иные предметы. То есть примерами веществ могут служить все химические соединения как органической, так и неорганической природы.
Тело - это сам предмет, который состоит как раз из какого-то вещества. Они могут быть искусственно сконструированы человеком, либо же иметь природное происхождение. Примеры тел: гвозди, окна, пластинки, стол, шкаф, цветочный горшок и прочее.
Чтобы различить эти два понятия, приведем несколько сравнительных примеров.
- Сахар - вещество, леденец на палочке - тело.
- Железо - вещество, гвоздь - тело.
- Окно - тело, стекло - вещество.
Очевидно из этих рассуждений, что на вопрос: "Медь - это тело или вещество?" - ответ однозначен. Это вещество. Вот если речь пойдет о медной пластинке или медном колечке, тогда, безусловно, следует говорить о них как о теле.
С точки зрения химии, медь - это вещество, относящееся к категории металлов. Оно обладает рядом очень ценных свойств, которые лежат в основе широкого использования данного соединения.

Простое вещество медь - это цветной металл
Как мы уже обозначили, медь - металл. Однако не все представители этой группы веществ одинаковы по своим характеристикам. Существуют мягкие и твердые, белые и желтые, красные металлы и прочее. Медь же относится к цветным мягким металлам.
Электронное строение ее атома позволяет точно определить, медь - это металл или неметалл. Ведь на внешнем уровне у нее всего один электрон, это значит, что его она способна легко отдавать, проявляя типичные металлические восстановительные свойства. Следовательно, в том, что она должна относиться к категории именно металлов, сомнений быть не может. Об этом же говорят и физические свойства ее простого вещества.
Физические свойства
Медь - это вещество или тело? Полностью убедиться в правильности ответа можно лишь рассмотрев ее физические свойства. Если мы говорим о данном элементе как о простом веществе, то для него характерен следующий набор свойств.
- Металл красного цвета.
- Мягкий и очень ковкий.
- Отличный теплопроводник и электропроводник.
- Не тугоплавкий, температура плавления составляет 1084,5 0С.
- Плотность составляет 8,9 г/см3.
- В природе встречается в основном в самородном виде.
Таким образом, получается, что медь - это вещество, причем известное с самой древности. На основе нее издревле создаются многие архитектурные сооружения, изготовляется посуда и предметы быта.

Химические свойства
С точки зрения химической активности, медь - это тело или вещество, обладающее низкой способностью к взаимодействию. Существует две основные степени окисления этого элемента, которые он проявляет в соединениях. Это:
Очень редко можно встретить вещества, в которых данные значения заменяются на +3.
Итак, медь может взаимодействовать с:
- воздухом;
- углекислым газом;
- соляной кислотой и некоторыми другими соединениями только при очень высоких температурах.
Все это объясняется тем, что на поверхности металла формируется защитная оксидная пленка. Именно она предохраняет его от дальнейшего окисления и придает стабильность и малоактивность.
Из простых веществ медь способна взаимодействовать с:
- галогенами;
- селеном;
- цианидами;
- серой.
Часто формирует комплексные соединения либо двойные соли. Практически все сложные соединения данного элемента, кроме оксидов - ядовитые вещества. Те молекулы, которые образует одновалентная медь, легко окисляются до двувалентных представителей.

Области применения
Медь - это смесь или чистое вещество, которое в любом из этих состояний находит широкое применение в промышленности и быту. Можно обозначить несколько основных отраслей использования соединений меди и чистого металла.
- Кожевенная промышленность, в которой используются некоторые соли.
- Производство меха и шелка.
- Изготовление удобрений, средств защиты растений от вредителей (медный купорос).
- Сплавы меди находят широкое применение в автомобилестроении.
- Судостроение, авиаконструкции.
- Электротехника, в которой медь используется, благодаря хорошей антикоррозионной устойчивости и высокой электро- и теплопроводности.
- Различное приборостроение.
- Изготовление посуды и бытовых предметов хозяйственного значения.
Очевидно, что несмотря на долгие сотни лет, рассматриваемый металл только укрепил свои позиции и доказал состоятельность и незаменимость в применении.

Сплавы меди и их свойства
Существует много сплавов на основе меди. Она сама отличается высокими техническими характеристиками, так как легко поддается ковке и прокатке, является легкой и достаточно прочной. Однако при добавлении определенных компонентов свойства значительно улучшаются.
В данном случае следует задать вопрос: "Медь - это вещество или физическое тело, когда речь идет о ее сплавах?" Ответ будет такой: это вещество. Все равно она является именно им до тех пор, пока из сплава не будет изготовлено какое-либо физическое тело, то есть определенный продукт.
Какие сплавы меди бывают?
- Практически равное сочетание меди и цинка в одном составе принято называть латунью. Этот сплав отличается высокой прочностью и устойчивостью к химическим воздействиям.
- Оловянистая бронза - сочетание меди и олова.
- Мельхиор - никель и медь в соотношении 20/80 из 100. Используется для изготовления украшений.
- Константан - сочетание никеля, меди и добавка марганца.

Биологическое значение
Не столь важно, медь - это вещество или тело. Значимо другое. Какую роль играет медь в жизни живых организмов? Оказывается, весьма немаловажную. Так, ионы рассматриваемого металла выполняют следующие функции.
- Участвуют в преобразовании ионов железа в гемоглобин.
- Являются активными участниками процессов роста и размножения.
- Позволяют усваиваться аминокислоте тирозину, следовательно влияют на проявление цвета волос, кожи.
Если организм недополучает данный элемент в нужном количестве, то могут возникать неприятные заболевания. Например, анемия, облысение, болезненная худоба и прочее.
fb.ru