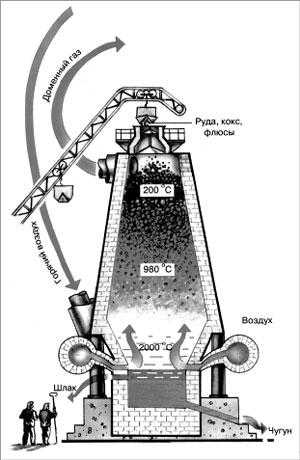
Аномалия Тауссиг-Бинг: диагностика, особенности, лечение, последствия. Клапан наездник
Аномалия Тауссиг-Бинг: диагностика, особенности, лечение, последствия
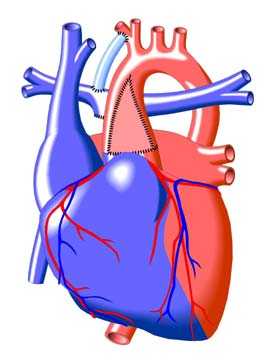
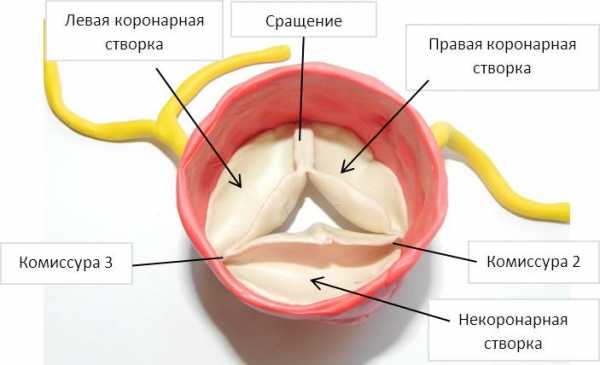
Термин «аномалия Taussig-Bing» применяют в двух разных значениях, которые нельзя смешивать. Если его применяют в физиологическом смысле, имеют в виду широкое обозначение любой формы ДВПЖ, которая гемодинамически соответствует транспозиции, а именно когда насыщение в легочной артерии выше, чем в аорте, из-за преимущественного поступления крови из левого желудочка в легочную артерию. Если в это название вкладывают анатомический смысл, то имеют в виду конкретный порок, описанный Taussig и Bing в 1949 г. Van Praagh уточнил анатомическое определение этого порока в 1968 г. Подаортальный и подлегочный конусы отделяют аортальный и легочный клапаны от AV-клапанов. Полулунные клапаны лежат «бок о бок» на одном уровне. Имеется большой подлегочный ДВПЖ, расположенный выше септальной ножки и мышечной межжелудочковой перегородки. Дефект межжелудочковой перегородки, будучи подлегочным, не сливается с легочным клапаном и отделен от него свободной стенкой подлегочного конуса. Это истинный ДВПЖ, при котором аорта отходит полностью от правого желудочка, в то время как легочный клапан нависает над межжелудочковой перегородкой, но не над полостью левого желудочка. При этом пороке выводной тракт из правого желудочка в аорту часто сужен. Порок нередко сопровождается коарктацией аорты, митральным клапаном-наездником. Встречается расщепление митрального клапана, но не как часть АВСД. Возможна недостаточность клапана. Он может стать причиной обструкции выводного тракта и компрометировать ДМЖП. Бивентрикулярная коррекция в этих анатомических условиях опасна.
Сопутствующие аномалии
Типичными сопутствующими аномалиями являются стеноз или АЛА, которые отмечаются у половины больных при всех, включая подлегочную, локализациях ДМЖП. Достаточно часты пороки аорты — клапанный и субаортальный стеноз, коарктация и перерыв дуги. Коарктация и гипоплазия аорты и другие формы обструкции выводного тракта левого желудочка чаще встречаются при аномалии Taussig-Bing. В частности, сужение выводного тракта аорты специфично для подлегочного ДМЖП. Выводной тракт как бы вклинен между вентрикулоинфундибулярной складкой с латеральной стороны и медиально выдающейся внутрь желудочка инфундибулярной перегородкой.
Сопутствущие пороки AV-клапанов представлены АВСД, стенозом или атрезией клапанов, расщеплением передней створки митрального клапана, клапанами-наездниками, нависающими клапанами, перекрестным AV-соединением.
Иногда встречаются варианты порока с дискордантным, одножелудочковым AV-соединением, с атрезией AV-клапана, с предсердным изомеризмом. Кроме того, отхождению магистральных сосудов от правого желудочка сопутствуют многие другие пороки сердца — ОАП, гипоплазия желудочков, аномалии системного венозного возврата, юкстапозиция предсердных ушек, situs inversus totalis, декстрокардия, дефект ДМПП, коронарный синус, открывающийся в левое предсердие.
В Национальном институте сердечно-сосудистой хирургии им. Н.М. Амосова АМН Украины с 1991 по 2004 гг. прооперированы 352 пациента с ДВПЖ.
Рестриктивный ДМЖП, потребовавший резекции части перегородки, встречался при всех типах ДВПЖ с разной частотой:
-
при тетрадном типе — 26%;
-
при изолированном ДМЖП — 33,3%;
-
при ТМА — 50%;
-
при удаленном ДМЖП — 79,2%.
Хордальный аппарат перегородочной створки трехстворчатого клапана, прикрепляющийся к краю ДМЖП и потребовавший его отсечения и последующей реимплантации, встретился у 5,1% больных.
Гемодинамика и клиника
Гемодинамика и клиника зависят от расположения дефекта, наличия или отсутствия легочного стеноза и сопутствующих аномалий.
При подаортальном ДМЖП без СЛА оксигенированная кровь поступает прямо из левого желудочка в аорту, а венозная — в легочную артерию, поэтому цианоз отсутствует или слабо выражен. При отсутствии ОБЛС легочный кровоток усилен, давление в легочной артерии равно системному, имеются признаки застойной сердечной недостаточности. Клиническая картина аналогична таковой при изолированном большом ДМЖП. Характерны отставание в развитии, одышка, усиленный верхушечный толчок, усиленный II тон, систолический шум, иногда на верхушке — убывающий диастолический шум.
ЭКГ-признаки часто соответствуют АВСД. Угол a QRS — от 300 до 1700, гипертрофия правого или обоих желудочков, а также левого предсердия, иногда АV-блокада I степени.
Рентгенограмма: кардиомегалия, выступает дуга легочного ствола, усилен легочный рисунок.
Несмотря на подаортальное расположение ДМЖП, при СЛА часть венозной крови поступает в аорту. Это приводит к цианозу и снижению объема легочного кровотока. Клиническая картина напоминает тетраду Фалло: задержка развития, цианоз, пальцы в виде барабанных палочек, усиленный II тон не расщеплен, систолический шум у верхнего левого края грудины.
ЭКГ: отклонение оси вправо, гипертрофия правого предсердия и правого желудочка, блокада правой ножки пучка Гиса.
Рентгенограмма: нормальные размеры сердечной тени с приподнятой верхушкой. Легочный рисунок ослаблен.
Отличительной особенностью является слабый цианоз с признаками усиленного легочного кровотока.
Эхокардиограмма у новорожденного и младенца почти всегда позволяет поставить диагноз с учетом всех интересующих хирурга подробностей. Она должна констатировать 3 признака отхождения магистральных сосудов от правого желудочка:
-
отхождение обоих магистральных сосудов от правого желудочка;
-
наличие единственного выхода из левого желудочка через ДМЖП;
-
отсутствие или наличие митрально-аортального контакта.
Одновременно выясняются все анатомические подробности, необходимые для принятия хирургических решений: взаимная ориентация, относительные размеры магистральных сосудов, диаметр и локализация дефекта, наличие СЛА, его выраженность и характер — динамический или фиксированный. Должны быть оценены расстояние между легочным и трехстворчатым клапанами, степень развития конусной перегородки, наличие прикрепления к ней хорд, анатомия коронарных артерий, наличие сопутствующих аномалий.
Ангиокардиография
Катетеризация и ангиокардиография могут понадобиться только у более старших детей для исключения ОБЛС и у пациентов с транспозиционным типом ДВПЖ для выполнения предоперационной баллонной атриосептостомии в целях улучшения смешивания крови и, следовательно, для повышения артериальной оксигенации и стабилизации состояния ребенка. Ангиокардиография еще не утратила своего значения для диагностики самого порока и деталей его анатомии. Классификация ангиокардиографических признаков построена на основе взаимного положения магистральных артерий и расположения ДМЖП.
Сосуды расположены «бок о бок», аорта — справа от легочной артерии, полулунные клапаны — на одном горизонтальном уровне. Во фронтальной плоскости хорошо видны подаортальный и подлегочный конусы, разделенные инфундибулярной перегородкой. Оба конуса отделяют полулунные клапаны от атриовентрикулярных, что также видно в боковой проекции. В боковой проекции определяется ДМЖП ниже аортального конуса.
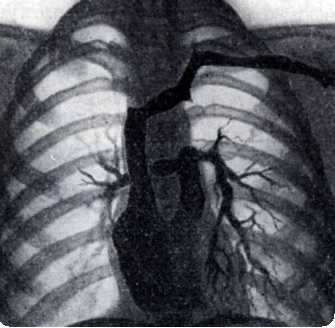
На ангиокардиограмме во фронтальной плоскости при введении контрастного вещества в правый желудочек видно, что сосуды расположены «бок о бок». Хорошо развиты билатеральные конусы. Внедрение в правый желудочек конусной перегородки обычно выражено меньше, чем при подаортальном дефекте. В ранней фазе правожелудочковой ангиокардиограммы обнаруживается высокий ДМЖП, непосредственно связанный с легочным клапаном. Между ДМЖП и легочным клапаном отсутствует конус.
Обоюдосвязанный ДМЖП ангиокардиографически трудно отличить от подлегочного дефекта. Классическими признаками при АВСД являются деформация выводного тракта левого желудочка, вызванная аномальным прикреплением левого АV-клапана, и дефицит межжелудочковой перегородки.
Переднезаднее расположение магистральных сосудов при ДВПЖ хорошо определяется в боковой проекции. Виден билатеральный конус. При мальпозиции магистральных артерий часто обнаруживается клапанный и подклапанный стеноз легочной артерии. В боковой проекции левожелудочковой ангиокардиограммы можно легко определить подлегочный ДМЖП.
Естественное течение
Вследствие морфологической гетерогенности течение различных подтипов ДВПЖ неодинаково. Наиболее показательные данные представили две группы исследователей. Hornberger и соавторы сообщили об исходах у 62 плодов, у которых до родов диагностирован ДВПЖ. Прерывание беременности имело место в 34 случаях, в 2 случаях наступила внутриутробная смерть, 5 детей умерли в неонатальном периоде и 4 — до года жизни. Семнадцать выживших детей составляют 27,4% полной эмбриональной когорты. Samanek и Voriskova сообщили о судьбе 69 детей, родившихся с ДВПЖ. Более 13% из них умерли в течение недели после рождения. В течение первого месяца жизни кривая выживаемости стабилизировалась на 78,6%. Снижение выживаемости продолжалось до 3-летнего возраста, и в среднем она составила 47,8%. Между 3-м и 5-м годами жизни кривая снизилась только на 2,9% и между 5-м и 10-м годами — на 1,5%. Выживаемость осталась на уровне 43,4%.

Большой неожиданностью для кардиологов стала находка у женщины в возрасте 65 лет ДВПЖ с незащищенным сосудистым ложем.
Естественное течение у больных без легочного стеноза может сопровождаться застойной сердечной недостаточностью с развивающейся впоследствии ОБЛС. У больных с аномалией Taussig-Bing тяжелая ОБЛС развивается в раннем возрасте. Сопутствующие аномалии ухудшают прогноз. В казуистических случаях происходит фетальное спонтанное закрытие ДМЖП.
При наличии СЛА отмечаются осложнения, характерные для всех цианотических ВПС.
Лечение
Медикаментозное
При застойной сердечной недостаточности дополнительно назначают дигоксин и диуретики, по показаниям проводят профилактику бактериального эндокардита.
Хирургическое
В передовых западных кардиохирургических центрах сложилось твердое убеждение в том, что полную коррекцию порока целесообразно выполнять в неонатальном периоде, даже в случаях, когда необходимо применить кондуит, требующий замены уже в ближайшие после операции годы. Несмотря на то, что системно-легочный анастомоз является разумной альтернативой, он не уменьшает количества вмешательств, которые предстоит перенести пациенту, и удлиняет период патологической физиологии, который может повлиять на качество окончательного результата.
Паллиативные операции
В настоящее время суживание легочной артерии у больных с застойной сердечной недостаточностью выполняется редко и главным образом при наличии удаленного от сосудов ДМЖП. Эта процедура является единственным паллиативным вмешательством при ДВПЖ с подаортальным дефектом без СЛА. Показания к ней должны быть обоснованными, прежде всего из-за высокой летальности, которая достигает 16%, и необходимости второй, радикальной коррекции порока. Надо отметить, что при ДВПЖ типа ТМА суживание легочной артерии является фактором риска при последующей операции артериального переключения. Более того, эта операция не гарантирует значительного улучшения состояния пациента и может осложниться развитием инфундибулярного и легочного стенозов, субаортального стеноза и миграцией тесьмы к бифуркации легочной артерии. Однако при хронической сердечной недостаточности на фоне высокой легочной гипертензии или таких сопутствующих пороков, как множественные ДМЖП, АV-клапаны-наездники и коарктация аорты, может быть выбрано этапное лечение.
Суживание легочной артерии выполняют через левую переднебоковую торакотомию или через трансстернальный доступ. После вскрытия перикарда выделяют ствол легочной артерии. Тесьму предварительно размечают согласно формуле Trusler: длина ее равна 20 мм + количество миллиметров, численно равное массе тела, при неосложненных вариантах, и 24 + количество миллиметров, численно равное массе тела — при осложненных. Тесьма должна иметь ширину 3-4 мм, ее проводят вокруг средней части ствола легочной артерии и сшивают по предварительно нанесенным меткам. Давление периферийнее тесьмы должно составлять менее 50% системного давления, а насыщение крови кислородом по показаниям пульсоксиметра не должно быть ниже 80-85%. Если эти параметры не достигнуты, тесьму ослабляют или суживают до получения необходимых показателей.

Для больных с подаортальными и обоюдосвязанными ДМЖП лучшим выбором считается первичная полная коррекция порока.
При аномалии Taussig-Bing паллиативная помощь пациентам заключается в суживании легочной артерии и расширении межпредсердного сообщения для улучшения смешивания венозной и артериальной крови и для декомпрессии левых отделов сердца. Во время последующей радикальной операции межпредсердное сообщение позволяет использовать одну венозную канюлю в правом предсердии, через которую дренируются левые отделы сердца. Благодаря этому обеспечивается сухое операционное поле, если вмешательство выполняется в условиях постоянной гипотермической перфузии с низким объемом кровотока. В зависимости от ситуации производят баллонную или ножевую септостомию или операцию Hanlon-Blalock.
Больные с выраженным цианозом, обусловленном СЛА, нуждаются в системно-легочном анастомозе.
Полная коррекция
В связи с выраженным полиморфизмом данного порока применяются различные виды хирургических вмешательств. Залогом их успеха является точная дооперационная оценка анатомического варианта и расчетливый выбор типа операции. При принятии тактических решений целесообразно воспользоваться хирургической классификацией порока, отражающей сложность хирургической задачи. Полная коррекция показана:
-
пациентам с неосложненными пороками — атриовентрикулярной конкордантностью, единственным ДМЖП, сбалансированными желудочками, без наличия AV-клапана-наездника, без аномалий легочного ствола и центральных ветвей;
-
больным с подлегочным стенозом;
-
пациентам, имеющим сложные дополнительные аномалии — клапан-наездник, АВСБ, гипоплазию клапана или желудочка, предсердный изомеризм, множественные ДМЖП, АЛА, петлю легочной артерии, несливающиеся легочные артерии, аномальный дренаж системных или легочных вен.
В настоящее время применяются 4 типа хирургических вмешательств:
1. Формирование внутрижелудочкового туннеля, соединяющего левый желудочек с аортой. При рестриктивном ДМЖП или с целью улучшения геометрии туннеля выполняют частичную резекцию конусной перегородки. Внутрижелудочковый туннель является своеобразным ресивером или демпфирующей камерой, которая может создавать эффект, аналогичный аневризме левого желудочка. Поэтому при ДВПЖ, на наш взгляд, объем левого желудочка должен приближаться к требованию, высказанному Kirklin, т. е. он должен быть равным или больше 30 мл/м2. В противоположность ДВПЖ, успешная коррекция тетрады Фалло у детей первого года жизни может быть выполнена при объеме левого желудочка 18—20 мл/м2.
2. Использование клапанных или бесклапанных кондуитов или альтернативной кондуитам операции Lecompte.
3. Операция артериального переключения с отведением с помощью заплаты легочного ствола в левый желудочек.
4. Один из вариантов операции Fontan. Дополнительным вмешательством является операция Damus-Kaye-Stansel, которая применяется при гипоплазии корня аорты, субаортальном стенозе и аномальном прохождении коронарных артерий.
Коррекция при этом типе ДВПЖ впервые опубликована Kirklin и соавторами в 1957 г. Сейчас первичную полную коррекцию порока выполняют в раннем возрасте, в пределах 6 мес. жизни. Она состоит в создании внутрижелудочкового туннеля между ДМЖП и субаортальным выводным трактом с помощью дакроновой или перикардиальной заплаты, обработанной глютаральдегидом.
При субаортальном ДМЖП летальность составляет около 5%, при обоюдосвязанном ДМЖП она выше.
Впервые коррекция этого порока была выполнена в 1962 г.. Хирургическое лечение следует проводить в ранние сроки из-за быстрого развития необратимых изменений в легочных сосудах. Гемодинамические нарушения соответствуют таковым при ТМА, поэтому принципы коррекции схожи. В основе их лежит переключение потоков артериальной и венозной крови на артериальном или предсердном уровнях.
Гемодинамическая коррекция на предсердном уровне стала возможной с 1963 г., когда была внедрена операция Mustard, предусматривающая предсердную инверсию и отведение легочной артерии через ДМЖП в левый желудочек с помощью заплаты.
В настоящее время эта операция не применяется из-за высокой госпитальной летальности и осложнений в отдаленном периоде: серьезных нарушений ритма, недостаточности трехстворчатого клапана, обструкции системного или легочного венозного возврата, функциональной недостаточность системного желудочка со снижением переносимости физических нагрузок.
-
Операция Damus-Kaye-Stansel, туннель между ДМЖП и устьем легочной артерии, кондуит между правым желудочком и легочной артерией.
Отведение легочной артерии в левый желудочек через ДМЖП, соединение пересеченной легочной артерии с аортой и имплантация клапанного экстракардиального кондуита между правым желудочком и дистальной легочной артерией, предложены для коррекции сложной формы ТМА, впервые применены для коррекции ДВПЖ с подлегочным ДМЖП в 1982 г..
Эта операция создает вентрикулоартериальную конкордантность без необходимости перемещения коронарних артерий и в прошлом рассматривалась, как возможность избежать последствий сопутствующего субаортального стеноза. Причиной обструкции системного выводного тракта является смещение инфундибулярной перегородки вправо и кверху. Недостаток этой операции заключается в имплантации кондуита, вероятности тромбоза корня аорты и возникновении недостаточности аортального клапана. В настоящее время эта операция не применяется при лечении аномалии Taussig-Bing и вытеснена операциями артериального переключения или внутрижелудочковой инверсией. Несмотря на то, что артериальное переключение стало операцией выбора при коррекции аномалии Taussig-Bing, операция Damus-Kaye-Stancel используется как резервный вариант в случаях, когда отсутствует возможность трансплантации коронарных артерий при таких анатомических факторах, как отхождение огибающей артерии от правой коронарной артерии, или при раннем ветвлении левой главной коронарной артерии, которое ограничивает мобильность левого коронарного устья.
Наиболее привлекательным методом лечения ДВПЖ с подлегочным дефектом является полная внутрижелудочковая коррекция без артериального переключения и использования экстракардиального кондуита. Известно 4 типа таких операций:
1. Задний тубулярный кондуит по Abe.
2. Передний тубулярный кондуит по Doty.
3. Передний спиралевидный туннель по Patrick и McGoon.
4. Задний прямой туннель по Kawashima.
Обе методики предусматривают создание внутрижелудочкового целиком или частично тубулярного кондуита, соединяющего ДМЖП с аортой. Abe предлагал помещать его позади легочной артерии, когда магистральные сосуды располагаются «бок о бок». Для переднезадней ориентации крупных сосудов Doty предложил конструкцию пути из желудочка прямо кпереди вдоль перегородки к свободной стенке правого желудочка. Затем тубулярный кондуит поворачивают резко вправо и кпереди от легочной артерии и пришивают к субаортальному конусу. Линия шва проходит в передней стенке правого желудочка и служит заплатой в выводном тракте правого желудочка. Таким образом, бесклапанный внутрижелудочковый кондуит функционирует с нативным аортальным клапаном. Обеим операциям присущи одинаковые недостатки: отсутствие роста, формирование псевдоинтимы и, следовательно, развитие субаортального стеноза. По этой причине данные операции не применяются.
Для коррекции ДВПЖ с подлегочным стенозом предложены два метода конструирования внутрижелудочкового туннеля между ДМЖП и аортой: операция Patrick-McGoon и операция Kawashima. Создание туннеля между ДМЖП и аортой представляется хорошей альтернативой операции переключения, однако зачастую является технически невыполнимой.
Операция Kawashima производится при расположении магистральных сосудов «бок о бок», когда расстояние между трехстворчатым и легочным клапанами достаточно для формирования свободного внутрижелудочкового туннеля. Операцию выполняют доступом через трехстворчатый клапан или поперечную вентрикулотомию. Туннель, соединяющий левый желудочек с аортой, проходит позади легочной артерии между легочным и трехстворчатым клапанами. Конусная перегородка должна быть резецирована для обеспечения свободного выводного тракта.
ДМЖП расширяют, только если он небольшой. Для больных с косой или переднезадней ориентацией магистральных сосудов операция Kawashima непригодна из-за близости легочного и трехстворчатого клапанов. В этих случаях показана операция Patrick-McGoon или артериальное переключение.
При аномальном прикреплении хордального аппарата трехстворчатого клапана к конусной перегородке и при наличии нависающего или «верхом сидящего» митрального клапана выполнение этого типа операции невозможно. Операцию рекомендуют выполнять в раннем младенческом возрасте как первичное вмешательство.
Если трехстворчатый и легочный клапаны расположены слишком близко, заплата должна быть размещена вокруг передневерхнего края легочного клапана.
Техника Patrick-McGoon была разработана для коррекции порока с косой или переднезадней ориентацией магистральных сосудов. Она предусматривает формирование длинного и геометрически сложного внутрижелудочкового туннеля, который проходит слева и спереди клапана легочной артерии, соединяя ДМЖП с аортой. Поскольку туннель проходит впереди легочной артерии, формирование его не зависит от расстояния между легочным и трехстворчатым клапанами. При этой методике часто требуется расширение ДМЖП, даже когда он нерестриктивный. Хирургическая летальность — около 15%.
Операция Patrick-McGoon впоследствии была заменена на артериальное переключение.
Артериальное переключение с одновременным созданием внутрижелудочкового туннеля между ДМЖП и легочной артерией является предпочтительной операцией. Ее выбирают в случаях, когда отсутствует обструкция выходного тракта правого желудочка и когда левый желудочек технически проще соединить с легочной артерий, чем с аортой. Операция должна быть выполнена в течение первого месяца жизни. Эталонный уровень летальности ниже 10%.
При удаленном ДМЖП у большинства больных технически возможно внутрижелудочковое туннелирование, за исключением случаев предсердного изомеризма, сочетающегося с выраженным в разной степени желудочковым дисбалансом. В этих ситуациях показана операция Fontan. Анатомическую коррекцию этого варианта порока впервые выполнил Kirklin в 1977 г. Несмотря на удобное для туннелирования расположение дефекта, летальность в недалеком прошлом достигала 50%. Сравнительно большую группу — 23 пациента — представили Belli и соавторы, которыми была произведена двухжелудочковая коррекция:
-
у 21 пациента выполнено туннелирование;
-
у 2 — операция артериального переключения с отведением легочной артерии в левый желудочек.
В половине случаев понадобилось расширение дефекта кпереди. У 2 пациентов с рестриктивным приточным ДМЖП и аномальным прикреплением хорд трехстворчатого клапана, препятствующим формированию субаортального тракта, пришлось отказаться от двухжелудочковой коррекции. Двое больных умерли на госпитальном этапе. Восемь пациентов подвергнуты 9 повторным операциям, 6 из них — по поводу субаортального стеноза. Примерно такие же результаты с применением артериального переключения и внутрижелудочковым туннелированием у 10 пациентов с одним летальным исходом представили Lacour-Gayet и соавторы. Barbero-Marcial и соавторы предложили использование нескольких заплат для коррекции ДВПЖ с удаленным ДМЖП. Эта техника облегчает операцию, делая ее реальной, когда коррекция с помощью одной заплаты представляется невозможной.
Одним из наиболее сложных вариантов удаленного дефекта является полная форма AВСД. Некоторым больным из этой подгруппы может быть выполнена двухжелудочковая коррекция, другим — одножелудочковая паллиативная гемодинамическая операция по Fontan. Wilkinson в 2002 г. представил результаты хирургических вмешательств у 23 пациентов, перенесших различные радикальные и паллиативные операции, с одним летальным исходом. Tchervenkov считает условием, облегчающим создание тракта оттока левого желудочка, резекцию перегородки и увеличение дефекта кпереди, назвав его «транслокацией дефекта межжелудочковой перегородки». При сопутствующем сужении легочного выводного пути использовался кондуит.
Сопутствующий клапан-наездник, крисс-кросс сердце и гипоплазия одного из желудочков практически исключают возможность выполнения двухжелудочковой коррекции. Для лечения сложных анатомических комплексов применяется гемодинамическая коррекция по Fontan. В последние годы непосредственные и среднесрочные результаты этого типа операций значительно улучшились благодаря внедрению этапного лечения и фенестрации внутрипредсердного туннеля.
doctoroff.ru
Единственный желудочек сердца: анатомия, морфология, диагностика, лечение
Это название объединяет целую группу аномалий сердца, для которых характерно соединение правого и левого предсердий через оба или общий АV-клапан с общим или единственным желудочком. Не смотря на то, что со времени первого выявления сердца с одножелудочковой камерой прошло около двухсот лет, до сих пор ведется дискуссия по вопросам классификации и терминологии, употребляемой для описания этих сложных врожденных аномалий сердца.
Для обозначения данной патологии применяются разные названия, но термин «единственный желудочек сердца» является наиболее удачным, так как он менее громоздкий и не включает в себя вторичных, несущественных компонентов порока.

Классификация и терминология
Первая классификация врожденных аномалий с ЕЖС была разработана Van Praagh, Ongley, Swan. Авторы описывают их под названиями «единственный» или «общий» желудочек. Главным критерием, определяющим наличие ЕЖС, они считают открытие трехстворчатого и митрального клапанов или же общего AV-клапана в одну желудочковую камеру. Атрезия трехстворчатого клапана выделяется как отдельная нозологическая единица.
В зависимости от морфологического строения различают четыре типа порока — А, В, С, D, которые характеризуются:
-
тип А — отсутствием синусной части правого желудочка;
-
тип В — отсутствием синусной части левого желудочка;
-
тип С — отсутствием или недоразвитием синусной части межжелудочковой перегородки;
-
тип D — отсутствием синусных частей правого и левого желудочков, а также межжелудочковой перегородки.
По характеру расположения магистральных артерий в каждом из типов выделяют четыре подтипа:
-
I — с нормальным расположением аорты и легочного ствола;
-
II — с d-ТМА;
-
III — с L-ТМА;
-
IV — аорта и легочный ствол находятся в перевернутом положении по отношению друг к другу.
Наиболее распространенной формой ЕЖС является тип A III . Lev и соавторы также предлагают классификацию подобного рода.
Biarke, Anderson и соавторы к одножелудочковому сердцу относят аномалии, у которых AV -клапаны открываются только в одну камеру желудочковой массы. Они выделяют три разновидности анатомического строения желудочков:
1) по левожелудочковому типу с рудиментарной камерой правого желудочка;
2) по правожелудочковому типу с рудиментарной камерой левого желудочка;
3) неопределенное строение желудочковой массы.
Атрезия трехстворчатого клапана в эту классификацию не входит. Название «общий желудочек» они используют в случаях, когда отсутствует или недоразвита межжелудочковая перегородка.
В связи с полиморфностью данной патологии и для лучшего ее понимания следует подробнее остановиться на терминологии, употребляемой в описании анатомических структур сердца с единственным желудочком.
Расположение предсердий может быть обычным — правое предсердие расположено справа, левое — слева — или перевернутым. В некоторых случаях при синдроме гетеротаксии расположение предсердий бывает неопределенным. Ось желудочковой массы может быть смещена влево, вправо, расположена посередине. Тип предсердно-желудочкового соединения носит название «одножелудочковое».
Способ соединения может быть двуприточным, с отсутствием левого или правого AV-отверстия. При двуприточном соединении оба предсердия сообщаются с желудочком через два раздельных клапана или через общий AV-клапан. Если имеются два отдельных AV-клапана, их называют не «трехстворчатый» и «митральный», а «правый» и «левый», соответственно расположению предсердия, с которым сообщается данный клапан. Любой из этих клапанов может быть сужен или атрезирован.
У пациентов с ЕЖС часто встречаются различные варианты прикрепления AV-клапанов. Атриовентрикулярный клапан, у которого часть хорд пересекает ДМЖП и прикрепляются к перегородке или папиллярным мышцам со стороны рудиментарного желудочка, получил название «клапан-наездник». Степень смещения AV-клапана-наездника является одним из критериев в постановке диагноза «ЕЖС». Если больше половины поверхности клапана-наездника и другой AV-клапан открываются в одну желудочковою камеру, то в данном случае ставится диагноз «ЕЖС с двуприточным AV-соединением». Если же больше половины поверхности клапана-наездника относится к желудочковой камере, в которую не открывается другой AV-клапан, наличие ЕЖС исключается.

Клапаны-наездники классифицируются как правый, левый и общий AV-клапаны. Желудочек, в который открывается один целый и часть другого AV-клапана, называется первичной камерой. Рудиментарный желудочек, к которому прикрепляется другая часть клапана-наездника, носит название вторичной камеры.
Окончательно сформированный желудочек состоит из приточного, верхушечно-трабекулярного и выводного компонентов. Приточный компонент состоит из AV-отверстия и части, поддерживающей клапан. Трабекулярный компонент включает в себя часть желудочка, расположенную ниже прикрепления папиллярных мышц.
Выводной компонент служит основанием для прикрепления артериальных клапанов. Это может быть полностью сформированная мышечная структура или утонченное продолжение между артериальными и AV-клапанами.
В отличие от нормального сердца, в котором правая и левая желудочковые камеры имеют свои характерные черты, в сердце с одножелудочковым AV-соединением приточные части каждой камеры имеют нетипичное строение. Выводная часть также может иметь нетипичное строение или вовсе отсутствовать, и только по верхушечно-трабекулярной части можно определить, какая из камер имеет строение правого желудочка, а какая — левого. Так, строение верхушечно-трабекулярной части по правожелудочковому типу характеризуется грубой трабекулярностью, а по левожелудочковому — гладкой поверхностью септальной стенки и наличием множества перекрещивающихся между собой тонких трабекул.
В случаях, когда желудочковая масса состоит из двух камер, верхушечно-трабекулярная часть одной из них имеет правожелудочковое строение, а другой — левожелудочковое. Желудочек, в который открываются AV-клапаны, обычно имеет большие размеры и называется доминирующим. Другой желудочек имеет несколько наименований — «недоминирующий», «рудиментарный» или «недоразвитый». Недоминирующий желудочек, как правило, имеет маленькие размеры. Если от недоминирующего желудочка отходит одна из магистральных артерий более чем на половину своего диаметра, его называют выпускной камерой, если меньше — трабекулярной подушкой.
Встречается разное расположение желудочков по отношению друг к другу. Для описания используется правило правой и левой руки. Если положить ладонь правой руки на поверхность межжелудочковой перегородки со стороны правого желудочка и большой палец будет указывать на приточную часть желудочка, все остальные — на выводную часть, а кисть — на верхушечно-трабекулярную, то такое расположение сердца будет соответствовать правилу правой руки. Расположение сердца по правилу левой руки определяется таким же образом, только с использованием левой руки. В случаях, когда отсутствует приточная часть желудочка, данное правило действует без учета большого пальца.
Сообщение между доминирующей и недоминирующей желудочковыми камерами также имеет несколько названий:
-
«выводное отверстие»;
-
«трабекулярный межжелудочковый дефект»;
-
«ДМЖП»;
-
«бульбовентрикулярное отверстие»;
-
«межжелудочковое сообщение».
Редко внутреннее строение ЕЖС может быть неопределенным, т.е. его строение не имеет сходства ни с левым, ни с правым желудочком. При этом отсутствует вторая желудочковая камера.
Если одна сторона мышечной массы сердца представлена трабекулярной частью правого желудочка, другая — частью левого желудочка, а межжелудочковая перегородка небольшим гребешком, Lev и соавторы применяют название «общий желудочек». R. Van Praagh в своей классификации эту патологию относит к типу С. Anderson и соавторы считают, что в данном случае предсердия соединяются с двумя желудочками при наличии огромного ДМЖП.
При постановке диагноза обязательно должен быть указан тип желудочково-артериального соединения. Он может быть конкордантным, дискордантным, с двойным выходом из одной желудочковой камеры или с единственным выходом. При конкордантном типе соединения от морфологически правого желудочка отходит легочный ствол, а от морфологически левого — аорта. При дискордантном типе легочный ствол отходит от анатомически левого желудочка, а аорта — от правого желудочка.
Анатомия
В зависимости от желудочковой морфологии выделяют три основных типа ЕЖС:
-
с доминирующей левожелудочковой морфологией;
-
с доминирующей правожелудочковой морфологией;
-
с неопределенной морфологией желудочковой массы.
Чаще всего доминирующий желудочек имеет левожелудочковое строение верхушечно-трабекулярной части. Это так называемый двуприточный левый желудочек, или, по Van Praagh, единственный левый желудочек. Трабекулярная часть недоминирующей камеры соответствует правожелудочковому типу строения. Недоминирующий желудочек обычно расположен спереди и слева или спереди и справа; иногда он может располагаться прямо спереди. От него почти всегда отходят одна или обе магистральные артерии.
Так называемый двуприточный правый желудочек имеет строение трабекулярной части доминирующей камеры по правожелудочковому типу, а недоминирующей — по левожелудочковому. Недоминирующий желудочек располагается обычно сзади со смещением влево или вправо. Как правило, в недоминирующей желудочковой камере отсутствуют приточный и выпускной компоненты. Распознать ЕЖС с доминирующим правым желудочком часто бывает довольно трудно. В основном это происходит за счет отождествления с недоминирующей желудочковой камерой по левожелудочковому типу.
Желудочковая масса ЕЖС с неопределенной морфологией состоит из одной камеры, имеющей нетипичное строение. Этот желудочек не напоминает своим строением ни левый, ни правый желудочки.
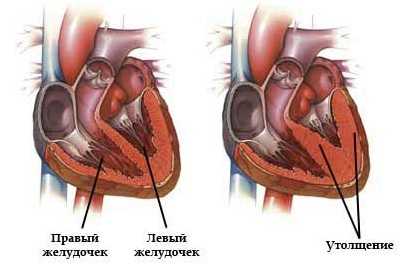
При ЕЖС с доминирующим левым желудочком межжелудочковая перегородка смещена вперед. Коронарные артерии обычно отходят от синусов, которые повернуты к легочному стволу. Передние веточки правой и левой коронарных артерий служат наружными ориентирами расположения перегородки. Изредка часть хорд одного из AV-клапанов крепится в правом желудочке. Почти всегда от недоминирующего желудочка отходит или аорта, или легочный ствол. Редко наблюдаются случаи, когда от него отходят обе магистральные артерии или общий артериальный ствол. Доминирующий и недоминирующий желудочки сообщаются между собой через ДМЖП. Иногда бывают множественные ДМЖП. ДМЖП может быть рестриктивным.
Как уже говорилось раньше, желудочковые камеры по отношению друг к другу располагаются согласно правилу правой и левой руки.
Классическим примером ЕЖС с доминирующим левым желудочком и расположением желудочков по правилу правой руки является так называемое сердце Холмса. Holmes впервые описал эту врожденную аномалию сердца. В данном случае наблюдается расположение предсердий по типу situs solitus и левокардия с нормальным расположением желудочков. Оба AV-отверстия открываются в доминирующий левый желудочек, а желудочково-артериальное соединение конкордантное. Легочный ствол отходил от праворасположенной недоминирующей желудочковой камеры со строением трабекулярной части по правожелудочковому типу. В дальнейшем были описаны другие разновидности ЕЖС с подобным морфологическим строением. Сюда также входят случаи с наличием общего АV-клапана.
Дефект межжелудочковой перегородки в таком сердце, как правило, рестриктивный. У пациентов с атрезией правого АV-клапана наблюдается тенденция к уменьшению межжелудочкового дефекта. Длина выпускной перегородки обычно достаточна для того, чтобы можно было ее иссечь для расширения ДМЖП, если в этом есть необходимость.
Единственный желудочек сердца, напоминающий своим строением сердце Холмса, может иметь желудочково-артериальную дискордантность. В таких случаях выпускная перегородка укорочена, поэтому возможности расширения ДМЖП за счет ее иссечения ограничены. Дефект межжелудочковой перегородки часто пересекают полоски мышечной ткани, которые разделяют его на несколько дефектов. В толще одной из них может проходить АV-пучок.
Единственный желудочек сердца с доминирующим левым желудочком и расположением по правилу левой руки имеет синонимы: «единственный левый желудочек», по Van Praagh, и «двуприточный левый желудочек», по Anderson. В сердце с подобным названием обычно наблюдается расположение предсердий по типу situs solitus и открытие обоих AV-клапанов в большой морфологически левый желудочек. Трабекулярность приточной части этого желудочка более грубая, чем верхушечно-трабекулярной части. Недоминирующий желудочек располагается в передневерхнем положении и смещен влево по отношению к доминирующему левому желудочку. Трабекулярная часть недоминирующей камеры имеет правожелудочковое строение. Межжелудочковая перегородка смещена вперед и кверху. Желудочковые камеры сообщаются между собой через ДМЖП, который может быть также рестриктивным. Редко встречаются множественные межжелудочковые дефекты. Легочный ствол обычно отходит от доминирующего желудочка. Часто наблюдается наличие клапанного или подклапанного стеноза легочной артерии. Аорта в таких случаях отходит от недоминирующего желудочка и располагается слева от легочного ствола. Субаортальная выпускная перегородка, как правило, бывает укороченной.
В таком сердце верхушечнотрабекулярная часть доминирующей желудочковой камеры имеет выраженную трабекулярность. Оба AV-клапана открываются в доминирующий правый желудочек. Маленький недоминирующий морфологически левый желудочек располагается кзади и вниз от правого желудочка. Передняя и задняя нисходящие артерии отграничивают недоминирующий желудочек от доминирующего.
При расположении желудочков по правилу правой руки недоминирующий желудочек располагается в задненижнем положении и смещен влево. Чаще встречается общий AV-клапан. Обе магистральные артерии обычно отходят от правого желудочка, но может встречаться и конкордантное желудочково-артериальное соединение. Anderson описывает три основные разновидности этой анатомической формы ЕЖС. Для первой из них характерно наличие двух AV-клапанов, причем левый в виде наездника, а также двойной выход из правого желудочка; для второй — наличие общего AV-клапана, открывающегося в правый желудочек, и выход в аорту из недоминирующего левого желудочка; для третьей — наличие правопредсердного изомеризма с ТАДЛВ и АЛА. В таких случаях аорта отходит от доминирующего правого желудочка.
Единственный желудочек сердца с доминирующим правым желудочком и расположением желудочков по типу левой руки встречается очень редко. В таком сердце обычно имеется сочетание правопредсердного изомеризма и общего AV-клапана. Обе магистральные артерии, как правило, отходят от одного желудочка. Также может быть атрезирован выход в легочный ствол.
В строении верхушечной трабекулы ЕЖС с неопределенной желудочковой морфологией отсутствуют признаки, характерные для левого или для правого желудочка. В таком сердце отсутствует второй желудочек. Существует две точки зрения на происхождение и строение этой разновидности ЕЖС. Одни авторы считают, что такие сердца имеют правожелудочковое или левожелудочковое строение с отсутствием недоминирующей желудочковой камеры. Другие утверждают, данной разновидности ЕЖС присущи свои особенности анатомического строения. Трабекулярность верхушечной части грубее, чем в правом желудочке, а также строение ее не похоже на строение стенки левого желудочка. Септальная поверхность не гладкая, как в левом желудочке, и не утолщенная, как в правом желудочке. Мышечные структуры, своим строением напоминающие перегородочно-краевую трабекулу, могут располагаться и в верхушечной области, и в выводном отделе.
Единственный желудочек сердца с неопределенной желудочковой морфологией обычно сочетается с предсердным изомеризмом, аномальным впадением системных вен, общим АV-клапаном и единственным выходом, с АЛА.
Некоторые особенности строения проводящей системы ЕЖС и коронарных артерий
Строение проводящей системы при ЕЖС имеет свои особенности. Для типичного расположения проводящей системы характерно нормальное развитие приточной части межжелудочковой перегородки. В нормально развитом сердце она соединяется на уровне центрального фиброзного тела с межпредсердной перегородкой. В этом месте от AV-узла отходит пучок Гиса, который разделяется на ветви в трабекулярной части перегородки. В ЕЖС приточная часть межжелудочковой перегородки отсутствует. Следовательно, и проводящая система сердца развивается нетипично. В этой ситуации проводящие пути, проходящие в трабекулярной части, не могут контактировать с нормальным AV-узлом. Вместо этого они сообщаются с узлоподобной тканью, которая образует окружность трехстворчатого клапана и существует во всех нормально развитых сердцах. Эта ткань носит название нетипичного AV-узла. Обычно нетипичный узел формируется в передней или переднебоковой правопредсердной части AV-кольца.
В ЕЖС с расположенным слева рудиментарным правым желудочком пучок Гиса находится вблизи устья той магистральной артерии, которая расположена сзади. Он проходит над устьем легочного ствола и спускается вдоль верхнего края выпускного отверстия. При расположении рудиментарного желудочка справа AV-пучок проходит вдоль нижнего края выпускного отверстия, вдали от магистральной артерии, которая расположена сзади.
В сердце, где правый AV-клапан прикрепляется в виде наездника, более вероятным является заднебоковое расположение AV-узла, в то время как при наличии левого AV-клапана-наездника узел обычно располагается в переднебоковом положении.
Строение коронарных артерий сердца с единственным желудочком имеет свои особенности. В таком сердце некоронарная створка располагается спереди. Левая коронарная артерия чаще всего отходит от левого синуса аорты, который расположен сзади, и является доминирующей. Правая коронарная артерия отходит от синуса, расположенного в правом заднем положении, и редко бывает доминирующей. От обеих коронарных артерий отходят крупные разграничивающие ветки. Разграничивающими их называют потому, что они проходят точно по границам рудиментарного желудочка и, таким образом, являются наружными ориентирами его расположения. Правая разграничивающая артерия почти всегда крупнее, чем левая. Когда главные коронарные артерии проходят по предсердно-желудочковой борозде, от них отходят несколько веточек, которые спускаются вниз параллельно разграничивающим артериям.
Частота встречаемости разных типов ЕЖС
Из-за большого разнообразия анатомических вариантов этой патологии и отсутствия на протяжении длительного времени единого подхода в определении той или иной аномалии трудно точно установить частоту их встречаемости.
Первые исследования, посвященные этому вопросу, были проведены Van Praagh и соавторами. При изучении морфологии 60 образцов с ЕЖС в 47 случаях было обнаружено сердце с доминирующим левым желудочком, в 3 — сердце с доминирующим правым желудочком, в 6 — единственная камера неопределенной морфологии и в 4 случаях — с отсутствием или рудиментарным развитием синусной части межжелудочковой перегородки.
Во второй серии исследований они сообщают дополнительно о 31 случае. Из этого числа у 23 пациентов был доминирующий левый желудочек и у 8 — доминирующий правый желудочек.
Наиболее подробные морфологичекие исследования, посвященные данной проблеме, были проведены Anderson и соавторами. Ими изучено строение 273 сердец с ЕЖС и АТК. В 140 случаях был доминирующим левый желудочек, в 34 — доминирующий правый желудочек и в 41 случае — желудочек неопределенной морфологии. Из этого числа образцов в 87 случаях отмечалось отсутствие правого AV-соединения, т.е. это были сердца с АТК.
По данным клинических методов исследования, из 191 пациента с ЕЖС, находившегося на обследовании и хирургическом лечении в детском Госпитале и Бромптон госпитале г. Лондона, у 136 имел место двуприточный левый желудочек, у 34 — двуприточный правый желудочек и у 21 — неопределенный тип ЕЖС.
Гемодинамика
В основе нарушения гемодинамики при ЕЖС лежит наличие единственной функциональной желудочковой камеры, в которой смешивается артериальная и венозная кровь, поступающая из обоих предсердий.
При отсутствии патологии легких, кровь поступающая из легочных вен с сатурацией 95-100%, смешивается в общей желудочковой камере с кровью, притекающей из системных вен, с сатурацией 55-60% или меньше. При равном количестве циркулирующей крови в обоих кругах кровообращения насыщение крови, выбрасываемой в аорту, будет варьировать от 75 до 80%. При увеличении легочного кровотока артериальное насыщение кислородом повышается. Например, для того чтобы артериальное насыщение кислородом составило 90%, необходимо, чтобы соотношение легочного объема циркулирующей крови и системного было больше чем 3:1. Следовательно, единственный желудочек, который обеспечивает легочный и системный кровоток, находится в условиях существенной объемной перегрузки.
Если обе магистральные артерии отходят от единственного желудочка и отсутствуют анатомические препятствия выхода крови в каждый из них, то объем протекающей крови по легочным и системным артериям определяется их сопротивлением. В первые недели жизни ребенка сопротивление легочных артерий падает и становится ниже общеперифирического сосудистого сопротивления, поэтому у таких больных объем циркулирующей крови в легких превышает таковой в системном круге кровообращения, вследствие чего насыщение артериальной крови кислородом составляет более 80%.
Вредное воздействие повышенного легочного кровотока в сочетании с объемной перегрузкой сердца приводит к развитию застойной сердечной недостаточности, в результате которой ухудшаются системный кровоток и доставка кислорода, не смотря на повышенное артериальное насыщение кислородом.
Длительное существование увеличенного легочного кровотока приводит к постепенному повышению легочного сопротивления и уменьшению легочного кровотока, в связи с чем возрастает уровень гипоксемии.
Наличие СЛА ведет к дефициту легочного кровотока. В желудочке смешивается относительно небольшой объем артериальной крови с большим объемом венозной. Больные, у которых отношение легочного кровотока к системному менее 1, страдают гипоксемией.
Клиническая картина и естественное течение
Клинические проявления этого порока зависят от его морфологии. При отсутствии СЛА клиническое течение болезни сходно с таковым при большом ДМЖП. У таких больных наблюдаются признаки застойной сердечной недостаточности с первых дней жизни. У пациентов с небольшим или умеренным СЛА в первые годы жизни болезнь протекает без симптомов. И только со временем у них появляется незначительный цианоз, а также увеличиваются размеры сердца при хорошем функциональном состоянии.
При осложнении порока резким СЛА дети рождаются с явлениями гипоксемии, которая проявляется выраженным цианозом и низким насыщением артериальной крови кислородом.
Клиническое течение больных с ЕЖС во многом зависит также от сочетания его с другими аномалиями. Например, сочетание ЕЖС с предсердным изомеризмом, ТАДЛВ и выраженным СЛА сопровождается тяжелым течением с неблагоприятным прогнозом.
У больных с ЕЖС, которые находились на обследовании в Институте сердечно-сосудистой хирургии им. Н.М. Амосова АМН Украины, у 137 пациентов были выявлены стеноз или атрезия легочной артерии. У 102 из них легочный кровоток был недостаточным: у них обнаружены признаки гипоксемии. У 35 пациентов легочный кровоток был нормальным за счет умеренного сужения выхода в легочный ствол. У 50 больных была гипертензия в легочной артерии разной степени выраженности. Таким образом, у 102 больных был вариант клинического течения ЕЖС с недостаточным легочным кровотоком, у 35 — вариант со сбалансированным кровотоком в большом и малом кругах кровообращения и у 50 пациентов вариант клинического течения характеризовался наличием гипертензии в легочной артерии.
Из 117 пациентов с ЕЖС, сочетавшимся с другими ВПС, у 45 клиническое течение заболевания значительно ухудшалось за счет сопутствующих аномалий. У 13 больных это было обусловлено сужением тракта оттока крови в системный круг кровообращения. Такие пациенты с момента рождения находились в тяжелом клиническом состоянии, проявлявшемся выраженной застойной сердечной недостаточностью, серо-бледным цветом кожи и цианозом слизистых оболочек. Младенцы плохо набирали массу тела. С момента рождения они постоянно находились в специализированных детских лечебных отделениях в связи с необходимостью интенсивной терапии, у всех были признаки легочной гипертензии.
У 13 пациентов состояние ухудшалось вследствие недостаточности одного из AV-клапанов. Это были дети старшего возраста, у которых основные симптомы ЕЖС сочетались с признаками вторичной кардиомиопатии, а именно кардиомегалии; у них также наблюдались ухудшение сократительной функции желудочка, недостаточность кровообращения.
У 3 пациентов с двуприточным правым желудочком и атрезией левого AV-клапана клиническое состояние было отягощено вследствие небольших размеров межпредсердного дефекта. Затрудненный отток крови из легочных вен в этих случаях способствовал застою крови в легких, что проявлялось низким насыщением артериальной крови кислородом, наличием выраженной одышки, влажных хрипов в легких.
Вторичная кардиомиопатия, обусловленная объемной перегрузкой желудочка, выявлена у 15 больных. Врожденная полная AV-блокада зарегистрирована у 3 пациентов.
Естественное течение больных с ЕЖС зависит от анатомической формы порока, однако, риск смертельного исхода у таких пациентов в новорожденном периоде и в грудном возрасте меньше, чем у больных с полным аномальным дренажем легочных вен, легочной атрезии в сочетании с интактной межжелудочковой перегородкой, синдромом гипоплазии левых отделов сердца или выраженной формой тетрады Фалло. По данным Stefanelli и соавторов, приблизительно 15% больных с ЕЖС требуют хирургических вмешательств на первом месяце жизни, 33% — в первые 6 мес жизни и 40% — к концу первого года.
Естественное течение ЕЖС без наличия стеноза легочной артерии сходно с течением большого ДМЖП, однако при ЕЖС не может наблюдаться самопроизвольного закрытия межжелудочкового сообщения. Без оперативного вмешательства приблизительно 9 % таких больных умирают на первом году жизни из-за застойной сердечной недостаточности или часто повторяющихся пневмоний.
Увеличение легочного кровотока способствует повышению ЛСС и, как следствие, развитию комплекса Эйзенменгера. Как правило, такие больные не доживают до 3-й декады жизни.
Из 62 неоперированных больных, обследованных в нашем институте, у 31 наблюдали высокую легочную гипертензию. Возраст этих больных колебался от 2 до 28 лет. Среди них 20 пациентов на время обследования были неоперабельными из-за наличия необратимых изменений в сосудах легких, у 5 развилась вторичная кардиомиопатия и только у 6 больных можно было выпол- нитьоперативное лечение.
Объемная перегрузка желудочка способствует развитию вторичной кардиомиопатии и недостаточности одного или обоих AV-клапанов.
Из общего числа неоперированных больных с ЕЖС у 15 наблюдались признаки вторичной кардиомиопатии, что сопровождалось нарушением кровообращения IIА-IIБ стадии. Их возраст составлял от 2 до 34 лет. У 10 пациентов это осложнение развилось при ЕЖС с умеренным СЛА и у 5 — при ЕЖС с легочной гипертензией.
При сочетании ЕЖС с небольшим или умеренным легочным стенозом течение заболевания более благоприятное, чем при других формах порока. Объемная перегрузка желудочка у таких больных значительно меньше, чем у пациентов без СЛА. У них не развивается недостаточность AV- клапанов и легочная гипертензия. Цианоз и полицитемия при этой форме порока выражены незначительно. Продолжительность жизни у пациентов с ЕЖС и небольшим или умеренным СЛА составляет 30-40 лет. Смерть наступает в результате миокардиальной недостаточности.
У пациентов с выраженным СЛА или ее атрезией естественное течение заболевания очень напоминает течение тяжелой формы тетрады Фалло. Без операции 25% из них умирают на первом году жизни от гипоксемии и еще 40% — на протяжении первых 3 лет. Остальные редко переживают 10-летний возраст.
Естественное течение заболевания зависит также от морфологического типа ЕЖС и сочетания его с другими аномалиями. Так, продолжительность жизни у пациентов с висцеральной гетеротаксией, двуприточным правым желудочком, с сужением выхода в системный круг кровообращения, ТАДЛВ значительно меньше, чем при других формах этой патологии.
Диагностика
Вследствие большого разнообразия анатомических форм ЕЖС и частого сочетания его с другими врожденными аномалиями сердца диагностика должна основываться на сочетании клинических и инструментальных методов исследований.
При осмотре у пациентов с увеличенным легочным кровотоком в период после рождения определяется легкий цианоз кожи и слизистых оболочек. Отмечаются признаки застойной сердечной недостаточности, при резком СЛА — выраженный цианоз.
У большинства пациентов с ЕЖС выслушивается систолический шум, при этом у больных без СЛА он максимально выражен в III—IV межреберьях слева. При СЛА выслушивается грубый шум с эпицентром над местом расположения легочного ствола. При отсутствии СЛА систолический шум обусловлен увеличенным кровотоком через устье легочного ствола или током крови из желудочка через ДМЖП в выпускную камеру, а затем в аорту. Определяется акцент II тона.
На ЭКГ электрическая ось сердца отклонена вправо, имеются признаки гипертрофии «правого» желудочка. Примерно у половины больных обнаруживаются признаки гипертрофии «левого» желудочка — высокие зубцы R в левых грудных отведениях, которые выше, чем RV4 с одновременным углублением SV1, SV2.
Отклонение электрической оси сердца влево и наличие на ЭКГ признаков изолированной перегрузки левого желудочка у больных с цианозом может рассматриваться как один из вероятных признаков ЕЖС, но в этих случаях необходимо исключить разнообразные формы гипоплазии правого желудочка.
На рентгенограммах у всех больных, независимо от типа расположения магистральных артерий, наблюдается увеличение тени сердца. В большей степени оно выражено у больных с увеличенным легочным кровотоком. У них же наблюдается усиление легочного рисунка за счет переполнения артериального русла и расширения корней легких, содержащих крупные округлые тени.
У больных с ЕЖС и нормальным расположением магистральных артерий или расположением их, как при d-TMA со СЛА, в переднезадней проекции в области II дуги отмечается западение, аналогичное тому, которое обычно встречается при тетраде Фалло.
У больных с корригированной ТМА левый контур сердечно-сосудистой тени не дифференцируется на I и II дуги и представлен непрерывной, слегка выпуклой или прямой тенью. Это связано с левосторонним расположением восходящей части аорты.
В диагностике ЕЖС первостепенное значение принадлежит методам двухмерной и допплер-ЭхоКГ. Эти методы позволяют довольно быстро и точно установить диагноз и особенности анатомии порока.
С помощью метода двухмерной ЭхоКГ определяется наличие большой желудочковой камеры, в которую открываются оба AV-клапана, а также тип и способ AV-соединения. Наличие клапана-наездника определяется только с помощью этого метода. Вариант расположения предсердий определяется по строению и местам впадения системных вен. Ультразвуковое исследование позволяет определять наличие ДМПП и его размеры. Если есть рудиментарная камера, морфологический тип доминирующего желудочка определяется по месту расположения рудиментарной камеры. Размеры и расположение бульбовентрикулярного отверстия регистрируются во время эхокардиографического сеанса.

Определение типа желудочково-артериального соединения и расположения магистральных артерий по отношению друг к другу, а также наличия субаортального или клапанного стеноза проводят путем выведения изображения через длинную и короткую парастернальные оси. Дугу аорты и место расположения ОАП выводят со стороны яремной ямки. В поперечном сечении видна бифуркация легочного ствола. Эта проекция также позволяет регистрировать расположение верхней полой вены. Легочные вены, лежащие глубже легочных артерий, определяются по месту впадения их в левое предсердие. Они впадают или отдельно, или соединяются в один коллектор за левым предсердием.
Допплер-ЭхоКГ позволяет определить поток крови по ОАП и отличить венозные сосуды от артериальных в сложных случаях, а также выполнить количественную оценку обратного тока крови на AV-клапанах. С помощью допплеровского исследования дифференцируют легочный стеноз и АЛА, определяют степень сужения и градиент давления в местах сужений.
Цветное изображение в комбинации с допплеровским методом позволяет значительно сократить обследование и определить непредвиденный ток крови. Сочетание цветной допплерографии с двухмерной ЭхоКГ дает возможность единовременно получить много важной информации при обследовании пациентов с множественными нарушениями строения сердца и магистральных сосудов.
С помощью ЭхоКГ можно точно определить сократительную и насосную функции сердца, а также степень гипертрофии желудочка. Сократительную функцию желудочка определяют по фракции выброса доминирующего желудочка, а степень гипертрофии — по индексу массы миокарда.
При катетеризации полостей сердца у всех больных с ЕЖС в полости желудочка определяется высокое систолическое давление, равное давлению в аорте. Проведение катетера в легочную артерию и запись давления в ней дают возможность диагностировать наличие СЛА. При определении уровня насыщения крови кислородом в полостях сердца для ЕЖС наиболее патогномоничным комплексом признаков является умеренное повышение оксигенации крови в полости желудочка по сравнению с полостью правого предсердия, различие показателей кислородного насыщения в отдельных пробах, взятых из желудочковой камеры, и снижение насыщения кислородом артериальной крови. Степень артериальной гипоксемии определяет выраженность СЛА. В редких наблюдениях артериальная гипоксемия отсутствует.
Ангиокардиографическое исследование позволяет определить:
-
анатомическую структуру желудочка;
-
наличие и положение выпускной камеры;
-
расположение магистральных сосудов и характер желудочко-артериального соединения;
-
состояние и место открытия АV-клапанов;
-
наличие сопутствующих аномалий.
В связи с этим необходимо произвести:
-
вентрикулографию;
-
правую и левую атриографию;
-
легочную артериографию в аксиальной проекции легочного ствола.
Наибольшую ценность представляет селективная ангиография желудочковой массы в двух проекциях.
Важное диагностическое значение имеет контрастирование рудиментарной камеры из полости ЕЖС. В прямой проекции у больных с нормальным расположением аорты и легочного ствола или корригированной ТМА рудиментарная камера располагается на передней левой поверхности сердца бок о бок с желудочком. У больных с полной ТМА рудиментарная камера контрастируется на передней правой поверхности сердца, тень его накладывается на полость желудочка, от которого отходит аорта.
Таким образом, ЕЖС характеризуется большим разнообразием анатомических форм, которые определяют варианты клинического течения. Естественное течение неблагоприятное у большинства пациентов, родившихся с этим пороком. Наиболее сложной категорией пациентов являются те, у которых ЕЖС сочетается с висцеральной гетеротаксией, аномальным дренированием системных и легочных вен, а также обструкцией выхода в системный круг кровообращения.
doctoroff.ru
Корригированная транспозиция магистральных артерий: у плода, прогноз
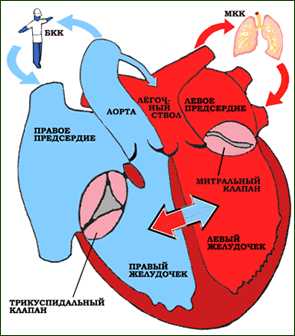
Корригированная ТМА относится к наиболее тяжелым врожденным аномалиям сердца. В 1875 г. впервые австрийским патологоанатомом Van Rokitansky в монографии «Defecte der schtidewande des herzenns» описаны два таких случая. Автор, подчеркивая физиологическое направление потоков крови, отметил, что «транспозиция магистральных артерий была корригирована положением межжелудочковой перегородки таким образом, что аорта получает артериальную кровь, а легочная артерия — венозную, несмотря на то, что речь идет о транспозиции магистральных артерий». При этом пороке кровоток имеет физиологическое направление — в легочную артерию поступает венозная кровь, а в аорту — артериальная. В связи с двойной дискордантностью — атриовентрикулярной и вентрикулоартериальной — в названии порока присутствует термин «корригированная». Висцероатриальное соотношение нормальное: правое предсердие расположено справа от левого предсердия. Правое предсердие опорожняется в левый желудочек через митральный клапан, а левое предсердие — в правый желудочек через трехстворчатый клапан. Во избежание путаницы желудочки удобнее обозначать как «артериальный» и «венозный», а AV-клапаны как «левый» и «правый».
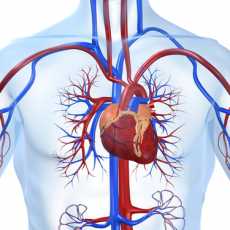
Кровь из полых вен поступает в правое предсердие, далее через митральный клапан и левый желудочек в легочную артерию. Из легких оксигенированная кровь возвращается в левое предсердие и далее через трехстворчатый клапан поступает в правый желудочек, который нагнетает ее в аорту. Таким образом, КТМА характеризуется инверсией желудочков с предсердно-желудочковыми клапанами по отношению к предсердиям и магистральным сосудам.
Близкими к корригированной транспозиции являются ряд ВПС, в основе которых лежит инверсия желудочков с различными типами вентрикулоартериального соединения.
Частота
Частота КТМА, по анатомическим материалам Abbott, составляет 4,9%, Gibson и Gliffon нашли ее в 8,6% случаев всех ВПС. Частота этого порока, по данным клинических исследований, составляет 0,4—0,6% всех ВПС.
Изолированная форма КТМА сердца диагностируется редко из-за бессимптомного течения этого варианта патологии и составляет 1-2% всех случаев этого порока. Поэтому при патологоанатомических исследованиях неосложненная форма КТМА встречается гораздо чаще, чем в клинической практике. Первые наблюдения, описанные Van Rokitansky, были, скорее всего, изолированными, поскольку отсутствует упоминание о сопутствующих внутрисердечных аномалиях.
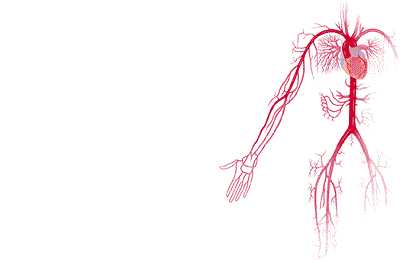
Эмбриология
Существует ряд гипотез, объясняющих механизмы эмбрионального развития сердец с КТМА. Согласно одной из наиболее принятых, нарушение взаимоотношения желудочков происходит на стадии «петлеобразования» эмбриональной сердечной трубки. Последняя изгибается влево, а не вправо. Первичный AV-канал соединяется только с той частью желудочковой петли, из которой в дальнейшем разовьется морфологически левый желудочек. Развитие анатомически правого желудочка зависит от комплекса пока еще не известных процессов, которые предполагают, что в результате расширения AV-канала одна из вновь разделенных предсердных камер может быть соединена с более дистальной частью эмбриональной сердечной трубки, из которой возникнет трабекулярный компонент правого желудочка.
Инверсия желудочков, сочетающаяся с транспозицией больших сосудов, обусловлена одним эмбриологическим нарушением — инверсией бульбовентрикулярной петли, и никаких других нарушений в развитии не происходит. Инверсия сердечной петли с нормальным разделением трункоаортального мешка должна неизбежно привести к транспозиции больших сосудов.
Аномалии вращения сердца всегда сопровождаются инверсией желудочков. При нормальном развитии сердца, когда сердечная петля изгибается вправо, верхушка сердца расположена слева. При КТМА, когда сердечная петля как бы перевернута, развитие сердца должно переместить его верхушку вправо, поэтому в основе формирования КТМА однозначно лежит аномалия вращения сердечной петли. Корригированную транспозицию, наблюдаемую при левосформированном право- и леворасположенном сердце, не следует рассматривать как результат синоаурикулярной инверсии. Эти случаи порока следует расценивать как результат бульбовентрикулярной инверсии у пациентов с обратным формированием и расположением внутренних органов, которые являются редким вариантом нормального развития.
Анатомия
При нормальном расположении предсердий, которое чаще всего наблюдается у пациентов с КТМА, имеется L-перекрест желудочков и L-позиция аорты. Анатомически левый желудочек чаще всего расположен справа, а анатомически правый желудочек — слева, таким образом, митральный клапан находится справа, а трехстворчатый клапан, соответственно, слева. Левый желудочек расположен несколько кзади и ниже правого. При обратном расположении предсердий наблюдается зеркально противоположное взаимоотношение.
Правое предсердие, которое имеет обычную конфигурацию, соединяется через митральный клапан с праворасположенным желудочком. Последний имеет две папиллярные мышцы: одна расположена спереди, другая сзади. Верхние 2/3 перегородки этого желудочка сглажены, наджелудочковый гребень отсутствует. Эта камера имеет все характерные анатомические признаки левого желудочка, но расположена справа.
В отличие от нормальной анатомии левого желудочка, при КТМА имеется фиброзный митрально-легочный контакт. Из этого желудочка отходит легочная артерия, которая располагается позади, справа и параллельно аорте на всем ее протяжении, не перекрещиваясь.
Левое предсердие также имеет обычную конфигурацию. Через трехстворчатый клапан оно соединяется с левосторонним желудочком, который расположен спереди и имеет все анатомические черты правого желудочка:
-
наджелудочковый гребень, разделяющий его полость на приточный и выводной отделы;
-
небольшой валик передней папиллярной мышцы;
-
выраженную трабекулярность.
Инфундибулярный отдел желудочка отделяет трехстворчатый клапан от аортального: отсутствует аортально-трехстворчатый контакт. На морфологии правого желудочка отражается системная нагрузка — гипертофия стенок и инфундибулярного отдела. Из левостороннего желудочка отходит аорта, которая идет спереди, слева и параллельно легочному стволу на всем его протяжении.
Клапан легочной артерии вклинивается между митральным и трехстворчатым клапанами. Эта особенность характерна для КТМА в большей степени, чем для полной транспозиции, и более выражена, чем расположение аортального клапана в нормальном сердце. Клапан легочной артерии расположен справа и сзади по отношению к аортальному. Полулунные створки истончены и часто срастаются между собой, иногда образуя одностворчатый клапан. В 50% случаев имеется анатомическая обструкция выводного тракта венозного желудочка и в 25% она гемодинамически значимая.
Клапанный или подклапанный легочный стеноз отмечается у половины больных с КТМА, главным образом в сочетании с ДМЖП. Изолированный стеноз редок. Обструкция, преимущественно подклапанная, создается фиброзно-мышечным гребнем или наростом ткани эндокардиальных подушечек и чаще всего представляет собой длинный, узкий фиброзно-мышечный туннель. Среди других причин обструкции встречаются:
-
истинная аневризма мембранозной перегородки в задней части выводного тракта;
-
гипоплазия ствола и кольца;
-
фиброзные изменения створок клапана;
-
пролабирование через ДМЖП створки трехстворчатого клапана.
Аортальный клапан, как правило, не изменен и смещен влево. Аорта находится в передней позиции. Иногда она может быть справа и спереди легочного ствола, что связано с ротацией выводного отдела. При situs inversus аорта смещена вправо.
В связи с вклинением клапана легочной артерии митральный клапан смещен кпереди по отношению к кольцу легочного клапана. В результате клапан легочной артерии прикрыт септальной створкой митрального клапана. Последний ротирован таким образом, что его септальная створка является фиброзным продолжением легочного клапана, поэтому ее можно назвать «легочной» створкой и она расположена сзади, в то время как «муральная» створка расположена спереди. Короткие папиллярные мышцы начинаются от переднелатеральной свободной стенки желудочка, поэтому они могут быть повреждены при выполнении вентрикулотомии. На их расположение указывает прямая борозда, пересекающая левый желудочек и соответствующая прохождению передней нисходящей коронарной артерии. Более крупные папиллярные мышцы отходят от заднелатеральной свободной стенки желудочка.
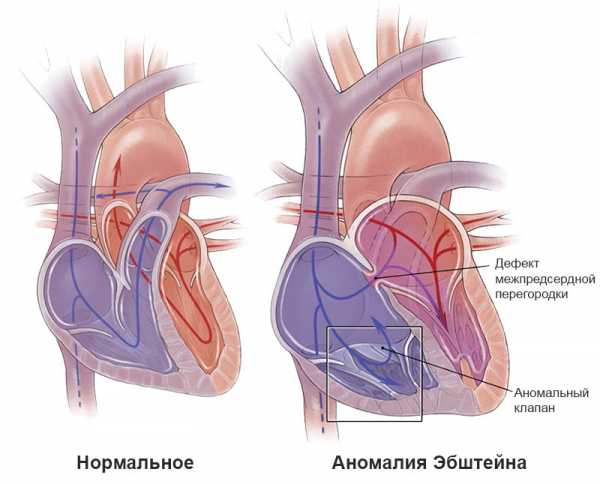
Трехстворчатый клапан обычно расположен в сагиттальной плоскости. Септальная створка занимает более медиальное и переднее положение, чем в норме. В 90% случаев отмечается нарушение его строения. Чаще всего наблюдается дисплазия створок с аномальными, укороченными хордами, прикрепляющимися к септальной и задней створкам. Недостаточность трехстворчатого клапана может быть чисто функциональной вследствие аномального расположения его в системном круге, однако могут иметь место и анатомические причины. Реже встречается истинная аномалия Эбштейна с характерным смещением места прикрепления перегородочной и задней створок с патологией подклапанного аппарата: короткие толстые хорды, удерживающие септальную и заднюю створки, крепятся к задней стенке желудочка. Однако, в отличие от аномалии Эбштейна, атриализация части правого желудочка и стеноз клапана наблюдаются редко. Известно, что аномалия Эбштейна является пороком трехстворчатого клапана, поэтому патология Эбштейна системного клапана встречается только при КТМА.
Фиброзное кольцо трехстворчатого клапана слабое, предрасположенное к растяжению. Папиллярные мышцы в правом желудочке в отличие от левого исходят из его свободной стенки и межжелудочковой перегородки. Поэтому при возникновении недостаточности клапана и дилатации полости створки подтягиваются хордальным аппаратом в разные стороны, увеличивая степень недостаточности. В некоторых случаях клапан с подклапанным аппаратом в виде наездника смещен и нависает над мышечным или приточным ДМЖП. Из 60 оперированных в ходе исследования пациентов клапан-наездник встретился у одного больного.
Положение трехстворчатого клапана в системном желудочке в условиях высокого давления является причиной его недостаточности у 26-50% больных и очень редко — стеноза.
К анатомическим особенностям КТМА относится необычное расположение межпредсердной и межжелудочковой перегородок, за исключением тех случаев, когда легочный, митральный и трехстворчатый клапаны расположены близко друг к другу и сочленены правым фиброзным треугольником. Прикрепление межпредсердной перегородки к фиброзному скелету сердца смещено вправо по отношению к месту прикрепления межжелудочковой перегородки. Это приводит к тому, что AV-узел, расположенный в типичном месте, не может достичь нижележащей межжелудочковой перегородки.
Большая часть мышечной межжелудочковой перегородки расположена в сагиттальной плоскости и видна в переднезадней позиции во время ангиографии. Аномальное расположение межжелудочковой перегородки приводит к увеличению ее мембранозной части. Довольно часто она аневризматически выпячивается, создавая обструкцию выводного тракта венозного желудочка.
Необычная анатомия проводящей системы предрасполагает к спонтанной блокаде. Синусовый узел расположен нормально. Атриовентрикулярный узел, как обычно, локализуется впереди устья коронарного синуса на верхушке треугольника Коха, однако в связи с неправильным расположением межжелудочковой перегородки от него очень редко отходят ветви пучка Гиса.
При situs solitus всегда имеется дополнительный передний AV-узел. Он расположен между кольцом митрального клапана и основанием правого ушка. Удлиненная часть общего пучка после прободения фиброзного треугольника пересекает переднюю стенку выводного тракта анатомически левого желудочка поверх кольца легочной артерии. Затем он спускается субэндокардиально по левой стороне межжелудочковой перегородки, где делится на левую переднюю, заднюю и правую ножки на уровне перехода мембранозной части межжелудочковой перегородки в мышечную. Он расположен субэндокардиально и часто имеет вид бледной борозды. Правая ветвь пучка Гиса пересекает гребень мышечной части перегородки и направляется к левой поверхности межжелудочковой перегородки, т.е. со стороны правого желудочка, возле места отхождения папиллярных мышц конуса, затем идет вниз по септальной борозде до разделения на отдельные волокна. Левая ветвь пучка Гиса от узла спускается по септальной поверхности левого желудочка.
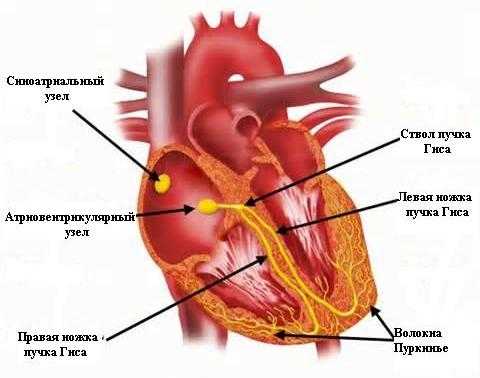
При наличии мембранозного ДМЖП общий пучок Гиса проходит близко к его передневерхнему и передненижнему краям. В нормальном сердце он следует вдоль задненижнего края дефекта.
Фиброзная ткань в месте соединения АV-узла с АV-пучком, обычно истонченная при КТМА, является причиной спонтанного возникновения АV-блокады при этом пороке. При врожденной полной блокаде имеется нарушение анатомической связи между AV-узлом и пучком Гиса.
Иногда ветви пучка отходят как от нормального AV-узла, так и от переднего, образуя массив проводящих волокон, окружающих кольцо клапана легочной артерии.
Анатомия коронарных артерий соответствует анатомии желудочков, которые ими кровоснабжаются. Таким образом, левая коронарная артерия и ее передняя нисходящая и огибающая ветви кровоснабжают анатомически левый желудочек, а правая коронарная артерия, ее конусная и задняя нисходящие ветви осуществляют кровоснабжение правого желудочка. Отхождение же коронарных артерий от аорты при КТМА отличается от нормального. Расположенная справа левая коронарная артерия отходит от правого заднего синуса и проходит спереди кольца клапана легочной артерии, после чего делится на левую переднюю нисходящую и огибающую ветви. Огибающая ветвь проходит по передней поверхности ушка правого предсердия по предсердно-желудочковой борозде.
Правая коронарная артерия отходит от правого заднего синуса и идет по AV-борозде и передней поверхности ушка правого предсердия. Анатомия коронарных артерий при КТМА имеет особо важное значение при хирургических вмешательствах, ибо их локализация определяет возможность применения различных хирургических доступов к сердцу. Так, топография огибающей ветви левой коронарной артерии, пересекающей легочный ствол, обусловливает применение иной хирургической тактики при легочном стенозе, чем в подобных случаях при нормальном сердце.
Правый желудочек в системном кровообращении
Исследователей давно интересует вопрос: способен ли морфологически правый желудочек функционировать в качестве системного в течение длительного времени? Ведь он отличается от левого по многим анатомическим и функциональным параметрам — конфигурации желудочка, анатомии трехстворчатого клапана, месту крепления папиллярных мышц, кровоснабжению одной коронарной артерией — в отличие от левого, который имеет двухкоронарную систему. В то же время многие авторы сообщают о долгожителях с КТМА, обратившихся к врачам по несердечным причинам. Эти случаи доказывают, что правый желудочек может функционировать как системный в течение многих лет. С помощью радиоизотопных методов исследования функции желудочка рядом авторов показана сохранность правого желудочка. Из клинического опыта очевидно, что у пациентов с двойной дискордантностью имеется предрасположенность к сократительной дисфункции. Методом сканирования было обнаружено, что при отсутствии дополнительных пороков часто встречается обратимая и фиксированная ишемия миокарда с нарушением движения стенки. У молодых пациентов фракция выброса правого желудочка нормальная, а у старших — снижена. Интересно, что показатели сократимости у не оперированных пациентов с КТМА, были более близки к норме, чем у перенесших физиологическую коррекцию.
КТМА с выраженной гипоплазией желудочков
При этом казуистическом сочетании межжелудочковая перегородка нередко расположена горизонтально, в отличие от типичной сагиттальной ориентации. При недоразвитии системного правого желудочка следует ожидать смещения «верхом сидящего» трехстворчатого клапана с мышечным приточным ДМЖП или стенозом левого AV-отверстия. Гипоплазия анатомически левого желудочка реже встречается при КТМА и сопровождается аномалией митрального клапана. Пациентам с этой патологией нельзя выполнять двухжелудочковую коррекцию. Они подлежат этапным вмешательствам на пути к окончательной операции Fontan.
Сопутствующие пороки
КТМА у большинства пациентов сочетается с другими пороками, которые непосредственно являются причиной обращения за хирургической помощью.
-
Наиболее частым из них является ДМЖП. Как правило, он располагается в мембранозной части перегородки, распространяясь кпереди или кзади по направлению к AV-клапану.
-
Второй по частоте порок — обструкция путей оттока из венозного желудочка — очень редко наблюдается в изолированном виде: менее 20% случаев, в основном в сочетании с ДМЖП.
-
Третье место среди сопутствующих КТМА пороков занимает недостаточность левого AV- клапана — анатомически трехстворчатого клапана, функционирующего в условиях системного давления. Частота сопутствующей недостаточности артериального AV-клапана составляет 26-46%.
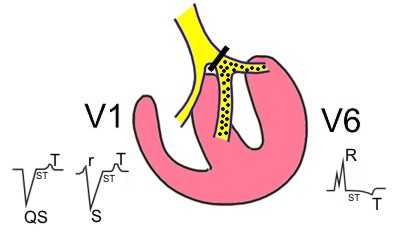
-
Нарушения ритма сердца наблюдаются у 5-40% больных. Их частота увеличивается с возрастом. Они проявляются в виде полной AV- блокады, блокады правой и/или левой ножки пучка Гиса. У 5-10% пациентов полная AV-блокада отмечается уже при рождении.
Эти четыре аномалии настолько часто сопровождают КТМА, что их можно рассматривать как неотъемлемую часть порока. Реже встречаются ДМЖП, коарктация аорты, ОАП, особенно при атрезии легочной артерии, недостаточность аортального клапана, недостаточность митрального клапана, гипоплазия венозного желудочка, смещенный и «верхом сидящий» митральный и трехстворчатый клапаны, перерыв дуги аорты, аортальный клапанный и субаортальный стеноз. Патология митрального клапана встречается гораздо реже, чем трехстворчатого. Обычно это аномалии количества створок и подклапанного аппарата, реже наблюдаются дисплазия, общее AV- отверстие, стеноз и расщепление створок. При КТМА изредка наблюдалась атрезия аорты, сопровождающаяся массивной регургитацией системного АV-клапана и тяжелым истончением миокарда правого желудочка.
Клиника
Клиника КТМА не столько зависит от самой аномалии, сколько от сопутствующих внутрисердечных пороков. Корригированная транспозиция магистральных артерий была впервые диагностирована в 1956 г. Helmhzol и соавторами. Более подробное описание клинических проявлений появилось через год в статье Anderson.
Клиническое течение изолированной формы КТМА
Течение изолированной КТМА обычно благоприятное, отсутствуют какие-либо жалобы больных, их физическое развитие расценивается как нормальное. По мнению Stanger, это один из вариантов нормального сердца. Изолированную КТМА или с минимальными сопутствующими пороками случайно обнаруживали у людей в 5-й, 6-й, 7-й и 8-й декадах жизни. Остается неизвестным, умирают ли пациенты с изолированной формой КТМА в младенческом и детском возрасте. Без сомнения, полная AV-блокада сердца может быть причиной внезапной смерти в любом возрасте, даже во внутриутробном периоде. Развитие клинических симптомов у этой группы пациентов связано со следующими факторами:
-
возникновением или прогрессированием с возрастом AV-блокады вследствие врожденной аномалии проводящей системы сердца или замещения на протяжении жизни проводящих волокон фиброзной тканью. Согласно гистологическим исследованиям миокарда Ким и соавторов, у 3 больных с КТМА в возрасте старше 15 лет во всех препаратах обнаружены различной степени выраженности зоны периваскулярного и интерстициального склероза;
-
возникновением и прогрессированием недостаточности системного АV-клапана, наблюдаемым у 35-82% больных;
-
снижением сократительной способности правого желудочка, имеющего неестественную для системной нагрузки конфигурацию и кровоснабжение.
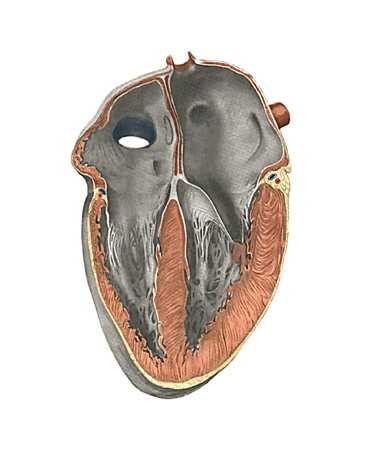
Так как системный желудочек при КТМА менее толерантен к недостаточности клапана, чем венозный, прогрессирование регургитации и последующая недостаточность системного желудочка наступают раньше, чем это бывает при поражении митрального клапана. Причина подобного различия, скорее всего, связана с анатомическими особенностями строения, как самих желудочков, так и соответствующих клапанов.
Prieto изучил функцию системного AV-клапана у 40 пациентов с КТМА. Длительность наблюдений колебалась от 7 до 36 лет, в среднем 20 лет. Коррекцию порока провели 21 пациенту, 19 — не были прооперированы или перенесли закрытые процедуры. Только одним независимым фактором риска летальности было наличие умеренной или выраженной недостаточности системного желудочка. Во всей когорте больных 20-летняя выживаемость без недостаточности левого AV-клапана составила 93%, а с недостаточностью клапана — только 49%. Несмотря на то, что фракция выброса системного желудочка не увеличивается при нагрузке, функциональная способность правого желудочка в отсутствие недостаточности трехстворчатого клапана обеспечивает полноценную продолжительную жизнь.
Huntha и соавторы описали естественное течение КТМА у 107 пациентов, проходивших обследование и лечение в течение 30-летнего периода — с 1951 по 1985 гг. Снижение выживаемости пациентов в этой серии коррелировало только с недостаточностью левого AV-клапана. Эти авторы сообщили о 70% выживаемости в течение 5 лет и 64% — в течение 10 лет.
Уникальная анатомия проводящей системы сердца является причиной AV-блокады у 10% пациентов с корригированной транспозицией. В течение 20 наблюдений у 30-45% пациентов спонтанно развилась блокада III степени. Показано, что в этой популяции полная блокада возникает с частотой 2% в год.
В ходе одного из исследований под наблюдением находились 12 пациентов с изолированной формой КТМА в возрасте от 8 мес до 71 года. Полная AV-блокада сердца выявлена у 7 пациентов в возрасте от 8 до 43 лет. При рождении, как следовало из анамнеза, блокада отсутствовала. Время ее возникновения практически совпадало с обращением в институт. Блокада сердца развилась в детском возрасте лишь у 2 больных. У остальных она появилась во 2, 3, 4-й и 5-й декадах жизни. Всем пациентам с блокадой имплантирован водитель ритма. Недостаточность системного AV-клапана выявлена у 10 больных. У 6 больных она была минимальной, у 2 — умеренной и у 2 — выраженной. У пациентов старше 20 лет фракция выброса системного желудочка была сниженной, с худшими показателями у лиц более старшего возраста. Коррекция недостаточности клапана с помощью кольца Карпентье выполнена только у пациентки 43 лет. Несостоятельность клапана была обусловлена расширением фиброзного кольца при неизмененных створках.
Таким образом, прогрессирующее ухудшение качества жизни у больных с изолированной формой КТМА обусловлено недостаточностью системного желудочка и полной AV-блокадой. Сочетание этих осложнений является причиной быстрого ухудшения показателей гемодинамики, развития застойной сердечной недостаточности и смерти.
Connolly и соавторы изучали течение беременности у женщин с двойной дискордантностью. У 22 женщин было 60 беременностей, в 50 случаях закончившихся рождением живых детей. В 11 случаях имело место прерывание беременности. Не было смертей, связанных с беременностью.
Клиническая картина при сочетании КТМА с ВПС
Клиническая картина КТМА с ВПС обусловлена типом порока и степенью гемодинамических расстройств. Гемодинамические нарушения определяют продолжительность жизни. В отличие от обычного изолированного ДМЖП в нормальном сердце, при ДМЖП с КТМА у больных на первом году жизни симптомы отсутствуют. Это объясняется сопутствующим нерезким функциональным или органическим подлегочным стенозом. При отсутствии стеноза и большом ДМЖП может развиться застойная сердечная недостаточность, рано развивается легочная гипертензия. При резком стенозе с цианозом клиника напоминает таковую при тетраде Фалло. Недостаточность левого AV-клапана проявляется так же, как и митральная недостаточность в нормальном сердце.
У больных часто имеется сердечный горб или деформация грудной клетки по типу куриной груди. Обычно такие больные жалуются на одышку, сердцебиение, быструю утомляемость при физической нагрузке, иногда на колющие боли в области сердца.
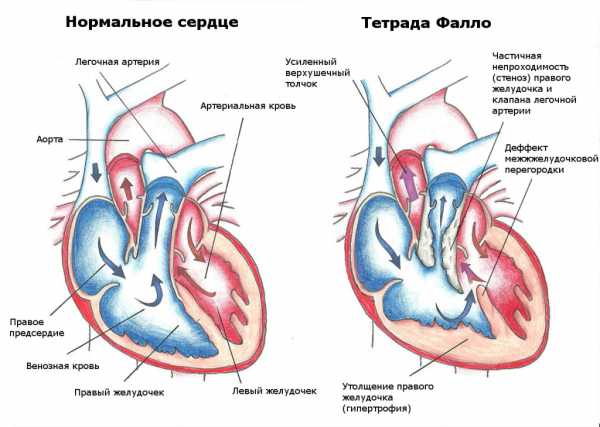
Таким образом, КТМА является тяжелой патологией, отличающейся многообразием клинических проявлений и отсутствием патогномоничных для нее признаков. Поэтому, как остроумно высказались независимо друг от друга van Praagh и Warnes, только условно можно назвать этот порок корригированным.
Диагностика
Инструментальные методы исследования
Обследование пациентов следует проводить последовательно, раскрывая характер формирования и расположения сердца в грудной клетке, наличие инверсии желудочков, тип вентрикулоартериального соединения, присутствие сопутствующих внутрисердечных пороков и характер нарушений гемодинамики. Распознавание КТМА возможно только на основании трактовки совокупности всех результатов неинвазивных и инвазивных методов исследования. При этом специфичность и достоверность разных диагностических признаков различна: одни критерии играют вспомогательную роль, другие — определяющую. Именно поэтому придается такое большое значение всем диагностическим методам, несущим объективную информацию о морфологических и функциональных изменениях сердца.
На поверхностной ЭКГ при КТМА диагностической ценностью обладают три признака:
1) нарушение проводимости и ритма сердца;
2) характерное изменение комплекса QRS и зубца Т, присущее данному пороку;
3) изменение зубца Р и комплекса QRS, обусловленное имеющимися сопутствующими аномалиями.
Характерным признаком КТМА является отклонение электрической оси сердца влево. Механизм подобного отклонения оси сердца влево до конца не ясен, во всяком случае, не указывает на переднелевую фасцикулярную блокаду, так как левая ножка пучка Гиса расположена в правой половине сердца. Отклонение электрической оси сердца влево иногда сочетается с пикообразной формой зубцов Q в отведениях II, III и aVF, в большинстве, а возможно, и во всех грудных отведениях.
Перегрузка оказывает влияние не только на отклонение оси сердца, но также и на форму комплекса QRS. При выраженном стенозе легочной артерии с интактной межжелудочковой перегородкой ЭКГ-признаки могут проявляться в отведении V1 qR и V6 rS. Нерестриктивный ДМЖП с большим лево-правым сбросом сочетается с эквибифазным комплексом RS в отведении V3-4 и с увеличением зубцов R без зубцов Q в отведении V5-6. Положительные зубцы Т регистрируются во всех грудных отведениях более чем в 80% случаев, что является следствием расположения инвертированных желудочков «бок о бок».
Более чем у 75% пациентов с КТМА всех возрастных категорий имеется AV-блокада различной степени выраженности — от удлинения интервала PQ, преходящей блокады 2:1 и до полной AV-блокады. Со временем у одного и того же пациента степень блокады может изменяться.
В отличие от нормы, при КТМА в результате инверсии правой и левой ветвей пучка Гиса возбуждение межжелудочковой перегородки распространяется справа налево и сзади кпереди, таким образом, зубец Q в отведении V5-6 отсутствует и очень часто регистрируется в отведении V1-3.
При КТМА II тон часто не имеет второго компонента, что указывает на более синхронное сокращение желудочков, в отличие от нормального сердца, и это является характерным признаком данного порока.
Рентгенографическое исследование позволяет заподозрить корригированную транспозицию по характерной конфигурации сердечной тени. В связи с левосторонним расположением аорты левый контур сосудистого пучка представлен сплошной линией, I и II дуга не дифференцируются. Обращает на себя внимание неопределенное положение верхушки сердца.
При выраженной недостаточности системного AV-клапана размеры сердца резко увеличены. Усиленный рисунок легочных полей обусловлен застоем в малом круге кровообращения. Характерным признаком КТМА является узкий сосудистый пучок. У большинства больных наблюдается расширение левого предсердия в виде большого шаровидного образования как следствие недостаточности артериального желудочка.
Эхокардиографическое исследование позволяет точно поставить ранний диагноз КТМА. В комплексе диагностических методов ЭхоКГ стала основным инструментом при этом пороке.
ЭхоКГ-диагностика КТМА сердца базируется на идентификации инверсии желудочков по характерным морфологическим признакам:
-
расположению митрального клапана спереди и трехстворчатого клапана сзади;
-
левой позиции аорты по отношению к легочному стволу;
-
наличию межжелудочковой перегородки, исключающей единственный желудочек сердца.
Для морфологически левого желудочка характерно наличие AV-клапана, который прикрепляется к межжелудочковой перегородке на более высоком уровне по сравнению с другим AV-клапаном. Клапан имеет две створки и две комиссуры. В диастолу часто отмечается симптом рыбьего рта. Для клапана характерно парное расположение папиллярных мышц и хорд, которые прикрепляются исключительно к свободной стенке желудочка, имеющего овальную или эллипсовидную конфигурацию, а также фиброзная связь между AV-клапаном и магистральным сосудом.

Левый АV-клапан имеет треугольную форму с тремя комиссурами, множественными хаотично расположенными папиллярными мышцами с прикреплением хорд к межжелудочковой перегородке. Желудочек серповидной формы, с грубыми трабекулами на верхушке и срединным валиком. Фиброзная перемычка между клапаном и магистральной артерией отсутствует.
При исследовании магистральных артерий оценивается их взаимное расположение, а также место отхождения. В нормальном сердце имеется спиральное взаиморасположение или перекрест магистральных артерий. По короткой оси определяются эхо-срезы аорты и ствола легочной артерии. При КТМА окружность аорты расположена спереди и слева от ствола легочной артерии. Модифицированная длинная ось двухмерной ЭхоКГ демонстрирует параллельное расположение магистральных артерий.
Дефект межжелудочковой перегородки обычно нерестриктивный и перимембранозный. Он частично занимает перегородку выводного тракта желудочка. При двухмерной ЭхоКГ иногда трудно определить морфологический тип СЛА, но можно установить обструкцию, вызванную фиброзной мембраной или подвижной фиброзной заслонкой. Можно также диагностировать стеноз клапана легочной артерии.
Катетеризация сердца и ангиокардиография полостей сердца позволяют определить аномальную архитектуру сердца, уточнить сопутствующие внутрисердечные пороки, получить данные о состоянии гемодинамики.
При проведении катетера отмечается характерное его положение в легочном стволе, которое обусловлено особым взаиморасположением приточного и выводного отделов венозного желудочка. Заднемедиальная позиция катетера является полезным ориентиром, но не абсолютным подтверждением КТМА.
Венозная катетеризация сердца, определяющая с большой точностью локализацию нижней полой вены и правого предсердия, позволяет провести дифференциацию с предсердным изомеризмом. Отсутствие нижней полой вены с azygos-продолжением, наличие билатеральной верхней полой вены, выявление ТАДЛВ указывают на предсердную изомерию, что исключает диагноз КТМА.
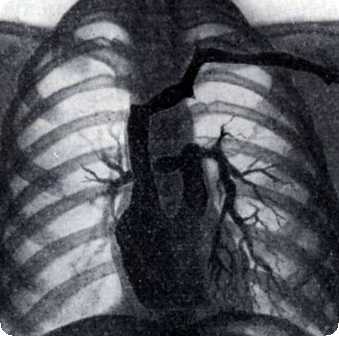
Идентификация правого и левого предсердия проводится путем определения морфологии предсердной тени, но в основном на основании морфологии предсердных ушек. Правое предсердие удлиненное, а его ушко имеет характерную треугольную форму с широким основанием и тупой верхушкой. Левое предсердие имеет треугольную форму с плоской крышей, в отличие от правого; ушко вытянутое, пальцеобразное, с узким устьем.
Взаимоотношение желудочков варьирует в зависимости от степени ротации сердца. При селективной ангиокардиографии отчетливо выявляются признаки бульбовентрикулярной инверсии. В переднезадней проекции венозный желудочек имеет овальную форму, гладкие внутренние контуры и хвостообразный выступ по направлению к верхушке сердца, т. е. признаки, характерные для левого желудочка. Из него контрастируется легочный ствол, располагающийся медиально. В боковой проекции венозный желудочек расположен спереди, а его выводной отдел и легочный ствол направлены кзади.
Системный желудочек в переднезадней проекции имеет грушевидную форму с выраженной тра- бекулярностью внутренней поверхности, а также конусный выводной отдел и наджелудочковый гребень, т.е. признаки, характерные для правого желудочка. Из системного желудочка отходит восходящая аорта, которая занимает крайнее левое положение и образует левую дугу.
Устье аорты отделено от остальной части желудочка инфундибулярным отделом и расположено выше, чем в нормальном сердце. Восходящая часть аорты образует верхний сегмент по левому контуру сердца. Устье легочной артерии располагается значительно ниже, чем в здоровом сердце. Видно зеркальное расположение коронарных сосудов.
При исследовании в боковой проекции приточная часть системного желудочка расположена сзади, выводной отдел направлен вперед и восходящая часть аорты находится спереди. Оба магистральных сосуда идут параллельно, клапан легочной артерии расположен ниже клапана аорты.
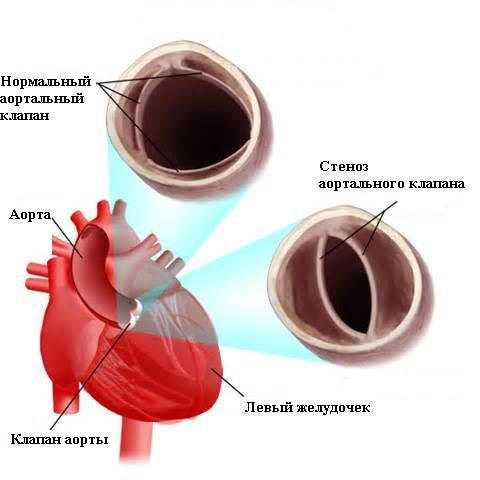
Необходимость проведения ангиокардиографии возникает для диагностики легочной гипертензии и определения величины ЛСС, а также выявления деформации ветвей легочной артерии после шунтирующих операций.
Дохирургическое лечение и показания к операциям
Новорожденные с дуктусзависимым легочным кровотоком нуждаются в безотлагательном начале инфузии простогландина для поддержания проходимости артериального протока вплоть до наложения системно-легочного анастомоза. Аналогичные действия предпринимают у младенцев с тяжелой коарктацией аорты или перерывом дуги. Прогноз в этой подгруппе детей гораздо менее благоприятный из-за предрасположенности к анатомическим и функциональным нарушениям системного AV-клапана. Назначение дигоксина еще более оправдано у этой категории пациентов, чем у больных с нормальным сердцем.
Системно-легочный анастомоз показан при тяжелом цианозе или гипоплазии одного из желудочков для дальнейшего этапного лечения функционально единственного желудочка. При наличии большого ДМЖП и застойной сердечной недостаточности в целях отсрочки корригирующей операции показано суживание легочной артерии. Выраженную недостаточность трехстворчатого клапана, как правило, не пытаются корригировать в младенческом возрасте из-за ее невысокой эффективности, необходимости протезирования и большого хирургического риска. Адекватным вмешательством является анатомическая коррекция путем двойного переключения на артериальном и предсердном уровнях.
Международным стандартом хирургической тактики являются радикальные вмешательства в течение первого-второго года жизни из-за прогрессирования цианоза и недостаточности трехстворчатого клапана.
doctoroff.ru
Митральный стеноз: симптомы, диагностика, лечение, последствия
Врожденный митральный стеноз первые описал Smith в 1846 г. В 1923 г. появилось первое сообщение об успешной комиссуротомии, выполненной Culter и Levine 11-летней пациентке. Два года спустя Souttar выполнил операцию 15-летней пациентке, при этом митральное отверстие было расширено при помощи пальца доступом через ушко левого предсердия. Несмотря на то, что указанные хирургические вмешательства были выполнены детям, они проводились по поводу приобретенных пороков митрального клапана. В 1952 г. Bower впервые успешно выполнил закрытую комиссуротомию по поводу врожденного стеноза митрального клапана ребенку в возрасте 5,5 года. Сообщение об успешном протезировании митрального клапана 10-месячному младенцу, опубликовано в 1964 г.
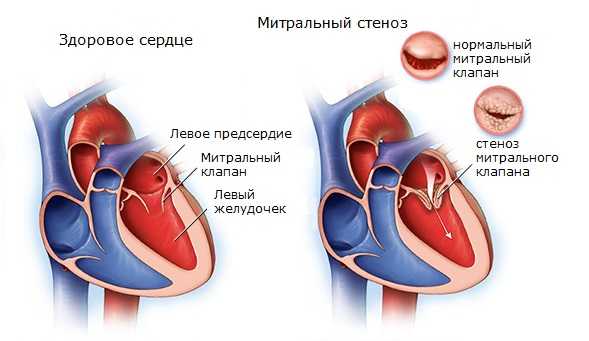
Эмбриогенез
Формирование митрального клапана начинается на 4-й неделе развития зародыша из мезодермы, образующей сердечные подушечки, которые расположены с левой стороны AV-отверстия. Подушечки участвуют в формировании створок между предсердным и желудочковым отделами общего AV-канала. В образовании клапана также принимает участие выпячивание мышечной ткани желудочка, которая отделяется от его стенки. Формирование перегородок между предсердиями и желудочками сердца эмбриона происходит на 5-6-й неделе внутриутробного развития. Эти перегородки образуются за счет слияния брюшной и позвоночной подушек с образованием структур, в дальнейшем участвующих в формировании митрального и трехстворчатого клапанов. В области левого AV-отверстия на 6-й неделе внутриутробного развития уже образуются задняя и предсердная створки митрального клапана. Одновременно происходит образование мышечных внутрижелудочковых структур, которые являются прообразом сухожильных нитей и папиллярных мышц, благодаря чему на 7-й неделе внутриутробного развития происходит формирование первичного митрального клапана. На 3-м месяце внутриутробного развития створки AV-клапанов и волокна, отходящие от их свободных краев, имеют мышечную структуру. В дальнейшем мышечная ткань в створках клапанов, а также в участках трабекул, преобразующихся в сухожильные нити, замещается соединительной тканью. На 6-м месяце внутриутробного развития происходит окончательное формирование створок и сухожильных нитей из соединительной ткани. По свободным краям створок клапана со стороны предсердия в период новорожденности можно обнаружить небольшие узелки, являющиеся остатками первичных сердечных подушечек.
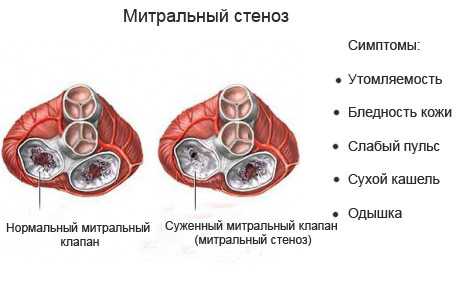
Кольцо митрального клапана формируется из фиброзного скелета сердца, который вначале состоит из переднемедиального и латерального фиброзных треугольников и связывающих их коллагеновых волокон. Фиброзная ткань образует переднюю половину или две трети кольца. Остальная часть кольца, соответствующая линии прикрепления задней створки, плохо дифференцирована. В этом месте фиброзное кольцо формируется за счет образования AV-борозды, которая окружает эмбриональную сердечную трубку. Отложение желеобразной ткани сердца вдоль эндокардиальной поверхности борозды и механическая нагрузка приводят к регрессии миоцитов и прерыванию мышечной связи между AV-отверстиями, за исключением области пучка Гиса.
Анатомия
К аномалиям, стенозирующим левое AV-отверстие, относятся:
1. Атрезия митрального клапана.
2. Дисплазия митрального клапана.
3. Аномалия строения створок митрального клапана.
4. Пороки структур, связанных с митральным клапаном:
-
клапанного кольца;
-
папиллярных мышц и сухожильных нитей;
-
надклапанной диафрагмы.
5. Удвоение митрального клапана.
Врожденные пороки митрального клапана могут входить в состав ряда синдромов. Синдром Shone включает в себя наличие парашютообразного митрального клапана, надклапанную диафрагму левого AV-отверстия, подклапанный стеноз аорты и коарктацию аорты. Синдром Bharati-Lev представляет собой врожденную многоклапанную дисплазию. Врожденный муковисцидоз приводит к нарушению структуры и функции створок клапана.
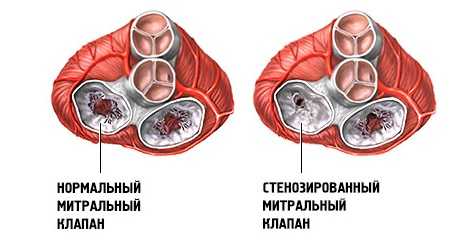
Надклапанное стенозирующее кольцо
Надклапанное кольцо образуется из соединительной ткани, которая происходит из предсердной поверхности створок митрального клапана и суживает вход в митральный клапан. Изолированное стенозирующее надклапанное кольцо встречается редко. В большинстве случаев оно сочетается с другими пороками, такими, как парашютообразный митральный клапан, субаортальный стеноз, коарктация аорты. Кольцо может быть приращено к передней створке митрального клапана и гемодинамически напоминает митральный стеноз. Подлежащий аппарат митрального клапана может быть как нормальным, так и аномальным. В отличие от трехпредсердного сердца, овальное окно и ушко левого предсердия располагается выше плоскости мембраны. Аномалия диагностируется с помощью двухмерной трансторакальной и чреспищеводной ЭхоКГ.
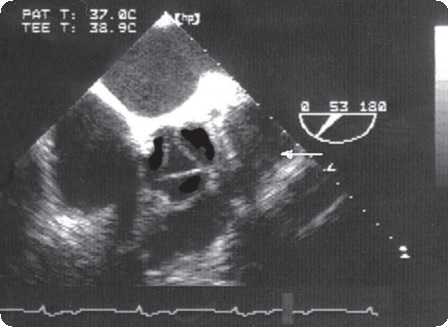
Гипоплазия и атрезия митрального клапана
Атрезия левого AV-отверстия обусловлена сращением его створок или полным его отсутствием. Она является частью одного из вариантов синдрома гипоплазии левых отделов сердца и одножелудочкового сердца.
Врожденный митральный стеноз можно классифицировать в зависимости от того, какой компонент митрального клапана аномален — створки, кольцо, хорды или папиллярные мышцы. Однако в большинстве случаев все компоненты клапанного аппарата патологически изменены.
Врожденный митральный стеноз представляет собой вариабельную комбинацию аномалий, включая утолщенный закругленный край створки, укороченные и утолщенные хорды, фиброзную облитерацию межхордальных пространств, аномальное прикрепление хорд, гипоплазию папиллярных мышц или их сращение. Наиболее частыми сопутствующими пороками являются коарктация аорты и стеноз аорты. Обычно имеется склероз эндокарда, но полость левого желудочка в большинстве случаев нормальная или умеренно уменьшена. Средняя выживаемость в одной из групп пациентов с этим пороком варьировала от 2 до 12 лет и не зависела от размера митрального отверстия или левого желудочка, а также от наличия осложняющих сопутствующих аномалий.
При этом варианте стеноза комиссуры плохо идентифицируются, хорды недоразвиты или полностью отсутствуют. Подвижность створок ограничена, а центральное отверстие митрального клапана значительно сужено. Сращение створок по комиссурам с небольшим по размеру отверстием, несколько смещенным от центра, может приводить к образованию воронкообразного клапана. Створки клапана грубые, их края деформированы, сухожильные нити укорочены, сращены или отсутствуют.
В наиболее тяжелых формах межхордальное пространство облитерировано избыточной тканью клапана и наростами. Иногда утолщенные хорды создают субаортальную обструкцию. Аномальные створки митрального клапана или прикрепление хорд к перегородке может вызвать сужение выводного тракта левого желудочка уже в раннем возрасте. Микроскопические исследования дополнительных створок клапана обнаруживают фиброзную ткань и миксоидную дисплазию. Сопутствующим пороком является частичный АВСД.
Удвоение митрального клапана
При этой аномалии дополнительный мостик ткани частично или полностью разделяет митральный клапан на два отверстия, которые открываются в левый желудочек.
Двойной клапан является случайной находкой при эхокардиографическом исследовании или во время операции и в половине случаев сопровождается стенозом или недостаточностью. Оба отверстия имеют одинаковые размеры в 15 % случаев. Чаще они имеют неравные размеры, меньшее из них расположено у переднелатеральной комиссуры или у заднемедиальной комиссуры. Встречается удвоение небольшого рудиментарного клапана или удвоение полностью развитого дополнительного клапана, когда невозможно определить, какой из клапанов является истинным. Рядом с истинным клапаном наблюдается самостоятельное дополнительное клапанное кольцо с независимыми створками и клапанным аппаратом даже при незначительных размерах или выраженной гипоплазии дополнительного клапана. Отверстие дополнительного клапана, гораздо меньших размеров, может располагаться в области задней или передней створки истинного клапана.
Выделяют 3 типа удвоения митрального клапана:
-
Дополнительный клапан расположен кзади от задней створки. Данный порок обычно сочетается с другими пороками сердца.
-
Дополнительный клапан расположен кпереди от передней створки. Может быть аномалией, не диагностированной при жизни, и позволяет прожить до глубокой старости без каких-либо клинических проявлений.
-
Существует два равнозначных митральных клапана, практически одинаковые по размерам. Данная аномалия в 50 % случаев сопутствует другим порокам сердца.
Обычно двойной митральный клапан находят при частичном АВСД в сочетании с митральной недостаточностью. Функциональный митральный стеноз более типичен для интактной AV-перегородки. Нередко двойной митральный клапан сочетается с коарктацией аорты.
При эксцентричном малом отверстии перемычка между двумя клапанами представлена нормальной клапанной тканью, и если её иссечь, обязательно возникнет ятрогенная митральная недостаточность.
Парашютный митральный клапан
При этой аномалии все хорды прикрепляются к единственной папиллярной мышце. Хорды обычно укорочены и утолщены. Вследствие облитерации межхордальных пространств образуется митральный стеноз. Анатомия сросшихся между собой папиллярных мышц очень вариабельна. Переднелатеральная и реже обе папиллярные мышцы могут полностью отсутствовать. Встречаются две различимые, но частично сросшиеся папиллярные мышцы. Расстояние между ними уменьшено.
Парашютный митральный клапан сочетается с надклапанным кольцом, подклапанным и клапанным аортальным стенозом, коарктацией аорты и может быть одним из компонентов анатомического синдрома Shone.
Без операции средняя продолжительность жизни больных составляет 10 лет и зависит в большей степени от объёма левого желудочка, чем от размера митрального клапана.
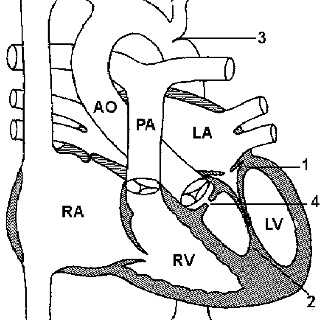
Митральная аркада или гамак
Редкая патология, при которой створки митрального клапана утолщены, хорды укорочены или вовсе отсутствуют. Створки непосредственно прикрепляются к папиллярным мышцам, что ограничивает подвижность митрального клапана, создавая стеноз и недостаточность. Вдоль свободного края одной или обеих створок простирается полоска фиброзной ткани, связывающая папиллярные мышцы. При укорочении и сращении сухожильных нитей удлиненные папиллярные мышцы непосредственно прикрепляются к створкам клапана. Они приобретают вид, напоминающий аркаду. Если обе папиллярные мышцы замещаются несколькими более мелкими мышцами, которые прикрепляются выше обычного места прикрепления, то створки клапана, даже правильной формы, со стороны полости левого предсердия принимают вид гамака.
Сопутствующие аномалии
Врожденный митральный стеноз встречается в сочетании с множеством пороков сердца, особенно часто с коарктацией аорты, достаточно редко, в нетяжелой форме — с d-ТМА. Относительно высока частота митрального стеноза у больных с отхождением обоих магистральных сосудов, особенно с подаортальной локализацией ДМЖП. Нависающие клапаны, или клапаны-наездники, иногда создают значительное сужение митрального клапана.
Врожденный стеноз створок митрального клапана
Врожденное изолированное сужение левого AV-отверстия без признаков гипоплазии левых отделов сердца — наиболее редкая аномалия, при которой створки клапана утолщены, малоподвижны, неправильной узловатой формы. Комиссуры клапана сращены или створки настолько деформированы, что комиссуры не идентифицируются. Иногда вместо одного суженного отверстия может быть несколько небольших отверстий, которые с трудом пропускают кровь из увеличенного левого предсердия. В отдельных случаях над или под клапаном имеются выраженные соединительнотканные образования, частично перекрывающие отверстие клапана.

Патофизиология
Функциональная обструкция митрального клапанного аппарата на любом уровне затрудняет легочный венозный кровоток из левого предсердия в левый желудочек. В результате повышается давление в левом предсердии, легочных венах и капиллярном русле. Согласно концепции Starling о транскапиллярном обмене жидкости, вода просачивается в интерстициальное альвеолярное пространство, если гидростатический градиент давления превышает онкотическое давление плазмы. Застойные бронхиальные ветви сдавливают бронхиолы, увеличивая сопротивление дыхательных путей. Эти и другие факторы отрицательно влияют на механические свойства легких и газообмен, что клинически проявляется увеличением дыхательных усилий, снижением РаО2, вызывая гипоксемию и гиперкапнию. Одновременно повышается давление в легочной артерии. Острое повышение давления в левом предсердии приводит к пассивному увеличению внутрисосудистого давления, растяжению сосудов и компенсаторному снижению ЛСС. Вслед за этим наступает гипоксическая легочная вазоконстрикция, развиваются легочная артериальная гипертензия и дисфункция правого желудочка как результат выраженных структурных изменений резистивных легочных сосудов.
Сопутствующее уменьшение объёма левого желудочка, ишемия, фиброз и ухудшение его функции способствуют снижению сердечного выброса. Падение сердечного выброса и несоответствие доставки кислорода потребностям организма приводят к нарушению обмена веществ, анаэробному метаболизму и системному ацидозу. Вследствие гипоперфузии почек развиваются почечная недостаточность, задержка жидкости и дисбаланс электролитов. В патогенез включаются гормональные факторы.
Клиника
Время появления клинических признаков стеноза митрального клапана зависит от степени обструкции, наличия и характера сопутствующих пороков, физического состояния и адекватности роста младенца. Обструкция митрального клапана заметно не нарушает кровообращение плода, даже при атрезии митрального клапана новорожденный нормально развит и при рождении отсутствуют признаки внутриутробной сердечной недостаточности.
Проявления выраженного стеноза обнаруживаются вскоре после рождения и связаны с закрытием артериального протока, снижением системного кровотока и возникновением дыхательной недостаточности из-за отёка легких. Младенцы с менее тяжелой обструкцией митрального клапана и легкими сопутствующими пороками поступают в клинику после неонатального периода, часто с предшествующей респираторной инфекцией и недостаточной прибавкой массы тела.
Другими признаками являются раздражительность, срыгивание при кормлении, профузная потливость, одышка и хронический кашель. Плохими прогностическими признаками являются ранний младенческий возраст, малый сердечный выброс и правожелудочковая недостаточность.
При тяжелом стенозе отмечаются признаки сниженной периферический перфузии и слабый пульс. При наличии легочной гипертензии увеличен предсердечный толчок правого желудочка. Первый тон сердца ослаблен, тон открытия митрального клапана обычно отсутствует из-за малоподвижности створок клапана. Второй тон сердца расщеплен в большей или меньшей степени, легочный компонент акцентуирован при наличии легочной гипертензии. Хотя обструкция притока должна препятствовать наполнению желудочка, III и IV сердечные тоны могут выслушиваться. На верхушке определяется низкочастотный негромкий средне-диастолический шум, часто с пресистолическим усилением. Интенсивность шума может уменьшиться и даже полностью исчезнуть при значительном сниженном сердечном выбросе.
Дополнительные шумы генерируются митральной недостаточностью, регургитацией на клапане легочной артерии и сопутствующими пороками.
Электрокардиография
На ЭКГ определяются признаки расширения левого предсердия с широко расщепленным зубцом Р во II отведении и направленный книзу зубец Р в передних отведениях. Расширение правого желудочка и предсердия свидетельствует о тяжелом стенозе и легочной гипертензии. Ось QRS отклонена вправо, преобладание левого желудочка может отсутствовать. Однако эти признаки могут варьировать в зависимости от сопутствующих пороков и развития левого желудочка. При расширении левого предсердия и гипертензии амбулаторные электрокардиографические исследования могут выявить предсердные аритмии.
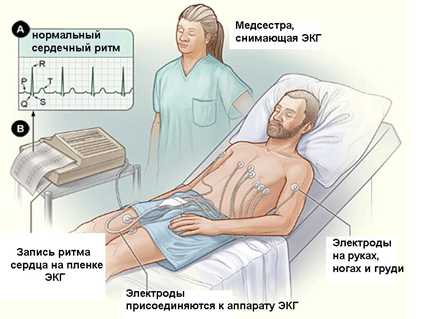
Рентгенография
На рентгенограмме отмечается расширение левого предсердия по наличию двойного контура и оттеснению кверху левого главного бронха в переднезадней проекции, расширение легочных вен и правых отделов сердца.
Эхокардиография
Одномерная ЭхоКГ более не используется исключительно для постановки диагноза, но может быть полезной. Она позволяет оценить открытие митрального клапана, снижение D-Е-экскурсии и наклон Е-F, аномальное диастолическое движение передней створки, увеличение размеров левого предсердия и уменьшение размеров левого желудочка.
Двухмерная и цветная доплер-эхокардиография может детализировать большинство анатомических и функциональных признаков митрального стеноза и, что особенно важно, исключить легочную венозную и надклапанную обструкцию.
Парастернальный доступ по длинной оси позволяет оценить подвижность створок клапана, длину хорд и их прикрепление. Выводной тракт левого желудочка также хорошо виден. Аномалии клапанного кольца и наличие надклапанного митрального стенозирующего кольца можно идентифицировать по парастернальной длинной оси и из четырехкамерного доступа. При тяжелом митральном стенозе важно диагностировать тромбоз левых отделов сердца. Парастернальный и субкостальный доступы по короткой оси хорошо демонстрируют удвоение митрального клапана и аномалии папиллярных мышц.
При цветной допплерографии обнаруживается турбулентный антеградный диастолический ток в левый желудочек. Она может показать локализацию уровня стеноза и оценить выраженность сопутствующей митральной недостаточности. При этом можно оценить другие внутрисердечные пороки. Смещение вправо межпредсердной перегородки и овального окна свидетельствуют о повышении давления в левом предсердии. С некоторыми ограничениями можно количественно оценить объём регургитации и степень сужения клапана.
В отдельных случаях показана чреспищеводная ЭхоКГ. Это особенно касается взрослых или послеоперационных пациентов, у которых наружный доступ ограничен. Исследования могут выполняться в лаборатории катетеризации, послеоперационном отделении, во время операции и в амбулаторных условиях у старших пациентов. Интраоперационная ЭхоКГ — важный метод для оценки устранения митрального стеноза и остаточной регургитации. Эпикардиальное исследование может быть выполнено с отличным качеством при отсутствии пищеводного датчика или у очень маленьких детей. Однако это исследование проводится в хирургическом поле. Преимущества чреспищеводных исследований состоят в возможности получения отличного изображения межпредсердной перегородки, AV-клапанов с хордальным аппаратом и в отсутствии необходимости внедряться в операционное поле.
Катетеризация сердца
Газы крови отражают умеренную системную десатурацию и гиперкапнию у пациентов с отёком легких. При тяжелом стенозе оксиметрия позволяет диагностировать лево-правый шунт на предсердном уровне через открытое овальное окно. Катетеризация дает возможность произвести прямое измерение давления в легочной артерии и в капиллярном русле и рассчитать ЛСС. Одновременная запись давления в легочном капиллярном русле и левом желудочке демонстрирует увеличенную левопредсердную волну А, волну V, среднее давление и диастолический градиент давления между левыми предсердием и желудочком. Следует отметить, что обструкция легочных вен, трехпредсердное сердце и надклапанное стенозирующее кольцо могут имитировать митральный стеноз и сосуществовать с патологией митрального клапана. Сочетание пороков должно быть предварительно диагностировано неинвазивными методами. Оценка природы и тяжести легочной гипертензии усложняется при митральном стенозе. Наличие диастолического градиента давления между легочной артерией и средним давлением заклинивания капиллярного ложа свидетельствует о вазоконстрикции или обструктивных изменениях легочных артериальных сосудов. Ингаляция кислорода или легочных вазодилататоров может разрешить эту дилемму. Однако иногда требуется открытая биопсия легкого, чтобы определить выраженность легочной сосудистой патологии и оценить прогноз. Наконец, если имеется подозрение на обструкцию легочных вен, необходимо сравнить давление заклинивания и давление в левом предсердии.
Киноангиокардиография с контрастированием
Киноангиокардиография с контрастированием легочной артерии или левого желудочка в правой передней косой проекции демонстрирует утолщение и ограниченную подвижность створок митрального клапана при изолированном стенозе или диастолический дефект заполнения левого желудочка в виде часового стекла, характерный для парашютообразного митрального клапана. Ангиография четко выявляет митральную недостаточность. Левая вентрикулография демонстрирует анатомию выводного тракта левого желудочка.
В редких случаях атрезии митрального клапана с нормально развитым левым желудочком и аортальным клапаном необходимо селективное контрастирование левого предсердия для уточнения диагноза и выполнения баллонной или ножевой атриосептостомии в целях декомпрессии левого предсердия.
Медикаментозное лечение
Ведение младенцев и детей с невыраженным и умеренным митральным стенозом включает обычную терапию сердечной недостаточности и наблюдение за возможными осложнениями, такими, как респираторная инфекция, эндокардит, мерцательная аритмия с угрозой эмболий. При отсутствии дисфункции правого и левого желудочков назначение дигоксина при сердечной недостаточности неэффективно, поскольку повышение давления в левом предсердии обусловлено механической обструкцией. Диуретики могут уменьшить легочный венозный застой, однако следует избегать чрезмерного диуреза, поскольку это может уменьшить выброс левого желудочка из-за снижения преднагрузки. Если сердечная недостаточность устойчива к медикаментозному лечению, необходимо хирургическое устранение обструкции. Даже в случае временной стабилизации состояния ребенка терапевтическое лечение необходимо рассматривать исключительно как подготовку к хирургической коррекции порока. В литературе есть сообщения о единичных случаях успешной баллонной ангиопластики митрального стеноза ревматического или врожденного происхождения. Однако опыт применения этого метода у младенцев и детей ограничен. В настоящее время все усилия должны быть направлены на оптимальную медикаментозную терапию и сохранение естественного митрального клапана при хирургическом вмешательстве.
Хирургическое лечение
При сочетании порока митрального клапана с другими пороками сердца хирургическая тактика должна основываться на наиболее рациональном плане коррекции порока. При умеренно выраженной клинике порока митрального клапана и при наличии других пороков предложено использовать поэтапную коррекцию, например: устранить хирургическим путем или с помощью катетерной технологии коарктацию аорты, ОАП, клапанный или надклапанный стеноз аорты. Улучшение состояния ребенка после такой коррекции позволяет отсрочить оперативное вмешательство по поводу митрального стеноза. Взвешенные показания и время вмешательства являются важной составляющей хирургической тактики.
Вмешательства на митральном клапане целесообразнее выполнять в старшем возрасте, если позволяет состояние ребенка. Отсрочка дает возможность качественнее произвести реконструкцию митрального клапана в большем сердце или выполнить имплантацию протеза большего размера. Рекомендуется сохранить собственный клапан в период максимального роста ребенка, несмотря на остаточную умеренную некомпетентность митрального клапана после пластики.
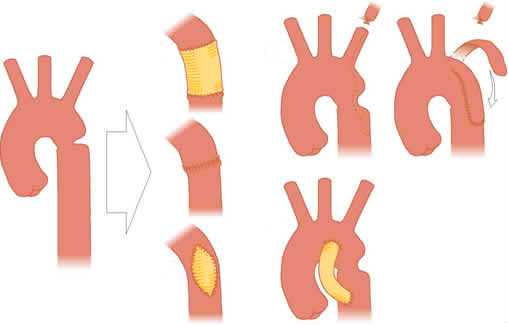
Имплантация митрального клапана в детском возрасте имеет больше отрицательных последствий, чем положительных. Наиболее весомым аргументом против ранних протезирований является необходимость замены протезов по мере увеличения массы тела. Кроме того, постоянный прием ребенком антикоагулянтов создает не меньшую проблему, чем сам искусственный клапан.
Хирургическое лечение врожденного митрального стеноза улучшилось с тех пор, как стала более ясной анатомия и функция клапана. Отрицательная динамика вторичных изменений и функции левого желудочка, легочной гипертензии и легочной функции является показанием для хирургического вмешательства. До настоящего времени мало известно о легочной гипертензии у детей с врожденным митральным стенозом и возможности её уменьшения после длительного естественного течения.
За редкими исключениями, ранние серии вмешательств в 1970-х годах сопровождались неудовлетворительными результатами реконструкции или протезирования у детей в возрасте до 1 года. В последнее время накопление опыта клапансохраняющих операций у детей позволило улучшить результаты вальвулопластики и в более старшем возрасте — протезирования клапана. Несмотря на улучшение выживаемости, к 8-му году после операции отсутствие необходимости в повторном вмешательстве составило только 58%. Митральная вальвулопластика остается паллиативным вмешательством в большинстве случаев. Появление на рынке маленьких низкопрофильных протезов обеспечило возможность раннего протезирования с меньшей обструкцией выводного тракта у отдельных младенцев, состояние которых требует замены клапана при неудавшейся попытке его коррекции. Малый диаметр клапанного кольца вынуждает имплантировать клапан в супраанулярную позицию.
Carpentier разделили пациентов с врожденной патологией митрального клапана на две группы: с недостаточностью и стенозом. Методика реконструкции клапана, разработанная Carpentier и основанная на четырех принципах, революционизировала хирургию патологии митрального клапана. Эта техника предусматривает:
-
ремоделирование кольца;
-
резекцию и шовную пластику створок;
-
укорочение хорд;
-
фенестрацию хордальных сращений.
Коррекция надклапанного стенозирующего кольца
Операция включает иссечение мембраны и коррекцию сопутствующей патологии митрального клапана. Иногда мембрана настолько приращена к створкам, что безальтернативным методом остаётся протезирование. Наличие нормального подлежащего митрального клапана дает отличный результат вмешательства.
Врожденный митральный стеноз
Оптимальный возраст пациента для коррекции этой патологии — около 3 лет, хотя операции выполнялись и в более раннем возрасте. Во время операции следует стремиться получить отверстие, соответствующее среднему нормальному размеру митрального клапана для данной поверхности тела пациента. Поскольку врожденный митральный стеноз создается различными компонентами клапанного аппарата, важно учесть, являются ли папиллярные мышцы нормальными или патологически уменьшенными.
Нормальные папиллярные мышцы
При гипоплазии клапанного кольца сам клапан может выглядеть нормальным. Компоненты клапана и желудочек могут быть гипоплазированными, что затрудняет хирургическую коррекцию. В этих случаях следует выбрать один из двух возможных вариантов: или клапанный кондуит между левым предсердием и левым желудочком или модифицированную операцию Norwood I как первый этап гемодинамической коррекции по Fontan.
При сращении комиссур клапана они обычно слабо дифференцируются, а хорды отсутствуют или плохо развиты. Этот тип сужения устраняют с помощью комиссуротомии и фенестрации папиллярных мышц с удалением вторичных хорд. Хирург обязан тщательно оценить клапанный аппарат в области комиссур, так как при врожденном сужении гораздо чаще, чем при приобретенном стенозе, существует вероятность повреждения аномально прикрепленной сухожильной нити или папиллярной мышцы при укорочении хорды. Эффективная комиссуротомия увеличивает переднюю створку митрального клапана и не нарушает смыкание створок без необходимости реимплантации сухожильных нитей. Врожденное сужение митрального клапана часто сопровождается патологией подклапанного аппарата, в этом случае требуется одновременное расщепление папиллярных мышц.
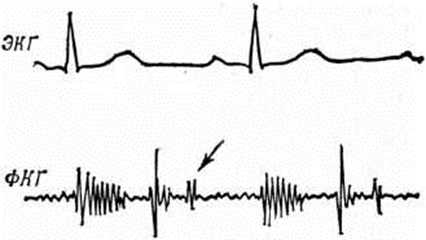
Необходимость протезирования клапана возникает редко.
У пациентов с избыточной тканью клапана межхордальные пространства частично или полностью облитерированы. Операция предусматривает иссечение лишних тканей между хордами.
При удвоении митрального клапана с наличием фиброзного моста между передней и задней митральными створками имеются два равных клапанных отверстия. Если суммарная площадь двойного клапана мала, может потребоваться резекция мостика, разделяющего два отверстия. При истинном удвоении митрального клапана с неравными отверстиями разделять мостик между ними нецелесообразно из-за риска развития ятрогенной митральной недостаточности.
Аномальные папиллярные мышцы
Эта группа включает три различных варианта врожденного митрального стеноза: парашютообразный митральный клапан с единственной папиллярной мышцей, аркаду митрального клапана с множеством папиллярных мышц и отсутствие папиллярных мышц.
При парашютообразном клапане расщепляют папиллярную мышцу и фенестрируют облитери- рованные межхордальные пространства. Операция часто включает коррекцию сопутствующей обструкции выводного тракта левого желудочка, аортального стеноза и коарктации аорты. Хирургическая летальность зависит от тяжести патологии.
При митральной аркаде стеноз образован переплетением хорд и папиллярных мышц, которые заполняют пространство под задней створкой. Такие клапаны часто некомпетентны. Коррекция этого варианта наиболее сложна и, как правило, требует протезирования клапана.
Отсутствие папиллярных мышц как вариант патологии митрального клапана означает прямое прикрепление хорд к стенкам желудочка. При этом межхордальные пространства часто недостаточны. Единственным методом лечения является протезирование клапана.
Результаты хирургического лечения
Хирургическое лечение врожденного митрального стеноза у детей, как показали отдаленные результаты, представленные многими авторами, носит паллиативный характер. В одном из последних обзоров авторы сообщают о клиническом опыте лечения 72 больных, у 13 из которых был изолированный митральный стеноз и у 59 он сочетался с другими пороками сердца. Этапному лечению подвергнуты 23 пациента, одноэтапному —26. Ранняя летальность составила 12,5%. Факторами риска были обструкция выводного тракта левого желудочка и этапные вмешательства. В отдаленном периоде умерли 8 пациентов. В повторных операциях нуждались 24 больных. Десяти пациентам, в том числе оперированным повторно, произведено протезирование клапана. К 15-му году после операции оставались живы 69,6% пациентов, не нуждались в повторных операциях 70,8%, не требовалось протезирование клапана 69,6% пациентам.
Некоторые хирурги являются приверженцами раннего протезирования клапана и размещения его в супраанулярную позицию, однако результаты такого вмешательства неудовлетворительны.
Проблемами отдаленного периода являются остаточный митральный стеноз, недостаточность митрального клапана, легочная артериальная гипертензия, левожелудочковая недостаточность, обструкция системного выводного тракта, недостаточность аортального клапана и мерцательная аритмия или трепетание предсердий.
doctoroff.ru
Клапаны обратные КО, КОп, АЗЕ 034, клапаны лепестковые КЛ, КЛС
| Цена | от 1 435,00 pуб. с НДС |
| Гарантийный срок | 12 месяцев |
| Условия доставки | Доставка по РФ и ЕАЭС, либо самовывоз |
| Способы оплаты | Безналичный платеж на РС организации |
Клапаны обратные круглые и прямоугольные
Клапаны обратные общего назначения служат для предотвращения перетекания воздуха через воздуховоды при остановленном вентиляторе.
Кроме того, клапаны с регулируемыми упорами, можно использовать для регулирования подачи воздуха в вентиляционных установках. Обратные клапаны изготавливаются круглыми (КО) и прямоугольными (КОп) по сериям 5.904-41 и 1.494-28. Основное отличие между данными сериями длина клапана.
Клапаны могут быть установлены как в вертикальном, так и в горизонтальном участке воздуховода. При установке клапана в вертикальном воздуховоде поток воздуха должен быть направлен снизу вверх. Установка клапанов в сети допускается при скоростях воздуха на горизонтальных участках 6м/с и на вертикальных 4м/с.
Клапаны применяются в системах кондиционирования воздуха и вентиляции промышленных и общественных зданий при температуре окружающей среды от - 40ºС до +70ºС.
Компания «Эпсилон» изготавливает обратные клапаны в полном соответствии с требованиями нормативной документации, код ОКП 48 6300, что подтверждается сертификатом РОСС RU.АГ66.Н03402.
Габаритные размеры прямоугольных обратных клапанов КОп
 |
Тип
Н, мм
L, мм
С,мм
5.904-41
C, мм
1.494-28
m, кг
|||||
| КОп-00 | 150 | 150 | 50 | 150 | 2,5 |
| КОп-01 | 200 | 200 | 50 | 160 | 3,17 |
| КОп-02 | 250 | 250 | 50 | 160 | 3,88 |
| КОп-03 | 400 | 400 | 50 | 170 | 7,5 |
| КОп-04 | 500 | 500 | 50 | 170 | 8,59 |
| КОп-05 | 800 | 800 | 64 | 200 | 16,05 |
| КОп-06 | 1000 | 1000 | 72 | 200 | 23,5 |
Габаритные размеры круглых обратных клапанов КО
| Тип D, мм С, мм 5.904-41 C, мм 1.494-28 m, кг | ||||
| КО-00 | 250 | 50 | 235 | 5,5 |
| КО-01 | 315 | 50 | 300 | 7,54 |
| КО-02 | 400 | 50 | 385 | 10,39 |
| КО-03 | 500 | 50 | 485 | 16,7 |
| КО-04 | 630 | 50 | 580 | 21,0 |
| КО-05 | 800 | 50 | 615 | 30,0 |
| КО-06 | 1000 | 64 | 615 | 37,0 |
| КО-07 | 1250 | 64 | 615 | 45,5 |
Обратный клапан АЗЕ 034
Самооткрывающиеся клапаны АЗЕ 034 используются для установки на всасывающей стороне крышных вентиляторов ВКР с целью предотвращения попадания холодного воздуха и атмосферных осадков в производственные помещения после отключения вентиляторов.
Самооткрывающийся клапан АЗЕ 034 представляет собой цилиндрическую обечайку, в которой эксцентрично установлена створка, свободно поворачивающаяся на осях и уравновешенная противовесом. Створка клапана открывается потоком воздуха и закрывается под воздействием собственного веса при неработающем вентиляторе ВКР. Клапаны АЗЕ 034 применяются в системах кондиционирования воздуха и вентиляции промышленных и общественных зданий при температуре окружающей среды от - 40ºС до +70ºС.
| АЗЕ 034.000 | 403 | 430 | 460 | 250 | 8х12 | 10 | 7 |
| АЗЕ 034.000-01 | 503 | 530 | 560 | 280 | 9,5 | ||
| АЗЕ 034.000-02 | 633 | 660 | 690 | 330 | 10х15 | 12 | 14,3 |
| АЗЕ 034.000-03 | 805 | 840 | 880 | 390 | 24 |
Клапан обратный лепестковый КЛ
Клапан лепестковый КЛ предназначен для установки на нагнетательной стороне осевых вентиляторов ВО 06-300 № 4-12,5 с целью предотвращения попадания холодного воздуха и атмосферных осадков в производственные помещения после отключения вентилятора.
Конструкция лепесткового клапана КЛ по серии 1.494-33 представляет собой корпус, в подшипниках которого на осях закреплены лопатки. Назначение подшипников – обеспечить свободное открывание клапана в условиях отрицательных наружных температур при периодической работе вентиляторов. При включенном вентиляторе под воздействием воздушного потока лопатки поддерживаются в открытом положении. После отключения вентилятора лопатки возвращаются в исходное положение и перекрывают сечение клапана. Оси лопаток смещены относительно оси симметрии, что значительно снижает величину момента, необходимого для их открывания.
Минимальный динамический напор, при котором работает лепестковый клапан, составляет 30-40 Па.
С целью уменьшения ширины клапана вместо перехода с круглого сечения вентилятора на прямоугольное сечение клапана предусмотрена переходная диафрагма.
| КЛ.00.000 | 403 | 469 | 247 | 403 | 430 | 8 | 7х14 | 13,4 |
| КЛ.00.000-01 | 503 | 563 | 287 | 503 | 530 | 16 | 7х14 | 17,5 |
| КЛ.00.000-02 | 633 | 699 | 357 | 633 | 660 | 16 | 7х14 | 24,1 |
| КЛ.00.000-03 | 805 | 871 | 332 | 805 | 830 | 16 | 10 | 33,5 |
| КЛ.00.000-04 | 1008 | 1076 | 392 | 1006 | 1035 | 16 | 12 | 43,4 |
| КЛ.00.000-05 | 1260 | 1328 | 497 | 1258 | 1285 | 24 | 12 | 61,7 |
Клапан обратный лепестковый КЛС
Клапаны лепестковые самооткрывающиеся КЛС применяются на всасывающей стороне крышных вентиляторов с целью предотвращения попадания холодного воздуха и атмосферных осадков в производственные помещения после отключения вентиляторов.
Самооткрывающийся клапан КЛС представляет собой цилиндрическую обечайку, в которой установлены две створки (лепестки), свободно поворачивающиеся на осях. Лепестки клапана открываются потоком воздуха и закрывается под воздействием собственного веса при неработающем вентиляторе. Клапаны КЛС применяются в системах кондиционирования воздуха и вентиляции промышленных и общественных зданий при температуре окружающей среды от - 40ºС до +70ºС.
| КЛС 00.000 | 403 | 430 | 460 | 250 | 8х12 | 10 | 7 |
| КЛС 00.000-01 | 503 | 530 | 560 | 280 | 9,5 | ||
| КЛС 00.000-02 | 633 | 660 | 690 | 330 | 10х15 | 12 | 14,3 |
| КЛС 00.000-03 | 805 | 840 | 880 | 390 | 24 |
eng-e.com
Клапаны вентиляционные утепленные КВУ и КУС
| Цена | от 6 977,00 pуб. с НДС |
| Гарантийный срок | 12 месяцев |
| Условия доставки | Доставка по РФ и ЕАЭС, либо самовывоз |
| Способы оплаты | Безналичный платеж на РС организации |
Клапан вентиляционный утепленный КВУ
Клапаны КВУ воздушные утепленные — детали систем вентиляции и кондиционирования. Их назначение заключается в заборе наружного воздуха.
Корпус клапана изготавливается из окрашенной стали. В корпус вмонтированы поворотные лопатки. Движение лопаток для открытия и закрытия клапана происходит за счет электро- или ручного привода.
Клапаны КВУ в точках стыка поворотных лопаток оснащены трубчатыми электронагревателями (ТЭНами), которые разогревают стыки в моменты примерзания. Оптимальное время прогрева ТЭНов — 15-20 минут до того, как сам клапан будет открыт.
Функция клапана КВУ состоит в регулировании воздушного и газового потока, в котором содержание примесей, липких и волокнистых веществ не превышает 100 мг/м3. Применяется клапан КВУ в вентиляционных система с низким давлением до 1470 Па.
Компания «Эпсилон» изготавливает утепленные вентиляционные клапаны в полном соответствии с требованиями нормативной документации, код ОКП 48 6300, что подтверждается сертификатом РОСС RU.АГ66.Н03402.
Клапан КВУ состоит из: 1-корпус; 2-лопатка; 3-тяга и рычаги; 4-ТЭН; 5-электропривод.
| КВУ 400*500 | 500 | 540 | 400 | 440 | 3 | 1,2 | 27,4 | 6 977,00 |
| КВУ 600*500 | 600 | 640 | 4 | 1,6 | 31,8 | 9 443,00 | ||
| КВУ 600*1000 | 1000 | 1040 | 600 | 640 | 4 | 1,6 | 43,2 | 12 596,00 |
| КВУ 800*1000 | 800 | 840 | 5 | 2 | 54,3 | 16 023,00 | ||
| КВУ 1000*1000 | 1000 | 1040 | 6 | 2,4 | 65,3 | 19 448,00 | ||
| КВУ 1200*1000 | 1180 | 1220 | 7 | 2,8 | 74,5 | 22 874,00 | ||
| КВУ 1400*1000 | 1380 | 1420 | 8 | 3,2 | 83,7 | 26 302,00 | ||
| КВУ 1600*1000 | 1560 | 1600 | 9 | 3,6 | 92,8 | 29 757,00 | ||
| КВУ 1800*1000 | 1755 | 1795 | 10 | 4 | 112,3 | 33 156,00 | ||
| КВУ 2400*1000 | 2400 | 2440 | 13 | 5,2 | 169,7 | 43 433,00 | ||
| КВУ 600*1400 | 1400 | 1440 | 600 | 640 | 4 | 1,6 | 45,8 | 14 014,00 |
| КВУ 1400*1400 | 1380 | 1420 | 8 | 3,2 | 112,3 | 27 346,00 | ||
| КВУ 1600*1400 | 1560 | 1600 | 9 | 3,6 | 120,7 | 30 679,00 | ||
| КВУ 1800*1400 | 1755 | 1795 | 10 | 4 | 129,1 | 34 011,00 | ||
| КВУ 2400*1400 | 2400 | 2440 | 13 | 5 | 169,7 | 44 009,00 |
- Указаны розничные цены в рублях за 1 шт. с учетом НДС 18%, скидки предоставляются исходя из объема закупки.
Клапан утепленный одностворчатый КУС 1
Клапаны КУС утепленные створные предназначены для временного отключения одной из приточных систем, работающих на общем воздухозаборе, клапаны КУС изготавливаются по серии 5.904-74.93.
Применяются клапаны КУС в системах кондиционирования воздуха и вентиляции промышленных и общественных зданий при температуре окружающей среды от - 40ºС до +70ºС.
| КУС 1.00.00 | КУС-1 | 610 | 510 | 585 | 485 | 20 | 5 857,00 |
| КУС 1.00.00-1 | КУС-2 | 735 | 635 | 23 | 6 325,00 | ||
| КУС 1.00.00-2 | КУС-3 | 880 | 780 | 26 | 6 732,00 | ||
| КУС 1.00.00-3 | КУС-4 | 985 | 885 | 29,5 | 7 219,00 | ||
| КУС 1.00.00-4 | КУС-5 | 610 | 510 | 1085 | 985 | 33,5 | 7 813,00 |
| КУС 1.00.00-5 | КУС-6 | 735 | 635 | 37 | 8 451,00 | ||
| КУС 1.00.00-6 | КУС-7 | 860 | 760 | 43 | 9 056,00 | ||
| КУС 1.00.00-7 | КУС-8 | 985 | 885 | 47 | 9 677,00 | ||
| КУС 1.00.00-8 | КУС-9 | 610 | 510 | 1565 | 1465 | 49 | 9 423,00 |
| КУС 1.00.00-9 | КУС-10 | 735 | 635 | 52 | 10 198,00 | ||
| КУС 1.00.00-10 | КУС-11 | 860 | 760 | 62 | 11 009,00 | ||
| КУС 1.00.00-11 | КУС-12 | 985 | 885 | 67 | 11 818,00 |
- Указаны розничные цены в рублях за 1 шт. с учетом НДС 18%, скидки предоставляются исходя из объема закупки.
eng-e.com
общие сведения, описание некоторых видов
Паразитизм в мире насекомых – явление до сих пор окончательно неизученное.
Parasitica или наездники – обширное семейство, насчитывающее до 100 тысяч видов.
Отличительной его чертой является паразитирование личинок на других насекомых.
Особенности
Размеры взрослых особей от 2 миллиметров до 4 и больше сантиметров. Брюшко удлинённой формы, у самок имеющее длинный яйцеклад (иногда до 17 сантиметров). Головные усики также удлинённые. Крылья у большинства представителей хорошо развиты.
После спаривания самки откладывают яйца непосредственно на тело будущего хозяина. Иногда в тело или рядом с насекомым-жертвой. Одни личинки избирательны в выборе хозяина, другие паразитируют на различных насекомых. Гибель хозяина наступает перед окукливанием, реже после весеннего пробуждения. Наездник впрыскивает в тело жертвы особые вирусы для подчинения иммунной системы. И при этом старательно обеспечивает себя свежей пищей.
Жизнеспособность хозяина сохраняется, даже если от массы его внутренних органов остаётся целой всего лишь десятая часть.Пищей служат гусеницы, жуки, муравьи, осы. Реже пауки и скорпионы. Есть виды, паразитирующие на мухах-тахинах. Это, так называемое, вторичное паразитирование.
Взрослые наездники активны в ночное время и очень чувствительны к влажности воздуха. Предпочитают селиться у водоёмов. Здесь их можно встретить на цветущих травах. Популяция резко увеличивается в дождливое лето.
Средняя продолжительность жизни взрослых особей от трёх до десяти месяцев (в случае зимовки во взрослой стадии).
Разновидности
Бракониды
Три вида представителей Braconidae встречается на всех континентах. Всего биологами описано более 15 тысяч видов. Бракониды успешно используются человеком в борьбе с  сельскохозяйственными вредителями. Питаются гусеницами бабочек листовёрток и амбарной огнёвки (повреждающей муку, зерно, сухофрукты, кондитерские изделия, пряности т.п.)
сельскохозяйственными вредителями. Питаются гусеницами бабочек листовёрток и амбарной огнёвки (повреждающей муку, зерно, сухофрукты, кондитерские изделия, пряности т.п.)
Окрас взрослой особи тёмно-коричневый с жёлтыми и чёрными вкраплениями. Длина тела 2,5 сантиметра. Яйцеклад у самок относительно небольшой (немного короче брюшка).
Яйца откладываются на гусениц в количестве 20 штук. Перед кладкой гусеница парализуется ядом. Личинки появляются через двенадцать часов. Активно поглощая гусеницу, они проходят все этапы развития за пять дней. Стадия окукливания длится четыре дня. Взрослые особи имеют разную продолжительность жизни. Самцы живут десять дней. Самки месяц.
Трихограмма
Trichogramma – ещё одно полезное для человека семейство наездников. В мире насчитывается 200 видов трихограмм.
Размеры взрослых особей до 1 миллиметра. Окрас чёрный или бурый. Тело плотное, голова с короткими усиками. Личинки паразитируют в яйцах листовёрток, пядениц, шелкопряда и капустной совки.
В яйцо насекомого-хозяина откладывается до четырёх яиц. Окукливание происходит в теле уже мёртвого носителя (на стадии личинки).
Этот наездник чрезвычайно полезен для сельского хозяйства. Взрослых особей выпускают на гектар, исходя из строгого расчёта (до 50 тысяч). Происходит это во время кладки вредителями яиц. Паразитируют трихограммы более чем на семидесяти видах вредителей сельскохозяйственных культур.
Дрииниды
Dryinidae – небольшие осы-паразиты, встречающиеся повсеместно. Хорошо переносят низкие температуры. Некоторые виды обитают в северных регионах Европы. Всего известно 48 родов этих насекомых.
Взрослые особи имеют тёмный окрас. Тело стройное с узким брюшком и длинными ногами. У самок нет крыльев, они похожи на крупных муравьёв. Размеры от 2 миллиметров до сантиметра.
Перед кладкой яиц самка парализует жертву лишь на некоторое время. Впоследствии заражённые личинки продолжают двигаться и развиваться.
Дрииниды питаются равнокрылыми (вредителями сельскохозяйственных культур) и представителями семейства цикад.
Chrysididae
Chrysididae паразитируют на пчёлах и осах. В мире насчитывается 3 тысячи видов этих наездников.
Отличаются яркой окраской тела. Встречаются красные, зелёные и синие расцветки. Тело гладкое, блестящее. Отсюда и втрое название – оса-блестянка.
Селится в земляных норах. Размер взрослой особи 1,5 сантиметра. Брюшко вогнутое. У самок яйцеклад тонкий и втягивается внутрь брюшка. Благодаря этому насекомое может с лёгкостью просовывать его в труднодоступные места вроде щелей в ульях. Наносит ощутимый вред пасекам. Заражённые личинками молодые пчёлы гибнут.
Имеется жало, как у настоящей осы. Блестянка способна болезненно укусить. Однако укус не опасен для человека.Чаще при испуге насекомое просто сворачивается в тугой шарик и замирает.
Оруссиды
Orussidae живут преимущественно в хвойных лесах. Паразитируют на древесных жуках. Во всём мире обитает восемьдесят видов оруссидов. В Европе встречаются представители семи видов.
Размер взрослой особи достигает 1,5 сантиметра. Туловище чёрное с ярко-оранжевым брюшком и хорошо развитыми парными крыльями. У самок яйцеклад втягивается внутрь брюшка.
Яйца откладываются на ослабленных личинок рогохвостов, усачей и златок. Уничтожив хозяина, личинка зимует в древесных ходах, пропиленных личинками жуков. Окукливается в начале лета. Вскоре из куколок появляются взрослые особи, которые прогрызают древесину и выходят наружу в поисках пары. После спаривания самка ползает по коре деревьев в поисках будущей кормовой базы для потомства. Отыскав личинки жуков, она откладывает в них яйца сквозь естественные трещины в коре.
Эфиальт
Dolichomitus imperator является самым крупным видом наездников в Европе.
Взрослые особи достигают в длину 3 сантиметров. Тело блестящее, чёрное, с мелкими белыми пятнами. Ноги красноватого оттенка. Самок отличает огромных размеров яйцеклад (примерно в два раза длиннее брюшка). Питаются нектаром и соком древесных растений.
Личинки эфиальта паразитируют на личинках жуков усачей и златок (вредителей сосны). Самка способна отыскать будущих носителей на глубине до четырёх сантиметров. Чтобы добраться до них, она сверлит кору дерева прочным яйцекладом. Процедура сверления занимает несколько часов. При этом насекомое корректирует, если это необходимо, своё положение относительно личинки жука. Яйцо помещается непосредственно в тело парализованной жертвы.
Один из самых опасных видов мух — муха цеце. Она переносит сонную болезнь, которая практически неизлечима.Слепни переносят возбудителей таких опасных болезней как полиомиелита и сибирской язвы. Как выглядит паразит, смотрите в этой статье.
Рыжий лесной муравей — один из самых распространенных видов в России. О других муравьях, которых можно встретить на территории России, читайте по http://stopvreditel.ru/doma/muravi-rossii.html ссылке.
Megarhyssa perlata
Megarhyssa perlata – редкий вид наездников, занесённый в Красную книгу. На территории России встречается по всей лесной зоне.
Размер взрослых особей 4,5 сантиметра. Тело ярко-оранжевое. На удлинённом брюшке располагаются чёрно-белые полосы. Головные усики длинные и светлые. У самок имеется длинный жёсткий яйцеклад, превышающий длину брюшка примерно в два раза. Питаются взрослые особи нектаром цветков.
Личинки паразитируют на вредителях лиственных пород деревьев – рогохвостах. Самка откладывает яйца в ходы, проточенные вредителями, предварительно просверлив кору яйцекладом. Вышедшая из яйца личинка ведёт себя активно. Передвигаясь по ходам, она отыскивает хозяина и прикрепляется к его телу.
Живёт на поверхности тела хозяина как эктопаразит.Польза и вред
Очевидно, что представители семейства наездников приносят человеку скорее пользу, чем вред.
Защита полей и продуктовых складов с помощью этих насекомых позволяет избежать применения инсектицидов или значительно сократить количество ядов, что делает продукцию экологически чистой.
Страшно представить, во что превратились бы леса, ежегодно подвергаемые нашествию самых разнообразных гусениц и жуков короедов, не будь в этих лесах естественных санитаров-наездников.
Для людей наездники опасности не представляют. Исключением может стать случайный укус видов, похожих на ос, имеющих жала. Но яд этот не опасен для человеческого организма, хотя укус и будет болезненным.
Одно время учёными выдвигалась теория о полном искоренении вредителей лесов и культурных насаждений путём искусственного распространения представителей семейства наездников. К сожалению, попытка регулирования популяции не удалась.
Стоит крупным наездникам увеличить численность, как на них тут же начинают паразитировать более мелкие наездники. Природа удерживает баланс между видами на какой-то одной ей известной грани.
stopvreditel.ru