Как из кухонной соли сделать один сплошной кусок, это возможно? Можно ли расплавить соль
Как из кухонной соли сделать один сплошной кусок, это возможно?
Чтобы вырастить соляной кристалл, потребуются:
1) — соль.
Она должна быть как можно более чистой. Лучше всего подойдет соль морская, так как в обычной поваренной очень много мусора незаметного для глаз.
2) — вода.
Идеальным вариантом будет использовать дистиллированную воду, или хотя бы кипяченую, максимально очистив ее от примесей фильтрованием.
3) — стеклянная посуда, в которой будет выращиваться кристалл.
Основные требования к ней: она также должна быть идеально чистой, никакие посторонние предметы, даже незначительные соринки не должны присутствовать внутри нее на протяжении всего процесса, поскольку они могут спровоцировать рост других кристалликов в ущерб основному.
4) — кристаллик соли.
Его можно «добыть» из пачки с солью или в опустевшей солонке. Там на дне почти наверняка найдется подходящий, который не смог пролезть через отверстие в солонке. Выбрать надо прозрачный кристалл по форме более близкий к параллелепипеду.
5) — палочка: пластиковая или деревянная керамическая, или ложка из тех же материалов.
Один из этих предметов потребуется для перемешивания раствора. Наверное, излишним будет напоминать, что после каждого использования, они должны быть вымыты и высушены.
6) — лак.
Лак потребуется для защиты уже готового кристалла, потому что без защиты в сухом воздухе он рассыплется, а во влажном расползется в бесформенную массу.
7) — марля или фильтровальная бумага.
Процесс выращивания кристалла.
Емкость с подготовленной водой помещается в теплую воду (примерно, 50-60 градусов), в нее, при постоянном помешивании, понемножку засыпают соль. Когда соль уже не сможет растворяться, раствор переливают в другую чистую посуду таким образом, чтобы в нее не попал осадок из первой емкости. Для гарантии получения лучшей чистоты можно переливать через воронку с фильтром.
Теперь, «добытый» ранее кристалл на нитке опускают в этот раствор так, чтобы он не касался дна и стенок сосуда.

Поместите емкость в темное прохладное место и запаситесь терпением — видимый процесс начнется через пару-тройку суток, но для выращивания большого кристалла потребуется несколько недель.
По мере роста кристалла жидкость, естественно, будет уменьшаться, а потому, примерно, раз в десять дней необходимо будет добавлять свежий раствор, приготовленный в соответствии с выше указанными условиями.
Во время всех дополнительных операций нельзя допускать частых передвижений, сильных механических воздействий, значительных колебаний температуры.
Когда кристалл достигнет желаемой величины, его достают из раствора. Делать это надо очень осторожно, потому что на этом этапе он еще очень хрупок. Вынутый кристалл обсушивают от воды с помощью салфеток. Высушенный кристалл для придания прочности покрывают бесцветным лаком, для чего можно использовать как бытовой, так и маникюрный.

И напоследок ложка дегтя.
Выращенный таким образом кристалл нельзя будет использовать для изготовления полноценной соляной лампы, так как там используется специальный природный минерал — галит, который содержит множество природных минералов.
Но и из того, что получилось у Вас, вполне можно смастерить какую-нибудь поделку, например, миниатюрный макет той же соляной лампы, вставив в кристалл маленький светодиодик, запитав его от батарейки.
www.remotvet.ru
Чистая расплавленная соль - Большая Энциклопедия Нефти и Газа, статья, страница 1
Чистая расплавленная соль
Cтраница 1
Чистые расплавленные соли представляют собой, быть может, наиболее концентрированные жидкие электролиты, которые можно получить обычными лабораторными методами. Совершенно очевидно, что они находятся за пределами применимости дебай-хюккелевского приближения. Очень высокие точки плавления и кипения, а также большое поверхностное натяжение при повышенной температуре, обнаруженные в расплавленных солях, указывают на первостепенное значение, которое имеют электростатические связи системы ионов в этих веществах. Законченная теория расплавленных солей, конечно, должна в полной мере учитывать наличие кулоновских взаимодействий и выяснить их роль в образовании ионных структур и движений. [1]
В чистой расплавленной соли отсутствует система отсчета, аналогичная растворителю для водных растворов электролитов. [2]
Кристаллизация чистых расплавленных солей, так же как и их плавление, протекает, следовательно, при строго определенной температуре, соответствующей температуре их плавления. Однако, если при плавлении кристаллов соли дальний порядок в расположении их ионов ( атомов) исчезает, то при кристаллизации он, напротив, возникает. [3]
При изучении чистых расплавленных солей часто оказывается возможным связать поглощение света в некотором конечном интервале длин волн с ионами одного определенного типа. Тогда целесообразно определять коэффициент погашения для этих ионов, считая, что величина М в уравнении ( 5) равна числу грамм-ионов хромофора на литр расплава. [4]
В соответствии с величинами краевых углов смачивания чистых расплавленных солей на угле и графите в двойных системах, составленных из фторидов или хлоридов расплавленных солей, понижение краевых углов смачивания под влиянием повышения концентрации поверхностно активного компонента на границе с твердой фазой в большинстве случаев не является аддитивным. Исследования показывают, что в системе NaF - A1F3 ( рис. 106), расплавы которой составляют основу электролита алюминиевой ванны, поверхностно активным компонентом, понижающим межфазное натяжение на границе криолитовых ( расплавов с твердой поверхностью ( углем), оказывается фтористый натрий. [5]
Настоящая статья представляет обзор некоторых попыток теоретического объяснения равновесных свойств чистых расплавленных солей. Здесь не рассматриваются интересные исследования кинетических процессов, таких, как электропроводность, теплопроводность, вязкая диссипация и диффузия, каждый из которых может быть изучен экспериментально только при установлении неравновесного состояния. [6]
С термодинамической точки зрения условие электронейтральности электролита в целом требует, чтобы чистая расплавленная соль рассматривалась как один компонент. Величины л и Т одинаковы в обеих фазах вследствие общих условий термодинамического равновесия: величина р в случае плоских поверхностей раздела также совпадает в обеих фазах, если пренебречь гидростатическим давлением, вызванным наличием силы тяжести. [7]
Пока не получено теоретически выражение, которое позволяло бы рассчитать вязкость смеси по вязкости чистых расплавленных солей. [9]
Пальгуева [250] с помощью меченых атомов были впервые определены числа переноса катиона и аниона в чистой расплавленной соли. Исследовался хлористый свинец, меченный природным изотопом свинца RaD. Было найдено, что ток переносится преимущественно ( но не исключительно, как раньше предполагали) анионом хлора. [10]
Опишите поведение множителя l d ny - / d nm в области концентраций, включающей чистую расплавленную соль. [11]
Опишите поведение множителя d In y - / d In m в области концентраций, включающей чистую расплавленную соль. [12]
Чистые расплавленные соли бериллия, например хлористый бериллий ВеСЬ или фтористый бериллий BeFa, не могут быть применены для электролиза, так как они не проводят электрического тока. [13]
Попытки измерить числа переноса в расплавленных электролитах предпринимались неоднократно в течение целого ряда лет. Сварц [73] и Сандхейм [74] высказали сомнение в том, что понятие числа переноса в чистой расплавленной соли имеет какой-либо физический смысл. Например, при электролизе хлористого свинца между свинцовыми электродами никаких изменений концентрации в жидкости произойти не может и единственным результатом прохождения одного фарадея электричества является перенос одного эквивалента свинца с анода на катод. Таким образом, создается впечатление, что движутся только ионы свинца и что число переноса для иона хлора равно нулю. Однако при использовании хлорных электродов аналогичные рассуждения приводят к выводу, что весь ток переносится хлор-ионами, а ионы свинца не движутся. Следовательно, совершенно ясно, что в расплавленных электролитах числа переноса не могут быть измерены относительно электродных поверхностей как точек сравнения, поскольку числа переноса зависят от природы процесса, протекающего на электродах. [14]
Одной из характернейших особенностей электродных процессов при высоких температурах, присущих электролизу солевых расплавов, является отсутствие заметных затруднений в перезарядке ионов. Вследствие этого указан - - ные процессы происходят на границе между прилегающими слоями электролита и электрода в условиях, близких к равновесным. В чистых расплавленных солях, как правило, поляризация отсутствует, а в расплавленных смесях солей она имеет концентрационный характер. [15]
Страницы: 1 2
www.ngpedia.ru
Агрегатное состояние поваренной соли. Поваренная соль, химия
Более 10 миллионов органических и более 500 тысяч неорганических соединений известно химикам на сегодняшний день. Среди них есть сложные по строению и свойствам, которые применяются только в химических или медицинских целях. А есть те, что совсем не сложно устроены и очень распространены в быту. Но от этого не менее важны и значимы. К одному из таких веществ относится поваренная соль. В быту ее называют еще пищевой, а в химической промышленности именуют хлоридом натрия или хлористым натрием. В технологической промышленности ее называют минералом, который она образует в природе, - галитом, а также каменной солью или твердой каменной солью. Рассмотрим подробнее агрегатное состояние поваренной соли, строение, свойства, добычу, применение и историю введения в массовое потребление.

В каких состояниях существует поваренная соль?
Что такое агрегатное состояние веществ и каким оно бывает? Это зависит от того, о каком веществе идет речь. Каждый ученик старше 7 класса может назвать агрегатное состояние поваренной соли, потому что это то вещество, которое находится у каждого дома. Сегодня без него сложно современному человеку представить свою жизнь. К тому же агрегатное состояние поваренной соли совершенно очевидно невооруженным глазом - мелко или крупно дисперсные кристаллики правильной кубической формы. Однако, растворив соль в воде, мы получим ее уже в другом агрегатном состоянии - жидком. То же самое мы получим, если просто расплавим кристаллы при высокой температуре. Единственное состояние, которое для соли не характерно, - это газообразное. Но при определенных условиях можно получить и его.
Условия для изменения агрегатного состояния
- Чтобы получить соль в жидком состоянии путем плавки твердых кристаллов естественного происхождения, необходимо применить температуру, равную 800оС.
- Для перевода соли в газообразное состояние расплавленные кристаллы нужно довести до кипения (примерно 1400оС) и кипятить до полного перехода структурных компонентов в ионы (Na+ и CL-).
- Твердое агрегатное состояние поваренной соли - это ее естественный вид в природных условиях.

Почему происходит такой разброс температур при манипуляциях с кристаллами? Объясняется это строением кристаллической решетки.
Кристаллическая решетка
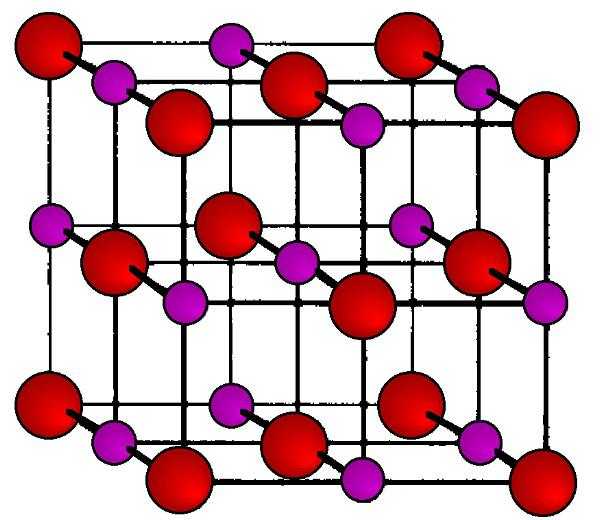
Она представляет собой правильные гранецентрированные кубические прозрачные кристаллы. В каждом углу куба (узлах кристаллической решетки) находятся чередующиеся положительно заряженные ионы Na+ и отрицательно заряженные ионы CL-. Благодаря резко различающейся электроотрицательности этих атомов между ними возникает настолько сильное электростатическое притяжение, что для разрушения его необходимо приложить жесткие условия (высокую температуру, механическое воздействие). Такой тип кристаллической решетки носит название ионной, и он характерен для всех солей щелочных, щелочноземельных и переходных металлов.
Именно поэтому температура поваренной соли (как для плавления, так и для кипения) настолько высока. Однако можно получить кристаллы не только кубической формы, но и пирамидальной (восьми-, двенадцати- и двадцатигранной). Для этого необходимо просто регулировать температуру выпаривания соленого раствора определенным образом. В любом случае внутренняя полость кристаллов остается заполнена жидкостью, если речь идет о растворе соли в воде.
Химическая формула хлористого натрия проста и выражается элементным составом NaCL.
Физические свойства галита
Физические свойства хлорида натрия можно описать несколькими пунктами:
- Твердые кристаллы белого, розового, голубого, фиолетового, красного цвета. Окраска зависит от наличия примесей при добыче. Чистое вещество кристально белого цвета.
- Растворяется в воде в соотношении примерно 100/30 (в 100 г воды 30 г соли). Хорошая растворимость объясняется присутствием диполей воды, которые ассоциируют вокруг себя ионы натрия и хлора, вызывая разрушение электростатического притяжения между ними и, как следствие, разрушение кристаллической решетки.
- Плавится и закипает при высоких температурах (800-1400оС).
- Имеет едва уловимый приятный запах.
- Соленый на вкус.

Химические свойства хлористого натрия
Как и любая растворимая средняя соль, хлористый натрий способен вступать во взаимодействия с:
- Другими солями по реакции обмена (обязательное условие: реакции выделения газа, выпадения осадка или образования малодиссоциируемого вещества): NaCL + AgNO3 = NaNO3 + AgCL (белый творожистый осадок). Это качественная реакция на ион CL-.
- С металлами, стоящими в ЭХРНМ левее натрия: К + NaCL = KCL + Na.
- Диссоциирует в водном растворе на свободные гидратированные диполями воды ионы: NaCL (водный р-р) = Na+ + CL-. В результате образуется раствор поваренной соли, который является сильным электролитом.
- Гидролизу не подвергается, так как является солью, образованной сильной кислотой и сильным основанием.
- При электролизе (действие электрического тока) разлагается с образованием свободных продуктов и едкого натра (каустика): NaCL = Na + Cl2 + NaOH.
Где в природе содержится хлорид натрия?
В настоящее время поваренная соль - вещество, часто встречаемое в природе. И хотя так было всегда, но в древние времена и времена средневековья она считалась очень дорогим продуктом. Все это от того, что не знали способов добычи соли из природных источников. А таких источников в мировых запасах очень много - галит считается почти неограниченным природным ресурсом. Где же соль находится в природе?
- Моря и океаны с соленой водой.
- Соленые озера.
- Соленые источники.
- Подземные воды.
- Воды лиманов.

Добыча галита
Извлечение и переработка соли имеют свою технологию, поскольку просто добытое вещество чаще всего к употреблению непригодно из-за высокого содержания посторонних примесей. Добывают галит по-разному, например:
- путем подземных работ;
- из пластов на дне соляных водоемов;
- выпариванием или вымораживаем соленой морской или океанской воды;
- выпариванием подземных вод.
Любой из способов дает возможность получить кристаллы галита. Однако для употребления в пищу они должны пройти еще один вид обработки - измельчение. Ведь вряд ли кто-то использует дома при приготовлении пищи крупный кристалл поваренной соли. Чаще всего ее приобретают в уже очищенном от примесей, измельченном практически в порошок виде. Также существуют виды соли йодированной, фторированной и так далее не только для пищевых, но и технических целей.
Применение каменной соли
Области применения и использования хлорида натрия весьма обширны. Основные из них вместе с примерами и результатами приведены в таблице.
| Отрасль промышленности | Основа использования соли | Результат |
| Ландшафтное строительство | Смягчение грунта при низких температурах и устранение утечки воды | Построение оросительных каналов и водоемов |
| Медицина | Сходство раствора соли с кровью человека. Кровезаменяющий раствор хлорида натрия (0,85%), называемый физиологическим | Восстановление кровяного баланса после обширных кровепотерь, нормализация работы натрие-калиевого насоса в сердечно-сосудистой системе, поддержание постоянства состава желудочного сока |
| Химическая | Синтезы практически значимых веществ на основе сырья хлористого натрия | Получают: гидрокарбонат натрия, соляную кислоту, металлический натрий, хлор, гидроксид натрия, стекло, пластмассы, мыло, бумагу и другие продукты |
| Пищевая | Антисептическое и антибактериальное действие соли | Консервирование продуктов (мясо, рыба, овощи), улучшение вкусовых качеств пищи |
| Металлургическая | Физические и химические свойства соли | Получение алюминия, солевых батареек, фильтров |
| Кожевенная | Антисептическое и антибактериальное действие соли | Обработка меха и сыромятной кожи при дублении |
История появления в быту
Соль появилась на столах в каждом доме далеко не сразу. Когда-то она ценилась на вес золота, причем в самом прямом смысле. Еще в XVIII веке некоторые народы Африки обменивали горсть соли на горсть золотого песка. Чуть позже в Эфиопии брусочки соли были стандартной валютой. В Древнем Риме военным легионерам даже месячное жалованье выдавали этим веществом, что со временем привело к называнию их солдатами. Дети бедных африканских народов просто лизали каменные куски повареной соли как лакомство. В Голландии она использовалась для наказания преступников, для пытки. Провинившемуся вообще не давали соль, и человек за короткое время умирал.
Впервые выделять и потреблять в пищу это вещество люди научились еще в древности. Тогда было обнаружено, что соль содержится в растениях. Поэтому их сжигали, а золу использовали как приправу. Позже в Китае научились выпаривать соль из морской воды, и процесс развития методов ее получения начал продвигаться быстрее.

На Руси соль добывали из озер (самые знаменитые соленые озера России до сих пор - Эльтон и Баскунчак). Тогда промысловое значение вещества являлось очень редким явлением. Добывали его только немногие купцы, которые затем продавали втридорога. Позволить себе иметь соль могли только богатые и знаменитые люди. Со временем производство и добыча наладились. Стали использоваться разные способы добычи и обработки, и на сегодняшний день одно из самых распространенных бытовых веществ - поваренная соль. Химия этого соединения, свойства, применение в медицине и других отраслях стали известны примерно с XVI-XVII веков.
Изучение в школьном курсе
Изучение структуры и агрегатного состояния, а также химических свойств поваренной соли начинается со школьной скамьи, в рамках такой дисциплины, как химия (8 класс). Соли в школьном курсе исследуются во всем их многообразии в природе. Ученики получают представление о химической основе, эмпирических формулах, основных физических и химических свойствах. Для простоты и удобства запоминания формул и физических свойств на форзаце учебника обычно располагаются соли, таблица которых дает представление об их растворимости в воде. Там же можно найти информацию о растворимости кислот, щелочей и оснований.

Важной характеристикой солей является их плавкость, на основе которой также построена их добыча в природе. Учащимся легко сориентироваться при решении задач на плавкость соли. Таблица и графические изображения позволяют не только увидеть, легкоплавко вещество или тугоплавко, но и определить примерную температуру плавления и кипения. Обычно такие таблицы также располагаются в учебниках ("Химия", 8 класс). Соли должны изучаться в контексте таких наук, как биология и физика. Поэтому множество задач для учащихся построено именно на интеграции межпредметных связей.
fb.ru
Расплавленная соль энергоноситель? | Проект Заряд
Молекула соли
С того времени как люди стали задумываться об альтернативных источниках энергии, а именно ветер и солнце, появилось достаточно много скептиков, которые не воспринимали электричество полученное таким путем из-за того, что оно не могло быть постоянным, и не существовало необходимых технологий для хранения и последующей обработки электроэнергии. Совсем недавно было сделано открытие, которое может решить эту проблему, а в основе теории лежит расплавленная соль. Попробуем разобраться, в чем же ее секрет?
Технология получения энергии солнца заключается в следующем: гелиостаты или большие сконцентрированные зеркала, установленные на центральной вышке, фокусируют на солнце, вследствие чего они могут нагревать жидкость внутри установки. Жидкость, представленная расплавленной солью (раствор натрия и нитрата калия) после нагрева, отправляется в резервуар, а уже затем с помощью парогенератора заставляет турбину вращаться, так происходит генерация электроэнергии. Затем охлажденный раствор соли, вновь подается в вышку, и процесс идет также циклически. Выбор расплавленной соли в роли жидкости обусловлен тем, что этот раствор удерживает тепло на достаточно длительные промежутки времени. Так у расплавленной соли есть способность эффективно тратить аккумулируемую солнечную энергию и во время производства, и во время необходимости.
Расплавленная соль, играя роль теплового аккумулятора, отлично хранит тепловую энергию в течение долгого времени и способна функционировать при таких высоких температурах как 1000° Фаренгейта или 538°C, что делает работу паровой турбины намного эффективнее. Также соль находится в жидком агрегатном состоянии по всему энергоблоку в режиме, позволяющем повышать надежность и уменьшать расходы на использование и обслуживание всей установки. Расплавленная соль нетоксичный, а самое главное легкодоступный материал.
Расплавленная соль не предназначена для длительного хранения аккумулируемой энергии, но она отлично подойдет как средство для посменного хранения электричества в топливных элементах.
zaryad.com
Может ли расплавленная соль производить солнечную энергию круглые сутки?
Наряду с солнечной и ветровой энергией, можно также рассматривать использование соли для производства чистой электроэнергии — расплавленной соли, если быть точнее. Расплавленная соль может производить энергию в любое время суток. Потенциал имеется, но нужно учитывать как цену генерирующих мощностей, так и важность хранения энергии.
В 2015 году компания SolarReserve построила 110-мегаваттный солнечный объект Crescent Dunes в Неваде, в результате чего было накоплено 1,100 мегаватт- часов запасов энергии и возможность обеспечения 75 тысяч домов в штате Невада. Создание подобных проектов с концентрированной солнечной энергией (CSP) запланированы в Южной Австралии, в Африке, в Чили и других стран по всему миру.
В отличие от солнечной и ветровой энергии, которые могут уменьшить потребность в ископаемом топливе, когда есть солнце или когда ветрено, объекты, которые используют расплавленную соль, могут работать в любое время суток и хранить энергию до 10 часов. Схема получения электроэнергии довольно проста: солнечный свет, сконцентрированный на башне полем зеркал, нагревает расплавленную соль в башне до температуры свыше 538 градусов Цельсия; тепло затем может быть использовано для выработки пара и вращения турбин.

Энергия от установок на расплавленной соли намного дешевле. По данным Inside Climate News, завод Crescent Dunes может вырабатывать электроэнергию по цене 0,06 доллара за киловатт-час.
Отмечая важность хранения энергии, Кевин Смит, генеральный директор SolarReserve, сказал в интервью Inside Climate News, что американские коммунальные предприятия «просто хотят киловатт-часы. Их не волнует, когда они их получат». Иными словами, потребителей менее всего волнует, в какое время дня будет использоваться возобновляемая энергия.
Например, в таких районах, как Калифорния, избыток возобновляемой энергии генерируется в определённые часы дня, в то время как потребность возрастает к вечеру.
Пока SolarReserve немного отстает в темпах внедрения. Предполагалось, что завод Crescent Dunes будет генерировать 500 тысяч МВтч электроэнергии в год, но Inside Climate News сообщает, что ему ещё предстоит достичь этой цели.
Между тем, испанская инженерная компания Sener готовит два проекта для Ouarzazate в Марокко, которые тоже используют расплавленную соль. Цены на оба проекта пока достаточно высоки, но ожидаемый спад цен может поставить компанию в более выгодное положение для продвижения своих проектов CSP. Даже у Google есть планы по хранению возобновляемой энергии в расплавленной соли, но она всё равно должна проверить свою собственную систему, чтобы узнать, можно ли её использовать на коммерческой основе.
ПОХОЖИЕ ЗАПИСИ
© Gearmix 2013 Права на опубликованный перевод принадлежат владельцам вебсайта gearmix.ru Все графические изображения, использованные при оформлении статьи принадлежат их владельцам. Знак охраны авторского права распространяется только на текст статьи. Использование материалов сайта без активной индексируемой ссылки на источник запрещено.
gearmix.ru
расплавленных солях - Справочник химика 21
Схема процесса показана на рис. 32, а. Пропан и хлор через расходомеры 32 поступают в нагреватели 2и 3, помещенные в обогреваемую баню, в которой в зависимости от требуемой температуры нагрева в качестве теплоносителя применена вода или расплавленные соли. Хлор и пропан поступают в трубопровод в жидком состоянии, поэтому количество их может измеряться жидкостными расходомерами. Если необходимо, пропан можно разбавлять соответствующими разбавителями, например азотом или углекислотой, для отвода части выделяющегося тепла, чтобы предотвратить чрезмерно бурное протекание реакции. При хлорировании хлористого пропана в качестве исходного материала азот можно предварительно нагревать, так как в этом случае он играет роль теплоносителя, подводящего тепло, необходимое для испарения и нагрева хлористого алкила. [c.161] При выборе теплоносителей необходимо учитывать их физикохимические и токсические свойства. При нагреве расплавами солей следует помнить, что аммонийные расплавленные соли при соприкосновении с органическими веществами способны к воспламенению и взрыву. Расплавленные соли аммония образуют с нефтепродуктами и коксом нитрат аммония, обладающий взрыв- [c.133]Термическое хлорирование пропана в промышленности проводится главным образом с целью производства 1,3-дихлорпро-пана, на основе которого получается циклопропан. Хлорирование пропана аналогично хлорированию метана может проводиться по Хессу и Мак-Би. При работе по этому способу пропан и хлор нагревают раздельно в жидком виде до 400—600°, после чего в поток пропана с большой скоростью вводится хлор с таким расчетом, чтобы скорость его ввода была выше скорости распространения пламени. Реакция проводится в трубчатом змеевике. Так же как и при хлорировании метана, применяется ступенчатая подача хлора с таким расчетом, чтобы на отрезке реакционной трубы между предыдущей и последующей подачей хлора реакция успевала полностью завершиться. Съем избыточного тепла реакции достигается введением с пропаном инертного разбавителя, например азота или двуокиси углерода. На некоторых установках реакционный змеевик с этой целью помещают в баню с расплавленными солями. Продукты реакции охлаждаются в змеевиковом холодильнике, после чего поступают в ректификационную колонну на разделение. Выделяемые углеводороды вновь направляются на реакцию, а хлорированные углеводороды подвергаются повторной ректификации для разделения на moho-, ди-и полихлориды. Разгонка осуществляется на нескольких колоннах. [c.121]
Электростатическая теория растворов объясняет сравнительно малую электропроводность расплавленных солей огромным тормозящим влиянием ионной атмосферы, которая здесь имеет характер ближнего окружения каждого иона ионами противоположного знака. Растворитель, уменьшающий взаимодействие ионов, отсутствует, а расстояния между нонами очень малы. Вследствие отсутствия сольватации подвижности ионов в расплавах непосредственно связаны с их радиусами, и в ряду щелочных катионов наблюдается правильная последовательность подвижностей [c.452]
Прохождение электрического тока через расплавленные соли [c.450]
В процессе сборки пакетов особое внимание уделяют обеспечению точности укладки элементов, строгой их фиксации и плотному прилеганию спаиваемых поверхностей. Зазор между спаиваемыми поверхностями не должен превышать 0,2 мм. Во избежание спаивания поверхностей пакета со сборочно-фиксирующим приспособлением в местах их соприкосновения прокладывают фольгу из нихрома, из которого изготовляют также все сборочно-фиксирующие приспособления и тигель ванны для обеспечения ее чистоты. Пайку пакетов производят двумя методами спеканием в печи и погружением в соляную ванну. Метод спекания в печи проще, но паяные соединения получаются более низкого качества, чем при пайке в расплавленных солях. [c.195]
Несмотря на большое разнообразие химических производств, большинство процессов химической переработки сырья и полупродуктов производства осуществляется а) методами термической обработки исходных материалов (обжиг, плавка, крекинг, термическое разложение и т. п.), б) каталитическим путем (синтез, контактное окисление и т. п.), в) электрохимическим путем (электролиз растворов и расплавленных солей), г) физико-химическими методами (выщелачивание и кристаллизация, сжижение и ректификация, экстрагирование и перегонка и т. п.), д) сочетанием одного из указанных методов с другим (каталитический крекинг, гидрирование жидкого топлива и полимеризация и т. п.). [c.263]
Электропроводность расплавленных солей, как правило, с температурой увеличивается (исключение составляют соли ртути, индия и некоторые другие). Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуры плавления. [c.452]
Этот тип коррозии наиболее распространен. Он имеет место при взаимодействии металлов с жидкими электролитами (водой, водными растворами солей, кислот и щелочей, расплавленными солями и щелочами) и является гетерогенной электрохимической реакцией электролитов с металлами. Однако в принципе не исключена возможность и химической коррозии металлов в электролитах, при которой окисление металла и восстановление окислительного компонента (молекул или ионов) электролита происходят в одном акте, скорость которого не зависит от величины электродного потенциала металла, с образованием соединений и их последующим растворением. [c.148]
В тонливных элементах, как и в обычных гальванических, электроды, к которым подаются восстановитель (топливо) и окислитель, разделены ионопроводящим электро-лито.м (кислотами и щелочами, расплавленными солями и др.). Электроды в случае применения газообразных продуктов делают обычно из полых пористых трубок и пластин. Токообразующий процесс со-вергиается на границе соприкосновения электрода с электролитом. [c.224]
Расплавленные соли и окислы во многом похожи на кристаллические ионные решетки, из которых они образуются при плавлении. В расплавах сохраняется квазикристаллический порядок чередования ионов разного знака этот порядок лишь незначительно нарушается тепловым движением ионов. Очевидно, что в расплаве при температурах, близких к температурам плавления, имеются в относительно свободном состоянии те же ионы, которые характерны для соли в кристаллическом состоянии. Например, в расплаве криолита есть ноны A Fg" и Ыа+ АЬОа, растворенны.й в жидком кри- [c.450]
Примерами электрохимической коррозии металлов являются ржавление различных металлических изделий и конструкций в атмосфере (металлических станков и оборудования заводов, стальных мостов, каркасов зданий, средств. транспорта и др.) коррозия наружной металлической обшивки судов в речной и морской воде ржавление стальных сооружений гидросооружений ржавление стальных трубопроводов в земле разрушение баков и аппаратов растворами кислот, солей н щелочей на химических и других заводах, коррозионные потери металла при кислотном травлении окалины коррозионные потери металлических деталей при нагревании их в расплавленных солях и щелочах и др. [c.148]
Удельные электропроводности расплавленных солей при температурах, незначительно превышающих температуры [c.451]
Пропускание электрического тока через расплавленную соль (электролиз) [c.151]
Имеется сообщение о работах но хлорированию метана расплавленными солями, в частности хлорной медью. Реакция про- [c.119]
В изотермическом реакторе необходим либо подвод тепла (при эндотермическом процессе), либо отвод (при экзотермическом). Теплообмен часто осуществляется при помощи теплоносителей, в качестве которых при высоких температурах применяются даутерм, расплавленные соли и металлы. [c.132]
Основным промышленным способом получения металлического алюминия является электролиз расплавленных солей, содержащих ионы АР ". Определите величину электрического заряда, в фарадеях и кулонах, который должен быть пропущен через расплав для получения 1 кг. металла. [c.44]
В качестве теплоносителя применяются различные вещества хладоагенты, вода, водяной пар, даутерм и расплавленные соли. Рис. Х1-7 иллюстрирует часто применяемый принцип использования реакционной смеси для нагрева или охлаждения уже прореагировавшей смеси внутри самого реактора. В этом аппарате реагирующий воздух предварительно нагревается продуктами реакции и в свою очередь быстро их охлаждает. Равновесная степень пре-вращ,ения воздуха в N0 достаточно велика только при температурах свыше 2200 °С. Однако при быстром охлаждении газов до температуры ниже 1200 °С предотвращается распад N0 н поддерживается приемлемая степень превращения. [c.360]
Одна из главных целей строительства больших плотин на реке Колумбия в США заключалась в выработке дешевой гидроэлектроэнергии для электролитического получения алюминия. Электростанция на каждой плотине вырабатывает ток силой около 2 10 А при напряжении достаточно высоком, чтобы разлагать расплавленные соли алюминия. Каково ежедневное производство металлического алюминия в килограммах, если для его получения использовать все электричество, вырабатываемое одной плотиной Сколько плотин необходимо для ежедневного производства 3000 тонн алюминия [c.61]
Если электролит представляет собой токопроводящий раствор одного или нескольких веществ в воде или ином растворителе, то такие системы относятся к электрохимии водных или неводных растворов если электролитом служит расплавленная соль (или смесь расплавленных солей и оксидов), эти системы относятся к электрохимии расплавов или расплавленных сред если межэлект-родное пространство заполнено газом — к электрохимии газов. Электрохимическая система может находиться в равновесном (рис. 2, а) или неравновесном (рис. 2, б, в) состоянии. [c.13]
Расплавы солей и их смесей составляют интересный и важный класс неводных растворителей. В расплавленных солях растворяется большинство металлов. Эти растворы имеют интенсивную окраску и являются очень сильными юсстановителями. В них растворенные металлы находятся либо в атомарном состоянии, либо в виде сольватированных ионов необычно низкой ста- [c.487]
Хорошо управляемые реакции хлорирования идут при барботирова-. НИИ реагирующих веществ через ванну с расплавленными солями металла, такими, например, как легкоплавящиеся смеси хлоридов натрия, калия, кальция, цинка и алюминия, поддерживаемую при подходящей темпераг- [c.62]
Вещества, прохождение через которые электрического тока вызывает передвижение вещества в виде ионов ионная проводимость) и химические превращения в местах входа и выхода тока (электрохимические реакции), называются проводниками второго рода. Типичными проводниками второго рода являются растворы солей, кислот и оснований в воде и некоторых других растворителях, расплавленные соли и некоторые твердые соли. Как правило, в проводниках второго рода электричество переносится положительными (катионы) и отрицательными (анионы) ионами, однако некоторые твердые соли характеризуются униполярной проводимостью, т. е. переносчиками тока в них являются ионы только одного знака — катионы (например, в Ag l) или анионы (ВаСЬ, ZrOa + aO, растворы щелочных металлов в жидком аммиаке). [c.384]
Подробное рассмотрение физико-химических аспектов растворимости газов в жидкостях, включая расплавленные соли и жидкие металлы, дано Бэттингом и Клевером . Они приводят также много ссылок на работы последнего времени по экспериментальному определению растворимостей. Экспериментальные данные о растворимостях различных неорганических и органических веш,еств со-Д(ержатся также в ряде справочников - 2.>з.2о. [c.31]
Н о 1 г о у d F. R. В., К е n п е у С. N., hem. Eng. Sei., 26, 1963 (1971). Кинетика окисления двуокиси серы в расплавленных солях абсорбция двуокиси серы расплавом пятиокиси ванадия и пиросульфата калия. [c.283]
Одно из первых конкретных представлений о природе химической связи возникло на основании экспериментального исследования электролиза английским ученым Майклом Фарадеем (1791-1867). (Электролиз означает разрыв на части при помощи электричества .) Если расплавить хлорид натрия, нагрев его выше 80ГС, и погрузить в расплав два электрода (катод и анод), как показано на рис. 1-8, а затем пропустить через расплавленную соль электрический ток, на электродах начнут протекать химические реакции ионы натрия будут мигрировать к катоду (где электроны поступают в расплав) и восстанавливаться там до металлического натрия [c.41]
Запишите уравнения реакций, протекающих при пропускании электрического тока через расплавленную соль Na l. Сколько граммов натрия и хлора выделится при пропускании 1F электричества через электролитическую ячейку [c.44]
В расплавленных солях в отличие от водных и неводных растворов, помимо равновесного обмена ионами, наблюдается также равновесие в результате восстановления мeVaллoм ионов высшей валентности 7Ие + до низшей валентности (растворение ме- [c.153]
Потенциалы нулевых зарядов К(0) (относительно электрода сравнения расплавленный РЬ — эвтектика K l + Li l) расплавленных металлов в расплавленных солях (по Л. И. Антропову) [c.164]
chem21.info
ПОВАРЕННАЯ СОЛЬ | Энциклопедия Кругосвет
ПОВАРЕННАЯ СОЛЬ – хлорид натрия NaCl. Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 20° С и 38,1 при 80° С. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей – хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. Плотность NaCl – 2,165 г/см3, температура плавления 800,8° С, температура кипения 1465° С.
Раньше говаривали: «Соль всему голова, без соли и жито – трава»; «Один глаз на полицу (где хлеб), другой – в солоницу (солонку)», и еще: «Без хлеба не сытно, без соли не сладко»... Бурятская народная мудрость гласит: «Собираясь пить чай, клади в него щепотку соли; от нее быстрее усваивается пища, исчезнут болезни желудка».
Вряд ли мы узнаем, когда впервые наши далекие предки вкусили соль: нас отделяют от них десять-пятнадцать тысяч лет. Тогда еще не было посуды для приготовления пищи, все растительные продукты люди вымачивали в воде и подпекали на тлеющих углях, а мясо, насаженное на палки, обжаривали в пламени костра. «Поваренной солью» первобытных людей наверняка была зола, которая неизбежно попадала в пищу во время ее приготовления. Зола содержит поташ – карбонат калия K2CO3, который в местах, удаленных от морей и соленых озер, долгое время служил пищевой приправой.
Возможно, однажды, за неимением пресной воды, мясо либо корни и листья растений были замочены в соленой морской или озерной воде, и еда оказалась вкуснее обычной. Может быть, добытое впрок мясо, чтобы защитить его от хищных птиц и насекомых, люди спрятали в морскую воду, а потом обнаружили, что оно приобрело приятный вкус. Наблюдательные охотники первобытных племен могли заметить, что животные любят лизать солонцы – белые кристаллы каменной соли, выступающие кое-где из-под земли, и попробовали добавлять соль в пищу. Могли быть и другие случаи первого знакомства людей с этим удивительным веществом.
Чистая поваренная соль, или хлорид натрия NaCl – бесцветное негигроскопичное (не поглощающее влагу из воздуха) кристаллическое вещество, растворимое в воде и плавящееся при 801° С. В природе хлорид натрия встречается в виде минерала галита – каменной соли. Слово «галит» происходит от греческого «галос», означающего и «соль», и «море». Основная масса галита чаще всего находится на глубине 5 км под поверхностью земли. Однако давление слоя горных пород, расположенных над пластом соли, превращает ее в вязкую, пластичную массу. «Всплывая» в местах пониженного давления кроющих пород, пласт соли образует соляные «купола», выходящие в ряде мест наружу.
Природный галит редко бывает чисто белого цвета. Чаще он буроватый или желтоватый из-за примесей соединений железа. Встречаются, но очень редко, кристаллы галита голубого цвета. Это означает, что они долгое время в глубинах земли находились по соседству с породами, содержащими уран, и подверглись радиоактивному облучению.
В лаборатории тоже можно получить синие кристаллы хлорида натрия. Для этого не потребуется облучения; просто в плотно закрытом сосуде надо нагреть смесь поваренной соли NaCl и небольшого количества металлического натрия Na. Металл способен растворяться в соли. Когда атомы натрия проникают в кристалл, состоящий из катионов Na+ и анионов Cl–, они «достраивают» кристаллическую решетку, занимая подходящие места и превращаясь в катионы Na+. Освободившиеся электроны располагаются в тех местах кристалла, где полагалось бы находиться хлорид-анионам Cl–?. Такие необычные места внутри кристалла, занятые электронами вместо ионов, называют «вакансиями».
При охлаждении кристалла некоторые вакансии объединяются, это и служит причиной появления синей окраски. Кстати, при растворении в воде синего кристалла соли образуется бесцветный раствор – совсем как из обычной соли.
Греческий поэт Гомер (VIII в. до н.э.), написавший Илиаду и Одиссею, называл поваренную соль «божественной». В те времена она ценилась выше золота: ведь, как гласила пословица, «без золота прожить можно, а без соли - нельзя». Из-за месторождений каменной соли происходили военные столкновения, а иногда нехватка соли вызывала «соляные бунты».
На столах императоров, царей, королей и шахов стояли солонки из золота, и заведовал ими особо доверенный человек - солоничий. Воинам часто платили жалованье солью, а чиновники получали солевой паек. Как правило, соляные источники были собственностью властителей и коронованных особ. В Библии есть выражение «пьет соль от дворца царского», означающее человека, получающего содержание от царя.
Соль издавна была символом чистоты и дружбы. «Вы – соль земли» – говорил Христос своим ученикам, имея в виду их высокие нравственные качества. Соль употреблялась при жертвоприношениях, новорожденных детей у древних евреев посыпали солью, а в католических церквах при крещении в ротик младенца клали кристаллик соли.
В обычае арабов было при утверждении торжественных договоров подавать сосуд с солью, из которого в знак доказательства и гарантии постоянной дружбы лица, заключившие договор – «завет соли» – съедали по несколько ее крупинок. «Съесть вместе пуд соли» – у славян значит хорошо узнать друг друга и подружиться. По русскому обычаю, когда подносят гостям хлеб-соль, то тем самым желают им здоровья.
Поваренная соль – не только пищевой продукт, но издавна распространенный консервант, ее применяли при обработке кожевенного и мехового сырья. А в технике она до сих пор является исходным сырьем для получения практически всех соединений натрия, в том числе соды.
Поваренная соль входила и в состав самых древних лекарств, ей приписывали целебные свойства, очищающее и дезинфицирующее действие, причем с давних пор подмечено, что поваренная соль разных месторождений имеет разные биологические свойства: самая в этом отношении полезная – морская. В Лечебнике-травнике, изданном в России в 17 в., написано: «Две сути соли, одну копали из горы, а другую находили в море, а которая из моря, та лутчи, а кроме морской соли та лутчи, которая бела».
Однако в употреблении соли надо соблюдать меру. Известно, что средний европеец ежедневно поглощает с пищей до 15 г соли, в то время как средний японец – около 40 г. Как раз японцы и держат мировое первенство по числу больных гипертонией – болезнью, одна из причин которой состоит в том, что в организме задерживается больше жидкости, чем ему необходимо. Клетки разбухают от ее излишка, сжимают кровеносные сосуды, поэтому повышается кровяное давление, от чего и сердце начинает работать с перегрузкой. Трудно становится и почкам, очищающим организм от избытка катионов натрия.
Ни одно растение не может расти на почве, покрытой солью, солончаки всегда были символом земли бесплодной и необитаемой. Когда властитель Священной Римской империи Фридрих I Барбаросса разрушил в 1155 Милан в Италии, то велел посыпать руины поверженного города солью в знак его полного уничтожения... У разных народов во все времена рассыпать соль значило накликать беду и потерять здоровье.
В древности люди использовали несколько способов добычи поваренной соли: естественное испарение морской воды в «соляных садках», где выпадал хлорид натрия NaCl – «морская» соль, вываривание воды соленых озер с получением «выварочной» соли, и выламывание «каменной» соли в подземных рудниках. Все эти способы дают соль с примесями хлорида магния MgCl2·6 h3O, сульфатов калия K2SO4 и магния MgSO4·7h3O и бромида магния MgBr2·6h3O, содержание которых достигает 8–10 %.
В морской воде в среднем на 1 л приходится до 30 г различных солей, на долю поваренной соли приходится 24 г. Технология получения хлорида натрия NaCl из морской и озерной воды всегда была довольно примитивной.
Например, в конце «бронзового века» – за три, три с половиной тысячи лет до нашей эры – древние солевары обливали бревна морской водой, а потом сжигали их и из золы выбирали соль. Позднее соленые воды стали выпаривать на больших противнях, а для удаления примесей добавляли кровь животных, собирая образующуюся пену. Примерно с конца 16 в. растворы соли очищали и концентрировали, пропуская через башни, заполненные соломой и ветками кустарников. Выпаривание раствора соли на воздухе производили и совсем примитивным способом, сливая рассол по стене, сложенной из связок хвороста и соломы.
Солеварение, старейшее из химических ремесел, возникло на Руси, по-видимому, в начале 7 века. Соляные промыслы принадлежали монахам, которым благоволили русские цари, с них даже не взимался налог на продаваемую соль. Выварка соли приносила монастырям огромные прибыли. Рассолы добывали не только из озер, но и из подземных соляных источников; буровые скважины, которые для этого строили, в 15 в. достигали длины 60–70 м. В скважины опускали трубы, изготовленные из цельного дерева, а упаривали рассолы в железных противнях на дровяной топке. В 1780 в России таким способом было выварено более ста тысяч тонн соли…
В настоящее время поваренную соль добывают из отложений соляных озер и на месторожденияхкаменной соли – галита.
Поваренная соль – не только важная пищевая приправа, но и химическое сырье: из нее получают гидроксид натрия, соду, хлор.
Людмила Аликберова
www.krugosvet.ru