КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ. Коррозия металлов и способы защиты
Тема 3 Коррозия металлов и способы защиты от неё. Коррозия металлов
Металлические материалы — металлы и сплавы на основе металлов, — приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.
Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией. Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. Но еще больший вред связан не с потерей металла, а с порчей изделий, вызываемой коррозией. Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, приборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную проблему, а на защиту от коррозии тратятся большие средства.
Большинство металлов в реальных условиях способны разрушаться, переходя в окисленное состояние. Самым доступным окислителем для металлов является кислород. Изменение энергии Гиббса в этом процессе меньше нуля, т. е. металлы - термодинамически неустойчивые системы.
К важнейшим случаям коррозии относятся химическая и электрохимическая коррозия.
Химическая коррозия металлов.
Коррозия металлов может протекать при взаимодействии металлов с сухими газами или растворами неэлектролитов. Такая коррозия называется химической. Взаимодействие металлов с газами (газовая коррозия) происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке.
Механизм газовой коррозии связан с протеканием на поверхности раздела твердой и газообразной фаз двух сопряженных реакций: окисления металла и восстановления газообразного окислителя, причем в пространстве эти два процесса, как правило, не разделены. В этом же месте происходит и накопление продуктов реакции окисления. Для непрерывного осуществления реакции атомы и ионы металла, с одной стороны, и атомы или ионы кислорода или другого окислителя, с другой, диффундируют сквозь постепенно утолщающуюся пленку продуктов коррозии. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др. В зависимости от свойств образующихся продуктов может происходить торможение процесса окисления.
Газовой коррозии подвергаются углеродистые стали, чугуны, которые взаимодействуя с кислородом могут терять прочность и твердость, особенно при повышенных температурах (300°С и выше):
Fe + 02 —> FeO + Fe304 + Fe203 .
Образующаяся смесь продуктов называется окалиной. Одновременно протекает обезуглероживание поверхностного слоя металла за счет превращения цементита:
Fe3C + 02 —►Fe + CO2.
Водород взаимодействует с имеющимся в стали углеродом, превращая его в углеводороды (обычно в метан), что приводит к резкому ухудшению свойств стали. Поэтому в присутствии водорода возникает водородная хрупкость стали за счет того, что в результате реакции также происходит обезуглероживание стали, возникновение микротрещин.
Fe3C + h3 —>Fe + Ch5
Сталь при температурах выше 200 °С начинает интенсивно корродировать в присутствии многих других газов (хлора, оксидов азота, углерода, серы).
Медь активно взаимодействует с оксидами углерода и серы, содержащимися в атмосфере.
Из цветных металлов устойчив к газовой коррозии в воздушных средах никель, а его сплавы с хромом устойчивы к коррозии даже при температурах, превышающих 1000 °С.
Основными способами защиты от газовой коррозии являются легирование металлов, создание защитных покрытий и замена агрессивной газовой среды. Для изготовления аппаратуры, подвергающейся действию коррозионно-активных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия этот метод носит название алитирования, в случае хрома — термохромирования. Для защиты используют и неметаллические покрытия, изготовленные из керамических и керамико-металлических материалов.
studfiles.net
Лекция 11. Коррозия металлов и методы защиты от коррозии
Химическая и электрохимическая коррозия. Способы защиты металлов от коррозии
Коррозией называется процесс самопроизвольного разрушения металлов под воздействием внешней среды. Все случаи коррозии принято делать на два вида: химическую и электрохимическую.
Химическая коррозия - это окисление металлов, не сопровождающееся возникновением электрического тока. Примером химической коррозии является образование окалины на железе при высокой температуре без участия электролитов,
Электрохимическая коррозия - разрушение металла, обусловленное его окислением в среде электролита и сопровождающееся возникновением электрического тока в результате образования гальванического элемента, который в этом случае называют коррозионным гальваническим элементом. Работа коррозионного гальванического элемента обусловлена разностью потенциалов активного (анодного) участка и пассивного (катодного) участка. На анодных участках коррозионного гальванического элемента происходит окисление (растворение) основного металла
Анод: Me - Ze = Mez+ .
Коррозия с участием кислорода называется коррозией с кислородной деполяризацией. Она описывается уравнениями:
Анодный процесс: Me - Ze = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
О2 + 4Н+ + 4ё=2Н2O;
б) в нейтральной и щелочной среде (рН > 7)
О2 + 2Н2О + 4e = 4OH.
Коррозия, сопровождающаяся выделением водорода на катоде, называется коррозией с водородной деполяризацией и описывается уравнениями:
Анодный процесс: Me - Z e = Mez+
Катодный процесс:
а) в кислой среде (рН < 7)
2Н+ + 2e = Н2↑;
б) в нейтральной и щелочной среде (рН ≥ 7)
2h3O + 2e = h3↑ + 2OH..
Таким образом, электрохимическая коррозия возможна при условии, когда электроны с анодных участков постоянно отводятся на катодные, а затем удаляются с них окислителем. Коррозионный гальванический элемент изображают следующим образом:
(A) MI| Н2О/Окислитель(О2 или Н+)| МII (примеси) (К).
Выделяемая иногда в отдельный вид грунтовая (почвенная) коррозия может быть сведена к одному из вышеперечисленных случаев.
Примеры решения задач
Пример 1. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов находится в кислой среде (НСl). Составьте схему образующегося при этом гальванического элемента. Какой процесс будет протекать на катоде?
Решение. Исходя из положения металлов в ряду напряжений, находим, что хром более активный металл: (φ0Cr2+/Cr = -0,74 В,φ0Cu2+/Cu = +0,34 В). В образующемся гальваническом элементе он будет выполнять роль анода, а медь - катода:
(А)Сr|Н2О/НС1|Сu(К).
Хромовый анод растворяется, а на медном катоде выделяется водород:
Анод:Сr-3е =Сr3+
Катод: 2Н2+ 2е =Н2↑
Пример 2. Какие процессы протекают при коррозии технического железа в атмосферных условиях?
Решение. Техническое железо содержит примеси углерода и некоторых металлов, которые, как правило, менее активны, чем железо, и выполняют роль катода в образующемся гальваническом элементе, основная масса железа является анодом. Адсорбированная на поверхности железа вода, с растворенными в ней кислородом и другими газами, образует пленку электролита.
Схема, образующегося гальванического элемента имеет вид
(A)Fe|h3O/O2|Me(K).
При работе гальванического элемента протекают процессы:
Анод:Fе-2е =Fe2+
Катод: 2Н2О + О2 + 4 e - 4ОH.
Вторичные процессы: Fe2+ +2ОH. = Fe(OH)2,
4Fe(OH)2 + О2 + Н2О = 4Fe(OH)3.
На скорость коррозии влияют как внутренние факторы (наличие дефектов кристаллической решетки металла, механические напряжения и др.), так и внешние: температура, природа и состав электролита. С повышением температуры скорость коррозии, как и большинства химических реакций, возрастает. Усиливают коррозию содержащаяся в атмосфере промышленных городов пыль, SO2, СO2 и другие газы. Поэтому в городах коррозия протекает в 5-10 раз быстрее, чем в сельской местности. Ионы Сl-, присутствующие в морской воде, являются катализаторами коррозии железа и его сплавов, так как адсорбируясь на поверхности металла, разрушают или препятствуют образованию на нем защитных слоев. Кроме того, скорость коррозии двух контактирующих металлов будет тем больше, чем больше разность потенциалов этих металлов. Полностью предотвратить процессы коррозии металлов практически не удается, однако существуют способы защиты металлов от коррозии.
1. Изменение коррозионной среды - этот метод пригоден для тех случаев, когда защищаемые изделия эксплуатируются в небольшом объеме. Суть метода состоит в удалении из электролита растворенного кислорода или добавлении к этому раствору веществ, замедляющих коррозию - ингибиторов.
2. Легирование металлов. Это введение в состав сплавов компонентов, повышающих химическую стойкость. Наибольшее применение находят нержавеющие стали, в состав которых входит хром (до 15 %) и никель (до 10 %). Кроме того, в качестве легирующих компонентов используют марганец, кремний, вольфрам, молибден, титан и другие металлы.
4. Металлические покрытия. По характеру защитного действия различают анодные и катодные покрытия. Анодным является покрытие металлом, электродный потенциал которого меньше, чем у защищаемого металла. Покрытие из металла менее активного (с большим электродным потенциалом), чем защищаемый металл, называется катодным. Если покрытие не нарушено и полностью изолирует основной металл от воздействия окружающей среды, принципиального различия между анодными и катодными покрытиями нет. При нарушении слоя защищающего металла возникают коррозионные гальванические элементы, в которых защищаемый металл может играть роль или инертного катода, или активного анода. Так, при нарушении в атмосферных условиях алюминиевого покрытия на медном изделии (φ0Al3+/Al= -1,67 В, φ0 Cu2+/Cu = +0,34 В) возникает гальванический элемент (А)А1|Н2О/О2|Cu(К).
В этом элементе, покрывающий металл Аl является анодом, он разрушается (окисляется) и, растворяясь, защищает основной металл, несмотря на нарушение целостности покрывающего слоя:
Анод: Аl - 3 е = Аl3+
Катод: 2Н2О + О2 + 4 е = 4ОН.
Катодное же покрытие (например, свинцовое покрытие железа) в аналогичном случае перестает защищать основной металл и, создавая с ним гальванический элемент, усиливает своим присутствием его коррозию:
(А)Fе|Н2О/О2|Рb(К)
Анод: Fe - 2 e = Fe2+
Катод: Н2О + О2 + 4 е = 4ОН.
5. Электрохимическая защита:
а) катодная защита. Защищаемую конструкцию присоединяют к катоду внешнего источника тока, в результате она становится катодом, не окисляется, на ней идет восстановление компонентов среды. В качестве анода применяют любой металлический лом, ко-торый присоединяют к аноду внешнего источника тока. Таким способом защищают, например, подземные трубопроводы;
б) протекторная защита. Защищаемый металл соединяют с более активным металлом, имеющим меньший электродный потенциал. Последний служит анодом, растворяется и защищает основной металл. Так цинк является протектором для стального корпуса судна:
(А) Zn | Н2О/ О2| Fe (К)
Анод:Zn-2е =Zn2+
Катод: Н2О + О2 + 4e =4ОН.
Для более активной защиты металлических конструкций можно совмещать несколько способов защиты от коррозии, например, покрытие и катодную электрозащиту.
studfiles.net
Коррозия металлов и способы защиты от нее
Коррозия металлов и способы защиты от нее
Коррозия металлов — процесс разрушения металлов и сплавов вследствие химического или электрохимического взаимодействия с внешней средой, при котором металлы окисляются и теряют присущие им свойства. Ежегодно в мире в результате коррозии теряется 10…15% выплавляемого металла или 1-1,5% всего металла, накопленного и эксплуатируемого человеком. В наибольшей степени коррозии подвергаются черные металлы (сталь и чугун).
Химическая коррозия — разрушение металлов и сплавов в результате окисления при взаимодействии с сухими газами (02, S02 и др.) при высоких температурах или с органическими жидкостями — нефтепродуктами, спиртом и т. п.
Электрохимическая коррозия — разрушение металлов и сплавов в воде и водных растворах. Для развития коррозии достаточно, чтобы металл был просто покрыт тончайшим слоем адсорбированной воды (влажная поверхность). Из-за неоднородности строения металла при электрохимической коррозии в нем образуются гальванические пары (катод — анод) между зернами (кристаллами) металла, отличающимися одно от другого химическим составом, например между зернами феррита и цемента. Атомы металла с анода переходят в раствор в виде катионов. Эти катионы, соединяясь с анионами, содержащимися в растворе, образуют на поверхности металла слой ржавчины. В основном металлы разрушаются от электрохимической коррозии.
Для повышения долговечности и сохранения декоративности металлоконструкции защищают от коррозии. Сущность большинства способов защиты от коррозии — предохранение поверхности метал- ; ла от проникновения в нее влаги и газов путем создания на металле защитного слоя. Существуют и другие методы, например электрохимическая защита, с помощью установки протектора из более активного металла на защищаемую металлоконструкцию.
Наиболее простой, но не долговечный метод защиты металла — нанесение на его поверхность водонепроницаемых неметаллических покрытий (битумных, масляных и эмалевых красок). В последние годы все большее применение находит метод защиты от коррозии покрытием металла тонким слоем пластмассы.
Защитить металл от коррозии можно также, покрывая его слоем другого более коррозионно-стойкого металла: оловом, цинком, хромом, никелем и др. Защитный слой металла наносят путем цинкования, никелирования, хромирования, лужения и свинцевания. Покрытие цинком используют для защиты от коррозии закладных деталей железобетонных изделий, водопроводных труб, кровельной жести. Защитный слой наносят гальваническим (электролитическим осаждением из раствора солей) или термическим (окунанием в расплав металла или распылением расплава) методом.
Применяют химические способы образования покрытий (плотных оксидных пленок) на металле: фосфатирование (для черных металлов) и анодирование (для алюминиевых сплавов).
Для получения металлов, хорошо противостоящих коррозии (например, нержавеющей стали), применяют легирование. Так, вводя в сталь хром и никель в количестве 12…20%, получают нержавеющие стали, стойкие не только в водных растворах солей, но и в кислотах.
Читать далее:Цветные металлы и сплавыСоединение стальных конструкцийСтальная арматураСтальной прокат и стальные конструкцииТермическая обработка сталиУглеродистые и легированные сталиСвойства сталейОсновы технологии черных металловСтроение и свойства железоуглеродистых сплавовОбщие сведения о металлах и сплавах
stroy-server.ru
Тема 8. Коррозия металлов и способы защиты от неё
Литература: [1] c. 310-336; [2] с. 554-560
Теоретические основы
Коррозией называется самопроизвольное разрушением металлов и сплавов под действием окружающей среды. Характер и скорость коррозии определяется природой металла, составом среды, а также наличием примесей в металле и структурой его поверхности. В зависимости от природы среды, в которой находится металл, коррозию условно делят на два вида - химическую и электрохимическую.
Химическая коррозия протекает в среде неэлектролита, т.е. в сухих газах и парах при высокой температуре, когда невозможна конденсация влаги на поверхности металла (газовая коррозия), или в жидком неэлектролите (например, нефтепродукты, в которых присутствуют хлор- или серосодержащие вещества).
Электрохимическая коррозия происходит в средах, проводящих электрический ток - в растворах электролитов, во влажной атмосфере, в почве и т.п. Согласно теории микрогальванических элементов электрохимическая коррозия объясняется тем, что на отдельных участках металлической поверхности возникают разные по величине электродные потенциалы. Причиной этого является неоднородность поверхности: металлические и неметаллические примеси, оксидные и солевые плёнки, загрязнения, контакт разных металлов и т.д.
При контакте двух разных металлов или при наличии металлической примеси катодом является менее активный металл, у которого больше электродный потенциал. Более активный металл, поляризуясь анодно, окисляется и подвергается разрушению:
Мео n = Men+.
Катодный процесс при электрохимической коррозии, называемый деполяризацией, представляет собой восстановление окислителя, содержащегося в электролите.
В кислой среде это преимущественно катионы водорода:
2Не+ + 2 = Н2 (водородная деполяризация).
В нейтральной и щелочной среде идёт восстановление растворённого кислорода:
О2 + 2Н2О + 4 = 4ОН (кислородная деполяризация).
Пример. Написать уравнения процессов, происходящих при коррозии железа, содержащего примеси меди, в разбавленной соляной кислоте.
Ответ. В местах контакта железа с включениями меди в растворе соляной кислоты образуются микрогальванические элементы, которые можно представить схемой:
()Fe HCl Cu(+). Исходя из положения металлов в ряду напряжений, заключаем, что железо более активно ( оFe= 0.44 В) и в образующейся гальванопаре является анодом, а менее активная медь ( оCu= + 0.34 В) катодом. Поэтому железо окисляется, а на катоде происходит восстановление ионов водорода:
А: Fео 2 = Fe2+
K(Cu) : 2Не+ + 2 = Н2
Суммарное уравнение: Fe + 2HCl FeCl2 + h3. Коррозии подвергается железо.
Для предупреждения коррозии и защиты от неё используются разнообразные методы: электрохимическая защита, применение химически стойких сплавов, обработка коррозионной среды, металлические и неметаллические покрытия, обработка поверхности металла. Материалами для металлических защитных покрытий могут быть как чистые металлы (Zn, Cd, Al, Ni, Cu, Cr, Ag и др.), так и их сплавы (бронза, латунь и др.). По характеру поведения металлических покрытий при коррозии их подразделяют на катодные и анодные.
Катодными называются покрытия, в которых металл покрытия менее активен, т.е. имеет более положительное значение стандартного электродного потенциала, чем защищаемый металл. Катодные покрытия на стали образуют медь, никель, олово и др. В случае механического повреждения такого покрытия возникает гальваническая пара, в которой анодом является железо, а катодом - металл покрытия. Например, коррозия лужёного (покрытого оловом) железа при нарушении целостности покрытия во влажном воздухе описывается следующими уравнениями электродных процессов:
А: Fео 2 = Fe2+
K(Sn) : О2 + 2Н2О + 4 = 4ОН
Суммарное уравнение: 2Fe + 2Н2О + О2 2Fe(OH)2
4Fe(OH)2 +2Н2О + О2 4Fe(OH)3
Т.о., железо окисляется и разрушается.
Анодные покрытия образуют металлы, обладающие более отрицательными электродными потенциалами, чем защищаемый металл, например покрытие железа цинком. При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом, а цинк - анодом, т.е. цинк окисляется, а железо остаётся защищённым до тех пор, пока не разрушится весь материал покрытия.
Уравнения электродных процессов, происходящих при коррозии оцинкованного железа во влажном воздухе, имеют вид:
А: Znо 2 = Zn2+
K(Fe) : О2 + 2Н2О + 4 = 4ОН
Суммарное уравнение: 2Zn + 2Н2О + О2 2Zn(OH)2
studfiles.net
| Коррозия — процесс химического или электрохимического разрушения металлов под действием окружающей среды. Установлено, что от коррозии ежегодно теряется безвозвратно около 10 % производимых металлов, т. е. годовая продукция крупного металлургического завода. В процессе химического разрушения на поверхности металла образуется пленка из продуктов коррозии, обычно оксидов. В некоторых случаях эта пленка может защищать лежащий под ней металл от дальнейшей коррозии. Сравнительно плотные оксиды пленки образуются на поверхности алюминия, свинца, олова, никеля, хрома. При окислении железа в сухом воздухе или в атмосфере сухого кислорода образуется также достаточно плотная пленка, но она по мере роста растрескивается и отслаивается от металла. Чаще всего химическая коррозия происходит в среде сухих газов при высокой температуре (металлическая арматура печей, клапаны двигателей, лопатки газовых турбин и т.п.) или в жидкостях неэлектролитов (окисление металла в спирте, бензине, нефти, мазуте и т. п.). При электрохимической коррозии металл разрушается вследствие его растворения в жидкой среде, являющейся электролитом. Сущность процесса электрохимической коррозии заключается в том, что атомы, находящиеся в узлах кристаллической решетки металла, при контакте с раствором электролита переходят в раствор в форме ионов, оставляя эквивалентное количество электронов в металле. Переход атомов металла в ионы и растворение их в жидком электролите определяется величиной нормального электродного потенциала. Он характеризует то напряжение электрического тока, которое надо приложить к границе раздела твердого металла с жидким электролитом, чтобы воспрепятствовать переходу иона металла в раствор. Чем отрицательнее нормальный электродный потенциал, тем более резко выражено стремление металла к растворению в электролитах (например, свинец растворяется значительно медленнее, чем железо). Данный вид коррозии может также возникнуть при контакте двух разнородных металлов в присутствии электролита, когда между этими металлами возникает гальванический ток. В гальванической паре любых двух металлов будет растворяться тот металл, который обладает более отрицательным электродным потенциалом. Например, железо имеет более низкий отрицательный электродный потенциал, чем цинк, и более высокий, чем медь. Следовательно, при контакте железа с цинком будет разрушаться цинк, а при контакте железа с медью — железо. Гальванические пары при коррозии образуются не только между отдельными участками контактирующих металлов, но также и между микроскопически малыми кристалликами одного и того же сплава, если они различаются по химическому составу и физическим свойствам. В результате возникает коррозионное разрушение, которое может проникнуть очень глубоко и идти по границам раздела зерен (межкристаллическая коррозия). Например, в перлите феррит более электроотрицателен, чем цементит, он и будет разрушаться в соответствующих условиях. Таким образом, электрохимическая коррозия — это разрушение сплава, сопровождающееся появлением электрического тока в результате работы множества микрогальванических элементов на корродирующей поверхности металла. На скорость растворения металла в электролите влияют примеси, способы обработки металла, концентрация электролитов. Металл, находящийся под нагрузкой, корродирует значительно быстрее ненагруженного, так как нарушается целостность защитной пленки и образуются микротрещины (коррозионное растрескивание). Разрушение металла одновременным воздействием знакопеременных нагрузок и коррозионной среды называют коррозионной усталостью. В зависимости от характера окружающей среды электрохимическая коррозия может быть подводной, атмосферной, почвенной, вызванной блуждающими токами. Электрохимическая коррозия металлов в воде обусловливается присутствием в ней растворенного кислорода. При атмосферной коррозии электролитом служит тонкая пленка влаги, сам же процесс коррозии ничем не отличается от коррозии в воде. В результате коррозии стали на ее поверхности появляется смесь различных гидратированных оксидов железа, имеющих состав «FeO-ph3O+mFe2O3-<?h3O (ржавчина). Активному протеканию процесса коррозии способствует углекислый и в особенности сернистый газы, хлористый водород, различные соли. Защиту от коррозии следует начинать с правильного подбора химического состава и структуры металла. При конструировании необходимо избегать форм, способствующих задержке влаги. Для защиты металла от коррозии применяют различные способы. Легирование стали повышает ее антикоррозионные свойства. Например, совершенную стойкость к атмосферной коррозии показывают нержавеющие легированные стали, содержащие в большом количестве хром, который, образуя на поверхности оксидные пленки, приводит сталь в пассивное состояние. Существенно повышается (в 1,5...3 раза) коррозионная стойкость строительных сталей при введении в их состав меди (0,2...0,5 %). Повышенной стойкости нержавеющих сталей против коррозии способствуют также их однородность и небольшое содержание вредных примесей. Защитные покрытия представляют собой пленки (металлические, оксидные, лакокрасочные и т.п.). Металлические покрытия бывают двух типов — анодные и катодные. Для анодного покрытия используют металлы, обладающие более отрицательным электродным потенциалом, чем основной металл (например, цинк, хром). Для катодного покрытия выбирают металлы, имеющие меньшее отрицательное значение электродного потенциала, чем основной металл (медь, олово, свинец, никель и др.). Металлические покрытия наносят горячим методом, гальваническим и металлизацией. При горячем методе покрытия изделия погружают в ванну с расплавленным защитным металлом, температура которого ниже, чем температура плавления изделия (цинк, олово, свинец). Гальванический метод защиты состоит в том, что на поверхности изделия путем электролитического осаждения из растворов солей создается тонкий слой защищаемого металла. Покрываемое изделие при этом служит катодом, а осаждаемый металл — анодом. Металлизация — покрытие поверхности детали расплавленным металлом, распыленным сжатым воздухом. Преимуществом этого метода защиты металла является то, что покрывать расплавом можно уже собранные конструкции. Недостаток заключается в том, что получается шероховатая поверхность. Металлические покрытия можно наносить также посредством диффузии металла покрытия в основной металл— алитирование, силицирование, хромирование (см. с. 316), а также способом плакирования, т.е. наложения на основной металл тонкого слоя защитного металла (биметалл) и зарепления его путем горячей прокатки (например, железо — медный сплав, дюралюминий — чистый алюминий). Оксидирование — защита оксидными пленками. Для этого естественную оксидную пленку, всегда имеющуюся на металле, делают более прочной путем обработки сильным окислителем, например концентрированной азотной кислотой, растворами марганцевой или хромовой кислот и их солей. Частным случаем оксидирования является воронение стали. В этом случае на поверхности также создается оксидная пленка, но более сложными приемами, связанными с многократной термической обработкой при температуре ЗО0...40О°С в присутствии древесного угля. Фосфатирование состоит в получении на изделии поверхностной пленки из нерастворимых солей железа или марганца в результате погружения металла в горячие растворы кислых фосфатов железа или марганца. Лакокрасочные покрытия основаны на механической защите металла пленкой из различных красок и лаков. Ванны, раковины, декоративные изделия для защиты от коррозии покрывают эмалью, т. е. наплавляют на металл при температуре 750...800°С различные комбинации силикатов. При временной защите металлических изделий от коррозии (транспортировании, складировании) используют для покрытия металла невысыхающие масла (технический вазелин, лак этиноль), а также ингибиторы, т. е. вещества, замедляющие протекание реакции (нитрит натрия с углекислым аммонием, с уротропином, ингибитор ную бумагу и др.). |
megalektsii.ru
КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ — Мегаобучалка
Коррозией называется окислительно-восстановительный процесс разрушения металлов и сплавов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Причиной коррозии является термодинамическая неустойчивость чистых металлов. «Corrosio» означает разъедание. Разрушение материала истиранием относится к процессу эрозии.
По механизму процессы коррозии делятся на химические и электрохи-мические.
При химической коррозии металл взаимодействует со средой, не проводящей электрический ток. Передача электронов от атома металла к окислителю происходит при их непосредственном контакте за один акт без разделения на стадии. Например, коррозия в сухих газах Н2, О2, NO2, SO2, h3S, Cl2 и др. Это – газовая коррозия. Так, кислород взаимодействует с металлом, образуя на его поверхности оксидную пленку. С повышением температуры скорость коррозии возрастает. Например, железо при ~ 300 °С тускнеет на воздухе, образуя оксидную пленку, а при температуре около 600 °С возникает слой окалины, т.е. толстый слой оксидной пленки.
Более опасна водородная коррозия. Водород растворяется в металле, при этом он атомизируется. Атомы водорода подвижнее его молекул, и поэтому проникают в глубинные слои металла, взаимодействуя с карбидом железа Fe3C – источником прочности стали. Сталь обезуглероживается, при этом ухудшаются ее прочностные свойства. Углерод карбида железа, соединяясь с водородом, образует метан, который нерастворим в металле. Образовавшиеся пузырьки метана испытывают огромное давление, металл из-за них становится хрупким. Это так называемое водородное охрупчивание. Таким образом, при водородной коррозии может наблюдаться потеря прочности, вследствие умягчения стали и возникновения ее хрупкости.
Коррозия в присутствии кислорода, например атмосферного, разрушает металл с поверхности, превращая его в оксидную пленку. Лишь у некоторых металлов (Zn, Al, Cr и некоторых других) эта пленка защищает их от дальнейшей коррозии. Газовая коррозия протекает в сухих газах или в присутствии воды, но при температуре выше температуры ее конденсации, т.е. когда вода находится в виде пара.
Другой разновидностью химической коррозии является коррозия в неэлектролитах, когда коррозионно-агрессивный агент, например, сероводород, растворен в углеводородах, что может иметь место в моторном масле. Но даже в присутствии в неэлектролитах следов влаги механизм коррозии будет уже нехимический.
Электрохимическая коррозия протекает по законам электрохимии при наличии всех ее необходимых условий, т.е. электролита, катода и анода. По сути, эта работа гальванического элемента, сопровождаемая химическими изменениями веществ и выделением электрического тока или тока коррозии.
Электрохимическая коррозия подразделяется на следующие разновидности: коррозия в электролитах, атмосферная коррозия, грунтовая, морская, электрическая.
Принцип действия коррозии в электролитах легко понять из рис. 4.
Р и с. 4. Схема электрохимической коррозии железа в растворе кислоты
Катодом служит какая-либо примесь в металле, например карбид железа Fe3C, анодом – любой прилегающий участок железа. На анодном участке железо окисляется Fe = Fe2+ +2 , а свободные электроны движутся к катоду, где они присоединяются к ионам водорода
2Н+ + 2 = Н2
При этом свободный водород выделяется в виде пузырьков.
Пример. В железной конструкции содержатся детали из меди. Составьте схему процесса коррозии в растворе соляной кислоты. Как отразится контакт железа с медью на процессе коррозии?
Решение. При контакте железа с медью, т.е. металлов, отличающихся по активности, в присутствии электролита возникает короткозамкнутый гальвани-ческий элемент, в котором железо, как более активный металл φ0Fe2+/Fe=-0,44B, играет роль анода, а медь φ0Cu2+/Cu = +0,34 В является катодом. Схему гальвани-ческого элемента можно записать в виде
(-)Fe | HCl | Cu(+)
Схему протекания электрохимической коррозии можно представить электронными уравнениями
А (-) Fe – 2 = Fe2+
К (+) 2Н+ + 2 = Н2
В наибольшей мере металлы разрушаются от атмосферной коррозии. Необ-ходимым условием ее возникновения является наличие воды и кислорода. Основной причиной атмосферной коррозии является неравномерная аэрация поверхности металла. Участки, где кислорода меньше, являются анодными; участки, где его больше – катодными. Схема возникновения и развития атмо-сферной коррозии на участке железа с неравномерной аэрацией - неравномерным контактом атмосферы с поверхностью металла – приведена на рис. 5.
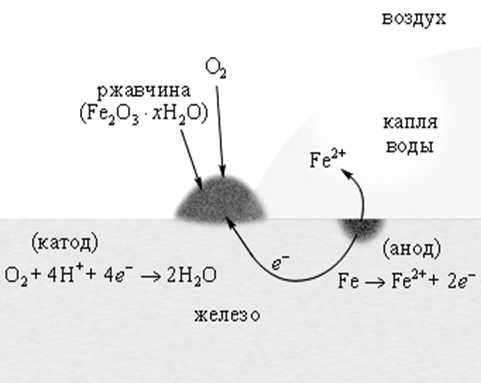
Р и с. 5. Схема атмосферной коррозии стали
Атмосферный кислород достигает поверхности трещины или зазора в металле позднее, чем основной поверхности металла. Взаимодействуя с металлом, кислород образует оксид, т.е. пассивную пленку, которая является катодом, а участок металла, до которого не успел дойти кислород, - анодом. Возникает гальванический элемент, и металл поверхности трещины начинает окисляться. В этом месте образуется каверна, которая разрастается. Ионы железа, взаимодействуя с водой, превращаются в гидроксид железа(II) – первичный продукт коррозии
Fe2+ +2ОН- = Fe(ОН)2,
а ионы водорода восстанавливаются до свободного водорода. В избытке кислорода гидроксид железа(II) превращается в гидроксид железа(III):
4Fe(ОН)2 + O2 + 2h3O = 4Fe(ОН)3.
Смесь Fe(ОН)2 и Fe(ОН)3 называется ржавчиной. Оксидная формула ржавчины имеет вид nFeO×mFe2О3×ph3O.
Разновидностью атмосферной коррозии являются грунтовая и морская коррозия.
Для предотвращения больших потерь от коррозии применяются различные методы для ее ослабления:
защита путем изменения коррозионной среды;
неметаллические покрытия;
металлические покрытия;
легирование металлов;
электрохимическая защита.
Скорость процессов коррозии может быть существенно уменьшена введением в коррозионную среду ингибиторов (замедлителей) коррозии. К числу ингибиторов относятся многие вещества неорганического или органического характера, например, нитриты и нитраты, хроматы, альдегиды, гетероор-ганические соединения и другие. Ингибиторы вводятся в среду в малых количествах, порядка долей процента, при этом скорость коррозии уменьшается в сотни и тысячи раз. Если вводить ингибитор, например в кислоту, то она не изменяет своих свойств по отношению к разным химическим соединениям, но теряет свою агрессивность по отношению к металлам. Это происходит вследствие того, что ингибиторы адсорбируются на поверхности металла, образуя тонкие пленки, которые выводят из строя коррозионные микрогальванопары, препятствуя протеканию электродных процессов.
Неметаллические покрытия делятся на неорганические и органические. К неорганическим покрытиям относятся оксидные и фосфатные пленки на железе. При кипячении железа в растворах солей фосфорной кислоты (обычно солей железа и марганца) получают фосфатные пленки, хорошо защищающие от коррозии в атмосфере.
Широко распространены органические покрытия, например, лаки, краски, консервационные смазки.
При защите металлов другими металлами различают анодные и катодные покрытия. Анодное покрытие обладает более отрицательным электродным потен-циалом, чем защищаемый металл, и при образовании гальванопары служит анодом, т.е. разрушается, выполняя защитную функцию. К катодным относятся покрытия с противоположным соотношением в свойствах металлов, например, железо луженое или покрытое медью. В этом случае покрытие выполняет изолирующую функцию до тех пор, пока оно не разрушено. Если целостность катодного покрытия нарушается, то возникает гальванический элемент, работа которого сводится к разрушению защищаемого металла.
Для защиты металлов от наиболее распространенного и вредного вида химической коррозии – газовой коррозии – используют жаростойкое легирование, т.е. введение в состав сплава компонентов, повышающих жаростойкость. Единой теории, объясняющей механизм этого вида защиты, не существует. Две из трех наиболее обоснованных теорий объясняют механизм этого вида защиты образованием защитных оксидных пленок легирующим металлом.
Электрохимическая защита подразделяется на протекторную и катодную. При протекторной защите защищаемая конструкция находится в среде электролита (вода, грунт).
Для протекторной защиты используется специальный электрод – протектор с более отрицательным потенциалом, чем потенциал защищаемой конструкции.
В других методах, называемых катодной защитой, аналогичный результат достигается присоединением металла к отрицательному полюсу внешнего источника постоянного тока. Защитное действие осуществляется благодаря повышению концентрации электронов в поверхностном слое металла, что затрудняет его растворение.
281. Как происходит атмосферная коррозия луженого и оцинкованного железа при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
282. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты свинца в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов.
283. Железная пластинка, склепанная с медной, погружена в разбавленную серную кислоту. На какой пластинке будет выделяться водород? Почему? Происходящие процессы изобразите электронными уравнениями.
284. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислород, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив электронные уравнения анодного и катодного процессов. Напишите уравнение протекающей химической реакции.
285. Для защиты от коррозии железо покрыли: а) цинком; б) оловом; в) никелем. Составьте уравнения анодных и катодных процессов, которые будут происходить в нейтральной среде при нарушении целостности защитного слоя.
286. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. После высыхания капли в ее центре появляется пятно ржавчины. Чем это можно объяснить? Какой участок металла, находящийся под каплей воды, является анодным и какой катодным? Составьте электронные уравнения соответствующих процессов.
287. Железное изделие покрыли кадмием. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
288. Алюминиевую и железную пластинки погрузили в раствор хлорида меди(II). Составьте электронные и ионные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут происходить на пластинках, если наружные концы их соединить проводником?
289. Железные пластинки находятся в растворе соляной кислоты в контакте с серебряной, свинцовой и алюминиевой пластинками. В каком случае скорость коррозии наибольшая? Почему? Ответ мотивируйте расчетами и составьте схемы анодных и катодных процессов.
290. Какой металл будет окисляться при нарушении поверхности, если а) медь покрыта алюминием; б) никель покрыт серебром? Составьте электронные уравнения анодных и катодных процессов коррозии указанных металлов в растворе серной кислоты.
291. Какой металл целесообразнее выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? Почему? Напишите уравнения электродных процессов, происходящих при коррозии протектора в кислых почвенных водах.
292. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов.
293. Если гвоздь вбить во влажное дерево, то ржавчиной покрывается та его часть, которая находится внутри дерева. Чем это можно объяснить? Анодом или катодом является эта часть гвоздя? Составьте электронные уравнения соответствующих процессов.
294. Склепаны два металла и находятся в кислом растворе: а) цинк с серебром; б) алюминий с марганцем. Указать, какой из металлов подвергается коррозии. Почему? Составьте электронные уравнения анодного и катодного процессов, происходящих в обоих случаях.
295. Железное изделие покрыли свинцом. Какое это покрытие – анодное или катодное? Почему? Составьте электронные уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте. Какие продукты коррозии образуются в первом и во втором случаях?
296. В раствор соляной кислоты поместили цинковую пластинку и цинковую пластинку, частично покрытую серебром. В каком случае процесс коррозии цинка происходит интенсивнее? Ответ мотивируйте, составив электронные уравнения соответствующих процессов.
297. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте электронные уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в сильнокислой среде.
298. В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую алюминием. В каком случае электрохимическая коррозия происходит интенсивнее? Что разрушается? Составьте электронные уравнения анодного и катодного процессов.
299. В контакте с цинком и железом в растворе серной кислоты коррозия магния будет происходить сильнее. Почему? Дать схему процесса коррозии.
300. Какие металлы могут быть защищены от коррозии протекторным способом, если в качестве протекторов брать магний, цинк? Какую роль – катода или анода – играет протектор? Составить схемы анодного и катодного процессов коррозии магния, цинка в контакте с железом во влажном воздухе.
megaobuchalka.ru
Коррозия металлов и способы защиты от неё
 Коррозия металлов и способы защиты от неё Урок химии в 11 классе Автор: Наумов Сергей
Коррозия металлов и способы защиты от неё Урок химии в 11 классе Автор: Наумов Сергей
 КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. Химический энциклопедический словарь
КОРРОЗИЯ МЕТАЛЛОВ – физико-химическое или химическое взаимодействие между металлом (сплавом) и средой, приводящее к ухудшению функциональных свойств металла (сплава), среды или включающей их технической системы. Химический энциклопедический словарь
 Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание» ). Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
Слово коррозия происходит от латинского «corrodo» – «грызу» (позднелатинское «corrosio» означает «разъедание» ). Коррозия вызывается химической реакцией металла с веществами окружающей среды, протекающей на границе металла и среды. Чаще всего это окисление металла, например, кислородом воздуха или кислотами, содержащимися в растворах, с которыми контактирует металл. Особенно подвержены этому металлы, расположенные в ряду напряжений (ряду активности) левее водорода, в том числе железо.
 Химическая коррозия 0 +4 0 t +3 +6 -2 2 Fe+ 3 SO 2 + 3 O 2 Fe 2(SO 4)3 0 0 t +3 -1 2 Fe + 3 Cl 2 2 Fe. Cl 3 0 0 t +2 -2 2 Zn + O 2 2 Zn. O Коррозия происходит в непроводящей ток среде. Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т. д. )
Химическая коррозия 0 +4 0 t +3 +6 -2 2 Fe+ 3 SO 2 + 3 O 2 Fe 2(SO 4)3 0 0 t +3 -1 2 Fe + 3 Cl 2 2 Fe. Cl 3 0 0 t +2 -2 2 Zn + O 2 2 Zn. O Коррозия происходит в непроводящей ток среде. Например, взаимодействие металла с сухими газами или жидкостями - неэлектролитами (бензином, керосином и т. д. )
 Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.
Многие металлы (например, алюминий) при коррозии покрываются плотной, оксидной пленкой, которая не позволяет окислителям проникнуть в более глубокие слои и потому предохраняет металл от коррозии. При удалении этой пленки металл начинает взаимодействовать с влагой и кислородом воздуха.
 Электрохимическая коррозия Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
Электрохимическая коррозия Коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Металлы не однородны и содержат различные примеси. При контакте их с электролитами одни участки поверхности выполняют роль- анодов, другие- катодов.
 Рассмотрим разрушение железного образца в присутствии примеси олова. 1. В кислой среде: На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит: Fe 0 – 2 e = Fe 2+ (анод) На катоде (олово) происходит восстановление катионов водорода: 2 H+ + 2 e H 20 Ржавчина не образуется, т. к. ионы железа (Fe 2+) переходят в раствор
Рассмотрим разрушение железного образца в присутствии примеси олова. 1. В кислой среде: На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит: Fe 0 – 2 e = Fe 2+ (анод) На катоде (олово) происходит восстановление катионов водорода: 2 H+ + 2 e H 20 Ржавчина не образуется, т. к. ионы железа (Fe 2+) переходят в раствор
 2. В щелочной или нейтральной среде: Fe 0 – 2 e Fe 2+ (на аноде) O 20 + 2 H 2 O + 4 e 4 OH – (на катоде) ____________________________ Fe 2+ + 2 OH - Fe(OH)2 4 Fe (OH)2 + O 2 + 2 H 2 O = 4 Fe (OH)3 ( Ржавчина)
2. В щелочной или нейтральной среде: Fe 0 – 2 e Fe 2+ (на аноде) O 20 + 2 H 2 O + 4 e 4 OH – (на катоде) ____________________________ Fe 2+ + 2 OH - Fe(OH)2 4 Fe (OH)2 + O 2 + 2 H 2 O = 4 Fe (OH)3 ( Ржавчина)
 В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4 Fe + 6 H 2 O (влага) + 3 O 2 (воздух) = 4 Fe(OH)3
В результате коррозии железо ржавеет. Этот процесс очень сложен и включает несколько стадий. Его можно описать суммарным уравнением: 4 Fe + 6 H 2 O (влага) + 3 O 2 (воздух) = 4 Fe(OH)3
 Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
Гидроксид железа(III) очень неустойчив, быстро теряет воду и превращается в оксид железа(III). Это соединение не защищает поверхность железа от дальнейшего окисления. В результате железный предмет может быть полностью разрушен.
 Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
Катионы водорода и растворенный кислород- важнейшие окислители, вызывающие электрохимическую коррозию
 Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности
 Значительноусиливает коррозию повышение температуры
Значительноусиливает коррозию повышение температуры
 Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду для электрохимической коррозии подземных коммуникаций и деталей автомобилей.
Зимой для удаления снега и льда с тротуаров используют техническую соль. Образующиеся растворы создают благоприятную среду для электрохимической коррозии подземных коммуникаций и деталей автомобилей.
 Способы защиты от коррозии
Способы защиты от коррозии
 1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки : хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой(например Cr 2 O 3). Общеизвестные легированные стали – «нержавейки» , из которых изготовляют предметы домашнего обихода(ножи, вилки, ложки), детали машин, инструменты.
1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага. 2. Применение легированных сплавов, содержащих специальные добавки : хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой(например Cr 2 O 3). Общеизвестные легированные стали – «нержавейки» , из которых изготовляют предметы домашнего обихода(ножи, вилки, ложки), детали машин, инструменты.
 3. Нанесение защитных покрытий Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы. Химические – искусственно создаваемые поверхностные плёнки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей плёнки оксидов железа на поверхности стального изделия.
3. Нанесение защитных покрытий Неметаллические – неокисляющиеся масла, специальные лаки, краски, эмали. Правда, они недолговечны, но зато дешевы. Химические – искусственно создаваемые поверхностные плёнки: оксидные, нитридные, силицидные, полимерные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению – это процесс получения тончайшей плёнки оксидов железа на поверхности стального изделия.
 Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки. Нанесение хрома- хромирование, никеля - никелирование, цинка - цинкование и т. д. Покрытием может служить и пассивный в химическом отношении металл – золото, серебро, медь.
Металлические – это покрытие другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные плёнки. Нанесение хрома- хромирование, никеля - никелирование, цинка - цинкование и т. д. Покрытием может служить и пассивный в химическом отношении металл – золото, серебро, медь.
 4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного металла (протектора), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и др. стальных изделий используются магний, алюминий, цинк. *Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока , что исключает возможность её анодного разрушения.
4. Электрохимические методы защиты *Протекторная (анодная) – к защищаемой металлической конструкции присоединяют кусочек более активного металла (протектора), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и др. стальных изделий используются магний, алюминий, цинк. *Катодная – металлоконструкцию подсоединяют к катоду внешнего источника тока , что исключает возможность её анодного разрушения.
 5. Специальная обработка электролита или другой среды, в которой находится защитная металлическая конструкция Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота –азотной кислотой; летучий диэтиламин впрыскивают в различные ёмкости. Ингибиторы действуют только на металл, делая его пассивным по отношению к среде. Науке известно более 5 тыс. ингибиторов коррозии. Удаление растворённого в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
5. Специальная обработка электролита или другой среды, в которой находится защитная металлическая конструкция Введение веществ - ингибиторов, замедляющих коррозию. Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота –азотной кислотой; летучий диэтиламин впрыскивают в различные ёмкости. Ингибиторы действуют только на металл, делая его пассивным по отношению к среде. Науке известно более 5 тыс. ингибиторов коррозии. Удаление растворённого в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
 Спасибо за внимание!
Спасибо за внимание!
present5.com