Содержание
ICSC 1166 — СЕРА
ICSC 1166 — СЕРА
« back to the search result list(ru)
Chinese — ZHEnglish — ENFinnish — FIFrench — FRHebrew — HEHungarian — HUItalian — ITJapanese — JAKorean — KOPersian — FAPolish — PLPortuguese — PTRussian — RUSpanish — ES
| СЕРА | ICSC: 1166 (Ноябрь 2000) |
| CAS #: 7704-34-9 |
| UN #: 1350 |
| EINECS #: 231-722-6 |
| ОСОБЫЕ ОПАСНОСТИ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ТУШЕНИЕ ПОЖАРА | |
|---|---|---|---|
| ПОЖАР И ВЗРЫВ | Горючее. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. Мелкодисперсные частицы образуют в воздухе взрывчатые смеси. | НЕ использовать открытый огонь, НЕ допускать образование искр, НЕ КУРИТЬ. Замкнутая система, взрывозащищенное (для пыльной среды) электрическое оборудование и освещение. Не допускать оседания пыли. Предотвращать образование электростатического заряда (например, используя заземление). | Использовать распыленную воду, пену, порошок, сухой песк. В случае пожара: охлаждать бочки и т.д. распыляя воду. |
| НЕ ДОПУСКАТЬ ОБРАЗОВАНИЕ ПЫЛИ! | |||
|---|---|---|---|
| СИМПТОМЫ | ПРОФИЛАКТИЧЕСКИЕ МЕРЫ | ПЕРВАЯ ПОМОЩЬ | |
| Вдыхание | Ощущения жжения. Кашель. Боли в горле. | Применять местную вытяжку или средства защиты органов дыхания. | Свежий воздух, покой. Полусидячее положение. Обратиться за медицинской помощью. Обратиться за медицинской помощью. |
| Кожа | Покраснение. | Защитные перчатки. | Снять загрязненную одежду. Ополоснуть и затем промыть кожу водой с мылом. |
| Глаза | Покраснение. Боль. Помутнение зрения. | Использовать защитные очки. | Прежде всего промыть большим количеством воды в течение нескольких минут (снять контактные линзы, если это возможно сделать без затруднений), затем обратится за медицинской помощью. |
| Проглатывание | Ощущение жжения. Диарея. | Не принимать пищу, напитки и не курить во время работы. | Прополоскать рот. Обратиться за медицинской помощью . |
| ЛИКВИДАЦИЯ УТЕЧЕК | КЛАССИФИКАЦИЯ И МАРКИРОВКА |
|---|---|
Индивидуальная защита: Респиратор с сажевым фильтром, подходящий для концентрации вещества в воздухе.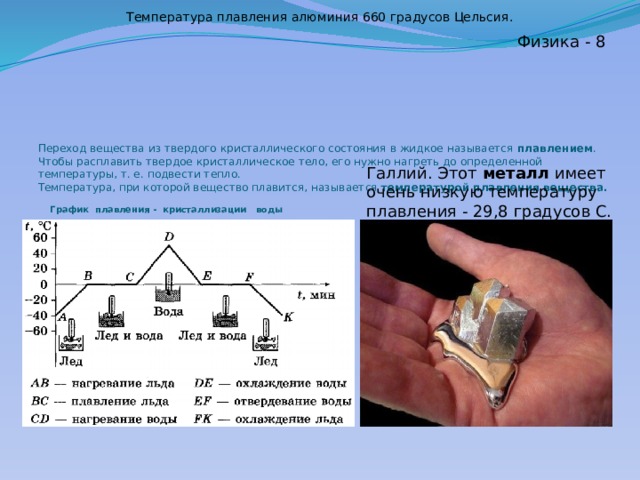 Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. Смести просыпанное вещество в закрытые контейнеры. При необходимости, сначала намочить, чтобы избежать появления пыли. |
Согласно критериям СГС ООН
Транспортировка |
| ХРАНЕНИЕ | |
| Обеспечить огнестойкость. Отдельно от сильных окислителей. | |
| УПАКОВКА | |
| СЕРА | ICSC: 1166 |
| ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА | |
|---|---|
|
Агрегатное Состояние; Внешний Вид
Физические опасности
Химические опасности
|
Формула: S / S8 |
| ВОЗДЕЙСТВИЕ НА ОРГАНИЗМ И ЭФФЕКТЫ ОТ ВОЗДЕЙСТВИЯ | |
|---|---|
|
Пути воздействия
Эффекты от кратковременного воздействия
|
Риск вдыхания
Эффекты от длительного или повторяющегося воздействия
|
| Предельно-допустимые концентрации |
|---|
|
|
| ОКРУЖАЮЩАЯ СРЕДА |
|---|
| ПРИМЕЧАНИЯ |
|---|
| Often transported in molten state (UN 2448; TEC(R)-115). Molten sulfur reacts with hydrocarbons to form toxic and flammable gases. В зависимости от степени воздействия, рекомендуется периодическое медицинское обследование. |
| ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ |
|---|
|
Классификация ЕС |
| (ru) | Ни МОТ, ни ВОЗ, ни Европейский Союз не несут ответственности за качество и точность перевода или за возможное использование данной информации.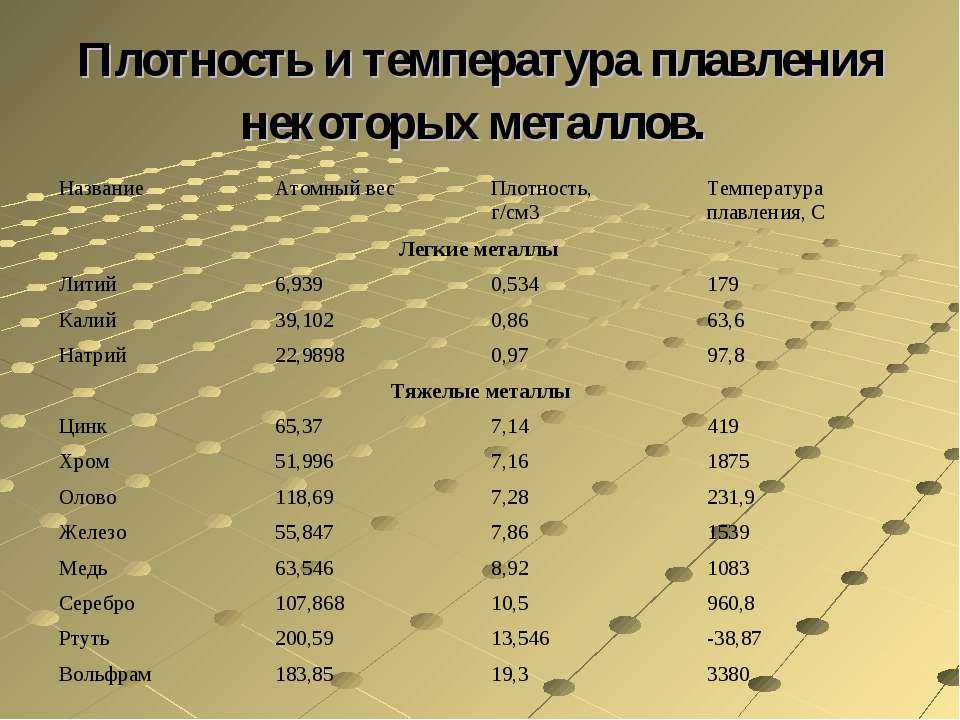 © Версия на русском языке, 2018 |
Температура плавления серы. Установки для плавления серы
Сера — один из самых распространённых элементов земной коры. Чаще всего она встречается в составе минералов, содержащих кроме неё металлы. Очень интересны процессы, происходящие при достижении температуры кипения и плавления серы. Эти процессы, а также связанные с ними сложности мы и разберём в этой статье. Но для начала окунёмся в историю открытия этого элемента.
История
В самородном виде, а также в составе минералов сера была известна ещё с древности. В старых греческих текстах описано ядовитое действие ее соединений на человеческий организм. Сернистый газ, выделяемый при горении соединений этого элемента, действительно может быть смертельно опасен для людей. Примерно в 8 веке серу начали использовать в Китае для приготовления пиротехнических смесей. Неудивительно, ведь именно в этой стране, как считается, изобрели порох.
Ещё в Древнем Египте людям был известен способ обжига серосодержащей руды на основе меди. Таким образом добывали этот металл. Сера уходила в виде ядовитого газа SO2.
Таким образом добывали этот металл. Сера уходила в виде ядовитого газа SO2.
Несмотря на известность с древнейших времён, знание о том, что представляет собой сера, пришло благодаря работам французского естествоиспытателя Антуана Лавуазье. Именно он установил, что она является элементом, а продукты её горения — оксидами.
Вот такая вот краткая история знакомства людей с этим химическим элементом. Далее мы подробно расскажем о процессах, происходящих в недрах земли и приводящих к образованию серы в том виде, в котором она есть сейчас.
Как появляется сера?
Существует распространённое заблуждение о том, что чаще всего этот элемент встречается в самородном (то есть чистом) виде. Однако это не совсем так. Самородная сера чаще всего встречается как вкрапление в другую руду.
На данный момент есть несколько теорий, касающихся происхождения элемента в чистом виде. Они предполагают отличие во времени образования серы и руд, в которые она вкрапляется. Первая, теория сингенеза, предполагает образование серы совместно с рудами.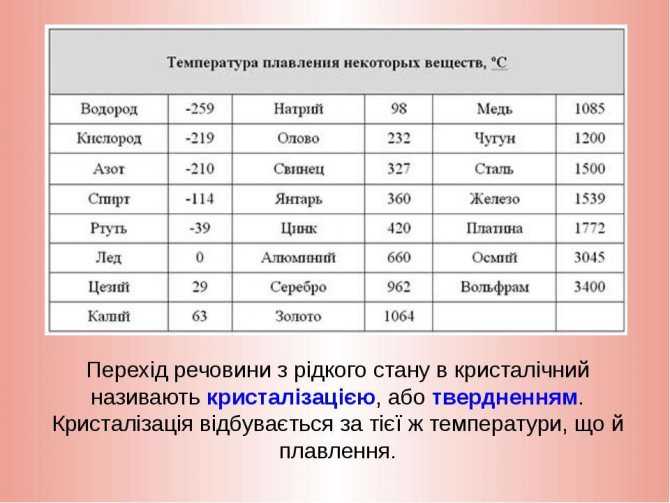 Согласно ей некоторые бактерии, обитающие в толще океана, восстанавливали сульфаты, находящиеся в воде, до сероводорода. Последний, в свою очередь, поднимался вверх, где с помощью других бактерий окислялся до серы. Она падала на дно, смешивалась с илом, и впоследствии они вместе образовывали руду.
Согласно ей некоторые бактерии, обитающие в толще океана, восстанавливали сульфаты, находящиеся в воде, до сероводорода. Последний, в свою очередь, поднимался вверх, где с помощью других бактерий окислялся до серы. Она падала на дно, смешивалась с илом, и впоследствии они вместе образовывали руду.
Суть теории эпигенеза — то, что сера в руде образовалась позднее её самой. Тут есть несколько ответвлений. Мы расскажем лишь о самом распространённом варианте этой теории. Состоит он вот в чём: подземные воды, протекая через скопления сульфатных руд, обогащаются ими. Затем, проходя через месторождения нефти и газа, ионы сульфатов восстанавливаются до сероводорода благодаря углеводородам. Сернистый водород, поднимаясь к поверхности, окисляется кислородом воздуха до серы, которая и оседает в породах, образуя кристаллы. Эта теория в последнее время находит всё больше подтверждений, но пока остаётся открытым вопрос о химизме этих превращений.
От процесса происхождения серы в природе перейдём к её модификациям.
Аллотропия и полиморфизм
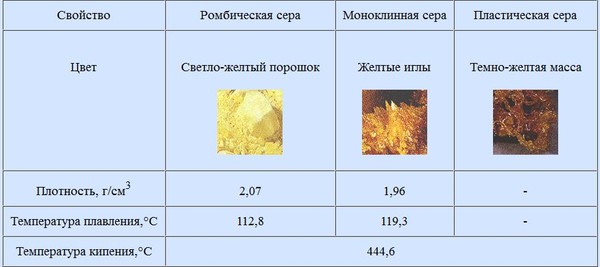
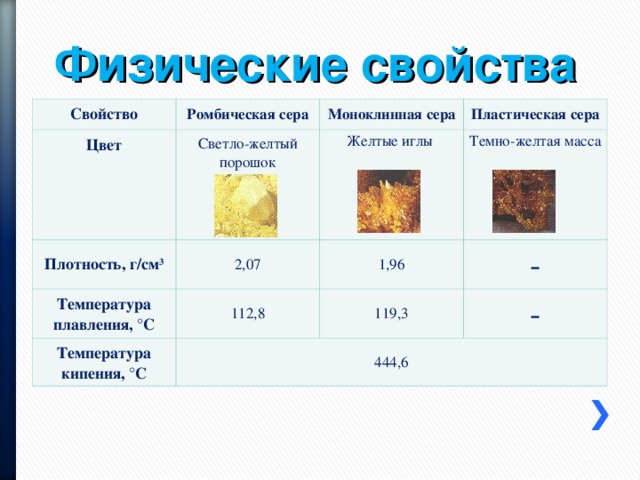
Сера, как и многие другие элементы таблицы Менделеева, существует в природе в нескольких формах. В химии их называют аллотропными модификациями. Существует сера ромбическая. Температура плавления её несколько ниже, чем у второй модификации: моноклинной (112 и 119 градусов по Цельсию). А различаются они строением элементарных ячеек. Ромбическая сера отличается большей плотностью и устойчивостью. Она может при нагревании до 95 градусов переходить во вторую форму — моноклинную. У обсуждаемого нами элемента есть аналоги в таблице Менделеева. Полиморфизм серы, селена и теллура учёные обсуждают до сих пор. Они имеют очень тесную связь между собой, и все модификации, которые они образуют, сильно похожи.
А далее мы разберём процессы, происходящие при плавлении серы. Но перед тем как начать, следует немного окунуться в теорию строения кристаллической решётки и явлений, происходящих при фазовых переходах вещества.
Из чего состоит кристалл?
Как известно, в газообразном состоянии вещество находится в виде молекул (или атомов), беспорядочно движущихся в пространстве. В жидком веществе составляющие его частицы группируются, но всё равно имеют достаточно большую свободу движения. В твёрдом агрегатном состоянии всё немного иначе. Здесь степень упорядоченности возрастает до своего максимального значения, и атомы образуют кристаллическую решётку. В ней, конечно, происходят колебания, но они имеют очень малую амплитуду, и это нельзя назвать свободным движением.
В жидком веществе составляющие его частицы группируются, но всё равно имеют достаточно большую свободу движения. В твёрдом агрегатном состоянии всё немного иначе. Здесь степень упорядоченности возрастает до своего максимального значения, и атомы образуют кристаллическую решётку. В ней, конечно, происходят колебания, но они имеют очень малую амплитуду, и это нельзя назвать свободным движением.
Любой кристалл можно поделить на элементарные ячейки — такие последовательные соединения атомов, которые повторяются во всём объёме образца соединения. Тут стоит уточнить, что такие ячейки — это не кристаллическая решётка, и тут атомы располагаются внутри объёма определённой фигуры, а не в её узлах. Для каждого кристалла они индивидуальны, но их можно разделить на несколько основных типов (сингоний) в зависимости от геометрии: триклинная, моноклинная, ромбическая, ромбоэдрическая, тетрагональная, гексагональная, кубическая.
Кратко разберём каждый тип решёток, ведь они делятся ещё на несколько подвидов. И начнём мы с того, чем они могут отличаться между собой. Во-первых, это соотношения длин сторон, а во-вторых, угол между ними.
И начнём мы с того, чем они могут отличаться между собой. Во-первых, это соотношения длин сторон, а во-вторых, угол между ними.
Таким образом, триклинная сингония, самая низшая из всех, представляет собой элементарную решётку (параллелограмм), в которой все стороны и углы не равны между собой. Ещё один представитель так называемой низшей категории сингоний — моноклинная. Здесь два угла ячейки равны 90 градусам, а все стороны имеют разную длину. Следующий вид, относящейся к низшей категории, — ромбическая сингония. Она имеет три неравные между собой стороны, но все углы фигуры равны 90 градусам.
Перейдём к средней категории. И первый её член — тетрагональная сингония. Тут по аналогии нетрудно догадаться, что все углы фигуры, которую она представляет, равны 90 градусам, а также две из трёх сторон равны между собой. Следующий представитель — ромбоэдрическая (тригональная) сингония. Тут всё немного интереснее. Этот тип определяется тремя одинаковыми сторонами и тремя углами, которые равны между собой, но не являются прямыми.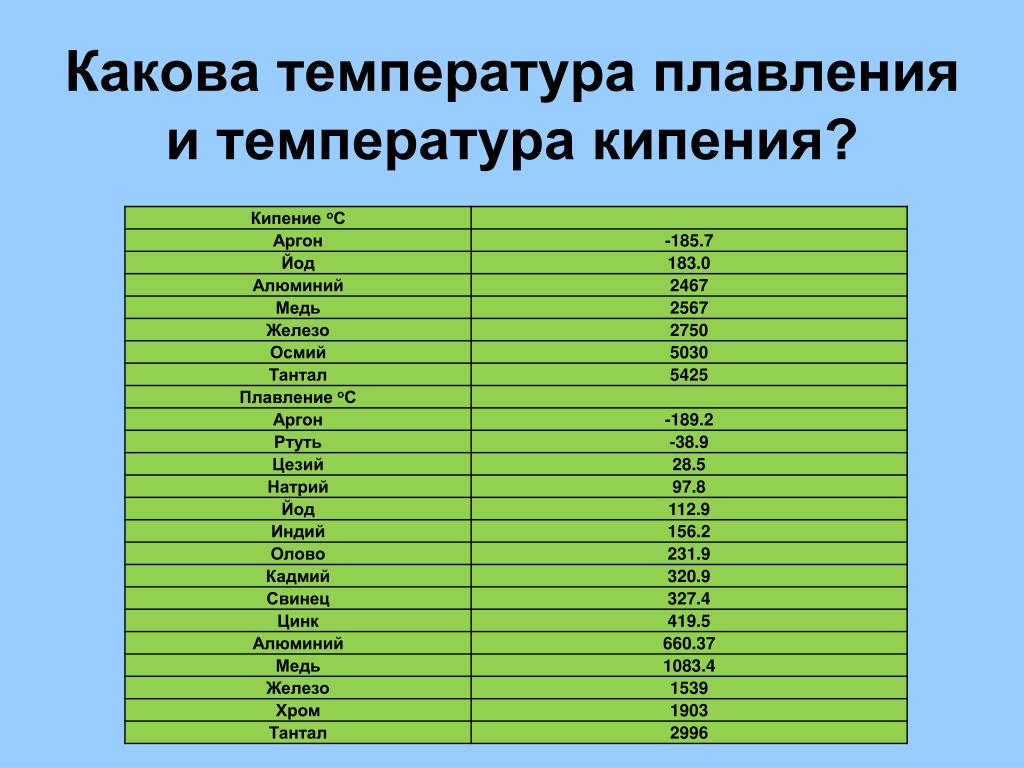
Последний вариант средней категории — гексагональная сингония. В её определении ещё больше сложности. Этот вариант строится на трёх сторонах, две из которых равны и образуют угол 120 градусов, а третья находится в перпендикулярной им плоскости. Если взять три ячейки гексагональной сингонии и приложить их друг к другу, то мы получим цилиндр с шестигранным основанием (именно поэтому у неё такое название, ведь «гекса» в переводе с латинского означает «шесть»).
Ну а вершина всех сингоний, имеющая симметрию во всех направлениях, — кубическая. Она является единственной принадлежащей к высшей категории. Тут можно сразу догадаться, как её можно характеризовать. Все углы и стороны равны между собой и образуют куб.
Итак, мы закончили разбор теории по основным группам сингоний, а теперь подробнее расскажем о строении различных форм серы и свойствах, которые из этого вытекают.
Строение серы
Как уже было сказано, сера имеет две модификации: ромбическую и моноклинную.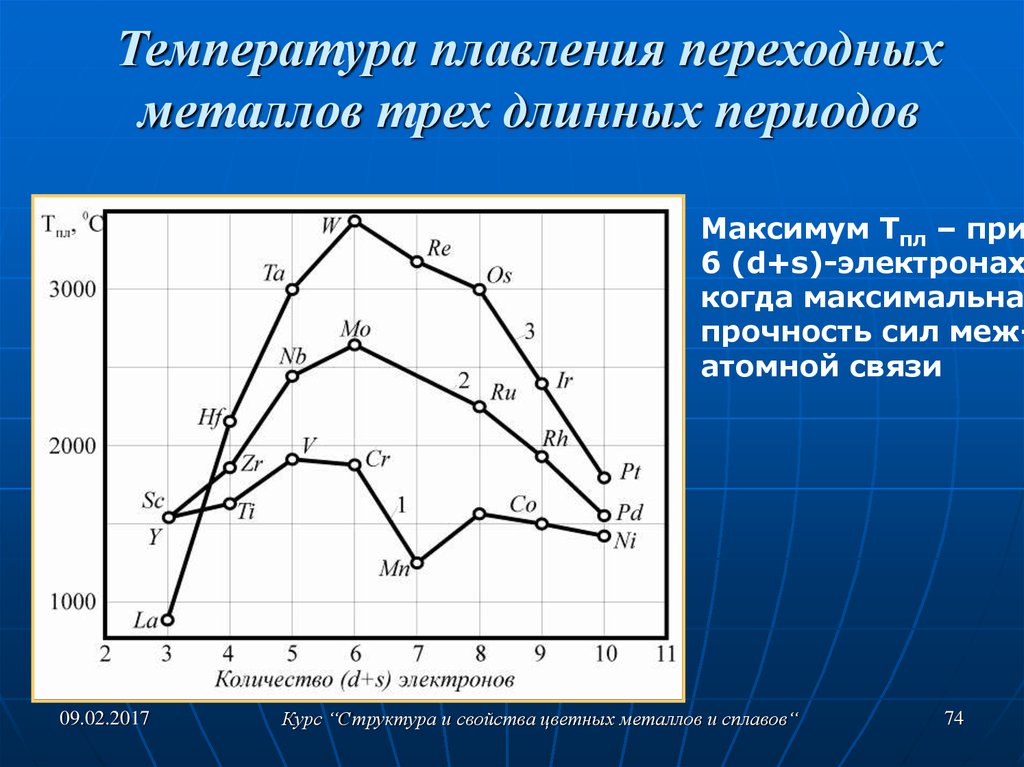 После раздела с теорией наверняка стало ясно, чем они отличаются. Но вся суть состоит в том, что в зависимости от температуры структура решётки может меняться. Вся суть в самом процессе превращений, происходящих, когда достигается температура плавления серы. Тогда кристаллическая решётка полностью разрушается, и атомы могут более-менее свободно двигаться в пространстве.
После раздела с теорией наверняка стало ясно, чем они отличаются. Но вся суть состоит в том, что в зависимости от температуры структура решётки может меняться. Вся суть в самом процессе превращений, происходящих, когда достигается температура плавления серы. Тогда кристаллическая решётка полностью разрушается, и атомы могут более-менее свободно двигаться в пространстве.
Но вернёмся к строению и особенностям такого вещества, как сера. Свойства химических элементов во многом зависят от их строения. Например, сера в силу особенностей кристаллической структуры обладает свойством флотации. Её частички не смачиваются водой, и прилипающие к ним пузырьки воздуха тянут их на поверхность. Таким образом, комовая сера всплывает при погружении в воду. На этом основаны некоторые способы отделения этого элемента из смеси ему подобных. А далее мы разберём основные методы добычи этого соединения.
Добыча
Сера может залегать с различными минералами, а следовательно, на различной глубине.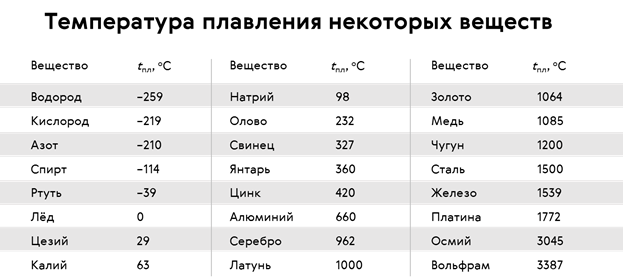 В зависимости от этого выбирают разные способы добычи. Если глубина небольшая и под землёй нет скоплений газов, мешающих добыче, то материал добывают открытым способом: убирают пласты пород и, находя руду, содержащую серу, отправляют её на переработку. Но если эти условия не соблюдены и есть опасности, то применяют скважинный метод. В нём необходимо, чтобы достигалась температура плавления серы. Для этого применяют специальные установки. Аппарат для плавления комовой серы в этом способе просто необходим. Но об этом процессе -немного позднее.
В зависимости от этого выбирают разные способы добычи. Если глубина небольшая и под землёй нет скоплений газов, мешающих добыче, то материал добывают открытым способом: убирают пласты пород и, находя руду, содержащую серу, отправляют её на переработку. Но если эти условия не соблюдены и есть опасности, то применяют скважинный метод. В нём необходимо, чтобы достигалась температура плавления серы. Для этого применяют специальные установки. Аппарат для плавления комовой серы в этом способе просто необходим. Но об этом процессе -немного позднее.
Вообще при добыче серы любым способом существует большой риск отравления, потому как чаще всего вместе с ней залегают сероводород и сернистый газ, которые очень опасны для человека.
Чтобы лучше понять, какими недостатками и достоинствами обладает тот или иной способ, ознакомимся с методами переработки серосодержащей руды.
Извлечение
Тут тоже есть несколько приёмов, основанных на совершенно разных свойствах серы. Среди них выделяют термические, экстракционные, пароводяные, центрифугальные и фильтрационные.
Самые проверенные из них — термические. Они основаны на том, что температуры кипения и плавления серы ниже, чем у руд, в которые она «вклинивается». Проблема только в том, что расходуется много энергии. Для поддержания температуры раньше приходилось сжигать часть серы. Несмотря на всю простоту, этот метод малоэффективен, и потери могут доходить до рекордных 45 процентов.
Мы идём по ветке исторического развития, поэтому переходим к пароводяному методу. В отличие от термических эти способы до сих пор используются на многих фабриках. Как ни странно, основаны они на том же свойстве — отличии температуры кипения и плавления серы от аналогичных показателей для сопутствующих металлов. Разница состоит лишь в том, каким образом происходит нагрев. Весь процесс идёт в автоклавах — специальных установках. Туда подаётся обогащённая серная руда, содержащая до 80 % добываемого элемента. Затем под давлением в автоклав закачивается горячий водяной пар. Разогреваясь до 130 градусов по Цельсию, сера плавится и выводится из системы. Конечно, остаются и так называемые хвосты — частички серы, плавающие в воде, образовавшейся благодаря конденсированию водяного пара. Их удаляют и вновь пускают в процесс, так как там тоже содержится немало нужного нам элемента.
Конечно, остаются и так называемые хвосты — частички серы, плавающие в воде, образовавшейся благодаря конденсированию водяного пара. Их удаляют и вновь пускают в процесс, так как там тоже содержится немало нужного нам элемента.
Один из самых современных методов — центрифужный. К слову, разработан он в России. Если кратко, суть его в том, что расплав смеси серы и минералов, которым она сопутствует, погружается в центрифугу и раскручивается с большой скоростью. Более тяжёлая порода за счёт центробежной силы стремится от центра, а сама сера остаётся выше. Затем полученные слои просто отделяют друг от друга.
Есть ещё один метод, который тоже по сей день используется на производствах. Заключается он в отделении серы от минералов через специальные фильтры.
В этой статье мы рассмотрим исключительно термические методы извлечения несомненно важного для нас элемента.
Процесс плавления
Исследование теплообмена при плавлении серы — важный вопрос, потому как это один из самых экономичных способов добычи этого элемента. Мы можем комбинировать параметры системы при нагревании, и нам необходимо вычислить их оптимальное сочетание. Именно для этого проводится исследование теплообмена и анализ особенностей процесса плавления серы. Существует несколько видов установок для осуществления этого процесса. Котёл для плавления серы — одна из них. Получение искомого элемента с помощью этого изделия — лишь вспомогательный способ. Однако сегодня есть специальная установка — аппарат для плавления комовой серы. Он может эффективно использоваться на производстве для получения высокочистой серы в большом объёме.
Мы можем комбинировать параметры системы при нагревании, и нам необходимо вычислить их оптимальное сочетание. Именно для этого проводится исследование теплообмена и анализ особенностей процесса плавления серы. Существует несколько видов установок для осуществления этого процесса. Котёл для плавления серы — одна из них. Получение искомого элемента с помощью этого изделия — лишь вспомогательный способ. Однако сегодня есть специальная установка — аппарат для плавления комовой серы. Он может эффективно использоваться на производстве для получения высокочистой серы в большом объёме.
Для вышеизложенной цели в 1890 году была изобретена установка, позволяющая плавить серу на глубине и выкачивать на поверхность с помощью трубы. Её конструкция достаточно проста и эффективна в действии: две трубы находятся друг в друге. По внешней трубе циркулирует перегретый до 120 градусов (температура плавления серы) пар. Конец внутренней трубы достаёт до залежей нужного нам элемента. Нагреваясь водой, сера начинает плавиться и выходить наружу. Всё достаточно просто. В современном варианте установка содержит ещё одну трубу: она находится внутри трубы с серой, и по ней идёт сжатый воздух, который заставляет расплав подниматься быстрее.
Всё достаточно просто. В современном варианте установка содержит ещё одну трубу: она находится внутри трубы с серой, и по ней идёт сжатый воздух, который заставляет расплав подниматься быстрее.
Есть ещё несколько методов, и в одном из них достигается температура плавления серы. Под землю опускают два электрода и пускают по ним ток. Так как сера — типичный диэлектрик, она не проводит ток и начинает сильно нагреваться. Таким образом она плавится и с помощью трубы, как и в первом способе, выкачивается наружу. Если серу хотят направить на производство серной кислоты, то её поджигают под землёй и выводят полученный газ наружу. Его доокисляют до оксида серы (VI), а потом растворяют в воде, получая конечный продукт.
Мы разобрали плавление серы, установки плавления серы и способы её добычи. Теперь пришла пора выяснить, зачем нужны столь сложные методы. На самом деле анализ процесса плавления серы и система контроля температуры нужны для того, чтобы хорошо очистить и эффективно применить конечный продукт добычи. Ведь сера — один из важнейших элементов, играющих ключевую роль во многих сферах нашей жизни.
Ведь сера — один из важнейших элементов, играющих ключевую роль во многих сферах нашей жизни.
Применение
Бессмысленно говорить, где применяются соединения серы. Проще сказать, где они не применяются. Сера есть в любой резине и резиновых изделиях, в газе, который подаётся в дома (там он нужен для идентификации утечки в случае таковой). Это самые бытовые и простые примеры. На самом деле сфер применения серы бесчисленное множество. Перечислить их все просто нереально. Но если мы возьмёмся делать это, окажется, что сера — один из самых необходимых для человечества элементов.
Заключение
Из этой статьи вы узнали, какая температура плавления у серы, чем этот элемент так важен для нас. Если вы заинтересованы в этом процессе и его изучении, то наверняка почерпнули для себя что-то новое. Например, это могут быть особенности плавления серы. В любом случае нет предела совершенству, и никому из нас не помешают знания процессов, происходящих в промышленности. Вы можете самостоятельно продолжить освоение технологических тонкостей процессов добычи, извлечения и переработки серы и других элементов, содержащихся в земной коре.
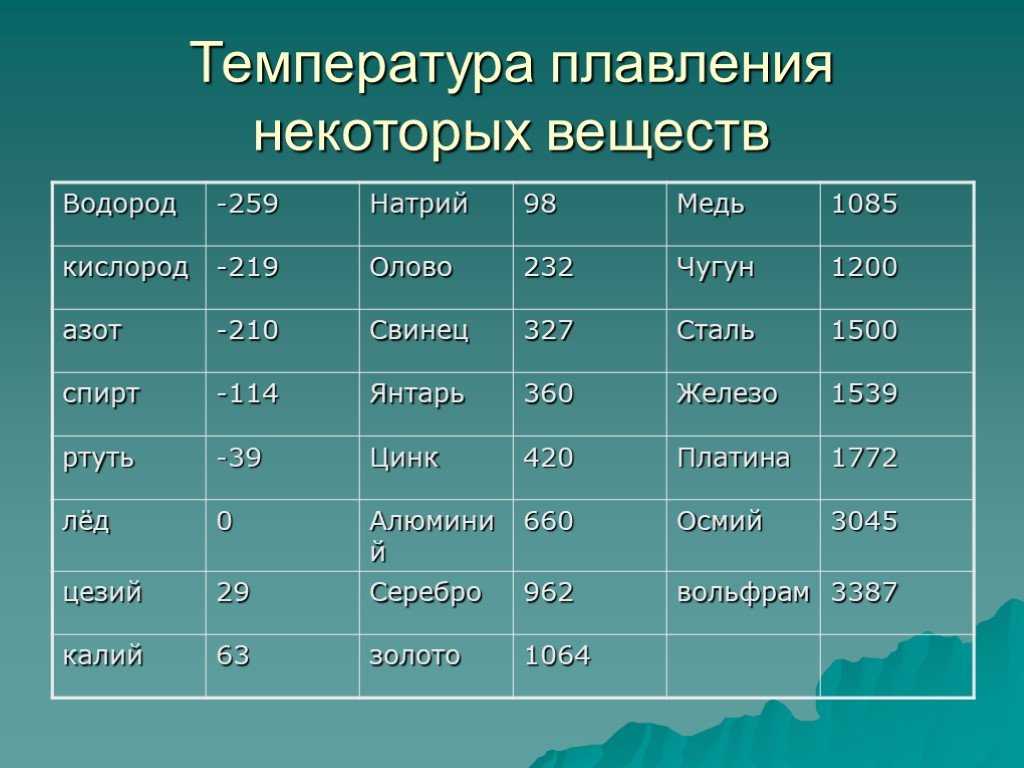
Справочник по точкам плавления
элементов – Angstrom Sciences
| Символы | Точка плавления | Имя | # | ||
|---|---|---|---|---|---|
| 0,95 К | -272,05 °С | -458 °F | Гелий | Он | 2 |
| 14,025 К | -258,975 °С | -434 °F | Водород | Х | 1 |
| 24,553 К | -248,447 °С | -415,205 °F | Неон | Не | 10 |
| 50,35 К | -222,65 °С | -368,77 °F | Кислород | О | 8 |
| 53,48 К | -219,52 °С | -363,14 °F | Фтор | Ф | 9 |
| 63,14 К | -209,86 °С | -345,75 °F | Азот | Н | 7 |
| 83,81 К | -189,19 °С | -308,54 °F | Аргон | Ар | 18 |
| 115,78 К | -157,22 °С | -251 °F | Криптон | Кр | 36 |
| 161,3 К | -111,7 °С | -169,1 °F | Ксенон | Хе | 54 |
| 172,16 К | -100,84 °С | -149,51 °F | Хлор | Кл | 17 |
| 202 К | -71 °С | -96 °F | Радон | Рн | 86 |
| 234,28 К | -38,72 °С | -37,7 °F | Меркурий | рт. ст. ст. | 80 |
| 265,9 К | -7,1 °С | 19,2 °F | Бром | Бр | 35 |
| 300 К | 27 °С | 81 °F | Франций | Пт | 87 |
| 301,55 К | 28,55 °С | 83,39 °F | Цезий | цезий | 55 |
| 302,9 К | 29,9 °С | 85,8 °F | Галлий | Га | 31 |
| 312,64 К | 39,64 °С | 103,35 °F | Рубидий | руб | 37 |
| 317,3 К | 44,3 °С | 111,7 °F | Фосфор | Р | 15 |
| 336,35 К | 63,35 °С | 146,03 °F | Калий | К | 19 |
| 371 К | 98 °С | 208 °F | Натрий | На | 11 |
| 386,7 К | 113,5 °С | 236,3 °F | Йод | я | 53 |
| 388,36 К | 115,36 °С | 239,65 °F | Сера | С | 16 |
| 429,76 К | 156,76 °С | 314,17 °F | Индий | В | 49 |
| 453,7 К | 180,7 °С | 357,3 °F | Литий | Ли | 3 |
| 494 К | 221 °С | 430 °F | Селен | Se | 34 |
505. 06 К 06 К | 232,06 °С | 449,71 °F | Олово | Сн | 50 |
| 527 К | 254 °С | 489 °F | Полоний | ПО | 84 |
| 544,52 К | 271,52 °С | 520,74 °F | Висмут | Би | 83 |
| 575 К | 302 °С | 576 °F | Астатин | В | 85 |
| 577 К | 304 °С | 579 °F | Таллий | Тл | 81 |
| 594,18 К | 321,18 °С | 610,12 °F | Кадмий | CD | 48 |
| 600,6 К | 327,6 °С | 621,7 °F | Свинец | Пб | 82 |
| 692,73 К | 419,73 °С | 787,51 °F | Цинк | Цин | 30 |
| 722,65 К | 449,65 °С | 841,37 °F | Теллурий | Те | 52 |
| 903,9 К | 630,9 °С | 1167,6 °F | Сурьма | Сб | 51 |
| 913 К | 640 °С | 1184 °F | Плутоний | Пу | 94 |
| 913 К | 640 °С | 1184 °F | Нептуний | Нп | 93 |
| 922 К | 649 °С | 1200 °F | Магний | мг | 12 |
| 933,25 К | 660,25 °С | 1220,45 °F | Алюминий | Ал | 13 |
| 973 К | 700 °С | 1292 °F | Радий | Ра | 88 |
| 1002 К | 729 °С | 1344 °F | Барий | Ба | 56 |
| 1042 К | 769 °С | 1416 °F | Стронций | Старший | 38 |
| 1071 К | 798 °С | 1468 °F | Церий | Се | 58 |
| 1081 К | 808 °С | 1486 °F | Мышьяк | Как | 33 |
| 1095 К | 822 °С | 1512 °F | Европий | ЕС | 63 |
| 1097 К | 824 °С | 1515 °F | Иттербий | Ыб | 70 |
| 1112 К | 839 °С | 1542 °F | Кальций | Са | 20 |
| 1133 К | 860 °С | 1580 °F | Эйнштейний | Эс | 99 |
| 1173 К | 900 °С | 1652 °F | Калифорния | См. | 98 |
| 1193 К | 920 °С | 1688 °F | Лантан | Ла | 57 |
| 1204 К | 931 °С | 1708 °F | Прометий | вечера | 61 |
| 1204 К | 931 °С | 1708 °F | Празеодим | Пр | 59 |
| 1210.4 К | 937,4 °С | 1719,3 °F | Германий | Ге | 32 |
| 1234 К | 961 °С | 1762 °F | Серебро | Аг | 47 |
| 1259 К | 986 °С | 1807 °F | Берклиум | Б К | 97 |
| 1267 К | 994 °С | 1821 °F | Америций | утра | 95 |
| 1289 К | 1016 °С | 1861 °F | Неодим | Нд | 60 |
| 1323 К | 1050 °С | 1922 °F | Актиний | Ас | 89 |
| 1337,58 К | 1064,58 °С | 1948,24 °F | Золото | Золото | 79 |
| 1340 К | 1067 °С | 1953 °F | Кюриум | См | 96 |
| 1345 К | 1072 °С | 1962 °F | Самарий | См | 62 |
| 1357,6 К | 1084,6 °С | 1984,3 °F | Медь | Медь | 29 |
| 1405 К | 1132 °С | 2070°F | Уран | У | 92 |
| 1517 К | 1244 °С | 2271 °F | Марганец | Мн | 25 |
| 1551 К | 1278 °С | 2332 °F | Бериллий | Быть | 4 |
| 1585 К | 1312 °С | 2394 °F | Гадолиний | Гд | 64 |
| 1630 К | 1357 °С | 2475 °F | Тербий | Тб | 65 |
| 1683 К | 1410 °С | 2570 °F | Кремний | Си | 14 |
| 1685 К | 1412 °С | 2574 °F | Диспрозий | Дай | 66 |
| 1726 К | 1453 °С | 2647 °F | Никель | Ni | 28 |
| 1743 К | 1470 °С | 2678 °F | Гольмий | Хо | 67 |
| 1768 К | 1495 °С | 2723 °F | Кобальт | Со | 27 |
| 1795 К | 1522 °С | 2772 °F | Эрбий | Er | 68 |
| 1799 К | 1526 °С | 2779 °F | Иттрий | Д | 39 |
| 1808 К | 1535 °С | 2795 °F | Железо | Фе | 26 |
| 1812 К | 1539 °С | 2802 °F | Скандий | Ск | 21 |
| 1818 К | 1545 °С | 2813 °F | Тулий | Тм | 69 |
| 1825 К | 1552 °С | 2826 °F | Палладий | Пд | 46 |
| 1933 К | 1660 °С | 3020 °F | Титан | Ти | 22 |
| 1936 К | 1663 °С | 3025 °F | Лютеций | Лу | 71 |
| 2028 К | 1755 °С | 3191 °F | Торий | Т | 90 |
| 2045 К | 1772 °С | 3222 °F | Платина | Пт | 78 |
| 2113 К | 1600 °С | 2912 °F | Протактиний | Па | 91 |
| 2125 К | 1852 °С | 3366 °F | Цирконий | Зр | 40 |
| 2130 К | 1857 °С | 3375 °F | Хром | Кр | 24 |
| 2175 К | 1902 °С | 3456 °F | Ванадий | В | 23 |
| 2239 К | 1966 °С | 3571 °F | Родий | Рх | 45 |
| 2473 К | 2200 °С | 3992 °F | Технеций | ТК | 43 |
| 2500 К | 2227 °С | 4041 °F | Гафний | ВЧ | 72 |
| 2523 К | 2250 °С | 4082 °F | Рутений | Ру | 44 |
| 2573 К | 2300 °С | 4172 °F | Бор | Б | 5 |
| 2716 К | 2443 °С | 4429 °F | Иридиум | Ир | 77 |
| 2741 К | 2468 °С | 4474 °F | Ниобий | № | 41 |
| 2890 К | 2617 °С | 4743 °F | Молибден | Пн | 42 |
| 3269 К | 2996 °С | 5425 °F | Тантал | Та | 73 |
| 3300 К | 3027 °С | 5481 °F | Осмий | ОС | 76 |
| 3453 К | 3180 °С | 5756 °F | Рений | перед | 75 |
| 3680 К | 3407 °С | 6165 °F | Вольфрам | Вт | 74 |
| 3773 К | 3500 °С | 6332 °F | Углерод | С | 6 |
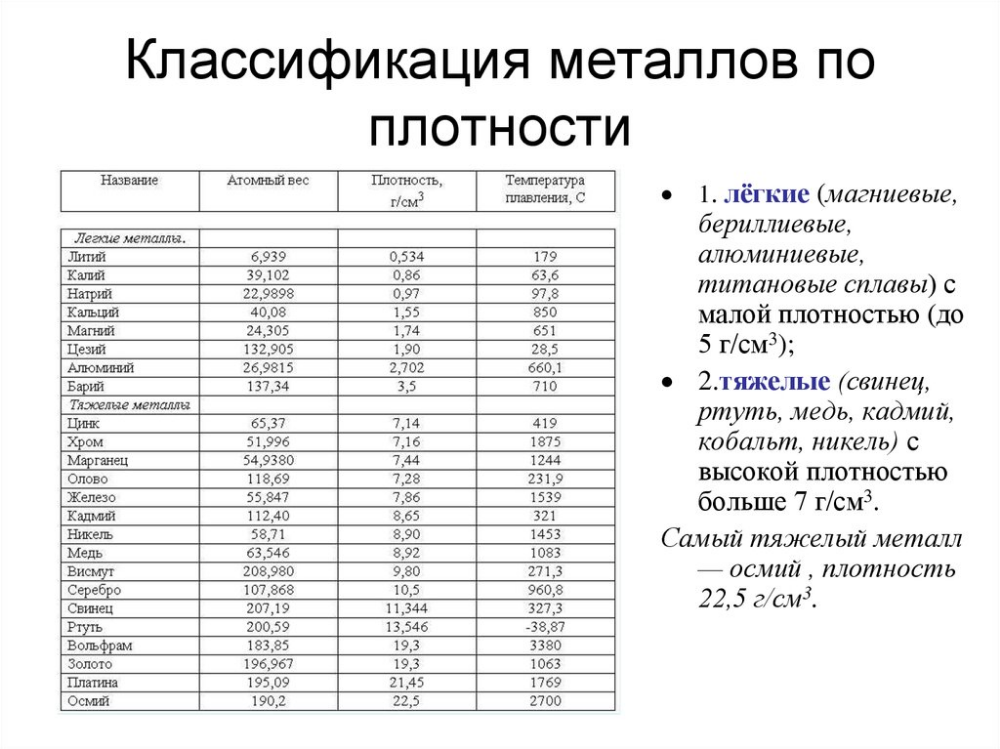
Твердые вещества – температуры плавления и кипения
- плавление – или плавление – фазовый переход вещества из твердого состояния в жидкое
- кипение – фазовый переход вещества из жидкого состояния в газообразное
.
80021
0018
 3
3020 Cast iron
1 Медь0021
 5
50021
5
80020 Molybdenum
8
80020 Pinchbeck
1
0005

 c.
c.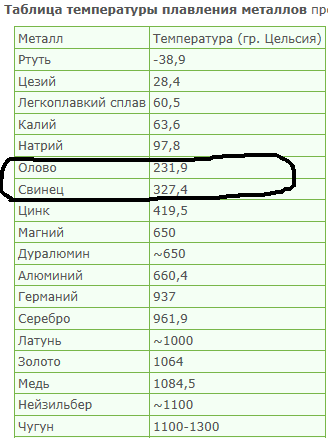 Вещество может оказать воздействие на дыхательные пути. Может привести к хроническому бронхиту.
Вещество может оказать воздействие на дыхательные пути. Может привести к хроническому бронхиту.