Глава 1. Медь – простое вещество. Соединения меди
Глава 2. Химические свойства меди и ее соединений
§1. Химические свойства простого вещества (ст. ок. = 0).
а) Отношение к кислороду.
В отличие от своих соседей по подгруппе – серебра и золота, - медь непосредственно реагирует с кислородом. Медь проявляет к кислороду незначительную активность, но во влажном воздухе постепенно окисляется и покрывается пленкой зеленоватого цвета, состоящей из основных карбонатов меди:
В сухом воздухе окисление идет очень медленно, на поверхности меди образуется тончайший слой оксида меди:
Внешне медь при этом не меняется, так как оксид меди (I) как и сама медь, розового цвета. К тому же слой оксида настолько тонок, что пропускает свет, т.е. просвечивает. По-иному медь окисляется при нагревании, например, при 600-800 0C. В первые секунды окисление идет до оксида меди (I), которая с поверхности переходит в оксид меди (II) черного цвета. Образуется двухслойное окисное покрытие.
Qобразования (Cu2O) = 84935 кДж.
Рисунок 2. Строение оксидной пленки меди.
б) Взаимодействие с водой.
Металлы подгруппы меди стоят в конце электрохимического ряда напряжений, после иона водорода. Следовательно, эти металлы не могут вытеснять водород из воды. В то же время водород и другие металлы могут вытеснять металлы подгруппы меди из растворов их солей, например:
.
Эта реакция окислительно-восстановительная, так как происходит переход электронов:
Молекулярный водород вытесняет металлы подгруппы меди с большим трудом. Объясняется это тем, что связь между атомами водорода прочная и на ее разрыв затрачивается много энергии. Реакция же идет только с атомами водорода.
Медь при отсутствии кислорода с водой практически не взаимодействует. В присутствии кислорода медь медленно взаимодействует с водой и покрывается зеленой пленкой гидроксида меди и основного карбоната:
в) Взаимодействие с кислотами.
Однако в присутствии кислорода медь растворяется в этих кислотах с образованием соответствующих солей:
Исключение составляет только иодоводородная кислота, которая вступает в реакцию с медью с выделением водорода и образованием очень устойчивого комплекса меди (I):
2Cu + 3HI → 2H[CuI2] +h3↑
Медь так же реагирует с кислотами – окислителями, например, с азотной:
Cu + 4HNO3(конц.) → Cu(NO3)2+2NO2↑+2h3O
3Cu + 8HNO3(разбав.) → 3Cu(NO3)2+2NO↑+4h3O
А так же с концентрированной холодной серной кислотой:
Cu + h3SO4(конц.) → CuO + SO2↑ + h3O
C горячей концентрированной серной кислотой:
Cu + 2h3SO4(конц., горячая) → CuSO4 + SO2↑ + 2h3O
C безводной серной кислотой при температуре 2000С образуется сульфат меди (I):
2Cu + 2h3SO4(безводн.) 200 °C→ Cu2SO4↓ + SO2↑ + 2h3O
г) Отношение к галогенам и некоторым другим неметаллам.
Qобразования (CuCl) = 134300 кДж
Qобразования (CuCl2) = 111700 кДж
Медь хорошо реагирует с галогенами, дает два вида галогенидов: CuX и CuX2.. При действии галогенов при комнатной температуре видимых изменений не происходит, но на поверхности вначале образуется слой адсорбированных молекул, а затем и тончайший слой галогенидов. При нагревании реакция с медью происходит очень бурно. Нагреем медную проволочку или фольги и опустим ее в горячем виде в банку с хлором – около меди появятся бурые пары, состоящие из хлорида меди (II) CuCl2 с примесью хлорида меди (I) CuCl. Реакция происходит самопроизвольно за счет выделяющейся теплоты. Одновалентные галогениды меди получают при взаимодействии металлической меди с раствором галогенида двухвалентной меди, например:
При этом монохлорид выпадает из раствора в виде белого осадка на поверхности меди.
Медь так же достаточно легко ступает в реакции с серой и селеном при нагревании (300—400 °C):
2Cu +S→Cu2S
2Cu +Se→Cu2Se
д) Взаимодействие с оксидами неметаллов
Медь при нагревании может вытеснять из некоторых оксидов неметаллов (например, оксид серы (IV) и оксиды азота (II, IV)) простые вещества, образуя при этом термодинамически более устойчивый оксид меди (II):
4Cu+SO2 600-800°C →2CuO + Cu2S
4Cu+2NO2 500-600°C →4CuO + N2↑
2Cu+2NO 500-600°C →2CuO + N2↑
§2. Химические свойства одновалентной меди (ст.ок. = +1)
В водных растворах ион Cu+ очень неустойчив и диспропорционирует:
Cu+↔Cu0+Cu2+
Однако медь в степени окисления (+1) может стабилизироваться в соединениях с очень низкой растворимостью или за счет комплексообразовния [9].
а) Оксид меди (I) Cu2O
Амфотерный оксид. Кристаллическое вещество коричнево-красного цвета. В природе встречается в виде минерала куприта. Исскуственно может быть получен нагреванием раствора соли меди (II) с щелочью и каким-нибудь сильным восстановителем, например, формалином или глюкозой [11]. Оксид меди(I) не реагирует с водой. Оксид меди(I) переводится в раствор концентрированной соляной кислотой с образованием хлоридного комплекса:
Cu2O+4HCl→2H[CuCl2]+ h3O
Так же растворим в концентрированном растворе аммиака и солей аммония:
Cu2O+2Nh5+→2[Cu(h3O)(Nh4)]+
В разбавленной серной кислоте диспропорционирует на двухвалентную медь и металлическую медь:
Cu2O+h3SO4(разбав.) →CuSO4+Cu0↓+h3O
Также оксид меди(I) вступает в водных растворах в следующие реакции:
1. Медленно окисляется кислородом до гидроксида меди(II):
2Cu2O+4h3O+O2→4Cu(OH)2↓
2. Реагирует с разбавленными галогенводородными кислотами с образованием соответствующих галогенидов меди(I):
Cu2O+2HГ→2CuГ↓ +h3O (Г=Cl, Br, J)
3.Восстанавливается до металлической меди типичными восстановителями, например, гидросульфитом натрия в концентрированном растворе:
2Cu2O+2NaSO3→4Cu↓+Na2SO4+h3SO4
Оксид меди(I) восстанавливается до металлической меди в следующих реакциях:
1. При нагревании до 1800 °C (разложение):
2Cu2O -1800 °C →2Cu +O2
2. При нагревании в токе водорода, монооксида углерода, с алюминиеми прочими типичными восстановителями:
Cu2O + h3 ->250°C→2Cu +h3O
Cu2O + CO -250-300°C→2Cu +CO2
3Cu2O + 2Al -1000°C→6Cu +Al2O3
Также, при высоких температурах оксид меди(I) реагирует:
1. C аммиаком (образуется нитрид меди(I))
3Cu2O + 2Nh4 -250°C→2Cu3N + 3h3O
2. С оксидами щелочных металлов:
Cu2O+M2O-600-800°C →2МCuO (M= Li, Na, K)
При этом образуются купраты меди (I).
Оксид меди (I) заметно реагирует с щелочами [9]:
Cu2O+2NaOH(конц.) +h3O↔2Na[Cu(OH)2]
б) Гидроксид меди (I) CuOH
Гидроксид меди(I) образует жёлтое вещество, не растворяется в воде.
Легко разлагается при нагревании или кипячении:
2CuOH → Cu2O + h3O
в) Галогениды CuF, CuСl, CuBr и CuJ
Все эти соединения – белые кристаллические вещества, плохо растворимые в воде, но хорошо растворимые в избытке Nh4, цианидных ионов, тиосульфатных ионов и иных сильных комплексообразователей. Иод образует только соединениеCu+1J. В газообразном состоянии образуются циклы типа (CuГ)3 [10]. Обратимо растворимы в соответствующих галогенводородных кислотах:
CuГ + HГ ↔ H[CuГ2] (Г=Cl, Br, J)
Хлорид и бромид меди (I) неустойчивы во влажном воздухе и постепенно превращаются в основные соли меди (II):
4CuГ +2h3O +O2 →4Cu(OH)Г (Г=Cl, Br)
г) Прочие соединения меди (I)
1. Ацетат меди (I) (СН3СООСu) — соединение меди, имеет вид бесцветных кристаллов. В воде медленно гидролизуется до Сu2О, на воздухе окисляется до ацетата двухвалентной меди; Получают СН3СООСu восстановлением (СН3СОО)2Сu водородом или медью, сублимацией (СН3СОО)2Сu в вакууме или взаимодействием (Nh4OH)SO4 с (СН3СОО)2Сu в р-ре в присутствии Н3СООNh4. Вещество токсично.
2. Ацетиленид меди(I) — красно-коричневые, иногда черные кристаллы. В сухом виде кристаллы детонируют при ударе или нагреве. Устойчивы во влажном состоянии. При детонации в отсутствие кислорода не образуется газообразных веществ. Под действием кислот разлагается. Образуется в виде осадка при пропускании ацетилена в аммиачные растворы солей меди(I):
С2h3 +2[Cu(Nh4)2](OH) →Cu2C2↓ +2h3O+2Nh4
Данная реакция используется для качественного обнаружения ацетилена.
3. Нитрид меди — неорганическое соединение с формулой Cu3N, тёмно-зелёные кристаллы.
Разлагается при нагревании:
2Cu3N -300°C→6Cu +N2↑
Бурно реагирует с кислотами:
2Cu3N +6HCl -300°C→3Cu↓ +3CuCl2 +2Nh4↑
§3. Химические свойства двухвалентной меди (ст.ок. = +2)
Наиболее устойчивая степень окисления у меди и самая характерная для нее.
а) Оксид меди (II) CuO
CuO — основный оксид двухвалентной меди. Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита (мелаконита) чёрного цвета. Оксид меди(II) реагирует с кислотами с образованием соответствующих солей меди(II) и воды:
CuO + 2HNO3→Cu(NO3)2 +h3O
При сплавлении CuO со щелочами образуются купраты меди (II):
CuO+2KOH-t°→K2CuO2 +h3O
При нагревании до 1100 °C разлагается [9]:
4CuO-t°→2Cu2O + O2
б) Гидроксид меди (II) Cu(OH)2
Гидроксид меди(II) - голубое аморфное или кристаллическое вещество, практически не растворимое в воде. При нагревании до 70-90 °C порошка Cu(ОН)2 или его водных суспензий разлагается до CuО и Н2О:
Cu(OH)2 → CuO + h3O
Является амфотерным гидроксидом. Реагирует с кислотами с образованием воды и соответствующей соли меди:
С разбавленными растворами щелочей не реагирует, в концентрированных растворяется, образуя ярко-синие тетрагидроксокупраты (II):
Гидроксид меди(II) со слабыми кислотами образует основные соли [11]. Очень легко растворяется в избытке аммиака с образованием аммиаката меди:
Cu(OH)2+4Nh5OH→[Cu(Nh4)4](OH)2+4h3O
Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов Cu2+ в растворе.
в) Соли меди (II)
Простые соли меди (II) известны для большинства анионов, кроме цианида и иодида, которые при взаимодействии с катионом Cu2+ образуют ковалентные соединения меди (I), нерастворимые в воде.
Соли меди (+2), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(h3O)4]2+. Они часто кристаллизуются в виде гидратов. Так, из водного раствора хлорида меди (II) ниже 150С кристаллизуется тетрагидрат, при 15-260С – тригидрат, свыше 260С – дигидрат. В водных растворах соли меди (II) в небольшой степени подвержены гидролизу, и из них часто осаждаются основные соли [9].
1. Пентагидрат сульфата меди (II) (медный купорос)
Наибольшее практическое значение имеет CuSO4*5h3O, называемый медным купоросом. Сухая соль имеет голубую окраску, однако при несильном нагревании (2000С) она теряет кристаллизационную воду. Безводная соль белого цвета. При дальнейшем нагревании до 7000С она превращается в оксид меди, теряя триоксид серы:
CuSO4--t°→CuO+SO3↑
Готовят медный купорос растворением меди в концентрированной серной кислоте. Эта реакция описана в разделе «Химические свойства простого вещества». Медный купорос применяют при электролитическом получении меди, в сельском хозяйстве для борьбы с вредителями и болезнями растений, для получения других соединений меди [9].
2. Дигидрат хлорида меди (II).
Это темно-зеленые кристаллы, легкорастворимые в воде. Концентрированные растворы хлорида меди имеют зеленый цвет, а разбавленные – голубой. Это объясняется образованием хлоридного комплекса зеленого цвета:
Cu2++4Cl- →[CuCl4]2-
И его дальнейшим разрушением и образованием голубого аквакомплекса.
3. Тригидрат нитрата меди (II).
Кристаллическое вещество синего цвета. Получается при растворении меди в азотной кислоте. При нагревании кристаллы сначала теряют воду, затем разлагаются с выделением кислорода и диоксида азота, переходя в оксид меди (II):
2Cu(NO3)2--t°→2CuO+4NO2↑+O2↑
4. Карбонат гидроксомеди (II).
Карбонаты меди малоустойчивы и в практике почти не применяются. Некоторое значение для получения меди имеет лишь основной карбонат меди Cu2(OH)2CO3, который встречается в природе в виде минерала малахита. При нагревании легко разлагается с выделением воды, оксида углерода (IV) и оксида меди (II):
Cu2(OH)2CO3--t°→2CuO+h3O↑+CO2↑
§4. Химические свойства трехвалентной меди (ст.ок. = +3)
Эта степень окисления является наименее стабильной для меди, и поэтому соединения меди (III) являются скорее исключениями, чем «правилами». Тем не менее, некоторые соединения трехвалентной меди существуют.
а) Оксид меди (III) Cu2O3
Это кристаллическое вещество, темно-гранатового цвета. Не растворяется в воде.
Получается окислением гидроксида меди(II) пероксодисульфатом калия в щелочной среде при отрицательных температурах:
2Cu(OH)2 +K2S2O8+2KOH ---20°C→Cu2O3↓+2K2SO4+3h3O
Это вещество разлагается при температуре 4000С:
Cu2O3--t°→2CuO+O2↑
Окисид меди (III) – сильный окислитель. При взаимодействии с хлороводородом хлор восстанавливается до свободного хлора [10]:
Cu2O3+6HCl--t°→2CuCl2+Cl2↑+3h3O
б) Купраты меди (Ш)
Это черные или синие вещества, в воде не устойчивы, диамагнитны, анион – ленты квадратов (dsp2). Образуются при взаимодействии гидроксида меди(II) и гипохлорита щелочного металла в щелочной среде [10]:
2Cu(OH)2 + МClO + 2NaOH→2МCuO3 +NaCl +3h3O (M=Na-Cs)
в) Калия гексафторкупрат(III)
Зеленое вещество, парамагнитно. Октаэдрическое строение sp3d2. Комплекс фторида меди CuF3, который в свободном состоянии разлагается при -600С. Образуется нагреванием смеси хлоридов калия и меди в атмосфере фтора:
3KCl + CuCl + 3F2 → K3[CuF6] + 2Cl2
Разлагает воду с образованием свободного фтора.
§5. Соединения меди в степени окисления (+4)
Пока науке известно лишь одно вещество, где медь в степени окисления +4, это гексафторкупрат(IV) цезия – Cs2Cu+4F6 - оранжевое кристаллическое вещество, стабильное в стеклянных ампулах при 00С. Бурно реагирует с водой. Получается фторированием при высоком давлении и температуре смеси хлоридов цезия и меди [10]:
CuCl2 +2CsCl +3F2 --t° р→ Cs2CuF6 +2Cl2
studfiles.net
Соединения меди
Соединения со степенью окисления +1. У меди данная степень окисления проявляется редко. Бинарные соединения меди(I) (оксиды, сульфиды, галогениды) - кристаллические вещества, малорастворимые в воде. Оксид меди(I) - Cu2О - оранжевого цвета, амфотерен, его кислотные свойства проявляются при растворении в концентрированных растворах щелочей:
Cu2О + 2NаОH + Н2О = 2Na[Cu(OH)2]
Гидроксид – Cu(OH) – малорастворимое соединение желтого цвета. Неустойчив, при попытке его получения обменной реакцией выделяется оксид Cu2О:
Cu+2 + 2ОH- = Cu2О + h3O
Медь(I) образует устойчивые комплексные ионы как катионного, так и анионного типа, в которых обычно проявляет координационное число 2:
CuCl + 2Nh4 = [Cu(Nh4)2]Cl; CuCN + KCN = K[Cu(CN)2]
Образованием координационных соединений объясняется тот факт, что нерастворимые в воде галогениды, цианиды или сульфиды обычно растворяются в концентрированных растворах кислот или соответствующих основных соединений. Например:
CuCl + HCl = H[CuCl2]
Соединения меди в степени окисления +1 - сильные восстановители и легко окисляются уже кислородом воздуха:
4CuCl + O2 + 4HCl = 4CuCl2 + 2h3O
Для соединений меди(I) также характерны реакции диспропорционирования, поэтому при действии света или тепла они легко распадаются:
2Cu+1Cl = Cu+2Cl2 + Cu0
Соединения со степенью окисления +2. Степень окисления +2 характерна для меди, которая образует бинарные соединения (оксид, галогениды и пр.), гидроксид, разнообразные соли и координационные соединения.
Оксид меди(II) образуется при прокаливании меди на воздухе, это порошок черного цвета, нерастворим в воде. Гидроксид меди(II) – осадок голубого цвета – получают обменным взаимодействием растворов солей меди(II) со щелочами.
Оксид и гидроксид меди(II) амфотерны и растворяются как в кислотах, так и в концентрированных растворах щелочей:
CuO + 2HCl = CuCl2 + h3O; Cu(OН)2 + 2KOH = K2[Cu(OH)4]
Из солей меди(II) хорошо растворимы в воде хлорид, нитрат, сульфат. Гидратированный катион меди(II) имеет голубую окраску. Иодид, тиоцианат и цианид меди(II) нестабильны. При попытке получения этих солей по обменной реакции протекает окислительно-восстановительный процесс:
Cu2+ + 3I- = CuI + I2;
2СuSO4 + 4KCN = 2CuCN + (CN)2 + 2K2SO4
Наиболее широко из солей меди применяется медный купорос - CuSO45h3O. В основном он используется для производства минеральных красок и для борьбы с вредителями и заболеваниями растений.
Координационные соединения меди(II) весьма разнообразны, характерные координационные числа – 4, 5 и 6. Из катионных известны аквакомплексы и аммиакаты: [Cu(Oh3)6]2+, [Cu(Nh4)4]2+, точнее [Cu(Nh4)4(Oh3)2]2+. Из анионных координационных соединений наиболее устойчивы цианидные, например К2[Cu(СN)4]. Известны координационные соединения с карбонат-, сульфат- и другими анионами в качестве лигандов, например, выделено темно-синее соединение состава К2[Cu(СО3)2].
studfiles.net
Медь комплексные соединения - Справочник химика 21
Медь, серебро. Оксиды меди (I) и (II), оксид серебра (I). Гидроксид меди (II). Соли серебра и меди. Комплексные соединения серебра и меди [c.313]ГЛИКОЛЯТ меди (комплексное соединение) [c.117]
Путем замыкания концевых атомов в комплексном соединении могут образовываться не только пятичленные кольца, но и кольца с большим числом атомов. Например, диаминопропан дает с медью комплексное соединение с шестичленными кольцами [c.252]
Определение с диэтилдитиокарбаматом. Диэтилдитиокарбамат образует с ионами меди комплексное соединение, окрашивающее [c.885]Способность органических продуктов образовывать комплексные соединения с металлами известна давно. Однако своеобразие практического применения их в качестве деактиваторов металла для топлив нефтяного происхождения выдвигает ряд новых, самостоятельных теоретических проблем. Известно, что простейшие органические соединения, содержащие хотя бы один гетероатом (азот, кислород, сера или фосфор), уже обладают координационными связями и способны образовывать с медью комплексные соединения, но такие соединения обладают малой стабильностью и в их присутствии каталитическое влияние меди на окисление бензинов сохраняется. [c.252]
Бутадиен образует с солями одновалентной меди комплексные соединения, что и используется для его выделения. Фракцию С4 обрабатывают при низкой температуре суспензией однохлористой меди в водном растворе хлористого аммония. После этого отгоняют бутан и бутилены. Затем разлагают образовавшееся комплексное соединение, нагревая его до 55—60° нри этом выделяется бутадиен. Выли предложены для этих целей и другие вещества (пиридиновый [c.237]
Ацетилен образует с солями одновалентной меди комплексные соединения, причем некоторые из них выделены в кристаллическом виде. Эти комплексы возникают за счет электронодонорных свойств ацетилена, поставляющего электроны координационно ненасыщенным ионам одновалентной меди. В я-комплексе углеродные атомы ацетилена приобретают частичный положительный заряд, и активи- [c.422]
Реагент при pH = 3 -ь 4 с индием образует слабоокрашен-ные растворы, а с медью — комплексное соединение, окрашенное в розовый цвет трилон Б в этих условиях образует с индием более прочное соединение чем с медью. При введении реагента ПАН в раствор индия, содержащий комплексонат меди, возникает розовая окраска в результате образования соединения медь — ПАН. [c.232]
Сернистые красители. При обработке фталоцианина меди комплексным соединением однохлористой серы и хлористого алюминия, [c.1302]
Бутадиен-бутиленовые смеси разделяются при помощи раствора медных солей. При низких температурах, например при 0°, бутадиен образует с солями одновалентной меди комплексные соединения [c.181]
Выделение и концентрирование дивинила из его смесей с бутиленами и бутаном основано на способности дивинила образовывать с солями одновалентной меди комплексное соединение, устойчивое при низкой темнературе (до +20°), разлагающееся на исходные составные части при +80°. [c.636]
Определение с диэтилдитиокарбаматом. Диэтилдитиокарбамат образует с ионами меди комплексное соединение, окрашивающие раствор в желтый или коричневый цвет, а при больших концентрациях выпадающее в осадок. Окраска получается мгновенно и сохраняется, не ослабевая, в течение 1 ч. [c.712]
Медь в отличие от остальных металлов, применяемых в технике в больших масштабах, электроположительна, и только в растворах, образующих с медью комплексные соединения, как например, цианистых и аммиачных, она имеет отри-6 [c.83]
В цианидных электролитах основными компонентами являются цианид меди u N и цианид натрия или калия Na N, K N. При растворении этих компонентов образуются комплексные соединения одновалентной меди, при электролизе которых на катоде осаждается металлическая медь. Комплексные соединения образуются по следующей схеме [c.165]
В отличие от остальных металлов, применяемых в технике в больших масштабах, медь электроположительна, и только в растворах, образующих с медью комплексные соединения (например, цианистых и аммиачных), она имеет отрицательный потенциал. Медь растворяется с образованием двух- и одновалентных ионов. Первый процесс происходит пр и коррозии значительна чаще, чем второй. [c.76]
Из растворов солей двухвалентной меди метиламин как довольно сильное основание осаждает гидроокись меди, а избыток амина образует с ионами меди комплексные соединения, легко растворимые в воде. [c.120]
Растворы химического меднения помимо соли двухвалентной меди и восстановителя содержат едкую щелочь для создания необходимой среды, лиганды, образующие с медью комплексные соединения и способствующие тем самым большей концентрации ее в растворе, и в некоторых случаях добавку небольшого количества соединений, оказывающих стабилизирующее действие на рабочий раствор, предотвращающих его возможное разложение. Наиболее распространенным восстановителем является формальдегид, активное действие которого проявляется при комнатной температуре. Восстановление Си + с его участием происходит только в щелочной среде при pH > 11. Чем больше концентрация в растворе формальдегида, тем выше скорость реакции восстановления ионов меди до металла, что особенно заметно при повышенном содержании соли. [c.218]
Выделение бутадиена из смеси с другими углеводородами С4 с помощью растворов солей одновалентной меди основано на образовании на холоду комплексных соединений между ионами за-кисной меди и соединениями с двойными связями. Чем больше ненасыщенность углеводорода, тем выше его растворимость бутадиен в 10—50 раз более растворим, чем близкокипящие н-бута-диены. Насыщенные углеводороды не образуют комплексных соединений с ацетатом меди. Комплексные соединения очень чувствительны к нагреванию, с повышением температуры их растворимость быстро снижается. [c.118]
Эфедрин гидрохлорид — бесцветные криста.плы или белый кристаллический порошок горького вкуса, без запаха, т. пл, 216—-220° (т. пл. рацемата 187°). Вращает плоскость поляризации —33 до — 36° (с 5, вода). Растворяется в 25 ч. воды, 14 ч. спирта, не растворим в эфире н хло-[Юформе Выдерживает стерилизацию при 100". В щелочном растворе образует с сульфатом Меди комплексное соединение - (С оН,40К)2Си) окрашенное в фиолетовый цвет, растворимое в эфире водный раствор сохраняет [c.240]
Интересно, что, заменяя ЭДТА другим комплексоном — этилен-гликоль-бис-(аминоэтил)-тетрауксусной кислотой можно титровать кадмий в присутствии цинка, так как константы нестойкости комплексных соединений обоих металлов с этим комплексоном достаточно сильно различаются. В качестве электрохимического индикатора при этом титровании применяют медь, комплексное соединение которой с данным реактивом по своей устойчивости занимает среднее положение между комплексными соединениями кадмия и цинка. Среду при этом титровании создают аммиачную, pH около 10, титруют при —0,3 в (Нас. КЭ) с ртутным капельным электродом. При этом потенциале восстановление кадмия исклю- [c.224]
В промышленных условиях, когда имеет место загрязнение поверхности минералов в результате адсорбции растворимых продуктов других компонентов смеси, предпочтительнее использовать полимеры, химически адсорбирующиеся на поверхности определенного минерала, чем полимеры, адсорбция которых зависит от селективного подавления. Однако применение химически сорбирующихся полимеров ограничено ввиду малого числа доступных в настоящее время высокомолекулярных флокулянтов. Сделаны попытки получения модифицированных полимеров для селективной флокуляции. Так, Аттиа и Китченер (1975) достигли селективности на медных минералах при их отделении от кальцита, доломита и полевого шпата путем введения в полиакриламид функциональных групп, образующих с ионами меди комплексные соединения. [c.165]
Диэтилдитиокарбаматрый метод очень чувствителен его можно применять лишь для определения меди в количестве нескольких микрограммов мкг). Применяемый реактив реагирует со многими элементами но большинство из них можно связать в прочные комплексные соединения добавлением лимонной и и винной кислот, диметилглиоксима и этилен-Диаминтетраацетата натрия тогда метод становится специфичным в отношении меди. Комплексное соединение меди с диэтилдитиокарбаматом можно экстрагировать ор1 аническими растворителями, например бутил-ацетатом, и окраску полуденного раствора сравнивать с окрасками стандартных растворов в обыкновенном колориметре или же измерять светопоглощение полученного раствора в фотоколориметре. [c.293]
Белки Соль меди Комплексные соединения Ксантогенаты 1Х.13 [c.334]
Из растворов солей двухвалентной меди (опыт В) метилами , как довольно сильное основание, осаждает гидроокись меди, но затем избыток амина образует с ионами меди комплексные соединения, легкорастворимые в воде. Эти соединения, содержащие комплексный ион [Си(СНзЫН2)4]" +, аналогичны аммиакатам меди и, подобно им, окрашены в растворах в интенсивный фиолетовый цвет. [c.178]
Позеленение медных проводников после пайки припоем ПОС-60 с применением спиртоканифольного флюса объясняется капиллярным проникновением флюса под изоляцию и образованием с окислами меди комплексных соединений зеленого цвета, [c.40]
Так, например, согласно результатам измерений, проведенных Антиповой и Вайнштейном [352], в разбавленных спиртовых растворах образуются гексаалкоголяты меди. В литературе также указывается [5], что более прочные координационные соединения медь образует с гликолями или глицирином, так как при наличии нескольких гидроксильных групп возможно образование цикла. Многоатомные спирты образуют с ионами двухвалентной меди комплексные соединения в щелочном растворе [353]. [c.197]
Мы сравнили каталазную активность растворов ферроцианида калия, нитропруссида и указанного аммиачного комплекса. Гексациановый комплекс и нитропруссид обладают очень малой активностью. Введение аммиака в комплекс резко увеличивает его каталазную активность наблюдается тот же эффект, который с такой ясностью мы констатировали, рассматривая комплексные соединения меди. Комплексные соединения металлов с основаниями Шиффа, в частности полученными из о-амино-фенола и салицилового альдегида (САФ), представляют объект исследований, заслуживающий внимания, так как, несмотря на малую устойчивость к действию перекиси водорода, они проявляют в неводных растворах такие эффекты, которые не удается наблюдать в водных средах. [c.151]
Каждая капля прилитого раствора медного купороса, взаимодействуя с едким натрол , вызывает образование осадка гидрата окиси меди, исчезающего при взбалтывании, так как глюкоза, имеющая в своей молекуле несколько гидроксильных групп, обладает способностью давать с гидратом окиси меди комплексные соединения, растворимые в щелочах. Не следует приливать избытка медного купороса, так как в этом случае возможно образование большого количества нерастворяющегося гидрата окиси меди, а потом, при кипячении, может образоваться черный осадок окиси меди, маскирующий положительный результат реакции Троммера. Не следует прибавлять и слишком мало медного купороса, так как в этом случае темное окрашивание может появиться от оставшегося неокислен-ньш виноградного сахара при его нагревании со щелочами, что также может маскировать положительную реакцию. [c.78]
Позднее было найдено, что и изобутилеп образует с галоге-нидами меди комплексные соединения [142], [143]. Джиллиленд (Gilliland) показал, что при температурах порядка от —23,3 до —51,1° С и под давлением изобутилеп образует с твердыми гало-генидами двухвалентной меди комплексное соединение в молярном соотношении 1 1 [144]. Процесс идет чрезвычайно медленно, и для его ускорения (до 15 минут) рекомендуется суспендировать галогенид меди в десятикратном количестве какого-нибудь нейтрального органического растворителя, например керосина [145]. [c.72]
Поглощение кислорода происходит на поверхности медных спиралей с образованием окиси меди СиО. Для удаления окислов с поверхности медных спиралей применяют раствор хлористого аммония Nh5 I (нашатыря) в аммиачной воде (750 г нашатыря растворяют в смеси, состоящей из 1 л 18%-ного раствора аммиака и 1 л дистиллированной воды). Во время поглощения, продолжающегося 1—3 мин, поглотитель-TibiH сосуд покачивают или встряхивают, чтобы смочить раствором поверхность спиралей. Образующееся при поглощении окиси меди комплексное соединение окрашивает раствор в синий цвет. Избыток раствора, вытесненный из поглотительного сосуда в уравнительный шаровой сосуд 2 по мере уменьшения объема пробы газа возвращается обратно. [c.352]
Добавленные к синтетическим средам белки и экстракты растительных тканей заметно ослабляют токсическое действие меди, по-видимому, за счет способности этих веществ образовывать с медью комплексные соединения. Исследование тормозящего действия 50 наиболее распространенных элементов на процесс размножения дрожжей в синтетической среде показало, что только 10 элементов (С, Н, О, N. Mg, К, N3, Са, 5, Р) не оказывают отрицательного влияния -на к тжроорга- [c.46]
Для количественного анализа в ссновном можно применять ранее приведенные методы (см. стр. 3 -5). Чаще всего пользуются зависимостью между величиной площади пятна и концентрацией. Точность этого метода колеблется в пределах 5—10 о. Мепее точными по Брайанту и Овереллу являются методы электрометрического титрования, например потенциометрического. Виланд и Фельд [1] разработали следующий ретен-ционный метод количественного анализа кислот. Согласно этому методу, раствор уксуснокислой меди(И) в тетрагидрофуране просачивается по капиллярам бумаги перпендикулярно направлению тока растворителя. При этом кислоты, образующие с медью комплексные соединения или нерастворимые осадки, задерживают фронт восходящего растворителя из величины площади задержанных пятен на хроматограмме можно вычислить количество кислоты. Райхль и Леффлер усовершенствовали этот метод, применив так называемый обратный ретенциоиный анализ (см. стр. 189). [c.247]
Для определения лимонной кислоты Босер использовал ее способность образовывать с медью комплексное соединение. Нордман и сотрудники количественно определяли цис- или транс-аконитовую кислоту р. акцией с н-диметиламинобензальдегидом в уксуснолг ангидриде образовавшееся нри этом красное производное экстрагировали метанолом и фотомотри-ровали. [c.247]
Результаты нашей работы в основном подтверждают теоретические соображения американских авторов о механизме полимеризации ацетилена в винил- и дивинилацетилен, т. е. что апетилен образует с полухлори-стой медью комплексное соединение, в котором ацетилен изомеригован в активную форму СНг = С = последняя, реагируя с ацетиленом нормального строения, дает молекулу винилацетилена [c.229]
chem21.info
Соединения меди | справочник Пестициды.ru
Пестициды, содержащие медь, широко применяются для защиты садов и виноградников от вредителей и болезней, а также в качестве протравителей семян. Соединения меди являются одной из наиболее важных групп фунгицидов, используемых самостоятельно и в смеси с другими органическими препаратами.[6]
Более ста лет они находят применение в борьбе с ложномучнисторосяными и несовершенными грибами, вызывающими пятнистости вегетативных органов растений. Это основная группа препаратов в системе антирезистентной программы к системным фунгицидам.[2]
История
В 1761 г. Шалтесом или в 1783 г. Тессиром был предложен сульфат меди для протравливания семян пшеницы. В 1807 г. Превост опубликовал данные о головневых болезнях пшеницы и борьбе с ними, а также о влиянии сульфата меди и температуры на прорастание хламидоспор головни. Таким образом, были заложены основы лабораторных испытаний фунгицидов.[3] Во Франции в 1887 г. А.Милярде и У.Гейон предложили смесь раствора с известковым молоком (бордоская жидкость), которую до сих пор применяют в защите растений.[2]
Бордоская смесьБордоская смесь
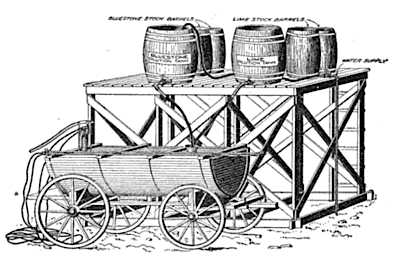
Установка, применяемая для приготовления бордоской жидкости в начале прошлого века.
Использовано изображение: [8]
Действие на вредные организмы
Все препараты на основе солей меди являются контактными фунгицидами защитного действия. Они активно подавляют прорастание конидий и спор грибов только в момент прорастания в капле воды и обладают бактерицидными свойствами. Для обеспечения высокой эффективности препараты меди должны быть нанесены на растения до начала прорастания конидий или спор патогена. Большое значение имеет равномерное и тщательное покрытие всего растения. Продолжительность защитного действия зависит от метеорологических условий (осадки), качества препаративной формы (размер частиц, прилипаемость) и скорости роста растения. Обычно защитное действие длится не более 10 дней.[7]
. Активность медьсодержащих фунгицидов основана на способности ионов меди взаимодействовать с сульфгидрильными группами коферментов и ферментов, а также с аминогруппами грибной клетки, вызывая денатурацию и осаждение белков. Кроме того, эти фунгициды, являясь сильными окислителями, могут ускорять внутриклеточные окислительные процессы.[3]Соединения меди, - действующие вещества
Важная роль в фунгитоксичности принадлежит сорбционной способности протоплазмы клеток грибов и переходу ионов меди в раствор из осадка на листьях. Растворенная медь адсорбируется спорами, вследствие чего равновесие нарушается, и часть меди снова переходит в растворимое состояние. Данный процесс происходит до тех пор, пока спорой не кумулируется токсическая доза. Переводу меди в раствор способствуют аммонийные соли, углекислота и другие вещества, присутствующие в атмосфере, росе, осадках, выделениях листьев, спор грибов.[3]
Как и все препараты контактного действия, медьсодержащие соединения не проникают внутрь листа, поэтому не могут вызвать гибель находящихся там гиф и мицелия гриба. Они взаимодействуют в основном со спорами, препятствуя их прорастанию.[1]
Биологические свойства медьсодержащих препаратов определяются способностью ионов меди активно реагировать с ферментными и липопротеиновыми комплексами живых клеток и вызывать необратимые изменения (коагуляцию) протоплазмы. Ионы меди, поступившие в достаточно высокой концентрации в клетки патогена, взаимодействуют с различными ферментами, содержащими имидазольные, карбоксильные и тиольные группы, и подавляют их активность. Прежде всего, при этом ингибируются процессы, которые входят в дыхательный цикл, в частности, процесс превращения пировиноградной кислоты в ацетилфермент А. Также они вызывают неспецифическую денатурацию белков. Их избирательность по отношению к полезным организмам зависит от количества ионов меди, поступивших в клетки и накопившихся в них. Конидии и споры грибов, прорастающие на поверхности растений в капле воды, способны внутри своей клетки накапливать ионы меди, создавая концентрацию в 100 и более раз выше, чем в растительных клетках или снаружи.[7]
Бордоская смесь обладает репеллентными свойствами для многих насекомых.[3]
. Бордоская смесь не эффективна против пероноспороза махорки и табака, а также против настоящих мучнистых рос.[5]. Бордоская смесь подавляет листоблошек на картофеле. Проявляет овицидное действие.[3] Бордосская жидкостьБордосская жидкость
Применение
Медьсодержащие соединения используются для предупреждения заболеваний растений. Их применяют заранее, до появления массового заражения.[1]
Соединения меди активно подавляют развитие пятнистостей винограда, сахарной свеклы, ложных мучнистых рос, макроспориоза и фитофтороза картофеля, монилиоза, ржавчины, парши семечковых, кластероспороза и коккомикоза косточковых плодовых культур, а также сдерживают развитие настоящей мучнистой росы и ряда бактериозов.[7]
. Бордоскую жидкость нельзя смешивать с фосфорорганическими инсектицидами и другими препаратами, которые разлагаются в щелочной среде.[4]Хлорокись меди входит в состав многих комбинированных фунгицидов.[2] Суспензию можно применять совместно с большинством пестицидов, но нельзя смешивать с препаратами, содержащими известь. Средство применяется также в смеси с антииспарителями.[1]
. Фитотоксичность особенно проявляется в годы с повышенной влажностью воздуха и продолжительным периодом выпадения осадков, а также в период активного роста растений. Кроме того, многолетнее использование медьсодержащих фунгицидов (при их накоплении в почве) отрицательно действует на деревья, вызывая сильное опадение листьев и завязей в начале лета.[1]Фитотоксичность препаратов меди зависит от концентрации меди в растворе на поверхности растений и способности стеблей и листьев поглощать ее ионы.[7]
В связи с тем, что фитотоксичность сильнее проявляется в период активного роста растений, рекомендуется чередование обработок медьсодержащими препаратами с обработками органическими средствами. Перед цветением растений и во время него следует применять органические препараты, безопасные для цветков и стимулирующие рост побегов и листьев. Перед созреванием плодов используют хлорокись меди. Она менее фитотоксична, чем бордоская жидкость, но хуже удерживается на растениях.[4]
Токсикологические свойства и характеристики
. Бордоская смесь не является ядовитой для хищных клещей, личинок и имаго златоглазок, кокцинеллид, хищных галлиц и таких перепончатокрылых, как их невмониды, афелиниды, птеромалиды.[3]Хлорокись меди не токсична для яиц златоглазки, умеренно токсична для ее личинок и имаго; высокотоксична для перепончатокрылых из семейства трихограмматид.[3]
. Препараты меди ядовиты для человека и теплокровных животных. Доза 10 г является абсолютно смертельной для человека. Дозы 0,2-0,5 г вызывают рвоту.[6]. Соединения меди стабильны во внешней среде, активно участвуют в кругообороте веществ в природе, переходят из почвы в растения, употребляемые человеком и животными. Установлено, что применение бордоской жидкости для опрыскивания яблоневого сада и виноградников, ранее не обрабатываемых никакими пестицидами, приводило к увеличению содержания меди в почве.[6]Поведение попавших в почву медьсодержащих пестицидов зависит в основном от типа почвы, ее физико-химических свойств, содержания гумуса, влажности. При внесении пестицидов в почву, а также при различных способах обработки наземных частей растений могут загрязняться как открытые водоемы, так и подземные источники водоснабжения. В воде колодца, питающегося грунтовыми водами и расположенного на супесчаной почве, количество меди за вегетационный период повысилось в 10 раз.[6]
Установлено также, что медь и ее соединения оказывают бактерицидное действие на микроорганизмы почвы и водоемов, что может привести к угнетению почвенной микрофлоры и процессов минерализации органических веществ.[6]
. Установлено, что при применении медьсодержащих пестицидов загрязняются также плоды. Так, концентрация меди в яблоках, обработанных 1%-ной бордоской жидкостью, составляла 4,14 мг/кг, в то время как в плодах, отобранных на контрольном участке, содержалось 0,93 мг/кг.[6]. Соли меди при непосредственном воздействии на ткани образуют с тканевыми белками альбуминаты, что обуславливает их вяжущее и прижигающее действие. Они сильно раздражают слизистые оболочки желудочно-кишечного тракта, а также верхних дыхательных путей.[6]Клиническая картина отравления человека при попадании соединений меди в желудочно-кишечный тракт характеризуется неприятным металлическим и вяжущим вкусом во рту, обильным слюнотечением, тошнотой, рвотой. Рвотные массы окрашены в зеленый или сине-зеленый цвет. Отмечаются схваткообразные боли в животе. Резко выражено гемолитическое действие с быстрым появлением билирубина в плазме и моче, отмечается желтуха, иногда уремия, обнаруживается белок в моче, развивается слабость, головокружение, затрудненное дыхание.[6]
При поступлении солей меди (СuCO3, CuSO4) через дыхательные пути развивается симптомокомплекс «меднопротравной» лихорадки. Описаны случаи отравления работающих на протравливании зерна углекислой медью. Явления интоксикации начинались с сильного озноба, продолжающегося несколько часов, повышения температуры тела (до 39). При тяжелой форме интоксикации заболевание может длиться три-четыре дня.[6]
Соединения меди могут оказывать также местнораздражающее действие на кожу: иногда появляется мелкая красная сыпь с зудом, экзема, кожная пурпура.[6]
Особенно опасным является поступление солей меди в виде пыли в дыхательные пути. При этом наблюдаются признаки раздражения слизистой оболочки верхних дыхательных путей, сильный бронхиальный кашель в сочетании с рвотой и болями в желудке, носовые кровотечения. Хроническая токсичность соединений меди не выражена.[7]
Статья составлена с использованием следующих материалов:
Литературные источники:
1.Белов Д.А. Химические методы и средства защиты растений в лесном хозяйстве и озеленении: Учебное пособие для студентов. –М.: МГУЛ, 2003. – 128 с
2.Ганиев М.М., Недорезков В.Д. Химические средства защиты растений. – М.: КолосС, 2006. – 248 с.
3.Голышин Н. М. Фунгициды. - М.: Колос, 1993. -319 с.: ил.
4.Груздев Г.С. Химическая защита растений. Под редакцией Г.С. Груздева - 3-е изд., перераб. и доп. - М.: Агропромиздат, 1987. - 415 с.: ил.
5.Зинченко В.А. Химическая защита растений: средства, технология и экологическая безопасность. – М.: «КолосС», 2012. – 127 с.
6.Медведь Л.И. Справочник по пестицидам (гигиена применения и токсикология) / Коллектив авторов, под ред. академика АМН СССР, профессора Медведя Л.И. -К.: Урожай, 1974. 448 с.
7.Попов С.Я. Основы химической защиты растений. Попов С.Я., Дорожкина Л.А., Калинин В.А./ Под ред. профессора С.Я Попова. - М.: Арт-Лион, 2003. - 208 с.
Изображения (переработаны):
8.Altus Lacy Quaintance, Cornelius Lott Shear U.S. Dept. of Agriculture, 1907. Иллюстрации из книги
Свернуть Список всех источниковwww.pesticidy.ru
Глава 1. Медь – простое вещество
§1. Электронное строение. Степени окисления.
Медь — элемент первой группы побочной подгруппы четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 29. Обозначается символом Cu (лат. Cuprum).
Электронное строение атома: 1s22s22p63s23p63d104s1. Подобно атомам щелочных металлов, атомы меди имеют в наружном слое один электрон, но в отличие от атомов щелочных металлов, предпоследний электронный слой содержит восемнадцать электронов. Медь – предпоследний член первой декады d-элементов. Поэтому у меди наблюдается так называемый «провал электрона» - конфигурация наружного электронного слоя 3d104s1 устойчивее, чем 3d94s2.
| Элемент | Радиус атома, нм | Энергия ионизации Э0→Э +, эВ | Радиус иона Э+, нм | Стандартный электродный потенциал процесса Э++e-→Э0, эВ |
| K | 0.236 | 4.18 | 0.149 | -2.925 |
| Cu | 0.128 | 7.73 | 0.098 | +0.52 |
Сравнивая медь с металлом главной подгруппы того же периода - калием, можно видеть, что радиус атома и иона меди почти в два раза меньше соответственно атома и иона калия. Это обуславливает значительно бóльшую плотность, высокие температуры плавления, так как меньшие по размеру атомы располагаются в кристаллической решетке более плотно, вследствие чего силы притяжения между ними велики.
Малый радиус объясняет так же более высокие значения энергии ионизации меди, чем калия. Это приводит к большим различиям в химических свойствах этих металлов одного периода и одной группы. Медь – малоактивный металл, в ряду напряжений стоит после водорода, в отличие от калия – одного из самых активных металлов. В то же время, восмнедцатиэлектронный наружный слой, устойчивый у других элементов, здесь еще не вполне стабилизируется, и способен к частичной потере электронов. Так, медь, наряду с однозарядными катионами образует и двухзарядные, которые для нее наиболее характерны. Так же известны соединения со степенью окисления +3 в составе анионов или в комплексных соединений.
§2. Нахождение в природе. Месторождения.
Металлы подгруппы меди обладают небольшой химической активностью, поэтому они находятся частично в виде химических соединений, а частично в свободном виде, особенно золото.
Медь в далекие геологические эпохи, очевидно, находилась только в виде сернистых соединений – халькопирита (или) и халькозина. Объясняется это тем, что медь обладает довольно большим химическим сродством к сере, в настоящее время сульфиды – наиболее распространенные минералы меди. При высоких температурах, например, в районах вулканической деятельности, под действием избытка кислорода происходило превращение сульфидов меди в окислы, например:
При температуре ниже 10000C происходило образование окиси меди, которая в небольших количествах встречается в природе:
.
Самородная (металлическая) медь, очевидно, возникла в природе при сильном нагревании частично окисленных сернистых руд. Можно представить, что после землетрясений, грандиозных извержений окисленные минералы меди были погребены под толстым слоем горных пород и нагревались за счет земного тепла. При этом происходило взаимодействие окислов с сульфидами:
.
Подобные процессы протекают при выплавке меди на металлургических заводах. Такие природные “металлургические заводы” выплавляют громадные количества меди: самый крупный из найденных самородков весил 420 т. По-видимому, в меньших масштабах взаимодействие окислов некоторых металлов с сульфидами идет и в настоящее время, например, в районе некоторых Курильских островов.
Некоторые другие минералы меди получились из окисных руд. Например, под действием влаги и двуокиси углерода происходила гидратация окиси меди и образование основных карбонатов:
.
В лаборатории мы эти процессы не наблюдаем, так как они идут медленно. В “лаборатории” природы сроки в несколько тысяч лет совершенно незначительны. В дальнейшем под влиянием давления вышележащих горных пород и некоторого нагревания происходило уплотнение основного карбоната меди, и он превратился в изумительный по красоте минерал – малахит. Особенно красив полированный малахит. Он бывает окрашен от светло-зеленого до темно-зеленого цвета. Переходы оттенков причудливы и создают фантастический рисунок на поверхности камня.
Переход нерастворимых сульфидных соединений меди в раствор мог осуществляться за счет взаимодействия растворов сульфата железа (III):
.
Растворы сульфата железа, как указано выше, получаются в природе при действии воды, насыщенной кислородом, на пирит. Эти процессы медленно идут в природе и в настоящее время. [1, с.8-10]
Медь входит более чем в 198 минералов, из которых для промышленности важны лишь 17. Для производства меди наибольшее значение имеют халькопирит (он же – медный колчедан) CuFeS2, халькозин (медный блеск) Cu2S, ковеллин CuS, борнит (пестрая медная руда) Cu5FeS4. Иногда встречается и самородная медь. Распространение меди в земной коре –4,7*103% по массе (1015 - 1016 тонн). [3]
Соединения меди распределены в земной коре неравномерно, что объясняется различием в геологических условиях, сложившихся в различных местах земного шара. Богатейшие месторождения меди имеются в Конго (Катангский пояс). Материалы, собранные археологами о древнейших месторождениях датируются тысячелетиями до новой эры. Древнейшие выработки меди на территории нашей страны найдены в Закавказье, на побережье Балхаша, в многочисленных пунктах Сибири.
Планомерные поиски месторождений меди начинаются при Иване III, Иване Грозном и особенно при Петре I. При Иване Грозном в Олонецкий уезд был послан новгородский гость (купец) Семен Гаврилов “для сыску медные руды”, где она и была найдена. В 1652 г. Казанский воевода сообщил царю: “Медные руды… сыскано много и заводы к медному делу заводим”. [2, с.26] Из документов следует, что с 1562 по 1664 г. было послано из “Казани к Москве чистыя меди 4641 пуд. 6 гривенков”. В 1702 г. стала выходить первая русская газета “Ведомости”, которую, очевидно, редактировал Петр I. 2 января 1703 г. в ней писали: “Из Казани пишут. На реке Соку нашли много нефти и медной руды, из той руды меди выплавили изрядно, отчего чают не малую прибыль Московскому государству”. [2, с.27]
В начале этого столетия главнейшими месторождениями, которые разрабатывались, были: в районе Северного Урала – Богословский завод, в районе Нижнего Тагила – Выйский завод, а на Кавказе – Калакентский и Кедабекский заводы.
В наше время известны месторождения меди на восточном склоне Урала, Средней Азии, Закавказье и т.д.
Большое количество меди и других ископаемых находится на дне океанов, которое покрыто так называемыми конкрециями – скоплениями в виде камней округлой неправильной формы. Они содержат в среднем 0,5% меди. По подсчетам ученых запасы этой ценной и своеобразной руды составляют 5 млрд. тонн. [1, с.16-18]
studfiles.net
Меди соединения - Справочник химика 21
Соединения одновалентной меди легко окисляются воздухом до соединений двухвалентной меди. Соединения двухвалентной меди более важные и более распространенные, чем соединения одновалентной меди. Соли двухвалентной меди имеют синюю или зеленую окраску. Все соли меди в той или иной мере ядовиты. [c.419]Меди соединения — из соединений Си +наиболее важны оксид меди СиО — соеди 80 [c.80]
Медь нагревают на воздухе. В результате медь соединяется с кислородом. Образуется оксид меди-соединение меди и кислорода. [c.67]Для крашения тканей некоторыми красителями (так называемыми протравными) ткань необходимо предварительно пропитать веществом, которое образует с краской нерастворимое соединение, что способствует закреплению ее на ткани. Вещества, служащие для закрепления красителя на волокне, называются протравами. В качестве протрав применяют уксуснокислый алюминий, соли окиси железа и окиси меди, соединения олова, а также таннин. Для крашения ткань погружают в раствор протравы и затем подвергают действию пара при высокой темпера- [c.514]
В обмене хлорного атома на гидроксил (получение фенола из хлорбензола) играют роль также заключающие медь катализаторы и вместе гидроксил-ионы. Медные стенки аппарата — катализатор гетерогенный, быть может, частично работающий в направлении образования содержащих медь соединений, гомогенно катализирующих реакцию. Присутствие железа (в молекулярном или ионном состоянии) благоприятствует сдвигу реакции в направлении конденсации в дифенильные производные. [c.472]
Кг меди — соединения углеводной природы, получаемые из растений. К. представляют собой нейтральные соли высокомолекулярных соединений, состоящих из остатков пентоз, метилпентоз, гексоз и уроновых кислот. К. выделяются из надрезов или поврежденных участков коры некоторых деревьев. [c.134]
СОЕДИНЕНИЯ МЕДИ Соединения меди(1) [c.394]
Меди соединения (сульфат, нитрат, ацетат, карбонат, хлорид). При случайном попадании внутрь вызывает неприятный, металлический и вяжущий привкус во рту, повышенное слюноотделение, потерю аппетита, тошноту, обильную и повторяющуюся рвоту зеленого или сине-зеленого цвета, схваткообразные боли в животе, частый кровянистый стул. Наблюдается редкий пульс слабого наполнения, сильная жажда, общая слабость, головокружение, похолодание конечностей, судороги, потеря сознания мочи мало, черного цвета. [c.253]
Для ацетиленида меди (а также серебра) очень специфично присоединение ацетилена по С=0-связи карбонильных соединений с образованием ацетиленовых спиртов [687—697, 1177]. Ацетилен выступает здесь в качестве донора водорода, который присоединяется к кислороду карбонильной группы, в то время как к ее углеродному атому присоединяется этинильный остаток —С=СН (реакции этинилирования). Родственным процессом является димеризация (тримеризация) ацетилена [624—629], легко протекающая при низких температурах в растворах хлоридных комплексов одновалентной меди. Соединения меди являются, вероятно, наиболее активными катализаторами реакций этинилирования. Соли серебра ускоряют присоединение перекиси водорода к аллиловому спирту, значительно уступая по активности солям ртути, железа и вольфрамовой кислоте [951]. [c.1219]
Задругой серии испытаний для исследования контактной коррозии были изготовлены образцы железо - медь, соединенные в одно целое. В одной серии испытания контактная коррозия наблюдалась только на образцах, не обработанных ингибирующей композицией, а в случае применения ингибитора коррозия отсутствовала. Увеличение длительности испытаний в ингибированных растворах приводило к значительному снижению контактной коррозии. [c.62]
К этой группе относятся также некоторые другие теллуриды меди. Соединение СиТе с небольшим интервалом составов имеет структуру анти-510, но позиции атомов меди смещены таким образом, что пирамиды оказываются деформированными. В соединении [c.175]
Гидрат окиси меди соединение непрочное, разлагающееся при нагревании. Чтобы убедиться в этом, стакан с осадком нагрейте на слабом огне.. [c.33]
Каталитические свойства соединений меди. Соединения меда катализуют чрезвычайно широкий круг реакций, гетерогенных, го- могенных, в газовой- фазе, в органических растворителях и в вод- [c.489]
Оба окисла меди Си О и СиО на воздухе постоянны и оба, как сказано выше, находятся в природе [613]. Впрочем, в большинстве случаев, медь получается в виде окиси меди и ее солеи, таковы, напр., медные соединения, которые употребляются в практике. Это зависит от того, что соединения закиси меди на воздухе поглощают кислород и переходят в соединения окиси меди. Соединения окиси меди могут служить для получения закиси меди, потому что многие восстановительные вещества способны раскислять окись меди в закись. Чаще всего употребляются органические вещества, а именно— преимущественно сахаристые, способные в присутствии щелочей окисляться на счет кислорода окиси меди и давать кис- [c.293]
Медь в своих соединениях закиси настолько сходна с серебром, что если бы не существовало для меди соединений окиси, или если бы для серебра существовали постоянные соединения высшей окиси AgO, то близость была бы такая же, как у С1 и Вг или Zn и d. Для серебра соединения, соот- [c.298]
Отсюда уже видно, во-первых, что золото, обладая гораздо меньшим сродством, чем Ag, отделяет гораздо менее тепла, чем эквивалентное количество меди, даюшей такое же соединение, и во-вторых, что для меди соединение с атомом кислорода влечет большее выделение тепла, чем при соединении с галоидом, а для серебра — обратно. Это стоит в связи с тем, что СиЮ прочнее Ag O — при нагревании. [c.656]
Материал пластин и дополнительной теплообменной поверхности — алюминий или медь. Соединения листов и ребер производятся пайкой, осуществляемой по специально разработанной технологии. [c.260]
Марганца окись Меди соединения н. р. в. Меди фталоцианин Медь [c.272]
Применяют кислоты лимонную, адипиновую, муравьиную и некоторые другие. Более широко используется лимонная кислота, при очистке которой требуется надежная циркуляция раствора со скоростью не менее 0,5 м/сек, но не более 1,в м/сек во избежание усиления коррозии котельного металла. Концентрация кислоты лежит в пределах 1,0—3,0% (3%-ный раствор кислоты может связывать 0,75% железа—по массе). Очистка ведется при температуре 95— 105 °С. Скорость растворения окислов железа при этом составляет 250—300 г/ м -ч) при температуре меньше 80°С растворение окислов железа идет медленно, а при >105 °С усиливается коррозия. Концентрация железа в растворе не допускается более 0,5%, а pH раствора не должно быть выше 4,5 длительность пребывания раствора в парогенераторе составляет 3—4 ч (большая длительность может вызвать вы падение осадка цитрата железа, что недопустимо). Лимонная кислота эффективно удаляет прокатную окалину, но не действует на силикаты и медь соединения кальция удаляются в ограниченных размерах. Нельзя допускать Пферывов в циркуляции раствора и добавлять в раствор свежую кислоту (сумма свободных [c.16]
Наиболее устойчивы соединения двухвалентной меди. Соединения закисного ряда не имеют большого практического значения, они неустойчивы и легко превращаются в окисные. Растворы солей двухвалентной (окисной) меди имеют голубой цвет, обусловленный присутствием иона Си [c.216]
Электрохимическая регенерация соединений трехвалентного железа и металлической меди. Соединения трехвалентного железа находят применение в ряде окислительно-восстановительных реакций, имеющих практическое значение. Например, растворы хлорного железа используются для травления медных изделий, в частности для стравливания излишних участков сплошной медной пленки, нанесенной на изоляционное основание. При этом ионы трехвалентного железа восстанавливаются в ионы двухвалентного железа [c.176]
Бутадиен образует с хлористой медью соединение С4Нб-2СиС1, а ацетилен — СоНг-ЗСиС , которое, вероятно, является промежуточным продуктом в рассматриваемой реакции. [c.79]
Сера образует с медью соединение СигЗ, которые линш до некоторого предела растворимо в меди в жидком состоянии. [c.145]
II днмеризации получающегося при этом бензгидрильного радикала. При образовании карбена в присутствии медной пудры и в протонной и в аиротонной средах в качестве главного продукта получается азин (2). В присутствии хелатного соединения меди соединение (3) не образуется совсем, а продуктами реакции являются азин (2) п тетрафенилэтилен (4), соотношение которых зависит от растворителя. Японские исследователи предполагают, что действие хелата меди состоит в координации дпазоалкана как пятого лиганда [c.272]
Разработан спектрофотометрический метод определения никеля в чистых индии и алк1минии с а -фурилдиоксимом [6]. Из сопутствующих элементов наибольшее влияние оказывает медь. Соединение никеля (также меди) с а -фурилдиоксимом экстрагируют хлороформом при pH 8,7—9,3, связывая алюминий в тартратный или цитратный комплекс. Влияние меди устраняют, используя различную устойчивость аммиакатов и а -фурилдиоксиматов меди и никеля. Для этого хлороформный [c.263]К хро .юпротеидам относятся также окрашенные геминовые соединения с белками, такие как миоглобин (миохром) поперечнополосатых мышц, эритрокруорины беспозвоночных, каталаза н пероксидазы, цитохром с. Некоторые хромопротеиды представляют собой не содержащие железа или меди соединения желчных пигментов с белком. Кроме того, к хромопротеидам могут быть отнесены и окрашенные соединения белков с каро-тиноидами.. [c.177]
Получение и свойства меди. Соединения меди довольно распространены, но больших скоплений они обычно не образуют. Важнейшими рудами меди являются красная медная руда Си О, медный блеск СозЗ и медный колчедан СиРеЗз. В СССР богатые залежи медных руд находятся на Урале, в Казахстане, на Алтае, в Закавказье и других районах. [c.274]
Гидрат окиси меди — соединение непрочное. При нагревании даже под водой он превращается в окись меди СиО. Если к раствору медного купороса прилить раствора щелочи, чтобы выпал осадок гидрата окиси меди, а затем жидкость вместе. с осадком Си(0Н)2 нагреть до кипения, то можно, заметить постепенное потем нение осадка гидроокиси меди вследствие превращения Си(ОН)г в СиО [c.258]
chem21.info
Соединения меди - Художественная и холодная ковка металла, металлоконструкции
Еще в глубокой древности человек научился использовать химические соединения меди.
Всем известны сине-голубые кристаллы сульфата меди, называемые в обиходе медным купоросом. В современном быту он применяется в качестве протравы при крашении текстиля и при выделке кож, используется как пигмент в красках. Маляры применяют водный раствор медного купороса для промывки участков поверхности, пораженной плесенью, перед ее окраской. В электрических батарейках он используется в качестве электролита. Как электролит медный купорос нашел широкое применение в гальванотехнике при изготовлении особо точных медных деталей. В медицине соединение меди находит применение как вяжущее и антисептическое средство, в фотографии — для усиления и тонирования фотоотпечатков.
Сине-зеленые кристаллы хлороксида соединения меди (в быту огородники называют его хлорокисью) применяют для защиты плодовых и овощных культур от насекомых.
Другое соединение — оксид меди представляет собой черные кристаллы, которые применяют в промышленности для окраски стекла, эмалей и керамики.
Красивый зеленый поделочный камень малахит — это тоже одно из соединений меди — дигидроксокарбонат. Каменных дел мастера и ювелиры создавали из этого камня настоящие шедевры декоративно-прикладного искусства. Заслуженной славой пользуется Малахитовый зал Эрмитажа в Ленинграде. Малахитовые изделия стали символом высокого мастерства и красоты. Недаром П. Бажов объединил свои сказы о народных умельцах в сборнике с символическим названием «Малахитовая шкатулка».
Есть и другая разновидность малахита соединения меди — порошок «землистый малахит». Он идет на изготовление зеленой краски, известной под названием «малахитовая зелень». Землистый малахит и малахитовый камень, тем не менее, просто медная руда, из которой можно выплавлять медь. Но здесь мы встречаемся со случаем, когда сырье имеет большую ценность, чем извлекаемый из него металл.
С незапамятных времен изготовляли из соединения меди яркую зеленую краску,— так называемую ярь-медянку (основной апатит меди). Ярь-медянка была обнаружена во фресках из античного города Помпеи, погибшего от извержения вулкана Везувия. Изготавливали и с успехом применяли ярь-медянку и художники Древней Руси. У средневекового автора Теофила она называется испанской зеленью. В своем руководстве он приводит следующий рецепт: «Если ты хочешь приготовить испанскую зелень, то возьми тонкие листы меди, очисти их хорошенько с обеих сторон, облей чистым и теплым уксусом... помести их в маленьком выдолбленном кусочке дерева... Через две недели открой и соскобли. Продолжай это делать и дальше до тех пор, пока не получишь достаточно краски». При изготовлении зеленой краски из соединения меди дорогой и дефицитный уксус часто заменяли кислым молоком.
Технологию приготовления яри-медянки изложил в «Каноне изображений» азербайджанский поэт и художник Садиг-бек-Афшар (1533-1612):
В сыром месте выкопай яму глубиной в два геза,
Клади туда тонкие листы меди, но чистой,
влей незрелого уксуса,
чтобы листы полностью покрылись им,
в той яме оставь их около одного месяца,
прикрой их и не думай, что мало или много.
Через месяц взгляни — увидишь,
что они полностью превратились
в желанную и славную ярь-медянку.
Еще в древности человек заметил, что от прикосновения медных предметов унималась боль и спадала опухоль. Такое необычное поведение металла заинтересовало «отца медицины» — греческого врача Гиппократа, жившего в V—VI веке до н. э. Исторические факты свидетельствуют, что он пытался применять медные пластины для лечения различных болезней. Позднее знаменитый таджикский врач Ибн-Сина, известный в Европе под именем Авиценны (ок. 980—1037 годов н. э.), тоже обратил внимание на лечение медью. Не осталась в стороне и народная медицина. В тех странах, где были распространены медные монеты, их вовсю использовали в качестве лечебных пластин, прикладывая к ушибам и больным суставам. Исследования, проведенные современными учеными, подтвердили лечебные свойства меди. Было установлено, что с помощью соединения медных пластин можно устранять отечность, унимать боль, останавливать воспалительные процессы.
www.sibirservis.ru










