Содержание
Коррозия металлов и способы защиты от нее
| Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе. |
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
3Fe + 2O2 = Fe3O4
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H+ + 2e → H2
O2 + 2H2O + 4e → 4OH–
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H+ + 2e → H2
Суммарная реакция: Fe + 2H+ → H2 + Fe2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH–
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
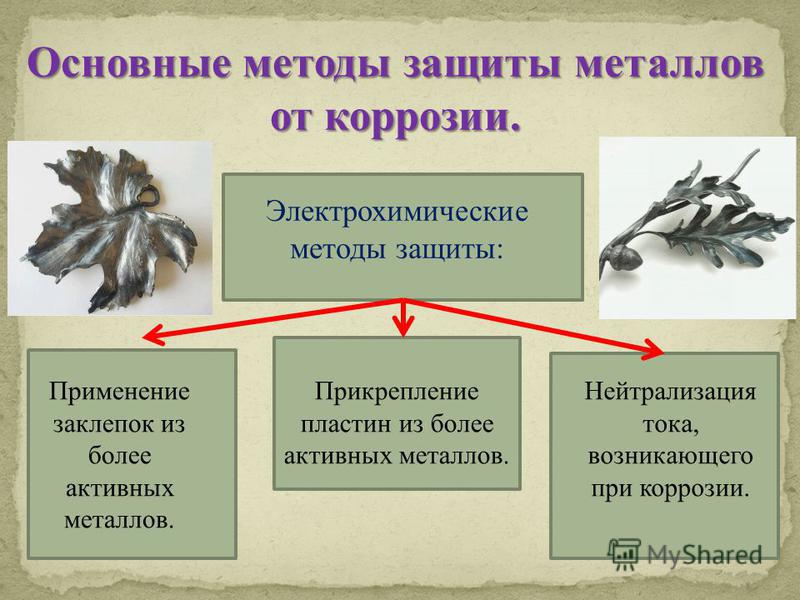
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Понравилось это:
Нравится Загрузка…
Коррозия металлов — что это такое? Виды и примеры
Коротко о главном
Коррозия металлов или ржавление в химии — это явление, которое возникает из-за взаимодействия металлической пластинки с веществами окружающей среды (кислородом воздуха или кислотами, с которыми может реагировать металлическое изделие).
Обычно окисляются металлы, включая железо, которые находятся левее водорода в ряду напряжений.
Чаще всего встречаются химическая и электрохимическая коррозии. Чтобы понять, чем они отличаются друг от друга, давайте сравним их по нескольким критериям в таблице ниже.
Таблица 1. Сравнение химической и электрохимической коррозии металлов | ||
|---|---|---|
Признаки сравнения | Химическая коррозия | Электрохимическая коррозия |
Определение | Разрушение металлов в из-за взаимодействия с газами или растворами, которые не проводят электрический ток | Разрушение металла, при котором возникает электрический ток в воде или среде другого электролита |
Агрессивные реагенты | O2, пары H2O, CO2, SO2, Cl2 | Растворы электролитов |
Примеры | 3Fe + 2O2 → Fe3O4 | 4Fe + 3O2 + 6H2O = 4 Fe(OH)3 При контакте железа с цинком коррозии подвергается цинк: А (+) на цинке: Zn0 — 2e— = Zn2+. К (–) на железе: 2H+ + 2e— = H2. |
Защитить металл от коррозии можно по-разному: покрытием защитными материалами, электрохимическими методами, шлифованием и т. д. Далее — подробно обо всем этом.
Практикующий детский психолог Екатерина Мурашова
Бесплатный курс для современных мам и пап от Екатерины Мурашовой. Запишитесь и участвуйте в розыгрыше 8 уроков
Что такое коррозия
Коррозия — это самопроизвольное разрушение элементов, чаще всего металлов, под действием химического или физико-химического влияния окружающей среды.
Иными словами, из-за химического воздействия железо начинает ржаветь. Это весьма сложный процесс, который состоит из несколько этапов. Но суммарное уравнение коррозии выглядит так:
4Fe + 6H2O (влага) + 3O2 (воздух) = 4Fe(OH)3.
Часто под коррозией понимают химическую реакцию между материалом и средой либо между их компонентами, которая протекает на границе раздела фаз. Обычно это окисление металла. Например:
3Fe + 2О2 = Fe3O4;
Fe + H2SO4 = FeSО4 + Н2.
Некоторые металлы, даже активные, покрываются плотной оксидной пленкой при коррозии. Это одна из их характерных черт. Оксидная пленка не дает окислителям проникнуть в более глубокий слой и поэтому защищает металл от коррозии. Алюминий обычно устойчив при контакте с воздухом и водой, даже горячей. Тем не менее, если поверхность алюминия покрыть ртутью, то образуется амальгама. Она разрушает оксидную пленку, и алюминий начинает быстро превращаться в белые хлопья метагидроксида алюминия:
Коррозии подвергаются и многие малоактивные металлы. Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Например, поверхность медного изделия покрывается патиной — зеленоватым налетом. Это происходит потому, что на ней образуются смеси основных солей.
Виды коррозии металлов
Химическая коррозия
Химическая коррозия — это процесс разрушения металла, который связан с реакцией между металлом и коррозионной средой.
Химическая коррозия протекает без воздействия электрического тока, и в результате этой реакции металлы окисляются. Этот вид коррозии можно разделить на два подвида:
Их них более распространенной считают газовую коррозию. Она протекает во время прямого контакта твердого тела с активным газом воздуха. Чаще всего это кислород. В результате на поверхности тела образуется пленка продуктов химической реакции между веществом и газом. Дальше эта пленка мешает контакту корродирующего материала с газом. При высоких температурах газовая коррозия развивается интенсивно. Возникшая при этом пленка называется окалиной, которая со временем становится толще.
Важную роль в процессе коррозии играет состав газовой среды. Но для каждого металла он индивидуален и изменяется с переменой температур.
Электрохимическая коррозия
Электрохимическая коррозия — это разрушение металла, которое протекает при его взаимодействии с окружающей средой электролита.
Этот вид коррозии считают наиболее распространенным. Самым важным происхождением электрохимической коррозии является то, что металл неустойчив в окружающей среде с точки зрения термодинамики. Вот несколько ярких примеров этой реакции: ржавчина в трубопроводе, на обшивке днища морского судна и на различных металлоконструкциях в атмосфере.
В механизме электрохимической коррозии обычно выделяют два направления: гомогенное и гетерогенное. Разберем их подробнее в таблице ниже.
Гомогенный механизм электрохимической коррозии | Гетерогенный механизм электрохимической коррозии |
|---|---|
Поверхность металла рассматривается как однородный слой. | У твердых металлов поверхность неоднородна из-за структуры сплава, в котором атомы по-разному расположены в кристаллической решетке. |
Растворение металла происходит из-за термодинамической возможности для катодного или анодного процессов. | Неоднородность можно наблюдать при наличии в сплаве каких-либо включений. |
Скорость, с которой протекает электрохимическая коррозия, зависит от времени протекания процесса. |
В электрохимической коррозии протекает одновременно два процесса на аноде и на катоде, которые зависят друг от друга. Растворение основного металла происходит только на анодах. Анодный процесс заключается в том, что ионы металла отрываются и переходят в раствор:
Fe → Fe2+ + 2e.
В результате происходит реакция окисления металла. В данном случае анод заряжается отрицательно.
При катодном процессе избыточные электроны переходят в молекулы или атомы электролита, которые, в свою очередь, восстанавливаются. На катоде идет реакция восстановления. Он носит заряд положительного электрода.
O2 + 2H2O + 4e → 4OH—
2H+ + 2e → H2
Торможение одного процесса приводит к торможению и другого процесса. Окисление металла может происходить только в анодном процессе.
Как защитить металлы от коррозии
От коррозии можно и нужно защищаться. Чтобы уберечь металлы от этой реакции, их покрывают защитными материалами, обрабатывают электрохимическими методами, шлифованием и т. д. Рассмотрим все эти способы подробнее.
Способ № 1.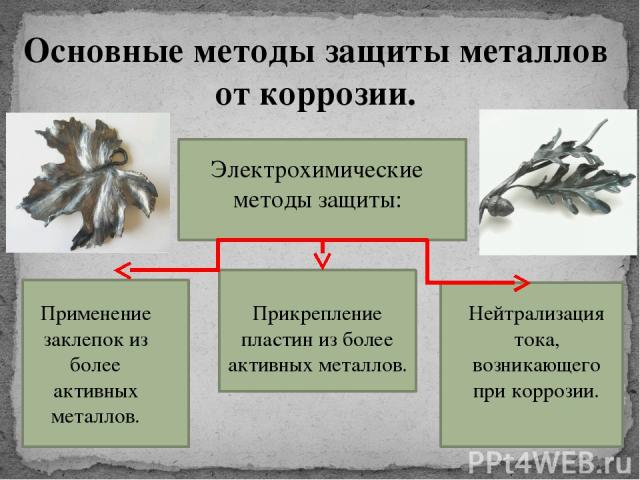 Защитные покрытия.
Защитные покрытия.
Для защиты от коррозии металлические изделия покрывают другим металлом, т. е. производят никелирование, хромирование, цинкование, лужение и т. д. Еще один вариант защиты — покрыть поверхность металла специальными лаками, красками, эмалями.
Способ № 2. Легирование.
Легирование — это введение добавок, которые образуют защитный слой на поверхности металла. Например, при легировании железа хромом и никелем получают нержавеющую сталь.
Способ № 3. Протекторная защита.
Протекторная защита — это способ уберечь металл от коррозии, при котором металлическое изделие соединяют с более активным металлом. Этот второй металл в итоге и разрушается в первую очередь.
Способ № 4. Электрохимическая защита.
Чтобы защитить металлы от электрохимической коррозии, нейтрализуют ток, который возникает при ней. Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Это делают с помощью постоянного тока, который пропускают в обратном направлении.
Способ № 5. Изменение состава среды путем добавления ингибиторов.
Для защиты от коррозии используют специальные средства, которые ее замедляют — ингибиторы. Они изменяют состояние поверхности металла — образуют труднорастворимые соединения с катионами металла. Защитные слои, образованные ингибиторами, всегда тоньше наносимых покрытий.
Способ № 6. Замена корродирующего металла на другие материалы: керамику и пластмассу.
Способ № 7. Шлифование поверхностей изделия.
Проверьте себя
Что такое коррозия?
Где в повседневной жизни можно встретить ржавление железа и других металлов? Приведите примеры.
Гидроксид железа Fe(OH)3 называют:
а ржавчина;
б) окалина;
в) патина.

Что является причиной возникновения коррозии?
Чем отличаются химический и электрохимический типы коррозии?
Что такое коррозионная среда?
Узнайте все о коррозии металлов и разберитесь в других темах за 9 класс на онлайн-курсах по химии в Skysmart! Наши преподаватели помогут выяснить, где скрываются пробелы в знаниях, и восполнить их. Никаких скучных задач и сухих лекций — только интерактивные упражнения, опыты и теория простым языком. Все это поможет разобраться даже в тех темах, которые не давались в школе. Ждем на бесплатном вводном уроке!
Как защитить металлы – AMPP
Коррозия – это естественный износ, возникающий в результате химической или электрохимической реакции металла или металлического сплава с окружающей средой. Подобно другим стихийным бедствиям — землетрясениям, торнадо, наводнениям — коррозия может нанести опасный и дорогостоящий ущерб всему, от транспортных средств, бытовой техники и систем водоснабжения/очистки до трубопроводов, мостов и общественных зданий. Коррозия отличается от других стихийных бедствий тем, что существуют проверенные временем методы, а также новые технологии, которые помогают контролировать и предотвращать коррозию, тем самым защищая людей, имущество и планету от ее негативного воздействия.
Коррозия отличается от других стихийных бедствий тем, что существуют проверенные временем методы, а также новые технологии, которые помогают контролировать и предотвращать коррозию, тем самым защищая людей, имущество и планету от ее негативного воздействия.
Перед определением конкретной проблемы и/или решения по предотвращению и контролю коррозии необходимо учитывать множество факторов, включая, помимо прочего:
- условия окружающей среды (удельное сопротивление почвы, влажность и воздействие соленой воды на различные типы материалов )
- тип продукта, подлежащего обработке, обработке или транспортировке
- требуемый срок службы конструкции или компонента
- близость к явлениям, вызывающим коррозию
Несмотря на это, казалось бы, сложное взаимодействие факторов и почти неизбежную ржавчину металлов, коррозия является управляемым процессом, когда такие широко используемые и эффективные методы выбора и проектирования материалов, защитных покрытий, измерений и контроля, катодной защиты, химических ингибиторов и управления коррозией считаются.
Выбор материалов и проектирование
Тщательное и реалистичное рассмотрение вопросов предотвращения коррозии и смягчения ее последствий на этапе выбора материалов в процессе проектирования имеет решающее значение для предотвращения многих типов отказов.
Факторы, которые могут повлиять на выбор материалов, включают коррозионную стойкость в окружающей среде, наличие проектных данных и данных испытаний, механические свойства, стоимость, доступность, ремонтопригодность, совместимость с другими компонентами системы, ожидаемый срок службы, надежность и внешний вид.
Неотъемлемой частью выбора материалов является соответствующий проект системы, учитывающий параметры процесса и конструкции; геометрия для дренажа; предотвращение или электрическое разделение разнородных металлов; предотвращение или герметизация щелей; допуск на коррозию; срок эксплуатации; требования к техническому обслуживанию и осмотру.
В то время как использование металлов и бетона является обычным выбором при проектировании, наука о материалах предлагает инженерам-коррозионистам варианты борьбы с коррозией с использованием современных материалов.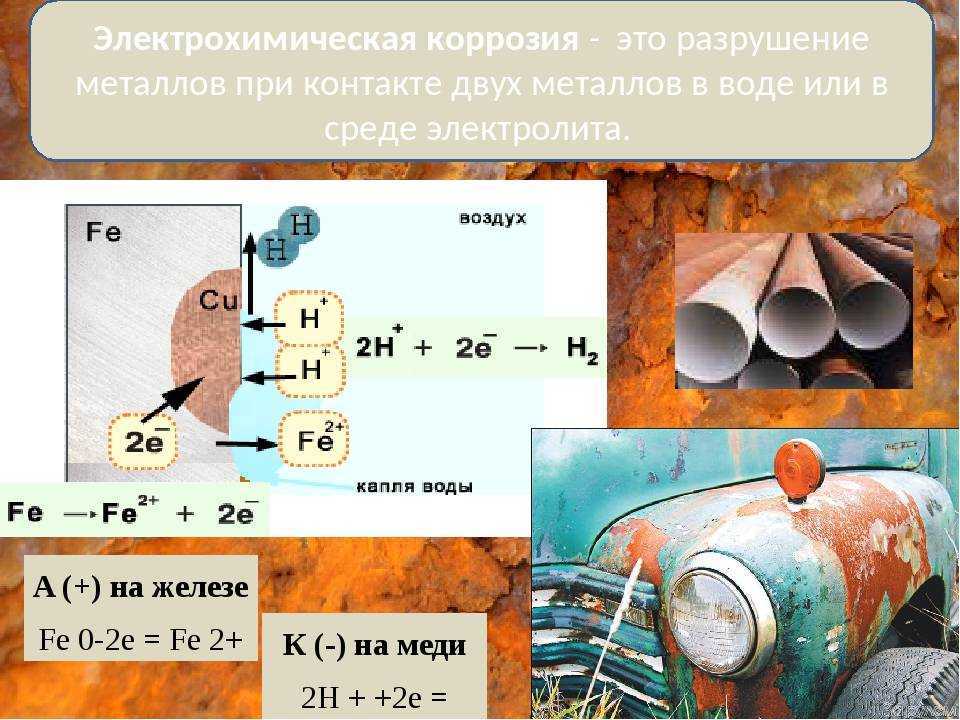 Инженерные свойства, созданные с помощью специализированных технологий обработки и синтеза, придают усовершенствованным материалам превосходные характеристики по сравнению с обычными материалами и включают керамику, металлы с высокой добавленной стоимостью, электронные материалы, композиты, полимеры и биоматериалы.
Инженерные свойства, созданные с помощью специализированных технологий обработки и синтеза, придают усовершенствованным материалам превосходные характеристики по сравнению с обычными материалами и включают керамику, металлы с высокой добавленной стоимостью, электронные материалы, композиты, полимеры и биоматериалы.
Ресурсы по выбору материалов и проектированию AMPP
Защитные покрытия
Исследование коррозии, проведенное NACE International, теперь AMPP, показывает, что 50% всех затрат на коррозию можно предотвратить, причем примерно 85% из них относится к защитным покрытиям.
Защитные покрытия, включая краски, представляют собой тонкие слои твердого материала, нанесенные на подложку, при этом покрытие действует как барьер, препятствующий или предотвращающий коррозию, износ или воздействие воды. Каждая жидкая, разжижаемая или мастичная композиция после нанесения на поверхность превращается в твердую защитную, декоративную или функциональную клейкую пленку. Покрытия можно напылять, приваривать, гальванизировать или наносить с помощью ручных инструментов в зависимости от поверхности покрытия, окружающей среды и целей нанесения.
Покрытия можно напылять, приваривать, гальванизировать или наносить с помощью ручных инструментов в зависимости от поверхности покрытия, окружающей среды и целей нанесения.
Материалы, обычно используемые в органических покрытиях, представляют собой эпоксидные смолы, полиуретаны или другие полимеры, в то время как материалы, обычно используемые в неорганических металлических покрытиях, включают цинк, алюминий и хром.
После подготовки поверхности покрытия наносятся в 3 этапа: сначала грунтовка, затем полное покрытие, а затем герметик.
Учебный центр защитных покрытий | Ресурсы защитных покрытий AMPP
Измерение и проверка
Инспекции покрытий проверяют промышленное оборудование и объекты, а также коммерческую недвижимость и проекты, чтобы убедиться, что защитные покрытия были нанесены правильно, чтобы минимизировать риск коррозии.
Проверка покрытий помогает укрепить всю отрасль защитных покрытий и позволяет сэкономить миллиарды долларов на коррозионных затратах.
Ресурсы для измерения и проверки AMPP
Катодная защита (CP)
Катодная защита — это технология, используемая для контроля коррозии поверхности металла путем превращения ее в катод электрохимической ячейки. CP может быть достигнут путем подачи тока в структуру от внешнего электрода и поляризации металлической поверхности в электроотрицательном направлении. Это обеспечивает защиту поверхности и продлевает срок службы актива.
Системы CP защищают широкий спектр металлических конструкций, в том числе наземные и морские трубопроводы, резервуары для хранения, сваи причалов, корпуса кораблей и лодок, морские нефтяные платформы и компоненты металлической арматуры в бетонных конструкциях. Другой метод CP для смягчения коррозии включает нанесение цинкового покрытия на компоненты из оцинкованной стали.
Средства катодной защиты AMPP
Химические ингибиторы
Ингибитор коррозии снижает скорость коррозии металла, подвергающегося воздействию окружающей среды, путем замедления химической (коррозионной) реакции.
Чтобы уменьшить интенсивность коррозии, их обычно добавляют в небольших количествах к кислотам, охлаждающей воде, пару и многим другим средам либо постоянно, либо периодически. При использовании в качестве покрытия ингибиторы коррозии обычно наносят на чистые поверхности и дают им проникнуть и высохнуть.
Ингибирование может использоваться внутри труб и сосудов из углеродистой стали в качестве экономичной альтернативы защите от коррозии для нержавеющих сталей и сплавов, покрытий или неметаллических композитов, и часто может применяться без нарушения процесса. Ингибиторы также можно использовать для защиты от коррозии армированных стальных стержней (арматурных стержней) внутри бетона.
Ресурсы химических ингибиторов AMPP
Борьба с коррозией
Для предотвращения коррозии и снижения связанных с ней затрат необходимы не только технологии; для этого требуется упреждающий план управления коррозией для улучшения проектирования, эксплуатации и технического обслуживания критически важных активов.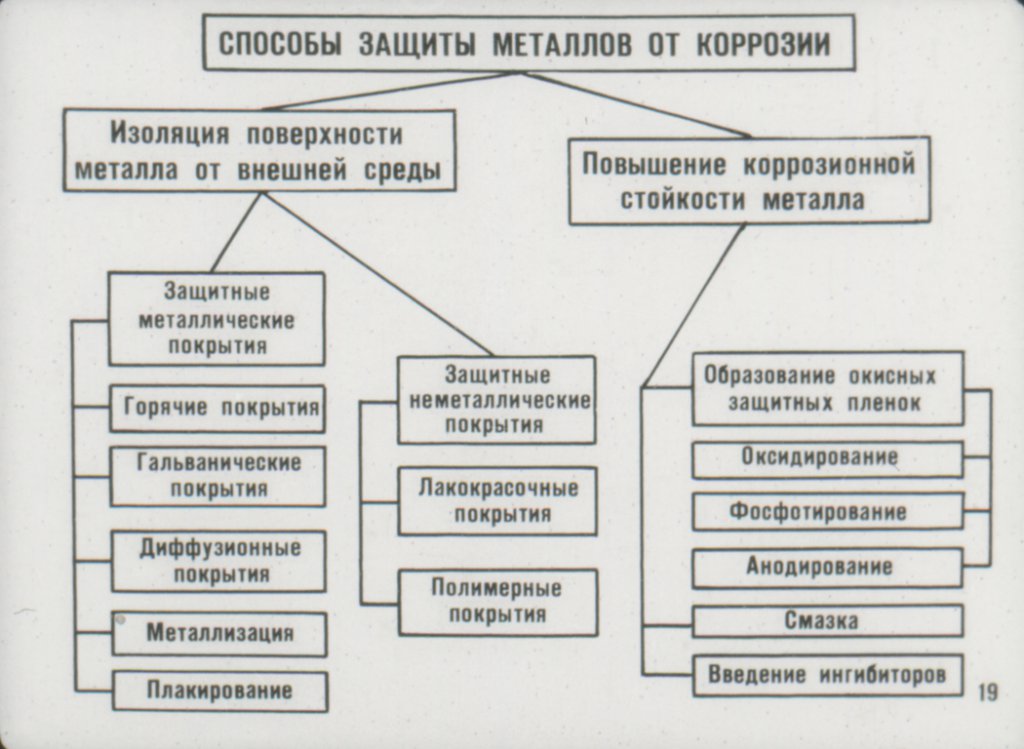 Кроме того, эти планы должны быть основаны на изменении того, как решения по коррозии принимаются внутри организации.
Кроме того, эти планы должны быть основаны на изменении того, как решения по коррозии принимаются внутри организации.
Согласно исследованию NACE, те компании, которые лучше всего справляются с сокращением негативных последствий коррозии, следуют определенным практикам с техническими планами управления коррозией, интегрированными в общую систему управления их организации, таким образом охватывая все уровни организации. Вовлекая каждого сотрудника в план управления коррозией организации, стратегии могут быть реализованы на каждом этапе жизненного цикла продукта или объекта, что приводит к значительной экономии затрат в течение всего срока службы актива.
Ресурсы по борьбе с коррозией AMPP
Коррозия и как защитить металл от нее — блог
Коррозия — это процесс расхода строительных материалов в результате химического воздействия жидкостей, разрушительно воздействующий на металлы и неорганические металлы, а также участвующий в деградации органических материалов.
Коррозия и защита металлов от коррозии
Коррозия — это нежелательный процесс, с которым мы сталкиваемся ежедневно и который связан с реакцией металла и окружающей средой, в которой он находится.
Это опасно по нескольким причинам, и одна из основных — это; повреждая металл до такой степени, что изменяются некоторые его механические свойства.
Один из курьезов, связанных с коррозией и важностью антикоррозионной защиты; заключается в том, что коррозия ежегодно приводит к потере 3,5% мирового ВВП.
Однако не все металлы подвержены коррозии. Такие металлы, как цинк, никель, олово, алюминий, золото, платина и легированная сталь; где процентное содержание хрома превышает 13%, являются коррозионностойкими.
Кроме того, некоторые драгоценные металлы, такие как золото и платина, также устойчивы к коррозии.
Виды коррозии
Если разделить коррозию на виды, то получится:
- Общая коррозия которая поражает всю поверхность металла.
 Такая коррозия одинаково повреждает всю поверхность материала. Общая коррозия также известна как «ржавчина».
Такая коррозия одинаково повреждает всю поверхность материала. Общая коррозия также известна как «ржавчина».
- Точечная коррозия – это такая коррозия, которая возникает в небольших углублениях на поверхности материала, которые со временем превращаются в более крупные отверстия.
- Межкристаллитная коррозия проникает в материал и поэтому практически незаметна на поверхности.
- Избирательная коррозия , которая поражает только отдельные компоненты сложного материала. Этот тип коррозии начинается на поверхности материала, а затем проникает внутрь и атакует с разной скоростью.
- Коррозионное растрескивание под напряжением — такая коррозия, которая возникает, когда материал подвергается предельному пределу прочности на растяжение; а также действие агрессивного агента
Защита от коррозии
Для защиты от коррозии были разработаны многочисленные методы, которые можно разделить на:
- Защита от коррозии с помощью покрытия все примеси, такие как жир и коррозия.
 Подготовка поверхности обычно осуществляется шлифованием, крацеванием, полированием, пескоструйной обработкой или промоканием. Что касается покрытий, наносимых на материал, то они могут быть металлическими, эмалированными, т.е. наиболее известными и наиболее распространенными, лакокрасочными
Подготовка поверхности обычно осуществляется шлифованием, крацеванием, полированием, пескоструйной обработкой или промоканием. Что касается покрытий, наносимых на материал, то они могут быть металлическими, эмалированными, т.е. наиболее известными и наиболее распространенными, лакокрасочными
- Электрохимическая защита от коррозии – Электрохимическая защита от коррозии проводится для металлов, которые труднодоступны и непросты в обслуживании. Электрохимическая защита от коррозии применяется для защиты нефтепроводов, судов, резервуаров и других устройств, используемых в промышленности
- Конструктивные меры – защита от коррозии, связанная с выбором тех материалов, которые обладают определенными свойствами, снижающими вероятность коррозии
- Защита от изменения обстоятельств – Этот вид защиты от коррозии осуществляется путем изменения окружающих факторов, участвующих в процессе разрушения.



 Такая коррозия одинаково повреждает всю поверхность материала. Общая коррозия также известна как «ржавчина».
Такая коррозия одинаково повреждает всю поверхность материала. Общая коррозия также известна как «ржавчина». Подготовка поверхности обычно осуществляется шлифованием, крацеванием, полированием, пескоструйной обработкой или промоканием. Что касается покрытий, наносимых на материал, то они могут быть металлическими, эмалированными, т.е. наиболее известными и наиболее распространенными, лакокрасочными
Подготовка поверхности обычно осуществляется шлифованием, крацеванием, полированием, пескоструйной обработкой или промоканием. Что касается покрытий, наносимых на материал, то они могут быть металлическими, эмалированными, т.е. наиболее известными и наиболее распространенными, лакокрасочными