Содержание
Аргон
|
Аргон | |
|---|---|
|
Атомный номер |
18 |
|
Внешний вид простого вещества |
инертный газ без цвета, вкуса и запаха |
|
Свойства атома | |
|
Атомная масса (молярная масса) |
39,948 а. е. м. (г/моль) |
|
Радиус атома |
? (71)[1]пм |
|
Энергия ионизации (первый электрон) |
1519,6(15,75) кДж/моль (эВ) |
|
Электронная конфигурация |
[Ne] 3s2 3p6 |
|
Химические свойства | |
|
Ковалентный радиус |
106 пм |
|
Радиус иона |
154 пм |
|
Электроотрицательность (по Полингу) |
0,0 |
|
Электродный потенциал |
0 |
|
Степени окисления |
0 |
|
Термодинамические свойства простого вещества | |
|
Плотность |
(при -186 °C) 1,40 г/см³ |
|
Молярная теплоёмкость |
20,79[2]Дж/(K·моль) |
|
Теплопроводность |
0,0177 Вт/(м·K) |
|
Температура плавления |
83,8 K |
|
Теплота плавления |
n/a кДж/моль |
|
Температура кипения |
87,3 K |
|
Теплота испарения |
6,52 кДж/моль |
|
Молярный объём |
24,2 см³/моль |
|
Кристаллическая решётка простого вещества | |
|
Структура решётки |
кубическая гранецентрированая |
|
Параметры решётки |
5,260 Å |
|
Отношение c/a |
— |
|
Температура Дебая |
85 K |
|
Ar |
18 |
|
39,948 | |
|
[Ne]3s23p6 | |
|
Аргон | |
Аргон — элемент главной подгруппы восьмой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
И. Менделеева, с атомным номером 18. Обозначается символом Ar (лат. Argon). Третий по распространённости элемент в земной атмосфере (после азота и кислорода) — 0,93 % по объёму. Простое вещество аргон (CAS-номер: 7440–37–1) — инертный одноатомный газ без цвета, вкуса и запаха.
История
Схема атома аргона
История открытия аргона начинается в 1785 году, когда английский физик и химик Генри Кавендиш, изучая состав воздуха, решил установить, весь ли азот воздуха окисляется. С помощью электрофорной машины в течение многих недель он подвергал воздействию электрического разряда смесь воздуха с кислородом в U-образных трубках, в результате чего в них образовывались все новые порции бурых окислов азота, которые исследователь периодически растворял в щёлочи. Через некоторое время образование окислов прекращалось, но, после связывания оставшегося кислорода, оставался газовый пузырь, объём которого не уменьшался при длительном воздействии электрических разрядов в присутствии кислорода. Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Кавендиш оценил объём оставшегося газового пузыря в 1/120 от первоначального объёма воздуха[4][5]. Разгадать загадку пузыря Кавендиш не смог, поэтому прекратил свое исследование, и даже не опубликовал его результатов. Только спустя много лет английский физик Джеймс Максвелл собрал и опубликовал неизданные рукописи и лабораторные записки Кавендиша.
Дальнейшая история открытия аргона связана с именем Рэлея, который несколько лет посвятил исследованиям плотности газов, особенно азота. Оказалось, что литр азота, полученного из воздуха, весил больше литра «химического» азота (полученного путём разложения какого-либо азотистого соединения, например, закиси азота, окиси азота, аммиака, мочевины или селитры) на 1,6 мг (вес первого был равен 1,2521, а второго 1,2505 г). Эта разница была не так уж мала, чтобы можно было её отнести на счет ошибки опыта. К тому же она постоянно повторялась независимо от источника получения химического азота
Не придя к разгадке, осенью 1892 года Рэлей в журнале «Nature» опубликовал письмо к учёным, с просьбой дать объяснение тому факту, что в зависимости от способа выделения азота он получал разные величины плотности. Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
Письмо прочли многие учёные, однако никто не был в состоянии ответить на поставленный в нём вопрос.
У известного уже в то время английского химика Уильяма Рамзая также не было готового ответа, но он предложил Рэлею свое сотрудничество. Интуиция побудила Рамзая предположить, что азот воздуха содержит примеси неизвестного и более тяжелого газа, а Дьюар обратил внимание Рэлея на описание старинных опытов Кавендиша (которые уже были к этому времени опубликованы)
Пытаясь выделить из воздуха скрытую составную часть, каждый из учёных пошел своим путём. Рэлей повторил опыт Кавендиша в увеличенном масштабе и на более высоком техническом уровне. Трансформатор под напряжением 6000 вольт посылал в 50-литровый колокол, заполненный азотом, сноп электрических искр. Специальная турбина создавала в колоколе фонтан брызг раствора щёлочи, поглощающих окислы азота и примесь углекислоты. Оставшийся газ Рэлей высушил, и пропустил через фарфоровую трубку с нагретыми медными опилками, задерживающими остатки кислорода.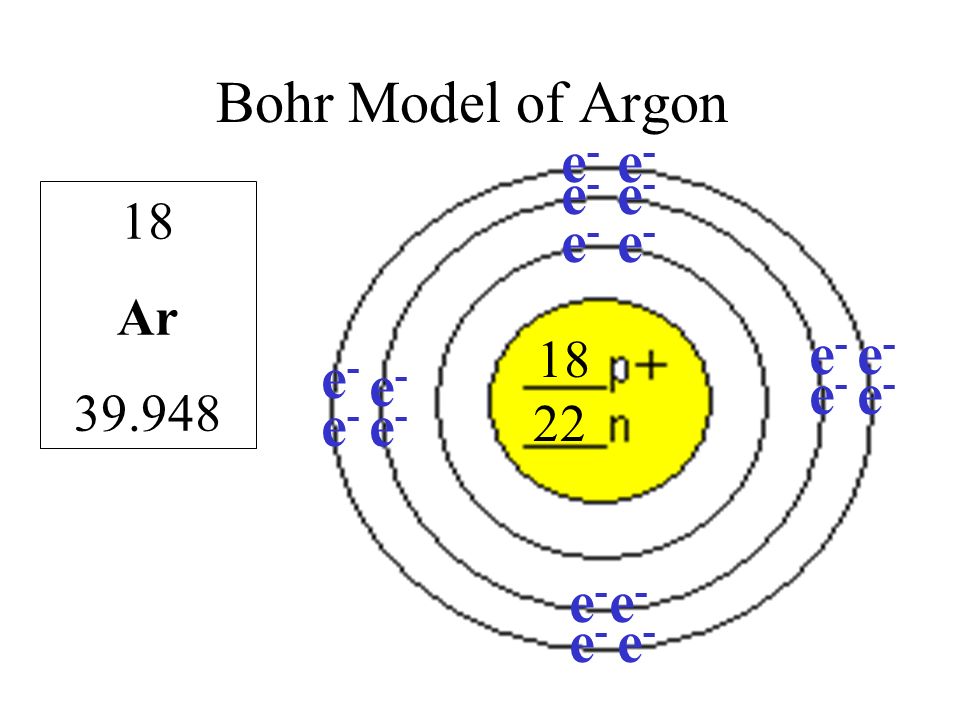 Опыт длился несколько дней
Опыт длился несколько дней
Рамзай воспользовался открытой им способностью нагретого металлического магния поглощать азот, образуя твёрдый нитрид магния. Многократно пропускал он несколько литров азота через собранный им прибор. Через 10 дней объём газа перестал уменьшаться, следовательно, весь азот оказался связанным. Одновременно путём соединения с медью был удален кислород, присутствовавший в качестве примеси к азоту. Этим способом Рамзаю в первом же опыте удалось выделить около 100 см³ нового газа.
Итак, был открыт новый элемент. Стало известно, что он тяжелее азота почти в полтора раза и составляет 1/80 часть объёма воздуха. Рамзай при помощи акустических измерений нашёл, что молекула нового газа состоит из одного атома — до этого подобные газы в устойчивом состоянии не встречались. Отсюда следовал очень важный вывод — раз молекула одноатомна, то, очевидно, новый газ представляет собой не сложное химическое соединение, а простое вещество.
Много времени затратили Рамзай и Рэлей на изучение его реакционной способности по отношению ко многим химически активным веществам. Но, как и следовало ожидать, пришли к выводу: их газ совершенно недеятелен. Это было ошеломляюще — до той поры не было известно ни одного настолько инертного вещества.
Большую роль в изучении нового газа сыграл спектральный анализ. Спектр выделенного из воздуха газа с его характерными оранжевыми, синими и зелёными линиями резко отличался от спектров уже известных газов. Уильям Крукс, один из виднейших спектроскопистов того времени, насчитал в его спектре почти 200 линий. Уровень развития спектрального анализа на то время не дал возможности определить, одному или нескольким элементам принадлежал наблюдаемый спектр. Несколько лет спустя выяснилось, что Рамзай и Рэлей держали в своих руках не одного незнакомца, а нескольких — целую плеяду инертных газов.
7 августа 1894 года в Оксфорде, на собрании Британской ассоциации физиков, химиков и естествоиспытателей, было сделано сообщение об открытии нового элемента, который был назван аргоном. В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
В своём докладе Рэлей утверждал, что в каждом кубическом метре воздуха присутствует около 15 г открытого газа (1,288 вес. %). Слишком невероятен был тот факт, что несколько поколений ученых не заметили составной части воздуха, да еще и в количестве целого процента! В считанные дни десятки естествоиспытателей из разных стран проверили опыты Рамзая и Рэлея. Сомнений не оставалось: воздух содержит аргон.
Через 10 лет, в 1904 году, Рэлей за исследования плотностей наиболее распространнённых газов и открытие аргона получает Нобелевскую премию по физике, а Рамзай за открытие в атмосфере различных инертных газов — Нобелевскую премию по химии.
Происхождение названия
По предложению доктора Медана (председателя заседания, на котором был сделан доклад об открытии) Рэлей и Рамзай дали новому газу имя «аргон» (от греч. αργός — ленивый, медленный, неактивный). Это название подчеркивало важнейшее свойство элемента — его химическую неактивность.
Распространённость
Во Вселенной
Содержание аргона в мировой материи оценивается приблизительно в 0,02 % по массе.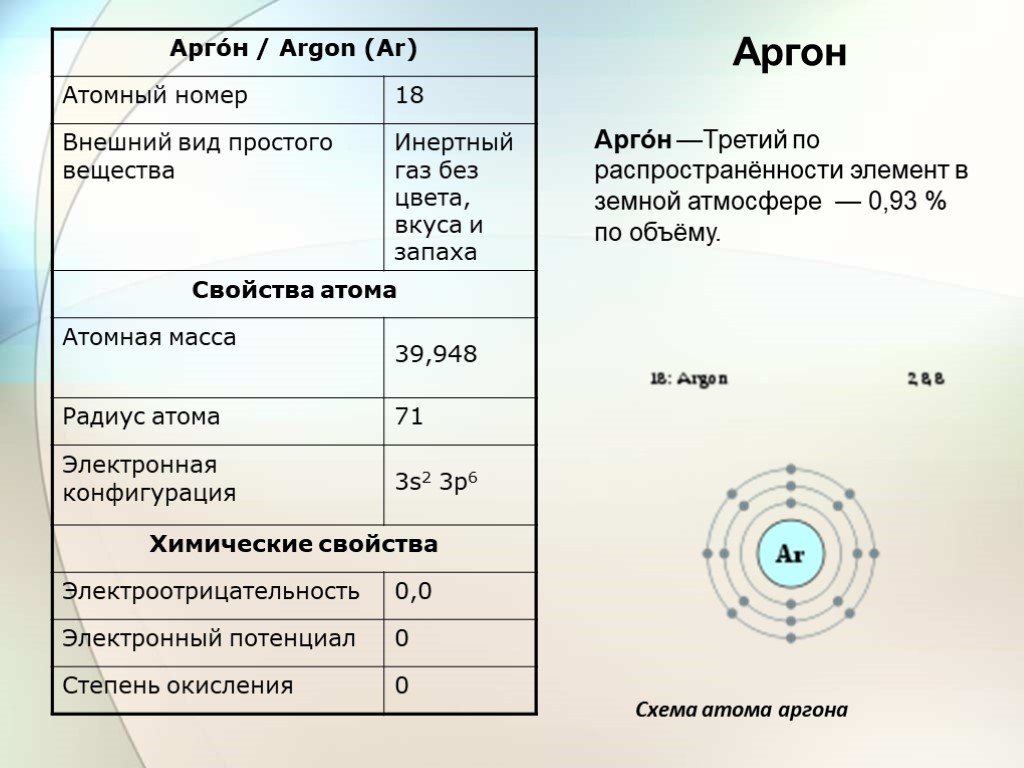
Аргон (вместе с неоном) наблюдается на некоторых звездах и в планетарных туманностях. В целом его в космосе больше, чем кальция, фосфора, хлора, в то время как на Земле существуют обратные отношения.
Земная кора
Аргон — третий по содержанию после азота и кислорода компонент воздуха, его среднестатистическое содержание в атмосфере Земли составляет 0,934 % по объему и 1,288 % по массе, его запасы в атмосфере оцениваются в 4·1014 т. Аргон — самый распространённый инертный газ в земной атмосфере, в 1 м³ воздуха содержится 9,34 л аргона (для сравнения: в том же объеме воздуха содержится 18,2 см³ неона, 5,2 см³ гелия, 1,1 см³ криптона, 0,09 см³ ксенона).
Содержание аргона в литосфере — 4·10-6 % по массе. В каждом литре морской воды растворено 0,3 см³ аргона, в пресной воде его содержится 5,5·10-5 — 9,7·10-5 %. Его содержание в Мировом океане оценивается в 7,5·1011 т, а в изверженных породах земной оболочки — 16,5·1011 т.
Определение
Качественно аргон обнаруживают с помощью эмиссионного спектрального анализа, основные характеристические линии — 434,80 и 811,53 нм. При количественном определении сопутствующие газы (O2, N2, H2, CO2) связываются специфичными реагентами (Ca, Cu, MnO, CuO, NaOH) или отделяются с помощью поглотителей (например, водных растворов органических и неорганических сульфатов). Отделение от других инертных газов основано на различной адсорбируемости их активным углём. Используются методы анализа, основанные на измерении различных физических свойств (плотности, теплопроводности и др.), а также масс-спектрометрические и хроматографические методы анализа.
Физические свойства
Аргон — одноатомный газ с температурой кипения (при нормальном давлении) −185,9 °C (немного ниже, чем у кислорода, но немного выше, чем у азота). В 100 мл воды при 20 °C растворяется 3,3 мл аргона, в некоторых органических растворителях аргон растворяется значительно лучше, чем в воде.
Химические свойства
Пока известны только 2 химических соединения аргона — гидрофторид аргона и CU(Ar)O, которые существуют при очень низких температурах. Кроме того, аргон образует эксимерные молекулы, то есть молекулы, у которых устойчивы возбужденные электронные состояния и неустойчиво основное состояние. Есть основания считать, что исключительно нестойкое соединение Hg—Ar, образующееся в электрическом разряде, — это подлинно химическое (валентное) соединение. Не исключено, что будут получены другие валентные соединения аргона с фтором и кислородом, которые тоже должны быть крайне неустойчивыми. Например, при электрическом возбуждении смеси аргона и хлора возможна газофазная реакция с образованием ArCl.
Также со многими веществами, между молекулами которых действуют водородные связи (водой, фенолом, гидрохиноном и другими), образует соединения включения (клатраты), где атом аргона, как своего рода «гость», находится в полости, образованной в кристаллической решётке молекулами вещества-хозяина.
Соединение CU(Ar)O получено из соединения урана с углеродом и кислородом CUO. Вероятно существование соединений со связями Ar-Si и Ar-C: FArSiF3 и FArCCH.
Изотопы
Аргон представлен в земной атмосфере тремя стабильными изотопами: 36Ar (0,337 %), 38Ar (0,063 %), 40Ar (99,600 %). Почти вся масса тяжёлого изотопа 40Ar возникла на Земле в результате распада радиоактивного изотопа калия 40K (содержание этого изотопа в изверженных породах в среднем составляет 3,1 г/т). Распад радиоактивного калия идёт по двум направлениям одновременно:
Первый процесс (обычный β-распад) протекает в 88 % случаев и ведет к возникновению стабильного изотопа кальция. Во втором процессе, где участвуют 12 % атомов, происходит электронный захват, в результате чего образуется тяжёлый изотоп аргона. Одна тонна калия, содержащегося в горных породах или водах, в течение года генерирует приблизительно 3100 атомов аргона. Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Таким образом, в минералах, содержащих калий, постепенно накапливается 40Ar, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Вероятные источники происхождения изотопов 36Ar и 38Ar — неустойчивые продукты спонтанного деления тяжёлых ядер, а также реакции захвата нейтронов и альфа-частиц ядрами лёгких элементов, содержащихся в урано-ториевых минералах.
Подавляющая часть космического аргона состоит из изотопов 36Ar и 38Ar. Это вызвано тем обстоятельством, что калий распространён в космосе примерно в 50 000 раз меньше, чем аргон (на Земле калий преобладает над аргоном в 660 раз). Примечателен произведенный геохимиками подсчёт: вычтя из аргона земной атмосферы радиогенный 40Ar, они получили изотопный состав, очень близкий к составу космического аргона.
Получение
В промышленности аргон получают как побочный продукт при крупномасштабном разделении воздуха на кислород и азот. При температуре −185,9°C аргон конденсируется, при −189,4°С — кристаллизуется.
При температуре −185,9°C аргон конденсируется, при −189,4°С — кристаллизуется.
Применение
Заполненная аргоном и парами ртути газоразрядная трубка
Применения аргона:
-
в аргоновых лазерах -
в лампах накаливания и при заполнении внутреннего пространства стеклопакетов -
в качестве защитной среды при сварке (дуговой, лазерной, контактной и т. п.) как металлов, так и неметаллов -
в качестве плазмаобразователя в плазматронах при сварке и резке -
в пищевой промышленности аргон зарегистрирован в качестве пищевой добавки E938, в качестве пропеллента и упаковочного газа -
в качестве огнетушащего вещества в газовых установках пожаротушения
Биологическая роль
Аргон не играет никакой биологической роли.
Физиологическое действие
Инертные газы обладают физиологическим действием, которое проявляется в их наркотическом воздействии на организм. Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа..
Наркотический эффект от вдыхания аргона проявляется только при барометрическом давлении свыше 0,2 МПа..
Содержание аргона в высоких концентрациях во вдыхаемом воздухе может вызвать головокружение, тошноту, рвоту, потерю сознания и смерть от асфиксии (в результате кислородного голодания).
Аргон: применение, получение, история — «ИСКРОЛАЙН»
Авторы:
сотрудники компанииАналитические линии плазмообразующего газа (аргона) на фрагменте спектра образца углеродистой низколегированной стали
Аргон – элемент с атомной массой 39,944 и порядковым номером 18. Принадлежит к 8-ой группе главной подгруппы таблицы Менделеева, относится к благородным инертным одноатомным газам. Не обладает ни запахом, ни цветом, ни вкусом. Негорючий и невзрывоопасный.
История открытия Аргона
Впервые неизвестный до этого газ, при химических и физических экспериментах, обнаружил в 1785 году Генри Кавендиш — английский физик и химик. Но он не смог разгадать загадку и прекратил исследования. Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
Позднее на записи Кавендиша обратил внимание Джеймс Максвелл.
И лишь спустя более ста лет, в 1894 году, химик Уильям Рамзай и физик Джон Уильям Стретт (Лорд Рэлей) сделали доклад об открытии нового элемента, который, за свою химическую неактивность, назвали аргоном. Это случилось в Оксфорде на собрании Британской ассоциации естествоиспытателей, физиков и химиков. Название нового газа произошло от греческого слова ἀργός, что в переводе означает — неактивный, медленный.
Спустя еще 10 лет, эти ученые получили Нобелевские премии за исследования газов, открытие аргона и других инертных газов в атмосфере.
Получение Аргона
Аргон — наиболее распространенный в воздухе инертный газ. В 1 м3 содержится примерно 0,09 см3 ксенона, 1,1 см3 криптона, 5,2 см3 гелия, 18,2 см3 неона, 9000 см3 аргона.
В атмосфере Земли аргон занимает третье место. На первом – азот, на втором — кислород. В процентном отношении это примерно 0,93% по объёму или 1. 3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
3% по массе. По этой причине он является самым легкодоступным и недорогим инертным газом.
Получение и промышленное производство этого газа происходит как выделение сопутствующего газа при добыче азота и кислорода из атмосферного воздуха. Наиболее простой метод — это глубокое охлаждение и ректификация с последующей доочисткой от примесей.
Кроме того, аргон получают при производстве аммиака. Доочистку аргона осуществляют по технологии гидрирования с платиновым катализатором или адсорбционным методом с использованием молекулярных сит или активного угля.
Применение Аргона
Основными потребителями аргона являются:
Металлургия. Применение аргона в современных технологических процессах выплавки стали — продувка расплава в ковше. Эта операция выполняет несколько функций: охлаждение металла, ускорение плавления вводимых в ковш лигатур и раскислителей, гомогенизация металла по химическому составу и температуре, очищение от неметаллических включений, образующихся от раскисляющих и легирующих добавок, углеродное раскисление металла и его обезуглероживание, удаление водорода и азота, ускорение десульфурации (удаление серы из расплава), вдувание раскисляющих и легирующих порошкообразных добавок.
В металлургии высококачественных сплавов аргон используется для защиты расплава от контакта с воздухом во время выплавки и разливки. Высокотемпературная обработка титана и его сплавов требует защитной аргоновой атмосферы. Незаменим аргон и в технологиях обработки таких редких металлов как цирконий, вольфрам, тантал, ниобий, бериллий, гафний и др.
Металлообрабатывающая промышленность. Основное использование аргона — создание защитной завесы при электродуговой (АРДЭС), контактной и лазерной сварке, термообработке. Аргон — плазмообразующий газ в установках сварки и резки активных, редких металлов, сплавов на их основе, например, алюминиевых и магниевых, нержавеющих, хромоникелевых, жаропрочных сплавов и легированных сталей.
Радиоэлектронная промышленность. Здесь аргон незаменим для создания инертной среды в установках плазменного напыления, заполнение колб электрических и люминесцентных ламп, электровакуумных приборов, газосветной рекламы. Например, сине-голубое свечение получается при заполнении трубок аргоном с парами ртути.
Пищевая промышленность. Благодаря своей химической нейтральности, аргон широко используют как пропеллтен («выталкивающий» газ) в аэрозольных упаковках, антифламинг (вещество снижающее образование пены) и «упаковочный» газ в пищевой промышленности.
Спектральный анализ и метрология. В данной сфере аргон наиболее часто используется как газ-носитель, инертная среда и плазмообразующий газ в контрольно-измерительных приборах, а также при производстве поверочных газовых смесей (ПГС) для различных газоанализаторов.
В данной сфере применения чистота аргона имеет ключевое значение. Даже при минимальных отклонениях качества аргона от соответствующих ГОСТов и ТУ, регламентированных для использования в конкретных приборах, изменяются условия работы и анализа, что приводит к серьезным искажениям результатов измерений, нарушению работоспособности оборудования, снижению качества продукции, снижению ресурса фильтров и, как следствие, серьезным экономическим убыткам.
Для предотвращения вышеописанного, могут использоваться специализированные фильтры, а также установки доочистки аргона (инертных газов) лабораторного или промышленного назначения.
Так как наша компания занимается разработкой и производством спектрометров, применение аргона в этих приборах мы решили рассмотреть более подробно. Ниже в статье этому будет посвящена отдельная глава.
Прочие сферы применения. Огнетушительные установки, заполнение стеклопакетов и поддув сухих гидрокостюмов водолазов для лучшей теплоизоляции, в медицине — очистка разрезов при хирургическом вмешательстве, в химической промышленности — инертная среда для нестабильных на воздухе соединений, а так же в прочих областях промышленности.
Продолжение >
аргон | Свойства, использование, атомный номер и факты
аргон
Посмотреть все СМИ
- Ключевые люди:
- сэр Уильям Рамзи
Лорд Рэлей
- Похожие темы:
- химический элемент
благородный газ
воздуха
аргон-40
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
аргон (Ar) , химический элемент, инертный газ группы 18 (благородные газы) периодической таблицы, наиболее распространенный на Земле и наиболее часто используемый в промышленности из благородных газов. Бесцветный, без запаха и вкуса газообразный аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамзи. Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 г. пришел к выводу, что не более 1 / 120 часть азота может быть каким-то инертным компонентом. Его работа была забыта, пока лорд Рэлей более века спустя не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента более плотный, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления из воздуха кислорода и азота, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за его химической инертности. (Гелий был обнаружен спектроскопически на Солнце в 1868 г.)
Бесцветный, без запаха и вкуса газообразный аргон был выделен (1894 г.) из воздуха британскими учеными лордом Рэлеем и сэром Уильямом Рамзи. Генри Кавендиш, исследуя атмосферный азот («флогистированный воздух»), в 1785 г. пришел к выводу, что не более 1 / 120 часть азота может быть каким-то инертным компонентом. Его работа была забыта, пока лорд Рэлей более века спустя не обнаружил, что азот, полученный путем удаления кислорода из воздуха, всегда примерно на 0,5 процента более плотный, чем азот, полученный из химических источников, таких как аммиак. Более тяжелый газ, оставшийся после удаления из воздуха кислорода и азота, был первым из благородных газов, обнаруженных на Земле, и был назван в честь греческого слова argos , «ленивый», из-за его химической инертности. (Гелий был обнаружен спектроскопически на Солнце в 1868 г.)
По распространенности в космосе аргон занимает примерно 12-е место среди химических элементов. Аргон составляет 1,288 % атмосферы по весу и 0,934 % по объему и содержится в горных породах. Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента земного аргона соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Хотя стабильные изотопы аргон-36 и аргон-38 составляют почти след этого элемента во Вселенной, третий стабильный изотоп, аргон-40, составляет 99,60% аргона, обнаруженного на Земле. (Аргон-36 и аргон-38 составляют 0,34 и 0,06 процента земного аргона соответственно.) Большая часть земного аргона была произведена с момента образования Земли из калийсодержащих минералов в результате распада редкого, естественно радиоактивного изотопа. калий-40. Газ медленно просачивается в атмосферу из горных пород, в которых он еще формируется. Производство аргона-40 при распаде калия-40 используется как средство определения возраста Земли (калий-аргоновое датирование).
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Аргон выделяют в больших масштабах фракционной перегонкой жидкого воздуха. Он используется в газонаполненных электрических лампочках, радиолампах и счетчиках Гейгера. Он также широко используется в качестве инертной атмосферы для дуговой сварки металлов, таких как алюминий и нержавеющая сталь; для производства и изготовления металлов, таких как титан, цирконий и уран; и для выращивания кристаллов полупроводников, таких как кремний и германий.
Газообразный аргон конденсируется в бесцветную жидкость при -185,8 °C (-302,4 °F) и в кристаллическое твердое вещество при -189,4 °C (-308,9 °F). Газ нельзя сжижать под давлением выше температуры -122,3 ° C (-188,1 ° F), и в этот момент для его сжижения требуется давление не менее 48 атмосфер. При 12 ° C (53,6 ° F) 3,94 объема газообразного аргона растворяются в 100 объемах воды. Электрический разряд в аргоне при низком давлении выглядит бледно-красным, а при высоком давлении — сине-стальным.
Самая внешняя (валентная) оболочка аргона имеет восемь электронов, что делает ее чрезвычайно стабильной и, таким образом, химически инертной. Атомы аргона не соединяются друг с другом; также не наблюдалось их химического соединения с атомами любого другого элемента. Атомы аргона были механически захвачены в подобных клеткам полостях среди молекул других веществ, как, например, в кристаллах льда или органического соединения гидрохинона (называемого клатратами аргона).
| atomic number | 18 |
|---|---|
| atomic weight | [39. 792, 39.963] 792, 39.963] |
| melting point | −189.2 °C (−308.6 °F) |
| точка кипения | −185,7 ° C (–302,3 ° F) |
| Плотность (1 атм, 0 ° C) | 1,784 г/литр |
| Электрит. | |
| ЭЛЕКТРИЧЕСКИЙ ЭЛЕКТРИЧЕСКИЙ. | 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 |
The Editors of Encyclopaedia BritannicaThis article was последний раз переработанный и обновленный Эриком Грегерсеном.
Доступный элемент Аргон | ChemTalk
Элементы
- Сообщение от
Кеннеди Брем
05
Aug
Знакомство с аргоном
Элемент аргон бесцветен, не имеет запаха, негорюч и нетоксичен. Это наиболее распространенный благородный газ, химически инертный. Стабильных соединений аргона не существует. Он обычно используется в промышленных целях, в научных исследованиях и в качестве консерванта.
Это наиболее распространенный благородный газ, химически инертный. Стабильных соединений аргона не существует. Он обычно используется в промышленных целях, в научных исследованиях и в качестве консерванта.
Десять интересных и забавных фактов об аргоне
- Аргона в два раза больше, чем водяного пара, и более чем в 20 раз больше, чем углекислого газа.
- Слово аргон происходит от греческого слова, означающего «ленивый» и «неактивный».
- Американский национальный архив хранит Декларацию независимости и Конституцию с аргоном. Раньше их консервировал гелий, однако его заменили, потому что он вытекал из корпуса и требовал замены.
- Синие неоновые лампы на самом деле содержат аргон. Неон создает оранжево-красное свечение.
- Аргон исследуется как более дешевая альтернатива ксенону при лечении черепно-мозговых травм. Вот новое исследование о влиянии вдыхаемого аргона на травмы головного мозга у мышей.
- Аргон был первым обнаруженным благородным газом.

- Атмосферы Марса и Меркурия содержат аргон.
- Научные исследования используют аргон для поиска темной материи.
- Аргон светится фиолетово-сиреневым цветом в газоразрядной трубке.
- Он так же растворим в воде, как кислород.
Аргон в периодической таблице
Аргон, атомный символ Ar, имеет атомный номер 18 и находится в группе 18 в периодической таблице ниже неона и справа от хлора. Этот элемент является третьим по распространенности газом в атмосфере Земли. Аргон — благородный газ с полной валентной электронной оболочкой, что делает его нереакционноспособным.
Аргон имеет электроотрицательность 0 (по шкале Полинга). Электронная конфигурация аргона [Ne] 3s2 3p6. Другие благородные газы включают гелий, неон, криптон, ксенон и радон. Аргон имеет схожие свойства со своей группой.
Применение аргона в современном мире
Для чего используется аргон?
Птицеводство
Аргон на 38% плотнее воздуха и вытесняет кислород у земли. Это делает целесообразным удушение птиц как более гуманную форму убоя. Он также может действовать как консервант, поскольку заменяет кислород внутри птицы.
Это делает целесообразным удушение птиц как более гуманную форму убоя. Он также может действовать как консервант, поскольку заменяет кислород внутри птицы.
Аргон может быть опасен для человека в закрытых помещениях. Его трудно обнаружить, и возникает опасность утечки аргонового баллона в замкнутое пространство. Мужчина умер в 1984 году от удушья аргоном на строительной площадке нефтепровода на Аляске.
Консервант
Аргон может продлить срок годности пищевых продуктов за счет вытеснения кислорода и предотвращения окисления и гидролиза в воздухе. Он также может сохранять фармацевтические препараты. Аргон также является полезным барьером между кислородом и вином в виноделии.
Освещение
Элемент аргон сохраняет нити накаливания в лампах накаливания при высоких температурах. Он также предотвращает коррозию нитей кислородом. В энергосберегающих лампочках используется аргон и ртуть. Электрический разряд проходит через газ для генерации УФ-излучения, которое активирует покрытие на внутренней поверхности колбы.
Газоразрядная трубка для аргона.
Другое применение
- Электронные печи с графитом для предотвращения горения графита
- Дуговая сварка, дуговая сварка металлическим электродом, дуговая сварка вольфрамовым электродом
- Обработка реактивных элементов, таких как титан
- Выращивание кристаллов кремния и германия
- Тушение пожаров
- Лабораторное оборудование, такое как газовая хроматография, масс-спектрометрия с электрораспылением, ICP-спектроскопия и сканирующая электронная микроскопия.
- Пропеллент в аэрозольных баллончиках
- Уничтожение раковых клеток в криохирургии
- Синие лазеры, используемые для сваривания артерий, разрушения опухолей и при хирургии глаза
- Теплоизоляция окон
- Надувание гидрокостюмов
- Счетчики Гейгера
Где содержится аргон?
40Ar — самый распространенный изотоп аргона на Земле. 40K распадается с периодом полураспада 1,25 x 10 9 в 40Ar путем захвата электронов и испускания позитронов. Этот распад полезен для датирования горных пород K-Ar. Кроме того, звездный нуклеосинтез в сверхновых производит самый распространенный изотоп аргона во Вселенной: 36Ar.
Этот распад полезен для датирования горных пород K-Ar. Кроме того, звездный нуклеосинтез в сверхновых производит самый распространенный изотоп аргона во Вселенной: 36Ar.
Когда и как был открыт аргон?
Генри Кавендиш был первым, кто заподозрил нереакционноспособный компонент воздуха в 1785 году.4, что лорд Рэлей и сэр Уильям Рамзи из Университетского колледжа Лондона выделили аргон из пробы воздуха. Они обнаружили, что азот, полученный в результате реакций, был на 0,5% легче атмосферного азота. Это привлекло их внимание и привело к открытию аргона. Рамзи получил Нобелевскую премию по химии 1904 года за открытие аргона. И Х. Ф. Ньюолл, и В. Н. Хартли также открыли аргон в 1882 году в виде новых линий в спектре излучения воздуха. Символ аргона изменился с «А» на «Ар» в 1957 г.
Химия аргона – соединения, реакции, степени окисления, выделение
Химические свойства элемента аргона
Аргон химически инертен из-за его полной валентной электронной оболочки. Это делает аргон пригодным для хранения и в качестве консерванта.
Это делает аргон пригодным для хранения и в качестве консерванта.
Соединения аргона
Аргон имеет полный октет электронов, что делает его очень стабильным и устойчивым к связыванию с другими элементами. До 1962 года считалось, что благородные газы не способны образовывать соединения. Первое соединение аргона ученые синтезировали в 1975 с пентакарбонилом вольфрама. Хельсинкский университет открыл фторгидрид аргона в 2000 году. В результате официальное признание получили слабые соединения аргона. Добавление ультрафиолетового света к замороженному аргону, фтороводороду и иодиду цезия создает фторгидрид аргона.
Выделение аргона
При фракционной перегонке жидкого воздуха в криогенной воздухоразделительной установке жидкий азот и кислород отделяются от аргона по их температурам кипения. В результате производится более полумиллиона тонн аргона.
Степени окисления аргона
Поскольку аргон является инертным газом, он не имеет степеней окисления.![]()
