Основные физические свойства олова. Характеристика олова
Особенности и основные физические свойства.
Олово — металл, служивший человеку с незапамятных времен. Физические свойства олова обеспечили его основополагающую роль в истории человечества. Без него невозможно существование бронзы, остававшейся на протяжении многих веков единственным сплавом, из которого человек изготовлял практически все — от орудий труда до ювелирных украшений.

Олово — металл использующийся человеком с давних времен
Физические свойства олова
При нормальном давлении и температуре 20°C олово идентифицируется как металл с блеском бело-серебристого цвета. Медленно тускнеет на воздухе вследствие образования оксидной пленки.
Для олова, как и для всех металлов, характерна непрозрачность. Свободные электроны металлической кристаллической решетки заполняют межатомное пространство и отражают световые лучи, не пропуская их. Поэтому находясь в кристаллическом состоянии, металл имеет характерный блеск, а в порошкообразном виде этот блеск утрачивает.
Обладает отличной ковкостью, т. е. легко подвергается обработке с помощью давления. Ковкость олову придает его высокая пластичность в сочетании с низким сопротивлением деформации. Пластичность металла позволяет раскатать его в тонкую фольгу, называемую станиолем или оловянной бумагой. Ее толщина колеблется от 0,008 до 0,12 мм. Ранее станиоль находил применение в качестве подложки при изготовлении зеркал и в электротехнике при производстве конденсаторов, пока не был полностью вытеснен алюминиевой фольгой.
У олова свойства достаточно мягкого металла. Его твердость по шкале Бринелля составляет 3,9–4,2 кгс/мм².
Относится к легкоплавким металлам. Температура плавления олова — 231,9°C — способствует быстрому извлечению его из руды. Олово просто сплавляется с другими металлами, что обеспечивает его обширное применение в промышленности.
Плотность при температуре 20°C составляет 7,29 г/см³. По этому показателю олово в 2,7 раза тяжелее алюминия, но легче серебра, золота, платины и приближено к плотности железа (7,87 г/см³).
Металл закипает при высокой температуре, равной 2620°C, долго оставаясь жидким в расплаве.
Химически чистое олово при обычной температуре обладает незначительной прочностью. При растяжении предел механической прочности составляет всего 1,7 кгс/мм², а относительное удлинение — 80–90%. Эти характеристики говорят о том, что деформировать оловянный прут можно без особых усилий в разных направлениях. При этом смещение слоев кристаллической решетки металла относительно друг друга сопровождается специфичным треском.
Полиморфизм олова
Полиморфизм (аллотропия) — физическое явление, основанное на перестроении атомов или молекул веществ в твердом состоянии, что влечет за собой изменение их свойств. Каждая полиморфная модификация устойчиво существует только в строго определенном интервале значений температур и давлений.
Любой металл обладает специфической кристаллической решеткой. При изменении внешних физических условий кристаллическая решетка может меняться. Полиморфизм металлов используют при их термической обработке в промышленности.

Олово — металл по разному реагирующий на химические воздействия
Химические свойства олова определяются его положением в периодической системе элементов Д. И. Менделеева и предусматривают амфотерность, т. е. способность проявлять как основные, так и кислотные свойства. Напрямую зависят от полиморфизма олова физические свойства.
Для металла известны три аллотропные модификации: альфа, бета и гамма. Полиморфная перестройка кристаллических решеток возможна вследствие изменения симметрии электронных оболочек атомов под воздействием разных температур.
- Для серого олова (α-Sn) характерна гранецентрированная кубическая кристаллическая решетка. Размер элементарной ячейки решетки здесь большой. Это напрямую отражается на плотности. Она меньше, чем у белого олова: 5,85 и 7,29 г/см³ соответственно. По электропроводности альфа-модификация относится к полупроводникам. По магнетизму — к диамагнетикам, т. к. под внешним магнитным воздействием намагничивается против направления внутреннего магнитного поля. Альфа-олово существует до температуры 13,2°C в виде мелкодисперсного порошка и практического значения не несет.
- Белое олово (β-Sn) является самой устойчивой аллотропной модификацией с объемноцентрированной тетрагональной кристаллической решеткой. Существует в диапазоне температурных значений от 13,2 до 161°С. Очень пластично, мягче золота, но тверже свинца. Среди остальных металлов обладает средним значением теплопроводности. Металл относят к проводникам, хотя электропроводность у бета-модификации относительно низкая. Этим свойством пользуются, чтобы уменьшить электропроводность какого-либо сплава путем добавления олова. Является парамагнетиком, т. е. во внешнем магнитном поле намагничивается в направлении внутреннего магнитного поля.
- Гамма-модификация (γ-Sn) обладает ромбической кристаллической решеткой, устойчива в диапазоне температур от 161 до 232°С. С увеличением температуры пластичность возрастает, но, достигнув температуры фазового перехода в 161°С, металл полностью утрачивает это свойство. Гамма-модификация имеет большую плотность при высокой степени хрупкости, т. е. сразу рассыпается в порошок, поэтому практического применения не имеет.
Особенности полиморфного перехода β→α
Процесс перехода из одной полиморфной модификации в другую происходит при изменении температуры. При этом наблюдают скачкообразные изменения физико-химических свойств металла.
Выше температуры 161°С бета-олово обратимо превращается в хрупкую гамма-модификацию. Ниже температуры 13°С бета-модификация необратимо переходит в порошкообразное серое олово. Данный полиморфный переход совершается с очень малой скоростью, но стоит только на бета-олово попасть крупинкам альфа-модификации, как плотный металл рассыпается в пыль. Поэтому полиморфный переход β→α иногда называют «оловянной чумой». Обратно альфа-модификация переводится в бета-модификацию только путем переплавки.
Фазовый переход β→α значительно ускоряется при минусовых температурах окружающей среды и сопровождается увеличением удельного объема металла примерно на 25%, что приводит к его рассыпанию в порошок.

У олова есть уникальная реакция на мороз «оловянная чума»
В истории есть случаи, когда оловянные изделия на морозе становились серым порошком, обескураживая своих хозяев. «Оловянная чума» встречается редко и характерна лишь для химически чистого вещества. При наличии даже мельчайших примесей переход металла в порошок сильно замедляется.
Интересно предположение некоторых историков, что победу российскому императору Александру I над французской армией под командованием Наполеона Бонапарта помогла одержать «оловянная чума». При сильных морозах пуговицы на шинелях французов просто рассыпались в прах, и солдаты, замерзая, потеряли боеспособность.
Заключение
Олово обладает всеми типичными физическими свойствами металлов, а его полиморфизм по-своему удивителен. Без уникальной тягучести и пластичности этого металла невозможно представить себе современную промышленность. Почти половина от мировой добычи олова используется для производства пищевой жести. Оставшаяся половина расходуется для изготовления сплавов и различных соединений, применяемых во всех хозяйственных отраслях.
Похожие статьи
ometallah.com
Соединения, взаимодействие и состав олова
Олово представляет собой металл с характерным серебристо-белым цветом. В периодической системе химических элементов имеет 50 номер и обозначается в химической номенклатуре символом Sn (с латинского Stannum). Олово входит в группу легких металлов. В нормальных условиях существования металл проявляет свою пластичность, а также легко поддается ковке и плавке.
Олово является достаточно редким металлом, который встречается только в рассеянном состоянии. Среди перечня всех содержащихся в земной коре химических элементов, олово располагается на 47 месте. Основным материалом, из которого добывается олово, являются руды и пески. Максимальное количество содержания олова найдено в кассетирите ,минерале, доля которого достаточно велика в песках, находящихся на океанском дне. Содержание металла в кассетирите достигает 80%. Также достаточное для добычи содержание олова находится и в оловянном колчедане. Однако, его существование в природе – настоящая редкость.

Характеристики олова
Свойства олова заключаются в следующем. Это твердый металл, который при температуре 200С имеет плотность, равную 7,3 г/см3, когда олово переходит в жидкое состояние, что возможно только при температуре плавления, его плотность составляет 6,98 г/см3. Плавится металл при 231,90С, закипает при 26000С. Т.е. предельной температурой, при которой металл способен сохранять свое твердое состояние, является 2310С. Стоит отметить, что металл достаточно гибкий в охлажденном состоянии. Если воздействовать элемент незначительным повышением температуры, то при нажатии металл легко поддается деформации, подобно пластилину.
Олово имеет коэффициент линейного расширения при температуре в диапазоне от 200С до 1000С, который составляет 22,4*10-6К-1. Металл имеет удельную теплоемкость, которая при 200С равняется 226 Дж/(кг*К), а в жидком состоянии – 268 Дж/(кг*К).
При температуре, равной 200С, теплопроводность олова составляет 65,8 Вт(м*К), его удельное электросопротивление и удельная электропроводность при той же температуре составляют 0,115 мкОм*м и 8,69 МСм/м, соответственно.
Как уже говорилось, металл является достаточно мягким и без труда поддающимся резанию ножом. Его твердость по Бринеллю составляет 50 МПа. Относительное удлинение металла равняется 80%. Литье осуществляется, когда температура металла достигает 260-3000С.
Олово имеет молекулярную массу 50, в связи, с чем считается легким металлом. Вес металла практически такой же, как и у алюминия.
На поверхности металла находится оксид олова, который является отличной защитной пленкой, призванной предотвратить появление на нем коррозии. Данное свойство присуще металлу даже во влажном воздухе при температуре 100 0С. Олово не обладает химической стойкостью, легко реагируя с азотной и серной кислотами. Также вступает в реакцию и с галогенами.
| Свойства атома | |
| Название, символ, номер | О́лово / Stannum (Sn), 50 |
|
Атомная масса (молярная масса) |
118,710(7)[1] а. е. м. (г/моль) |
|
Электронная конфигурация |
[Kr] 4d10 5s2 5p2 |
|
Радиус атома |
162 пм |
|
Химические свойства олова |
|
|
Ковалентный радиус |
141 пм |
|
Радиус иона |
(+4e) 71 (+2) 93 пм |
|
Электроотрицательность |
1,96 (шкала Полинга) |
|
Электродный потенциал |
-0,136 |
|
Степени окисления |
+4, +2 |
|
Энергия ионизации (первый электрон) |
708,2 (7,34) кДж/моль (эВ) |
|
Термодинамические свойства простого вещества |
|
|
Плотность (при н. у.) |
7,31 г/см³ |
|
Температура плавления |
231,9 °C |
|
Температура кипения |
2873 K |
|
Уд. теплота плавления |
7,07 кДж/моль |
|
Уд. теплота испарения |
296 кДж/моль |
|
Молярная теплоёмкость |
27,11[2] Дж/(K·моль) |
|
Молярный объём |
16,3 см³/моль |
|
Кристаллическая решётка простого вещества |
|
|
Структура решётки |
тетрагональная |
|
Параметры решётки |
a=5,831;c=3,181 Å |
|
Отношение c/a |
0,546 |
|
Температура Дебая |
170,00 K |
|
Прочие характеристики олова |
|
|
Теплопроводность |
(300 K) 66,8 Вт/(м·К) |
|
Номер CAS |
7440-31-5 |
Виды олова
Очень важным значением является структура металла, от которой зависит его качество и многие свойства. Некоторые металлы могут иметь различную модификацию, не исключением в данном случае является и олово. Согласно его модификации различают следующие виды олова:
- белый металл (или олово β-модификации). Это именно тот вид олова, для которого характерными являются серебристый оттенок, легкость, пластичность, а также ковкость. Белое олово плавится при относительно низкой температуре - +2310С, а закипает при +22700С. Белое олово проявляет типичные металлические свойства. Стоит отметить, что данная фаза является устойчивой к повышению температуры выше +13,20С.
- серое олово (α-модификация). Образуется при температуре ниже 13,20С. Характеризуется кубической кристаллической решеткой, которая имеет схожесть с кристаллической решеткой алмаза. Серое олово имеет более низкую плотность, не поддается ковке, а также представляет собой полупроводник. Переход из одной фазы олова в другую по причине различной плотности способствует увеличению объема. Стоит отметить, что при этом изделия из олова разрушаются, превращаясь в гору порошка. Данное явление в древние века носило название «оловянная чума», которая больше всех заставляла страдать солдат. Это связано было с тем, что в те времена, именно олово служило основным материалом для изготовления пуговиц, ложек, некоторых частей обмундирования, которые рассыпались под воздействием низких температур. В результате этого, армия становилась не боеспособной. Порошок имеет плотность, которая в несколько раз ниже, чем плотность олова в металлическом состоянии, - 5850 гр/см3
- γ-олово является еще одной фазой металла. Данный вид способен существовать при определенном температурном режиме, который находится в диапазоне 161-2320С. До настоящего времени практического применения данного олова нет.
Стоит сказать, что олово относится к амфотерным элементам, способным проявлять как кислотные, так и основные свойства. Именно поэтому, металл встречается только в рассеянной форме.
Металлическое олово абсолютно не обладает токсичностью, что является основной причиной, по которой допускается применение олова в пищевой промышленности. А вот некоторые соединения олова, а точнее, их пары, представляют собой серьезную опасность для человеческого здоровья и жизни.
mining-prom.ru
Свойства олова | khimie.ru
Свойства олова. Олово представляет собой серебрлсто-бслый блестящий металл, обладающий незначительной твердостью, но большой ковкостью, так что его можно прокатать до очопь топких листов (сташшолъ). Его удельный вес 7,28, точка плавления 231,8 °С. В значительной мере оно улетучивается уже при 1200 °С, хотя точка кипения его лежит только при 2362 °С. Из расплава олово затвердевает обычно в виде тетрагональных кристаллитов. Кристаллическая структура Sn отчетливо проявляется, если его шлиф протравить соляной кислотой (муаровое олово). Хрустящий звук, появляющийся при сгибании оловянной палочки («оловянный крик»), обусловлен трепцом кристаллитов друг о друга. Выше 161 °С олово превращается в другую, ромбическую, модификацию. В этой форме оно очень хрупко, так что его можно истолочь в порошок (лучше всего при температуре примерно 200 °С), а при падении с небольшой высоты оно разбивается на мелкие куски. На этом основано приготовление так называемого зерненого олова. Третья модификация − порошкообразное серое олово (уд. вес при 18 °С 5,75) − стабильна ниже 13,2 °С. Превращение в эту модификацию и обратный процесс происходят обычно с бесконечно малой скоростью. При переходе олова в серую модификацию оловянные предметы полностью разрушаются. В местах, пораженных превращением, они рассыпаются в порошок («оловянная чума»).
При устойчивых сильных холодах в разных местах оловянных предметов начинается спонтанное превращение олова в серую модификацию. В этом случае на пораженных предметах образуются серые пятна, которые состоят из порошкообразного серого олова. Эти пылинки, попадая на другие места, действуют как зародыши кристаллизации, так что разрушающее превращение, если оно началось только в одном месте, распространяется как заразное заболевание. Название для этого явления «оловянная чума» очень характерно. Превращение тем активнее, чем сильнее охлаждено олово ниже температуры 13,2 ºС. Однако в силу того, что скорость реакции с понижением температуры уменьшается, имеется определенная температура, при которой скорость превращения достигает своего максимума. Эта температура лежит около −48 °С. Превращение ускоряется под действием спиртового раствора «розовой соли»; оно замедляется, прежде всего, под действием солей висмута и сурьмы. Термическая и механическая обработка металла и число превращений, которые уже произошли, также весьма значительно влияют на скорость превращения.
Структура решетки серого олова (α-Sn) такая же, как у алмаза, но с а = 6,46 Å. Обычное тетрагональное олово (β-Sn) образует (не наблюдающуюся у других соединений) решетку, которая может быть описана как решетка алмаза, сжатая в направлении оси с. Структура ромбического олова (γ-Sn) еще не известна.
Превращение α-Sn→β-Sn сопровождается не только значительным увеличением плотности, но также значительным усилением металлического характера. Оба свойства тесно связаны одно с другим, так как для металлов характерна особо плотная упаковка атомов (высокие координационные числа). Напротив, неметаллы вследствие наличия направленных связей имеют только небольшие координационные числа (4 и менее) и вследствие этого обладают достаточно объемными структурами. Наступающее при подводе тепла, очевидно вследствие разрыхления направленных связей, сжатее помимо олова, наблюдается также и у других элементов, которые в периодической системе расположены вблизи границы между металлами и неметаллами, например, у Ga, Si, Ge, Вi и Те. Однако у этих элементов сжатие не проявляется в твердом состояние, а наступает только при плавлении, а в случае даже несколько выше температуре плавления.
По отношению к воздуху и воде олово при обычной температуре устойчиво. Однако при более высокой температуре оно окисляется. Пары; олова легко и полностью сгорают, образуя диоксид. Со свободными галогенами олово образует тетрагалогениды. С хлором и бромом оно реагирует уже при обычной температуре, с йодом − при слабом нагревании. С фтором оно не реагирует заметно при обычной температуре, при 100 °С, напротив, очень энергично (с появлением пламени). Так же достаточно энергично оно реагирует при нагревании с серой, селеном и теллуром. С азотом олово непосредственно не соединяется, а с фосфором реагирует при нагревании.
Разбавленные кислоты лишь медленно действуют на олово, что объясняется незначительной разницей его нормального потенциала и нормального потенциала водорода. Лучше всего оно растворяется в концентрированной соляной кислоте Sn + 2HС1 = SnС12 + h3. Это уравнение выражает процесс только частично, поскольку для растворения в соляной кислоте большое значение имеет также тенденция олова образовывать хлорокомплексы, например [SnСl3]—. Энергично реагирует олово также с концентрированной азотной кислотой. При этом оно превращается в нерастворимый в воде белый порошок, β-оловянную кислоту. Гораздо медленнее взаимодействует олово с концентрированной серной кислотой, в которой оно растворяется с выделением SO2.
При кипячении с растворами едких щелочей олово переходит в раствор с образованием гидроксостаннат-ионов:
Sn + 4Н2O + 20Н— = [Sn(ОН)6]2- + 2Н2.
Аналогичным образом олово переходит в раствор, если его используют в качестве анода, погрузив в концентрированный раствор едкого натра:
Sn −4e— + 6OН— = [Sn(ОН)6]2-.
Если, однако, плотность тока превысит определенную величину, то олово внезапно «пассивируется», т. е. ведет себя как неразрушающийся электрод.
Важным для применения олова свойством является его способность легко образовывать сплавы с другими металлами.
Металлическое олово как практически нерастворимое вещество не ядовито. Однако в старых и сильно кислых консервах могут содержаться растворимые соединения олова, вредные для человеческого организма.
Ваш отзыв
Вы должны войти, чтобы оставлять комментарии.
khimie.ru
НихромПродукция Описание Цены Стандарты Статьи Фото ФехральПродукция Описание Цены Стандарты Статьи Фото Нихром в изоляцииПродукция Цены Стандарты Статьи Фото ТитанПродукция Описание Цены Стандарты Статьи Фото ВольфрамПродукция Описание Цены Стандарты Статьи Фото МолибденПродукция Описание Цены Стандарты Статьи Фото КобальтПродукция Описание Цены Стандарты Статьи Фото Термопарная проволокаПродукция Описание Цены Стандарты Статьи Фото Провода термопарныеПродукция Цены Стандарты Статьи Фото НикельПродукция Описание Цены Стандарты Статьи Фото МонельПродукция Описание Цены Стандарты Статьи Фото КонстантанПродукция Описание Цены Стандарты Статьи Фото МельхиорПродукция Описание Цены Стандарты Статьи Фото Твердые сплавыПродукция Описание Цены Стандарты Статьи Фото Порошки металловПродукция Цены Стандарты Статьи Фото Нержавеющая стальПродукция Описание Цены Стандарты Статьи Фото Жаропрочные сплавыПродукция Описание Цены Стандарты Статьи Фото ФерросплавыПродукция Описание Цены Стандарты Статьи Фото ОловоПродукция Описание Цены Стандарты Статьи Фото
Основные сведенияОлово (Sn, Stannum) - химический элемент с атомным номером 50 в периодической системе. Относится к группе легких металлов; ковкий и пластичный материал. Имеет серебристо-белый цвет с блестящей поверхностью. Плотность составляет 7,31 г/см3, температура плавления tпл. = 231,9 °С, температура кипения tкип. = 2620 °С.Металл может существовать в трех модификациях в зависимости от температуры:
В земной коре содержание Sn по разным данным составляет от 2·10-4 до 8·10-3% по массе. Данный металл занимает 47-е место по распространенности в земной коре. Основным минералом, содержащим олово, является касситерит (оловянный камень), в состав которого входит до 78,8% Sn. Лидерами по запасам рассматриваемого химического элемента являются Китай, Индонезия, Малайзия и Таиланд. История открытияОписываемый металл, издревле известный человечеству. Считается, что его использование началось еще в IV тысячелетии до н.э. Наибольшее распространение в древнем мире пришлось на бронзовый век (приблизительно XXXV-XI вв. до н.э.), так как Sn является одним из основных компонентов оловянистой бронзы. Название “олово” закрепилось за рассматриваемым химическим элементом в IV в. Свойства олова
Физические и механические свойства
Химические свойства
Марки оловаВ промышленных масштабах металл выпускается нескольких марок:
Достоинства / недостатки
Области применения оловаSn имеет несколько основных направлений применения. Благодаря своей нетоксичности и стойкости к коррозии в среде органических солей и кислот данный металл получил распространение в пищевой промышленности. Его наносят в виде покрытий на различные изделия, имеющие контакт с продуктами питания. Оловом также покрывают медные жилы проводов. Оно защищает Cu от негативного воздействия S, содержащейся в резиновой изоляции.В производстве электронных приборов, где очень часто для соединения элементов применяется пайка, олово используется в качестве припоя. Sn является составляющей большого количества сплавов с медью, цинком, медью и цинком, медью и сурьмой. Среди наиболее известных можно выделить баббиты, бронзы. Продукция из оловаСовременная промышленность выпускает разнообразную продукцию из олова. Наиболее распространены чушки, проволока, прутки и аноды.Достаточное широкое применение в промышленности получили оловянные аноды, которые используются при лужении поверхностей различных изделий. Оловянная проволока и прутки часто используются в качестве припоев в электронике при пайке. Оловянные чушки выступают исходным материалом для производства остальных полуфабрикатов, а также используются при выплавке сплавов, содержащих олово. |
www.metotech.ru
характеристика свойств с фото, вред в организме человека и польза
Описание
Олово или Stannum (лат.) представляет собой легкоплавкий, пластичный металл с серебристо-белым цветом (см. фото). Латинское название означает «прочный, стойкий» и изначально так называли сплав со свинцом и серебром. А славянское название, имеющее корни балтийские просто означает цвет металла – белый.
Этот элемент относится к семи древнейшим металлам. Уже 6000 лет назад человечество было с ним знакомо. Наибольшее распространение он получил в составе бронзы и был стратегически важным во времена «бронзового века» около 4000 лет назад. Из этого состава печатались деньги вплоть до 16 века, изготавливалась посуда и ювелирные изделия, применялся как антикоррозионное покрытие. Упоминания о металле были встречены даже на страницах Библии.
В природе встречается в виде минералов. Самые распространенные - касситерит (речное олово) и станин (оловянный колчедан). Из них добывают олово в промышленных целях: электроника, аккумуляторы, обработка стекла (оно становится непроницаемым для лучей рентгеновского аппарата). Также соединения этого элемента используется для изготовления консервных банок, веществ, отгоняющих насекомых.
Есть еще одна замечательная способность у олова – его присутствие в составе материалов музыкального инструмента, которое будет отличать этот инструмент великолепной чистотой звука и мелодичностью.
В составе живых организмов элемент был обнаружен в 1923 году. При исследовании останков древних людей оказалось, что содержание олова в костях в 1000 раз меньше, чем у современного человека. Возможно, это связано с тем, что мы можем поглощать его из воздуха. А развитие промышленности привело к тому, что около четвертой части миллиона тонн оказываются в атмосфере в виде выхлопных газов.
Действие олова
Действие макроэлемента на живой организм сложно назвать токсичным, его часто применяют в пищевой промышленности. Его роль до конца не изучена. Элемент содержится в основном в костях, а также некоторое его количество находится в легких, сердце, почках, кишечнике. А с возрастом может увеличиться содержание в легких, это связано с воздействием окружающей среды.

На сегодняшний день известны такие факты биологического воздействия:
- участие в процессах роста;
- входит в состав фермента желудка – гастрина;
- активно участвует в реакциях окислительно-восстановительного характера;
- за счет концентрации в костных тканях способствует их правильному развитию и развитию опорно-двигательного аппарата.
Может оказывать полезное воздействие на организм лишь будучи в составе жирных кислот. Минеральные соединения могут оказать отравляющее действие.
Относительно недавно оловом пользовались медики для лечения многих заболеваний – эпилепсия, неврозы, гельминтоз, экзема, помутнение роговицы глаза. В основном практиковалось наружное применение хлористого олова. К счастью, сегодня прогресс принес более эффективные и менее токсичные препараты без содержания металла.
Олово – достаточно неактивный в химическом отношении элемент, поэтому с этой точки зрения особой пользы и вреда он не принесет. Единственное замеченное взаимодействие – с медью и цинком. Они взаимно нейтрализуют действие друг друга.
Суточная норма
Суточная норма макроэлемента находится в пределах от 2 до 10 мг в зависимости от возраста и пола. Хотя за день в наш организм поступает около 50 мг только с едой (а токсичной считают дозировку в 20 мг), отравления не произойдет. Все объясняется тем, что наш желудочно-кишечный тракт способен усвоить лишь 3-5% от всего поступающего количества. Весь остальной металл просто выводится естественным путем с мочой.
Недостаток олова в организме человека
 Недостаток макроэлемента в организме происходит при хроническом поступлении менее 1 мг в сутки. Такой процесс может сопровождаться ухудшением слуха, потерей веса из-за утраты аппетита, замедлением роста, дисбалансом минерального состава, выпадением волос (частичная или полная патология).
Недостаток макроэлемента в организме происходит при хроническом поступлении менее 1 мг в сутки. Такой процесс может сопровождаться ухудшением слуха, потерей веса из-за утраты аппетита, замедлением роста, дисбалансом минерального состава, выпадением волос (частичная или полная патология).
Такие процессы довольно редки, т.к. обычно достаточно поступления макроэлемента с продуктами питания и чаще всего вызываются проблемами с пищеварением и сложностями с усвоением.
Вред избыточного приема олова
Переизбыток макроэлемента, в основном, рискуют получить сотрудники предприятий, на которых используются соли олова: производство пластмасс, пестицидов, линолеума и др. За счет регулярного поглощения паров и пыли развиваются заболевания легких. Также в группе риска находятся люди, проживающие в опасной близости от автострад (в переделах полукилометра) – они получают высокую дозу из выхлопных газов. Олово в больших количествах подавляют содержание магния, который способен защитить клетки от новообразований.
Есть еще один источник высоких доз элемента – консервные банки. При длительном хранении они начинают разрушаться, особенно если содержимое богато нитратами. Поэтому открыв такую банку, рекомендуется сразу переложить продукты в стекло. Хранить в открытом виде консервы категорически запрещается.
Организмы пожилых людей и детей не могут быстро выводить олово из организма, поэтому он начинает накапливаться. Достаточно совсем мизерной дозы, чтобы вызвать отравление.
Существует интересная теория из истории о падении Римской империи. Олово попадало в вино, обильно поглощаемое древними римлянами, из посуды и вызывало сбои в состоянии здоровья. Только в седьмом веке медики смогли определить причину заболевания, но было уже поздно – империя пала.
Содержание элемента в организме человека можно определить, проведя химический анализ мочи или волос.
Осложнения, которые возникают вследствие избытка олова, довольно неприятны. Опасной считается доза в 2 грамма макроэлемента, но она не является летальной (такая норма еще не определена). Она может вызывать анемию, заболевания печени, дыхательных путей, расстройства нервной системы. Может развиться такое заболевание, как станноз – тяжелый кашель, сопровождающийся отделением мокрот и задышкой.
Но это еще не все – основных симптомов отравления достаточно много:
 металлический привкус в ротовой полости;
металлический привкус в ротовой полости;- головокружения и мигрени;
- воспаления и язвенные образования на кожных покровах;
- проблемы со зрением;
- увеличение печени в размерах;
- боли в желудке, колики;
- рвота, диарея, потеря аппетита и, как следствие, снижение веса;
- ускорение белкового обмена в крови;
- возбужденность и агрессивное поведение, особенно у детей;
- кожа приобретает бледно-серый оттенок, десна становятся синего цвета;
- понижение уровня цинка и меди в крови.
В случае поступления олова в больших дозах в течение длительного времени есть риск возникновения структурных изменений в хромосомах, что может привести к серьезным последствиям на генетическом уровне.
При воздействии на центральную нервную систему этот макроэлемент способен вызывать депрессивные состояния. А дети могут отличаться агрессивностью, отсутствием заинтересованности в учебе, играх, чтению.
Лечение обычно назначается по симптомам – диеты, гепатопротекторы (защита печени), препараты, содержащие медь и цинк. При критических отравлениях вводят медикаменты, способные связывать и выводить токсины – хелатирующие вещества.
В каких продуктах питания содержится?
 Продукты, содержащие олово, можно найти как животного происхождения, так и растительного. Основная масса поступает с мясом свиньи, говядиной, птицей, молоком и его производными. Также некоторое количество элемента могут дать горох, семена подсолнуха, картофель, свекла. Другие овощи содержат совсем малые дозы олова.
Продукты, содержащие олово, можно найти как животного происхождения, так и растительного. Основная масса поступает с мясом свиньи, говядиной, птицей, молоком и его производными. Также некоторое количество элемента могут дать горох, семена подсолнуха, картофель, свекла. Другие овощи содержат совсем малые дозы олова.
Кроме этого мы ежедневно получаем макроэлемент из воды и воздуха. И не забывайте о том, что частое употребление консервов тоже может снабдить организм избыточным количесвтом олова.
Некоторые растения способны поглощать большое количество элемента из окружающей среды. Поэтому стоит аккуратно относиться к продуктам, выращенным возле автострад и промышленных зон.
Показания к назначению
 Показания к назначению макроэлемента, в основном, применяются гомеопатами. Они лечат оловом такие заболевания, как:
Показания к назначению макроэлемента, в основном, применяются гомеопатами. Они лечат оловом такие заболевания, как:
- бронхит, болезни легких;
- мигрени;
- панкреатит;
- малый рост и вес;
- а также применяют в качестве глистогонного препарата.
Замечено, что при приеме малых доз медикаментов, содержащих олово, часто изменяется психическое состояние пациента – хорошее настроение сменяется раздражительностью, меланхоличностью, слезивостью. Поэтому такие назначение применяются в крайне редких случаях.
xcook.info
Физические свойства олова | Мир сварки
Физические свойства олова
Олово – химический элемент подгруппы германия IV группы 5 периода периодической системы элементов Д. И. Менделеева. Природное олово состоит из десяти изотопов с массовыми числами: 112 (0,95 %), 114 (0,65 %), 115 (0,34 %), 116 (14,24 %), 117 (7,57 %), 118 (24,01 %), 119 (8,58 %), 120 (32,97 %), 122 (4,71 %), 124 (5,98 %). Последний изотоп слаборадиоактивен (период полураспада 1,5·1017 лет).
Олово – мягкий металл, обладает высокой пластичностью, ковкостью и легкоплавкостью. Оно может быть прокатано до толщины слоя 0,005 мм.
Известны две аллотропные формы олова: β-обычное белое олово, устойчивое выше 13,2 °С, и α-серое олово, устойчивое ниже 13,2 °С. Выше 161 °С олово становится хрупким и может быть легко измельчено в порошок (лучше всего при температуре ∼200 °С).
Некоторые основные физические и механические свойства олова приведены в таблице 1.
| Атомная масса | 118,69 |
| Кристаллическая структура | α (кубическая) и β (тетрагональная) |
| Плотность, кг/м3 | 7300 |
| Температура плавления, °С | 231,9 |
| Температура кипения, °С | 2270 |
| Температура превращения белого олова в серое, °С | 13,2 |
| Скрытая теплота плавления, кал/г | 14,4 |
| Скрытая теплота превращения, кал/г | 4,46 |
| Объемные изменения при переходе серого олова в белое, % | 27 |
| Удельная теплоемкость при 0-100 °С, кал/(г·°С) | 0,054 |
| Теплопроводность, кал/(см·с·°С) | 0,157 |
| Температурный коэффициент теплопроводности при 20-100 °С·103 | -0,7 |
| Коэффициент линейного расширения | 22,4·10-6 (твердое) |
| Термическое расширение в жидком состоянии | 100·10-6 |
| Удельная электропроводность, м/Oм·мм2 | 8,95 |
| Удельное электросопротивление, Oм·мм2/м | 0,124 |
| Температурный коэффициент электросопротивления | 0,0044 |
| Электросопротивление в жидком состоянии (300 °С), Ом/см3 | 49·10-3 |
| Поверхностное натяжение при 300 °С, дин/см | 526 |
| Поверхностное натяжение при 500 °С, дин/см | 510 |
| Стандартный электродный потенциал, В | -0,136 |
| Электрохимический эквивалент (двухвалентный), г/А·ч | 2,21 |
| Модуль упругости (при -180 °С), кгс/мм2 | 6500 |
| Модуль упругости (при 0 °С), кгс/мм2 | 5500 |
| Модуль упругости (при 100 °С), кгс/мм2 | 4800 |
| Модуль упругости (при 200 °С), кгс/мм2 | 3600 |
| Модуль сдвига, кгс/мм2 | 1680-1810 |
| Предел упругости, кгс/мм2 | 0,15 |
| Предел текучести (литого), кгс/мм2 | 1,2 |
| Предел прочности при растяжении (литого), кгс/мм2 | 1,9-2,1 |
| Предел прочности при растяжении (отоженного), кгс/мм2 | 1,7 |
| Предел прочности при растяжении (тянутого), кгс/мм2 | 2,5 |
| Сопротивление срезу (литого), кгс/мм2 | 2,0 |
| Относительное удлинение (литого), % | 45-60 |
| Относительное удлинение (отоженного), % | 80-90 |
| Относительное сужение, % | 75 |
| Линейная усадка, % | 2,7 |
| Твердость HB (литого), кгс/мм2 | 4,9-5,2 |
| Твердость HB (нагартованного), кгс/мм2 | 40 |
| Вязкость пуаз (при 301 °С) | 0,0168 |
| Вязкость пуаз (при 750 °С) | 0,0095 |
| Удельная магнитная восприимчивость | +0,025·10-6 |
| Температура, °С | 1492 | 1703 | 1968 | 2169 |
| Давление паров, мм рт. ст. | 1 | 10 | 100 | 400 |
| Температура, °С | 300 | 350 | 400 | 500 |
| Поверхностное натяжение, дин/см | 526 | 522 | 518 | 510 |
| Температура, °С | 235 | 250 | 280 | 330 |
| Вязкость η × 100, П | 1,95 | 1,86 | 1,73 | 1,60 |
| Температура, °С | 250 | 1100 | — | — |
| Теплоемкость, кал/(г·°С) | 0,058 | 0,0758 | — | — |
| Температура, °С | 231,9 | 400 | 600 | 1000 |
| Электросопротивление, мкОм·см | 47,6 | 51,4 | 56,8 | 63,6 |
| Температура, °С | 240 | 292 | 417 | 498 |
| Теплопроводность, (см·с·°С) | 0,08 | 0,081 | 0,079 | 0,078 |
| Температура, °С | 409 | 523 | 574 | 704 |
| Плотность, кг/м3 | 6834 | 6761 | 6729 | 6640 |
Зависимость олова от степени деформации и температуры отжига показана на рис. 1-4.
Рис.1 Диаграмма рекристаллизации олова
Рис.2 Механические свойства чистого олова при пониженных температурах
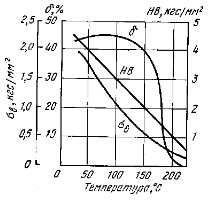 Рис.3 Изменение механических свойств олова при высоких температурах. Исходный материал – полосы деформированные и отожженные при 50 °С
Рис.3 Изменение механических свойств олова при высоких температурах. Исходный материал – полосы деформированные и отожженные при 50 °С
Рис.4 Ползучесть монокристалла чистого олова (начальный период) при температуре 20 °С и различных нагрузках P (гс/мм2)
Литература
- Аналитическая химия олова / В.Б. Спиваковский. М.: Наука. 1975. – 250 с.
- Справочник металлурга по цветным металлам. Т.1 / Под ред. Н.Н. Мурача. М.: Металлургиздат. 1953. – 1154 с.
- Промышленные цветные металлы и сплавы / А.П. Смирягин, Н.А. Смирягина, А.В. Белова, М., Металлургия, 1974, 488 с.
- ГОСТ 860-75 Олово. Технические условия
weldworld.ru
Олово и его свойства, оловянная руда
Олово - это вещество, обозначаемое символом Sn и относящееся к группе легких металлов. При нормальной (комнатной) температуре не вступает в реакцию ни с кислородом, ни с водой. Со временем способно покрываться специальной пленкой, предохраняющей металл от коррозии.
Плотность олова равна при температуре окружающей среды 20°С 7,3 грамма на сантиметр кубический, при температуре плавления (231,9°С) - 6,98 грамм на сантиметр кубический.
Олово проявляет следующие степени окисления: +2, +4. Наиболее распространена степень +4, а вот олово со степенью +2 является сильным восстановителем.
Как уже было сказано выше, олово устойчиво к воздействию кислорода и воды при комнатной температуре, но окисляться все-таки может - при температуре выше 150°С.
Нагретое олово вступает в химическую реакцию с большинством неметаллов, может вступить в реакцию с серной кислотой, но только если она концентрированная.
При проведении реакции между оловом и концентрированной азотной кислотой проявляет поведение, свойственное неметаллам, в результате реакции образуется оловянная кислота.
Может вступать в реакции с разведенными в воде щелочами, при нагреве гидроксид олова распадается на оксид и воду.
В отличие от некоторых других химических элементов, олово получают не в результате реакций, а в результате плавления и очистки оловянной руды.
Оловянная руда является очень важным для человека, хотя и относительно редким ископаемым. В России основное месторождение данной руды расположено в Восточной Сибири, также можно найти олово в Якутии.
Наиболее распространена оловянная руда в форме оловянного камня, также называемого касситеритом. Предположительно, первые касситериты были найдены еще во времена Гомера, и найдены они были в Греции - ведь само слово касситерит имеет греческое происхождение.
Скорее всего, оловянный камень был восстановлен до олова совершенно случайно, и красивый металл очень приглянулся людям. Но совершенно очевидно, что он был очень редкий и дорогой - среди сохранившихся древностей Греции и Рима предметы из олова встречаются, но крайне редко.
В настоящее время олово не стоит больших денег, но и сейчас изделия из него достаточно редки.
Месторождения оловянного камня встречаются двух видов: первичные и вторичные. В первых оловянная руда включена в гранит и другие горные породы, а во вторых представляет собой мелкие зернышки, перемешанные с глиной.
Для получения чистого металла оловянная руда плавится в специальной печи в течение трех суток, после чего осуществляется слив металла. Что интересно, если сначала в отверстие слива попадают шлаки, то олова будет мало, а если олово течет сразу, оставляя шлаки позади, то его количество будет достаточно велико.
Чистое олово - красивый, серебристо-белый, мягкий металл - используется во многих отраслях промышленности. Из него изготавливается посуда, пищевая жесть, тары для напитков. Также этот металл входит в состав припоев и присадок, его используют для покрытия многих изделий из металлов. Оловянное покрытие делается с целью защиты изделия от коррозии и улучшения его внешнего вида.
Кроме того, олово легко образует различные сплавы с другими металлами, в число которых входит и столь известная всем бронза. Более того, олово, химические свойства которого, без сомнения, удивительны, способно образовывать сплав с углеродом, иными словами - металлоорганическое соединение.
Роль металлоорганических (иначе - оловоорганических) соединений очень велика: их используют при изготовлении стабилизаторов для поливинилхлорида, сельскохозяйственных химикатов, красок для древесины.
К тому же, некоторые сплавы олова используются для уменьшения возгораемости и токсичности образующегося при горении дыма многих изделий из пластика и синтетики.
fb.ru