Медь и её природные соединения, синтез малахита (стр. 1 из 5). Медь и
Медь и ее сплавы - история материала, его свойства и применение + Видео
Медь и ее сплавы - прекрасные материалы, которые используются практически во всех сферах промышленного производства. Будет достаточно трудно представить без нее современный мир. Это неудивительно, ведь любой доклад подтверждает ее исключительные характеристики.
1 Исторический ракурс
Медь имеет большое значение для человека. Медными были первые орудия труда, выполненные из металла. Обрабатывали металл холодным способом, о чем свидетельствуют раскопки на побережье реки Гудзон в Северной Америке. Эту традицию индейцы сохранили до прибытия на континент Христофора Колумба.
Доподлинно известно, что наши предки начали добычу металла из медной руды около 7 тысяч лет тому назад.
Этот податливый материал во многом определил последующие тенденции в развитии человеческой культуры и истории.
Царствование меди в мире металлов продолжалось всего тысячу лет, ровно до той поры, пока не был открыт первый медный сплав, названный бронзой (в честь маленького купеческого городка). Древние люди быстро перешли на изготовление изделий из нового сплава, поскольку он обладал лучшими характеристиками: бронза тверже и плотнее меди, к тому же температура плавления у нее ниже. Египтяне, ассирийцы и индусы активно использовали бронзовые изделия, но отливать массивные сооружения научились только к V веку до нашей эры, о чем свидетельствуют найденные археологами древнегреческие статуи. Известное чудо древности - Колосс Родосский - был отлит из бронзы и установлен над входом в гавань порта Родос в III веке до нашей эры.

Древнегреческие статуи из бронзы
Рекомендуем ознакомиться
Медные листы использовали на Руси для кровли храмов. Специальные медные сплавы применялись для отливки пушечных орудий и церковных колоколов.
Медь обнаружена в составе почти 200 минералов, но стратегически важными оказались всего 17 из них, например, такие как медный колчедан (CuFeS2), халькозин (Сu2S), бронзит (Cu5FeS4) и ковеллин (CuS).
Формирование залежей медной руды в земной коре происходило неравномерно. Самые большие месторождения меди сегодня расположены в районе Конго. На территории России первые выработки меди производились в Закавказье и Сибири. Из летописей известно, что первые медные заводы в России появились в XVII веке.
Обнаружены значительные залежи руды на океаническом дне.
2 Физико-химические свойства меди
Незначительная примесь кислорода обеспечила меди красноватый оттенок. Если воздействие кислорода исключить полностью, цвет металла изменится на желтый.
Начищенная медь обладает ярко выраженным блеском. Чем выше валентность, тем слабее окрас. Так, оксид CuCl имеет белый цвет, Cu2O - красный, CuO - черный. Карбонаты меди, как правило, синего или зеленого цвета.

Начищенная медь с ярко выраженным блеском
Медь - второй металл после серебра, обладающий высокой электропроводностью, благодаря чему он широко используется в электронике.
Медь слабо вступает в реакцию с кислородом, имеет свойство окисляться на воздухе и покрываться пленкой. В сухом воздухе окисление происходит очень медленно: 4Cu+O2=2Cu2O. Металлы этой группы не способны вытеснить водород из воды и кислот.
3 Особенности оксида меди
Этот оксид можно получить, прокаливая медь, нитрат или гидрокарбонат на воздухе. Оксид меди способен окислять органические соединения, что позволяет проводить анализ соединений на предмет наличия в них водорода или углерода.

Оксид меди
Купроксные выпрямители электрического тока имеют в своей основе закись меди.
Растворением меди в концентрате серной кислоты получают медный купорос. Он необходим в химической промышленности и до сих пор применяется для защиты урожая.
4 Широко применяемые сплавы меди
Легирующий компонент практически во всех ныне используемых в производстве сплавах меди составляет менее 10%, исключением из этого правила является латунь. В качестве легирующего компонента могут использоваться такие элементы, как золото, фосфор, марганец, цинк.
Все зависит от того, какие свойства сплава необходимы. Среди интересующих характеристик особенно выделяют прочность, износоустойчивость и термостойкость. Олово, алюминий и кремний улучшают пластичность, большое количество легирующего компонента, напротив, увеличивает хрупкость. Так, например, медно-никелевый сплав (его маркировка - МНЖ5-1) хорошо обрабатывается давлением как в горячем, так и в холодном состоянии. Именно поэтому его используют при чеканке монет, а сплав серебра и меди - в ювелирном деле.

Медно-никелевый сплав
Основные виды сплавов меди и их классификация:
- Сплав меди с оловом - один из первых сплавов. Великолепные статуи Греции, произведения, имеющие и сегодня непревзойденную художественную ценность, отливались именно из оловянистых бронз. Сегодня процесс производства сплава с оловом усовершенствован. В технологическом процессе задействованы электрические дуговые печи, а защита сплава от окисления производится в вакууме. Для увеличения прочности и пластичности бронзы в технологический процесс производства включают такие этапы, как закаливание и старение сплава с оловом.
- Алюминиевая бронза - это сплав алюминия с медью, он хорошо деформируется и слабо поддается коррозии. Его применяют для изготовления конструкционных элементов и деталей, подвергающихся воздействию высоких температур.
- Сплавы меди и свинца являются непревзойденными материалами с антифрикционными свойствами. Добавление свинца значительно повышает прочность.
- Латунь. Двухкомпонентный или многокомпонентный сплав, в основе которого имеется медь, такой как томпак или полутомпак, называется латунью.
- Нейзильбер - это медно-никелевый сплав с никелем от 5 до 35% и цинком. Его стоимость дешевле мельхиора, но полностью аналогичен ему по внешнему виду и свойствам.
- Сплав меди с железом возможен благодаря близким физико-химическим параметрам металлов, однако разница в температурах плавления придает такому сплаву высокую пористость.
Латуни славятся высокой прочностью благодаря содержанию в них цинка (40-45%). Легкость в обработке делает латунь предпочтительней чистой меди. Этот сплав на основе меди используется преимущественно в приборостроении. Прочность латуни, которая содержит небольшой процент алюминия, марганца и других металлов, достигает 90 кг/мм². Она применяется при изготовлении запорной арматуры, подшипниковых вкладышей.
5 Применение сплавов
Пожалуй, трудно отыскать производственную отрасль, которая бы не использовала изделия из меди или ее сплавов. В чистом виде такой металл, как медь, задействован в электротехнических коммуникациях. Электрическая проводка, электродвигатели и кабельные изделия невозможно представить без участия меди.

Медное кабельное изделие
Трубопроводы, вакуумные машины, теплообменные камеры на 1/3 состоят из меди.
Сплавы благодаря их выверенным свойствам применяют в автомобильной промышленности и сельскохозяйственном машиностроении. Высокая устойчивость к коррозии позволяет медным сплавам участвовать в изготовлении химической аппаратуры, а сплав меди со свинцом используется в производстве сверхпроводниковой техники.
Изделия со сложным узором требуют вязких и пластичных сплавов, например, сплав серебра. Этим запросам отвечает мягкая медь, из которой можно формировать любые шнуры и элементы. Проволоку легко гнуть и паять вместе с такими элементами, как золото и серебро.
Медные сплавы хорошо взаимодействуют с эмалями. Эмалированная поверхность может сохраняться длительное время, не отслаиваясь и не растрескиваясь, на поверхности меди. Таково применение сплавов.
tutmet.ru
электропроводность, свойства, особенности и применение
Во многих отраслях современной промышленности очень широко используется такой материал, как медь. Электропроводность у этого металла очень высокая. Этим и объясняется целесообразность его применения прежде всего в электротехнике. Из меди получаются проводники с отличными эксплуатационными характеристиками. Конечно же, используется этот металл не только в электротехнике, но и в других отраслях промышленности. Объясняется его востребованность в том числе и такими его качествами, как стойкость к коррозионным разрушениям в ряде агрессивных сред, тугоплавкость, пластичность и т.д.
Историческая справка
Медь является металлом, известным человеку с глубокой древности. Объясняется раннее знакомство людей с эти материалом прежде всего его широкой распространенностью в природе в виде самородков. Многие ученые считают, что именно медь была первым металлом, восстановленным человеком из кислородных соединений. Когда-то горные породы просто нагревали на костре и резко остужали, в результате чего они растрескивались. Позднее восстановление меди начали производить на кострах с добавлением угля и поддувом мехами. Совершенствование этого способа в конечном итоге привело к созданию шахтной печи. Еще позже этот металл начали получать методом окислительной плавки руд.

Медь: электропроводность материала
В спокойном состоянии все свободные электроны любого металла вращаются вокруг ядра. При подключении внешнего источника воздействия они выстраиваются в определенной последовательности и становятся носителями тока. Степень способности металла пропускать сквозь себя последний и называется электропроводностью. Единицей ее измерения в Международной СИ является сименс, определяемый как 1 См = 1 Ом-1.
Электропроводность меди очень высока. По этому показателю она превосходит все известные на сегодня неблагородные металлы. Лучше нее ток пропускает только серебро. Показатель электропроводности меди составляет 57х104 см-1 при температуре в +20 °С. Благодаря такому своему свойству этот металл на данный момент является самым распространенным проводником из всех используемых в производственных и бытовых целях.
Медь отлично выдерживает постоянные электрические нагрузки и к тому же отличается надежностью и долговечностью. Помимо всего прочего, этот металл характеризуется и высокой температурой плавления (1083,4 °С). А это, в свою очередь, позволяет меди долгое время работать в нагретом состоянии. По распространенности в качестве проводника тока конкурировать с этим металлом может только алюминий.

Влияние примесей на электропроводность меди
Конечно же, в наше время для выплавки этого красного металла используются гораздо более совершенные методики, чем в древности. Однако и сегодня получить совершенно чистый Cu практически невозможно. В меди всегда присутствуют разного рода примеси. Это могут быть, к примеру, кремний, железо или бериллий. Между тем, чем больше примесей в меди, тем меньше показатель ее электропроводности. Для изготовления проводов, к примеру, подходит только достаточно чистый металл. Согласно нормативам, для этой цели можно использовать медь с количеством примесей, не превышающем 0.1 %.
Очень часто в этом металле содержится определенный процент серы, мышьяка и сурьмы. Первое вещество значительно снижает пластичность материала. Электропроводность меди и серы сильно различается. Ток эта примесь совершенно не проводит. То есть является хорошим изолятором. Однако на электропроводность меди сера не влияет практически никак. То же самое касается и теплопроводности. С сурьмой и мышьяком наблюдается обратная картина. Эти элементы электропроводность меди способны снижать значительно.
Сплавы
Разного рода добавки могут использоваться и специально для повышения прочности такого пластичного материала, как медь. Электропроводность ее они также снижают. Но зато их применение позволяет значительно продлить срок службы разного рода изделий.

Чаще всего в качестве повышающей прочность меди добавки используется Cd (0.9 %). В результате получается кадмиевая бронза. Ее проводимость составляет 90 % от проводимости меди. Иногда вместо кадмия в качестве добавки используют также алюминий. Проводимость этого металла составляет 65 % от этого же показателя меди. Для повышения прочности проводов в виде добавки могут применяться и другие материалы и вещества — олово, фосфор, хром, бериллий. В результате получается бронза определенной марки. Соединение меди с цинком называется латунью.
Характеристики сплавов
Зависеть электропроводность металлов может не только от количества имеющихся в них примесей, но и от других показателей. К примеру с повышением температуры нагрева способность меди пропускать сквозь себя ток снижается. Оказывает влияние на электропроводность такой проволоки даже способ ее изготовления. В быту и на производстве могут использоваться как мягкие отожженные медные проводники, так и твердотянутые. У первой разновидности способность пропускать сквозь себя ток выше.
Однако больше всего влияют, конечно же, используемые добавки и их количество на электропроводность меди. Таблица ниже представляет читателю исчерпывающую информацию относительно способности пропускать ток наиболее распространенных сплавов этого металла.
Сплав | Состояние (О — отожженная, Т-твердотянутая) | Электропроводность (%) |
Чистая медь | О | 101 |
Т | 98 | |
Оловянная бронза (0.75 %) | О | 55-60 |
Т | 50-55 | |
Кадмиевая бронза (0.9 %) | О | 95 |
Т | 83-90 | |
Алюминиевая бронза (2,5 % А1, 2 % Sn) | О | 15-18 |
Т | 15-18 | |
Фосфористая бронза (7 % Sn, 0,1 % Ρ) | О | 10-15 |
Т | 10-15 |
Электропроводность латуни и меди сравнима. Однако у первого металла этот показатель, конечно же, немного ниже. Но при этом он и выше, чем у бронз. В качестве проводника латунь используется довольно-таки широко. Ток она пропускает хуже меди, но при этом и стоит дешевле. Чаще всего из латуни делают контакты, зажимы и различные детали для радиоаппаратуры.
Медные сплавы высокого сопротивления
Такие проводниковые материалы применяют в основном при изготовлении резисторов, реостатов, измерительных приборов и электронагревательных устройств. Чаще всего для этой цели используются медные сплавы константан и манганин. Удельное сопротивление первого (86 % Cu, 12 % Mn, 2 % Ni) составляет 0.42-0.48 мкОм/м, а второго (60 % Cu, 40 % Ni) — 0.48-0.52 мкОм/м.
Связь с коэффициентом теплопроводности
Удельная электропроводность меди - 59 500 000 См/м. Этот показатель, как уже упоминалось, верен, однако только при температуре +20 оС. Между коэффициентом теплопроводности любого металла и удельной проводимостью существует определенная связь. Устанавливает его закон Видемана — Франца. Выполняется он для металлов при высоких температурах и выражается в такой формуле: K/γ = π2 / 3 (k/e)2T, где y — удельная проводимость, k — постоянная Больцмана, e — элементарный заряд.

Разумеется, существует подобная связь и у такого металла, как медь. Теплопроводность и электропроводность у нее очень высокие. На втором месте после серебра она находится по обоим этим показателям.
Соединение медных и алюминиевых проводов
В последнее время в быту и промышленности начало использоваться электрооборудование все более высокой мощности. Во времена СССР проводка изготавливалась в основном из дешевого алюминия. Новым требованиям ее эксплуатационные характеристики, к сожалению, уже не соответствуют. Поэтому сегодня в быту и в промышленности очень часто алюминиевые провода меняются на медные. Основным преимуществом последних, помимо тугоплавкости, является то, что при окислительном процессе их токопроводящие свойства не уменьшаются.
Часто при модернизации электросетей алюминиевые и медные провода приходится соединять. Делать это напрямую нельзя. Собственно, электропроводность алюминия и меди различается не слишком сильно. Но только у самих этих металлов. Окислительные же пленки у алюминия и меди свойства имеют неодинаковые. Из-за этого значительно снижается проводимость в месте соединения. Окислительная пленка у алюминия отличается гораздо большим сопротивлением, чем у меди. Поэтому соединение этих двух разновидностей проводников должно производиться исключительно через специальные переходники. Это могут быть, к примеру, зажимы, содержащие пасту, защищающую металлы от появления окиси. Данный вариант переходников обычно используется при соединении проводов на улице. В помещениях чаще применяются ответвительные сжимы. В их конструкцию входит специальная пластина, исключающая прямой контакт между алюминием и медью. При отсутствии таких проводников в бытовых условиях вместо скручивания проводов напрямую рекомендуется использовать шайбу и гайку в качестве промежуточного «мостика».

Физические свойства
Таким образом, мы выяснили, какая электропроводность у меди. Показатель этот может меняться в зависимости от входящих в состав этого металла примесей. Однако востребованность меди в промышленности определяется и другими ее полезными физическими свойствами, получить информацию о которых можно из представленной ниже таблицы.
Параметр | Значение |
Решетка | Гранецентрированная кубическая, а=3.6074 Å |
Атомный радиус | 1,28 Å |
Удельная теплоемкость | 385,48 дж/(кг·К) при +20 оС |
Теплопроводность | 394,279 вт/(м·К) при +20 оС |
Электрическое сопротивление | 1,68·10-8 Ом·м |
Коэффициент линейного расширения | 17,0·10-6 |
Твердость | 350 Мн/м2 |
Предел прочности при растяжении | 220 Мн/м2 |
Химические свойства
По таким характеристикам медь, электропроводность и теплопроводность которой очень высокие, занимает промежуточное положение между элементами первой триады восьмой группы и щелочными первой группы таблицы Менделеева. К основным ее химическим свойствам относят:
склонность к комплексообразованию;
способность давать окрашенные соединения и нерастворимые сульфиды.
Наиболее характерным для меди является двухвалентное состояние. Сходства с щелочными металлами она не имеет практически никакого. Химическая активность ее также невелика. В присутствии СО2 или же влаги на поверхности меди образуется зеленая карбонатная пленка. Все соли меди являются ядовитыми веществами. В одно- и двухвалентном состоянии этот металл образует очень устойчивые комплексные соединения. Наибольшее значение для промышленности имеют аммиачные.

Сфера использования
Высокая тепло- и электропроводность меди определяет ее широкое применение в самых разных отраслях промышленности. Конечно же, чаще всего этот металл используется в электротехнике. Однако это далеко не единственная сфера его применения. Помимо всего прочего, медь может использоваться:
в ювелирном деле;
в архитектуре;
при сборке водопроводных и отопительных систем;
в газопроводах.
Для изготовления разного рода ювелирных изделий используется в основном сплав меди с золотом. Это позволяет увеличить стойкость украшений к деформациям и истиранию. В архитектуре медь может использоваться при облицовке кровель и фасадов. Основным преимуществом такой отделки является долговечность. К примеру, листами именно этого металла обшита крыша широко известной архитектурной достопримечательности — католического собора в немецком городе Хильдесхайме. Медная кровля этого здания надежно защищает его внутреннее пространство вот уже почти 700 лет.

Инженерные коммуникации
Основными преимуществами медных водопроводов также являются долговечность и надежность. Кроме того, этот металл способен придавать воде особые уникальные свойства, делая ее полезной для организма. Для сборки газопроводов и систем отопления медные трубы также подходят идеально - в основном благодаря своей коррозийной стойкости и пластичности. При аварийном повышении давления такие магистрали способны выдерживать гораздо большую нагрузку, чем стальные. Единственным недостатком медных трубопроводов является их дороговизна.
fb.ru
Медь — Мегаэнциклопедия Кирилла и Мефодия — статья
Природная медь состоит из двух стабильных нуклидов63Cu (69, 09% по массе) и 65Cu (30, 91%). Конфигурация двух внешних электронных слоев нейтрального атома меди 3s2p6d104s1. Образует соединения в степенях окисления +2 (валентность II) и +1 (валентность I), очень редко проявляет степени окисления +3 и +4.В периодической системе Менделеева медь расположена в четвертом периоде и входит в группу IВ, к которой относятся такие благородные металлы, как серебро и золото.Радиус нейтрального атома меди 0, 128 нм, радиус иона Cu+ от 0, 060 нм (координационное число 2) до 0, 091 нм (координационное число 6), иона Cu2+ — от 0, 071 нм (координационное число 2) до 0, 087 нм (координационное число 6). Энергии последовательной ионизации атома меди 7, 726, 20, 291, 36, 8, 58, 9 и 82, 7 эВ. Сродство к электрону 1, 8 эВ. Работа выхода электрона 4, 36 эВ. По шкале Полинга электроотрицательность меди 1, 9; медь принадлежит к числу переходных металлов. Стандартный электродный потенциал Cu/Cu2+ 0, 339 В. В ряду стандартных потенциалов медь расположена правее водорода и ни из воды, ни из кислот водорода не вытесняет.
Простое вещество медь — красивый розовато-красный пластичный металл.
В земной коре содержание меди составляет около 5·10-3 % по массе. Очень редко медь встречается в самородном виде (самый крупный самородок в 420 тонн найден в Северной Америке). Из руд наиболее широко распространены сульфидные руды: халькопирит, или медный колчедан, CuFeS2 (30% меди), ковеллин CuS (64, 4% меди), халькозин, или медный блеск, Cu2S (79, 8% меди), борнит Cu5FeS4.(52-65% меди). Существует также много и оксидных руд меди, например: куприт Cu2O, (81, 8% меди), малахит CuCO3·Cu(OH)2 (57, 4% меди) и другие. Известно 170 медьсодержащих минералов, из которых 17 используются в промышленных масштабах.Различных руд меди много, а вот богатых месторождений на земном шаре мало, к тому же медные руды добывают уже многие сотни лет, так что некоторые месторождения полностью исчерпаны. Часто источником меди служат полиметаллические руды, в которых, кроме меди, присутствуют железо, цинк, свинец, и другие металлы. Как примеси медные руды обычно содержат рассеянные элементы (кадмий, селен, теллур, галий, германий и другие), а также серебро, а иногда и золото. Для промышленных разработок используют руды, в которых содержание меди составляет немногим более 1% по массе, а то и менее.В морской воде содержится примерно 1·10-8 % меди.
Промышленное получение меди — сложный многоступенчатый процесс. Добытую руду дробят, а для отделения пустой породы используют, как правило, флотационный метод обогащения. Полученный концентрат (содержит 18-45% меди по массе) подвергают обжигу в печи с воздушным дутьем. В результате обжига образуется огарок — твердое вещество, содержащее, кроме меди, также и примеси других металлов. Огарок плавят в отражательных печах или электропечах. После этой плавки, кроме шлака, образуется так называемый штейн, в котором содержание меди составляет до 40-50%.Далее штейн подвергают конвертированию — через расплавленный штейн продувают сжатый воздух, обогащенный кислородом. В штейн добавляют кварцевый флюс (песок SiO2). В процессе конвертирования содержащийся в штейне как нежелательная примесь сульфид железа FeS переходит в шлак и выделяется в виде сернистого газа SO2:
2FeS + 3O2 + 2SiO2 = 2FeSiO3 + 2SO2
Одновременно сульфид меди(I) Cu2S окисляется:
2Cu2S + 3О2 = 2Cu2О + 2SO2
Образовавшийся на этой стадии Cu2О далее реагирует с Cu2S:
2Cu2О + Cu2S = 6Cu + SО2
В результате возникает так называемая черновая медь, в которой содержание самой меди составляет уже 98, 5-99, 3% по массе. Далее черновую медь подвергают рафинированию. Рафинирование на первой стадии — огневое, оно заключается в том, что черновую медь расплавляют и через расплав пропускают кислород. Примеси более активных металлов, содержащихся в черновой меди, активно реагируют с кислородом и переходят в оксидные шлаки.
На заключительной стадии медь подвергают электрохимическому рафинированию в сернокислом растворе, при этом черновая медь служит анодом, а очищенная медь выделяется на катоде. При такой очистке примеси менее активных металлов, присутствовавшие в черновой меди, выпадают в осадок в виде шлама, а примеси более активных металлов остаются в электролите. Чистота рафинированной (катодной) меди достигает 99, 9% и более.Кристаллическая решетка металлической меди кубическая гранецентрированная, параметр решетки а = 0, 36150 нм. Плотность 8, 92 г/см3, температура плавления 1083, 4 °C, температура кипения 2567 °C. Медь среди всех других металлов обладает одной из самых высоких теплопроводностей и одним из самых низких электрических сопротивлений (при 20 °C удельное сопротивление 1, 68·10-3 Ом·м).
В сухой атмосфере медь практически не изменяется. Во влажном воздухе на поверхности меди в присутствии углекислого газа образуется зеленоватая пленка состава Cu(OH)2·CuCO3. Так как в воздухе всегда имеются следы сернистого газа и сероводорода, то в составе поверхностной пленки на металлической меди обычно имеются и сернистые соединения меди. Такая пленка, возникающая с течением времени на изделиях из меди и ее сплавов, называется патиной. Патина предохраняет металл от дальнейшего разрушения. Для создания на художественных предметах «налета старины» на них наносят слой меди, который затем специально патинируется.
При нагревании на воздухе медь тускнеет и в конце концов чернеет из-за образования на поверхности оксидного слоя. Сначала образуется оксид Cu2O, затем — оксид CuO.
Красновато-коричневый оксид меди(I) Cu2O при растворении в бромо- и иодоводородной кислотах образует, соответственно, бромид меди(I) CuBr и иодид меди(I) CuI. При взаимодействии Cu2O с разбавленной серной кислотой возникают медь и сульфат меди:
Cu2O + h3SO4 = Cu + CuSO4 + h3O.
При нагревании на воздухе или в кислороде Cu2O окисляется до CuO, при нагревании в токе водорода — восстанавливается до свободного металла.
Черный оксид меди (II) CuO, как и Cu2O, c водой не реагирует. При взаимодействии CuO с кислотами образуются соли меди (II):
CuO + h3SO4 = CuSO4 + h3O
При сплавлении со щелочами CuO образуются купраты, например:
CuO + 2NaOH = Na2CuO2 + h3O
Нагревание Cu2O в инертной атмосфере приводит к реакции диспропорционирования:
Cu2O = CuO + Cu.
Такие восстановители, как водород, метан, аммиак, оксид углерода (II) и другие восстанавливают CuO до свободной меди, например:
CuO +СО = Cu + СО2.
Кроме оксидов меди Cu2O и CuO, получен также темно-красный оксид меди (III) Cu2O3, обладающий сильными окислительными свойствами.
Медь реагирует с галогенами, например, при нагревании хлор реагирует с медью с образованием темно-коричневого дихлорида CuCl2. Существуют также дифторид меди CuF2 и дибромид меди CuBr2, но дииодида меди нет. И CuCl2, и CuBr2 хорошо растворимы в воде, при этом ионы меди гидратируются и образуют голубые растворы.При реакции CuCl2 с порошком металлической меди образуется бесцветный нерастворимый в воде хлорид меди (I) CuCl. Эта соль легко растворяется в концентрированной соляной кислоте, причем образуются комплексные анионы [CuCl2]-, [CuCl3]2- и [СuCl4]3-, например за счет процесса:
CuCl + НCl = H[CuCl2]
При сплавлении меди с серой образуетcя нерастворимый в воде сульфид Cu2S. Сульфид меди (II) CuS выпадает в осадок, например, при пропускании сероводорода через раствор соли меди (II):
h3S + CuSO4 = CuS + h3SO4
C водородом, азотом, графитом, кремнием медь не реагирует. При контакте с водородом медь становится хрупкой (так называемая «водородная болезнь» меди) из-за растворения водорода в этом металле.
В присутствии окислителей, прежде всего кислорода, медь может реагировать с соляной кислотой и разбавленной серной кислотой, но водород при этом не выделяется:
2Cu + 4HCl + O2 = 2CuCl2 + 2h3O.
С азотной кислотой различных концентраций медь реагирует довольно активно, при этом образуется нитрат меди (II) и выделяются различные оксиды азота. Например, с 30%-й азотной кислотой реакция меди протекает так:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4h3O.
С концентрированной серной кислотой медь реагирует при сильном нагревании:
Cu + 2h3SO4 = CuSO4 + SO2+ 2h3O.
Практическое значение имеет способность меди реагировать с растворами солей железа (III), причем медь переходит в раствор, а железо (III) восстанавливается до железа (II):
2FeCl3 + Cu = CuCl2 + 2FeCl2
Этот процесс травления меди хлоридом железа (III) используют, в частности, при необходимости удалить в определенных местах слой напыленной на пластмассу меди.
Ионы меди Cu2+ легко образуют комплексы с аммиаком, например, состава [Cu(Nh4)]2+ . При пропускании через аммиачные растворы солей меди ацетилена С2Н2 в осадок выпадает карбид (точнее, ацетиленид) меди CuC2.
Гидроксид меди Cu(OH)2 характеризуется преобладанием основных свойств. Он реагирует с кислотами с образованием соли и воды, например:
Сu(OH)2 + 2HNO3 = Cu(NO3)2 + 2h3O.
Но Сu(OH)2 реагирует и с концентрированными растворами щелочей, при этом образуются соответствующие купраты, например:
Сu(OH)2 + 2NaOH = Na2[Cu(OH)4]
Если в медноаммиачный раствор, полученный растворением Сu(OH)2 или основного сульфата меди в аммиаке, поместить целлюлозу, то наблюдается растворение целлюлозы и образуется раствор медноаммиачного комплекса целлюлозы. Из этого раствора можно изготовить медноаммиачные волокна, которые находят применение при производстве бельевого трикотажа и различных тканей.
Медь, как полагают, — первый металл, который человек научился обрабатывать и использовать для своих нужд. Найденные в верховьях реки Тигр изделия из меди датируются десятым тысячелетием до нашей эры. Позднее широкое применение сплавов меди определило материальную культуру бронзового века (конец 4 — начало 1 тысячелетия до нашей эры) и в дальнейшем сопровождало развитие цивилизации на всех этапах. Медь и ее использовались для изготовления посуды, утвари, украшений, различных художественных изделий. Особенно велика была роль бронзы .С 20 века главное применение меди обусловлено ее высокой электропроводимостью. Более половины добываемой меди используется в электротехнике для изготовления различных проводов, кабелей, токопроводящих частей электротехнической аппаратуры. Из-за высокой теплопроводности медь — незаменимый материал различных теплообменников и холодильной аппаратуры. Широко применяется медь в гальванотехнике — для нанесения медных покрытий, для получения тонкостенных изделий сложной формы, для изготовления клише в полиграфии и др.
Большое значение имеют медные сплавы — латуни (основная добавка цинк, Zn), бронзы (сплавы с разными элементами, главным образом металлами — оловом, алюминием, берилием, свинцом, кадмием и другими, кроме цинка и никеля) и медно-никелевые сплавы, в том числе мельхиор и нейзильбер . В зависимости от марки (состава) сплавы используются в самых различных областях техники как конструкционные, антидикционные, стойкие к коррозии материалы, а также как материалы с заданной электро- и теплопроводностью Так называемые монетные сплавы (медь с алюминием и медь с никелем) применяют для чеканки монет — «меди» и «серебра»; но медь входит в состав и настоящих монетного серебра и монетного золота.Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития (см. Биогенные элементы). В растениях и животных содержание меди варьируется от 10-15 до 10-3 %. Мышечная ткань человека содержит 1·10-3 % меди, костная ткань — (1-26) ·10-4%, в крови присутствует 1, 01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0, 5-6 мг меди.Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1, 0 мг/л.
- Биологическая роль меди. М., 1970.
- Смирнягин А. П. и др. Промышленные цветные металлы и сплавы. М., 1974.
- Набойченко С. С., Смирнов В. И. Гидрометаллургия меди. М., 1974.
- Подчайнова В. Н., Симонова Л. Н. Медь. М., 1990.
- Онаев И. А., Жакибаев Б. К. Медь в истории цивилизации. Алма-Ата, 1983.
- Подчайнова В. Н., Симонова Л. Н. Медь. М., 1990.
megabook.ru
: Металлургия: образование, работа, бизнес :: MarkMet.ru
СВОЙСТВА И ПРИМЕНЕНИЕ МЕДИ
Медь (Cu) носит также латинское название «купрум», которое происходит от названия острова Кипр, богатого залежами медьсодержащих ископаемых. Медь получила широкое применение в технике и промышленности благодаря ряду ценных свойств, которыми она обладает. Важнейшими свойствами меди являются высокие электро- и теплопроводность, высокая пластичность и способность подвергаться пластической деформации в холодном и нагретом состояниях, хорошая сопротивляемость коррозии и способность к образованию многих сплавов с широким диапазоном различных свойств. По показателям электро- и теплопроводности медь уступает только серебру. Медь диамагнитна.
Чистая пресная вода и сухой воздух практически не вызывают коррозии меди. Незначительное влияние на химическую стойкость меди оказывают сухие газы, ряд органических кислот, спирты и фенольные смолы, к углероду медь пассивна. Хорошей коррозионной стойкостью обладает медь и в морской воде. При отсутствии других окислителей на медь не действуют разбавленные серная и соляная кислоты. Медь растворяется в горячей серной кислоте и легко растворяется в азотной. Она плохо сопротивляется действию аммиака, аммиачных солей и щелочных цианистых соединений. Коррозию меди вызывают также хлористый аммоний и окислительные минеральные кислоты.
Более 50% добываемой меди применяется в электротехнической промышленности. Благодаря высокой теплопроводности и коррозионной стойкости медь широко применяется в теплообменниках, холодильниках, вакуумных аппаратах и т. п. Примерно 30— 40% меди применяется в виде сплавов
Основные физические и механические свойства меди приводятся ниже:
| Атомная масса | 63,54 |
| Плотность при 20°С, г/см3 | 8,96 |
| Температура, °С: |
|
| плавления | 1083 |
| кипения | 2600 |
| Удельная теплоемкость, кал/г | 0,092 |
| Теплопроводность кал/(см·сек·град) | 0,941 |
| Скрытая теплота плавления, кал/г | 43,3 |
| Коэффициент линейного расширения, 1 /град | 0,000017 |
| Удельное электросопротивление, ом-мм2/м | 0,0178 |
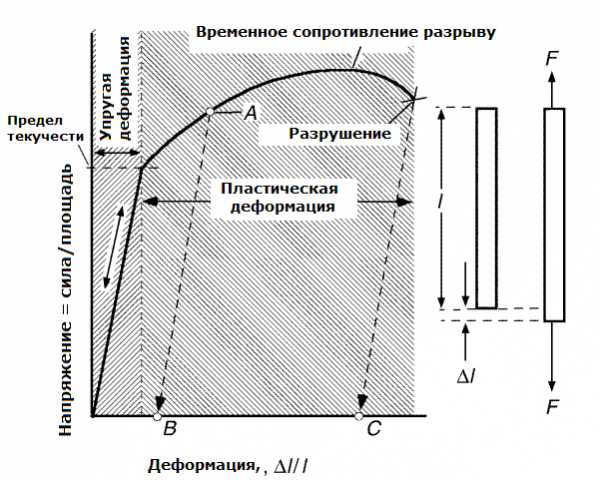
| Временное сопротивление меди, кГ/мм2 |
|
| деформированной | 40-50 |
| отожженной | 20-24 |
| Предел текучести меди, кГ/мм2, при температуре, °С |
|
| 20 | 7 |
| 200 | 5 |
| 400 | 1,4 |
| Относительное удлинение меди, %: |
|
| Деформированной | 4-6 |
| отожженной | 40-50 |
| Предел упругости меди, кГ/мм2: |
|
| Деформированной | 30 |
| отожженной | 7 |
| Модуль упругости, кГ/мм2 | 13200 |
| Модуль сдвига, кГ/мм2 | 4240 |
| Предел усталости меди при переменно-изгибающих напряжениях на базе 108 циклов, кГ/мм2 |
|
| Деформированной | 11 |
| отожженной | 6,7 |
| Твердость НВ меди, кГ/мм2 |
|
| Деформированной | 90-120 |
| отожженной | 35-40 |
В технической меди в качестве примесей содержатся: висмут, сурьма, мышьяк, железо, никель, свинец, олово, сера, кислород, цинк и другие. Все примеси, находящиеся в меди, понижают ее электропроводность. Температура плавления, плотность, пластичность и другие свойства меди также значительно изменяются от присутствия в ней примесей.
Висмут и свинец в сплавах с медью образуют легкоплавкие эвтектики, которые при кристаллизации затвердевают в последнюю очередь и располагаются по границам ранее выпавших зерен меди (кристаллов). При нагревании до температур, превышающих точки плавления эвтектик (270 и 327°С соответственно), зерна меди разъединяются жидкой эвтектикой. Такой сплав является красноломким и при прокатке в горячем состоянии разрушается. Красноломкость меди может вызываться присутствием в ней тысячных долей процента висмута и сотых долей процента свинца. При повышенном содержании висмута и свинца медь становится хрупкой и в холодном состоянии.
Сера и кислород образуют с медью тугоплавкие эвтектики с точками плавления выше температур горячей обработки меди (1065 и 1067°С). Поэтому присутствие в меди небольших количеств серы и кислорода не сопровождается появлением красноломкости. Однако значительное повышение содержания кислорода приводит к заметному понижению (механических, технологических и коррозионных свойств меди; медь становится красноломкой и хладноломкой.
Медь, содержащая кислород, при отжиге ее в водороде или в атмосфере, содержащей водород, делается хрупкой и растрескивается. Это явление известно под названием «водородной болезни». Растрескивание меди в этом случае происходит в результате образования значительного количества водяных паров при взаимодействии водорода с кислородом меди. (Водяные пары при повышенных температурах имеют высокое давление и разрушают медь. (Наличие трещин в меди устанавливается путем испытания на изгиб и кручение, а также микроскопическим методом. В меди, пораженной водородной болезнью, после полировки хорошо видны характерные темные .включения пор и трещин.
Сера снижает пластичность меди при холодной и горячей обработке давлением и улучшает обрабатываемость резанием.
Железо растворяется в меди в твердом состоянии весьма незначительно. Под влиянием примесей железа резко снижаются электро- и теплопроводность меди, а также ее коррозионная стойкость. Структура меди под влиянием примесей железа измельчается, что повышает ее прочность и уменьшает пластичность. Под влиянием железа медь становится магнитной.
Бериллий является раскислителем по отношению к меди, несколько снижает электропроводность ее, повышает механические свойства и значительно уменьшает окисление при повышенных температурах.
Мышьяк сильно понижает электро- и теплопроводность меди. Одновременно с этим мышьяк в значительной мере нейтрализует вредное влияние примесей висмута, кислорода, сурьмы и повышает жаростойкость меди. Поэтому мышьяковистая медь с содержанием 0,3—0,5% Аз применяется для изготовления деталей специального назначения, используемых для работы в условиях восстановительной атмосферы при повышенных температурах. Мышьяк растворим в меди в твердом состоянии до 7,5%.
Сурьма очень сильно понижает электро- и теплопроводность меди. Поэтому медь, предназначенная для изготовления проводников тока, должна содержать минимальное количество сурьмы (не выше 0,002%). Растворимость сурьмы в меди при температуре образования эвтектики (64б°С) составляет 9,5%. При понижении температуры растворимость сурьмы в меди резко падает. С этим связано отрицательное влияние сурьмы при прокатке меди. Медь, подлежащая прокатке, не должна содержать сурьмы более 0,06%. В меди, предназначенной для штамповки, допускается содержание сурьмы до 0,2%.
Фосфор сильно понижает электро- и теплопроводность меди, но положительно влияет на ее механические свойства и жидкотекучесть. Фосфор широко применяется в литейном деле в качестве раскислителя меди и оказывает положительное влияние при сварке меди.
Алюминий повышает коррозионную стойкость и снижает окисляемость меди при нормальной и повышенной температурах, значительно понижает ее электро- и теплопроводность, а также оказывает отрицательное влияние при пайке и лужении медных изделий. На механические свойства и обрабатываемость меди давлением примесь алюминия не оказывает заметного влияния. Растворимость алюминия в меди в твердом состоянии составляет 9,8%.
МЕДНЫЕ СПЛАВЫ
Латуни
Сплавы, в которых основными компонентами являются медь и цинк, (называют латунями. Латуни обладают достаточно высокими механическими и технологическими свойствами и высокой коррозионной стойкостью. Практическое применение в технике имеют латуни с содержанием цинка до 45%. При содержании цинка до 39% латунь имеет структуру однофазного твердого раствора цинка в меди, называемую α-латунью. Структура латуней, содержащих цинк в пределах от 39 до 43%, состоит из смеси кристаллов двух твердых растворов α+β. При содержании цинка более 50% образуется твердый раствор γ обладающий высокой хрупкостью. Максимальной пластичностью обладает латунь, содержащая примерно 32% Zn, а максимальной прочностью — латунь, содержащая 45% Zn. Латуни, структура которых состоит только из α-раствора, хорошо обрабатываются давлением в горячем и холодном состоянии. Латуни, имеющие двухфазную структуру (α+β), обладают повышенной твердостью, хорошо обрабатываются в горячем состоянии, но в холодном состоянии пластичность их очень мала.
Температуры начала и конца кристаллизации латуней лежат близко друг от друга. Этим объясняется особенность литейных свойств латуней — малая склонность к ликвации, хорошая жидкотекучесть, склонность к образованию концентрированной усадочной раковины. Обработка латуней давлением имеет ряд особенностей.
Твердый раствор латуней β при температуре выше 500°С обладает большей пластичностью и меньшей прочностью, чем α-латуни, в то время как при комнатной температуре прочность их выше, чем у α-латуней. В связи с этим для прокатки в горячем состоянии наиболее пригодны латуни, структура которых состоит из β-раствора или α+β-раствора.
При обработке давлением в холодном состоянии латуни получают значительный наклеп и для снятия напряжений их подвергают отжигу. На свойства латуней самым решающим образом влияет величина зерна. Свойства латуней и величина зерна находятся в зависимости от температуры и продолжительности отжига, а также от степени предшествующей деформации. Для получения мелкого зерна в α-латунях требуется температура отжита в пределах 350— 450°С.
В интервале температур 200—600°С у латуней появляется хрупкость, связанная с образованием примесями свинца, сурьмы и висмута хрупких межкристаллитных прослоек. С повышением температуры эти прослойки растворяются и пластичность латуней резко возрастает.
Атмосферные условия, сухой пар, пресная и морская вода, сухие газы, уксусная кислота в спокойном состоянии, сухой четыреххлористый углерод, фторированные органические соединения, хлористый метил и бромозамещенные соединения при отсутствии влаги не вызывают заметной коррозии латуни. Сильную коррозию латуней вызывают рудничные воды, растворы йодистых солей, окисляющие растворы, азотная, соляная, фосфорная и жирные кислоты, серный ангидрид, сероводород, растворы едких щелочей, растворы аммиака. Скорость коррозии резко возрастает при повышении температуры в морской и пресной воде, в уксусной кислоте, растворах едких щелочей и других средах. Значительно возрастает скорость коррозии латуней в газах с повышением их влажности.
Большой ущерб промышленности наносится обесцинкованием и коррозионным растрескиванием латуней, которое происходит при одновременном воздействии коррозионной среды и растягивающих напряжений. Склонность латуней к коррозионному растрескиванию возрастает с повышением содержания цинка и с увеличением до известного предела растягивающих напряжений. Мало чувствительны к коррозионному растрескиванию латуни, содержащие менее 7% Zn. В латунях с высоким содержанием цинка коррозионное растрескивание наблюдается относительно редко, если внутренние напряжения менее 6 кГ/мм2.
Коррозионное растрескивание нагартованной латуни может наблюдаться и при лежании во влажной атмосфере. Этот вид коррозии в сильной степени зависит от влажности атмосферы и проявляется во все времена года не одинаково интенсивно, поэтому ее иногда называют «сезонным растрескиванием ».
Медноцинковые сплавы, содержащие, кроме меди и цинка, добавки алюминия, железа, марганца, свинца, никеля и других элементов, называют специальными латунями. Они обладают повышенной коррозионной стойкостью, лучшими технологическими и механическими свойствами, а также особыми специальными свойствами.
Специальные латуни в зависимости от основного легирующего компонента обычно носят и соответствующие названия: алюминиевая, кремнистая, марганцовистая, никелевая, свинцовистая латунь и т. д.
Алюминиевые латуни находят применение в качестве коррозионно- и жаростойкого материала. Из разных марок алюминиевых латуней изготовляют конденсаторные трубки, трубы, шестерни, втулки, различные детали в авиационной и других отра елях промышленности.
При добавке в латуни алюминия резко повышаются прочность и твердость сплава и понижается пластичность. Наибольший практический интерес представляют латуни, содержащие до 4% Аl, которые хорошо обрабатываются давлением. Добавка алюминия повышает коррозионную стойкость сплава в отношении атмосферной коррозии. Однако латуни с добавкой алюминия менее устойчивы в морской воде. Кроме того, они сравнительно сильно подвержены коррозионному растрескиванию. Поэтому такие латуни не рекомендуются для длительного хранения. Кроме того, алюминий ухудшает способность латуней к пайке и лужению.
Кремнистые латуни обладают более высокой коррозионной стойкостью в атмосферных условиях и морской воде, чем простые латуни. Из кремнистых латуней изготовляют поковки и штамповки, литую арматуру, шестерни и детали морских судов, литые подшипники и втулки.
Под влиянием кремния значительно повышаются механические и литейные свойства сплава, а также улучшается технологический процесс сварки и пайки.В латунях с повышенным содержанием цинка кремний значительно повышает твердость и уменьшает пластичность. Примеси алюминия, железа, сурьмы, мышьяка и фосфора в кремнистых латунях являются вредными, так как ухудшают антифрикционные, коррозионные, литейные и другие свойства латуней.
Марганцовистые латуни характеризуются более высокой прочностью, твердостью и коррозионной стойкостью по сравнению с простыми латунями. (Применяются они в виде полос, листов, прутков, а также поковок в судостроении и в других отраслях промышленности.
При содержании марганца в латунях до 4% значительно повышаются временное сопротивление, пределы пропорциональности и упругости без понижения пластичности. Понижение удлинения, ударной вязкости наблюдается при содержании в латунях марганца выше 4%. Марганцевые латуни хорошо обрабатываются давлением в горячем и холодном состоянии. Стойкость их к воздействию хлоридов, морской воды и перегретого пара значительно выше, чем у обычных латуней. Склонность марганцевых латуней к коррозионному растрескиванию весьма значительна.
Никелевые латуни обладают хорошей коррозионной стойкостью, повышенными механическими свойствами и стойкостью против истирания, хорошо обрабатываются давлением в горячем и холодном состояниях. Применяются никелевые латуни для изготовления конденсаторных трубок для морских судов, манометрических трубок, сеток бумагоделательных машин я других изделий. Под влиянием никеля у латуней повышается коррозионная стойкость в атмосферных условиях, морской воде и в условиях бактериологической коррозии, а также резко уменьшается склонность к коррозионному растрескиванию.
Свинцовистые латуни относятся к числу так называемых автоматных латуней. Они хорошо обрабатываются резанием, обладают повышенными антифрикционными свойствами и хорошо деформируются в холодном состоянии. Значительная часть существующих марок свинцовистых латуней относится к группе специальных латуней, носящих название мунц-металл. Коррозионная стойкость латуней резко повышается в условиях воздействия морской воды при добавке в них 0,5—1,5% Sn «морские латуни». Эти латуни имеют удовлетворительные механические, технологические и литейные свойства. По химическому составу они относятся к оловянным латуням. Наибольшее применение имеют латуни марок ЛO70-1 и ЛO62-1. Из латуни марки ЛО70-1 изготовляют трубки конденсаторов морских судов и -различной теплотехнической аппаратуры. Латунь марки ЛO62-1 применяют для изготовления деталей, от которых требуется повышенная коррозионная стойкость. Выпускается она в виде полос, листов и прутков.
Добавка в латуни железа повышает механические и технологические свойства сплава главным образом вследствие того, что задерживает рекристаллизацию латуни и способствует получению мелкого зерна. При содержании железа более 0,03% латуни становятся магнитными. Поэтому для антимагнитных латуней содержание железа допускается не выше 0,03%. Особо благоприятное влияние на повышение механических свойств и улучшение коррозионной стойкости оказывает железо в сочетании с марганцем, никелем и алюминием.
Сурьма и сера сильно ухудшают качество латуней. Примеси сурьмы вызывают разрушение латуней при обработке давлением как в горячем, так и в холодном состоянии. Под влиянием сурьмы увеличивается склонность латуней к коррозионному растрескиванию.
При содержании в латунях свыше 0,5% Аs они в значительной мере теряют свою пластичность за счет образования на границах зерен хрупких прослоек химического соединения. (Вместе с тем содержание мышьяка до 0,02% предохраняет латуни от обесцинкования, что повышает коррозионную стойкость их в морокой воде.
Небольшие количества фосфора повышают механические свойства латуней и способствуют измельчению зерна в литье. При повышенном содержании фосфора он выделяется в виде отдельной составляющей с температурой плавления около 700°С, увеличивая твердость и снижая пластичность латуней.
В зависимости от способа изготовления изделий и полуфабрикатов из латуней их разделяют на литейные и деформируемые.
Литейные латуни предназначены для отливки различных коррозионностойких, антифрикционных и других деталей в кокиль, в землю и центробежным способом.
Деформируемые латуни подвергают всем видам горячей и холодной обработки давлением.
Изменяя режимы обработки давлением, получают латуни с различными механическими свойствами: мягкие, твердые, особо твердые.
Мягкая латунь обладает высокой пластичностью. Достигается это обработкой давлением в отожженном состоянии. Степень мягкости полуфабрикатов из таких латуней характеризуется (Величиной предела прочности и относительного удлинения, а для лент и листов — глубиной продавливания по Эриксону.
Твердая латунь характеризуется повышенной прочностью ((твердостью) и пони жени ой пластичностью. Повышенная прочность таких латуней достигается обработкой давлением с высокими степенями обжатия (упрочнением). Обычно требуемые механические свойства полуфабрикатов достигаются при степени нагартовки не менее 30%.
Особо твердая латунь получается холодной обработкой давлением (прокаткой и волочением) с высокой степенью деформации. Таким путем из латуни марки Л68 изготовляют ленты и полосы с временным сопротивлением не менее 62 кГ/мм2 и относительным удлинением не менее 2,5%. Из часовой латуни марки ЛС63-3 изготовляют ленты и полосы с временным сопротивлением не менее 64 кГ/мм2 и относительным удлинением не более 5%.
Установлен следующий порядок маркировки латуней: первая буква Л указывает название сплава (латунь), а следующая за ней цифра обозначает среднее содержание меди в сплаве.
Для специальных латуней приняты следующие обозначения элементов: А — алюминий, Ж — железо, Мц — марганец, К — кремний, С — свинец, О—олово, Н — никель. Первые две цифры, стоящие за буквенным обозначением, указывают среднее содержание меди в процентах, а последующие цифры — содержание других элементов; остальное (до 100%) составляет цинк.
Буква Л в конце наименования марки указывает на то, что латунь литейная, отсутствие этой буквы—латунь предназначена для обработки давлением.
Бронзы
Бронзами называют сплавы меди с различными элементами, кроме цинка и некоторых сплавов с марганцем и никелем.
Оловянные бронзы обладают хорошими механическими, антифрикционными и технологическими свойствами, а также высокой .коррозионной стойкостью в атмосферных условиях, «в сухом и влажном водяном паре, в пресной и морской воде, в сухих газах и кислороде при нормальной температуре.
Оловянные бронзы имеют очень малую усадку и поэтому все наиболее сложные по конфигурации отливки изготовляют из таких бронз. Они не дают сосредоточенной усадочной раковины, и поэтому для отливки изделий из них нет необходимости иметь большие прибыли. Оловянные бронзы мало чувствительны к перегреву, отлично воспринимают пайку и сварку, не дают искры при ударах, немагнитны и .морозостойки.
Оловянные бронзы с содержанием более 22% Sn очень хрупки и не имеют практического применения. Вследствие увеличения хрупкости с повышением содержания олова для обработки давлением применяют оловянные бронзы, содержащие не более 7— 8% Sn. Оловянные бронзы имеют большую склонность к обратной ликвации. При резко выраженной обратной ликвации на поверхности отливок появляются хрупкие выделения в виде белых пятен (оловянного пота), отрицательно влияющих на качество отливок. Они быстро разрушаются под воздействием рудничных вод, содержащих соли-окислители, и в растворах аммиака. Возрастает скорость коррозии оловянных бронз в газах при высоких температурах в присутствии хлора, брома, йода, а также в сернистом газе в присутствии влаги. Значительное влияние на свойства оловянных бронз оказывают примеси.
Фосфор повышает механические, литейные и антифрикционные свойства оловянных бронз, а свинец улучшает антифрикционные свойства и обрабатываемость резанием. В сплавах, обрабатываемых давлением, содержание фосфора допускается не более 0,5%. При более высоком содержании фосфора оловянные бронзы не поддаются горячей обработке давлением.
Железо при его содержании в оловянных бронзах до 0,03% является полезной примесью, так как способствует образованию мелкозернистой структуры, повышает механические свойства и задерживает рекристаллизацию. При более высоком содержании железа резко снижаются коррозионные и технологические свойства оловянных бронз.
Вредными примесями в оловянных бронзах являются алюминий, кремний, магний, висмут, мышьяк и сера.
Маркировка бронз производится по тому же принципу, что и латуней. Впереди стоят буквы Бр. (бронза), а затем следуют буквенные обозначения элементов, входящих в состав сплава, и за ними цифры, указывающие среднее содержание элемента в процентах.
Сплавы меди с другими элементами, кроме олова и цинка, называют специальными (безоловянными) бронзами. По литейным свойствам оловянные бронзы превосходят специальные. Однако по другим свойствам специальные бронзы обладают более высокими показателями.
Алюминиевые бронзы превосходят оловянные по механическим свойствам и коррозионной стойкости в атмосферных условиях, морской воде, углекислых растворах, а также в растворах многих органических кислот (лимонной, уксусной, молочной). Они кристаллизуются в узком интервале температур, обладают высокой жидко текучестью, не склонны к ликвации, морозостойки, немагнитны и не дают искры при ударах. К недостаткам алюминиевых бронз следует отнести то, что они трудно поддаются пайке мягкими и твердыми припоями, имеют повышенную объемную усадку и недостаточно устойчивы к воздействию перегретого пара.
Для повышения механических свойств и коррозионной стойкости в алюминиевые бронзы чаще всего добавляют железо, никель, марганец. Железо способствует образованию более мелкой структуры и повышает механические свойства алюминиевых бронз. Никель значительно повышает прочность, твердость, коррозионно- и жаростойкость алюминиевых бронз. Такие сплавы удовлетворительно переносят обработку давлением и применяются для деталей ответственного назначения как сплавы высокой прочности. Марганец повышает коррозионно- и жаростойкость алюминиевых бронз.
Примеси висмута и серы ухудшают механические, технологические свойства и поэтому являются вредными примесями в алюминиевых бронзах. Цинк также оказывает отрицательное «влияние на технологические и антифрикционные свойства алюминиевых бронз.
В наклепанном состоянии прочность алюминиевых бронз значительно возрастает. В широком диапазоне изменяются механические свойства алюминиевых бронз в результате термической обработки.
Бериллиевые бронзы имеют высокие пределы прочности, упругости, текучести и усталости; а также высокую электро- и теплопроводность, твердость, износоустойчивость, сопротивление ползучести, коррозионную стойкость и высокое сопротивление коррозионной усталости.
В связи с весьма ценными свойствами, которыми обладают бериллиевые бронзы, они получили широкое применение в технике для изготовления пружин, мембран, пружинящих контактов и т. д. Добавка некоторых количеств никеля и кобальта в бериллиевые бронзы является полезной. Ухудшают качество бериллиевых бронз примеси железа, алюминия, кремния, магния и фосфора. Весьма вредными примесями в бериллиевых бронзах являются свинец, висмут, сурьма.
Марганцевые бронзы при удовлетворительных механических свойствах обладают высокой пластичностью, хорошей коррозионной стойкостью и способностью сохранять механические свойства при повышенных температурах, поэтому их применяют для изготовления деталей, работающих при высоких температурах.
Кремнистые бронзы обладают высокой пластичностью и хорошими литейными свойствами. Для повышения механических свойств и коррозионной стойкости в кремнистые бронзы обычно добавляют марганец и никель. Такие бронзы имеют высокие механические и антифрикционные свойства, отлично свариваются и паяются, немагнитны, в значительной мере сохраняют свои свойства при низких температурах, не дают искры при ударах и хорошо обрабатываются давлением как «в горячем, так и в холодном состоянии, обладают хорошей коррозионной «стойкостью в пресной и морской воде и в атмосфере сухих газов: хлора, брома, фтора, фтористого водорода, сероводорода, сернистого газа, аммиака, хлористого водорода. В присутствии влаги коррозионная стойкость кремнистых бронз снижается. (Кремнистые бронзы удовлетворительно сопротивляются воздействию щелочей, кроме растворов высоких концентраций, и при высоких температурах. Они быстро корродируют в кислых рудничных водах, содержащих в растворе сернокислую окисную соль железа, а также в растворах солей хромовых кислот и хлорного железа.
В бронзах, обрабатываемых давлением, содержание железа не должно быть выше 0,2—0,3%, так как при более высоком содержании железа заметно снижается коррозионная стойкость сплава. Под «влиянием свинца кремнистые бронзы легко разрушаются при обработке давлением в горячем состоянии, поэтому кремнистые бронзы, предназначенные для горячей обработки давлением, не должны содержать свинца более 0,01 %. Примеси висмута, мышьяка, сурьмы, серы, фосфора являются очень вредными и содержание их в кремнистых бронзах не должно превышать 0,002%.
Свинцовые бронзы имеют высокие антифрикционные свойства и применяются для изготовления высоконагруженных подшипников с большим удельным давлением.
Состав бронзы, способы ее получения и изготовления готовых изделий выбираются в зависимости от назначения, условий эксплуатации и предъявляемых к ним требований.
По способу изготовления все бронзы разделяют на две группы: литейные и деформируемые.
Литейная бронза предназначена для получения деталей путем литья в песчаные формы, в кокиль, центробежным способом и по выплавляемым моделям. Литейные бронзы широко «применяют для изготовления различной арматуры, антифрикционных «деталей, для художественного литья и других целей.
Деформируемая бронза «предназначена для изготовления полуфабрикатов — поковок, фасонных профилей, прутков круглого, квадратного, прямоугольного и шестигранного сечения, полос, ленты, листов, проволоки и труб путем ковки, прессования, горячей и холодной прокатки.
Из оловянистых бронз в качестве деформируемых материалов применяются бронзы, содержащие до 8% Sn.
Легко обрабатываются давлением алюминиевые бронзы, содержащие обычно до 12% А1: алюминиевожелезные, алюминиево- марганцевые, алюминиевожелезоникелевые и др.
Хорошо поддаются обработке давлением кремнемарганцовистые бронзы марки Бр. КМцЗ-1 и бериллиевые бронзы. Бериллиевые бронзы в закаленном состоянии обла дают высокой пластичностью, а после отпуска они приобретают высокую упругость, прочность и твердость.
В зависимости от назначения, физических, механических и других свойств деформируемую бронзу разделяют на жаропрочную, износостойкую, конструкционную, приборную, пружинную и т. д.
Деформируемая жаропрочная бронза обладает хорошей прочностью при высоких температурах. К таким бронзам относятся кремнистоникелевая марки Бр. КШ-З, алюминиевая Бр.АЖН10-4-4, а также бронзы марок Бр. АЖ9-4 и Бр. АЖМц 10-3-1,5, хотя две последние марки обладают меньшей жаропрочностью. Кроме того, к жаропрочным бронзам относится целый ряд специальных сплавов: хромистая бронза, хромоциркониевые бронзы, хромо- кадмиевые бронзы, хромоцинковые бронзы н др.
Деформируемая износостойкая бронза применяется для изготовления деталей трения. К этой группе сплавов относятся оловянистые, алюминиевые, кремнистые и бариллиевые бронзы. Прутки из оловянистой бронзы марки Бр.ОФ6,5-0,15 применяются для подшипников, изготовляемых в виде втулок, работающих в условиях средней трудности по удельным давлениям и скоростям скольжения или при повышенных нагрузках и малых скоростях скольжения. По сравнению с литейными бронзы оловянистые деформируемые имеют более низкую износостойкость.
Бронзы алюминиевые уступают оловяни стым по сопротивлению заеданию и износостойкости. Однако они обладают большей прочностью и твердостью. В условиях средней трудности и при хорошей смазке алюминиевые бронзы работают надежно. Из алюминиевых бронз изготовляют червячные передачи, направляющие втулки, неответственные подшипники :в виде втулок и другие детали.
Бериллиевая бронза успешно применяется в условиях трения-качения, где недопустимы остаточные деформации материала (в шаровых сочленениях приборов и агрегатов и др.).
Бронза кремнистомарганцовистая в качестве коррозионно- и износостойкого материала используется для изготовления сеток и решеток, работающих в сточных водах, испарителях, дымовых фильтрах и т. д.
Деформируемая конструкционная бронза применяется для изготовления деталей, которые в процессе эксплуатации испытывают силовую нагрузку и от которых одновременно требуются коррозионная стойкость и специальные физические свойства.
Полуфабрикаты из алюминиевых бронз, легированных железом, никелем и марганцем, нашли широкое применение для нагруженных деталей в различных конструкциях химического аппаратостроения, в судостроении, в авиации и общем машиностроении. Этому способствует сочетание в указанных сплавах высоких прочностных характеристик при достаточно высоких пластических свойствах и ударной вязкости с большой коррозионной стойкостью.
Бронзы кремнемарганцовистая (Бр. КМцЗ-1) и кремнистоникелевая (Бр. КН1-3)
при хорошей коррозионной стойкости и достаточно высокой прочности обладают высокой пластичностью. Из бронзы Бр. КМцЗ-1 в отожженном состоянии изготовляют очень тонкие ленты (толщиной до 0,05 мм). При
Алюминиевожелезные бронзы (типа Бр. АЖН 10-4-4) и бронза марки Бр. КН1-3, обладающие высокой жаропрочностью, применяются для изготовления деталей, работающих при повышенных температурах.
Деформируемая приборная бронза применяется для изготовления деталей, приборов и аппаратов. В зависимости от условий службы для изготовления деталей приборов и аппаратов могут применяться различные высокопрочные конструкционные бронзы, пружинные бронзы и др.
Деформируемая пружинная бронза применяется для изготовления пружин и пружинных деталей различного типа и назначения. В качестве пружинных бронз широко применяются оловянистые бронзы Бр. ОФ6,5-0,15, Бр. ОФ4-0,25, Бр. ОЦ4-3, алюминиевая бронза А7 и бериллие- вые бронзы марок Бр. Б2, Бр. БНТ1,9 к Бр. БНТ1,7.
Оловянистые и алюминиевые бронзы обладают повышенной упругостью и прочностью в нагартованном состоянии. Бериллиевые бронзы, мягкие и пластичные в закаленном состоянии, получают высокую упругость и твердость после отпуска. Пружины из бериллиевых бронз по своим свойствам при нормальной и повышенных температурах превосходят все другие пружины.
Мягкая бронза легко штампуется и гнется. Мягкость бронз достигается обработкой давлением и отжигом при высокой температуре для полного снятия внутренних напряжений и восстановления структуры. Бронзы деформируемые дисперсионно твердеющие называются мягкими в состоянии закалки, а последующий отпуск резко повышает твердость и прочность. Мягкие бронзы применяются тогда, когда по условиям технологии изготовления детали подвергаются дополнительной деформации (штамповке, гибке).
Полутвердая бронза применяется для изготовления мембран, трубок Бурдона, фланцев, гроссов и других деталей крепления, от которых требуется повышенная прочность. Бронзы этой группы при повышенной прочности и твердости сохраняют достаточную пластичность для обработки штамповкой и гибкой. Для получения необходимых свойств бронзы полутвердые подвергаются обработке давлением со средними степенями деформации 10—30%.
Твердая бронза обрабатывается давлением со степенями деформации 30— 50%. Эта бронза обладает повышенной прочностью, твердостью и упругостью, низкой пластичностью и применяется для изготовления пружин, контактов, втулок и других деталей.
Особо твердая бронза имеет высокие пределы упругости, прочности и твердости и пониженную пластичность. Требуемые свойства бронза приобретает после обработки давлением с высокой степенью деформации (более 50%). Таким путем изготавливают особо твердые ленты и полосы из кремнемарганцовистой бронзы марки Бр.КМц3-1,оловянофосфористой бронзы марки Бр. ОФ6,5-0,15 и оловяиноцинковой бронзы марки Бр. ОЦ4-3.
МЕДНОНИКЕЛЕВЫЕ СПЛАВЫ
Медноникелевые сплавы условно разделяют на конструкционные и электротехнические. К конструкционным медионикелевым сплавам относятся коррозионностойкие сплавы типа мельхиор, сплавы меди, никеля и цинка типа нейзильбер и коррозионно- стойкие упрочняющиеся сплавы меди, никеля и алюминия типа куниаль.
Мельхиор. Сплавы этого типа обладают высокой коррозионной стойкостью в пресной и морской воде, сухих газах и в атмосферных условиях, они хорошо противостоят действию щелочных растворов солей и органических соединений. Структура сплавов типа мельхиор представляет собой твердый раствор и поэтому они хорошо обрабатываются давлением в холодном и горячем состояниях.
Мельхиор марки МНЖМцЗО-0,8-4,0 обладает большой стойкостью в среде парового конденсата. По устойчивости против действия ударной !(турбулентной) коррозии он превосходит практически все другие известные сплавы. Благодаря этим свойствам мельхиор марки МНЖМцЗО-0,8-1,0 применяется для конденсаторных труб морскигз судов, работающих в особо тяжелых условиях. Мягкие конденсаторные трубы, изготовляемые в соответствии с ГОСТ 10092—62, имеют временное сопротивление не менее 38 кГ/мм2 и относительное удлинение в- пределах 03%, а полутвердые трубы 50 кГ/мм2 и 10% соответственно.
Нейзильбер — сплав, обладающий наилучшими свойствами из группы тройных сплавов меди с никелем и цинком. Он представляет собой твердый раствор никеля и цинка и меди, обладает хорошей коррозионной стойкостью, красивым серебристым цветом, повышенной прочностью и удовлетворительной пластичностью в холодном и горячем состояниях. На воздухе нейзильбер не окисляется и достаточно стоек в растворах солей и органических кислот. Применяется этот сплав для изготовления медицинского инструмента, технической посуды, телефонной аппаратуры, паровой и водяной арматуры, изделий санитарной техники, точной механики, бытовой посуды и художественных изделий. Полуфабрикаты из нейзильбера поставляются в виде полос, ленты, прутков и проволоки.
Куниаль А — сплав меди с никелем и алюминием. Он хорошо обрабатывается давлением в холодном и горячем состояниях. Полуфабрикаты из этого сплава производят в виде прессованных прутков с временным сопротивлением не менее 70 кГ/мм2 и относительным удлинением не менее 7%.
Куниаль Б обладает хорошей коррозионной стойкостью. Полуфабрикаты из него изготовляют в виде полос толщиной 0,5— 3 мм для пружин. Полосы из сплава куниаль Б обладают временным сопротивлением не менее 56 кГ/мм2 и относительным удлинением не менее 3%.
Электротехнические медно- никелевые сплавы. К ним относятся сплавы типа ТП и ТБ, термоэлектродный сплав с высоким содержанием никеля— копель, реостатный сплав константан и сплав манганин.
Сплав ТП применяется для изготовления компенсационных проводов к платина- платинородиевой термопаре, а сплав ТБ применяется для изготовления компенсационных проводов к платина-золотой и палладий -платинородиевой термопарам.
Копель— сплав, применяемый в качестве отрицательного термоэлектрода термопар хромель — копель и железо—копель, а также в виде компенсационных проводов. Копель имеет максимальную термоэлектродвижущую силу но сравнению с другими меднооникелевыми сплавами такого же назначения и практически нулевой температурый коэффициент электросопротивления. Этот сплав является также хорошим материалом для реостатов и нагревательных устройств с рабочей температурой до 600°С.
Константан —сплав, отличающийся высокой термоэлектродвижущей силой, малым температурным коэффициентом, (постоянством электросопротивления. Сплав применяется для реостатов, термопар, нагревательных приборов с рабочей температурой до 500°С. Температурный коэффициент электросопротивления сплава в интервале 20—100°С составляет 2 • 10 -6 1/град.
Манганин. Сплав широко применяют в качестве прецизионного (материала с высоким омическим сопротивлением. В паре с медью он обладает незначительной термоэлектродвижущей силой, что позволяет почти полностью избавиться от термотоков. При 20°С электросопротивление сплава в виде лент, полос и проволоки составляет 0,42—0,48 ом •мм2/м.
markmet.ru
Медь и её природные соединения, синтез малахита
Цель работы.
Синтезировать 5 г. Малахита, рассчитать практический выход продукта, научиться пользоваться необходимой литературой, выбирать из неё необходимую информацию, и представлять полученные результаты.
Литературный обзор.
Медь и её природные соединения.
Введение.
Медь – элемент 1В группы Периодической системы, плотность 8,9 г см-3 , один из первых металлов, ставших известными человеку. Считают, что медь начали использовать около 5000 до н.э. В природе медь изредка встречается в виде металла. Из медных самородков, возможно, с помощью каменных топоров, были изготовлены первые металлические орудия труда. У индейцев, живших на его берегах оз. Верхнее (Сев. Америка), где есть очень чистая самородная медь, способы ее холодной обработки были известны до времен Колумба. Около 3500 до н.э. на Ближнем Востоке медь научились извлекать из руд, ее получали восстановлением углем. Медные рудники были и в Древнем Египте. Известно, что глыбы для знаменитой пирамиды Хеопса обрабатывали медным инструментом. [1]
К 3000 до н.э. в Индии, Месопотамии и Греции для выплавки более твердой бронзы в медь стали добавлять олово. Открытие бронзы могло произойти случайно, однако ее преимущества по сравнению с чистой медью быстро вывели этот сплав на первое место. Так начался «бронзовый век».
Изделия из бронзы были у ассирийцев, египтян, индусов и других народов древности. Однако цельные бронзовые статуи древние мастера научились отливать не раньше 5 в. до н.э. Около 290 до н.э. Харесом в честь бога солнца Гелиоса был создан Колосс Родосский. Он имел высоту 32 м и стоял над входом во внутреннюю гавань древнего порта острова Родоса в восточной части Эгейского моря. Гигантская бронзовая статуя была разрушена землетрясением в 223 н.э.
Предки древних славян, жившие в бассейне Дона и в Приднепровье, применяли медь для изготовления оружия, украшений и предметов домашнего обихода. Русское слово «медь», по мнению некоторых исследователей, произошло от слова «мида», которое у древних племен, населявших Восточную Европу, обозначало металл вообще.
Символ Cu происходит от латинского aes cyproum (позднее, Cuprum), так как на Кипре (Cyprus) находились медные рудники древних римлян. Относительное содержание меди в земной коре составляет 6,8·10–3%. Самородная медь встречается очень редко. Обычно элемент находится в виде сульфида, оксида или карбоната. Важнейшими рудами меди являются халькопирит CuFeS2, который, по оценкам, составляет около 50% всех месторождений этого элемента, медный блеск (халькоцит) Cu2S, куприт Cu2O и малахит Cu2CO3(OH)2. Большие месторождения медных руд найдены в различных частях Северной и Южной Америк, в Африке и на территории нашей страны. В 18–19 вв. близ Онежского озера добывали самородную медь, которую отправляли на монетный двор в Петербург. Открытие промышленных месторождений меди на Урале и в Сибири связано с именем Никиты Демидова. Именно он по указу Петра I в 1704 начал чеканить медные деньги.
Богатые месторождения меди давно выработаны. Сегодня почти весь металл добывается из низкосортных руд, содержащих не более 1% меди. Некоторые оксидные руды меди могут быть восстановлены непосредственно до металла нагреванием с коксом. Однако большая часть меди производится из железосодержащих сульфидных руд, что требует более сложной переработки. Эти руды сравнительно бедные, и экономический эффект при их эксплуатации может обеспечиваться лишь ростом масштабов добычи. Руду обычно добывают в огромных карьерах, где используются экскаваторы с ковшами до 25 м3 и грузовики грузоподъемностью до 250 т. Сырье размалывают и концентрируют (до содержания меди 15–20%) с использованием пенной флотации, при этом серьезной проблемой является сброс многих миллионов тонн тонко измельченных отходов в окружающую среду. К концентрату добавляют кремнезем, а затем смесь нагревают в отражательных печах (доменные печи для тонко измельченной руды неудобны) до температуры 1400° С, при которой она плавится.[3] Суммарное уравнение протекающих реакций можно представать в виде:
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2
Cu+1 + 1e– = Cu0 |
Fe+3 + 1e– = Fe+2 | –10 e–
2S-2 – 12e– = 2S+4 |
O2 + 4e– = 2O-2
Большую часть полученной черновой меди очищают электрохимическим методом, отливая из нее аноды, которые затем подвешивают в подкисленном растворе сульфата меди CuSO4, а катоды покрывают листами очищенной меди. В процессе электролиза чистая медь осаждается на катодах, а примеси собираются около анодов в виде анодного шлама, который является ценным источником серебра, золота и других драгоценных металлов. Около 1/3 используемой меди представляет собой вторичную медь, выплавленную из лома. Годовое производство нового металла составляет около 8 млн. т. Лидируют по производству меди Чили (22%), США (20%), СНГ (9%), Канада (7,5%), Китай (7,5%) и Замбия (5%). [2]
Главное применение металла – в качестве проводника электрического тока. Кроме того, медь используется в монетных сплавах, поэтому ее часто называют «монетным металлом». Она также входит в состав традиционных бронзы (сплавы меди с 7–10% олова) и латуни (сплав меди с цинком) и специальных сплавов, таких как монель (сплав никеля с медью). Металлообрабатывающий инструмент из медных сплавов не искрит и может использоваться во взрывоопасных цехах. Сплавы на основе меди служат для изготовления духовых инструментов и колоколов. [4]
Свойства Меди.
В виде простого вещества медь обладает характерной красноватой окраской. Медь металл мягкий и пластичный. По электро- и теплопроводности медь уступает только серебру. Металлическая медь, как и серебро, обладает антибактериальными свойствами.
Медь устойчива в чистом сухом воздухе при комнатной температуре, однако при температуре красного каления образует оксиды. Она реагирует также с серой и галогенами. В атмосфере, содержащей соединения серы, медь покрывается зеленой пленкой основного сульфата. В электрохимическом ряду напряжений медь находится правее водорода, поэтому она практически не взаимодействует с неокисляющими кислотами. Металл растворяется в горячей концентрированной серной кислоте, а также в разбавленной и концентрированной азотной кислоте. Кроме того, медь можно перевести в раствор действием водных растворов цианидов или аммиака:
2Cu + 8Nh4·h3O + O2 = 2[Cu(Nh4)4](OH)2 + 6h3O
В соответствии с положением меди в Периодической системе, ее единственная устойчивая степень окисления должна быть (+I), но это не так. Медь способны принимать более высокие степени окисления, причем наиболее устойчивой, особенно в водных растворах, является степень окисления (+II). В биохимических реакциях переноса электрона, возможно, участвует медь(III). Эта степень окисления редко встречается и очень легко понижается под действием даже слабых восстановителей. Известно несколько соединений меди(+IV).
При нагревании металла на воздухе или в кислороде образуются оксиды меди: желтый или красный Cu2O и черный CuO. Повышение температуры способствует образованию преимущественно оксида меди(I) Cu2O. В лаборатории этот оксид удобно получать восстановлением щелочного раствора соли меди(II) глюкозой, гидразином или гидроксиламином:
2CuSO4 + 2Nh3OH + 4NaOH = Cu2O + N2 + 2Na2SO4 + 5h3O
Эта реакция – основа чувствительного теста Фелинга на сахара и другие восстановители. К испытываемому веществу добавляют раствор соли меди(II) в щелочном растворе. Если вещество является восстановителем, появляется характерный красный осадок. [5]
Поскольку катион Cu+ в водном растворе неустойчив, при действии кислот на Cu2O происходит либо дисмутация, либо комплексообразование:
Cu2O + h3SO4 = Cu + CuSO4 + h3O
Cu2O + 4HCl = 2 H[CuCl2] + h3O
Оксид Cu2O заметно взаимодействует со щелочами. При этом образуется комплекс:
Cu2O + 2NaOH + h3O=2Na[Cu(OH)2]
Для получения оксида меди(II) CuO лучше всего использовать разложение
нитрата или основного карбоната меди(II):
2Cu(NO3)2 = 2CuO + 4NO2 + O2
(CuOH)2CO3 = 2CuO + CO2 + h3O
Оксиды меди не растворимы в воде и не реагируют с ней. Единственный гидроксид меди Cu(OH)2 обычно получают добавлением щелочи к водному раствору соли меди(II). Бледно-голубой осадок гидроксида меди(II), проявляющий амфотерные свойства (способность химических соединений проявлять либо основные, либо кислотные свойства), можно растворить не только в кислотах, но и в концентрированных щелочах. При этом образуются темно-синие растворы, содержащие частицы типа [Cu(OH)4]2– . Гидроксид меди(II) растворяется также в растворе аммиака:
Cu(OH)2 + 4Nh4 h3O = [Cu(Nh4)4](OH)2 + 4h3O
Гидроксид меди(II) термически неустойчив и при нагревании разлагается:
Cu(OH)2 = CuO + h3O
Есть сведения о существовании темно-красного оксида Cu2O3, образующегося при действии K2S2O8 на Cu(OH)2. Он является сильным окислителем, при нагревании до 400° С разлагается на CuO и О2.
Катион меди(II), напротив, в водном растворе вполне устойчив. Соли меди(II), в основном, растворимы в воде. Голубой цвет их растворов связан с образованием иона [Cu(h3O)4]2+ . Они часто кристаллизуются в виде гидратов. Водные растворы в небольшой степени подвержены гидролизу и из них часто осаждаются основные соли. Основный карбонат есть в природе – это минерал малахит, основные сульфаты и хлориды образуются при атмосферной коррозии меди, а основный ацетат (ярь-медянка) используется в качестве пигмента.
Ярь-медянка известна со времен Плиния Старшего (23–79 н.э.). В русских аптеках ее начали получать в начале 17 в. В зависимости от способа получения она может быть зеленого или голубого цвета. Ею были окрашены стены царских палат в Коломенском в Москве.
Наиболее известную простую соль – пентагидрат сульфата меди(II) CuSO4·5h3O – часто называют медным купоросом. Слово купорос, по-видимому, происходит от латинского Cipri Rosa – роза Кипра. В Росси медный купорос называли синим, кипрским, затем турецким. То, что купорос содержит медь, было впервые установлено в 1644 Ван Гельмонтом. В 1848 Р.Глаубер впервые получил медный купорос из меди и серной кислоты. Сульфат меди широко используется в электролитических процессах, при очистке воды, для защиты растений. Он является исходным веществом для получения многих других соединений меди.
mirznanii.com
Медь и ее сплавы
Строительные машины и оборудование, справочник
Категория:
Крановщикам и стропальщикам
Медь и ее сплавыЧто такое медь?
Медь — это вязкий металл светло-розового цвета, легко прокатываемый в листы. Плотность медн 8,92 г/см3, температура плавления 1083° G. Медь — очень хороший проводник тепла и электричества, уступает в этом отношении только серебру. В сухом воздухе медь почти не изменяется, но в присутствии влаги и двуокиси углерода поверхность меди покрывается зеленоватым налетом. Благодаря высокой тепло- и электропроводимости, ковкости, хорошим литейным качествам, большому сопротивлению на разрыв и стойкости к коррозии медь широко используется в промышленности.
Огромные количества чистой электролитической меди идут на изготовление электрических проводов и кабелей.
В машиностроительной промышленности, в электротехнике и в других производствах широко применяются различные сплавы, содержащие медь в комбинации с другими металлами.
На какие марки подразделяется медь?
В зависимости от содержания примесей медь поГОСТ 859—41 подразделяется на пять марок: МО, Ml, М2, МЗ, М4. Медь марки МО предназначается для проводников тока и сплавов высокой чистоты, общее количество примесей в ней не должно превышать 0,05% v так как даже незначительное количество примесей сильно понижает электропроводимость меди, а это ведет к бесполезной трате электроэнергии при передаче ее по проводам.
Медь марки М4 содержит наибольшее количество примесей (1%), она в основнном идет на сплавы н для паяния.
Что такое бронза?
Бронза —это сплав меди со свинцом, оловом, никелем или другим металлом, кроме цинка. Бронзы различаются между собой по содержанию в них основного легирующего элемента. Бронзы обладают высокими антикоррозийными и антифрикционными свойствами, поэтому широко используются для изготовления вкладышей подшипников скольжения, винтовых и червячных колес и т, п.
Как маркируются бронзы?
Бронзы маркируются буквами и цифрами. Буквы Бр означают, что сплав бронзовый, далее стоящие буквы т название основные элементов, которые входят в состав сплава, а цифры, стоящие за буквами,— их процентное содержание в бронзе.
Например, Бр ОФ5—3 — оловянисто-фосфористая бронза, содержащая 5% олова и 3% фосфора.
Что такое латунь?
Латунь — это сплав меди с цинком. Латуни бывают двойные и сложные. Двойные латуни — это сплав меди с цинком, а в сложных латунях кроме меди и цинка содержатся другие элементы — свинец, марганец, алюминий, кремний, железо, олово, никель.
Температура плавления латуни 800—1099 °С. Она обладает хорошими антифрикционными свойствами, электропроводностью и сопротивлением коррозии, поэтому широко применяется для изготовления деталей электрической аппаратуры, электромашин, арматуры и т. д. Латунь, так же как и бронза, обозначается буквами и цифрами. Например: Л063—3 — латунь с содержанием 63% меди и 3% олова, остальное цинк.
Читать далее: Алюминий
Категория: - Крановщикам и стропальщикам
Главная → Справочник → Статьи → Форум
stroy-technics.ru