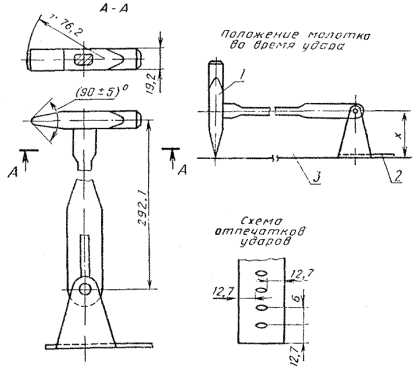
Большая Энциклопедия Нефти и Газа. При какой температуре плавится соль
Плотность солей. Температура плавления соли
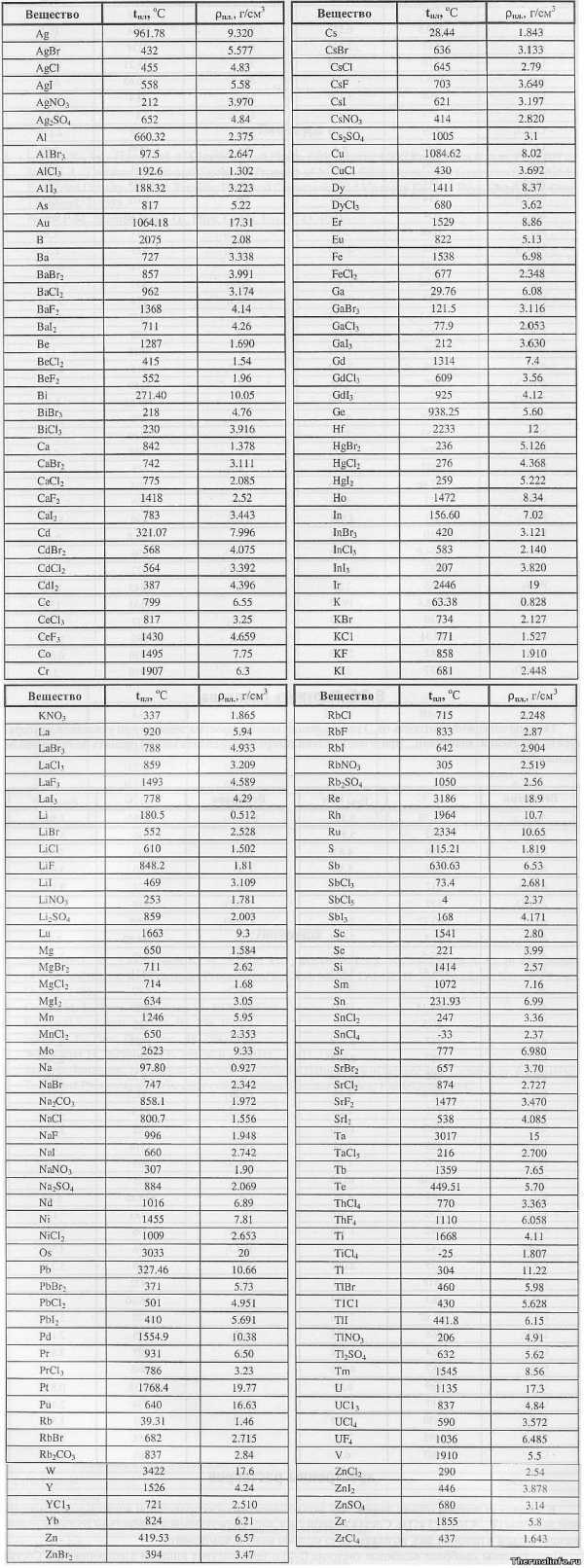
В таблице представлена плотность расплава солей (жидкой соли) и элементов, образующих эти соли, а также их температура плавления. Плотность соли дана при температуре расплава, в размерности г/см3.
Рассмотрены следующие соли: бромид, хлорид, йодид, нитрат, сульфат, фторид, карбонат; соли следующих металлов: серебра, алюминия, мышьяка, золота, бора, бария, бериллия, висмута, кальция, кадмия, церия, кобальта, хрома, цезия, меди, диспрозия, эрбия, европия, железа, галлия, гадолиния, германия, гафния, ртути, гольмия, индия, иридия, калия, лантана, лития, лютеция, магния, марганца, молибдена, натрия, неодима, никеля, осмия, свинца, палладия, празеодима, платины, плутония, рубидия, рения, родия, рутения, сурьмы, скандия, селена, самария, олова, стронция, тантала, тербия, теллура, тория, титана, таллия, тулия, урана, ванадия, вольфрама, иттрия, иттербия, цинка, циркония.
Следует отметить, что наибольшей плотностью обладают жидкие соли таких тяжелых металлов, как свинец и уран. Например, плотность расплавов солей йодида свинца PbI2, по данным таблицы, равна 5,691 г/см3, а плотность тетрафторида урана UF4 составляет величину 6,485 г/см3. К легким солям, с малой плотностью относятся соли алюминия, бериллия, лития, калия и циркония.
Плотность большинства солей в жидком состоянии меньше, чем в твердом. Это объясняется увеличением объема соли при нагревании. Например, плотность поваренной соли NaCl в кристаллическом состоянии при комнатной температуре равна 2,17 г/см3, а плотность жидкого хлорида натрия (при температуре 801°С) уменьшается и становится равной 1,556 г/см3.
Наименьшая температура плавления соли в таблице соответствует хлориду олова SnCl4 — он плавится при температуре минус 33°С, то есть при комнатной температуре находится в жидком состоянии и на воздухе дымит из-за реакции с парами воды.
Самой тугоплавкой солью с максимальной температурой плавления, по данным таблицы, является фторид лантана LaF3 — фтористый лантан плавится при температуре 1493°С.
 Источник:Волков. А.И., Жарский. И.М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
Источник:Волков. А.И., Жарский. И.М. Большой химический справочник. — М: Советская школа, 2005. — 608 с.
thermalinfo.ru
Температура - плавление - соль
Температура - плавление - соль
Cтраница 1
Температура плавления солей NaCl, KC1, RbCl и CsCl равна соответственно 800, 780, 715 и 646 С. [1]
Тал - температура плавления соли. [2]
Так как температура плавления соли несколько изменяется в зависимости от скорости нагревания, определение ее не имеет особого значения. [3]
Однако обычно температура плавления соли намного выше температуры плавления растворителя, иногда выше его температуры кипения и даже критической. [5]
Рассмотрение политермы до температуры плавления солей чаще всего неоправдано и не позволяет изобразить политерму в удобном масштабе. [6]
Одинаковыми оказались и температуры плавления солей синтетического и нефтяного ампно-продуктов. Но в отличие от метилциклопентана, цпклогек-сан Марковниковым выделен из фракции в более или менее чистом виде. Из нефтяного цнклогексана были получены различные производные, свойства которых идентичны свойствам соответствующих продуктов, полученных из синтетического циклогексана. [7]
Точка В соответствует температуре плавления соли. При добавлении воды температура плавления AgNO3 понижается до точки К. Линия ВК характеризует равновесие растворов различной концентрации ( при содержании AgNO3 более 47 1 %) с кристаллами AgNO3 при определенных температурах. Ее обычно называют кривой ( или ветвью) растворимости соли. [8]
В присутствии следов влаги температура плавления соли понижается. Здесь и далее под теплотой образования из элементов понимается теплота образования из про. [10]
Весьма большое влияние на температуру плавления солей оказывает и взаимная поляризация ионов. [12]
Температура первой стадии может быть выше температуры плавления соли. Вторую же стадию проводят при температуре, которая лежит ниже температуры плавления полимера. [13]
В табл. 13.1 - 13.5 приведены температуры плавления наиболее употребительных солей и данные об их плотности, электропроводности, вязкости и поверхностном натяжении в расплавленном состоянии. [14]
В литературе не указаны выход и температура плавления оксалатной соли гуанилтиомочевины. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Соли, плавление - Справочник химика 21
Температуры плавления и кипения солей [c.37]Температуры плавления п кипения солей и образующих их элементов [c.38]
Щелочи, селитра и другие соли (плавление) 30-35 [c.104]
В табл. 55 дана сравнительная характеристика жидких металлов, воды, дифенильной смеси и расплава солей. Весьма эффективным теплоносителем с точки зрения значений коэффициента теплоотдачи, температуры плавления и кипения, удельной теплоемкости, а также стоимости перекачки является натрий. Недостатком натрия является высокая активность по отношению к кислороду. Он является очень опасным горючим и взрывчатым веществом. [c.329]
По литературным данным [21], температура плавления этого нитросоединеиия равна 117,5—118,5° оио трудно растворимо в холодном спирте, легко в бензоле, растворяется в щелочах, образовывая соли ациформ с красным окрашиванием. [c.81]Огнепреградители подлежат замене после 50 случаев взрывного распада ацетилена. Для орошения насадки следует применять воду или морозоустойчивые растворы, для приготовления которых применяют этиленгликоль концентрированный (ГОСТ 6367—52), глицерин сырой (ГОСТ 6823—54), глицерин дистиллированный (ГОСТ 6824—54), поваренную (хлористый натрий), пищевую и техническую соль, кальций хлористый плавленый или обезвоженный (ГОСТ 450—70). [c.36]
Диапазон температур, при которых можно применять расплавы для нагрева, т. е. диапазон температур, в котором при повыщении температуры не наступает разложения, лежит в пределах для расплава I 200—450° С, для расплава II 200—540° С. При нагреве сверх указанных температур соли постепенно разлагаются, и температура плавления расплава при этом повышается. Температуры 21 32а [c.323]
Электропроводность расплавленных солей, как правило, с температурой увеличивается (исключение составляют соли ртути, индия и некоторые другие). Особенно быстро увеличивается электропроводность при температурах, незначительно превышающих температуры плавления. [c.452]
В виде кристаллогидратов могут кристаллизоваться не только индивидуальные соли, например АХ лНаО, но и химические соединения двух солей с одноименным ионом, которые можно записать р АХ)-р ВХ) г Н20). Если объемную треугольную диаграмму подобной системы пересечь плоскостью, соответствующей температуре более низкой, чем точки плавления индивидуальных [c.432]
Расплавленные соли и окислы во многом похожи на кристаллические ионные решетки, из которых они образуются при плавлении. В расплавах сохраняется квазикристаллический порядок чередования ионов разного знака этот порядок лишь незначительно нарушается тепловым движением ионов. Очевидно, что в расплаве при температурах, близких к температурам плавления, имеются в относительно свободном состоянии те же ионы, которые характерны для соли в кристаллическом состоянии. Например, в расплаве криолита есть ноны A Fg" и Ыа+ АЬОа, растворенны.й в жидком кри- [c.450]
Основная масса консистентных смазок получается на кальциевых, натриевых, алюминиевых и литиевых мылах. Соли некоторых металлов позволяют получать смазки с высокой температурой плавления и хорошей пластичностью при низких температурах (литий), других — с высокой температурой плавления и водоустойчивостью (кальций). Ассортимент смазок, вырабатываемых в СССР, весьма велик многие из них взаимозаменяемы. [c.146]
Семикарбазоны метилкетонов имеют наивысшую температуру плавления и труднее всех растворяются в органических растворителях. Семикарбазоны кетонов, у которых кетогруппы расположены ближе к середине цепи, растворяются гораздо легче. Поэтому семикарбазон метилкетО На, находяпгегося в смеси с другими изомерами, можно легко выделить в чистом виде кристаллизацией, все другие изомеры остаются в маточном растворе. Следовательно, селективность проявляется дважды первый раз при реакции с семикарбазидом и второй раз при перекристаллизации. Если проследить за выходами, сраэу будут заметны значительные потери. К тому же еще обнаружилось, что если заместитель находится в положении 2, растворимости натриевых солей алкилсульфатов и алкилсульфонатов в органических растворителях чрезвычайно малы, в то время как другие изомеры растворяются относительно легко. Так, из смеси различных изомерных алкилсульфатов или алкилсульфо-катов можно экстрагировать хлороформом, метилэтилкетоном или амиловым спиртом все изомеры, кроме 2-алкилсульфата или 2-алкилсуль-фоната, которые остаются нерастворимыми [84]. Алкилсульфонаты, у которых гидрофильная группа находится у второго атома углерода, негигроскопичны другие же изомеры сильно притягивают влагу и на воздухе расплываются. [c.567]
Ионы. Ионизация, катионы и анионы. Окисление и восстановление. Простые и комплексные ионы. Координационное число. Температуры плавления и кипения солей. [c.13]
Хлористая платина образовывала с ним двойную платиновую соль, желтокрасного цвета с температурой плавления 93°. [c.161]
Кристалл соли представляет собой наиболее устойчивое образование из положительных и отрицательных зарядов, в котором ион каждого типа как можно дальше удален от других ионов с зарядами такого же знака. Расплавить соль - это значит расстроить такое идеальное расположение зарядов и позволить взаимно отталкивающимся ионам время от времени сближаться друг с другом, когда они перемещаются один возле другого. Для того чтобы разрушить устойчивую структуру ионного кристалла, необходимо затратить достаточно большую энергию, и поэтому температуры плавления солей значительно выше, чем у молекулярных кристаллов. [c.37]
Соли имеют более высокие температуры плавления и кипения, чем молекулярные вещества, потому что для разрущения их устойчивой кристаллической решетки необходима большая тепловая энергия еще большая тепловая энергия требуется для того, чтобы заставить положительные и отрицательные ионы обобществить свои электроны и объединиться в нейтральные молекулы, способные перейти в газовую фазу. Однако многие соли хорошо растворяются в воде, поскольку притяжение со стороны полярных молекул воды позволяет компенсировать притяжение между ионами кристалла. Ионы, окруженные в растворе полярными молекулами воды, называются гидратированными. Бензин и другие неполярные жидкости неспособны растворять соли, поскольку они не гидратируют ионы (точнее, не сольватируют их, так как в этом случае растворителем является не вода). [c.54]
В обычный запаянный с одного конца капилляр диаметром около 1 мм вносят необходимое количество жидкости с помощью другого более узкого капилляра диаметром 0,3—0,4 мм. Затем более узкий капилляр оплавляют и используют его для перемешивания жидкости в процессе кристаллизации, если она склонна к переохлаждению. Охлаждающая баня должна иметь температуру на 10—15 °С ниже температуры застывания жидкости. В связи с этим, для охлаждения применяют либо смесь льда и соли, либо ацетон и сухой лед . В охлаждающую баню помещают прибор для определения температуры плавлен ния с пустой внутренней пробиркой (рис. 91), в колбу которого наливают спирт или ацетон. Прибор снабжают спиртовым или толуоловым термометром. После того как прибор охладится до нужной темпе ратуры, к термометру прикрепляют охлажденный в той же бане капилляр с закристаллизовавшейся жидкостью и проводят определение температуры плавления обычным образом. Если скорость подъема температуры недостаточна, колбу обогревают струей теплого воздуха или рукой, если слишком высока — изолируют колбу ватой, оставив окошко для наблю дения. [c.180]
Благодаря наличию в форме Б избытка структурных пустот сравнительно (с иодом) маленькие ионы Ag+ способны легко перемещаться по кристаллу. Этим обусловлена ее очень высокая электропроводность. Последняя приблизительно в два раза больше, чем у максимально электропровод п>1х водных растворов и вблизи точки перехода почти в 4000 раз превосходит электропроводность устойчивой при обычных условиях формы Agi, Интересно также, что электропроводность твердого Agi при температуре плаиления (5,58 С) даже несколько б о, i i> hi е, чем расплавленного, тогда как по1 кги у всех остальных солей плавление сопровождается рез- [c.55]
Динитропарафины можио получить в лаборатории и путем окисления псевдонитролов, которые могут быть синтезированы при действии четырехокиси азота на оксимы [197]. Вицинальнозамещенные динитропарафины можно получить также действием окислителей на натриевые соли нитроалканов. Так, например, при действии персульфата натрия на натриевую соль 2-нитропропана образуется с 53%-ным выходом 2,3-динитро-2,3-диметилбутан с точкой плавления 209—210° [198]. [c.340]
Ионные гидриды представляют собой белые кристаллические вещества с высокими температурами плавления, т. е. соли. Их расплавы характеризуются высокой электрической проводимостью, при электролизе расплавленных гидридов водород выделяется на аноде. Гидриды 5-элементов 1 группы, как и большинство галидов этих элементов, имеют структуру типа Na l. В химическом отношении ионные гидриды ведут себя как основные соединения, [c.276]
Резервуар 2 предназначен не только для хранения расплава солей, но является также сосудом, в котором расплав приготовляется. Кроме того, он может использоваться в качестве ре-зервиого сосуда для приема циркулирующего горячего расплава. Для разогрева расплава до температуры плавления, равной около 140° С, в резервуаре монтируется греющий змеевик, в который подается насыщенный пар с давлением не менее 10 ати. [c.325]
Вместо Na l можно использовать NaHSOg — побочный продукт получения фенола и нафтола щелочным плавлением солей натрия соответствующих сульфокислот [c.326]
После обработки солью сульфонат натрия выпадает в осадок (при перемешивании и охлаждении в течение около 10 ч), после чего его отделяют при помощи прессфильтра при этом образуется лепешка, содержащая около 70% воды. Дальнейшим прессованием в гидравлических прессах содержание воды в продукте можно снизить до 30%, что позволяет выделить Р-нафтол методом щелочного плавления. [c.328]
Послсдовательноеть выполнения работы. Измерение температурт при работе с солевыми пли металлическими сплавами производится обычно ири помощи термопары, присоединенной к гальванометру или включенной в компенсационную схему. Исследуемую смесь солей или металлов поместить в фарфоровый тигель. Тигель поставить в электрическую печь, включить ее и расплавить смесь, стараясь не перегревать ее выше температуры плавления. Перемешать сплав, вык-лючтгть печь и опустить в сплав горячий спай термопары. Закрепить термопару в штативе. Конец термопары должен находиться в расплаве, почти у дна тигля, и не касаться стенок тигля. [c.237]
Собрать установку по схеме, приЕ еденной на рнс. 111. Опустить холодные конц[)1 термопары в тающий лед, компенсировать э. д. с. элемента Вестона и приступить к измерениям, начиная нх с калибрования термопары. Взять пробирку с KNOy, погрузить в нее термопару. Пробирку закрепить в штативе и опустить в тигельную печь, пе касаясь дна и стенок последней. Печь включить на разогрев. После расплавления твердой фазы пробирку сле дует закрыть асбестом для равномерного охлаждения, печь выключить и при помощи магазина сопротивления (положение ползунка на реостате не изменять) подобрать такое сопротивление, чтобы максимальная температура опыта (температура плавления KNO ) отвечала точке компенсации на реохорде порядка 80—90 делений. Дальнейшие измерения производить через 15—30 сек. Один из работающих отмечает время но секундомеру, другой компенсирует и записывает показания на реохорде. После температурной остановки, отвечаюндей кристаллизации соли (в это время точка компенсации не изменяется), произвести еп е пять-шесть измерений, затем пробирку вынуть и также произвести измерения с пробирками 4 и 7. [c.239]
Температура плавления отложений поташа составляет 981°С. Накопление солей внутри пирозмеевиков, в порах металла и сварных швов и последующий их расплав при температуре плавления, приводит к интенсивному повреждению защитной иленки поверхности металла и вызывает усиленную язвенную коррозию. Кроме того, дендритная структура стали 45Х25Н20С2 в таком состоянии слабо сопротивляется днффу- [c.167]
Термическая обработка покрытия рекомендуется для повьиие-ния его твердости и заключается в пагреве детали в масле, парафине или расплаве солей азотнокислого патрия и калия в течение нескольких минут при температуре, близкой к температуре плавления пластмассы. [c.176]
chem21.info
какую можно достичь наи-низчайшую температуру водно-солевого раствора обычной (поваренной, NaCl) соли
Благодаря добавлению соли в воду скорость таяния льда увеличивается, а температура таяния льда опускается ниже. Это объясняется тем, что добавление соли вызывает ослабление молекулярного сцепления и разрушение кристаллических решеток льда. Таяние льдосоляной смеси протекает с отбором теплоты от окружающей среды, в результате чего окружающий воздух охлаждается и температура его понижается. С повышением содержания соли в льдосоляной смеси температура плавления ее понижается. Раствор соли с самой низкой температурой таяния называется эвтектическим, а температура его таяния — криогидратной точкой. Криогидратная точка для льдосоляной смеси с поваренной солью -21,2°С, при концентрации соли в растворе 23,1% по отношению к общей массе смеси, что примерно равно 30 кг соли на 100 кг льда. При дальнейшем повышении концентрации соли происходит не понижение температуры таяния льдосоляной смеси, а повышение температуры таяния (при 25%-ной концентрации соли в растворе к общей массе температура таяния повышается до -8°С).<br>При замораживании водного раствора поваренной соли в концентрации, соответствующей криогидратной точке, получается однородная смесь кристаллов льда и соли, которая называется эвтектическим твердым раствором.<br>Температура плавления эвтектического твердого раствора поваренной соли —21,2°С, а теплота плавления - 236 кДж/кг. Эвтектический раствор применяют для зероторного охлаждения. Для этого в зероты — наглухо запаянные формы — заливают эвтектический раствор поваренной соли и замораживают их. Замороженные зероты используют для охлаждения прилавков, шкафов, охлаждаемых переносных сумок-холодильников и т. д. (откройте морозилку бытового холодильника - найдете такой контейнер).В торговле льдосоляное охлаждение широко применялось до массового выпуска оборудования с машинным способом охлаждения.<br><br>
самая низкая температура из любой температуры - абсольтный ноль, около - 273 градуса цельсия
температура зависит от концентрации соли в растворе, чем больше концентрация, тем ниже температура замерзания.Точных цифр не скажу, т.к. справочник у меня на время отобрали)) но если исходить из того, что морская вода-это солевой раствор, то можно сделать вывод, что температура замерзания гараздо ниже нуля....градусов -15-20
22,4 %-ный водный раствор NaClзамерзает при 21,2 °С Ответ <a rel="nofollow" href="http://www.google.com.ua/" target="_blank">http://www.google.com.ua/</a> на вопрос Водный раствор NaCl "температура кристаллизации"
Таблица 10.8. Температура замерзания раствора NaCl Содержание NaCl, г в 100 г воды Температура замерзания, ºС 1,5 - —0,9 3,0 - — 1,8 4,5 - —2,6 5,9 - —3,5 7,5 - —4,4 9,0 - —5,4 10,6 - —6,4 12,3 - —7,5 14,0 - —8,6 15,7 - —9,8 17,5 - —11,0 19,3 - — 12,2 21,2 - —13,6 23,1 - — 15,1 25,0 - — 16,0 26,9 - —18,2 29,0 - —20,0 30,1 - —21,2
touch.otvet.mail.ru
Температура - плавление - соль
Температура - плавление - соль
Cтраница 3
Растворимость всех исследованных солей в углеводородных растворителях ( изооктане и циклогексане) растет с повышением температуры и при температурах, близких к температурам плавления солей, растворимость их становится безграничной. Поэтому высокоплавкие бариевые и калиевые соли при обыкновенных температурах обладают очень малой растворимостью, а никелевые соли, имеющие низкие температуры плавления, весьма высокой. Так, растворимость ди-к-бутилдитиофосфата бария ( температура плавления 136 0 - 138 0), диизоамилдитиофосфата бария ( температура плавления 179 0 - 180) ди-к-октадецилдитиофосфата бария ( температура плавления 99 0 - 100) и ди-к-октадецилдитиофосфата калия ( температура плавления 165 0 - 167 0) при температурах до 35 не превышает 0 2 ммоля / iOO г растворителя. [31]
Для полной характеристики взаимной системы строят политерму растворимости, представляющую совокупность изотерм для всего интервала температур - от эвтектической температуры замерзания раствора ло температур плавления солей. Для практических целей ограничиваются треб уемым интервалом температур. [32]
Для полной характеристики системы строят политермную диаграмму растворимости, представляющую совокупность изотермических диаграмм для всего интервала температур - от эвтектической температуры замерзания раствора до температур плавления солей. Для практических целей ограничиваются интервалом температур, отвечающих условиям изучаемого процесса. [34]
Коэффициент избытка воздуха а принимается при работе на мазуте 1 1 - 1 15, а температура газов за циклоном на 50 - 100 град выше температуры плавления солей. Величина температуры газов за циклоном проверена не только на легкоплавких солях ( Na2SO4, NaCl и др.), но и при разложении CaFs SiOa с температурой плавления - 1500 С или при обесфторивании природных фосфатов. [35]
Необходимо иметь в виду, что объемная диаграмма состояния трехкомпонентной системы соль - соль - вода во многих случаях не может быть доведена до температур плавления всех трех компонентов, поскольку температура плавления солей часто превышает критическую температуру воды и, кроме того, многие соли при нагревании разлагаются раньше, чем достигается температура их плавления. [37]
Что касается изменения температуры плавления внутри ряда однотипных ионных солей, то в силу того, что плавление их сопряжено с ослаблением связи между ионами и увеличением расстояния между ними, температура плавления солей любого заданного аниона при отсутствии поляризационных взаимодействий ионов в кристалле должна была бы по мере уменьшения радиуса катиона закономерно возрастать. Однако влияние различной поляризующей активности катиона, обусловленной различной величиной его радиуса, вносит изменение в эту закономерность. Однако по тому же ряду быстро усиливается поляризующее действие катионов. [38]
Вместе с тем скорость растворения солей зависит и от других факторов, в частности и от температуры их плавления ( табл. 1а), а именно: чем больше энергия кристаллической решетки, чем выше температура плавления соли, тем меньше скорость ее растворения. Но она зависит также от присутствующих в растворе других компонентов, от природы и концентрации посторонних электролитов. [39]
Перренат каяия образует небольшие безводные тетра-гонально-бипирамидальные кристаллы, которые можно расплавить ( около 550) и даже нагреть до температуры возгонки без разложения. Температура плавления соли равна 552 3 ( испр. Выше 600 у соли появляется отчетливое давление пара и она заметно теряет в весе. [40]
Изомеризация в присутствии триметиламина идет через образование соли [ ( CHghNHHBsHT-CsHs ] -, плавящейся при 22 С. Ниже температуры плавления соли изомеризация е идет даже при длительном хранении. [41]
В расплавленных солях и свинце общий коэффициент теплоотдачи зависит не только от лучеиспускания и конвекции, но и от теплопроводности жидкой среды. При температурах плавления солей общий коэффициент теплоотдачи мало зависит от рода соли и составляет 220 ккал / м2 час град. [42]
По их данным, температура плавления соли составляет 82 С. Две конечные стадии разложения быстро следуют одна за другой при 262 и 264 С. Мэрвин и Вулавер7 также нашли, что конечным продуктом распада является окись алюминия. [43]
Осадок, представляющий собой смесь триэтиламиновой соли циклогексилсульфаминовой кислоты и хлоргидрата триэтиламина, отфильтровывают, чтобы облегчить упаривание хлороформного раствора. В литературе не указана температура плавления триэтиламиновой соли циклогек-силсульфаминовон кислоты. По внешнему виду это бесцветные пластинки, растворимые в воде и спирте. [44]
По мере приближения к температуре плавления соли или солевой системы растворимость воды в солях сначала растет, а затем падает до нуля. В соответствии с этим проходит через максимум, и потом спускается до нуля и давление газообразной воды, равновесной с насыщенным раствором. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
Урок 8. Строение солей – HIMI4KA
В уроке 8 «Строение солей» из курса «Химия для чайников» выясним что такое соль, а также что из себя представляет кристаллическая решетка соли; рассмотрим как происходит плавление, кипение и испарение солей. Основы химии, которые необходимы для изучения строения солей, подробно изложены в предыдущих уроках: «простые ионы» и «комплексные ионы». Обязательно их просмотрите, если вы этого еще не сделали.

Что такое соль?
Соль — это химическое соединение из отрицательных и положительных ионов. Попробуем образовать соль из иона олова(II) Sn2+ с хлорид-иона Cl—. Поскольку любая соль должно быть электрически нейтральным соединением, то суммарный заряд всех ее положительных и отрицательных ионов должен быть равным нулю. Поэтому соль, состоящая из ионов Sn2+ и Cl—, должна иметь молекулярную формулу SnCl2, а не SnCl или SnCl3. Это соединение называется хлорид олова(II). В случае с четырехвалентным ионом олова Sn4+, соединение имело бы вид SnCl4. Все просто!
Строго говоря, нельзя употреблять термины «молекулярная формула и молекулярная масса» соли, поскольку в солях нет молекул, а имеются только упорядоченные решетки, состоящие из ионов. Ни один из ионов натрия в структуре хлорида натрия, не «принадлежит» какому-либо конкретному хлорид-иону. Правильно говорить о химической формуле соли и соответствующей ей формульной массе. Поскольку химическая формула хлорида натрия — NaCl, то его формульная масса определяется как сумма атомных масс одного атома натрия Na и одного атома хлора Cl:
1 атом натрия: 22,990 а.е.м.
1 атом хлора: 35,453 а.е.м.
Итого: 58,443 а.е.м
Принято называть эту величину «молекулярной массой» хлорида натрия, и не возникает никаких недоразумений, если ясно отдавать себе отчет, какую структуру имеет соль. Моль хлорида натрия имеет массу 58,443 г. В нем содержится 6,022·1023 ионов натрия и 6,022·1023 хлорид-ионов. Хотя они и не объединены попарно в молекулы, соотношение между числом тех и других ионов точно 1:1.
Кристалл соли представляет собой устойчивое образование из катионов и анионов, в котором ион каждого типа как можно дальше удален от других ионов с зарядом такого же знака.
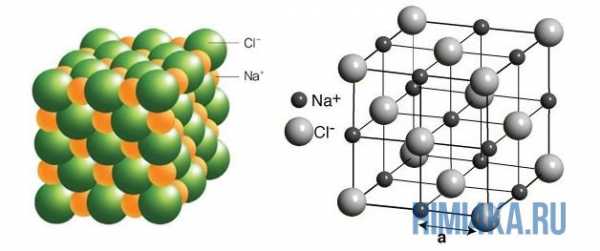
Если к кристаллу соли подвести БОЛЬШОЕ количество энергии, то можно разрушить такое идеальное расположение ионов в кристаллической решетке соли и позволить взаимно отталкивающимся зарядам приблизиться друг к другу на некоторый промежуток времени, тем самым разрушив устойчивую структуру кристалла. Как мы уже отметили, сообщаемая кристаллу соли энергия должна быть достаточно большой, по этой причине плавление солей происходит при бОльших температурах, чем у молекулярных кристаллов (например, лед).
Плавление, кипение и испарение солей
Ниже приведены температуры плавления и кипения солей, NaCl и K2SO4, а также их составляющих. Металлический натрий плавится при +97,8ºC, а кристаллический хлор имеет температуру плавления -101ºC, однако соль NaCl, которые они образуют, нужно нагреть до температуры плавления +801ºC.
Кипение и испарение соли происходит при еще гораздо больших температурах. В расплавленном кристалле соли ионы остаются такими же, но ведут себя как молекулы в жидкости, т.е свободно проскальзывают мимо друг друга. В случае когда соль переходит в газообразное состояние, положительные ионы Na+ и отрицательные ионы Cl— объединяются в нейтральные молекулы NaCl с полярной связью.
Надеюсь урок 8 «Строение солей» помог создать некоторое представление о солях. Если у вас возникли вопросы, пишите их в комментарии.
himi4ka.ru
Почему когда снег посыпают солью он тает даже при отрицательной температуре
Обратимся к физике и химии. В свойствах смесей есть еще одна интересная закономерность: температура плавления смеси нескольких веществ всегда ниже, чем температура плавления каждого из чистых веществ по отдельности. Так для нашего случая, температура плавления чистой воды (в виде льда или снега) 0 оС. Если внести в лед примесь поваренной соли, то лед начинает плавиться при более низких - минусовых температурах. Температура плавления зависит от соотношения льда и соли, скорости перемешивания и даже степени измельчения льда. Таким образом посыпав лед (стабильный при температуре ниже нуля) , солью получаем пограничный слой, в котором смесь льда и соли начинает плавится. Потому что температура замерзания этого слоя ниже. В результате образуется пленка из водного раствора соли, что увеличивает площадь соприкосновения соли со льдом, пока весь лед не растопится, отобрав энергию у воздуха. По этой же причине (отбирании телпа на растопление) стоять на солевой каше холоднее, чем просто на льду. Теперь то же самое человеческим языком. :) Грубо говоря добавляя соль мы меняем характеристику льда (а точнее полученной смеси) . Если на улице -10 чистая вода замерзает в лед без вопросов, потому что её точка замерзания 0. Солевой раствор воды определенной концентрации замерзает скажем при -20. Таким образом добавив соль получаем, что -10 недостаточная температура для замерзания этой смеси и она тает. ВладейМИРОМ, при растворении соли в воде химических реакций не происходит. Она просто растворяется. Новых веществ не образуется.
Точка замерзания соляного расствора, ниже точки замерзания воды.
<a rel="nofollow" href="http://ru.wikipedia.org/wiki/Закон_Рауля" target="_blank" >2-ой закон Рауля</a>
h3O вступает в реакцию. c NaCl....и продукт этой реакции не замерзает..
touch.otvet.mail.ru