Где можно достать медь для сдачи в металлолом. Как сделать медь тяжелее
Как получить медь в домашних условиях — Elfterra.ru
Содержание статьи:

Одним из самых дорогостоящих и распространенных металлов в бытовой электронике является медь. Именно этот металл больше остальных привлекает внимание сборщиков лома, из-за своей дороговизны и широкому применению благодаря своим свойствам.
К примеру, старый ламповый телевизор может содержать медных деталей общим весом до 1,5 кг. Хуже обстоят дела с новыми моделями полупроводниковых телевизоров, однако и в них можно насобирать до 0,5 кг меди. Еще хорошим содержанием медных обмоток и запчастей отличаются компрессионные холодильники и электродвигатели, содержание меди в которых достигает 1 кг. Но зачастую медные детали в них находятся внутри алюминиевого или того хуже чугунного корпуса, что предполагает использования «болгарки» и значительно затрудняет добычу медного лома.
Можно достать медь для сдачи в металлолом и в таких прибора как: трансформаторы, стартеры, реле, магнитные пускатели, арматура люминесцентных ламп. Выход чистого металла в этих деталях не слишком велик, но благодаря их широкой распространенности и повсеместному применению относятся к довольно привлекательным источникам цветного лома.
Для оптимизации сбора металлолома необходимо выработать алгоритм сбора медносодержащих приборов, их доставки до места разбора, самого разбора и естественно сдачи в пункт приема. К основным источникам медного лома можно отнести свалки, строительные площадки и заброшенные трансформаторные будки. Местом разбора и хранения может послужить гараж. Можно конечно проводить разбор непосредственно на месте, но для этого придется постоянно иметь при себе весь необходимый инструмент, поэтому такой вариант подойдет только при наличии автомобиля.
Достать медь для сдачи в металлолом это еще половина дела. Самое важное это выгодно продать добытый металл. В течение года цены на лом цветных металлов могут сильно колебаться и поскольку лето это основной сезон добычи меди, сдавать ее в этот период крайне не желательно. Лучше хранить добытую медь до зимы и ждать повышения цены приема, так можно более выгодно сдать медь в металлолом.
Меднение – это процесс нанесения меди гальваническим способом. С помощью меднения можно восстановить дефекты поверхности, и придать предмету свойство искробезопасности. Так как медь является мягким металлом, она легко деформируется при ударе, не образуя искру. Меднение может быть использовано как подготовительный процесс, перед другим гальваническими процессами, такими как никелирование и хромирование. Во время процесса омеднения, медь очень хорошо «прилипает» к стальным деталям, защищая их от коррозии. Таким образом она создает защитный слой, который не дает окисляться металлу в процессе гальванического покрытия и эксплуатации в «тяжелых» условиях. Омедненный ключ не будет покрываться ржавчиной при работе с морской водой, если слой меди будет покрывать всю площадь ключа. Часто используют меднение в домашних условиях, что бы восстановить какие-либо детали, которые потеряли приемлемый внешний вид или износились со временем.
На крупных предприятиях, можно повстречать огромные промышленные гальванические ванны. Как правило, они автоматизированы и в них используются высококонцентрированные кислоты, для утилизации которых требуется специальная лицензия. Процесс меднения на таких предприятиях доступен только для нужд самого предприятия, и заказать меднение детали у них не получится, либо будет стоить огромных денег и придется столкнуться с «бюрократической машиной». Но не расстраивайтесь, до читая эту статью, Вы с легкостью сможете создать свою гальваническую линию и наладить домашнее меднение.
Сам процесс домашнего меднения разделим на пункты, для соблюдения последовательности:
1. Нужно обезжирить поверхность.Для этого, воспользуемся обычной домашней содой. 2 столовые ложки соды на стакан воды будет достаточно. Погружаем деталь в раствор на 3-5 минут, далее промываем под струей воды.
2. Подготавливаем «гальваническую ванну». Подойдет и обычная стеклянная банка нужного размера (не стоит брать большие объемы, так как расход кислоты будет слишком большой, достаточно чтобы предмет и аноды полностью были погружены в кислоту). В принципе, тут подойдет любая емкость, которая выдержит взаимодействия с кислотой.
3. В «гальваническую ванну»погружается 2 медные пластины закрепленные на медной проволоке, они же аноды.Таким же образом закрепляем саму омедняемую деталь на другой проволоке, и вывешиваем между анодами. Подвешивать удобнее всего на деревянную палочку.
4. Провод (медная проволока) от анодов подключается к «плюсу», а омедняемая деталь к «минусу» источника тока.
5. Нам потребуется включить в электрическую цепь реостат для регулирования силы тока, и амперметр. Источником тока может быть простой автомобильный аккумулятор.
6. Заливаем электролит. Важно, чтобы электролит полностью закрыл поверхность анодов и область детали которую мы пытаемся омеднить. Будьте осторожны при обращении с электролитом, не допускайте попадание на открытые участки тела. Помните, электролит с легкостью прожигает синтетическую одежду!
В состав электролита для меднения входят:
— Кислота серная – 40 г .
— Сернокислая медь (медный купорос)– 190 г .
— Вода дистиллированная 1000 г .
Соблюдая пропорции, можно получить любой объем электролита.
Все эти компоненты легко достать в магазинах. За дистиллированной водой и серной кислотой идем в магазин авто запчастей, которые торгуют аккумуляторами. А медный купорос можно приобрести в садоводческих магазинах или рынках.
7. Приступим к самому процесс у домашнего меднения. Проверяем, что бы провода были верно подключены (аноды +, деталь — ) и подаем ток в цепь. Силу тока не следует делать большой, что бы избежать фольгирования покрытия. Достаточно установить 10-15 мА на квадратный сантиметр покрываемой поверхности. Минимальное время для покрытия медью составляет приблизительно 20 минут, чем дольше Вы будете держать деталь, тем толще образуется слой. От того, как тщательно была подготовлена поверхность, будет зависеть качество медного покрытия, не пренебрегайте этим, лучше зачистить деталь микронной шкуркой перед промывкой, для того что бы снять оксидную пленку.
Таким образом можно восстановить медное покрытие любой детали, вернув ему первоначальные анти коррозионные свойства и внешний вид. Но, к сожалению, вернуть искробезопасные свойства не получится, так как технология получения омедненного инструмента на промышленном оборудовании отличается от меднения в домашних условиях, и включает в себя дополнительные этапы нанесения и адгезии покрытия.Применяйте данный метод только в крайних случаях, когда нет возможности вовремя заменить отработанный омедненный инструмент . Вы всегда можете воспользоваться нашей услугой меднения на промышленном оборудовании, с получение качественного покрытия, или купить уже готовый омедненный инструмент в интернет магазине.
Добывать и плавить медь люди научились с древности. Уже в то время элемент находил широкое применение в быту и из него делали различные предметы. Сплав меди с оловом (бронзу) научились делать около трех тысяч лет назад, из него получалось хорошее оружие. Бронза сразу стала популярной, поскольку отличалась прочностью и красивым внешним видом. Из нее изготавливали украшения, посуду, орудия труда и охоты.
Благодаря невысокой температуре плавления человечеству не составило большого труда быстро освоить производство меди в домашних условиях. Как происходит процесс плавления меди, при какой температуре начинает плавиться?
 Свое название химический элемент получил от названия острова Кипр (Cuprum), там его научились добывать еще в 3 тысячелетии до н.э. В периодической системе химических элементов у меди 29 атомный номер, она расположена в 11 группе 4-го периода. Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
Свое название химический элемент получил от названия острова Кипр (Cuprum), там его научились добывать еще в 3 тысячелетии до н.э. В периодической системе химических элементов у меди 29 атомный номер, она расположена в 11 группе 4-го периода. Элемент является пластичным переходным металлом, имеющим золотисто-розовый цвет.
По распространению в земной коре элемент занимает среди других элементов 23 место и чаще всего встречается в виде сульфидных руд. Самыми распространенными видами являются медный колчедан и медный блеск. На сегодняшний день есть несколько способов получения меди из руды, но любая из технологий требует поэтапного подхода, чтобы достичь конечного результата.
В самом начале развития цивилизации люди научились получать и использовать медь, а также ее сплавы. Уже в то далекое время они добывали не сульфидную, а малахитовую руду.В таком виде она не нуждалась в предварительном обжиге. Смесь руды с углями помещали в глиняный сосуд, которые опускали в небольшую яму, после чего смесь поджигали, угарный газ помогал восстановиться малахиту до состояния свободной меди.
В природе медь встречается не только в руде, но и в самородном виде, самые богатые месторождения находятся на территории Чили. Сульфиды меди часто образуются в среднетемпературных геотермальных жилах. Часто медные месторождения могут быть в виде осадочных пород — сланцы и медяные песчаники, которые встречаются в Читинской области и Казахстане.
Пластичный металл на открытом воздухе быстро покрывается оксидной пленкой, она и придает элементу характерный желтовато-красный оттенок, в просвете пленки могут иметь зеленовато-голубой цвет. Медь относится к тем немногим элементам, которые имеют заметную для глаза цветовую окраску. Она обладает высоким уровнем тепло- и электропроводности — это второе место после серебра.
 Плотность — 8,94*10 3 кг/м 3
Плотность — 8,94*10 3 кг/м 3- Удельная теплоемкость при Т=20 о С — 390 Дж/кг*К
- Электрическое удельное сопротивление в температурном режиме от 20-100 о С — 1,78*10 -8 Ом/м
- Температура кипения — 2595 о С
- Удельная электропроводность при Т=20 о С — 55,5-58 МСм/м.
 Процесс плавления происходит, когда металл из твердого состояния переходит в жидкое и у каждого элемента есть своя температура плавления. Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083 о С. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140 о С, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050 о С.
Процесс плавления происходит, когда металл из твердого состояния переходит в жидкое и у каждого элемента есть своя температура плавления. Многое зависит от наличия примесей в составе металла, обычно медь плавится при температуре 1083 о С. Когда к ней добавляют олово, то температура плавления снижается и составляет 930-1140 о С, температура плавления здесь будет зависеть от содержания в сплаве олова. В сплаве меди с цинком температура плавления становится еще ниже — 900-1050 о С.
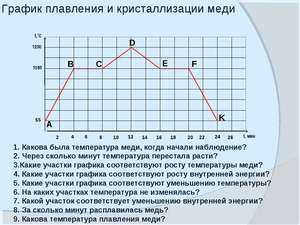
В процессе нагрева любого металла происходит разрушение кристаллической решетки. По мере нагревания температура плавления становится выше, но затем она остается постоянной, после того как достигла определенного температурного предела. В такой момент и происходит процесс плавления металла, он полностью расплавляется и после этого температура снова начинает повышаться.
Когда начинает происходить охлаждение металла, то температура начинает снижаться и в какой-то момент она остается на прежнем уровне до момента полного затвердения металла. Затем металл затвердевает полностью и температура снова снижается. Это можно увидеть на фазовой диаграмме, где отображен весь температурный процесс с начала момента плавления и до затвердения металла.
Разогретая медь при нагревании начинает переходить в состояние кипения при температуре 2560 о С. Процесс кипения металла очень напоминает процесс кипения жидких веществ, когда начинает выделяться газ и на поверхности появляются пузырьки. В моменты кипения металла при максимально высоких температурах начинает выделяться углерод, который образуется в результате окисления.
Низкая температура плавления позволила людям в древности расплавлять металл прямо на костре и затем использовать готовый металл в быту, чтобы сделать оружие, украшения, посуду, орудия труда. Для плавления меди в домашних условиях понадобятся следующие предметы:
 Тигель и специальные щипцы для него.
Тигель и специальные щипцы для него.- Древесный уголь.
- Муфельная печь.
- Горн.
- Бытовой пылесос.
- Форма для плавления.
- Стальной крюк.
Весь процесс происходит поэтапно, для начала металл нужно положить в тигель, после чего разместить в муфельную печь. Установить нужную температуру и наблюдать за процессом через стеклянное окошко. В процессе плавления в емкости с металлом появится окисная пленка, ее необходимо убрать, открыв окошко и стальным крюком отодвинуть в сторону.
Если нет муфельной печи, то медь можно расплавить с помощью автогена, плавление будет происходить при нормальном доступе воздуха. Используя паяльную лампу можно расплавить желтую медь (латунь) и легкоплавкие виды бронзы. Следить за тем, чтобы пламя охватило весь тигель.
 Если в домашних условиях нет ничего из перечисленных средств, тогда можно воспользоваться горном, установив его на слой древесного угля. Чтобы усилить температуру можно использовать бытовой пылесос, включив режим выдувания, но только если шланг имеет металлический наконечник. Хорошо, если наконечник будет иметь зауженный конец, чтобы струя воздуха была более тонкой.
Если в домашних условиях нет ничего из перечисленных средств, тогда можно воспользоваться горном, установив его на слой древесного угля. Чтобы усилить температуру можно использовать бытовой пылесос, включив режим выдувания, но только если шланг имеет металлический наконечник. Хорошо, если наконечник будет иметь зауженный конец, чтобы струя воздуха была более тонкой.
В современных промышленных условиях медь в чистом виде не применятся, ее состав содержит в себе много различных примесей — железа, никеля, мышьяка и сурьмы, а также других элементов. Качество готового изделия определяется наличием процентного содержания примесей в сплаве, но не более 1%. Важными показателями являются тепло- и электропроводность металла. Медь широко используется во многих отраслях промышленности благодаря своей пластичности, гибкости и низкой температуре плавления.
elfterra.ru
Где можно найти медь: места, способы, приборы
Поиск металлолома многим стал источником дохода. Существуют люди, для которых это вид деятельности хобби или способ заработка. Данный процесс является трудоемким и занимает много времени. Для начинающих металлоискателей это может показаться испытанием, но если знать, где можно найти металл, то это занятие не столь сложное.

Приборы, в которых содержится медь и ее сплавы
Для добычи меди не нужно далеко ходить. Это необязательно должны быть раскопки на полях, с использованием металлоискателя. Взять медь можно из старых электрических приборов. Из-за того, что ремонт старых приборов занимает много времени и средств, чаще всего их выбрасывают. Но перед этим из них, возможно, достать металлолом, который после переработки используется для изготовления труб, проволоки, профильных листов либо заменять некоторые элементы для приборов.
Медный сплав можно легко найти:
- В подшипниках, радиаторах, моторах, шестеренках.
- В старых украшениях и элементах декора.
- В сантехнике.
- В кухонной посуде.
- В радиаторах и компьютерах.
Саму же медь, возможно, найти в следующих приборах:
- До полутора килограмм металлолома можно найти в ламповом телевизоре.
- Почти три килограмма меди можно взять из двигателя старого холодильника, советского образца.
- Меньшее количество меди берется из стиральных машинок, фенов, микроволновых печей.
- Если имеется непригодный к ремонту стартер от транспортного средства, то оттуда тоже можно добыть металл.
Из данных устройств, взять меди можно не так много, но зато данные приборы широко встречаются.
Где искать?
Чтобы не терять время на поиски, нужно заранее знать, где добыть металл. К таким местам можно отнести:
- Поля. На них часто можно встретить сломанную технику.
- Заброшенные предприятия, где зачастую находится много алюминия и меди.
- Базы по ремонту автомобилей. Найти такое заброшенное место дорогого стоит. Где как не тут искать металлолом. Удобство заключается в том, что все сломанные детали складывают в одно место и порой, всего лишь один болт может вытянуть на килограмм.
- Свалка. Данное место подойдет для тех, кто является новичком и не знает где осуществлять поиск меди, для сдачи. Именно тут можно легко научиться различать виды металлов, чтобы не сдавать в дальнейшем их по одной цене.
- Заброшенный полигон. В таких местах можно с легкостью находить гильзы, мишени и муляжи техники.
Если для поиска выбирается поле, то лучше всего искать металлом весной, чтобы не столкнуться с работниками и не создавать друг другу проблем.

Как правильно собирать цветной лом
Почти все металлоискатели процесс сдачи лома ставят на поток. Для осуществления этого процесса нужно по максимуму оптимизировать свою деятельность. Для этого потребуется:
- Определиться с системой сбора приборов, которые непригодны для дальнейшего использования.
- Позаботиться о доставке собранного металлолома к пункту разборки. Для этого необходим транспортное средство, на котором будет осуществляться транспортировка. Заранее позаботиться о месте, в котором будет находиться весь лом металлов, ведь его будет достаточно много.
- Разработать процесс разборки. Для этого нужно приобрести специальный инструмент, чтобы отделять металл от других материалов и приступить к сортировке.
- Наладить быструю перевозку металла в пункты приема.
Следует также знать, что цены на цветной лом варьируются от времени года. Так как зимний период сложен для добывания металла, то цену дают больше, чем летом. Поэтому будет целесообразнее придержать имеющийся материал до «лучших» времен.
Способ получения меди
Получение меди даже в промышленных условиях очень трудоемкий процесс:
- На начальном этапе металл подвергается дроблению, после чего очищается от примесей других пород. После очистки исходный материал подвергается обжигу, после чего можно получить твердое вещество – огарок, который в свою очередь подвергается плавлению.
- После этой процедуры получают штейн, который содержит до 50% меди.
- Изготовленный штейн обогащают кислородом, продувкой воздухом, и кварцевым флюсом.
- Только после этих процедур можно получить черновую медь, ее подвергают оплавлению и пропускают через кислородный расплав.
- В заключение полученный материал обрабатывают оксидом серы, после чего процентное содержание меди составляет 99,9%.
Каким образом получить высокую цену за металлолом
Каждый искатель лома хочет сдать найденный металлолом по самой выгодной цене для себя. Как уже говорилось выше, можно осуществлять поиск металла летом, а продавать его зимой, когда цены повышают. Но если в приоритете получение прибыли регулярно, то лучше всего искать пункты приема, которые предлагают цены выше, чем у конкурентов. Не стоит также забывать, что стоимость зависит от качества и состава материала, который сдается. Самую высокую цену предлагают за чистую медь.
oxmetall.ru
Берем железо, получаем медь
Комментарий «УГ»
Владимир Головнер ([email protected])
На неофициальном сайте столичной школы №1259 ему посвящена страничка. Как только школяры не называют своего любимца - Нодарыч, ВладНад, Владимир Красное Солнышко. Обратите внимание на нежную характеристику, сочиненную кем-то из ребят: «Экстравагантный, прикольный, строгий и в то же время довольно-таки общительный человек. Ему можно посвящать сайты. Любит походы, газету «Контакт», всевозможные тусовки и мероприятия». А теперь отправляйтесь на портал самого популярного в Сети интернет-магазина, где вам предложат купить его книгу «Химия. Интересные уроки. Из зарубежного опыта преподавания. 8-11 классы». Это все - о московском химике Владимире Нодаровиче Головнере!
Публикация приведена в формате PDF:
Скачать/Просмотреть
(Для просмотра необходима программа Adobe Reader или ее произвольный аналог).
Любят его и ученики, особенно на ранней стадии изучения химии. Любят за то, за что вообще обычно любят химию в школе – за то, что она подобна чуду. Разве это не чудо: прямо на глазах железный гвоздь превращается в медный!
Хотя учитель и ученик едины в отношении зрелищной стороны этого опыта, их восприятие сущности процесса кардинально различается. Химик осознает сложные электрохимические явления, происходящие в растворе и не видные глазу, между тем как ребенок видит и воспринимает лишь внешние превращения: железо становится красным. Учащиеся поначалу полагают, что наблюдают процесс образования ржавчины, и только с помощью учителя вспомнив, что в растворе находится сульфат меди, догадываются, что наблюдают выделение меди. Но даже в этом случае они осознают лишь одну сторону этого процесса: выделение меди на поверхности железного предмета. То, что одновременно часть железа переходит в раствор, даже не приходит им в голову. Ведь это незаметно для глаза!
Вот эта разница в восприятии учителем и учеником одного и того же наблюдаемого явления служит замечательной иллюстрацией эволюции представлений о веществе, происходившей по мере развития химии на протяжении столетий. Именно изменение представлений о процессах, стоящих за превращениями веществ (а это и есть центральный вопрос химии), образует на карте развития мировой науки те пути познания, которыми двигались химики.
Мы попробуем проследить эти пути на примере одной-единственной реакции между железом и солью меди, которая в разные эпохи неизменно занимала умы исследователей, кем бы они ни были: алхимиками, металлургами, химиками-практиками. Большая часть материалов взята из статьи V. Karpenko из Карлова университета в Праге (Journal of Chemical Education, № 12, 1995, pp. 1095–1097).
Давайте попробуем взглянуть на описанный выше химический опыт глазами людей, живших задолго до возникновения современной химии. Что должны были увидеть они: в жидкость голубого цвета погружается железный предмет, который постепенно становится медным. Отметим важное обстоятельство: наблюдатель (в отличие от учеников в современной школе) не знает, что жидкость голубого цвета называется медный купорос. Иными словами, для ученика хотя бы очевидно, что медь в той или иной форме уже была в растворе до начала опыта (на это указывает название одного из веществ – медный купорос), а наш условный наблюдатель ничего об этом не знает. Таким образом, наблюдаемое явление для него становится ясной демонстрацией превращения одного металла в другой: железа – в медь. В самом деле о присутствии меди в растворе до начала опыта он не догадывается, а переход железа в раствор он наблюдать просто не может. Значит, вывод один: железо превращается в медь!
Понятно, как важна была рассматриваемая реакция для алхимиков. Ведь она ясно подтверждала возможность взаимного превращения металлов («трансмутацию», как это превращение называли алхимики). Да, железо в этом опыте «превращается» не в золото, а в медь, но зато это убедительно доказывает принципиальную возможность трансмутации!
Правда, если хорошенько поскоблить покрытое медью изделие, то оказывается, что внутри оно осталось железным, а медь только образует на его поверхности пленку. Но это недоразумение легко могло быть отнесено за счет недоброкачественного проведения эксперимента. Алхимики, безусловно, были убеждены: при соблюдении необходимых условий все железо, погруженное в раствор купороса, постепенно превратится в медь. Таким образом, железный гвоздь, погруженный в раствор медного купороса, на многие века стал своего рода символом великого чуда – трансмутации!
Древний Китай: «А железо-то поддельное!» Шаг вперед: реакция идет на поверхности.
Интересное свидетельство о понимании в античное время сущности взаимодействия железа с раствором медной соли оставил китайский даосский философ и алхимик Ко Хунг, совершенно справедливо рассматривая процесс взаимодействия как реакцию, идущую на поверхности (!) железа (как мы знаем сегодня, именно на поверхности железа происходит разряжение ионов меди).
Древний Китай: «И все-таки оно превращается!» Шаг назад: железо превращается в медь.
Почти одновременно с Ко Хунгом другие китайские источники воспринимают взаимодействие железа с ионами меди как полноценную трансмутацию. Сразу два текста периода династии Хань (206 г. до н. э. – 220 г. н. э.) прямо пишут об этом: «При взаимодействии железа с азуритом (основной карбонат меди. – В. Г.), первое превращается в медь».
Средневековый Китай: «Результат важнее причины». Шаг на месте: главное – получение меди, а не понимание процесса.
В 1086 году Шэнь Куо, китайский ученый и государственный деятель династии Сун, пишет об образцах воды, взятых из некоторых источников минеральных вод: «Если эти квасцы длительное время нагревать в железной чаше, то чаша становится медной»(курсив мой. - В. Г.).
Что для нас важно в этом тексте? Во-первых, слово «квасцы» здесь употребляется, видимо, в том смысле, что, судя по всему, образцы воды содержат растворенные соли меди. Если дальше пытаться расшифровывать этот текст, то можно предположить, что нагревание необходимо для концентрирования соли. Но самое важное в тексте то, что мы выделили курсивом. Шэнь Куо не говорит о превращении железа в медь (трансмутации), не говорит он и об изменении свойств самого железа («поддельном железе»). Он только констатирует: получается медь.
Чтобы понять причины такого прагматического отношения к химии, надо иметь в виду, что начиная с X века средневековый Китай испытывает все возрастающую потребность в производстве меди в промышленных масштабах. Медь, в частности, шла на изготовление монет. В одном только 1085 году (за год до появления цитируемого текста) в Китае было отлито шесть миллиардов (!) медных монет. Традиционные методы добычи меди не поспевали за растущими потребностями, а потому упомянутый текст Шэнь Куо есть не что иное, как описание гидрометаллургического метода получения меди. Судя по всему, автора интересует не объяснение сути происходящего явления, а возможность практического результата. Медь налицо, а причины – не главное!
Античная Европа: «Займемся аналитикой!». Шаг на месте: главное – практическое применение, а не суть реакции.
Об интересующей нас реакции упоминает греческий врач и натуралист Диоскорид (Диоскорид Педаний, I век н.э.). Речь идет о применении этого процесса в качестве инструмента аналитической химии. Диоскорид пишет о двух разных соединениях меди. Одно из них греки называли «ios» (ацетат меди (II), другое – «chalcanthon» (сульфат меди (II). По-видимому, «ios» ценился выше, чем «chalcanthon», поскольку Диоскорид сообщает о том, как обнаружить в первом примесь последнего. Для этого, по мнению автора, необходимо исследуемое вещество поместить в железный сосуд и нагреть. Если в образце имеется примесь «chalcanthon», то сосуд окрашивается в красный цвет.
Для современного химика в тексте Диоскорида много неясного. Во-первых, если «красный цвет» принадлежит меди, то непонятно, почему окрашивание происходит только в случае сульфата меди. В принципе железо способно вытеснять медь из обоих соединений – ацетата и сульфата. Во-вторых, непонятна роль нагревания. При нагревании оба соединения разлагаются, образуя черный оксид меди. Но для нас в тексте Диоскорида важно другое: не пытаясь исследовать существо взаимодействия железа с ионами меди, он констатирует факт – этот процесс можно использовать практически. В этом смысле Диоскорид поступает подобно уже упомянутому Шэнь Куо.
Средние века: «Полная неясность...» Шаг назад: медь покрывается… медью.
В средние века упоминание об интересующей нас реакции находим в трактате «Liber fornacum» (Книга о философских печах»), приписываемом Геберу (латинизированная форма имени арабского ученого Джабира ибн Хайяна, ок. 721 г. – ок. 815 г.). Под именем Гебера (для большей значимости) издавали свои труды многие оставшиеся безымянными средневековые алхимики, вследствие чего в научной литературе этот автор обычно именуется Псевдо-Гебером. Рассуждая о способах растворения металлов, Псевдо-Гебер, пишет: «Медь следует растворить и семь раз очистить… Полученный твердый продукт обработать аммиачной солью (хлорид аммония. – В. Г.) и уксусом. В результате будет получена благородная субстанция зеленого цвета. Если ее поместить в железный сосуд, то субстанция эта становится красной» (курсив мой. - В. Г.).
Как и многие тексты алхимиков, сообщение Псевдо-Гебера очень трудно расшифровать. По-видимому, в результате процессов, упомянутых в первой части текста, автор получает смесь хлорида и ацетата меди и каких-то еще солей, полученных при первичном растворении меди. Но почему во второй части текста «красной» становится эта субстанция, а не железный сосуд? Единственное, что мы можем предположить, это то, что при нагревании из этой смеси солей может частично восстановиться металлическая медь.
Эпоха Возрождения: «Торжество трансмутации». Шаг назад: железо превращается в медь.
Немецкий химик и врач Андреас Либавий (1550–1616 гг.), ссылаясь на Парацельса, описывает в книге «Die Alchemie» («Алхимия») следующий метод превращения железа в медь. Железные изделия смешивают с ртутью, уксусом, витриолем (медным купоросом. – В. Г.), аммиачной солью и кипятят. После полного удаления уксуса исходные компоненты вновь добавляют к железу, дополнив их также оксидом железа (III). Далее при кипячении «железо превращается в медь и проникает в ртуть. Для отделения меди от ртути следует поместить их между слоями кожи под пресс на 10–12 часов». Выделенный курсивом текст свидетельствует о том, что Либавий, подобно его учителю Парацельсу, является правоверным алхимиком. С его точки зрения вследствие реакции железа с солями меди железо именно превращается (трансмутирует) в медь.
Эпоха Возрождения: «В поисках истины спускаемся в шахту». Шаг вперед, два шага назад.
В XVI веке наряду с уже обсуждавшимися алхимическими подходами мы находим совершенно новый взгляд на рассматриваемый процесс. Пражский монетных дел мастер и металлург Лазарь Эркер (1530–1594 гг.) в изданном им минералогическом справочнике (1580 г.) пишет о процессах, происходящих с железом в растворе солей меди: «то, что оседает на поверхности железа, есть не что иное, как медь. Кроме того, нет никаких признаков превращения железа в медь». (курсив мой. – В. Г.). В этих фразах – настоящая революция в области химии! Эркер делает сразу два совершенно верных наблюдения: а) выделяющаяся в реакции медь не является продуктом трансмутации железа; б) медь появляется в результате поверхностного осаждения.
К сожалению, позднее Эркер изменил свою точку зрения. Занимаясь горными разработками (Эркер, в частности, создал в Австрии шахту по добыче гранатов), он неоднократно наблюдал, «как в шахтах, где имелись купоросные соединения, железные изделия – гвозди в бочках, крепеж на лестницах – со временем становились медными». «Из этого, – пишет Эркер, - я вынужден был сделать вывод, что железо превращается в медь. Если для проверки этого утверждения мы погрузим железо в раствор витриола или какой-либо другой раствор, содержащий медь, и будем наблюдать осаждение меди на поверхности железа, то количество осажденной при этом меди будет превосходить количество меди, содержавшейся в растворе».
Эпоха Просвещения: «Компоненты в реакциях не меняются!» Шаг вперед: медь изначально была в витриоле!
В самом начале XVII века появляется первое свидетельство того, что традиционный алхимический взгляд на «природу вещей» сменяется новым подходом к пониманию вещества и сущности превращения веществ. Свидетельство это мы находим у итальянского химика Ангелуса Сала (1576–1637 гг.): между 1617 и 1618 гг. он поставил серию экспериментов, которая привела его к важнейшему утверждению: продукты химических реакций состоят из тех же «компонентов», которые содержались в исходных веществах. По мнению Сала, железо вовсе не превращается в медь, медь изначально присутствует в растворе витриола. Единственное, чего не сделал Сала, так это не объяснил причин, по которым один металл вытесняет другой из раствора. Это сделал за него Роберт Бойль.
Эпоха Просвещения: «Роберт Бойль и теория корпускул». Шаг вперед: металл удерживается в растворе особыми силами.
В книге «Великие химики» (К. Манолов, «Великие химики», перевод с болгарского, М. : Мир, 1976) приводится следующий воображаемый монолог Роберта Бойля (1627–1691 гг.): «Возьмите немного золота, поместите его в царскую водку, нагрейте, и вы увидите, что через короткое время оно растворится. Если в раствор… прибавить немного цинка, на дно осядет золотой порошок. Это то золото, которое вы первоначально растворили. Следовательно, корпускулы изменяют свое состояние, но остаются вечными. Царская водка как бы разрушает природу золота, но его сущность – корпускулы – остаются без изменений».
В приведенном отрывке английский химик рассуждает как раз о взаимном осаждении металлов из их растворов и, более того, дает в целом верную картину строения вещества из мельчайших химически неделимых частиц, которые он называет корпускулами и которые позднее привели в химии к понятию «химический элемент».
Но и это еще не все. В трактате «О механических причинах химического осаждения» Бойль очень прозорливо рассуждает о движущих силах осаждения металлов из растворов. По мнению Бойля, металлы удерживаются в растворе особыми силами, и как только эти силы ослабевают, они выделяются в виде осадка. Причиной же ослабления этих сил может быть, например, помещение в раствор другого металла. Именно таким образом, пишет Бойль в названном трактате, «мы можем легко выделить медь из раствора ее соли с помощью железа».
Последняя цитата могла бы поставить точку в нашем рассказе о приключениях реакции Cu2+ + Fe0 = Fe2+ + Cu0. Конечно, Роберт Бойль не дал объяснения природе тех сил, которые «удерживают металл в растворе», да он и не мог это сделать. Но дальнейшее уже становится, так сказать, делом техники, ибо Сала и Бойль задали правильную ориентацию последующим исследованиям и заложили основы правильного подхода к пониманию природы вещества.
Как мы сегодня об этом думаем: «Электрохимический процесс».
Если железную пластину погрузить в воду или раствор соли железа, то из слоя металла, находящегося на границе с водой, положительно заряженные ионы Fe2+ начнут переходить в воду. Из-за этого пластинка приобретает отрицательный заряд. Между отрицательно заряженной пластинкой и перешедшими в раствор положительно заряженными ионами возникает электростатическое притяжение, что препятствует дальнейшему переходу ионов в раствор, то есть процесс растворения металла прекращается.
Одновременно развивается противоположный процесс: ионы железа из раствора, подойдя к поверхности пластинки, принимают от нее электроны и, переходя в нейтральное состояние, осаждаются. Железная пластинка, таким образом, фактически является электродом. Через некоторое время устанавливается состояние динамического равновесия, при котором скорость перехода ионов из металла в раствор равна скорости их осаждения на металле.
Равновесие между ионами раствора и металлом выражается уравнением:
Fe2+ (р-р) + 2е = Fe (кр.) (1)
В результате на межфазной границе образуется двойной электрический слой и возникает разность электрических потенциалов. Равновесие между металлом, жидкой фазой и двойным электрическим слоем полностью подчиняется всем положениям смещения химического равновесия.
Состояние равновесия электродного процесса определяется электродным потенциалом Е, представляющим собой разность потенциалов двух фаз на границе металл – электролит.
На железном электроде (железо – раствор с концентрацией ионов Fe2+, равной 1 моль/л) при разомкнутой гальванической цепи устанавливается равновесие, характеризующееся стандартным электродным потенциалом –0,44 B:
Fe2+ + 2e = Fe, E = –0,44 B.
Отрицательное значение электродного потенциала железа свидетельствует о невозможности самопроизвольного прохождения реакции по этому уравнению. Самопроизвольно проходит процесс в противоположном направлении:
Fe – 2e = Fe2+ , E = 0,44 B.
Для меди же наоборот, электродный потенциал имеет положительное значение:
Cu2+ + 2e = Cu, E = 0,34 В (2)
Это означает, что реакция может проходить самопроизвольно (при наличии второго электрода, поставляющего электроны), то есть ионы меди могут переходить в металлическую медь (медь будет осаждаться на электроде).
Если железная пластинка оказывается погруженной в раствор соли меди, содержащий ионы Cu2+, то эти ионы, разряжаясь на пластине, уменьшают число электронов на пластине и тем самым смещают равновесие в реакции (1) влево. В результате железо начинает активно переходить в раствор в виде ионов, увеличивая количество освободившихся электронов, что в свою очередь смещает равновесие в реакции (2) вправо.
В результате оба процесса стимулируют друг друга, а в целом в растворе протекает окислительно-восстановительная реакция:
Fe = Fe2+ + 2е
Сu2+ + 2е = Сu.
Пути познания
Вот так шаг за шагом, то двигаясь в правильном направлении, то ошибаясь, происходила эволюция взглядов химиков на реакцию между железом и ионами меди.
Мы рассмотрели в контексте истории химии только одну реакцию, но на ее примере видны все характерные особенности становления научного мышления. Мы видим, как одни исследователи руководствуются соображениями практической выгоды и прикладного значения полученных результатов, в то время как другие движимы чистым идеализмом и стремлением постигнуть «природу вещей». Мы видим, как в течение нескольких столетий сосуществуют и сталкиваются между собой два принципиально разных взгляда на устройство мира: мистический (алхимия), склонный искать причины наблюдаемых явлений во всеобщей взаимосвязи и личностном опыте алхимика, и материалистический, постепенно приходящий к мысли о том, что «ничто не появляется ниоткуда».
Библиография
Зайцев О. С. «Учебная книга по химии» (издательский дом «Первое сентября»), № 31, 2004.
Karpenko V. «Fifteen Centuries of Search», Journal of Chemical Education, № 12, 1995, pp. 1095-1097.
Гроссе Э., Вайсмантель X. Химия для любознательных. Основы химии и занимательные опыты. – 2-е русское изд. – Л. : Химия, 1985.
Морозов Н. В поисках философского камня (в книге «Великое Делание. Теория и символы алхимии», Киев, «Новый Акрополь», 1995).
www.ug.ru
Как получить гидроксид меди имея обычную медь?
В две стадии. 1) Cu + 2h3SO4 (концентрированная, при нагревании) = CuSO4 + SO2 + 2h3O. 2) CuSO4 + 2NaOH = Cu(OH)2 (осадок) + Na2SO4. Что касается оксида меди, то он с водой не реагирует. Есть ещё один способ (годится, если у Вас нет серной кислоты) : 1. 2Cu + O2 (нагревание над пламенем) = 2CuO. 2. CuO + 2HCl = CuCl2 + h3O. 3. CuCl2 + 2NaOH = Cu(OH)2 + 2NaCl. Если нет соляной кислоты, то можно вместо неё взять азотную. На худой конец (если уж ни серной, ни соляной, ни азотной у Вас нет) можно взять уксусную или лимонную.
Начни сразу c CuSO4, медный купорос есть в хозяйственном. NaOH - в хим- и радиомагазинах.
Конечно. Можно применить обычную пищевую соду. Перед этим можно её прокалить не жестоко (100-200 град) или прокипятить её раствор, или сходу дать, а потом полученный осадок не сильно прокалить. Конечно, лучше сразу начать с медного купороса. И неопасно, и без вони. А вот получать из меди сразу оксид, как тут нацарапал один полуграмотный, не стоит. Посинеешь, но не получишь. И так: медный купорос растворяешь в воде, 200г на 0.5л, даёшь соды 150г, перемешиваешь, кипятишь минут 10, охл, фильтруешь через 4 слоя марли, промываешь на фильтре водой, отжимаешь, сушишь до суха в тёплом месте. Потом прокаливаешь на газовой плите на нержавейке (посуда, пластина) при перемешивании. Суди по цвету. Но желательно осаждение вести в стеклянной посуде
Прежде чем заниматься опытами, ознакомьтесь со свойствами применяемых и получаемых веществ. Не ищите приключений на свою з...
touch.otvet.mail.ru
Где можно достать медь для сдачи в металлолом
Сбор и сдача металлолома позволяет не только получить хороший доход, но и приносит пользу окружающей среде, в первую очередь природе. Каждый год соответственные пункты приема принимают различные виды металлолома, их ассортимент постоянно растет, а вот требования к чистоте сырья и разделке начинает снизиться. Так как цены постоянно растут, то от сдачи металлолома можно получить реальные хорошие доходы. Поэтому перед тем, как выбросить старые бытовые техники или электроприборы, нужно из них извлечь все металлические элементы, чтобы от них получить пользу. Большинство электроприборов в себя содержат именно цветовые металлы, а сегодня цветовой металл цениться больше, чем черный. Если подойди к данному делу серьезно, то можно получить хорошие доходы и пополнить свой семейный бюджет. Прием цветного лома осуществляет компания, сайт которой расположен по ссылке vekomet.ru.
Одним из самых востребованных и ценных металлов, который часто встречается у бытовых электроприборов, является медь. Именно медь вызывает большой интерес среди тех, кто собирает лом. Медь дороговизны и обладает отличными свойствами. Например, ламповый телевизор содержит примерно 1.5 кг медных деталей, а вот у новых телевизоров можно найти всего 0.5 кг меди. Холодильники, электродвигатели или газовые плиты тоже являются хорошим содержанием медных обмоток. В них содержаться примерно 1 кг меди. Однако, в холодильнике и в электродвигателе медные обмотки находятся внутри алюминиевого или чугунного корпуса. Для того, чтобы извлечь их нужно применять болгарку или другую технику. Медные обмотки можно достать из стартера, реле, трансформатора, люминесцентных ламп и т.д. Из этих вещей можно получить небольшое количество металлолома, однако они очень широко применяются, поэтому и считаются привлекательными источниками для получения цветного лома.
Для того, чтобы оптимизировать сбор металла нужно выработать специальный алгоритм сбора приборов, которые содержат лом. Основными источниками лома можно считать свалки, заброшенные будки трансформаторов или строительные площадки.
www.ogirk.ru
Температура плавления меди: как расплавить металл в домашних условиях
Медь – крайне популярный и распространенный металл, используемый при производстве электроники, передаче электроэнергии, а также изготовлении разнообразных сплавов.
Какова же температура плавления меди, как ее добывают и чем она интересна? Расскажем обо всем этом.
...
Вконтакте
Google+
Мой мир
Как получают медь
Запасы этого металла на Земле сравнительно невелики (по сравнению с другими элементами). Причем встречается он как в виде самородков, так и в составе сложных соединений. Чаще всего это медный колчедан, халькопирит, борнит и халькозин. Находят их в осадочных породах, но чаще всего – в гидротермальных жилах. Общее количество месторождений меди в мире довольно велико, однако действительно крупных, имеющих важное стратегическое значение, всего несколько.
Это интересно! Содержание меди в руде очень невелико – 0,3–1%, в зависимости от конкретного месторождения.
 На территории России это Удокан, расположенный в Забайкальском крае. Если рассматривать Европу, то крупнейшим месторождением является немецкий Мансфельд. В ближнем зарубежье такими запасами может похвастать Казахстан – они есть в городе Жезказган.
На территории России это Удокан, расположенный в Забайкальском крае. Если рассматривать Европу, то крупнейшим месторождением является немецкий Мансфельд. В ближнем зарубежье такими запасами может похвастать Казахстан – они есть в городе Жезказган.
Серьезный медоносный пояс расположен в Центральной Африке. В США также имеется крупное месторождение – Моренси. Наконец, Чили может похвастать сразу двумя серьезными точками добычи – Кольяуси и Эскондида.
Добывается медная руда открытым методом. Лишь сравнительно малая часть месторождений, где сырье залегает на большой глубине, использует шахтный метод.
После добычи руда проходит сложнейшую обработку, позволяющую отделить чистый металл от шлака. Для этого применяются разные методы: электролиз, гидрометаллургия, а также пирометаллургия.
Каким образом наши предки плавили медь
Это древнейший металл, который освоили люди. Удивительная пластичность стала ее главным достоинством. Именно благодаря ему даже при наличии примитивных орудий труда можно обрабатывать металл, изготавливая из него предметы обихода и разнообразные орудия труда.
Это интересно! Латинское название «cuprum» происходит от названия острова Кипр, на котором было обнаружено крупное месторождение. Точное происхождение русского слова «медь», увы, неизвестно – существует лишь несколько теорий.
Обрабатывать первый металл наши предки научились примерно в 4 тысячелетии до нашей эры. Находя необычные по цвету булыжники, люди пытались обрабатывать их, привычно ударяя тяжелыми камнями. Однако самородки не раскалывались, а лишь деформировались. Таким образом первобытные мастера получили возможность изготовить первые орудия труда.
 Этим и был обусловлен переход от каменного века к медному. На изготовление металлического оружия уходило не больше сил, чем на каменное. Зато оно служило значительно дольше, а при повреждении медный топор или нож можно было отремонтировать – каменные аналоги приходилось делать заново.
Этим и был обусловлен переход от каменного века к медному. На изготовление металлического оружия уходило не больше сил, чем на каменное. Зато оно служило значительно дольше, а при повреждении медный топор или нож можно было отремонтировать – каменные аналоги приходилось делать заново.
При скольких градусах плавится медь? На сегодняшний день эта температура не кажется специалистам большой – всего 1083 градуса по Цельсию.
Однако для древних металлургов она была недостижимой, так что плавить материал для полноценной обработки научились значительно позже – только в 3 тысячелетии до нашей эры, когда появились необходимые технологии. Однако и до этого во многих поселениях мастера нагревали медные самородки на кострах, замечая, что горячий металл поддается обработке значительно легче.
Что изменилось со временем
Конечно, современные медные изделия не идут ни в какое сравнение с теми, которые изготавливались пять тысячелетий назад. Вместо грубых медных ножей, топоров и наконечников для стрел и копий сегодня выпускаются сложнейшие детали для электроники. А ведь все свойства металла остались неизменными. При какой температуре плавится медь сегодня, при такой плавилась и тысячи лет назад. Зато значительно улучшились технологии.
Например, раньше чистый (сравнительно чистый, конечно) металл из руды добывали самыми примитивными способами. Например, в глиняный кувшин складывали руду и уголь. Сосуд устанавливали в яму, смесь поджигали, а яму засыпали. При горении угля выделялся угарный газ. Контактируя с рудой, он запускал реакцию, в результате которой выделялся металл и небольшое количество воды.
Сегодня, как уже говорилось выше, для удаления примесей из руды применяют разные методы. Используя специальный график плавления меди и различные методы обработки, специалисты могут получить практически абсолютно чистый металл. Рассмотрим для примера гидрометаллургический как самый простой для понимания.
Медная руда заливается серной кислотой. Медь как сравнительно активный металл вступает в реакцию, превращаясь в сульфат меди. Железо при контакте с ним вытесняет медь. В результате реакции получается сульфат железа и медь.
Физические свойства
 Обладает редким цветом – золотисто-розовым, что весьма необычно для металлов. Сравнительно легко вступает в реакцию, а также соединяется с другими металлами, значительно изменяя их свойства. Демонстрацией этого является процесс горения – достаточно смешать чистый металл с серой и нагреть смесь.
Обладает редким цветом – золотисто-розовым, что весьма необычно для металлов. Сравнительно легко вступает в реакцию, а также соединяется с другими металлами, значительно изменяя их свойства. Демонстрацией этого является процесс горения – достаточно смешать чистый металл с серой и нагреть смесь.
Востребованным ее делает прекрасная электропроводность – лучшими показателями обладает только серебро.
Кроме того, она может похвастать хорошей теплопроводностью, что делает незаменимым материалом при производстве тепловых трубок и радиаторов охлаждения. Температура кипения меди довольно велика – 2567 градусов по Цельсию.
Плавка металла в домашних условиях или промышленных проходит одинаково. Температура повышается постепенно и постоянно. Однако при получении достаточного количества тепла кристаллическая решетка разрушается. В этот момент температура прекращает подниматься, несмотря на то, что нагрев не прекращается. Температура плавления меди, как говорилось выше, составляет 1085 градусов по Цельсию. Только после того, как металл полностью расплавится, будет продолжаться повышение температуры. Кипит он при 2567 градусов по Цельсию.
При охлаждении кристаллическая решетка восстанавливается и металл затвердевает. Температура кристаллизации – 1085 градусов, а при понижении она становится еще более плотной.
Сплавы могут иметь сильно отличную температуру плавления. Например, температура плавления алюминия и меди – 1040 градусов по Цельсию.
Как расплавить в домашних условиях
Некоторые люди имеют хобби, связанные с литьем из металлов. Те же, кто только встает на этот увлекательный путь, часто интересуются, как расплавить медь в домашних условиях. Для этого понадобится:
- форма для плавления;
- щипцы;
- сырье для плавки;
- газовая горелка высокого давления – лучшее решение, так как горн есть не в каждом хозяйстве;
- защитное снаряжение (очки, толстые перчатки).
 Если у вас есть все необходимое, можно начинать плавку в домашних условиях. Пошаговая инструкция довольно проста:
Если у вас есть все необходимое, можно начинать плавку в домашних условиях. Пошаговая инструкция довольно проста:
- Металл по возможности измельчить – можно при помощи напильника превратить в опилки. Это позволит быстрее расплавить его.
- Поместить в форму для плавления – она должна быть из материала с высокой температурой плавления.
- Надеть защитное снаряжение, зажечь горелку и направить струю пламени на сырье.
- Когда медь расплавится, захватить форму для плавления щипцами и вылить жидкий металл в подготовленную форму.
Как видите, все довольно просто. Впрочем, этот метод подойдет не для всех сплавов. Например, температура плавления и стали слишком высока – обычная горелка здесь не подойдет. Это касается также сплава меди и железа.
Сфера применения весьма обширна. Приведем лишь несколько примеров:
- передача электричества – низкое сопротивление делает этот металл крайне востребованным;
- приборостроение – устойчивость перед водой, в том числе морской, очень важна во многих сферах;
- при пайке – также благодаря хорошей электропроводности;
- водопроводные трубы – она прекрасно проводит тепло;
- радиаторы охлаждения – теплопроводность металла позволяет не только согревать помещения, но и охлаждать оборудования.
Полезное видео
Теперь вы знаете все о меди, способах ее получения, истории, использовании, а также способах обработки в домашних условиях. Наверняка эти знания окажутся для вас полезными.
stroim.guru