Методы защиты от коррозии. Способы защиты от коррозии сообщение
Методы защиты от коррозии
Проблема защиты металлов от коррозии возникла почти в самом начале их использования. Люди пытались защитить металлы от атмосферного воздействия с помощью жира, масел, а позднее и покрытием другими металлами и, прежде всего, легкоплавким оловом. Задачей химиков было и остается выяснение сущности явлений коррозии, разработка мер, препятствующих или замедляющих её протекание. Коррозия металлов осуществляется в соответствии с законами природы и поэтому ее нельзя полностью устранить, а можно лишь замедлить.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью.
Легирование
Имеется способ уменьшения коррозии металлов, который строго нельзя отнести к защите. Этим способом является получение сплавов, которое называется легирование. В настоящее время создано большое число нержавеющих сталей путем присадок к железу никеля, хрома, кобальта и др. Такие стали, действительно, не покрываются ржавчиной, но их поверхностная коррозия имеет место, хотя и с малой скоростью.
Защитные пленки
Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение на их поверхность защитных пленок: лака, краски, эмали, других металлов. Лакокрасочные покрытия наиболее доступны для широкого круга людей. Лаки и краски обладают низкой газо- и паропроницаемостью, водоотталкивающими свойствами, поэтому они препятствуют доступу к поверхности металла воды, кислорода и содержащихся в атмосфере агрессивных компонентов. Покрытие поверхности металла лакокрасочным слоем не исключает коррозию, а служит для нее лишь преградой, а значит, лишь тормозит процесс коррозии.
Грунтовки и фосфатирование
Часто под лакокрасочный слой наносят грунтовки. Пигменты, входящие в ее состав, также должны обладать ингибиторными свойствами. Проходя через слой грунтовки, вода растворяет некоторое количество пигмента и становится менее коррозионноактивной. Среди пигментов, рекомендуемых для грунтов, наиболее эффективным признан свинцовый сурик Pb3O4.
Вместо грунтовки иногда проводят фосфатирование поверхности металла. Для этого на чистую поверхность кистью или распылителем наносят растворы ортофосфатов железа (III), марганца (II) или цинка (II), содержащих и саму ортофосфорную кислоту h4PO4. В образование фосфатного покрытия вносят вклад металл, растворяющийся в фосфатирующейся смеси, и оставшиеся на его поверхности оксиды.
Пленка фосфатов защищает поверхность изделия от атмосферных осадков, но мало эффективна от растворов солей и даже слабых растворов кислот. Таким образом, фосфатная пленка может служить лишь грунтом для последовательного нанесения органических защитных и декоративных покрытий – лаков, красок, смол.
Электрохимическая защита
В производственных условиях используют также электрохимический способ – обработку изделий переменным током в растворе фосфата цинка при плотности тока 4 А/дм2 и напряжении 20 В и при температуре 60-70 оC. Фосфатные покрытия представляют собой сетку плотносцепленных с поверхностью фосфатов металлов. Сами по себе фосфатные покрытия не обеспечивают надежной коррозионной защиты. Преимущественно их используют как основу под окраску, обеспечивающую хорошее сцепление краски с металлом. Кроме того, фосфатный слой уменьшает коррозионные разрушения при образовании царапин или других дефектов.
Силикатные покрытия
Для защиты металлов от коррозии используют стекловидные и фарфоровые эмали, коэффициент теплового расширения которых должен быть близок к таковому для покрываемых металлов. Эмалирование осуществляют нанесением на поверхность изделий водной суспензии или сухим напудриванием. Кроме того, вводят вспомогательные материалы: окислители органических примесей, оксиды, способствующие сцеплению эмали с эмалируемой поверхностью, глушители, красители.
Эмали обладают высокими защитными свойствами, которые обусловлены их непроницаемостью для воды и воздуха (газов) даже при длительном контакте. Их важным качеством является высокая стойкость при повышенных температурах. К основным недостаткам эмалевых покрытий относят чувствительность к механическим и термическим ударам. При длительной эксплуатации на поверхности эмалевых покрытий может появиться сетка трещин, которая обеспечивает доступ влаги и воздуха к металлу, вследствие чего и начинается коррозия.
Цементные покрытия
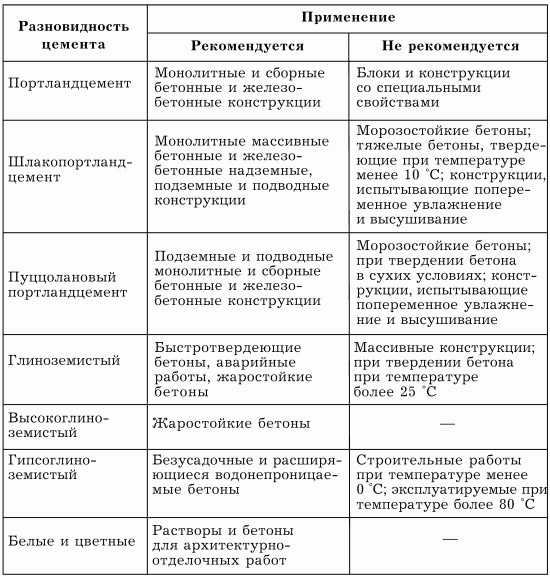
Для защиты чугунных и стальных водяных труб от коррозии используют цементные покрытия. Поскольку коэффициенты теплового расширения портландцемента и стали близки, то он довольно широко применяется для этих целей. Недостаток портландцементных покрытий тот же, что и эмалевых, – высокая чувствительность к механическим ударам.
Покрытие металлами
Широко распространенным способом защиты металлов от коррозии является покрытие их слоем других металлов. Покрывающие металлы сами корродируют с малой скоростью, так как покрываются плотной оксидной пленкой. Покрывающий слой наносят различными методами:
· горячее покрытие – кратковременное погружение в ванну с расплавленным металлом;
· гальваническое покрытие – электроосаждение из водных растворов электролитов;
· металлизация – напыление;
· диффузионное покрытие – обработка порошками при повышенной температуре в специальном барабане;
Металлические покрытия защищают железо от коррозии при сохранении сплошности. При нарушении же покрывающего слоя коррозия изделия протекает даже более интенсивно, чем без покрытия. Это объясняется работой гальванического элемента железо–металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии).
Ингибиторы
Применение ингибиторов – один из самых эффективных способов борьбы с коррозией металлов в различных агрессивных средах. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их.
Ингибирующее воздействие на металлы, прежде всего на сталь, оказывает целый ряд неорганических и органических веществ, которые часто добавляются в среду, вызывающую коррозию. Ингибиторы имеют свойство создавать на поверхности металла очень тонкую пленку, защищающую металл от коррозии.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление растворов.
В ходе данной лабораторной работы используют уже приготовленные растворы с различной концентрацией HCl. Концентрацию рабочего раствора задаёт преподаватель.
Подготовка образцов стали.
В качестве исследуемого образца используют пластинки цинка различной чистоты или пластинки другого металла. Перед опытом измеряют её площадь и массу (S, см2; m0, г).
Методика эксперимента
Для проведения эксперимента по определению скорости коррозии цинка (или другого металла) собирают установку (рис. 1) – водородный коррозиометр. Он состоит из газовой бюретки, снабженной в нижней части расширением, внутри которого крючок для закрепления образца.
Пластинку, подготовленную согласно пункту 2.2. подвешивают на крючок в водородном коррозиметре. Бюретка помещается в химический стакан с раствором кислоты и с помощью резиновой груши заполняется этим раствором. После того как вся установка собрана, отмечают время по секундомеру и соответствующее этому начальному моменту времени положение мениска жидкости в верхней части бюретки. В последующем отсчеты объемов производят через каждые 2 минуты в течение 25-30 минут. Полученные данные представляют в таблице 1 и отображают на графике «объём выделенного водорода-время». Если процесс протекает с постоянной скоростью, то объем выделенного водорода прямо пропорционален времени. Наклон прямой дает непосредственное значение скорости коррозии металла в растворе кислоты.
Рис.1. Водородный коррозиметр
Величину этой скорости следует выразить с помощью весового показателя скорости коррозии в мм/см2•мин, принимая во внимание размер образца.
На основе данных таблицы1, расчёт скорости коррозии производится исходя из объёма газа, собранного в бюретке за всё время опыта, что даёт среднее значение скорости коррозии.
Скорость коррозии можно определить и по потери массы металлической пластинки. Для этого после опыта её тщательно высушивают, взвешивают(m) и выражают скорость коррозии в г/см2•час.
Одной из возможных причин погрешности в оценке скорости коррозии в данном методе служит прилипание пузырьков водорода к стенкам бюретки. Чтобы избежать этого перед опытом необходимо тщательно промыть водородный коррозиметр хромовой смесью, тщательно ополаснуть сначала водопроводной, а затем дистиллированной водой, добиваясь полной смачиваемости внутренних стенок бюретки.
Таблица 1
Зависимость объёма выделившегося водорода от времени
при коррозии цинка в 1 н HCl
| № п/п | Время τ, мин | |
| и т.д. |
Строят график V=f(τ) и расчитывают скорость коррозии.
КОНТРОЛЬНЫЕ ВОПРОСЫ
- Из каких стадий состоит коррозионный процесс?
- Какой процесс называют электрохимической коррозией?
- Механизм взаимодействия цинка с кислотами.
- Гальванический элемент Вольта.
- Механизм коррозии металла с кислородной деполяризацией.
- Что такое поляризация? Перенапряжение кислорода?
- Понятие диффузионного и кинетически-диффузионного контроля.
- Механизм коррозии металла с водородной деполяризацией.
- Влияние серной кислоты на коррозию металлов.
- Влияние азотной и соляной кислот на коррозию металлов.
- Влияние фосфорной и фтороводородной кислот на коррозию металлов.
- Влияние органических кислот на коррозию металлов.
- Методы защиты от коррозии.
Таблица 1
Зависимость объёма выделившегося водорода от времени при коррозии цинка в 1 н HCl
| V,мл | 1,25 | 2,5 | 3,75 | 5,0 |
| t, мин |
1) i = 1,25/0,5 = 2,5 мг/(см2час) - скорость коррозии в 1 н HCl
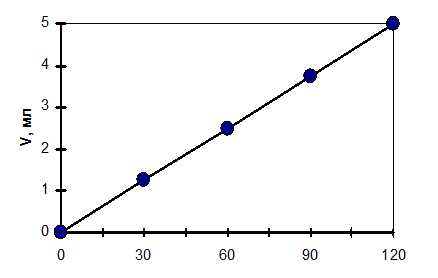
Рис. Зависимость V выделившегося водорода от τ при коррозии цинка в 1 н HCl
stydopedia.ru
Коррозия металлов и способы защиты от коррозии
При обычных условиях металлы могут вступать в химические реакции с веществами, содержащимися в окружающей среде, - кислородом и водой. На поверхности металлов появляются пятна, металл становится хрупким и не выдерживает нагрузок.
Это приводит к разрушению металлических изделий, на изготовление которых было затрачено большое количество сырья, энергии и много человеческих усилий.
Коррозией называют самопроизвольное разрушение металлов и сплавов под воздействием окружающей среды.
Яркий пример коррозии - ржавчина на поверхности стальных и чугунных изделий. Ежегодно из-за коррозии теряют около четверти всего производимого в мире железа. Затраты на ремонт или замену судов, автомобилей, приборов и коммуникаций, водопроводных труб во много раз превышают стоимость металла, из которого они изготовлены. Продукты коррозии загрязняют окружающую среду и негативно влияют на жизнь и здоровье людей.
Химическая коррозия происходит в различных химических производствах. В атмосфере активных газов (водорода, сероводорода, хлора), в среде кислот, щелочей, солей, а также в расплавах солей и других веществ происходят специфические реакции с привлечением металлических материалов, из которых сделаны аппараты, в которых осуществляется химический процесс. Газовая коррозия происходит при повышенных температурах. Под ее влияние попадают арматура печей, детали двигателей внутреннего сгорания. Электрохимическая коррозия происходит, если металл находится в любом водном растворе.
Наиболее активными компонентами окружающей среды, которые действуют на металлы, есть кислород О2, водяной пар Н2О, карбон (IV) оксид СО2, серы (IV) оксид SО2, азота (IV) оксид NО2. Очень сильно ускоряется процесс коррозии при контакте металлов с соленой водой. По этой причине корабли ржавеют в морской воде быстрее, чем в пресной.
Суть коррозии заключается в окислении металлов. Продуктами коррозии могут быть оксиды, гидроксиды, соли и т.д.. Например, коррозии железа можно схематично описать следующим уравнением:
4Fe + 6h3O + 3O2 ? 4Fe (OH) 3.
Остановить коррозию невозможно, но ее можно замедлить. Существует много способов защиты металлов от коррозии, но основным приемом является предотвращение контакта железа с воздухом. Для этого металлические изделия красят, покрывают лаком или покрывают слоем смазки. В большинстве случаев этого достаточно, чтобы металл не разрушался в течение нескольких десятков или даже сотен лет. Другой способ защиты металлов от коррозии электрохимическое покрытие поверхности металла или сплава другими металлами, которые являются стойкими к коррозии (никелирование, хромирование, оцинковка, серебрение и золочение). В технике очень часто используют специальные коррозионностойкие сплавы. Для замедления коррозии металлических изделий в кислой среде также используют специальные вещества - ингибиторы.
worldofscience.ru
КОРРОЗИЯ МЕТАЛЛОВ И СПОСОБЫ ЗАЩИТЫ ОТ НЕЕ
Строительные материалы и изделия
І Коррозия металлов — процесс разрушения металлов и сплавов
вследствие химического или электрохимического взаимодействия с ; внешней средой, в результате которого металлы окисляются и теряют ; присущие им свойства. Ежегодно в мире в результате коррозии теряется
10.. .15% выплавляемого металла или 1...1,5% всего металла, накоп - . ленного и эксплуатируемого человеком. В наибольшей степени кор - І розии подвергаются черные металлы (сталь и чугун).
Химическая коррозия — разрушение металлов и сплавов в результате, окисления при взаимодействии с сухими газами (02, S02 и др.) при ; высоких температурах или с органическими жидкостями — нефтепродуктами, спиртом и т. п.
1___ Электрохиминескаякоррози я — разрушение^лиеталдсшышллшавовла
. воде и водных растворах. Для развития коррозии достаточно, чтобы!; металл был просто покрыт тончайшим слоем адсорбированной воды I (влажная поверхность). Из-за неоднородности строения металла при
- электрохимической коррозии в нем образуются гальванические пары I (катод — анод), например между зернами (кристаллами) металла, от - ’■ личаюшимися один от другого химическим составом. Атомы металла : с анода переходят в раствор в виде катионов. Эти катионы, соединяясь
- с анионами, содержащимися в растворе, образуют на поверхности
• металла слой ржавчины. В основном металлы разрушаются от электрохимической коррозии.
| Для повышения долговечности и сохранения декоративности ме-
!" таллоконструкции защищают от коррозии. Сущность большинства. способов защиты от коррозии — предохранение поверхности металла : от проникновения к ней влаги и газов путем создания на металле
• ’ 133
защитного слоя. Существуют и другие методы, например электрохимическая защита, с помощью установки прожектора из более активного металла на защищаемую металлоконструкцию.
Наиболее простой, но не долговечный метод защиты металла — нанесение на его поверхность водонепроницаемых неметаллических покрытий (битумных, масляных и эмалевых красок). В последние годы все большее применение находит метод защиты от коррозии покрытием металла тонким слоем пластмассы.
Защитить металл от коррозии можно также, покрывая его слоем другого более коррозионно-стойкого металла: оловом, цинком, хромом, никелем и др. Защитный слой металла наносят путем никелиро - вания, хромирования, лужения, цинкования и свинцевания. Покрытие цинком используют для защиты от коррозии закладных деталей железобетонных изделий, водопроводных труб, кровельной жести. Защитный слой наносят гальваническим (электролитическим осаждением из раствора солей) или термическим (окунанием в расплав металла или распылением расплава) методом.
Применяют химические способы образования покрытий (плотных оксидных пленок) на металле: фосфатирование (для черных металлов) и анодирование (для алюминиевых сплавов).
Для получения металлов, хорошо противостоящих коррозии, применяют легирование. Так, вводя в сталь хром и никель в количестве
12.. .20 %, получают нержавеющие стали, стойкие не только к воде, но и к минеральным кислотам,
ЛАКОКРАСОЧНЫЕ МАТЕРИАЛЫ
Лакокрасочные материалы (ЛКМ) используются для получения защитных и декоративных покрытий на изделиях. ЛКМ после нанесения на поверхность отвердевают, образуя непроницаемую пленку, которая прочно сцепляется с основанием. Толщина пленки может составлять …
Геосинтетические материалы
Геосинтетические материалы — это материалы на основе полимерных волокон, проволоки, пленки, тканей, сеток, сотовых каркасов и т. д. Их применяют в гидротехническом строительстве; при строительстве дорог и аэродромов; сооружении хвостохранилищ, …
Полимербетоны и бетонополимеры
Полимербетон отличается от других видов бетона тем, что связующим веществом в нем являются термореактивные смолы (полиэфирные, фенольные, фурановые, карбамидные, реже — полиуретановые и эпоксидные). Термопластичные полимеры также могут быть использованы, …
msd.com.ua