Open Library - открытая библиотека учебной информации. Внутреннее строение сплавов
Внутреннее строение металлов и сплавов Кристаллическое строение металлов
У веществ в твердом состоянии строение кристаллическое или аморфное. В кристаллическом веществе атомы расположены по геометрически правильной схеме и на определенном расстоянии друг от друга, в аморфном же (стекле, канифоли) атомы расположены беспорядочно.
У всех металлов и их сплавов строение кристаллическое. На рис.12показана структура чистого железа. Кристаллические зерна неопределенной формы не похожи на типичные кристаллы - многогранники, поэтому их называюткристаллитами, зернамиили гранулами. Однако строение кристаллитов столь же закономерно, как и у развитых кристаллов.
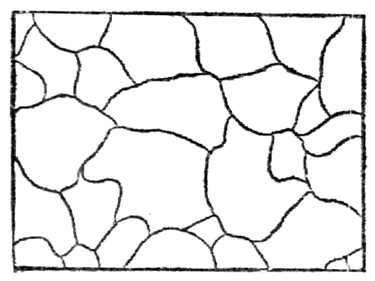
Рис.12.Микроструктура чистого железа (х - 150)
Виды кристаллических решеток. При затвердевании атомы металлов образуют геометрически правильные системы, называемыекристаллическими решетками. Порядок расположения атомов в решетке может быть различным. Многие важнейшие металлы образуют решетки, простейшие (элементарные) ячейки которых представляют форму центрированного куба (- и- железо, хром, молибден, вольфрам, ванадий, марганец), куба с центрированными гранями (- железо, алюминий, медь, никель, свинец) или гексагональную, как у шестигранной призмы, ячейку (магний, цинк,- титан,- кобальт).
Элементарная ячейкаповторяется непрерывно в трех измерениях, образуя кристаллическую решетку, поэтому положение атомов в элементарной ячейке определяет структуру всего кристалла.
Элементарная ячейка центрированного куба (рис.13) состоит из девяти атомов, из которых восемь расположены по вершинам куба, а девятый — в его центре.
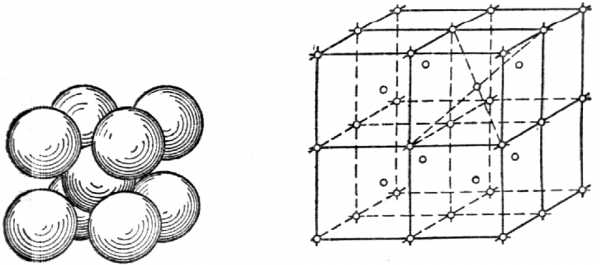
Рис.13. Элементарная ячейкаРис.14. Часть пространственной решет-
центрированного куба ки центрированного куба
Для характеристики кристаллической решетки (атомной структуры кристалла) применяют пространственную решетку, которая является геометрической схемой кристаллической решетки и состоит из точек (узлов), закономерно расположенных в пространств.
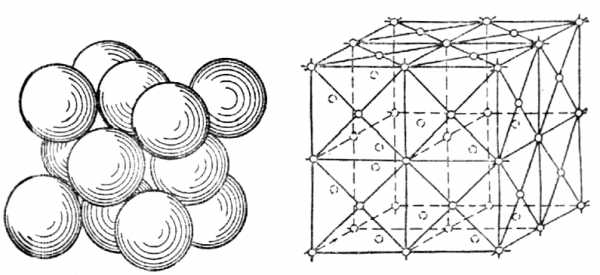
Рис.15. Элементарная ячейка кубаРис.16. Часть пространственной ре-
с центрированными гранями шетки куба с центрированными
гранями
На рис.14приведена часть пространственной решетки центрированного куба. Здесь взяты восемь смежных элементарных ячеек; узлы, расположенные по вершинам и в центре каждой ячейки, отмечены кружками. Элементарная ячейка куба с центрированными гранями (рис.15) состоит из 14 атомов, из них 8 атомов расположены по вершинам - куба и 6 атомов — по граням.
На рис.16приведена часть пространственной решетки куба с центрированными гранями ( гранецентрированного куба). На схеме имеется восемь элементарных ячеек; узлы расположены по вершинам и по центрам граней каждой ячейки. Гексагональная ячейка (рис.17) состоит из 17 атомов, из них 12 атомов расположены по вершинам шестигранной призмы, 2 атома — в центре оснований и 3 атома — внутри призмы. Для измерения расстояния между атомами кристаллических решеток пользуются специальной единицей, называемойангстремом см.
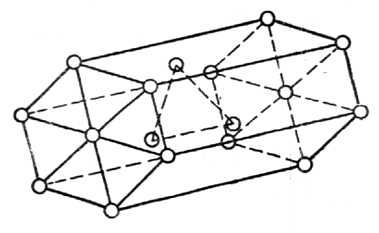
Рис.17. Гексагональная ячейка
Параметр решеток (сторона или шестигранника) у меди 3,6 А, а у алюминия 4,05 А, у цинка 2,67 А и т. д.
Каждый атом состоит из положительно заряженного ядра и нескольких слоев (оболочек) отрицательно заряженных и движущихся вокруг ядра электронов. Электроны внешних оболочек атомов металлов, называемые валентными, легко отщепляются, быстро движутся между ядрами и называютсясвободными. Вследствие наличия свободных электронов атомы металлов являются положительно заряженными ионами.
Таким образом, в узлах решеток, обозначенных кружками рис.14и16, находятся положительно заряженные ионы. Ионы, однако, не находятся в покое, а непрерывно колеблются положения равновесия. С повышением температуры амплитуда колебаний увеличивается, что вызывает расширение кристаллов, а при температуре плавления колебания частиц усиливаются настолько, что кристаллическая решетка разрушается.
Во всех кристаллах наблюдаются небольшие отклонения от идеальной решетки — незанятые узлы и различного рода смещения атомов.
Анизотропность и спайность кристаллов. В отдельных кристаллах свойства различны в разных направлениях. Если взять большой кристалл (существуют лабораторные и даже производственные методы выращивания крупных кристаллов) вырезать из него несколько одинаковых по размеру, но различно ориентированных образцов, и испытать их свойства, то иногда наблюдается весьма значительная разница в свойствах между отдельными образцами. Например, при испытании образцов, вырезанных из кристалла меди, относительное удлинение изменялось в пределах от 10 - 50 %, а предел прочности—от 14 до 35 кГ/мм2для различных образцов. Это свойство кристаллов называютанизотропностью. Анизотропность кристаллов объясняется особенностями расположения атомов в пространстве.
Следствием анизотропности кристаллов является спайность, которая выявляется при разрушении. В местах излома кристаллов можно наблюдать правильные плоскости, указывающие на смещение частиц под влиянием внешних сил не беспорядочное, а правильными рядами, в определенном направлении, соответственно расположению частиц в кристалле. Эти плоскости называютсяплоскостями спайности.
Аморфные тела изотропны, т. е. все их свойства одинаковы во всех направлениях. Излом аморфного тела всегда имеет неправильную искривленную, так называемую, раковистую поверхность.
Металлы, затвердевшие в обычных условиях, состоят не из одного кристалла, а из множества отдельных кристаллитов, различно ориентированных друг к другу, поэтому свойства литого металла приблизительно одинаковы во всех направлениях; это явление называют квазиизотропностью(кажущейся изотропностью).
Аллотропия металлов(или полиморфизм) — их свойство перестраивать решетку при определенных температурах в процессе нагревания или охлаждения. Аллотропию обнаруживают все элементы, меняющие валентность при изменении температуры: например, железо, марганец, никель, олово и др. Каждое аллотропическое превращение происходит при определенной температуре. Например, одно из превращений железа происходит при температуре 910°С, ниже которой атомы составляют решетку центрированного куба (см.рис.14), а выше — решетку гранецентрированного куба (см.рис.16).
Та или иная структура называется аллотропической формой или модификацией. Различные модификации обозначают греческими буквами , , и т. д., причем буквойобозначают модификацию, существующую при температурах ниже первого аллотропического превращения. Аллотропические превращения сопровождаются отдачей (уменьшением) или поглощением (увеличением) энергии.
Кристаллизация металлов. Кристаллизацией называется образование кристаллов в металлах (и сплавах) при переходе из жидкого состояния в твердое (первичная кристаллизация). Перекристаллизацию из одной модификации в другую при остывании эатвердевшего металла называют (вторичной кристаллизацией). Процесс кристаллизации металла легче всего проследить с помощью счетчика времени и термоэлектрического пирометра, который представляет собой милливольтметр, подключенный к термопаре. Термопару (две разнородные проволоки спаянные концами) погружают в расплавленный металл. Возникающий при этом термоток пропорционален температуре металла и стрелка милливольтметра отклоняется, указывая эту температуру по градуированной шкале.
Показания пирометра автоматически записываются во времени и по полученным данным строят кривые охлаждения в координатах «температура — время» (такие кривые вычерчивает самописец).
Температура, соответствующая какому-либо превращению в металле, называется критической точкой.
На рис.18, априведена кривая нагрева металла. Здесь точка а- начало плавления, точкаb — окончание плавления.
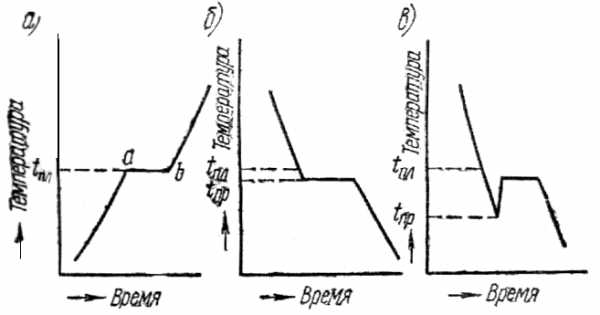
Рис.18. Кривые нагревания (а) и охлаждения (б- без петли,
в - с петлей) металла
Участок аbуказывает на неизменность температуры во времени при продолжающемся нагревании. Это показывает, что тепловая энергия затрачивается на внутреннее превращение в металле, в данном случае. на превращение твердого металла в жидкий (скрытая теплота плавления).
Переход из жидкого состояния в твердое при охлаждении сопровождается образованием кристаллической решетки, т. е. кристаллизацией. Чтобы вызвать кристаллизацию, жидкий металл нужно переохладитьнесколько ниже температуры плавления. Поэтому площадка на кривой охлаждения (рис.19,6) находится несколько нижеtпл при температуре переохлажденияtпр.
У некоторых металлов переохлаждение (tпл — tпр) может оказаться весьма значительным (например, у сурьмы до 40°С) и при температуре переохлажденияtпр(рис. 18, в) сразу бурно начинается кристаллизация, в результате чего температура скачком повышается почти доtпл. В этом случае на графике вычерчивается петля теплового гистерезиса.
При затвердевании и при аллотропическом превращении в металле вначале возникают зародыши кристалла (центры кристаллизации), вокруг которых группируются атомы, образуя соответствующую кристаллическую решетку.
Таким образом, процесс кристаллизации складывается из двух этапов: образования центров кристаллизации и роста кристаллов.
У каждого из возникающих кристаллов кристаллографические плоскости ориентированы случайно, кроме того, при первичной кристаллизации кристаллы могут поворачиваться, так как они окружены жидкостью. Смежные кристаллы растут навстречу друг другу и точки их соприкосновения определяют границы кристаллитов (зерен).
Кристаллизация железа. Рассмотрим в качестве примера кристаллизацию и критические точки железа.
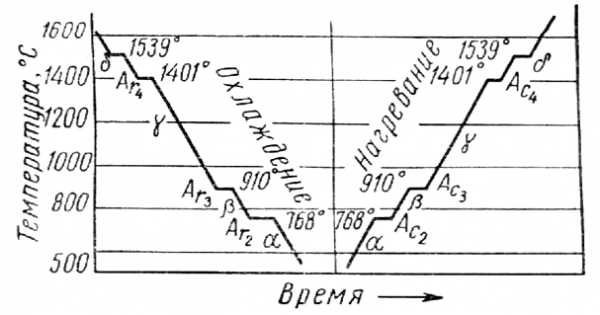
Рис.19. Кривые охлаждения и нагревания железа
На рис.19приведены кривые охлаждения и нагревания чистого железа, которое плавится при температуре 15390С. Наличие критических точек при меньших температурах указывает на аллотропические превращения в твердом железе.
Критические точки обозначаются буквой А, при нагревании обозначаютАcи при охлажденииAr индексы 2, 3, 4 служат для отличия аллотропических превращений (индекс 1 обозначает превращение на диаграмме состоянияFe - Fe3C.
При температурах ниже 768 0С железо магнитно и имеет кристаллическую решетку центрированного куба. Эту модификацию называют-железо ; при нагревании она в точкеАс2переходит в немагнитную модификацию-железо. Кристаллическая структура при этом не меняется.
В точке Ас3при температуре 9100С-железо переходит в-железо с кристаллической решеткой гранецентрированного куба.
В точке Ас4при температуре 14010С-железо переходит в-железо, причем кристаллическая решетка вновь перестраивается из гранецентрированного куба в центрированный куб.
При охлаждении происходят те же переходы, только в обратной последовательности.
Из перечисленных превращений наибольшее практическое значение имеют превращения А3 как при нагреве (Ас3), так и при охлаждении (Аr3).
Превращение в точке А3сопровождается изменением объема, так как плотность кристаллической решетки-железа больше плотности решетки-железа, в точкеАс3 объем уменьшается, в точкеAr3 - увеличивается.
studfiles.net
Внутреннее строение - сплав - Большая Энциклопедия Нефти и Газа, статья, страница 1
Внутреннее строение - сплав
Cтраница 1
Внутреннее строение сплавов определяется той связью, которая возникает между составляющими их элементами. [2]
Внутреннее строение сплавов значительно отличается от строения металлов и неметаллов, из которых они образованы. Этим объясняется и резкое отличие свойств сплавов от свойств исходных материалов. [3]
Внутреннее строение сплавов определяется той связью, которая возникает между составляющими их элементами. [5]
Изменение внутреннего строения сплава путем ввода различных химических элементов в процессе его плавки называется объемным легированием. Легирование может быть и поверхностным, осуществляемым путем диффузионного насыщения отливок. Химические элементы, специально вводимые в сплав в различных количествах с целью изменения его строения, состава и свойств, называются легирующими добавками. [6]
Легирующие добавки изменяют внутреннее строение сплава в результате образования новых структурных составляющих и фаз. Легирующий элемент может вступить в соединение с другими элементами, образовать сложные твердые растворы, раствориться в металлической основе, образовать интерметаллические соединения, неметаллические фазы, присутствовать в виде самостоятельной фазы. [7]
Металлографический метод испытаний позволяет изучать внутреннее строение сплавов и осуществляется макроскопическим и микроскопическим анализами. [8]
Металлографический метод испытаний позволяет изучать внутреннее строение сплавов при помощи макроскопических и микроскопических анализов. [9]
Термической обработкой называются процессы, связанные с нагревом и охлаждением, вызывающие изменения внутреннего строения сплава и, в связи с этим, изменения физических, механических и других свойств. [10]
Термической обработкой называют процессы, связанные с нагревом и охлаждением, вызывающие изменение внутреннего строения сплава и, как следствие этого, изменение механических, физических и других свойств. [11]
Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, проводимых в определенной последовательности с целью изменения внутреннего строения сплава и получения нужных свойств. [12]
Термическая обработка представляет собой совокупность операций нагрева, выдержки и охлаждения, проводимых в определенной последовательности с целью изменения внутреннего строения сплава и получения нужных свойств. [13]
Диаграммы состояния являются обобщением большого числа наблюдений над составом и структурой сплавов, и знакомство с ними дает возможность лучше усвоить процессы изменения внутреннего строения сплавов и в твердом состоянии, что имеет важное значение во многих случаях, особенно при термической обработке. [14]
Микроскопический анализ ( микроанализ) - исследование металлов при больших увеличениях ( до 2000 раз) при помощи металломикроскопов - применяют для определения химического состава некоторых составляющих и характера действия на них специальных веществ, участвующих в химической реакции; для выявления микропороков ( пористости, раковин, трещин) и изменений внутреннего строения сплава, происходящих под влиянием различных режимов термической и химикотермической обработки, а также после внешнего механического воздействия на сплав. [15]
Страницы: 1 2
www.ngpedia.ru
Внутреннее строение сплавов
Химия Внутреннее строение сплавов
просмотров - 62
Большинство сплавов получают сплавлением компонентов в жидком состоянии. Компоненты, из которых состоят сплавы, в твердом состоянии могут по-разному взаимодействовать друг с другом, образуя механические смеси, твердые растворы и химические соединения.
Механическая смесь двух компонентов образуется тогда, когда они в твердом состоянии не растворяются друг в друге и не вступают в химическое взаимодействие. Сплавы – механические смеси (к примеру, свинец–сурьма, олово–цинк) неоднородны по своей структуре и представляют смесь кристаллов данных компонентов. При этом кристаллы каждого компонента в сплаве полностью сохраняют свои индивидуальные свойства. Вот почему свойства таких сплавов (к примеру, электросопротивление, твердость и др.) определяются как среднее арифметическое от величины свойств обоих компонентов.
Сплавы – твердые растворы характеризуются образованием общей пространственной кристаллической решетки атомами основного металла-растворителя и атомами растворимого элемента. Структура таких сплавов состоит из однородных кристаллических зерен, подобно чистому металлу. Существуют твердые растворы замещения (медноникелевые, железохромистые и др. сплавы) и твердые растворы внедрения (к примеру, раствор железа и углерода) (рис. 5).
Сплавы — твердые растворы являются самыми распространенными. Их свойства отличаются от свойств составляющих компонентов. Так, к примеру, твердость и электросопротивление у твердых растворов значительно выше, чем у чистых компонентов. Благодаря высокой пластичности они хорошо поддаются ковке и другим видам обработки давлением. Обрабатываемость резанием у твердых растворов низкие.
Химические соединения, подобно твердым растворам, являются однородными сплавами. Важной особенностью их является то, что при затвердевании образуется совершенно новая кристаллическая решетка, отличная от решеток составляющих сплав компонентов. По этой причине свойства химического соединения самостоятельны и не зависят от свойств компонентов. Химические соединения образуются при строго определенном количественном соотношении сплавляемых компонентов. Состав сплава химического соединения выражается химической формулой. Эти сплавы обладают обычно высоким электросопротивлением, большой твердостью, малой пластичностью. Так, химическое соединение железа с углеродом – цементит (Fe3C) тверже чистого железа в 10 раз.
Читайте также
Большинство сплавов получают сплавлением компонентов в жидком состоянии. Компоненты, из которых состоят сплавы, в твердом состоянии могут по-разному взаимодействовать друг с другом, образуя механические смеси, твердые растворы и химические соединения. Механическая... [читать подробенее]
oplib.ru
Внутреннее строение сплавов - Химия
Большинство сплавов получают сплавлением компонентов в жидком состоянии. Компоненты, из которых состоят сплавы, в твердом состоянии могут по-разному взаимодействовать друг с другом, образуя механические смеси, твердые растворы и химические соединения.
Механическая смесь двух компонентов образуется тогда, когда они в твердом состоянии не растворяются друг в друге и не вступают в химическое взаимодействие. Сплавы – механические смеси (например, свинец–сурьма, олово–цинк) неоднородны по своей структуре и представляют смесь кристаллов данных компонентов. При этом кристаллы каждого компонента в сплаве полностью сохраняют свои индивидуальные свойства. Вот почему свойства таких сплавов (например, электросопротивление, твердость и др.) определяются как среднее арифметическое от величины свойств обоих компонентов.
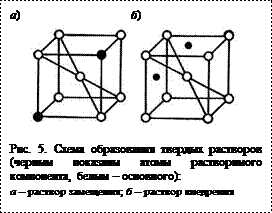 Сплавы – твердые растворы характеризуются образованием общей пространственной кристаллической решетки атомами основного металла-растворителя и атомами растворимого элемента. Структура таких сплавов состоит из однородных кристаллических зерен, подобно чистому металлу. Существуют твердые растворы замещения (медноникелевые, железохромистые и др. сплавы) и твердые растворы внедрения (например, раствор железа и углерода) (рис. 5).
Сплавы – твердые растворы характеризуются образованием общей пространственной кристаллической решетки атомами основного металла-растворителя и атомами растворимого элемента. Структура таких сплавов состоит из однородных кристаллических зерен, подобно чистому металлу. Существуют твердые растворы замещения (медноникелевые, железохромистые и др. сплавы) и твердые растворы внедрения (например, раствор железа и углерода) (рис. 5).
Сплавы — твердые растворы являются самыми распространенными. Их свойства отличаются от свойств составляющих компонентов. Так, например, твердость и электросопротивление у твердых растворов значительно выше, чем у чистых компонентов. Благодаря высокой пластичности они хорошо поддаются ковке и другим видам обработки давлением. Обрабатываемость резанием у твердых растворов низкие.
Химические соединения, подобно твердым растворам, являются однородными сплавами. Важной особенностью их является то, что при затвердевании образуется совершенно новая кристаллическая решетка, отличная от решеток составляющих сплав компонентов. Поэтому свойства химического соединения самостоятельны и не зависят от свойств компонентов. Химические соединения образуются при строго определенном количественном соотношении сплавляемых компонентов. Состав сплава химического соединения выражается химической формулой. Эти сплавы обладают обычно высоким электросопротивлением, большой твердостью, малой пластичностью. Так, химическое соединение железа с углеродом – цементит (Fe3C) тверже чистого железа в 10 раз.
Кристаллизация сплавов
Сплавы имеют более сложную структуру, чем простые металлы. В связи с этим процессы кристаллизации сплавов протекают значительно сложнее, чем металлов.
Сплавы в отличие от чистых металлов при затвердевании или плавлении имеют не одну, а две критические точки – температуры, при которых в металлах или сплавах происходят какие-либо превращения (рис. 6).
Для облегчения изучения сплавов их объединяют в системы.
К системам относятся все те сплавы, которые состоят из одних и тех же компонентов и отличающиеся друг от друга лишь количественным соотношением этих компонентов, т. е. концентрацией. Так, например, к системе сплавов свинец–сурьма относятся все сплавы, состоящие из свинца и сурьмы и отличающиеся друг от друга лишь количественным составом этих компонентов.
Количество сплавов одной системы, но разной концентрации настолько велико, что изучать по кривым охлаждения или нагревания все превращения, происходящие в каждом из них, практически невозможно, да и нерационально. Для изучения состояния сплавов выбранной системы в зависимости от температуры и концентрации строят диаграмму состояния.
student2.ru
Внутреннее строение сплавов
Большинство сплавов получают сплавлением компонентов в жидком состоянии. Компоненты, из которых состоят сплавы, в твердом состоянии могут по-разному взаимодействовать друг с другом, образуя механические смеси, твердые растворы и химические соединения.
Механическая смесь двух компонентов образуется тогда, когда они в твердом состоянии не растворяются друг в друге и не вступают в химическое взаимодействие. Сплавы – механические смеси (например, свинец–сурьма, олово–цинк) неоднородны по своей структуре и представляют смесь кристаллов данных компонентов. При этом кристаллы каждого компонента в сплаве полностью сохраняют свои индивидуальные свойства. Вот почему свойства таких сплавов (например, электросопротивление, твердость и др.) определяются как среднее арифметическое от величины свойств обоих компонентов.
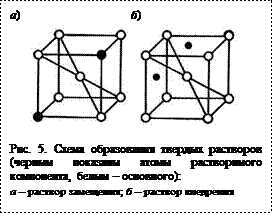 Сплавы – твердые растворы характеризуются образованием общей пространственной кристаллической решетки атомами основного металла-растворителя и атомами растворимого элемента. Структура таких сплавов состоит из однородных кристаллических зерен, подобно чистому металлу. Существуют твердые растворы замещения (медноникелевые, железохромистые и др. сплавы) и твердые растворы внедрения (например, раствор железа и углерода) (рис. 5).
Сплавы – твердые растворы характеризуются образованием общей пространственной кристаллической решетки атомами основного металла-растворителя и атомами растворимого элемента. Структура таких сплавов состоит из однородных кристаллических зерен, подобно чистому металлу. Существуют твердые растворы замещения (медноникелевые, железохромистые и др. сплавы) и твердые растворы внедрения (например, раствор железа и углерода) (рис. 5).
Сплавы — твердые растворы являются самыми распространенными. Их свойства отличаются от свойств составляющих компонентов. Так, например, твердость и электросопротивление у твердых растворов значительно выше, чем у чистых компонентов. Благодаря высокой пластичности они хорошо поддаются ковке и другим видам обработки давлением. Обрабатываемость резанием у твердых растворов низкие.
Химические соединения, подобно твердым растворам, являются однородными сплавами. Важной особенностью их является то, что при затвердевании образуется совершенно новая кристаллическая решетка, отличная от решеток составляющих сплав компонентов. Поэтому свойства химического соединения самостоятельны и не зависят от свойств компонентов. Химические соединения образуются при строго определенном количественном соотношении сплавляемых компонентов. Состав сплава химического соединения выражается химической формулой. Эти сплавы обладают обычно высоким электросопротивлением, большой твердостью, малой пластичностью. Так, химическое соединение железа с углеродом – цементит (Fe3C) тверже чистого железа в 10 раз.
Кристаллизация сплавов
Сплавы имеют более сложную структуру, чем простые металлы. В связи с этим процессы кристаллизации сплавов протекают значительно сложнее, чем металлов.
Сплавы в отличие от чистых металлов при затвердевании или плавлении имеют не одну, а две критические точки – температуры, при которых в металлах или сплавах происходят какие-либо превращения (рис. 6).
Для облегчения изучения сплавов их объединяют в системы.
К системам относятся все те сплавы, которые состоят из одних и тех же компонентов и отличающиеся друг от друга лишь количественным соотношением этих компонентов, т. е. концентрацией. Так, например, к системе сплавов свинец–сурьма относятся все сплавы, состоящие из свинца и сурьмы и отличающиеся друг от друга лишь количественным составом этих компонентов.
Количество сплавов одной системы, но разной концентрации настолько велико, что изучать по кривым охлаждения или нагревания все превращения, происходящие в каждом из них, практически невозможно, да и нерационально. Для изучения состояния сплавов выбранной системы в зависимости от температуры и концентрации строят диаграмму состояния.
studlib.info
СТРОЕНИЕ МЕТАЛЛОВ И СПЛАВОВ
РЕДКИЕ МЕТАЛЛЫ
Еталлы, как и все окружающие нас тела, состоят из отдельных невидимых даже в самый сильный микроскоп частиц, называемых атомами. Но атомы в свою очередь построены из ещё более мелких частиц: протонов, электронов и нейтронов. Протоны и электроны имеют электрические заряды: протон — положительный заряд, а электрон — отрицательный, нейтрон же не имеет никакого электрического заряда.
Если два протона «находятся близко, они отталкиваются друг от друга, так как они заряжены одноимённым электричеством. Так же ведут себя и два электрона. Напротив, протон и электрон притягиваются друг к другу, причём силы взаимного притяжения протона и электрона равны между собой, т. е. протон обладает элементарным электрическим зарядом, равным заряду электрона.
Атом в нормальном состоянии, т. е. когда он содержит одинаковое количество протонов и электронов, не обладает электрическим зарядом. Но бывают такие состояния атома, когда он приобретает или теряет электроны. Тогда атом становится электрически заряженным. При избытке электронов атом заряжен отрицательным электричеством, а при нехватке электронов он заряжен положительным электричеством. Вот такие атомы, в которых имеется избыток или недостаток электронов, называются ионами.
Как же располагаются элементарные частицы в атоме?
В настоящее время считают, что атом построен следующим образом. Протоны и нейтроны составляют ядро, находящееся в центре атома. Вокруг ядра обращаются электроны, которые образуют электронную оболочку атома. В каждом атоме количество электронов равно количеству протонов.
Электроны в электронной оболочке расположены слоями. В каждом слое может поместиться лишь опреде* лённое количество электронов. Первый слой, окружающий непосредственно ядро, может вместить лишь два электрона, второй слой — 8, третий — от 8 до 18 электронов. Каждый новый слой электронов при переходе от одного атома к другому образуется обычно после заполнения близлежащего к ядру внутреннего слоя.
Например, ядро атома натрия, как установлено, имеет 11 протонов, а его 11 электронов распределены в трёх оболочках: в первой — 2, во второй — 8 и в третьей —
1 электрон. Ядро атома рубидия содержит 37 протонов и окружено 37 электронами, котс^рые расположены в пяти оболочках: в первой — 2, во второй — 8, в третьей—18, в четвёртой — 8, в пятой — 1 электрон. Ещё более сложное строение имеет атом урана. Его ядро содержит 92 протона, а в электронной оболочке имеется 92 электрона.
Протон и нейтрон почти одинаковы по весу, а электрон почти в 1840 раз легче протона. Значит, основная масса атома содержится в его ядре. Чем большее количество нейтронов и протонов содержится в ядре, тем больший вес имеет атом.
Вес атома, например, в граммах выражать очень неудобно: потребовалось бы писать десятки нулей после запятой. Поэтому ввели понятие об относительном весе атомов, об атомном весе. Вначале за единицу был принят атомный вес водорода; с ним сравнивали атомные веса всех других элементов.
Стройную систему химических элементов создал великий русский химик Д. И. Менделеев в 1869 году, на основе открытого им периодического закона.
Сущность закона Менделеева состоит в том, что все химические элементы, расположенные один за другим в порядке возрастания атомных весов, образуют ряд, в котором химические свойства элементов через определённое количество элементов периодически повторяются.
Д. И. Менделеев расположил химические элементы в своей таблице так, что элементы, помещённые в одних и тех же вертикальных столбцах, обладают сходными химическими свойствами. Зная место элемента в таблице, можно определить большинство химических свойств элемента и его соединений. Каждый химический элемент в таблице Менделеева имеет порядковый номер. Его теперь называют числом Менделеева. Этот номер указывает число протонов в ядре. В одни и те же вертикальные столбцы таблицы попадают атомы с одинаковым числом электронов во внешней оболочке.
В зависимости от числа электронов во внешней оболочке меняются химические и физические свойства элемента.
Атомы одного и того же элемента, отличающиеся друг от друга лишь числом нейтронов в ядре, называются изотопами. «Изотоп» — греческое слово. Оно обозначает «занимающий одно и то же место». Изотопы каждого элемента располагаются в одной и той же клетке таблицы Менделеева, поскольку заряд ядра (количество прогонов) у изотопов одного и того же элемента одинаков. Металлы в отличие от жидких и газообразных тел в обычных условиях являются кристаллическими телами. Кристалл — это правильная фигура, ограниченная плоскими поверхностями.
Внутреннее строение кристаллов в настоящее время изучено довольно хорошо с помощью рентгеновских лучей. Освещая ими кристаллы, получают рентгенограмму, т. е. картину на фотопластинке, по которой определяют расположение атомов в кристаллической решётке и расстояния между ними. Рентгенограммы показали, что ионы металлов «укладываются» в кристалле примерно так же, как располагаются в ящике твёрдые шары.
Атомы разных металлов образуют неодинаковые кристаллические решётки. Чаще всего встречаются три типа решёток.
Первый тип — кубическая объёмноцентрированная решётка (рис. 1). Атомы металла в такой решётке находятся в вершинах и центре куба. Каждый атом окружён
| Рис. 1. Кубическая объёмноцентрированная кристаллическая решётка Металла. |
Восемью атомами. Такую решётку имеют металлы ванадий, вольфрам, молибден, литий, хром и другие.
Второй тип решётки — кубическая гранецентрирован - иая (рис. 2). Атомы металла в ней расположены по вершинам граней куба. Такой решёткой обладают, например, алюминий, свинец, золото, серебро, никель, торий.
Третий тип — гексагональная (шестиугольная) плотно упакованная решётка (рис. 3). Она встречается у цинка, магния, кадмия, бериллия.
На рис. 1—3 атомы условно изображены в виде шариков. В зависимости от типа решётки атомы занимают в ней больше или меньше места. Например, в кубической объёмноцентрированной решётке атомы занимают 68% пространства, а в кубической гранецентрированной—74%.
Расположение атомов в кристаллической решётке оказывает большое влияние на свойства металла.
У некоторых металлов кристаллическая решётка может перестраиваться из одного типа в другой. Например, чистое железо при температурах ниже 910° имеет кубическуюобъёмноцентрированную решётку, а выше 910° решётка становится гранецентрированной. Свойством изменять кристаллическую решётку обладают и такие металлы, как олово, уран, титан, таллий, цирконий, лантан, церий.
| Рис. 2. Кубическая гранецентрированная решётка металла. |
Свойство веществ образовывать решётки разной формы называют аллотропией; в переводе с греческого
| Рис. 3. Гексагональная (шестиугольная) плотно упакованная решётка. |
Языка это слово означает «другой поворот», «другое свойство». Общеизвестна аллотропия у кристаллического углерода. Он может находиться в виде графита и в виде алмаза. Графит и алмаз построены из атомов углерода; отличие их только в строении кристаллической решётки. А какая огромная разница в свойствах! Графит — мягкий,
Непрозрачный минерал чёрного цвега, алмаз, напротив, прозрачен, бесцветен и твёрд.
Атомы в кристаллической решётке металлов расположены столь близко друг к другу, что их внешние электроны имеют возможность двигаться не только вокруг одного атома, а вокруг многих атомов. Следовательно, внешние электроны, распределяющиеся в металле равномерно, свободно перемещаются по всему куску металла, образуя своеобразный электронный газ.
Таким образом, любой металл представляет собой решётку из правильно расположенных положительных ионов, заполненную электронным газом. Высокая прочность металлов и объясняется наличием электронного газа, который обволакивает все ионы, превращая металлический кристалл как бы в одно целое.
Ионы, находящиеся в определённых местах (узлах) кристаллической решётки, могут совершать, однако, движение — колебание. В ненагретом металле колебания ионов замедлены, в нагретом — ионы испытывают сильное колебание. Чем выше температура, тем сильнее раскачиваются ионы. Наконец, наступает момент, когда силы взаимодействия уже не могут удержать ионы в узлах кристаллической решетки и она разрушается; металл из твёрдого состояния переходит в жидкое. Это и есть температура плавления.
Если два расплавленных металла тщательно перемешать, то после затвердевания получится сплав этих металлов. Сплавы получаются и при сплавлении металла с неметаллом, например железа с углеродом, алюминия с кремнием и т. д. Свойства полученного сплава зависят не только от того, какие элементы входят в сплав, но и от внутреннего строения, или, как говорят, структуры сплава. Сплав является тоже кристаллическим телом.
Строение сплавов может быть различно. Составные части сплава могут образовать либо механическую смесь, либо твёрдый раствор, либо химическое соединение. Но есть сплавы, в которых имеются одновременно и механические смеси, и твёрдые растворы, и химические соединения.
Механическая смесь получается в том случае, когда составные части не взаимодействуют химически, а находятся в сплаве в виде самостоятельных мелких кристал
Ликов. Их можно наблюдать при рассматривании отполированной поверхности в микроскоп. Механические смеси образуются, например, при сплавлении свинца с сурьмой, висмута с кадмием и др.
Каждый знает раствор сахара или поваренной соли в иоде. Растворяя сахар или поваренную соль в воде, можно получить однородное вещество — жидкий раствор. В стакане воды можно растворить различное количество сахара
Или поваренной соли. Поэтому такие растворы являются однородными веществами переменного состава.
| Чр—ф—^—ф - 0) Атом тда Т Атом ткеля Рис. 4. Кристаллическая решётка твёрдого раствора замещения. |
Оказывается, что подобные однородные системы переменного состава образуются и в твёрдых телах. Их называют твёрдыми растворами. В них атомы растворённого вещества и растворителя «рассеяны», перемешаны между собой. В кристаллической решётке вещества, являющегося растворителем, некоторые его атомы замещаются атомами растворённого вещества (рис. 4). Такие растворы называются твёрдыми растворами замещения. Их образуют при сплавлении, например, металлы медь и никель, железо и хром, золото и медь, серебро и золото, медь и платина и др.
Замещение одних атомов другими в кристаллической решётке происходит в том случае, если атомы растворяемого металла близки по своим размерам атомам раство* рителя. Если разница в размерах атомов превышает 15%, твёрдый раствор замещения образоваться не может.
При очень большой разнице в размерах атомов образуются твёрдые растворы внедрения. Они чаще всего получаются тогда, когда металл растворяет в себе неметаллические элементы, атомы которых значительно меньше атомов металла. Самым распространённым сплавом, построенным по типу твёрдых растворов внедрения, является сплав железа с углеродом; этот сплав называется сталью. При образовании твёрдого раствора внедрения атомы внедряющегося элемента располагаютсяв промежутках кристаллической решётки между атомами растворителя. Кристаллическая решётка твёрдого раствора внедрения показана на рис. 5.
А много ли можно растворить одного металла в другом? Неограниченная растворимость присуща далеко не всем металлам. В меди, например, может раствориться сколько угодно никеля, точно так же и в никеле можно растворить любое количество меди. Растворителем считают тот металл, которого больше в сплаве по весу.
| О йтом дзота Рис. 5. Кристаллическая решётка твёрдого раствора внедрения. |
Многие металлы обладают ограниченной растворимостью. Например, в алюминии можно растворить не более 5,5% меди по весу. При большем количестве медь находится в сплаве в виде отдельных нераст - ворённых частиц. Чем выше температура твёрдого раствора, тем больше меди можно растворить в алюминии (но не более 5,5%).При охлаждении этого сплава медь выделяется в виде мельчайших, очень твёрдых и хрупких частиц.
Какова природа этих частиц? Оказывается — это не чистая медь, а её х и м и ч е - ское соединение с алюминием. Избыток меди в сплаве взаимодействует с алюминием химически. Кристаллики любого химического соединения в сплаве имеют вполне определённый состав. Так, например, при образовании химических соединений: железа с углеродом, называемого карбидом железа, три атома железа химически связаны с одним атомом углерода; алюминия с медью—два атома алюминия соединены с одним атомом меди. Для образования карбидов вольфрама или ванадия нужно, чтобы соотношение атомов этих металлов и атомов углерода было равно 1 : 1, а в карбиде хрома 23 атома хрома взаимодействуют с шестью атомами углерода.
Кристаллические решётки химических соединений очень сложны. При сильном разогревании сплава кристаллы химических соединений могут растворяться в твёр-
Дом растворе сплава, а при снижении температуры нагревания образовываться вновь.
Сплавы, применяемые в технике, имеют сложный химический состав. Высокопрочные стали, например, имеют в своем составе до десятка различных химических элементов. Чем сложнее состав и строение сплава, тем разнообразнее его свойства.
Редкие металлы, вводимые в состав сталей и сплавов, улучшают их качество, коренным образом изменяют первоначальные свойства сплавов, так как они часто образуют кристаллы химических соединений, упрочняющих твёрдый раствор.
Металлурги пользуются редкими металлами для того, чтобы выплавленные стали и сплавы были более прочны, более твёрды, обладали нужной пластичностью, упругостью, жароупорностью, химической' стойкостью и т. д. О том, какие это свойства и как они изменяются при добавке редких металлов, будет рассказано ниже.
С Реди редких металлов имеются такие, которые обладают особым физическим свойством — радиоактивностью. К ним относится радий, торий, уран. Изучение их началось с конца XIX века. В 1898 году молодой …
М Ного лет назад, исследуя золу, получающуюся при сжигании каменного угля, химики обнаружили в её составе 46 химических элементов. В их числе было немало редких и рассеянных элементов. Исследование морских …
В прежние времена, когда наука и техника были на низком уровне развития, природа для человека была единственным источником, откуда он брал в готовом виде всё, что ему нужно было для …
msd.com.ua
1.4. Строение сплавов
Если химическое соединение образуется только металлическими элементами, то в узлах решеток располагаются положительно заряженные ионы, удерживаемые электронным газом – возникает металлическая связь.
При образовании химического соединения металла с неметаллом возникает ионная связь. В результате взаимодействия элементов в этом случае атом металла отдает электроны(валентные) и становится положительным ионом, а атом металлоида принимает электроны на свою внешнюю оболочку и становится отрицательным ионом. В решетке химического соединения такого типа элементы удерживаются электростатическим притяжением.
Если образующиеся в сплавах химические соединения оказываются стойкими веществами, не диссоциирующими при нагреве вплоть до температуры плавления, и имеют широкую область существования, то их принято рассматривать в качестве самостоятельных компонентов, способных образовывать твердые растворы с компонентами сплава.
Твердый раствор образуется при растворении компонентов друг в друге, является однофазным, состоит из одного вида кристаллов, имеет одну кристаллическую решетку и существует в интервале концентраций. Обозначаются твердые растворы буквами греческого алфавита:α, β, γ и т. д.
При образовании твердого раствора сохраняется решетка одного из компонентов. В этом случае компонент называется растворителем.
Атомы растворенного вещества искажают и изменяют средние размеры элементарной ячейки растворителя. Если атомы растворенного компонентаВ замещают в узлах решетки атомыкомпонента-растворителяА,то образующийся раствор называетсятвердым раствором замещения. Твердые растворы замещения могут бытьограниченные и неограниченные.
Неограниченные твердые растворы образуются, если компоненты имеют одинаковую кристаллическую решетку и одинаковый атомный радиус.Ограниченные твердые растворыобразуются, если компоненты имеют одинаковую кристаллическую решетку, а атомные радиусы разнятся.
При образовании твердых растворов внедрения атомы растворенного веществаС располагаются между атомамиА в кристаллической решетке растворителя. Следовательно, диаметр атомаС должен быть невелик, а внутри решетки металлаА должно быть достаточное пространство для атомаС (рис. 1.11). Искажения решетки при образовании твердых растворов внедрения больше, чем при образовании твердых растворов замещения, поэтому у них более резко изменяются свойства.
studfiles.net