Аллотропные модификации. Аллотропия алюминия
это... Определение понятия и причины
Из нашей статьи вы узнаете, что такое аллотропия. Это понятие широко распространено в природе. К примеру, кислород и озон - это вещества, состоящие только из химического элемента оксигена. Как это возможно? Давайте разбираться вместе.
Определение понятия
Аллотропией называют явление существования одного химического элемента в виде двух или более простых веществ. Его открывателем по праву считается химик и минеролог из Швеции Йенс Берцелиус. Аллотропия - это явление, которое имеет много общего с полиморфизмом кристаллов. Это вызвало долгие споры среди ученых. В настоящее время они пришли к мнению, что полиморфизм характерен только для твердых простых веществ.
Причины аллотропии
Образовывать несколько простых веществ могут не все химические элементы. Способность к аллотропии обусловлена строением атома. Чаще всего она встречается у элементов, имеющих переменное значение степени окисления. К ним относятся полу- и неметаллы, инертные газы и галогены.
Аллотропия может быть обусловлена несколькими причинами. К ним относится разное количество атомов, порядок их соединения в молекулу, параллельность спинов электронов, тип кристаллической решетки. Рассмотрим данные виды аллотропии на конкретных примерах.
Кислород и озон
Данный вид аллотропии - пример того, как разное количество атомов одного химического элемента определяет физические и химические свойства вещества. Это касается и физиологического влияния на живые организмы. Так, кислород состоит из двух атомов оксигена, озон - из трех.
В чем же отличия этих веществ? Оба они газообразны. Кислород не имеет цвета, вкуса и запаха, он в полтора раза легче озона. Это вещество хорошо растворяется в воде, причем с понижением температуры скорость этого процесса только увеличивается. Кислород необходим всем организмам для дыхания. Поэтому это вещество является жизненно важным.
Озон имеет голубой цвет. Его характерный запах ощущал каждый из нас после дождя. Он резкий, но довольно приятный. По сравнению с кислородом, озон более химически активен. В чем же причина? При разложении озона образуется молекула кислорода и свободный атом оксигена. Он тут же вступает в реакции соединения, образуя новые вещества.
Удивительные свойства углерода
А вот количество атомов в молекуле углерода всегда остается неизменным. При этом он образует абсолютно разные вещества. Самыми распространенными модификациями углерода являются алмаз и графит. Первое вещество считается самым твердым на планете. Это свойство обусловлено тем, что атомы в алмазе связаны прочными ковалентными связями по всем направлениям. В совокупности они образуют трехмерную сеть из тетраэдров.

У графита прочные связи формируются только между атомами, расположенными в горизонтальной плоскости. По этой причине разломать графитовый стержень вдоль практически невозможно. А вот связи, которые соединяют горизонтальные слои углерода между собой, очень слабые. Поэтому каждый раз, когда мы проводим простым карандашом по бумаге, на ней остается серый след. Это и есть слой углерода.
Аллотропия серы
Причина модификаций серы также заключается в особенностях внутренней структуры молекул. Самой устойчивой формой является ромбическая. Кристаллы этого вида аллотропии серы называют ромбоидальными. Каждый из них образован коронообразными молекулами, в состав каждой из которой входит 8 атомов. По физическим свойствам ромбическая сера является твердым веществом желтого цвета. Она не только не растворяется в воде, но даже не смачивается ею. Показатели тепло- и электропроводности очень низкие.

Структура моноклинной серы представлена параллелепипедом со скошенными углами. Визуально это вещество напоминает иглы темно-желтого цвета. Если серу расплавить, а потом поместить в холодную воду, образуется ее новая модификация. Ее первоначальная структура разрушится до полимерных цепей разной длины. Так получают пластическую серу - резиноподобную массу коричневого цвета.
Модификации фосфора
Ученые насчитывают 11 видов фосфора. Его аллотропия была открыта практически случайно, как и само это вещество. В поисках философского камня алхимик Бранд получил светящуюся сухую субстанцию в результате выпаривания мочи. Это был белый фосфор. Данное вещество характеризуется большой химической активностью. Достаточно повышения температуры до 40 градусов, чтобы белый фосфор вступил в реакцию с кислородом и воспламенился.

Для фосфора причина аллотропии - это изменение в структуре кристаллической решетки. Изменить ее можно только при определенных условиях. Так, увеличив давление и температуру в атмосфере углекислого газа, получают красный фосфор. Химически он менее активен, поэтому для него не характерно свечение. При нагревании он превращается в пар. Мы наблюдаем это каждый раз, зажигая обычные спички. Терочная поверхность как раз содержит красный фосфор.
Итак, аллотропия - это существование одного химического элемента в виде нескольких простых веществ. Чаще всего встречается среди неметаллов. Основными причинами этого явления считаются разное количество атомов, образующих молекулу вещества, а также изменение конфигурации кристаллической решетки.
fb.ru
Аллотропные модификации
Аллотропией называют способность атомов одного элемента формировать разные типы простых веществ. Так образуются соединения, отличные друг от друга.
Аллотропные модификации являются стабильными. В условиях постоянного давления при определенной температуре эти вещества могут переходить одни в другие.
Аллотропные модификации могут образовываться из молекул, имеющих разное количество атомов. Например, элемент Кислород образует озон (О3) и собственно вещество кислород (О2).
Аллотропные модификации могут быть твердыми веществами, имеющими разное строение кристаллов. К таким соединениям можно отнести, например, алмаз и графит. Указанные вещества - аллотропные модификации углерода. Этот химический элемент может образовывать пять простых веществ: гексагональный и кубический алмаз, графит, карбин (в двух формах).
Гексагональный алмаз обнаружен в метеоритах и получен в лабораторных условиях при продолжительном нагревании под воздействием очень высокого давления.
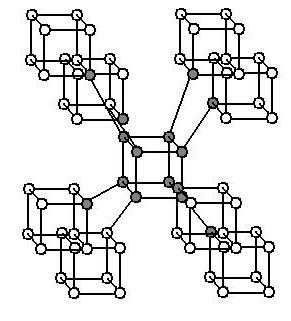
Алмаз, как известно, является самым твердым из всех веществ, существующих в природе. Применяется он при бурении горных пород и резке стекла. Алмаз представляет собой бесцветное прозрачное кристаллическое вещество, которое обладает высокой светопреломляемостью. Кристаллы алмазов имеют кубическую гранецентрированную решетку. Половина атомов кристалла располагается в центрах граней и вершинах одного куба, а остальная половина атомов – в центрах граней и вершинах другого куба, который смещен относительно первого по направлению пространственной диагонали. Атомы формируют тетраэдрическую трехмерную сетку, в которой они имеют ковалентные связи.
Из всех простых веществ только в алмазе присутствует максимальное количество атомов, которые располагаются очень плотно. Поэтому соединение является очень прочным и твердым. Прочные связи в углеродных тетраэдрах обеспечивают высокую химическую стойкость. На алмаз может воздействовать только фтор или кислород при температуре восемьсот градусов.
Без доступа воздуха при сильном нагреве алмаз превращается в графит. Это вещество представлено кристаллами темно-серого цвета. Графит имеет слабый металлический блеск. На ощупь вещество маслянистое. Графит устойчив к нагреванию, обладает сравнительно высокой тепло- и электропроводностью. Вещество применяют при изготовлении карандашей.
Карбин получают синтетическим путем. Это твердое вещество черного цвета со стеклянным блеском. Без доступа воздуха при нагревании карбин превращается в графит.
Существует еще одна форма углерода – аморфный углерод. Эту неупорядоченную структуру получают при нагревании углеродосодержащих соединений. Большие залежи угля обнаруживаются в природных условиях. При этом вещество имеет несколько сортов. Уголь может быть представлен в виде сажи, костяного угля или кокса.
Как уже было указано, аллотропные модификации одного элемента характеризуются разной межатомной структурой. Кроме того, они наделены различными химическими и физическими свойствами.
Сера является еще одним элементом, способным к аллотропии. Это вещество применяется человеком с давних времен. Существуют разные аллотропные модификации серы. Наиболее популярной является ромбическая. Она представлена твердым веществом желтого цвета. Ромбическая сера не смачивается водой (плавает на поверхности). Это свойство применяется при добыче вещества. Ромбическая сера растворима в органических растворителях. Вещество обладает плохой электро- и теплопроводностью.
Кроме этого, существует пластическая и моноклинная сера. Первая представляет собой коричневую аморфную (похожую на резину) массу. Она образуется, если в холодную воду вылить расплавленную серу. Моноклинная представлена в виде темно-желтых игл. Под влиянием комнатной (или приближенной к ней) температуре обе эти модификации переходят в ромбическую серу.
fb.ru
Химический элемент. Аллотропия - Справочник химика 21
Химический элемент. Аллотропия........ [c.396]Некоторые химические элементы образуют несколько простых веществ. Это явление получило название аллотропии. Наиример, кислород имеет две аллотропные модификации (или видоизменения), которые различаются составом молекул кислород О2 и озон О3. Аллотропные видоизменения элемента углерода — алмаз и графит имеют разное строение кристаллов. [c.14]
Простые и сложные вещества. Понятие о химическом элементе. Аллотропия. Металлы и неметаллы, различие их физических и химических свойств. [c.11]Явление аллотропии может быть обусловлено либо различием состава молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов. [c.254]
Аллотропные видоизменения элементарного вещества — это вещества, молекулы которых различны, хотя и образованы атомами одного и того же химического элемента. Свойства аллотропных видоизменений одного и того же элемента, проявляемые в различных агрегатных состояниях, различны. Способность одного и того же вещества существовать в различных кристаллических формах называют полиморфизмом. Он может быть двух видов энантиотропный, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотропный, когда одно видоизменение устойчивее другого независимо от температуры. Энантиотропные полиморфные видоизменения, таким образом, подобны агрегатным состояниям одного и того же вещества. Монотропные полиморфные видоизменения являются, по существу, аллотропными видоизменениями в кристаллическом состоянии. Таким образом, границы понятий аллотропии и полиморфизма не вполне совпадают. Следует отметить, что во многих случаях элементарные вещества в жидком и газообразном состояниях содержат молекулы, различные как по числу атомов, так и по структуре. Относительное содержание этих различных молекул в массе элементарного вещества зависит от температуры и других условий, причем изменение этих условий обычно приводит к возврату соответствующих равновесий. В связи с этим, а также с трудностью изоляции отдельных форм молекул последние не принято считать самостоятельными аллотропными видоизменениями. Известным примером таких элементарных веществ является сера, которая в газовом состоянии содержит молекулы четырех видов — За, 5 , (цепе-) и 5 (цикло-). [c.37]
Аллотропия (от греч. alios — другой и tropos — способ, образ) — существование одного и того же химического элемента в виде двух или нескольких простых веществ (аллотропных модификаций), различных по строению и формам. Напр., углерод существует в виае графита и алмаза. Несколько простых веществ дают элементы сера, селен, фосфор, олово, железо и др. А. вызывается либо образованием различных кристаллических форм (аллотропия формы), либо различным числом атомов химического элемента в молекуле простого вещества (аллотропия состава, напр., кислород О2 и озон Оз). [c.12]
Многие химические элементы периодической системы образуют не одно, а несколько простых веществ. Такое явление называют аллотропией, а каждое из этих простых веществ — аллотропным видоизменением или модификацией данного элемента. В настоящее время известно более 400 разновидностей простых веществ. Аллотропия может быть обусловлена либо числом атомов в молекуле — аллотропия состава (например, Оа и Оз), либо способом размещения молекул или атомов в кристаллах — аллотропия формы. [c.4]
Химический элемент. Аллотропия [c.9]
Атом, элемент, молекула — важнейшие понятия в химии. Многообразие химических соединений определяется взаимодействием атомов друг с другом, при этом образуются простые и сложные вещества. Атомы одного и того же элемента способны образовывать несколько простых веществ, чем и обусловлена аллотропия. Каждое соединение характеризуется своим качественным и количественным составом, который постоянен для молекул одного и того же вещества. Состав простых и сложных веществ может быть изображен с помощью символов атомов соответствующих химических элементов с указанием их количества. [c.25]
Вещества делят на простые и сложные. Простые вещества состоят из атомов одиого и того же элемента их можно рассматривать как форму существования элементов в свободном состоянии. В настоящее время известно 107 элементов, а простых веществ гораздо больше, поскольку многие нз них образуют несколько видоизменений (модификаций). Существование химического элемента в виде нескольких простых веществ получило название аллотропии (от греч. другая форма ). Образование аллотропных модификаций при данных условиях может быть обусловлено способом размещения атомов элемента в кристалле, изменением химической связи между атомами или составом молекул. [c.32]
Почему число простых веществ ( 550) гораздо больше числа известных химических элементов Чем обусловлено явление аллотропии [c.22]
Аллотропия — способность химического элемента суш,ествовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле, либо строением (с. 131). [c.110]
Аллотропия — способность химического элемента образовывать несколько простых веществ, отличающихся по строению и свойствам. [c.370]
От полиморфизма следует отличать аллотропию — явление, когда один и тот же химический элемент способен существовать в виде двух или нескольких разновидностей или модификаций, которые имеют различные внешние и внутренние признаки. Аллотропия относится к различным кристаллическим модификациям элемента, совпадая в этом случае с полиморфизмом (например, сера ромбическая и моноклинная), и к различным по строению молекулам, различающимся числом атомов в них, например, озон Оз и кислород Ог. [c.53]
Способность химического элемента образовывать несколько простых веществ называется аллотропией. [c.11]
Основополагающим понятием современной химии является понятие о химическом элементе , т. е. виде атомов с определенной совокупностью свойств. Под свойствами изолированных атомов подразумеваются заряд ядра и атомная масса, особенности электронного строения, потенциалы ионизации, сродство к электрону и электроотрицательность, атомные, орбитальные и ионные радиусы н т. д. Однако необходимо иметь в виду, что изолированные атомы как форма организации вещества могут существовать в природе лишь при достаточно высоких температурах в виде моноатомного пара. Единственным исключением являются благородные газы, для которых при любых условиях и в любом агрегатном состоянии структурной единицей является атом. Все остальные элементы существуют в природе в виде более сложных агрегатов молекул и кристаллов. Таким образом, следует строго различать понятия элемента как вида изолированных атомов и простого вещества как формы существования элемента в свободном состоянии. Следует особо подчеркнуть нетождественность этих понятий хотя бы потому, что один элемент может существовать в виде нескольких простых веществ (аллотропия) . [c.26]
В чем заключается различие между полиморфизмом и аллотропией химического элемента [c.100]
Полиморфизм простых веществ является частным случаем аллотропии химических элементов, под которой подразумевают способность элемента существовать в различных формах (модификациях). Как понятие аллотропия шире, чем полиморфизм, охватывающий лишь изменения в структуре твердого тела. [c.125]
Химические элементы в свободном виде находятся в форме простых веществ. Явление существования химического элемента в виде двух или нескольких простых веществ, различающихся по количественному составу или кристаллическому строению, называется аллотропией. [c.17]
Многие химические элементы образуют несколько простых веществ, различных по строению и свойствам. Это явление называется аллотропией, а образующиеся вещества — аллотропными видоизменениями [c.12]
Один и тот же химический элемент может образовывать несколько простых веществ. Явление, при котором один элемент образует разные простые вещества, отличающиеся по своему строению и свойствам, называется аллотропией. Простые вещества, образованные одним элементом, называются аллотропными видоизменениями этого элемента. Например, аллотропными [c.22]
Один и тот же элемент может образовывать несколько разных типов простых Веществ, называемых аллотропными модификациями. Известно свыше 400 разновидностей простых веществ. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов. [c.253]
Многие химические элементы образуют не одно, а несколько простых веществ. Эта способность химического элемента существовать в виде нескольких простых веществ называется аллотропией. Простые вещества, образованные одним и тем же элементом, называются аллотропными видоизменениями (модификациями) данного элемента. Явление аллотропии — наглядное подтверждение различия между простым веществом и химическим элементом. Существование аллотропных видоизменений связано с различным строением кристаллических структур простых веществ или с различием числа атомов, входящих в состав молекул отдельных аллотропных форм. Например, углерод имеет аллотропные формы алмаз, графит, кар-бин кислород — молекулярный кислород Og и озон Од. [c.30]
Химический элемент (19). — 4. Простое вещество. Аллотропия (22). — 5. Сложное вещество. Моль. (23). — 6. Закон Авогадро (24) — 7. Валентность. Степень окисления. Химические формулы (26) — Упражнения к главе 1 (28). [c.1]
Химические элементы. Знаки химических элементов и химические формулы. Простое вещество, сложное вещество. Аллотропия. [c.500]
Аллотропия — явление существования химического элемента в виде нескольких простых веществ, находящихся в одном физическом состоянии и отличающихся между собой строением и физическими свойствами (кислород и озон графит, алмаз, карбин). [c.19]
Частным случаем полиморфизма простых веществ является аллотропия. Под аллотропией понимают свойство химического элемента существовать в виде различных простых веществ, называемых аллотропическими видоизменениями данного элемента. Различие в свойствах простых веществ, в виде которых может существовать данный химический элемент, обусловливается не только разным пространственным расположением частиц в твердом состоянии, но и разным количеством атомов в молекуле. Примером этого могут служить два аллотропических видоизменения кислорода обычный кислород 0-2(г) и озон Оз(г). Каждая модификация одного и того же вещества является устойчивой лишь в определенных пределах давлений и температур. Поэтому при изменении давления и температуры происходит переход одной модификации в другую. [c.49]
Аллотропия — способность химического элемента существовать в виде двух или большего числа простых веществ, например кислород и озон, графит и алмаз. [c.3]
Многие химические элементы образукэт несколько простых веществ, различных по строению и свойствам. Это явление называегся аллотропией, а образующиеся вещества - аллотропными видоизменениями или модификациями. Так, элемент кислород образует две аллотропные модификации - кислород и озон элемент углерод - три а,пмаз, графит и карбин несколько модификаций образует элемент фосфор. [c.11]
АЛЛОТРОПИЯ ж. Явление существования химического элемента в виде нескольких простых веществ, различных по строению и свойствам. [c.21]
Аллотропные видоизменения элементарных веществ представляют собой вещества, построенные из различных молекул (или кристаллов), образованных атомами одного и того же химического элемента. Аллотропные видоизменения одного элемента имеют различные свойства, проявляемые в различ.чых агрегатных состояниях. Наряду с аллотропией известно также явление полиморфизма— способности одного и того же вещества существовать в различных кристаллических формах. Полиформизм может быть двух видов э н а и т и о т р о п и ы й, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотроп-н ы й, когда одно видоизменение устойчивее другого независимо от температуры. Энантиотропные полиморфные видоизменения, таким образом, подобны агрегатным состояниям одного и того же [c.111]
АЛЛОТРОПИЯ — свойство химического элемента существовать в виде двух или нескольких простых веществ — аллотропических форм, или м0диф икаций. Например, углерод существует в виде [c.17]
Как уже отмечалось, один и тот же элемент может образовывать несколько простых веществ. Способность химического элемента существовать в виде нескольких простых веществ называется аллотропией. Простые вещества, образованные одним и тем же элементом, называются аллотропическими видоизменениями данного элемента. Эти видоизменения-одного и того же элемента могут отличаться как числом (О2 и Оз), так и расположением (алмаз, графит) одних и тех же атомов в молекуле. Явление аллотропии — наглядное подтверждение различий между простым веществом и химичесьгим элементом. [c.8]
Аллотропия (греч. аХкоспособность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся количеством атомов в молекуле (например. О и [c.6]
chem21.info
Аллотропия - Справочник химика 21
Кислород имеет два аллотропа-двухатомный кислород О2 и трехатомный кислород О3 (озон). Когда говорят о молеку.пе кислорода, обычно подразумевают, что речь идет об О2, нормальной форме этого элемента. Структура озона показана на рис. 21.11. [c.301]Простые и сложные вещества. Аллотропий [c.8]
Явление аллотропии может быть обусловлено либо различием состава молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов. [c.254]
Другое различие между первым и последующим элементами каждой группы заключается в больщей способности первого элемента к образованию я-связей. Это различие в какой-то мере определяется размерами атомов. По мере увеличения размеров атомов боковое перекрывание р-орбиталей, ответственное за образование наиболее прочных п-связей, становится менее эффективным. Это показано на рис. 21.5. Для того чтобы проиллюстрировать этот эффект, рассмотрим два отличия в химических свойствах углерода и кремния, являющихся первыми двумя членами группы 4А. Углерод имеет два кристаллических аллотропа, алмаз и графит. В алмазе атомы углерода связаны друг с другом а-связями в нем не образуются я-связи. В графите боковое пере- [c.285]Применение высокотемпературной рентгенографии для изучения полиморфизма железа. Вся современная практика изготовления и термической обработки сталей базируется на уникальном физическом свойстве железа — его аллотропии или полиморфизме, открытом в 1868 г. Д. К. Черновым. [c.162]
У водорода отмечен особый вид аллотропии, отражающий различную ориентацию ядерных спинов в молекуле На у молекул пора-водорода (т. пл. —259,32 °С, т. кип. —252,89 °С) ядерные спины направлены противоположно друг другу в молекулах орто-во-дорода (г. пл. —259,2 °С, т. кип. —252,76 °С) ядерные спины направлены одинаково. Водород при обычных условиях является равновесной смесью пара- (25%) и ор/ио-формы (75%). Яара-водород несколько более устойчив. Разделить эти аллотропные модификации водорода можно методом хроматографии (используют обычно активированный уголь). [c.247]
Почему для азота в отличие от фосфора нехарактерна аллотропия [c.126]
Полиморфизм является наиболее частым проявлением аллотропии эле. ментов. Понятие аллотропии шире, чем понятие полиморфизма, так как относится к простым веществам независимо от их агрегатного (а не только твердого) состояния (например, кислород — озон). [c.111]
От полиморфизма следует отличать аллотропию—явление, когда данный элемент способен существовать в виде различных простых веществ. Границы этих понятий не совпадают. Аллотропия относится и к различным кристаллическим модификациям элемента, совпадая в этом случае с полиморфизмом, и к различным по строению молекулам, различающимся по числу атомов в них (например, озон Оз и обычный кислород О2). С другой стороны, полиморфизм охватывает явления различия кристаллических форм не только простых веществ, но и химических соединений. [c.121]
Молекула серы при обычных условиях и до 150 °С состоит из 8 атомов, соединенных в виде кольца (типа короны). В парах серы при iKH = 444,6 °С присутствуют также молекулы Sj, S4 и S2, причем с повышением температуры многоатомные молекулы распадаются и при 900 °С существуют лишь молекулы S2. При дальнейшем нагревании они диссоциируют на атомы. При этом окраска паров серы изменяется от оранжевой до бесцветной. Это объясняется тем, что сера относится к числу элементов, проявляющих аллотропию. Молекулы серы при комнатной температуре образуют кристаллы ромбической a-S (р = 2,07 г/см ). При 95,5 °С a-S превращается в моноклинную (i-S (р = 1,96 г/см ). P-S плавится при 119,3 °С. Расплавленная сера при 187 °С становится очень вязкой и при этом темнеет. Считают, что при этом кольца Sg разрываются и происходит полимеризация nSg = (Sg)n. [c.113]
Не следует путать полиморфизм с аллотропией — явлением существования элемента в виде различных простых веществ независимо от их фазового состояния. Например, кислород О2 и озон Оз — аллотропные формы кислорода, существующие в газообразном, жидком и кристаллическом состояниях. Графит и алмаз — аллотропные формы углерода и одновременно его кристаллические модификации. Понятия аллотропии> и полиморфизма совпадают для кристаллического состояния простого вещества. [c.12]
По мере увеличения числа непарных электронов для элементов становится возможной аллотропия состава. Так, для атомов серы (3s 3p ), имеющих два непарных электрона (.5 ), наиболее типично [c.255]
Явление аллотропии у металлов прежде всего связано с тем, что энергии кристаллических решеток различных металлических структур близки. Полиморфизм чаще всего проявляется у (1- и /-элементов (в особенности 5/), чем у 5- и р-элементов. Это обусловлено энергетической близостью (п — 1) - и П5-, пр-состояний у -элементов и близостью 5/-, М-, 75-состояний у 5/-элементов. [c.256]
Чем обусловлено явление аллотропии [c.38]
Вещества делят на простые и сложные. Простые вещества состоят из атомов одиого и того же элемента их можно рассматривать как форму существования элементов в свободном состоянии. В настоящее время известно 107 элементов, а простых веществ гораздо больше, поскольку многие нз них образуют несколько видоизменений (модификаций). Существование химического элемента в виде нескольких простых веществ получило название аллотропии (от греч. другая форма ). Образование аллотропных модификаций при данных условиях может быть обусловлено способом размещения атомов элемента в кристалле, изменением химической связи между атомами или составом молекул. [c.32]
Наиболее устойчивыми аллотропами селена и теллура являются кристаллические вещества, состоящие из зигзагообразных цепочек атомов, показанных на рис. 21.19. Однако каждый атом такой цепочки расположен вблизи от атомов соседних цепочек. [c.308]
Используется также термин полиморфизм ( много форм ). Под этим термином часто понимают разные кристаллические структурные формы простого и сложного вещества говорят, например, о полиморфных модификациях металлов и сложных вещ,еств (Т 02, 8102 и др.). Необходимо эти два понятия — аллотропия и полиморфизм —разграничивать. Понятие аллотропия относят к модификациям простых веществ, которые образует один и тот же элемент, тогда как термин полиморфизм целесообразно применять при рассмотрении модификаций одного и того же сложного вещества (АиОз, ТЮг и др.) таким образом три понятия — аллотропия, полиморфизм и изоморфизм — получат свою логическую качественную дифференциацию. [c.33]
Один и тот же элемент может образовывать несколько разных типов простых веществ, называемых аллотропными модификациями. В настоящее время известно свыше 400 разновидностей простых веществ. Явление аллотропии может быть обусловлено либо различным составом молекул простого вещества данного элемента (аллотропия состава), либо способом размещения молекул или атомов в кристаллах (аллотропия форм ы). Сгюсобность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов. [c.232]
По мере увеличения числа непарных электронов для элементов ста-ювится возможной аллотропия состава. Так, для атомов серы [c.232]
Поскольку металлическая связь ненасыщаема и ненаправлена, мета. лы имеют координационные решетки с максимально плотной упаковкой. Как указывалось выше (см. рис. 65), для металлических простых веществ самых разнообразных по химической природе элементов наиболее типичны три типа кристаллических решеток кубическая гранецентрированная (к. ч. 12), гексагональная (к. ч. 12) и ку()ическая объемноцентрированная (к. ч. 8). Для большинства металлов характерна аллотропия. Это прежде всего связано с тем, что энергии кристаллических решеток различных металлических структур близки. Полиморфизм чаще проявляется у ii- и /-элементов (в особенности 5/), чем у S- и р-элементов. Это обусловлено энергетической близостью п — 1) d-, ns-, пр-состояний у ( -элементов и близостью 5/-, bd-, 7з-состояний у 5/-элементов. [c.233]
Аллотропия углерода. В свободном состоянии углерод известен в виде алмаза, кристаллизующегося в кубической системе, н графита, прш1адлежащего к гексагональной системе. Такие формы его как древесный уголь, кокс, сажа имеют неупорядоченную структуру. Синтетически получены карбин и поликумулен — [c.432]
Для водорода характерен особый вид аллотропии, связанный с различной ориентацией ядерных спинов в молекуле На. В молекулах ортоводорода (т. пл. —259,20°С, т. кип. —252,76°С) ядерные спины направлены одинаково, у параводорода (т. пл. —259,32°С, т. кип, - 252,89 °С) — противополол но друг другу. [c.465]
Начало изучению аллотропии железа было положено работами Д. К. Чернова (1868 г.), впервые заметивщего (визуально) температурные точки перехода форм железа и указавшего на их определяющее значение при выборе оптимального режима обработки стали. [c.557]
Аллотропные видоизменения элементарных веществ представляют собой вещества, построенные из различных молекул (или кристаллов), образованных атомами одного и того же химического элемента. Аллотропные видоизменения одного элемента имеют различные свойства, проявляемые в различ.чых агрегатных состояниях. Наряду с аллотропией известно также явление полиморфизма— способности одного и того же вещества существовать в различных кристаллических формах. Полиформизм может быть двух видов э н а и т и о т р о п и ы й, когда относительная устойчивость полиморфных видоизменений зависит от температуры и существует температура обратимого превращения, и монотроп-н ы й, когда одно видоизменение устойчивее другого независимо от температуры. Энантиотропные полиморфные видоизменения, таким образом, подобны агрегатным состояниям одного и того же [c.111]
Аллотропия — способность химического элемента существовать в видэ двух илк нескольких простых веществ, отличающихся лишь числом атомов в молекуле, либо строением (с. 131). [c.110]
Одно и то же вещество может принимать различные так называемые аллотропические модификации кислород и озон, графит и алмаз. С аллотропией тесно связано свойство полиморфиз.ма, когда в зависимости от изменения внешних условий вещество может последовательно находиться в нескольких кристаллических состояниях пояи.морфных модификациях) с различной структурой. [c.53]
Открытие новых структурных разновидностей углерода - карбина, фуллеренов, нанотрубок и др. диктует необходимость поиска закономерностей их формирования. Нужна схема, которая позволила бы классифицировать разнообразные структурные модификации и предсказывать новые. Существующая на сегодня классификационная схема, основанная на определении степени гибридизации углеродных атомов [1,2], не может адекватно репшть эти задачи. Представляется необходимым введение раздельных классификаций - во-первых, структурных состояний углеродных аллотропов, во-вторых, состояния гибридизации отдельных углеродных атомов. Для построения первой диаграммы необходимо абстрагироваться от возможности существования не дискретных промежуточных состояний гибридизации углеродных атомов и считать, что структурных состояний только три. Тогда любая точка на такой тройной диафамме состояния даст однозначную информацию о соотнощении атомов углерода образующих ковалентные связи с двумя, тремя или четырьмя соседними атомами для соответствующей структурной модификации. Вторую диафамму состояния необходимо ввести для классификагщи состояний, в которых может находиться отдельный атом углерода. Разница между состояниями атома в различных гибридизированных состояниях заключается во взаимном пространственном расположении 4 орбиталей и их размере. Поэтому классификационная схема должна однозначно задавать эту конфигурацию, для этого необходимо определение б независимых переменных - углов между орбиталями. [c.56]
И сам углерод, и его аналоги могут существовать в нескольких аллотропических модификациях. Если для типичных неметаллов, например кислорода и серы, явление аллотропии связано с возможностью образования молекул различного состава, то в простых телах кристаллической структуры, например у у1 лерода, олова, кремния, аллотропия связана с возможностью построения кристаллических решеток различного типа. Так, в кристаллической структуре алмаза каждый атом углерода связан четырьмя связями с другими атомами таким образом, что все углы между связями равны 109,5°. Модель кристаллической решетки алмаза можно получить, если поместить атом углерода в центр тетраэдра на пересечении его высот и соединить его с четырьмя Е ершинами тетраэдра, поместив в них еще четыре атома углерода рассматривая каждый из этих атомов как центр нового тетраэдра, можно таким путем воспроизвести всю решетку. [c.95]
АЛЛОТРОПИЯ — свойство химического элемента существовать в виде двух или нескольких простых веществ — аллотропических форм, или м0диф икаций. Например, углерод существует в виде [c.17]
Общая химия (1984) -- [ c.321 ]Химия (1986) -- [ c.10 ]
Физическая и коллоидная химия (1988) -- [ c.28 ]
Неорганическая химия (1987) -- [ c.319 ]
Химия для поступающих в вузы 1985 (1985) -- [ c.12 ]
Химия для поступающих в вузы 1993 (1993) -- [ c.11 ]
Учебник общей химии (1981) -- [ c.42 ]
Неорганическая химия (1981) -- [ c.12 ]
Химия (1979) -- [ c.10 ]
Пособие по химии для поступающих в вузы 1972 (1972) -- [ c.14 , c.220 ]
Общая химия (1987) -- [ c.14 ]
Общая химия в формулах, определениях, схемах (1996) -- [ c.17 ]
Общая и неорганическая химия Изд.3 (1998) -- [ c.253 ]
Химический энциклопедический словарь (1983) -- [ c.26 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.17 ]
Структурная неорганическая химия Том3 (1988) -- [ c.20 ]
Кристаллохимия (1971) -- [ c.219 ]
Структурная неорганическая химия Т3 (1988) -- [ c.20 ]
Общая химия в формулах, определениях, схемах (1985) -- [ c.17 ]
Химия Краткий словарь (2002) -- [ c.19 ]
Общая химия в формулах, определениях, схемах (0) -- [ c.17 ]
Большой энциклопедический словарь Химия изд.2 (1998) -- [ c.26 ]
Химия справочное руководство (1975) -- [ c.445 ]
Краткий курс физической химии Изд5 (1978) -- [ c.120 ]
Учебник физической химии (1952) -- [ c.6 ]
Общая химия (1964) -- [ c.103 ]
История химии (1975) -- [ c.332 ]
Общая химия и неорганическая химия издание 5 (1952) -- [ c.17 , c.265 , c.267 , c.389 ]
Курс общей химии (1964) -- [ c.211 , c.369 , c.378 ]
Краткая химическая энциклопедия Том 1 (1961) -- [ c.134 ]
Неорганическая химия (1979) -- [ c.0 ]
Неорганическая химия (1950) -- [ c.69 ]
Неорганическая химия (1974) -- [ c.9 ]
Неорганическая химия Издание 2 (1976) -- [ c.9 ]
Общая химия 1982 (1982) -- [ c.22 ]
Общая химия 1986 (1986) -- [ c.19 , c.20 ]
Основы химии Том 2 (1906) -- [ c.137 ]
Учебник общей химии 1963 (0) -- [ c.41 , c.207 , c.256 , c.257 , c.264 , c.337 ]
Неорганическая химия (1981) -- [ c.12 ]
Качественный анализ (1964) -- [ c.53 ]
Строение неорганических веществ (1948) -- [ c.211 ]
Общая и неорганическая химия (1959) -- [ c.0 ]
Неорганическая химия (1978) -- [ c.296 ]
Неорганическая химия (1950) -- [ c.78 ]
Очерк общей истории химии (1979) -- [ c.169 , c.342 ]
Химия (1975) -- [ c.8 ]
Общая химия Издание 4 (1965) -- [ c.14 ]
Кристаллография (1976) -- [ c.177 ]
Физическая химия Том 1 Издание 5 (1944) -- [ c.152 , c.348 ]
Физическая химия Том 1 Издание 4 (1935) -- [ c.190 ]
Общая химия Издание 18 (1976) -- [ c.24 ]
Общая химия Издание 22 (1982) -- [ c.22 ]
Неорганическая химия (1969) -- [ c.208 ]
Общая и неорганическая химия (1981) -- [ c.232 ]
Избранные труды (1955) -- [ c.17 , c.24 , c.25 ]
Кристаллизация из растворов в химической промышленности (1968) -- [ c.35 ]
Введение в физическую химию и кристаллохимию полупроводников (1968) -- [ c.21 ]
Введение в физическую химию и кристаллохимию полупроводников Издание 2 (1973) -- [ c.19 ]
Теоретические основы общей химии (1978) -- [ c.134 ]
Неорганическая химия (1994) -- [ c.109 ]
Учебник физической химии (0) -- [ c.64 ]
Химия Издание 2 (1988) -- [ c.12 ]
Общая химия Изд2 (2000) -- [ c.341 ]
История химии (1966) -- [ c.324 ]
Сочинения Теоретические и экспериментальные работы по химии Том 1 (1953) -- [ c.424 ]
Сочинения Научно-популярные, исторические, критико-библиографические и другие работы по химии Том 3 (1958) -- [ c.62 ]
Краткий курс физической химии Издание 3 (1963) -- [ c.115 ]
Курс физической химии Издание 3 (1975) -- [ c.167 ]
Краткая химическая энциклопедия Том 1 (1961) -- [ c.134 ]
Основы общей химии Т 1 (1965) -- [ c.51 ]
Основы общей химии Том 2 (1967) -- [ c.208 , c.209 , c.306 , c.307 ]
Основы общей химии Том 2 Издание 3 (1973) -- [ c.50 , c.153 , c.464 , c.470 ]
Основы общей химии Том 3 (1970) -- [ c.253 , c.259 , c.260 ]
Общая химия (1968) -- [ c.132 , c.322 ]
Структуры неорганических веществ (1950) -- [ c.2 ]
Проблемы физики и химии твердого состояния органических соединений (1968) -- [ c.423 ]
Курс общей химии (0) -- [ c.245 ]
Курс общей химии (0) -- [ c.245 ]
Основы общей химии том №1 (1965) -- [ c.51 ]
Предмет химии (0) -- [ c.245 ]
Техника низких температур (1962) -- [ c.215 ]
Химия Справочник (2000) -- [ c.60 ]
chem21.info
аллотропия - это... Что такое аллотропия?
АЛЛОТРОПИ́Я -и; ж. [от греч. allos - другой и tropos - поворот, направление]. Существование одного и того же химического элемента в виде двух или нескольких простых веществ, различных по строению и свойствам.
◁ Аллотропи́ческий, -ая, -ое. Графит и алмаз являются аллотропическими видоизменениями углерода.
АЛЛОТРО́ПИЯ (от алло... и греч. tropos — поворот, свойство), существование химических элементов в виде двух или более кристаллических фаз (см. ФАЗА). Аллотропия — частный случай полиморфизма (см. ПОЛИМОРФИЗМ (в минералогии)). В понятие аллотропия включают также существование некристаллических фаз, таких, как кислород и озон, орто- и параводород. Большинство простых веществ существуют в нескольких аллотропных модификациях. Например, для чистого железа при атмосферном давлении известны три модификации: a-железо « b-железо « d-железо ОЦК 910о С ГЦК 1400о С ОЦК Общеизвестен пример существования двух модификаций олова: серое a-олово — полупроводник со структурой алмаза и белое b-олово — типичный металл. Каждая полиморфная (аллотропная) модификация вещества стабильна лишь в своей области температур и давлений, но и в метастабильном, неустойчивом состоянии она может существовать достаточно долго. Полиморфизм олова является здесь хорошим примером. Белое олово может переохлаждаться ниже температуры перехода, равной 13,2 °С, и существовать в виде белого металла достаточно долго. Однако его состояние при температуре менее 13,2 °С неустойчиво, поэтому сотрясение, механическое повреждение, внесение стабильной затравки вызывает резкий скачкообразный переход, получивший название «оловянной чумы». Переход из b- в a-модификацию происходит с изменением типа связи от металлической к ковалентной и сопровождается резким изменением объема. Коэффициент линейного расширения у серого олова в четыре раза больше, чем у белого, поэтому белое олово, переходя в серое, рассыпается в порошок. Углерод существует в двух четко различающихся кристаллических аллотропных формах: в виде алмаза (см. АЛМАЗ (минерал)) и графита (см. ГРАФИТ). Раньше полагали, что так называемые аморфные формы углерода, древесный уголь и сажа, — тоже его аллотропные модификации, но оказалось, что они имеют такое же кристаллическое строение, что и графит. Полиморфное превращение кристаллов углерода — пример монотропного, т. е. необратимого, перехода. При температурах выше 1000 °С алмаз легко и быстро переходит в графит. В противоположность этому превратить графит в алмаз удается лишь при температурах более 3000 °С и давлениях до 100 Мпа, т. е. при условиях термодинамической устойчивости алмаза. Аналогичная картина наблюдается для фосфора (см. ФОСФОР). Белая его форма может превращаться в красную почти при любой температуре. При температурах ниже 200 °С процесс протекает очень медленно, но его можно ускорить с помощью катализатора, например йода. Обратный же переход красного фосфора в белый невозможен без образования промежуточной газовой фазы. Красная форма стабильна во всем диапазоне температур, где она находится в твердом состоянии, тогда как белая нестабильна при любой температуре (метастабильна). Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, т. е. определенная точка перехода отсутствует. Здесь мы тоже имеем дело с монотропными модификациями элемента. В случае серы при обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95,6 °С и давлении 1 атм переходит в моноклинную форму. Последняя при охлаждении ниже 95,6 °С вновь переходит в ромбическую форму. Таким образом, переход одной формы серы в другую происходит при одной и той же температуре, и сами формы называются энантиотропными. Две известные модификации олова энантиотропны.dic.academic.ru
Аллотропия — Мегаэнциклопедия Кирилла и Мефодия — статья
Аллотро́пия (от алло... и греч. tropos — поворот, свойство), существование химических элементов в виде двух или более кристаллических фаз. Аллотропия — частный случай полиморфизма. В понятие аллотропия включают также существование некристаллических фаз, таких, как кислород и озон, орто- и параводород.Большинство простых веществ существуют в нескольких аллотропных модификациях. Например, для чистого железа при атмосферном давлении известны три модификации:
α-железо « β-железо« δ-железо
ОЦК 910о С ГЦК 1400о С ОЦК
Общеизвестен пример существования двух модификаций олова: серое α−олово — полупроводник со структурой алмаза и белое β-олово — типичный металл.
Каждая полиморфная (аллотропная) модификация вещества стабильна лишь в своей области температур и давлений, но и в метастабильном, неустойчивом состоянии она может существовать достаточно долго. Полиморфизм олова является здесь хорошим примером. Белое олово может переохлаждаться ниже температуры перехода, равной 13, 2 °С, и существовать в виде белого металла достаточно долго. Однако его состояние при температуре менее 13, 2 °С неустойчиво, поэтому сотрясение, механическое повреждение, внесение стабильной затравки вызывает резкий скачкообразный переход, получивший название «оловянной чумы». Переход из β− в α−модификацию происходит с изменением типа связи от металлической к ковалентной и сопровождается резким изменением объема. Коэффициент линейного расширения у серого олова в четыре раза больше, чем у белого, поэтому белое олово, переходя в серое, рассыпается в порошок.
Углерод существует в двух четко различающихся кристаллических аллотропных формах: в виде алмаза и графита. Раньше полагали, что так называемые аморфные формы углерода, древесный уголь и сажа, — тоже его аллотропные модификации, но оказалось, что они имеют такое же кристаллическое строение, что и графит. Полиморфное превращение кристаллов углерода — пример монотропного, т. е. необратимого, перехода. При температурах выше 1000 °С алмаз легко и быстро переходит в графит. В противоположность этому превратить графит в алмаз удается лишь при температурах более 3000 °С и давлениях до 100 Мпа, т. е. при условиях термодинамической устойчивости алмаза. Аналогичная картина наблюдается для фосфора. Белая его форма может превращаться в красную почти при любой температуре. При температурах ниже 200 °С процесс протекает очень медленно, но его можно ускорить с помощью катализатора, например йода. Обратный же переход красного фосфора в белый невозможен без образования промежуточной газовой фазы. Красная форма стабильна во всем диапазоне температур, где она находится в твердом состоянии, тогда как белая нестабильна при любой температуре (метастабильна). Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, т. е. определенная точка перехода отсутствует. Здесь мы тоже имеем дело с монотропными модификациями элемента.В случае серы при обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95, 6°С и давлении 1 атм переходит в моноклинную форму. Последняя при охлаждении ниже 95, 6 °С вновь переходит в ромбическую форму. Таким образом, переход одной формы серы в другую происходит при одной и той же температуре, и сами формы называются энантиотропными. Две известные модификации олова энантиотропны.
- Эддисон У. Аллотропия химических элементов. М., 1966.
megabook.ru
Аллотропия — Википедия (с комментариями)
Материал из Википедии — свободной энциклопедии
 Аллотро́пия (от др.-греч. ἄλλος — «другой», τρόπος — «поворот, свойство») — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
Аллотро́пия (от др.-греч. ἄλλος — «другой», τρόπος — «поворот, свойство») — существование двух и более простых веществ одного и того же химического элемента, различных по строению и свойствам — так называемых аллотропных (или аллотропических) модификаций или форм.
Явление аллотропии обусловлено либо различным составом молекул простого вещества (аллотропия состава), либо способом размещения атомов или молекул в кристаллической решётке (аллотропия формы).
История
Понятие аллотропии введено в науку Й. Берцелиусом в 1841 году для обозначения разных форм существования элементов; одновременно он предполагал, по-видимому, применить его и к изомерии соединений. После принятия гипотезы А. Авогадро в 1860 году стало понятно, что элементы могут существовать в виде многоатомных молекул, например, О2 — кислород и О3 — озон.
В начале XX века было признано, что различия в кристаллической структуре простых веществ (например, углерода или фосфора) также являются причиной аллотропии. В 1912 году В. Оствальд отметил, что аллотропия элементов является просто частным случаем полиморфизма кристаллов, и предложил отказаться от этого термина. Однако по настоящее время эти термины используются параллельно. Аллотропия относится только к простым веществам, независимо от их агрегатного состояния; полиморфизм — только к твёрдому состоянию независимо от того, простое это вещество или сложное. Таким образом, эти термины совпадают для простых твёрдых веществ (кристаллическая сера, фосфор, железо и др.)[1].
Примеры аллотропии
 В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
В настоящее время известно более 400 разновидностей простых веществ. Способность элемента к образованию аллотропных форм обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов.
Как правило, большее число аллотропных форм образуют элементы, имеющие переменные значения координационного числа или степени окисления (олово, фосфор). Другим важным фактором является катенация — способность атомов элемента образовывать гомоцепные структуры (например, сера). Склонность к аллотропии более выражена у неметаллов, за исключением галогенов, благородных газов, и полуметаллов.
Принято обозначать различные аллотропические формы одного и того же элемента строчными буквами греческого алфавита; причём форму, существующую при самых низких температурах, обозначают буквой α, следующую — β и т. д.
Неметаллы
| Водород: | Водород может существовать в виде орто- и пара-водорода. В молекуле орто-водорода o-h3 (т. пл. −259,10 °C, т. кип. −252,56 °C) ядерные спины параллельны, а у пара-водорода p-h3 (т. пл. −259,32 °C, т. кип. −252,89 °C) — антипараллельны. |
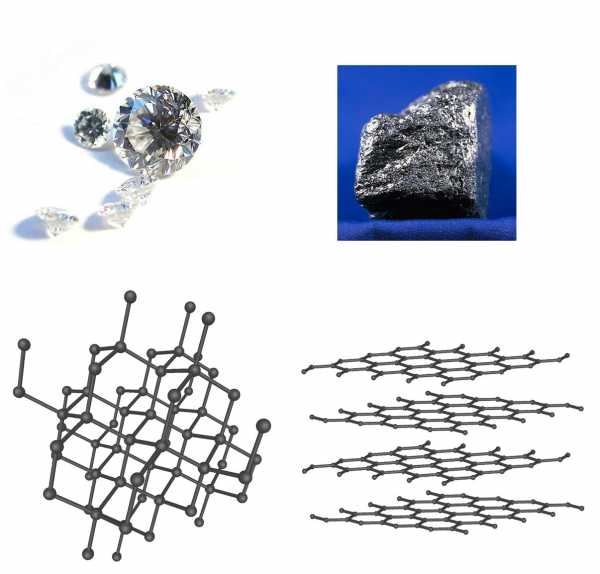
| Углерод: | Множество модификаций: алмаз, графит, фуллерен, карбин, графен, углеродные нанотрубки, лонсдейлит и др. Точное число модификаций указать затруднительно вследствие разнообразия форм связывания атомов углерода между собой. Наиболее многочисленны молекулярные структуры фуллеренов и нанотрубок. |
| Фосфор: | Известно 11 аллотропных модификаций фосфора. Основные модификации: белый, красный и чёрный фосфор. Белый фосфор ядовит, светится в темноте, способен самовоспламеняться, красный фосфор не ядовит, не светится в темноте, сам по себе не воспламеняется. |
| Кислород: | Две аллотропные модификации: О2 — кислород и О3 — озон. Кислород бесцветен, не имеет запаха; озон имеет выраженный запах, имеет бледно-фиолетовый цвет, он более бактерициден. |
| Сера: | Большое число аллотропных модификаций, второе место после углерода. Основные модификации: ромбическая, моноклинная и пластическая сера. |
| Селен: | Красный цикло-Se8, серый полимер Se и чёрный селен. |
Полуметаллы
| Бор: | Бор существует в аморфном и кристаллическом видах. Аморфный бор — порошок бурого цвета. Обладает большей реакционной способностью, чем кристаллический бор. Кристаллический бор — вещество чёрного цвета. Известно более 10 аллотропных модификаций бора, которые кристаллизуются в ромбической и тетрагональной сингониях. Наиболее устойчивая модификация — β-ромбический бор — состоит из икосаэдров B12, которые образуют слои, объединенные в бесконечную структуру. |
| Кремний: | Различают две основные аллотропные модификации кремния — аморфную и кристаллическую. Решётка кристаллической модификации кремния — атомная, алмазоподобная. Также выделяют поликристаллический и монокристаллический кремний. |
| Мышьяк: | Три основные аллотропные модификации: жёлтый мышьяк (неметалл, состоящий из молекул As4 — структура, аналогичная белому фосфору), серый мышьяк (полуметаллический полимер), чёрный мышьяк (неметаллическая молекулярная структура, аналогичная красному фосфору). |
| Германий: | Две аллотропные модификации: α-Ge — полуметалл с алмазоподобной кристаллической решёткой и β-Ge — с металлической структурой, аналогичной β-Sn. |
| Сурьма: | Известны четыре металлических аллотропных модификаций сурьмы, существующих при различных давлениях, и три аморфные модификации (взрывчатая, чёрная и жёлтая сурьма), из которых наиболее устойчива металлическая форма серебристо-белого цвета с синеватым оттенком |
| Полоний: | Полоний существует в двух аллотропных металлических модификациях. Кристаллы одной из них — низкотемпературной — имеют кубическую решетку (α-Po), а другой — высокотемпературной — ромбическую (β-Po). Фазовый переход из одной формы в другую происходит при 36 °C, однако при обычных условиях полоний находится в высокотемпературной форме вследствие разогрева собственным радиоактивным излучением. |
Металлы
Среди металлов, которые встречаются в природе в больших количествах (до U, без Tc и Pm), 28 имеют аллотропные формы при атмосферном давлении: Li, Be, Na, Ca, Sc, Ti, Mn, Fe, Co, Sr, Y, Zr, Sn, La, Ce, Pr, Nd, Sm, Gd, Tb, Dy, Yb, Hf, Tl, Th, Pa, U. Также важны аллотропные формы ряда металлов, образующиеся при их технологической обработке: Ti при 882˚C, Fe при 912˚C и 1394˚C, Co при 422˚C, Zr при 863˚C, Sn при 13˚C и U при 668˚C и 776˚C.
| Олово: | Олово существует в трех аллотропных модификациях. Серое олово (α-Sn) мелкокристаллический порошок, полупроводник, имеющий алмазоподобную кристаллическую решётку, существует при температуре ниже 13,2 °С. Белое олово (β-Sn) — пластичный серебристый металл, устойчивый в интервале температур 13,2—161 °С. Высокотемпературное гамма-олово (γ-Sn), имеющее ромбическую структуру, отличается высокой плотностью и хрупкостью, устойчиво между 161 и 232 °С (температура плавления чистого олова). |
| Железо: | Для железа известны четыре кристаллические модификации: до 769 °C (точка Кюри) существует α-Fe (феррит) с объёмноцентрированной кубической решёткой и свойствами ферромагнетика; в температурном интервале 769—917 °C существует β-Fe, который отличается от α-Fe только параметрами объёмноцентрированной кубической решётки и магнитными свойствами парамагнетика; в температурном интервале 917—1394 °C существует γ-Fe (аустенит) с гранецентрированной кубической решёткой; выше 1394 °C устойчиво δ-Fe с объёмоцентрированной кубической решёткой |
| Лантаноиды: | Церий, самарий, диспрозий и иттербий имеют по три аллотропических модификации; празеодим, неодим, гадолиний и тербий — по две. |
| Актиниды: | Для всех актиноидов, кроме актиния, характерен полиморфизм. Кристаллические структуры протактиния, урана, нептуния и плутония по своей сложности не имеют аналогов среди лантаноидов и более похожи на структуры 3d-переходных металлов. Плутоний имеет семь полиморфных модификаций (в том числе, при обычном давлении — 6), а уран, прометий, нептуний, америций, берклий и калифорний — три. Лёгкие актиниды в точке плавления имеют объёмно-центрированную решётку, а начиная с плутония — гранецентрированную. |
Энантиотропные и монотропные переходы
 Переход одной аллотропной модификации в другую происходит при изменении температуры или давления (или одновременном воздействии обоих факторов) и связан со скачкообразным изменением свойств вещества. Этот процесс бывает обратимым (энантиотропным) и необратимым (монотропным).
Переход одной аллотропной модификации в другую происходит при изменении температуры или давления (или одновременном воздействии обоих факторов) и связан со скачкообразным изменением свойств вещества. Этот процесс бывает обратимым (энантиотропным) и необратимым (монотропным).
Примером энантиотропного перехода может служить превращение ромбической серы в моноклинную α-S (ромб.) ↔ β-S (монокл.) при 95,6 °C. При обычной температуре стабильной является ромбическая модификация серы, которая при нагревании до 95,6 °С при нормальном давлении переходит в моноклинную форму. Последняя при охлаждении ниже 95,6 °С вновь переходит в ромбическую форму. Таким образом, переход одной формы серы в другую происходит при одной и той же температуре, и сами формы называются энантиотропными.
К монотропному переходу относится превращение белого фосфора P4 под давлением 1,25 ГПа и температуре 200 °C в более стабильную модификацию — чёрный фосфор. При возвращении к обычным условиям обратный переход не происходит. Переход из нестабильной формы в стабильную в принципе возможен при любой температуре, а обратный — нет, то есть определенная точка перехода отсутствует. Ещё один пример — превращение графита в алмаз при давлении 6 ГПа и температуре 1500 °C в присутствии катализатора (никель, хром, железо и другие металлы), то есть при условиях термодинамической устойчивости алмаза. Тогда как алмаз легко и быстро переходит в графит при температурах выше 1000 °С. В обоих случаях давление способствует превращению, поскольку образуется вещества с более высокой плотностью, чем исходные.
Три известные модификации олова переходят друг в друга различным образом. При обычных условиях устойчиво β-Sn (пластичное белое олово) с тетрагональной кристаллической решеткой[2]. Выше 173 °С β-Sn энантиотропно превращается в хрупкую модификацию γ-Sn, а ниже 13,2 °C β-Sn переходит монотропно в порошкообразное α-Sn (серое олово) с кубической решёткой типа алмаза. Этот полиморфный переход происходит с малой скоростью, но резко ускоряется в контакте с серым оловом — плотные куски белого олова рассыпаются в пыль («оловянная чума»). Обратный процесс возможен только путём переплавки.
Напишите отзыв о статье "Аллотропия"
Примечания
- ↑ Угай Я. А. Общая и неорганическая химия: Учеб. для студентов вузов, обучающихся по направлению и спец. «Химия». — М.: Высш. шк., 1997. — 524 с.: ил.
- ↑ Химическая энциклопедия: в 5 т. / Редкол.:Кнунянц И. Л. (гл. ред.). — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 382. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8
См. также
Литература
- Эддисон У. Аллотропия химических элементов. — М.: Мир, 1966. — 207 с.
Ссылки
Отрывок, характеризующий Аллотропия
– Достаточно ли фуража в Кремсе? – Фураж не был доставлен в том количестве… Император перебил его. – В котором часу убит генерал Шмит?… – В семь часов, кажется. – В 7 часов. Очень печально! Очень печально! Император сказал, что он благодарит, и поклонился. Князь Андрей вышел и тотчас же со всех сторон был окружен придворными. Со всех сторон глядели на него ласковые глаза и слышались ласковые слова. Вчерашний флигель адъютант делал ему упреки, зачем он не остановился во дворце, и предлагал ему свой дом. Военный министр подошел, поздравляя его с орденом Марии Терезии З й степени, которым жаловал его император. Камергер императрицы приглашал его к ее величеству. Эрцгерцогиня тоже желала его видеть. Он не знал, кому отвечать, и несколько секунд собирался с мыслями. Русский посланник взял его за плечо, отвел к окну и стал говорить с ним. Вопреки словам Билибина, известие, привезенное им, было принято радостно. Назначено было благодарственное молебствие. Кутузов был награжден Марией Терезией большого креста, и вся армия получила награды. Болконский получал приглашения со всех сторон и всё утро должен был делать визиты главным сановникам Австрии. Окончив свои визиты в пятом часу вечера, мысленно сочиняя письмо отцу о сражении и о своей поездке в Брюнн, князь Андрей возвращался домой к Билибину. У крыльца дома, занимаемого Билибиным, стояла до половины уложенная вещами бричка, и Франц, слуга Билибина, с трудом таща чемодан, вышел из двери. Прежде чем ехать к Билибину, князь Андрей поехал в книжную лавку запастись на поход книгами и засиделся в лавке. – Что такое? – спросил Болконский. – Ach, Erlaucht? – сказал Франц, с трудом взваливая чемодан в бричку. – Wir ziehen noch weiter. Der Bosewicht ist schon wieder hinter uns her! [Ах, ваше сиятельство! Мы отправляемся еще далее. Злодей уж опять за нами по пятам.] – Что такое? Что? – спрашивал князь Андрей. Билибин вышел навстречу Болконскому. На всегда спокойном лице Билибина было волнение. – Non, non, avouez que c'est charmant, – говорил он, – cette histoire du pont de Thabor (мост в Вене). Ils l'ont passe sans coup ferir. [Нет, нет, признайтесь, что это прелесть, эта история с Таборским мостом. Они перешли его без сопротивления.] Князь Андрей ничего не понимал. – Да откуда же вы, что вы не знаете того, что уже знают все кучера в городе? – Я от эрцгерцогини. Там я ничего не слыхал. – И не видали, что везде укладываются? – Не видал… Да в чем дело? – нетерпеливо спросил князь Андрей. – В чем дело? Дело в том, что французы перешли мост, который защищает Ауэсперг, и мост не взорвали, так что Мюрат бежит теперь по дороге к Брюнну, и нынче завтра они будут здесь. – Как здесь? Да как же не взорвали мост, когда он минирован? – А это я у вас спрашиваю. Этого никто, и сам Бонапарте, не знает. Болконский пожал плечами. – Но ежели мост перейден, значит, и армия погибла: она будет отрезана, – сказал он. – В этом то и штука, – отвечал Билибин. – Слушайте. Вступают французы в Вену, как я вам говорил. Всё очень хорошо. На другой день, то есть вчера, господа маршалы: Мюрат Ланн и Бельяр, садятся верхом и отправляются на мост. (Заметьте, все трое гасконцы.) Господа, – говорит один, – вы знаете, что Таборский мост минирован и контраминирован, и что перед ним грозный tete de pont и пятнадцать тысяч войска, которому велено взорвать мост и нас не пускать. Но нашему государю императору Наполеону будет приятно, ежели мы возьмем этот мост. Проедемте втроем и возьмем этот мост. – Поедемте, говорят другие; и они отправляются и берут мост, переходят его и теперь со всею армией по сю сторону Дуная направляются на нас, на вас и на ваши сообщения. – Полноте шутить, – грустно и серьезно сказал князь Андрей. Известие это было горестно и вместе с тем приятно князю Андрею. Как только он узнал, что русская армия находится в таком безнадежном положении, ему пришло в голову, что ему то именно предназначено вывести русскую армию из этого положения, что вот он, тот Тулон, который выведет его из рядов неизвестных офицеров и откроет ему первый путь к славе! Слушая Билибина, он соображал уже, как, приехав к армии, он на военном совете подаст мнение, которое одно спасет армию, и как ему одному будет поручено исполнение этого плана. – Полноте шутить, – сказал он. – Не шучу, – продолжал Билибин, – ничего нет справедливее и печальнее. Господа эти приезжают на мост одни и поднимают белые платки; уверяют, что перемирие, и что они, маршалы, едут для переговоров с князем Ауэрспергом. Дежурный офицер пускает их в tete de pont. [мостовое укрепление.] Они рассказывают ему тысячу гасконских глупостей: говорят, что война кончена, что император Франц назначил свидание Бонапарту, что они желают видеть князя Ауэрсперга, и тысячу гасконад и проч. Офицер посылает за Ауэрспергом; господа эти обнимают офицеров, шутят, садятся на пушки, а между тем французский баталион незамеченный входит на мост, сбрасывает мешки с горючими веществами в воду и подходит к tete de pont. Наконец, является сам генерал лейтенант, наш милый князь Ауэрсперг фон Маутерн. «Милый неприятель! Цвет австрийского воинства, герой турецких войн! Вражда кончена, мы можем подать друг другу руку… император Наполеон сгорает желанием узнать князя Ауэрсперга». Одним словом, эти господа, не даром гасконцы, так забрасывают Ауэрсперга прекрасными словами, он так прельщен своею столь быстро установившеюся интимностью с французскими маршалами, так ослеплен видом мантии и страусовых перьев Мюрата, qu'il n'y voit que du feu, et oubl celui qu'il devait faire faire sur l'ennemi. [Что он видит только их огонь и забывает о своем, о том, который он обязан был открыть против неприятеля.] (Несмотря на живость своей речи, Билибин не забыл приостановиться после этого mot, чтобы дать время оценить его.) Французский баталион вбегает в tete de pont, заколачивают пушки, и мост взят. Нет, но что лучше всего, – продолжал он, успокоиваясь в своем волнении прелестью собственного рассказа, – это то, что сержант, приставленный к той пушке, по сигналу которой должно было зажигать мины и взрывать мост, сержант этот, увидав, что французские войска бегут на мост, хотел уже стрелять, но Ланн отвел его руку. Сержант, который, видно, был умнее своего генерала, подходит к Ауэрспергу и говорит: «Князь, вас обманывают, вот французы!» Мюрат видит, что дело проиграно, ежели дать говорить сержанту. Он с удивлением (настоящий гасконец) обращается к Ауэрспергу: «Я не узнаю столь хваленую в мире австрийскую дисциплину, – говорит он, – и вы позволяете так говорить с вами низшему чину!» C'est genial. Le prince d'Auersperg se pique d'honneur et fait mettre le sergent aux arrets. Non, mais avouez que c'est charmant toute cette histoire du pont de Thabor. Ce n'est ni betise, ni lachete… [Это гениально. Князь Ауэрсперг оскорбляется и приказывает арестовать сержанта. Нет, признайтесь, что это прелесть, вся эта история с мостом. Это не то что глупость, не то что подлость…] – С'est trahison peut etre, [Быть может, измена,] – сказал князь Андрей, живо воображая себе серые шинели, раны, пороховой дым, звуки пальбы и славу, которая ожидает его. – Non plus. Cela met la cour dans de trop mauvais draps, – продолжал Билибин. – Ce n'est ni trahison, ni lachete, ni betise; c'est comme a Ulm… – Он как будто задумался, отыскивая выражение: – c'est… c'est du Mack. Nous sommes mackes , [Также нет. Это ставит двор в самое нелепое положение; это ни измена, ни подлость, ни глупость; это как при Ульме, это… это Маковщина . Мы обмаковались. ] – заключил он, чувствуя, что он сказал un mot, и свежее mot, такое mot, которое будет повторяться. Собранные до тех пор складки на лбу быстро распустились в знак удовольствия, и он, слегка улыбаясь, стал рассматривать свои ногти. – Куда вы? – сказал он вдруг, обращаясь к князю Андрею, который встал и направился в свою комнату. – Я еду. – Куда? – В армию. – Да вы хотели остаться еще два дня? – А теперь я еду сейчас. И князь Андрей, сделав распоряжение об отъезде, ушел в свою комнату. – Знаете что, мой милый, – сказал Билибин, входя к нему в комнату. – Я подумал об вас. Зачем вы поедете? И в доказательство неопровержимости этого довода складки все сбежали с лица. Князь Андрей вопросительно посмотрел на своего собеседника и ничего не ответил. – Зачем вы поедете? Я знаю, вы думаете, что ваш долг – скакать в армию теперь, когда армия в опасности. Я это понимаю, mon cher, c'est de l'heroisme. [мой дорогой, это героизм.] – Нисколько, – сказал князь Андрей. – Но вы un philoSophiee, [философ,] будьте же им вполне, посмотрите на вещи с другой стороны, и вы увидите, что ваш долг, напротив, беречь себя. Предоставьте это другим, которые ни на что более не годны… Вам не велено приезжать назад, и отсюда вас не отпустили; стало быть, вы можете остаться и ехать с нами, куда нас повлечет наша несчастная судьба. Говорят, едут в Ольмюц. А Ольмюц очень милый город. И мы с вами вместе спокойно поедем в моей коляске. – Перестаньте шутить, Билибин, – сказал Болконский. – Я говорю вам искренно и дружески. Рассудите. Куда и для чего вы поедете теперь, когда вы можете оставаться здесь? Вас ожидает одно из двух (он собрал кожу над левым виском): или не доедете до армии и мир будет заключен, или поражение и срам со всею кутузовскою армией. И Билибин распустил кожу, чувствуя, что дилемма его неопровержима. – Этого я не могу рассудить, – холодно сказал князь Андрей, а подумал: «еду для того, чтобы спасти армию». – Mon cher, vous etes un heros, [Мой дорогой, вы – герой,] – сказал Билибин.В ту же ночь, откланявшись военному министру, Болконский ехал в армию, сам не зная, где он найдет ее, и опасаясь по дороге к Кремсу быть перехваченным французами. В Брюнне всё придворное население укладывалось, и уже отправлялись тяжести в Ольмюц. Около Эцельсдорфа князь Андрей выехал на дорогу, по которой с величайшею поспешностью и в величайшем беспорядке двигалась русская армия. Дорога была так запружена повозками, что невозможно было ехать в экипаже. Взяв у казачьего начальника лошадь и казака, князь Андрей, голодный и усталый, обгоняя обозы, ехал отыскивать главнокомандующего и свою повозку. Самые зловещие слухи о положении армии доходили до него дорогой, и вид беспорядочно бегущей армии подтверждал эти слухи. «Cette armee russe que l'or de l'Angleterre a transportee, des extremites de l'univers, nous allons lui faire eprouver le meme sort (le sort de l'armee d'Ulm)», [«Эта русская армия, которую английское золото перенесло сюда с конца света, испытает ту же участь (участь ульмской армии)».] вспоминал он слова приказа Бонапарта своей армии перед началом кампании, и слова эти одинаково возбуждали в нем удивление к гениальному герою, чувство оскорбленной гордости и надежду славы. «А ежели ничего не остается, кроме как умереть? думал он. Что же, коли нужно! Я сделаю это не хуже других».
wiki-org.ru