Способ защиты низкоуглеродистой стали от коррозии. Защита стали от коррозии
Способы защиты стали от коррозии
Растрескивание металла под воздействием знакопеременной нагрузки или периодической динамической нагрузки называют усталостным разрушением. Чем быстрее приложенное в каждом цикле напряжение, тем быстрее разрушается металл.
Существуют способы снижения склонности коррозионной усталости. Для углеродистых сталей тщательная деаэрация растворов солей повышает предел усталости до его уровня на воздухе. Аналогичный результат дает катодная защита при потенциале -0,49В.
Эффективно также введение ингибиторов; в водопроводной воде с добавкой 200 мг/л дихромата натрия стойкость к коррозионной усталости, нормализованной стальной проволоки (0,35 % С) становится выше, чем на воздухе.
Достоинство покрытий протекторного типа (например, цинка или кадмия, электроосажденных на сталь) в том, что основной металл катодно защищен и на тех участках, где на покрытии есть дефекты. В одном из наиболее ранних исследований коррозионной усталости, проведенном Б.Хэйгом в 1916 г. В связи с преждевременным разрушением стальных буксировочных тросов, контактирующих с морской водой, было показано, что гальванические покрытия заметно увеличивают срок службы тросов. Цинковые покрытия по алюминию эффективны, в отличие от кадмиевых. Отмечается, что электролитические покрытия стали оловом, свинцом, медью или серебром предохраняют ее от разрушения главным образом за счет изоляции отвнешней среды, а не за счет повышения усталостной прочности. Данные о применении никелевых и хромовых покрытий противоречивы.
Органические покрытия полезны в тех случаях, когда в грунтовочном слое имеются ингибирующие пигменты (например, хромат цинка). Эффективна обработка металла, вызывающая напряжения сжатия на поверхности (например, дробеструйная).
Меры предотвращения коррозии стали.
1. Сочетание мягкого металла с твердым.
При достаточно высоких нагрузках мягкие металлы предохраняют поверхность раздела от контакта с воздухом. Более того, мягкий металл может течь при срезе, а не скользить по поверхности раздела, благодаря этому разрушение уменьшается. Для контакта со сталью можно рекомендовать металлы, покрытые оловом, серебром, свинцом, индием, кадмием. При сопряжении латуни со сталью разрушение меньше, чем при трении стали о сталь. Разрушении велики при сочетании нержавеющих сталей.
2. Проектирование контактирующих поверхностей с полным устранением проскальзывания (например, пескоструйная обработка поверхности).
Полностью устранить скольжение достаточно трудно, так как разрушение вызывается очень малым относительным перемещением поверхностей – на расстояние порядка размера атомов. Увеличение нагрузки дает эффект, когда она достаточна для полной остановки скольжения; в противном случае нагрузка крайне вредна.
3. Применение покрытий (например, нанесение на трущиеся поверхности резиновой мастики).
Покрытия предохраняют поверхности раздела от соприкосновения с воздухом.
4. Использование смазок.
Если нагрузка не очень велика, хороший результат дает применение масел с низкой вязкостью, особенно в сочетании с обработкой поверхности фосфатами. Маловязкие масла быстро проникают к свежей поверхности металла, образующейся при трении. В качестве твердой смазки можно использовать сульфид молибдена, особенно если он спекается с поверхностью металла, однако этот положительный эффект имеет временный характер, так как смазка в конце концов удаляется в результате движения поверхностей.
5. Применение эластомерных прокладок или материалов с низким коэффициентом трения.
Резина амортизирует колебания, предотвращая скольжение на поверхности раздела. Политетрафторэтилен (тефлон) имеет низкий коэффициент трения и снижает фреттинг. Эти материалы эффективны только при малых нагрузках в связи их относительно низкой прочностью.
6. Использование сплавов кобальта.
Эффективно только в присутствии воды ли водных растворов.
Ингибиторы коррозии
Ингибиторами коррозии являются такие химические соединения (или смеси нескольких соединений), небольшая добавка которых в коррозионную среду вызывает уменьшение скорости коррозии металла, находящегося в этой среде. Очень часто металлические конструкции, находящиеся в агрессивной среде, невозможно целиком предохранить от коррозии с помощью защитных покрытий (например, внутреннюю поверхность труб). Случается, что покрытие не обеспечивает необходимой защиты (различные теплообменные аппараты закрытого типа, когда покрытия затрудняют теплообмен). В этих случаяхуменьшение потерь, вызываемых коррозией, может быть достигнуто при помощи ингибиторной защиты.
Ингибиторнаязащита может применяться как самостоятельный метод борьбы с коррозией, а также в сочетании с другими методами (комплексная защита). Сначала ингибиторы использовались только взамкнутых системах(например, системы охлаждения двигателей локомотивов, судов, автомобилей) или при периодической замене среды (процессы травления металлов, конденсаторы и т. д.). В дальнейшем, по мере развития техники, ингибиторы получили более широкое распространение. Разработка специальных дозаторов позволила использовать этот экономичный метод борьбы с коррозией и в открытых циклах (например, промышленные транспортирующие трубопроводы).
Современная промышленность создает неограниченные возможности для использования ингибиторной защиты. Ингибиторы широко применяются в травильных цехах (ингибиторы травления), в автотракторной, (машиностроительной) и электронной промышленности (средства временной защиты и летучие ингибиторы), в нефтехимии (ингибиторы для процессов нефтепереработки, добавки к маслам и горючим), в коммунальном хозяйстве (ингибиторы для водооборотных систем), в пищевой промышленности (мясо-, рыбо-, овощеперерабатывающие предприятия) использует миллионы металлических консервных банок, которые при стерилизации и пастеризации подвергаются сильной коррозии. Применение ингибиторов в сочетании с пленкообразующими материалами—наиболее надежное средство защиты, так как в этом случае предотвращается коррозия банок в ходе изготовления консервов, во время их транспортировки и хранения, а также сохраняется удовлетворительный внешний вид продукции.
Эффективным способом борьбы с коррозией металлов является также изменение коррозионной среды, в частности удаление из нее агрессивных компонентов. Например, интенсивная коррозия стальных резервуаров и труб в системах теплоснабжения, вызываемая присутствием растворенного в воде кислорода, может быть уменьшена благодаря добавке в нее поглотителей кислорода (гидразина, сульфита натрия).
Имея в виду широкие перспективы использования ингибиторной защиты, следует помнить, что и изменение коррозионной среды, и введение в нее ингибиторов коррозии не должны противоречить технологическим условиям процесса и общим правилам защиты здоровья людей и охраны природной среды. Ингибиторами коррозии могут быть как неорганические, так и органические соединения. В зависимости от характера коррозионной среды, механизма действия и вида защитной пленки, образованной на поверхности металла, их можно разделить на группы. Однако вследствие сложного механизма действия ингибиторов любая их классификация является условной.
С электрохимической точки зрения ингибиторы делятся на катодные, анодные и смешанные. Это деление ингибиторов иллюстрирует рис. I, из которого следует, что введение ингибитора вызывает изменение коррозионного потенциала системы и в значительной мере влияет на уменьшение плотности коррозионного тока (рисунки даны в полулогарифмических координатах), являющегося мерой скорости коррозии металлов.
Замедление коррозии металла можно осуществить уменьшением скорости катодной реакции (рис. I, а), анодной реакции (рис. I, б) или обеих реакций одновременно (рис. I, в). Большинство применяемых ингибиторов коррозии влияет на ход как катодных, так и анодных реакций: смешанное ингибирующее действие обнаруживает, в частности, значительное число органических ингибиторов.
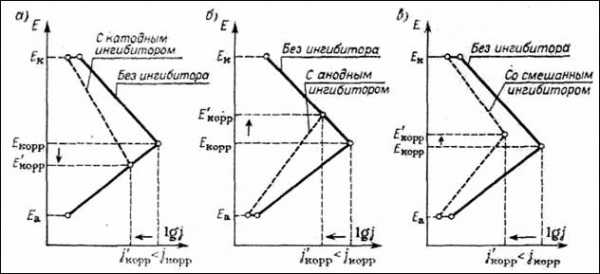 |
Рис.1. Влияние ингибитора на ход поляризационных кривых в растворе электролита:
а) катодный ингибитор; б) анодный ингибитор; в) смешанный ингибитор
Говоря об ингибиторах коррозии, следует рассматривать конкретную коррозионную систему (металл и среда, в которой он находится), так как универсальных ингибиторов не существует. Другими словами, определенное химическое соединение может быть ингибитором коррозии одного металла и одновременно в той же среде стимулятором коррозии другого. Изменяя коррозионную среду, следует применять и соответствующие ингибиторы. Например, нитриты, эффективно защищающие от коррозии железо в нейтральной среде, наоборот, ускоряют его коррозию в сильнокислых средах.
Большинство аппаратов и металлических конструкций (теплообменники, радиаторы, химические реакторы и т. д.) изготавливаются из нескольких металлов. Ингибиторная защита таких конструкций вполне реальна, но чаще всего необходимо применять смеси ингибиторов.
среда, пленки, электрохимический метод, цементные покрытия

Изначально для защиты металла от атмосферного влияния применялись различные масла и жиры, а спустя некоторое время, в качестве защитных средств стали использовать напыление другими видами металлов, в частности, оловом.
Воздействие среды на развитие коррозии металлов
Так как любой вид коррозии, в том числе и анодная, подчиняется исключительно законам природы, нельзя полностью избавиться от этого явления, а можно только приостановить процесс разрушения металла. Первостепенной задачей многих ученых является разработка и выведение новых методик, которые были бы более эффективными в борьбе с коррозией.
Стоит отметить, что защита металлических изделий от коррозии определяется степенью агрессивности их эксплуатации. Существует специальная таблица агрессивности сред по отношению к различным металлам.
| Относительная влажность внутри помещений и хар-ка климатической зоны | Степень агрессивности среды в зависимости от условий эксплуатации металлической конструкции | ||
| на открытом воздухе | Внутри зданий | Без конденсации влаги | |
| 60% сухая | низкая | неагрессивная | неагрессивная |
| низкая | низкая | неагрессивная | |
| умеренная | умеренная | низкая | |
| высокая | умеренная | умеренная | |
| 61-75% нормальная | низкая | низкая | неагрессивная |
| умеренная | умеренная | низкая | |
| умеренная | умеренная | умеренная | |
| высокая | высокая | умеренная | |
| Более 75% влажная | умеренная | низкая | низкая |
| умеренная | умеренная | умеренная | |
| высокая | умеренная | умеренная | |
| высокая | сильная | умеренная | |
Существует несколько основных способов защиты от коррозии металлов, и чтобы выбрать более подходящий, необходимо учитывать его эффективность в рассматриваемом случае, а также целесообразность вложения денежных средств. На сегодняшний день применяются такие виды борьбы с ржавчиной.
Защитные пленки от коррозии
Одним из самых популярных методов защиты металлов от коррозии является нанесение на их поверхность специальных защитных пленок : эмали, краски, лака и других металлов. Стоит отметить, что для большинства людей самыми доступными являются лакокрасочные пленки.
Лаки и краски имеют низкий уровень газо- и паропроницаемости, а также водоотталкивающие свойства, именно поэтому они на некоторое время задерживают попадание на поверхность металла влаги и различных агрессивных веществ атмосферного происхождения. Однако стоит помнить о том, что покрытие металла лакокрасочной пленкой не искореняет проблему коррозии, а лишь на время тормозит этот процесс.
Именно поэтому на первый план выходит качество наносимого покрытия –пористость, проницаемость, толщина слоя, равномерность, прочность сцепления (адгезия), способность набухать в воде. Качество покрытия определяется уровнем подготовки поверхности металла и метода нанесения защитного слоя. Перед нанесением слоя необходимо удалить ржавчину окалины и устранить нагар, так как они будут мешать взаимодействию покрытия с самой конструкцией.
Качество водопроводной воды, длительная эксплуатация, отсутствие надлежащего ухода и многие другие факторы часто приводят к загрязнению ванны. Как отчистить ее от коррозии и налета описано в этой статье.
Практические методы, а также перечень инструментов и средств, пригодных для использования при чистке акриловой ванны описаны здесь.
Зачастую низкий уровень соприкосновения наносимой пленки с материалом может быть связан с повышенной пористостью металла. В большинстве случаев она появляется в процессе создания защитной прослойки в результате испарения растворителя, удаления элементов отверждения и нарушения целостности (при старении пленки). Дабы получить максимально эффективное покрытие, рекомендуется наносить не один плотный слой, а несколько более тонких.
Очень часто при увеличении толщины покрытия наблюдается ослабление адгезии защитной пленки с металлом. [important]При низком качестве нанесения защитного слоя образуются воздушные полости и зазоры, которые оказывают пагубное влияние на покрытие.[/important]
Иногда лакокрасочные покрытия защищают кремнийорганическими соединениями или восковыми составами, что позволяет снизить уровень смачиваемости пленки водой. Примечательно, что краски и лаки более эффективны в условиях защиты от атмосферных раздражителей.
Что касается защиты подземных сооружений и конструкций, то этот метод защиты от коррозии оказывается не действенным, это связано с тем, что при контакте с грунтом затруднительно вычислить механические повреждения защитного покрытия. Как показывает практика, в таких условиях более приемлемым является применение толстослойных пленок, в основе которых лежит каменноугольная смола (битум).
Грунтовки и фосфатирование от коррозии металлов

Вторым видом защиты от коррозии является нанесение под слой лака или краски небольшого количества грунтовки. Элементы, которые входят в ее состав, также должны иметь ингибиторными свойствами. При выполнении этого условия, вода будет проходить через слой грунтовки, растворяя некое количество пигментов, тем самым становясь менее агрессивной. Среди наиболее эффективных элементов для грунтов признан свинцовый сурик.
Встречаются случаи, когда вместо грунтовки проводится фосфатирование поверхности металлических изделий. Этот процесс осуществляется с помощью нанесения на необходимый участок растворов ортофосфатов марганца (II) железа (III), или цинка (II), которые содержат в себе и саму ортофосфатную кислоту. Стоит отметить, что фосфатирование проводится в течение 30-90 минут при температуре 97-99 0 С.
Чтобы провести фосфатирование стальных поверхностей, существует большое количество специальных препаратов, которые состоят из фосфатов железа и марганца. Многие эксперты отмечают. Что самым эффективным подобным средством является “мажеф” – смесь дигидрофосфатов марганца, железа и фосфорной кислоты.
Процесс окисления (коррозия) сопровождается постепенным разрушением металлической поверхности и образованием порошка рыжего (ржавого) цвета. Чтобы его безопасно убрать, ознакомьтесь с методами, указанными в статье.
Читайте здесь, как убрать накипь из чайника.
Если проводить фосфатирование с помощью этого препарата, то изделие необходимо поместить в специальный раствор, разогретый до 1000 С. Внутри смеси происходит удаление вредных элементов с поверхности металла с обильным выделение водорода, в результате чего получается прочный, плотный и почти нерастворимый слой железа и марганца черно-серого цвета. Как только толщина слоя достигнет определенного уровня, растворение веществ прекращается.
Пленка фосфатов оказывается эффективной при защите конструкции от атмосферных явлений, однако не способна защитить даже от слабых кислотных растворов. Из всего сказанного можно сделать вывод, что фосфатный слой защиты может служить лишь фундаментом для дальнейшего нанесения декоративных и защитных покрытий.
Электрохимическая и силикатная защита от коррозии

В заводских условиях используется и электрохимический метод – обработка металлоконструкций переменным током в смеси фосфата цинка при фиксированной плотности тока 4 А/дм 2 , температуре 60-70 0 С и при напряжении 20 В. Фосфатные защитные покрытия представляют собой своеобразную сеть сцепленных с поверхностью фосфатов металлов.
Данный вид покрытия сам по себе не может обеспечить изделие надежной защитой от коррозии, и зачастую служит основой для покраски, что обеспечивает хорошее сцепление металла и краски. Кроме того, фосфатная защита значительно уменьшает вероятность появления разрушений в случае образования дефектов.
Кроме всех описанных способов защиты металлов от коррозии, в промышленности используются фарфоровые и стекловидные эмали. Уровень теплового расширения этих эмалей должен соответствовать таковому для покрываемых металлов. Процесс эмалирования осуществляется сухим напудриванием или нанесением на поверхность конструкций водной суспензии.
Изначально на чистую поверхность наносится слой грунтовки, который обжигается в печи, после чего на изделие наносят дозу покровной эмали и повторяют обжиг. Погашенные или прозрачные эмали являются наиболее распространенными среди стекловидных покрытий. Часто в их состав вводят дополнительные материалы: оксиды, окислители органических примесей, красители, глушители.
Эмалирующий материал получается путем сплавления исходных компонентов добавлением 6-10% глины и измельчением в порошок. Стоит заметить, что покрытия данного рода зачастую наносятся на чугун, сталь, латунь, алюминий и медь.
Отличительной особенностью эмалей являются высокий уровень защитных свойств, что делает эти вещества непроницаемыми для воздуха и воды даже при длительном контакте. Кроме того, эмали обладают повышенной стойкостью к перепадам температур, что значительно расширяет спектр применения подобных покрытий.
Мельчайшие частицы имеют неприятное свойство накапливаться и становиться причиной сразу многих проблем – от неопрятности квартиры до возникновения аллергических заболеваний. Узнайте, какие щетки лучше использовать в борьбе против пыли.
Здесь вы узнаете, как убрать жирные пятна с одежды.
Среди основных недостатков эмалевых покрытий стоит отметить сильную чувствительность к термическим и механическим ударам. Если использовать данный вид защиты в течение длительного периода времени, на поверхности металла могут появиться трещины, которые и станут причиной коррозии.
Цементные и металлические покрытия от коррозии
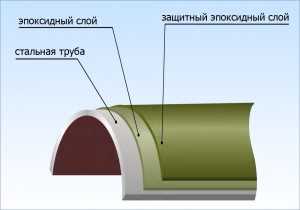
Чтобы обеспечить полноценную защиту стальных и чугунных водяных труб от коррозии, многие предприятия используют цементные покрытия. Так как показатели теплового расширения стали и портландцемента почти одинаковы, то он является отличным средством защиты металла. Так же, как и у эмалевых покрытий, цементная защита очень чувствительна к механическим повреждениям, что существенно сужает возможности применения данного метода.
Очень распространенным методом защиты от коррозии является нанесение небольшого слоя другого металла. Покрывающие металлы корродируют с очень низкой скоростью, причиной тому служит плотная оксидная пленка, образуемая наносимым напылением. Стоит отметить, что сейчас существует большое количество способов нанесения покрывающего слоя:
- Напыление,
- Диффузионное покрытие,
- Горячее покрытие,
- Гальваническое покрытие,
- При помощи различных газофазных реакций.
В современном мире можно смело говорить о том, что металл является одной из основ мировой цивилизации. Без металлических изделий и конструкций не обходится ни одна стройка или ремонтные работы. Однако большой проблемой подобных изделий является коррозия, которая постепенно разрушает целостную структуру материала.
На сегодняшний день существует множество способов защиты от коррозии, однако ни один из них не может полностью исключить вероятность появления «металлической болезни». Поэтому одной из первостепенных задач современного общества является изобретение более долговечного и действенного способа борьбы со ржавчиной.
Читайте также:
 2 метода защиты от коррозии металлов Коррозия в переводе с латинского означает «разъедание», это легко объясняет сущность данного понятия. С научной точки зрения коррозия является процессом самопроизвольного разрушения […]
2 метода защиты от коррозии металлов Коррозия в переводе с латинского означает «разъедание», это легко объясняет сущность данного понятия. С научной точки зрения коррозия является процессом самопроизвольного разрушения […] Анодная защита металла от коррозии Элетрохимическая защита является одним из самых действенных средств способных уберечь металлические изделия от коррозии. Данный метод активно применяется в случаях, когда […]
Анодная защита металла от коррозии Элетрохимическая защита является одним из самых действенных средств способных уберечь металлические изделия от коррозии. Данный метод активно применяется в случаях, когда […]
masterchist.ru
Protect metals from corrosion - grease monkey
The corrosion process is determined by three types of factors (ris.1.45): the chemical nature and structure of the metal or alloy, of construction of the item ; containing corrosive substances in the environment and the temperature of the environment.
chemical Corrosion - the destruction of metals exposed to high temperature gases or liquids (without electrolysis). At high temperatures, forms a deposit on the valves and cylinder heads, on spark plugs, on pistons (the top of the skirt and piston grooves), of kompressionnыh rings, on the valve and furnaces for heat- and electric heaters. First, on the surfaces of parts at temperatures up to 150 ° C formed clearcoats, Further at higher temperatures there is a deposit.
Electrochemical Corrosion takes place in liquid media, conducting electricity; It occurs in the process of electrolytic metal demolition.
a of the conditions for the occurrence of galvanic corrosion is the presence of water. Water is atmospheric, in soil, on the surfaces of parts and structures. In the soil, air and working environments are also available salt crystals and oxides, sulfur and exhaust gases and , eventually, acid formed - this second corrosion appearance condition.
Consider the example of the process of corrosion product in the presence of different metals: copper and zinc. In the acidic environment of zinc atoms leave their electrons the anode and become positively charged zinc ions and transferred to a liquid, and the cathode (copper plate) gain electrons hydrogen anions , therefore, the cathode will be allocated to hydrogen atoms from a solution.
Based on the above, for the occurrence of electrochemical corrosion process needed three conditions:
- the presence of water;
- the presence of salts, acids;
- presence of different metals, t. it is. metals. or its separate phases with different potential hydrogen.
Galvanic couples are formed on only between different materials, but also between different alloy small microscopic crystals. Sometimes submicroscopic galvanic couples may occur at the grain boundaries. Например, high-chromium steels are subject to intergranular corrosion. Phases of chromium has a positive potential, and depleted chromium - negative (Fe). Externally, no change of the alloy does not occur, and its properties deteriorate, which is very dangerous when the product.
Atoms of metal in contact with the electrolyte, go into solution as ions. Transition metal atoms into ions, ie. dissolution of metals is determined by the normal electrode potential (rice. 1.47 ), which is a voltage value (AT) eThe electrical .toka, which must be applied to the border interfacial metal - liquid, to prevent the transition metal ion in solution. The more negative potential ( — ), the metal is increasingly seeking to dissolve in electrolytes., the more intense is the corrosion.
Metals with a negative potential of hydrogen ( — ) displace hydrogen from acids, and metals with a positive potential( + ) -displaces hydrogen from the solution.
In the case of a thick dense film can be stabilized corrosion. Such films formed on aluminum, lead, olove, marriage and chromium. They do not allow the gases to the surface of the part. On the hardware also are dense film, but they cracked and peeled off from the iron so. Technical iron rusts at ordinary temperatures, also at a high temperature (250… 300 °С) rust film formed in front, and when 600 ° On the surface of iron is very quickly covered with a thick layer of scale. Из-за того, that the porous film, gases penetrate well to the metal surface and the corrosion rate is not reduced, tk. No protective effect of the film.
Corrosive destruction can be solid (uniform and non-uniform), local ( spots and dots ) and intergranular. It is seen, that corrosion may decrease when implementing following activities:
- selection of the piece of fabric;
- decrease the aggressiveness of the environment;
- creation of protective films and corrosion control process.
The methods of corrosion protection factors determined by the need of neutralization, determining the corrosion rate: the selection of corrosion-resistant materials; decrease the aggressiveness and the ambient temperature; the separation surface of the part of the corrosive environment; target control corrosion process.
1.selection of material Details performed based on the hydrogen potential of the metal. As can be seen from, that the gold-, platinum and silver, more corrosion-resistant, than iron products, zinc and aluminum, but these materials are expensive, so are of limited use in everyday life and technology. Chemically pure metals have higher corrosion resistance, than alloys, so "Demidov iron", smelted on charcoal of the good ores, virtually no rust, and a modern flat products can not be used without protective coatings. In contrast, the use of chemically pure metal additives of some alloying elements, mainly in large quantities Cr and Ni, possible to obtain so-called stainless steel (12Kh28N10T, 12F9 Anx18, 08Kh32N6T,… ).
Cast iron corrosion more resistant than steel, and at last the corrosion rate increases with increasing carbon content. Aluminium and its alloys have a very low potential of hydrogen, but on the surface of the part relatively quickly formed a strong and resistant protective film, therefore aluminum parts do not require additional protection ( painting, etc..) corrosion.
2. Reduced aggressiveness medium is performed by adding the antioxidant additives in lubricating oil and fuel and the cooling system. For heating systems is carried out pre-treatment of water (and removal of iron salts). The important factor is to reduce the temperature of the coolant, eg, for systems heating to 100 ... 110 оTo 60 ... 70 оС, что, естественно, will not only reduce heat loss, but also to reduce the corrosion of the Elements.
3. surface coatings parts can perform the following tasks: separation of parts of the material from the corrosive environment; circuit galvanic electrical circuit not through aggressive environment, and through the metal coating, and , в результате , electrochemical corrosion termination; "Sacrifice" of the coating material ( mainly Zn) to corrosion and thus decrease corrosion of the base material parts.
Coatings are applied to the surface of the parts (chrome and nickel), dishes (enamel), sheet metal and pipes (zinc), tin banks and bottoms (tinning body) cars, eg, Car M20 "Pobeda" . Currently, the production of non-metallic underbody coating and bimetallic.
Metal is applied via processes electrogalvanic (nickel deposition, chromium, zinc) or metallization. Plating provides good adhesion to the base metal , but it requires technologically sophisticated surface preparation and high production.
4. Metal Protection Method protectors заключается в том ,that is connected to the pipeline through the metal plate Cable, having a lower hydrogen potential, which the, естественно, It dissolves and collapses primarily, protect the main unit against corrosion.
5. process katodnoй zaщitы External current metal structures, courts and main pipelines was first used in 1910 in order to protect against corrosion of underground building structures. This process is characterized ont this method protektorov, that to the protected parts supplied negative potential from the power source, and the positive- to the auxiliary anode. In the case of "natural" corrosion detail "loses" electrons, and as here , conversely, electrons are supplied to the workpiece, then there is no corrosion of process.
One of the main technological operations to protect the details of building structures and machines against corrosion is color , designed not only to protect against corrosion, but for aesthetic purposes.
Surface preparation for painting is mechanical straightening and leveling of surfaces, degreasing surfaces before painting and phosphating. Degreasing solvents performed, gasoline or assembly by immersion in a bath with a solution of soda (less caustic) soda, waterglass and trisodium. After degreasing washed item (node) hot water.
Phosphating surface is obtained by processing details of the phosphoric acid or salt solution, or phosphating primer. The phosphate layer It protects the surface from corrosion, wherein in case of damage, and corrosion layer of paint will not spread from the site of injury under the undamaged part..
Primer necessary to ensure good adhesion of metal with paint or sealer for metal protection from corrosion. After application of the primer paint sprayer or brush is made at a temperature coating drying 80 ... 100 ° C. 40 minutes or 18 ... 25 ° C to 48 hours.
spackling the surface is necessary for leveling the surface from scratches, scratch, defects in welds, and to protect the metal from corrosion. Putties reduces the mechanical strength of the coating, therefore rational their minimum required thickness. If necessary, seal large defects using epoxy putty , layer which can be applied to 20 mm.
Spackling can be local and continuous. First the local puttying, with a spatula to manually perform putty cracks, joints and shells. Continuous puttying is performed using spray gun. Drying is carried out without heating during 30 minutes. Sanding filler layer is carried out manually or sandpaper sanders.
outer layers coatings intended for decorative and protective purposes. Depending on the need for high-quality decorative painting or ordinary paint is chosen, quantity and quality of process steps.
For coloring used nitroemali and synthetic enamel. The advantage is nitroenamels drying at natural temperature for 10 ... 15 minutes. Total applied 5 ... 6 layers thick 8 ... 10 m with obligatory drying of each layer. However nitroemalevoe coating has insufficient resistance to corrosion and requires complicated polishing process. The surface is first sanded and coated with solvent, Additional description poliruetsâ pastes.
Synthetic enamel coating give a lasting shine and better protection against corrosion. Their term of office 4 .. 5 лет. The number of layers is sufficient 2 3 ... and much easier polishing. However, the polymerization of synthetic coating (drying) It occurs at high temperature 120 ... 130 ° C for one hour, which requires the use of sophisticated equipment.
Paint can be applied in the following ways:
- — Hand-painting brush;
- — Dip painting parts in a bath of paint;
- — Air paint spray application;
- — Application By airless spray;
- — painting in electrostatic field.
Aerial spraying is carried out with the help of guns — dispensers in special chambers or rooms, equipped with ventilation systems. The paint is applied by air pressure or gravity. Mixing can be executed inside the gun, and outside. The best results are obtained with external mixing. The disadvantages are the aerial spraying: large paint losses (до 40 …50 %), explosiveness paint spray, harmful to the body. In order to save the solvent, which generally need to reduce the viscosity
tehnar.net.ua
Сталь защита от коррозии - Справочник химика 21
Не менее важно использование алюминия для защиты металлов от коррозии. Так, защита стали от коррозии часто достигается методом плакирования ее поверхности. [c.182]В декоративных целях прибегают к никелированию стальных и железных изделий (например, в производстве автомобилей, приборов, медицинских инструментов, бытовых изделий и т. д.), хотя в гальванической паре никель—железо никель является катодом. Так как гальванически осажденный никель даже в слое толщиной 25—30 мкм обладает пористостью, то для более надежной защиты стали от коррозии он применяется с подслоем меди. [c.229]
Для предотвращения коррозии металлических конструкций, находящихся в почве, таких как металлические трубопроводы, резервуары, сваи, опоры, применяется электрохимическая катодная защита. Ее осуществляют путем подсоединения металлической конструкции к отрицательному полюсу внешнего источника постоянного тока, положительный полюс присоединяют к заземленному металлическому электроду, который постепенно разрушается. При этом на поверхности защищаемого металла протекают восстановительные процессы, а окисляется материал анода. Другой метод электрохимической защиты основан на присоединении защищаемого металла к электроду, изготовленному из более активного металла. При защите стальных конструкций применяют цинковые пластины. В этой гальванической паре цинк будет разрушаться и защищать сталь от коррозии. Отсюда и название этого метода —метод протектора (от лат. рго ес/ог —покровитель). Например, для защиты от коррозии к корпусам морских кораблей прикрепляют цинковые пластины. [c.149]Необратимые коррозионные процессы наносят большой вред народному хозяйству. Потери чугуна, стали вследствие коррозии исчисляются десятками миллионов тонн. Вред коррозии металлов особенно остро ощущается в машиностроении, так как из-за коррозионного разрушения даже одной детали может выйти из строя вся машина. Коррозия снижает точность показаний приборов и стабильность их работы, выводит из строя электрические приборы. Поэтому защита металлов от коррозии в технике, промышленности, сельском хозяйстве приобретает первостепенное значение. [c.403]
Фосфорную кислоту используют для защиты сталей от коррозии. Образующиеся при коррозии ионы Ре" + 1) образуют нерастворимый фосфат железа(П1), [c.481]
К металлическим покрытиям, защищающим сталь от коррозии и наводороживания в различных агрессивных средах, а также в условиях статической водородной усталости, предъявляется комплекс требований, таких, как высокая коррозионная стойкость, низкая водопроницаемость, достаточная пластичность и прочность сцепления с основой, определенный уровень и знак внутренних напряжений, отсутствие наводороживания в процессе нанесения покрытий, технологичность процесса нанесения для защиты конкретного изделия, экономическая целесообразность нанесения покрытия. [c.90]
Одно из условий эффективной защиты стали от коррозии и наводороживания в коррозионно-активных и сероводородсодержащих средах, [c.100]
Ажогин Ф.Ф. Коррозионное растрескивание и защита высокопрочных сталей от коррозии. - М. Металлургия, 1984. - 256 с. [c.153]
Ограничениями в использовании кадмия является его высокая стоимость и дефицитность. В последние годы на ряде производств ограничено применение кадмиевых покрытий (вплоть до полного их исключения) вследствие высокой токсичности соединений кадмия. Поскольку кадмиевые покрытия более стойки в среде, содержащей ионы хлора, кадмирование используют для защиты черных и цветных металлов, соприкасающихся с морской водой, растворами солей. Кадмий более пластичный металл, чем цинк, поэтому кадмирование используется для защиты наиболее ответственных резьбовых изделий. Однако в последнее время все шире используют и цинковые покрытия. В промышленных условиях для создания электрохимической защиты предпочитают цинковые покрытия. Цинкованию подвергают не только готовые изделия, но и стальные листы, ленту. Цинковое покрытие часто применяют для защиты от коррозии водопроводных труб и запасных емкостей. В мягкой воде цинковое покрытие защищает сталь хуже, чем в жесткой. В горячей непроточной воде (свыше 70 °С) цинковое покрытие не обеспечивает надежной защиты стали от коррозии, так как в этих условиях цинк защищает сталь лишь механически. [c.281]
Ингибиторы И-1-В и И-2-В. И-1-В хорошо растворим в воде, спирте, соляной, серной и других сильных кислотах, его рекомендуется применять для защиты черных и цветных металлов от кислотной коррозии [4], в том числе для защиты углеродистых сталей при сернокислотном и солянокислом травлении для защиты коррозии нефтедобывающего оборудования при солянокислой обработке скважин теплосилового оборудования при кислотной промывке. [c.64]
При кислотном травлении ингибитор вводится в травильные растворы в количестве 0,1—0,2%. Он сохраняет эффективность до температуры 90° С. При травлении в открытых ваннах с И-1-В требуется добавление пенообразователя КБЖ или КДЖ в количестве 0,05—0,1%. При солянокислых обработках нефтяных скважин И-1-В вводится в соляную кислоту в количестве 1—1,5%. Для увеличения эффективности защиты стали от коррозии в соляную кислоту наряду с И-1-В рекомендуется добавлять уротропин в количестве 0,05—1%. И-1-В защищает углеродистую сталь в растворах серной кислоты на 95—99%, в 15%-ной соляной кислоте при 50° С — на 99%. При травлении сталей с И-1-В улучшается качество металла, уменьшаются потери металла и кислоты, снижается наводороживание, не тормозится растворение окалины. По своим характеристикам И-1-В лучше, чем ингибитор ЧМ. Применение И-1-В позволяет повысить температуру травления, что увеличивает производительность травильных ванн на 8—12% и продолжительность работы ванн. [c.64]
Афанасьев А. С., Тыр С. Г., Бовина Л. А. Влияние ингибиторов кислотной коррозии на скорость растворения и анодную поляризацию нержавеющих сталей.—Защита металлов, 1974, т. 10, № 5, с. 579—580. [c.173]
В том случае, когда внешний вид покрытия имеет второстепенное значение, для защиты стали от коррозии используют цинковые, алюминиевые и кадмиевые покрытия. Они обладают тем преимуществом, что оказывают протекторную защиту основного металла в случае нарушения покрытия. Однако при удалении покрытия исчезает его защитная функция. Из этого следует, что гальванический ток, протекающий между покрытием и основным металлом, должен быть достаточным для обеспечения защиты основного металла. [c.43]
В условиях приморского влажного субтропического и тропического климата необходимо увеличить толщину покрытия минимум до 30 мкм, так как покрытия толщиной 5- 10 мкм обеспечить необходимую защиту стали от коррозии не могут. [c.94]
Основное применение цинковая пыль находит при изготовлении протекторных грунтовок (на основе синтетических смол, водных растворов силикатов или водно-дисперсных пленкообразующих веществ), применяемых для катодной защиты железа и стали от коррозии. Содержание цинковой пыли в таких грунтовках составляет 95—97% (масс.). [c.67]
Нитрит натрия применяют для защиты от коррозии нелегированной стали, находящейся в контакте с нержавеющей сталью, а также с никелированными и хромированными деталями. Он успешно применяется также для защиты стали от коррозии, возникающей при одновременном воздействии на сталь щелочной воды и местных напряжений, при этом содержание нитрита натрия в воде должно составлять 30—40 % от содержания щелочи. [c.83]
Количество полифосфатов, необходимое для защиты стали от коррозии в воде, зависит от состава, температуры воды и скорости ее движения. В циркулирующих растворах, где полифосфаты все время имеют доступ к поверхности стали, коррозия замедляется [c.88]
При повышении температуры воды содержание бензоата натрия, необходимое для защиты стали от коррозии, возрастает при 5 °С 10", при 25 °С 5-10" и при 40 °С 10 моль/л. При более высоких температурах такой разницы не наблюдается. [c.90]
В проточных системах добавка силиката должна составлять 15—20 мг/л. В водопроводной воде защита стали от коррозии обеспечивается приблизительно при таких же концентрациях ингибитора, причем со временем оно может быть снижено до 4— 8 мг/л. Для защиты от коррозии замкнутых стальных охладительных систем применяют силикаты с модулем 2,4—3,3. [c.92]
Коррозионные испытания показали, что соотношение ингибиторов в смеси и их защитные функции во многом зависят от исходной концентрации ингибитора неокислительного типа. Казалось бы, концентрация ингибитора окислительного типа должна быть тем меньше, чем выше концентрация неокислительного ингибитора. Однако для полной защиты стали от коррозии в присутствии 0,15 г/л пербората натрия требуется столько же нитрита натрия, а при концентрации 1 г/л пербората натрия — 0,2 г/л нитрита натрия. [c.96]
Полностью проявлять свои защитные действия амины начинают приблизительно на 15-е сутки их подачи в систему. Если же подача аминов в систему прекращается, то через 10 сут происходит нарушение пленки. После 15—25 ч перерыва подачи аминов в систему требуется двойной период подачи, для того чтобы пленка полностью восстановилась. После перерыва подачи амина на 2 сут для возобновления пленки требуется 10 сут непрерывной подачи. Таким образом, пленкообразующие амины для защиты стали от коррозии следует подавать в систему непрерывно или с кратковременными перерывами, но при условии, чтобы эти перерывы не происходили ежедневно. Полное прекращение коррозии конденсаторной системы происходит через несколько недель непрерывной подачи в систему амина. [c.97]
Как уже отмечалось, в приморских районах морская вода часто применяется в качестве теплоносителя, особенно для систем охлаждения. Поэтому защита стали от коррозии в морской воде в замкнутых системах является актуальнейшей задачей [16]. Хорошую защиту стали в морской воде как в открытых, так и в закрытых системах обеспечивают неорганические фосфаты в концентрациях более 0,025 моль/л. [c.99]
В настоящее время не существует надежных способов защиты нелегированных хромистых сталей от коррозии в условиях полного погружения. Пассивная пленка не сохраняется даже в быстром потоке. Применение катодной защиты при плотностях тока, необходимых для поляризации, сопровождается выделением водорода, вызывающим водородное вспучивание или растрескивание [33]. [c.64]
Еще одним энергичным активатором коррозии являются сульфаты. Исследованиями [138,139,142] показано, что в присутствии сульфатов практически во всем диапазоне исследованных концентраций растворы с 0,76 г/л и выше гидрооксида кальция надежно обеспечивают защиту стали от коррозии. [c.23]
В середине 70-х годов был предложен комплексный ингибитор, который обеспечивал бы надежную защиту оборудования от коррозии и исключал бы возможность образования и отложения гидратов в стволах скважин и промысловых коммуникациях Оренбургского месторождения — 20 %-ный раствор ингибитора коррозии И-1-А в метаноле [8]. Промысловые испытания на скважине № 204 показали, что комплексный ингибитор обеспечивает 87-92 %-ную защиту стали от коррозии и предотвращает гидратообразование. Ингибитор был принят к внедрению на Оренбургском газоконденсатном месторождении. [c.37]
Стандартный потенциал олова (—0,136 В) положителен по отношению к железу, однако и средах с органическими кислотами олово приобретает более отрицательный потенциал. Поэтому при консерни )01 ании пищевых продуктов, содержащих различные органические кислоты, пок )Ытия оловом электрохимически (анодно) защищают тару из стали от коррозии. Оло-вянирование применяют также для защиты медного кабеля от коррозионного воздействия серы, имеющейся в резиновой изоляции. [c.27]
Медь является электроположительным металлом ( си /си + = 0,337 В), поэтому медные покрытия не обеспечивают электрохимической защиты стали от коррозии. Вследствие большой )азности потенциалов между медью и железом оголенные участки последнего (в порах и непокрытых местах) быстро корродируют. Кроме того, медь нельзя применять как самостоятельное покрытие, так как она покрывается на воздухе слоем основных углекислых солей. Чаще всего медные покрытия используют в качестве подслоя достаточно большой толщины (9—36 мкм) перед покрытиями другими металлами, благодаря чему достигается уменьшение пористости и увеличение коррозионной стойкости, а также экономия дефицитных и дорогих металлов (никель, серебро и др.). [c.31]
Контакт стали с алюминием разблагораживает ее потенциал до менее значительных величин. По данным В.В. Герасимова, алюминиевое покрытие с толщиной 0,3 мм, полученное газопламенным напылением, обеспечивает катодную защиту стали марки ОХ18ШОТ в хлорсодержащих средах. В контакте со сталью скорость коррозии алюминия растет на порядок и близка к измеряемому току пары, равному 19,1 мкА/см . Потенциалы стали, В (по н,в.э),.в центре непокрытого участка в зависимости от его диаметра приведены ниже. [c.85]
Идея защиты железа и стали от коррозии нашла снова повсеместное признание только в 18-м веке [10, 20]. Первые близкие к нашему времени сообщения об окрашивании для защиты от ржавления были опубликованы в Политехническом журнале Динглера в 1822 г. Там предлагалось покрывать стальные детали лаком, смолой или деревянным маслом. В 1847 г. по-видимому уже был известен и основной принцип любой технологии окрашивания тщательная очистка металлической поверхности перед нанесением слоя краски. В 1885 г. было рекомендовано применять грунтовку суриком [10]. В США лаки и краски из каменноугольной смолы использовали для защиты чугуна и стали в судостроении примерно с 1860 г., первоначально только для внутренней поверхности стальных судов. В 1892 г. на наружной поверхности крупного плавучего дока впервые была применена пассивная защита от коррозии. Ворота, шлюзы и затворы плотин на Панамском канале в 1912 г. были окрашены распылением краской на основе каменноугольной смолы. [c.31]
Все это указывает на то, что, хотя водные вытяжки фосфата хрома образуют на поверхности стали пленки, обладающие изолирующими свойствами, сами по себе они не способны защитить сталь от коррозии, но в присутствии ионов Сг04 облегчается оксидная пассивация, что способствует образованию защитных слоев, полностью защищающих металл от коррозии. [c.144]
Отечественной промышленностью выпускаются протекторная грунтовка ЭП-057, представляющая собой суспензию цинкового порошка в растворе эпоксидной смолы Э-41, стабилизированную бентонитом и отверждаемую полиамидным отвердителем № 3. Грунтовка ЭП-057 предназначается для защиты от коррозии стальных поверхностей, эксплуатируемых в атмосферных условиях при повышенной влажности. Хорошие результаты были получены также при испытании этой грунтовки в среде с повышенным содержанием сероводорода. К цинксодержащим материалам относится протекторная грунтовка ПС-084 на основе полистирола из кубового остатка. Установлено, что цинкнапол-ненная краска и стальная подложка образуют бинарную систему сталь —цинкнаполненная краска. Система, сохраняющая защитный потенциал (не ниже —600 мВ), хорошо защищает сталь от коррозии в морской воде. [c.147]
При повышенных температурах дистиллированная вода вызывает коррозию стали, причем часто коррозия имеет локальный характер. Для защиты стали от коррозии в дистиллированной воде, применяемой в качестве теплоносителя, в нее добавляют бихромат калия или его смесь с нитритом и карбонатом натрия (1000 мг/л ЫзаСг О, + 400 мг/л НагСОд или 500 мг/л ЫЭаСГгО + 500 Мг/л ЫаЫОа + 500 Мг/л МЗаСОз). [c.86]
Высоким синергическим эффектом обладают смеси (1 1) НаВОз и ЫаЫОа, НаУОд и NaN02. Надежная защита стали от коррозии обеспечивается при их суммарной концентрации 0,3 г/л. [c.96]
Наилучшая защита стали от коррозии в морской воде динат-рийфосфатом достигается при pH 10, при котором наблюдается максимум концентрации ионов НРО4". Уменьшение защитного действия фосфатов при pH > 10 связано с тем, что при этих pH в основном присутствуют ионы РО4 , адсорбируемость которых ниже, чем НРО4 . [c.100]
Цинк. Хотя ЦИНК используется в основном в виде гальванического покрытия для защиты стали от коррозии в морской атмосфере, интересно исследовать и коррозионное поведение самого цинка. В течение первых лет экспозиции в морской атмосфере коррозия цинка постепенно замедляется, затем происходит с определенной стационарной скоростью. Например, посла 10- и 20-летней экспозиции в Ла-Джолле (Калифорния) стационарная скорость атмосферной коррозии прокатанных образцов составила 1,75 мкм/год [122]. При испытаниях в Ки-Уэсте (Флорида) установившаяся скорость коррозии была еще меньше — 0,56 мкм/год. В табл. 65 представлены результаты коррозионных испытаний, проведенных в четырех разных местах. В слабо агрессивной сельской атмосфере Стейт-Колледжа (Пенсильвания) скорость коррозии цинка оказалась вдвое выше, чем в Ки-Уэсте, но в полтора раза меньше, чем в Ла-Джолле. [c.165]
Стоимость защиты стали от коррозии в морских условиях очень высока, однако нередко эти затраты бывают отчасти излищними. Можно назвать две причины подобной перезащиты . Во-первых, объемный и непривлекательный вид продуктов коррозии, создающий впечатление значительного разрушения металла, хотя действительные скорости коррозии материала при продолжительной эксплуатации известны сравнительно плохо. Скорости коррозии, приводимые в литературе, получены, как правило, в краткосрочных испытаниях и представляют средние значения за весь период экспозиции. Известно, однако, что коррозия углеродистой стали в морских условиях обычно протекает очень быстро в начальный период, а затем выходит на стационарный режим, характеризуемый линейной зависимостью. Этот линейный участок зависимости коррозионных потерь от времени и определяет стационарную скорость коррозии — наиболее важный параметр для оценки срока службы стальной конструкции в морской воде. Во-вторых, чрезмерные защитные меры связаны с плохо изученным влиянием биологической активности среды на скорости коррозии металла. Сплавы на основе железа, по-видимому, в наибольшей степени подверлвоздействию морских организмов среди всех металлов, однако эти биологические факторы практически игнорируются коррозионистами. В классических курсах коррозии влияние биологической активности на коррозионные процессы либо не упоминается совсем, либо считается несущественным и изолированным явлением. [c.441]
Ки-Уэст (Флорида) форма обрастания была в основном совсем другой здесь образцы быстро покрывались толстым слоем растений, главным образом водорослями из рода Еп1еготогр11а. Известковых отложений при обрастании наблюдалось очень мало. Растительное обрастание обеспечивало наиболее эффективную защиту стали от коррозии в начальный период экспозиции, возможно, из-за более быстрого развития [c.449]
Большой интерес представляет изучение поведения ингибиторов, используемых и рекомендованных в настоящее время для защиты углеродистых сталей от коррозии в растворах соляной кислоты при температурах 100—160°С. К таким ингибиторам прежде всего следует отнести смеси уротропина с ПБ-5, катапином, И-1-В и ПКУ-М. Из табл. 4-4 видно, как влияет повышение температуры раствора соляной кислоты от 100 до 140°С на скорость коррозии сталей 20 и 12Х1МФ в присутствии указанных смесей ингибиторов. При температуре 100°С все исследуемые смеси ингибиторов достаточно эффективны и скорость коррозии сталей не превышает 12— 17 т/ ш -ч), однако следует отме- [c.59]
Анализ результатов исследований показывает, что концентрация гидрооксида кальция ниже 1,0 г/л не обеспечивает достаточно эффективной защиты стали от коррозии, а применение раствора с концентрацией более 1,5 г/л нецелесообразно, так как это не приводит к дальнейшему снижению скорости коррозии. При инъектировании гидрооксида кальция концентрацией 1,0 г/л - 1,5 г/л в слабокислые, нейтральные и слабощелочные грунты степень защиты от коррозии составляет 90 - 95%, что соответствует эффекту, достигаемому при катодной или протекторной защите. [c.38]
В результате исследований наводороживания образцов стали 70С2ХА установлено, что высокую защиту стали от коррозии и водородного охрупчивания проявили четвертичные аммониевые основания, содержащие гетероатомы электронно-акцепторного характера, в частности соединения ЧАС-1, ЧАС-9 и ЧАС-14, а также продукт № 3 (на основе диметилгидразина) (табл. 4.1-4.7). [c.353]
chem21.info
Горячее цинковое покрытие: тройная защита от коррозии
Конструкционную сталь широко применяют как эффективный строительный материал, который обеспечивает конструкторам и архитекторам почти неограниченную свободу творчества.
Защита от коррозии
Для зданий и конструкций, которые подвергаются атмосферным воздействиям и другим суровым природным воздействиям, очень важно защитить сталь от коррозии. Часто расчетный срок службы зданий достигает 50-100 лет, что требует прочной и долговечной защиты стальных элементов зданий от коррозии.
Горячее цинковое покрытие – как раз то, что надо для защиты стали от коррозии. Оно обеспечивает три уровня защиты стали от коррозии: барьерную защиту, катодную защиту и защиту цинковой патиной.
Цинковое покрытие: барьерная защита
Первой линией обороны горячего цинкового покрытия является барьерная защита. Аналогично обычным краскам горячее цинковое покрытие обеспечивает защиту простой изоляцией стали от воздействия электролитов из окружающей среды. Пока этот барьер остается невредимым, сталь защищена, и коррозии не происходит. Однако, как только этот барьер повреждается, начинается коррозия.
Чтобы обеспечивать защиту от коррозии, барьер должен оставаться целым и невредимым. Поэтому он должен обладать двумя важными свойствами – прочностью сцепления с основой (сталью) и стойкостью к истиранию. Плотная и непроницаемая природа цинка делает его очень хорошим материалом для барьерного покрытия. В отличие от цинкового покрытия краски подвержены образованию точечных сквозных дефектов типа булавочных уколов. Через эти дефекты приникают элементы, которые вызывают коррозию стали под защитным покрытием.
Цинковое покрытие: катодная защита
В дополнение к барьерной защите горячее цинковое покрытие обеспечивает стали катодную защиту. Это означает, что цинк будет корродировать сам, чтобы защитить лежащий под ним металл. Это происходит в соответствии с так называемым «гальваническим рядом металлов» (см. ниже). Катодная защита стали цинком обеспечивается даже тогда, когда повреждение цинкового покрытия на стали до «голой» стали достигает 5-6 мм: никакой коррозии стали не происходит, пока она не «съест» окружающий цинк.
Гальванический ряд металлов
Гальванический ряд металлов представляет собой последовательность металлов в очередности по убыванию их коррозионных свойств.Чем выше металл в столбце, тем выше его коррозионные свойства и тем менее он «благороден».Чем ниже металл в столбце, тем более стоек он коррозии и тем более он «благороден».
| Анодные металлы, менее благородные |
| Магний Цинк Алюминий Кадмий Сталь Свинец Олово Никель Латунь Бронза медь Никелево-медные сплавы Нержавеющие стали (пассивированные) Серебро Золото Платина |
| Катодные металлы,более благородные |
Эта последовательность металлов определяет, какой металл будет анодом, а какой – катодом, когда они оба будут образовывать электролитическую ячейку. Металл, который находится выше в этом списке, является анодным по отношению к металлу, который находится ниже его. Это означает, что в соединении «верхний» металл будет защищать «нижний» металл от коррозии, подвергаясь ей сам. Поэтому цинк и защищает сталь.
Защита цинковой патиной
Последним рубежом защиты горячего цинкового покрытия является образование цинковой патины. Цинковая патина – это образование на поверхности стали покрытия из продуктов коррозии цинка. Цинк, как и все металлы, при взаимодействии с атмосферой начинает корродировать. Когда цинковое покрытие подвергается воздействию одновременно и влаги, и воздуха, продукты коррозии цинка будут естественным образом формировать на его поверхности покрытие. Образование этих продуктов коррозии – оксида цинка, гидроксида цинка и карбоната цинка – происходит постепенно в течение сухих и влажных периодов эксплуатации.
Полностью сформированная цинковая патина значительно снижает скорость коррозии цинка и действует для горячего цинкового покрытия как дополнительный непроницаемый барьер.
Источник: http://www.galvanizeit.org
steel-guide.ru
Способ защиты стали от коррозии
Изобретение относится к защите от коррозии и может быть использовано для защиты оборудования из сталей при действии агрессивных сред, близких к нейтральным. Способ заключается во введении в рабочую среду комплексного ингибитора, компоненты которого имеют следующие концентрации в среде, мг/дм3: нитрит натрия 100 - 200; полигексаметиленгуанидин фосфат 10 - 15; тетраборат натрия 15-20. При этих концентрациях наблюдаемая скорость коррозии была меньше 0,005 мм/год. Способ прошел опытно-промышленные испытания на оборотной системе станции поверки турбинных счетчиков объемом 54 м3. Способ позволяет получать сталь, имеющую высокие защитные показатели, использовать сравнительно невысокие концентрации реагентов, которые относятся к малотоксичным веществам и оказывают меньшее влияние на окружающую среду. 1 з.п. ф-лы, 2 табл.
Изобретение относится к области защиты от коррозии и конкретно касается защиты оборудования из сталей при действии агрессивных сред, близких к нейтральным, в широком диапазоне гидродинамических условий.
Объектами применения предлагаемого технического решения являются испытательные станции поверки контрольно-измерительных приборов расхода жидкостей, установки по проведению гидравлических испытаний, а также теплоэнергетические водооборотные системы в стояночных режимах [1] и в других случаях. Эффективным методом борьбы с коррозией является воздействие на агрессивную среду путем введения в нее ингибиторов коррозии. В качестве ингибиторов коррозии используют как индивидуальные неорганические соединения, так и их композиции. Из неорганических ингибиторов широкое распространение получили хроматы, вольфрамы, молибдаты, ванадаты щелочных металлов [2]. Однако указанные ингибиторы дороги и содержат высокотоксичные компоненты в виде тяжелых металлов. Для обработки воды используют также фосфаты или другие производные фосфорной кислоты (гидрофосфаты, полифосфаты и т.д.). Способ защиты от коррозии при действии этих ингибиторов обладает следующими недостатками: 1) фосфаты содержат биогенный элемент фосфор, который провоцирует появление биоотложений или биокоррозию; 2) фосфаты оказывают влияние на окружающую среду, воздействуя на экосистемы; 3) фосфаты и другие производные фосфорной кислоты малоэффективны при защите от коррозии в стояночных режимах [1, с. 49]; 4) кроме того, фосфаты при низких концентрациях вызывают опасность проявления питтинговой коррозии и стимулируют коррозию при слишком больших концентрациях [ 1, с. 50]. Применяемые иногда бензоаты также малоэффективны в стояночных режимах [2, с. 66]. Доступным и широкораспространенным способом защиты от коррозии стали является способ, основанный на применении в качестве ингибитора нитрата натрия [1-4] . Однако нитрит натрия обычно используется в высоких концентрациях, т.к. при низких концентрациях он как анодный пассиватор вызывает усиленную питтинговую коррозию. Особенно высокие концентрации нитрата натрия требуются для воды, содержащей ионы хлора и сульфат ионы. Поэтому нитрит натрия часто применяется для антикоррозионной обработки воды и других сред в виде компонента ингибиторных композиций [5]. Наиболее близким к предлагаемому техническим решением является способ защиты от коррозии в системах циркуляционного водопользования, основанный на введении в агрессивную среду комплексного ингибитора на основе нитрата натрия и гексаметилендиамина [6] (прототип). В этом способе количество вводимого ингибитора составляет: нитрит натрия - 1-10 г/дм3, гексаметилендиамина - 0,01 - 1 г/дм3. К недостаткам способа-прототипа можно отнести следующие: 1) высокие расходы реагентов и их высокие концентрации в рабочей среде; 2) применяемый гексаметилендиамин является высокотоксичным веществом для теплокровных животных и человека; 3) компоненты данной ингибиторной системы не препятствуют (а скорее способствуют) появлению биоотложений; 4) при снижении концентрации нитрита натрия в среде может возникнуть язвенная коррозия, протекающая с высокой скоростью. Цель предлагаемого изобретения - разработка способа защиты стали от коррозии, имеющего высокие защитные показатели, сравнительно невысокие концентрации реагентов, которые относятся к малотоксичным веществам и оказывают меньшее влияние на окружающую среду. Поставленная цель достигается путем введения в рабочую агрессивную среду ингибиторной композиции, компоненты которой имеют следующие концентрации в среде: нитрит натрия 100-200 мг/дм3; полигексаметиленгуанидин фосфат (ПГМГ 10-15 мг/дм3; тетраборат натрия (бура) 15-20 мг/дм3. В этом комплексном ингибиторе нитрит натрия выступает в качестве анодного пассиватора. ПГМГ - для торможения катодного процесса, а тетраборат натрия - в качестве буфера для поддержания pH на уровне 8,0 - 9,0. Применяемые по литературным данным рабочие концентрации нитрита натрия существенно выше (особенно в присутствии хлорид- и сульфатионов). Известно также применение ПГМГ в качестве ингибитора коррозии [7]. Однако ингибирующие концентрации ПГМГ (по полимеру) составляют 25-50 мг/дм3 [7], что также существенно выше предлагаемых рабочих концентраций. Из литературы известно, что если используются оба типа ингибиторов (замедляющие анодные и катодные процессы), то при концентрации анодного ингибитора, не обеспечивающей полной пассивации металла, наблюдается увеличение интенсивности коррозии [2, с. 96] . В предлагаемом способе защиты наблюдается усиление каждым компонентом действия другого, то есть наличие ингибирующего эффекта при концентрациях реагентов, не обеспечивающих отдельно анодную или катодную пассивацию. Достоинствами предлагаемого способа защиты стали от коррозии являются: 1. Концентрации реагентов и их расходы ниже обычно применяемых в таких случаях. 2. Все три компонента ингибиторной композиции относятся к малотоксичным веществам (по отношению к человеку и высшим животным). 3. ПГМГ используется в других направлениях в качестве биоцида, поэтому данная система препятствует проявлению биообрастаний. 4. Поскольку реагенты применяются в меньших концентрациях, то слив рабочей среды из соответствующей установки будет оказывать меньшее влияние на экологию. 5. ПГМГ, являясь водорастворимым полимером, обладает моющим и флокулирующим действием, поэтому наличие в среде взвешенных частиц (например, продуктов коррозии) способствует очистке воды, что особенно важно при работе станций поверки контрольно-измерительных приборов. 6. Предлагаемый способ позволяет защищать не только отдельно углеродистую сталь, но и при контакте ее с нержавеющей. 7. Компоненты ингибиторной композиции доступны, выпускаются отечественной промышленностью. 8. Уменьшение концентрации нитрита натрия и ПГМГ ниже рекомендуемых пределов не влечет за собой резкого увеличения скорости коррозии. Реализация предлагаемого способа защиты от коррозии осуществлена в лабораторных условиях и в опытно-промышленном масштабе для защиты оборудования станции по поверке турбинных счетчиков, имеющей объем системы 54 м3. Лабораторные эксперименты осуществлены с использованием метода гравиметрии при проведении процесса коррозии в стояночных условиях. Образцы из Ст. 10 размером 50х20х1,5 мм, отшлифованные и обезжиренные промывкой толуолом и этанолом, подвешивали в стакане, содержащем агрессивную среду, на 320 ч. В качестве агрессивной среды использована водопроводная вода с общей минерализацией в (пересчете на NaCl) 75 мг/дм3, pH исходной воды 7,7, жесткость (Ca2+) 60 мг/дм3, начальное содержание хлоридов 5 мг/дм3, сульфатов - 7 мг/дм3. Содержание хлоридов и сульфатов в некоторых примерах было увеличено путем добавления в рабочую среду соответствующего количества хлорида или сульфата натрия. Полученные результаты по данному способу защиты от коррозии путем введения компонентов ингибиторной композиции в агрессивную среду приведены в табл. 1. Как видно из данных табл. 1, ингибиторная система при концентрации компонентов в указанных пределах обеспечивает защиту, уменьшая скорость коррозии до величины меньше 0,005 мм/год. Увеличение концентрации компонентов выше указанных пределов не дает существенного уменьшения скорости и нецелесообразно с точки зрения расхода реагентов. Уменьшение концентрации реагентов ниже 100 мг/дм3 для нитрита натрия, 15 мг/дм3 для буры и 10 мг/дм3 для ПГМГ приводит к существенному увеличению скорости коррозии (но не выше, чем скорость в отсутствие ингибиторов). Опытно-промышленные испытания на станции поверки турбинных счетчиков проведены путем визуального наблюдения за системой и с помощью метода гравиметрии с использованием контрольных образцов из Ст 10 (50х20х1,5), обработанных как указано выше. После заполнения системы водопроводной водой (солесодержание 55 мг/дм3, pH 7,5, жесткость 28 мг/дм3, хлориды 12,2 мг/дм3, сульфаты 9,1 мг/дм3) в бассейн было введено 7 кг нитрита натрия, 0,9 кг буры и 3 кг 20%-ного водного раствора ПГМГ (товарная форма). Расчетная концентрация реагента: NaNO2 131 мг/дм3; Na2B4O7 17 мг/дм3; ПГМГ 14 мг/дм3. После прокачки системы (для перемешивания) в бассейн опускали контрольные образцы, которые последовательно вынимали, и на них определяли скорость коррозии гравиметрическим методом. В ходе проведения испытаний станция работала периодически, так что образцы большую часть времени подвергались стояночной коррозии. Получены следующие данные по коррозии образцов (см. табл. 2). Из этих результатов следует, что образцы подвергались коррозии в первые сутки экспозиции, затем скорость коррозии существенно падает. Визуальный осмотр бассейна с водой и доступных трубопроводов станции после испытаний показал отсутствие на них биоотложений. Продукты коррозии не обнаружены, включая места контакта обыкновенной стали и легированной. Таким образом, предложен способ защиты стали от коррозии с применением ингибиторной композиции, имеющий высокую эффективность защиты и дающий экономию реагентов. Источники информации 1. П.А.Акользин. Предупреждение коррозии оборудования технического водо- и теплоснабжения.- М.: Металлургия, 1988, 95 с. 2. И. Л.Розенфельд. Ингибиторы коррозии.- М.: Химия, 1977, с. 157 и далее. 3. Ю.Н.Шехтер. Защита металлов от коррозии.- М. - Л.:Химия, 1964, с. 16. 4. Коррозия под действием теплоносителей, хладагентов и рабочих тел. Под ред. А.М.Сухотина.- Л.: Химия, 1988, с. 82 и далее. 5. А. И.Алцыбеева, С.З.Левин. Ингибиторы коррозии металлов.- Л.: Химия, 1968, с. 112 и далее. 6. В. В.Цветков и др. Ингибирование коррозии металлов систем рециркулирующего водопользования. Химико-фармацевтический журнал, 1994, N 5, с. 50. 7. А.В.Уфимцев, В.П.Томин и др. Решение о выдаче патента РФ по заявке N 94025102. Применение полигексаметиленгуанидин фосфата в качестве ингибитора коррозии.Формула изобретения
1. Способ защиты стали от коррозии, включающий введение в агрессивную среду ингибиторной композиции на основе нитрита натрия и азотсодержащего органического соединения, отличающийся тем, что в качестве азотсодержащего органического соединения используют полигексаметиленгуанидин фосфат и дополнительно в среду вводят тетраборат натрия. 2. Способ по п.1, отличающийся тем, что компоненты ингибиторной композиции вводят в следующих концентрациях, мг/дм3: Нитрат натрия - 100 - 200 Полигексаметиленгуанидин фосфат - 10 - 15 Тетраборат натрия - 15 - 208РИСУНКИ
Рисунок 1www.findpatent.ru
Способ защиты низкоуглеродистой стали от коррозии
Изобретение относится к способам защиты низкоуглеродистой стали от коррозии в нейтральных водных средах с помощью ингибиторов, добавляемых к коррозионным средам, в частности, с помощью цинк-фосфонатного ингибитора, содержащего 1-гидроксиэтан-1,1-дифосфоновую кислоту и растворимую соль цинка. Способ включает предварительную анодную поляризацию защищамого изделия. При этом на поверхности изделия образуются ионы железа, которые необходимы для образования на поверхности защитной пленки, состоящей из не растворимых в воде соединений железа, цинка и 1-гидроксиэтан-1,1-дифосфоновой кислоты. Предварительная анодная поляризация может производиться в эксплуатационной среде, но предпочтительнее производить ее во вспомогательном растворе, содержащем кроме цинк-фосфонатного ингибитора также проводящие соли и восстановитель. Технический результат - повышение степени защиты стали от коррозии до 98,2%. 3 з.п. ф-лы, 1 табл.
Изобретение относится к способам защиты низкоуглеродистой стали от коррозии в нейтральных водных средах с помощью ингибиторов, добавляемых к коррозионным средам.
Оно может быть использовано для защиты от коррозии элементов водных охлаждающих систем, например теплообменников, в частности для защиты от коррозии узлов и деталей испытательных камер, работающих в дистиллированной воде.
Эффективная защита стали от коррозии в нейтральных водных средах достигается в случае применения в качестве ингибитора коррозии 1-гидроксиэтан-1,1-дифосфоновой кислоты в композиции с растворимыми солями некоторых металлов, чаще всего цинка. Название “1-гидроксиэтан-1,1-дифосфоновая кислота” для вещества СН3С(ОН)(РО3Н2)2 дано в соответствии с Номенклатурными правилами ИЮПАК по химии [1] и эквивалентно названиям “1-гидроксиэтилидендифосфоновая кислота”, “оксиэтилидендифосфоновая кислота”, “ОЭДФ”, употребляемым в отечественной и зарубежной патентной и технической литературе.
Известен способ защиты стали от коррозии с помощью композиции, в которую входит водорастворимое соединение цинка, фосфорорганическая кислота общей формулы RРО(ОН)2 (в том числе и 1-гидроксиэтан-1,1-дифосфоновая кислота) и другие соединения [2].
Известен также способ ингибирования коррозии стали с использованием композиции, имеющей в своем составе 1-гидроксиэтан-1,1-дифосфоновую кислоту либо ее соли со щелочными, щелочно-земельными металлами, а также с цинком и некоторыми другими металлами [3].
Известен ингибитор для защиты стали от коррозии, содержащий в качестве активных компонентов 1-гидроксиэтан-1,1-дифосфоновую кислоту, фосфонкарбоновые кислоты и водорастворимую соль цинка [4].
Наиболее близким к изобретению по составу и технической сущности является способ, предложенный в [5], который выбран в качестве прототипа. Этот способ заключается во введении в водную среду при рН 7,00,1 ингибитора, представляющего собой комбинацию 1-гидроксиэтан-1,1-дифосфоновой кислоты и ионов цинка с общей концентрацией 100 мг/л, причем наибольшее защитное действие наблюдается, если концентрация 1-гидроксиэтан-1,1-дифосфоновой кислоты составляет 60 мг/л, а концентрация ионов цинка - 40 мг/л.
Согласно современным представлениям защитное действие комплекса цинка с 1-гидроксиэтан-1,1-дифосфоновой кислотой объясняется образованием на поверхности защищаемого изделия в начальный период его эксплуатации защитной пленки, состоящей из не растворимых в воде соединений цинка и железа с 1-гидроксиэтан-1,1-дифосфоновой кислотой [6, 7].
Образование таких соединений происходит при контакте цинк-фосфонатного ингибитора с поверхностью защищаемого изделия, где он взаимодействует с ионами железа, образуя защитную пленку. Скорость образования защитной пленки зависит как от скорости подвода ингибитора к поверхности изделия, так и от скорости образования у поверхности ионов железа. Для увеличения скорости подвода ингибитора к поверхности защищаемого изделия применяется механическое перемешивание, например, путем циркуляции водной среды, содержащей ингибитор.
Недостатком известных способов, в том числе и по прототипу, является недостаточное защитное действие цинк-фосфонатного ингибитора, так как скорость образования ионов железа является нерегулируемой, поскольку определяется самопроизвольно протекающим процессом коррозии железа (низкоуглеродистой стали).
Введение ионов железа в водную среду извне нежелательно и не применяется на практике, так как в этом случае нерастворимые соли образуются в объеме рабочей среды, а не на поверхности защищаемого изделия, кроме того, избыток ионов железа вредно влияет на эффективность защиты [8].
При создании предполагаемого изобретения ставилась задача повышения защитного действия цинк-фосфонатного ингибитора, содержащего 1-гидроксиэтан-1,1-дифосфоновую кислоту и растворимую соль цинка, в нейтральной среде путем увеличения скорости образования защитной пленки и повышения ее защитных свойств.
Согласно изобретению поставленная цель достигается тем, что защита изделий из низкоуглеродистой стали от коррозии в нейтральной водной среде осуществляется с помощью цинк-фосфонатного ингибитора, содержащего 1-гидроксиэтан-1,1-дифосфоновую кислоту и растворимую соль цинка. Новым в этом способе является то, что защищаемое изделие подвергают предварительной анодной поляризации. Предпочтительнее производить предварительную анодную поляризацию не в эксплуатационной среде, а во вспомогательном растворе, после чего изделие помещают в эксплуатационную среду. Необходимо, чтобы вспомогательный раствор содержал 1-гидроксиэтан-1,1-дифосфоновую кислоту, сульфат цинка, сульфат натрия, калия или магния и восстановитель при следующем содержании компонентов:
1-Гидроксиэтан-1,1-
дифосфоновая кислота (1-3)·10-3 моль/л
Сульфат цинка (1-3)·10-3 моль/л
Сульфат натрия, калия
или магния (0-5)·10-2 моль/л
Восстановитель 0-5 г/л
Желательно, чтобы вспомогательный раствор вместо 1-гидроксиэтан-1,1-дифосфоновой кислоты и сульфата цинка содержал комплекс цинка с 1-гидроксиэтан-1,1-дифосфоновой кислотой, а также сульфат натрия, калия или магния и восстановитель при следующем содержании компонентов:
Комплекс цинка с
1-гидроксиэтан-
1,1-дифосфоновой
кислотой (3-5)·10-3 моль/л
Сульфат натрия, калия
или магния (0-5)·10-2 моль/л
Восстановитель 0-5 г/л
Предварительная анодная поляризация заключается в том, что защищаемое изделие до начала его практической эксплуатации в нейтральной водной среде, содержащей цинк-фосфонатный ингибитор, подключают к положительному полюсу источника постоянного тока (аноду) и пропускают ток при определенных значениях анодной плотности тока и длительности электролиза.
В процессе предварительной анодной поляризации вследствие электрохимического растворения стали у поверхности защищаемого изделия образуются ионы железа, которые необходимы для образования на поверхности защитной пленки, состоящей из не растворимых в воде соединений железа, цинка и 1-гидроксиэтан-1,1-дифосфоновой кислоты [7]. Предварительная анодная поляризация увеличивает скорость образования защитной пленки и улучшает ее защитные свойства. Вследствие этого увеличивается защитное действие цинк-фосфонатного ингибитора.
Близкое к нейтральному значение рН водной среды обеспечивает устойчивость пленки к саморастворению, которое возможно в кислых и щелочных растворах. Таким образом, за пределами нейтрального диапазона значений рН водной среды (6,0-8,0) эффективность использования изобретения уменьшается.
Для проведения процесса анодной поляризации изделие, помещенное в соответствующий раствор, подключают к положительному полюсу источника тока (анод), а к отрицательному полюсу источника тока (катод) подключают помещенный в ту же среду второй вспомогательный электрод из материала, нерастворимого в данных условиях.
В качестве источника тока может быть использован любой источник постоянного тока (выпрямитель, батарея элементов, аккумулятор), обеспечивающий необходимую силу тока. В качестве материала катода рекомендуется использовать платинированный титан или графит. Для измерения и регулирования силы тока в цепи подключают также амперметр и реостат соответствующих параметров.
Сила тока, необходимая для проведения процесса предварительной анодной поляризации, определяется по уравнению:
I=D·S,
где I - сила тока, А;
D - плотность тока анодной поляризации, А/дм2;
S - площадь поверхности изделия, дм2.
Рекомендуемая анодная плотность тока составляет 0,001-0,1 А/дм2.
В процессе анодной поляризации раствор необходимо перемешивать любым механическим способом (циркуляцией, механической мешалкой). После окончания процесса анодной поляризации ток отключают, вспомогательный электрод (катод) извлекают из раствора.
Дальнейшее улучшение способа защиты стали от коррозии можно обеспечить, если проводить анодную поляризацию не в эксплуатационной водной среде, а в специально приготовленном вспомогательном растворе.
Это позволяет получить следующие преимущества в использовании изобретения:
1) исключить попадание ионов железа в эксплуатационную среду;
2) использовать оптимальный состав вспомогательного раствора за счет введения в него дополнительных компонентов и поддержания оптимального значения рН 7,00,1;
3) не снижать концентрацию ингибитора в эксплуатационной среде, поскольку он расходуется на образование защитной пленки.
Для этого в состав вспомогательного раствора, содержащего 1-гидроксиэтан-1,1-дифосфоновую кислоту и растворимую соль цинка, дополнительно вводят сульфаты натрия, калия или магния, которые повышают электропроводность раствора, что позволяет применять более высокую плотность тока при анодной поляризации и тем самым сократить длительность процесса, а также повысить равномерность распределения тока по поверхности изделия и, следовательно, равномерность толщины защитной пленки.
Целесообразно также ввести в состав вспомогательного раствора восстановитель, например сульфит натрия или гидразин-сульфат, для предотвращения окисления ионов железа (II), образующихся при анодной поляризации, в ионы железа (III), которые не участвуют в формировании защитной пленки.
Рекомендуемый для применения вспомогательный раствор для анодной поляризации содержит следующие компоненты:
1-Гидроксиэтан-1,1-дифос-
фоновая кислота (1-3)·10-3 моль/л
Сульфат цинка (1-3)·10-3 моль/л
Сульфат натрия, калия
или магния (0-5)·10-2 моль/л
Восстановитель 0-5 г/л
pH 7,01,0
Можно также использовать вспомогательный раствор для анодной поляризации, содержащий следующие компоненты:
Комплекс цинка с 1-
гдроксиэтан-1,1
-дифосфоновой кислотой (1-3)·10-3 моль/л
Сульфат натрия,
калия или магния (0-5)·10-3 моль/л
Восстановитель 0-5 г/л
pH 7,01,0
Примеры использования изобретения
Пример 1 (по прототипу)
Пластину из низкоуглеродистой стали Ст10 размером 50501 мм зачищают и полируют наждачной шкуркой, обезжиривают по ГОСТ 9.305-84, промывают горячей, затем холодной водой и, наконец, дистиллированной водой, высушивают струей горячего сжатого воздуха, взвешивают на аналитических весах с точностью 0,0001 г и помещают в эксикатор.
В стеклянном стакане емкостью 1 л готовят испытательный раствор следующего состава (г/л):
Хлорид натрия 3,0
1-Гидроксиэтан-1,1-
дифосфоновая кислота 0,06
Цинка сульфат гептагидрат 0,18
рН 7,0
Пластину извлекают из эксикатора, погружают в испытательный раствор и выдерживают в нем 8 ч при температуре 20±2°С. В течение указанного времени испытательный раствор перемешивают с помощью магнитной мешалки. Через 8 ч пластину извлекают из раствора, очищают от продуктов коррозии с помощью волосяной щетки, промывают дистиллированной водой, высушивают струей горячего сжатого воздуха и взвешивают на аналитических весах с точностью ±0,0001 г.
Скорость коррозии определяют по потере массы пластины, выраженной в г/м2·сут. Скорость коррозии стали в указанных условиях составляет 0,38 г/м2·сут (среднее значение из 5 опытов). Степень защиты от коррозии определяют по формуле
C.З.=(V1-V2)/V1·100%,
где С.З. - степень защиты;
V1 - скорость коррозии без ингибитора;
V2 - скорость коррозии в присутствии ингибитора.
Для определения степени защиты предварительно определяют скорость коррозии V1 в растворе, не содержащем ингибитора, следующего состава:
Хлорид натрия 3,0 г/л
рН 7,0
Определенная описанным выше методом скорость коррозии V1 составляет 3,28 г/см2·сут. Таким образом, степень защиты по прототипу составляет
С.З.=(3,28-0,38)/3,28·100%=88,4%.
Пример 2 (предварительная анодная поляризация в испытательном растворе)
Пластинку из стали и испытательный раствор готовят в соответствие с примером 1.
Для предварительной анодной поляризации в стакан с испытательным раствором погружают пластину из стали и второй (вспомогательный) электрод из графита в виде стержня диаметром 5 мм и длиной 150 мм. Пластину подключают к положительному полюсу выпрямителя, графитовый стержень - к отрицательному. Затем включают ток и с помощью реостата и амперметра устанавливают ток в цепи, равный 0,0005 А. Плотность тока на пластине (анодная плотность тока) при такой силе тока составляет 0,001 А/дм2. Анодную поляризацию проводят в течение 100 мин. Затем ток отключают, графитовый стержень извлекают из раствора, а пластину из стали, подвергнутую предварительной анодной поляризации, выдерживают в растворе при температуре 202С в течение 8 ч при постоянном перемешивании раствора с помощью магнитной мешалки. Через 8 ч пластину извлекают из раствора и обрабатывают в соответствии с примером 1.
Скорость коррозии стали в указанных условиях составляет
0,246 г/м·сут, что соответствует степени защиты 92,5%.
С.З.=(3,28-0,246)/3,28·100%=92,5%.
Пример 3 (предварительная анодная поляризация во вспомогательном растворе)
Пластину из стали и испытательный раствор готовят в соответствии с примером 1.
В стакане емкостью 1 л готовят 500 мл вспомогательного раствора В-1 следующего состава:
Вспомогательный раствор В-1
1-Гидроксиэтан-1,1
-дифосфоновая кислота 3·10-3 моль/л
Сульфат цинка 3·10-3 моль/л
Сульфат натрия 5·10-2 моль/л
Гидразинсульфат 0,5 г/л
В стакан со вспомогательным раствором В-1 при комнатной температуре помещают пластину из стали и второй (вспомогательный) электрод из графита в виде стержня диаметром 5 мм и длиной 150 мм. Пластину подключают к положительному полюсу выпрямителя, графитовый стержень - к отрицательному. Затем включают ток и с помощью реостата и амперметра устанавливают ток в цепи, равный 0,005 А. Плотность тока на пластине (анодная плотность тока) при этой силе тока составляет 0,01 А/дм2. Анодную поляризацию проводят в течение 20 мин. Затем ток отключают, графитовый стержень и пластину извлекают из вспомогательного раствора. Пластину из стали, подвергнутую предварительной анодной поляризации, тщательно промывают дистиллированной водой и, не высушивая, погружают в стакан с испытательным раствором и выдерживают в нем 24 ч при температуре 202С.
В течение указанного времени испытательный раствор перемешивают с помощью магнитной мешалки. Выдержку 24 ч проводят в 3 цикла по 8 ч каждый, с промежуточной промывкой пластин в дистиллированной воде, высушиванием и хранением в эксикаторе. Через 24 ч пластину извлекают из раствора и обрабатывают в соответствии с примером 1.
Скорость коррозии стали в указанных условиях составляет 0,115 г/м2·сутки, что соответствует степени защиты 96,5%.
С.З.-(3,28-0,115)/3,28·100%=96,5%
Пример 4 (предварительная анодная поляризация во вспомогательном растворе)
Пластину из стали и испытательный раствор готовят в соответствии с примером 1.
В стакане емкостью 1 л готовят 500 мл вспомогательного раствора В-2 следующего состава:
Вспомогательный раствор В-2
Комплекс цинка с
1-гидроксиэтан-1,1
-дифосфоновой кислотой 3·10-3 моль/л
Сульфат натрия 5·10-3 моль/л
Гидразинсульфат 0,5 г/л
Предварительную анодную поляризацию и испытания проводят согласно примеру 3.
Скорость коррозии стали в указанных условиях составляет 0,115 г/м2·сут, что соответствует степени защиты 96,5%.
Таким образом, использование предварительной анодной поляризации изделий из низкоуглеродистой стали, эксплуатируемых в нейтральной водной среде, содержащей цинк-фосфонатный ингибитор, по предлагаемому изобретению позволяет повысить защитные свойства ингибитора более чем в 3 раза (см. таблицу).
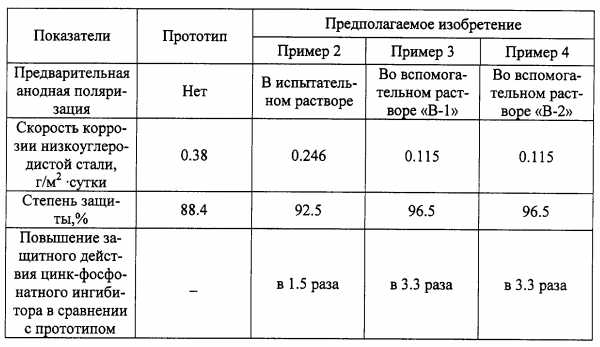
При оптимальных режимах предварительной анодной поляризации получена минимальная скорость коррозии 0,06 г/см2·сут, что соответствует степени защиты 98,2%. Таким образом, защитное действие цинк-фосфонатного ингибитора по предполагаемому изобретению повышено в 6,3 раза и приближается к полной защите низкоуглеродистой стали от коррозии.
Источники информации
1. Номенклатурные правила ИЮПАК по химии. М.: ВИНИТИ, 1979-1985.
2. Патент США №4663053, МПК С 02 F 5/14, опубл. 1987.
3. Патент США №4649025, МПК С 23 F11/16, опубл. 1987.
4. Заявка Японии №62-96683, МПК С 23 F 11/167, С 02 F 5/14, опубл. 1987.
5. Sekine I., Hirakawa Y. Effect of 1-Hydroxyethylidene-1,1-diphosphonic Acid on the Corrosion of SS 41 Steel in 0,3% Sodium Chloride Solution. //Corrosion, 1986, v. 42, №5, p. 272.
6. Кузнецов Ю.И., Раскольников А.Ф. Роль природы лиганда в ингибировании коррозии металлов фосфонатами. //Защита металлов, 1992, т. 28, №5, с. 707.
7. Кузнецов Ю.И., Раскольников А.Ф. Влияние сульфита натрия на защитные свойства цинк-фосфонатного ингибитора. //Защита металлов. 1993, т. 29, №1. с. 73.
8. Терехин С.Н., Маклакова В.П., Бихман Б.И., Дятлова Н.М., Кунянский В.М., Тыкман Г.М. Комплексонная стабилизация водоохлаждающих систем. //Защита металлов, 1990, т. 26, №5, с. 805.
Формула изобретения
1. Способ защиты низкоуглеродистой стали от коррозии в нейтральной водной среде с помощью цинк-фосфонатного ингибитора, содержащего 1-гидроксиэтан-1,1-дифосфоновую кислоту и растворимую соль цинка, отличающийся тем, что защищаемое изделие подвергают предварительной анодной поляризации.
2. Способ по п.1, отличающийся тем, что предварительную анодную поляризацию производят во вспомогательном растворе, после чего изделие помещают в эксплуатационную среду.
3. Способ по п.2, отличающийся тем, что вспомогательный раствор содержит 1-гидроксиэтан-1,1-дифосфоновую кислоту, сульфат цинка, сульфат натрия, калия или магния и восстановитель при следующем содержании компонентов, моль/л:
1-Гидроксиэтан-1,1-
дифосфоновая кислота (1-3)10-3
Сульфат цинка (1-3 )10-3
Сульфат натрия, калия
или магния (0-5)10-2
Восстановитель, г/л 0-5
4. Способ по п.2, отличающийся тем, что вспомогательный раствор содержит комплекс цинка с 1-гидроксиэтан-1,1-дифосфоновой кислотой, сульфат натрия, калия или магния и восстановитель при следующем содержании компонентов, моль/л:
Комплекс цинка с 1-
гидроксиэтан-1,1
-дифосфоновой кислотой (3-5)10-3
Сульфат натрия, калия
или магния (0-5)10-2
Восстановитель, г/л 0-5
www.findpatent.ru