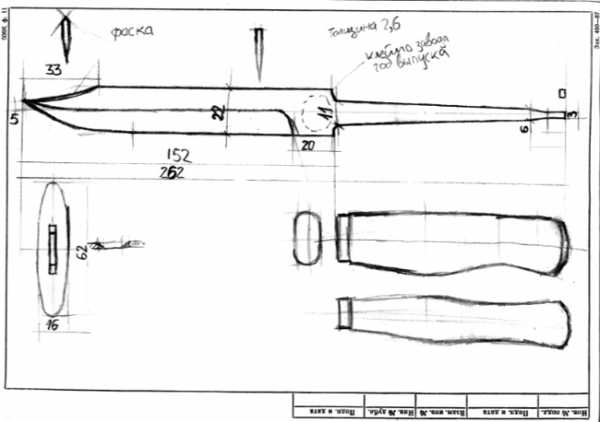
Большая Энциклопедия Нефти и Газа. Как окислить медь
Как состарить медь » Белисп

Для вас понадобится
- Медное изделие,
- нашатырный спирт,
- среднезернистая пилочка либо тонкодисперсная наждачка,
- крышка от стеклянной банки,
- колпачок от бутылки,
- блюдце,
- пластмассовый либо стеклянный контейнер.
Чтоб стремительно состарить медь, нужно обработать ее особым образом. Зависимо от размера изделия, для вас может понадобиться среднезернистая стеклянная пилочка либо тонкодисперсная наждачка. Обработайте новое медное изделие наждачкой либо пилочкой. Если вы обрабатываете фурнитуру для производства бижутерии, возьмите пилочку и обработайте медь по всей поверхности так, чтоб она смотрелась поцарапанной, но не была шершавой. Если фурнитура будет шершавой, она будет цепляться за одежку. Если речь входит о более огромных медных изделиях, обрабатывайте не всю поверхность идиентично. Больше всего обработайте наждачкой выступающие, острые места, также углубления и маленькие детали. Но, пытайтесь не оставлять совсем необработанных наждачкой мест.
Позже, чтоб стремительно состарить медь, нужно достигнуть ее окисления. Чтоб окислить медные изделия, для вас будет нужно аммиак. В чистом виде он не встречается, но всегда может быть приобрести нашатырный спирт, который есть веществом аммиака в воде. Приобрести нашатырный спирт может быть в хоть какой аптеке. Позже необходимо найти пластиковую либо стеклянную тару, сопоставимую с размерами обрабатываемого медного изделия. Возьмите эту тару и положите (поставьте) туда медное изделие, которое вы желаете состарить. Возьмите колпачок от бутылки, если вы желаете состарить фурнитуру либо другой небольшой медный предмет, и налейте туда нашатырный спирт. Если же вы обрабатываете более огромное изделие, возьмите блюдце либо крышку от малеханькой стеклянной банки, и налейте нашатырный спирт туда. Поставьте колпачок либо посуду с нашатырным спиртом в ту же тару, где стоит либо лежит медное изделие. Закройте отлично крышку и ждите. Через некое время вы увидите, что медь потемнела, и уже не смотрится новейшей.
Патинирование медных монет
belisp.ru
Скорость - окисление - медь
Скорость - окисление - медь
Cтраница 1
Скорость окисления меди при 800 С в атмосфере кислорода с примесью паров воды не зависит от их содержания в газовой среде, если оно не превышает-3 9 % [210], хотя, как сообщалось [165], скорость окисления во влажном воздухе была меньше, чем в сухом. Подобным же образом слабо изменялась и скорость окисления при 400 С многочисленных медных сплавов с переходом от сухого воздуха к атмосфере, содержавшей 10 % влаги. [1]
Скорость окисления меди кислородом растет с увеличением поверхности соприкосновения реагирующих фаз и записи. [2]
Скорость окисления меди понижается при ее легировании алюминием, бериллием, оловом и цинком. Высокой жаростойкостью обладают сплавы никеля с хромом-нихромы. [4]
Скорость окисления меди пропорциональна площади поверхности меди. [6]
На рис. 175 показано увеличение скорости окисления меди в воздухе и кислороде с ростом температуры. [8]
При температурах 400 С и выше скорость окисления меди подчиняется параболической зависимости. [9]
Примеси и добавки резко влияют на скорость окисления меди. [11]
Результаты, полученные различными авторами [265] при исследовании скорости окисления меди, хорошо согласуются между собой, поскольку для таких опытов обычно пользуются медью довольно высокой степени чистоты. Однако наиболее важное воздействие фосфора заключается в понижении прочности сцепления пленки окислов меди с самим металлом, что имеет большое значение при обработке этого металла и сплавов на его основе. [12]
Как влияет увеличение поверхности меди в натравочной башне на скорость окисления меди. [13]
Как влияет увеличение поверхности меди в натравочной башне на скорость окисления меди. [14]
В присутствии мышьяка, церия, хрома и марганца скорость окисления меди значительно возрастает. На рис. 23 показано влияние различных добавок на скорость окисления меди при температуре 800 С. [15]
Страницы: 1 2 3
www.ngpedia.ru
Окисление - медь - Большая Энциклопедия Нефти и Газа, статья, страница 4
Окисление - медь
Cтраница 4
Последнюю получают окислением меди воздухом в солянокислой среде и осаждением хлорной меди из раствора мелом. Сгущенную пульпу хлорокиси меди фильтруют на вакуум-фильтре, высушивают и размалывают. Будучи соединением основного характера, хлорокись меди не требует добавки извести, что значительно упрощает применение этого препарата по сравнению с медным купоросом. [46]
Основным недостатком является окисление меди при температурах более 453 15 К ( 180 С), что ограничивает верхний предел шкалы термометра с датчиком ТСМ. [48]
Как известно, окисление меди в обычных условиях протекает весьма интенсивно. Это окисление имеет место не только по поверхности меди, но и по границам кристаллов. Установлено, что проникновение кислорода в медь при нагреве ее в окислительных условиях зависит от температуры. Так как толщина меди в непосредственной близости к спаю обычно не превышает нескольких десятых долей миллиметра, то межкристаллитное окисление означает, что медь окажется насквозь пронизанной прожилками закиси меди. Поэтому желательно избегать нагрева меди в восстановительной среде. [49]
Соответствующие уравнения для окисления меди до закиси уже были приведены нами ранее, и в этом случае скорость окисления должна быть пропорциональна корню восьмой степени из величины давления кислорода, причем по экспериментальным данным Вагнера и Грюнвальда была выявлена пропорциональность приблизительно корню седьмой степени. [50]
Расход воздуха на окисление меди составляет примерно 1000 м3 на 1 т медного купороса. Содержащиеся ъ медных гранулах примеси железа, алюминия и др. также реагируют с серной кислотой, образуя преимущественно растворимые в ней сульфаты, постепенно накапливающиеся в циркулирующем растворе медного купороса. [51]
Как изменяется степень окисления меди в этой реакции. [52]
Интересные эксперименты по окислению меди [4] указывают на важноД - различие между термодинамическими и кинетическими факторами. [53]
Существенным отличием между окислением меди в кислороде и в водном растворе CuSO4 является ориентировка плоскости с большими индексами СигО, повернутой на угол 2 - 4 относительно грани ( 111) Ct O ( 001) Си. Экспериментальные условия появления нормальной и аномальной ориентации приблизительно одинаковы, так что даже при окислении одного и того же кристалла при одинаковых контролируемых условиях возможно образование окисла с любой из двух ориентации. Удовлетворительного объяснения аномальной ориентации еще не найдено. [54]
Последние образовывались при окислении меди в составе ЭЙ кислородом. [56]
Определение основано на окислении меди ( кислородом, содержащимся в анализируемом газе. Полученный окрашенный раствор сравнивают с эталонными растворами сульфата меди разных концентраций в 4 % - ном растворе аммиака. [57]
В присутствии воды вызывает окисление меди и ее сплавов, за исключением фосфористой бронзы. Аммиак горюч, а при содержании в воздухе от 13 1 до 26 8 % ( по объему) взрывоопасен. Аммиак легче воздуха и хорошо растворяется в воде, незначительно в технических маслах. [58]
Воздух, необходимый для окисления меди, с помощью инжектора 6 подают в башню под колосниковую решетку. Отработанный воздух из башни отводят через вытяжное отверстие 8 и фаолитовую трубу. Башня оборудована тремя инжекторами. [60]
Страницы: 1 2 3 4
www.ngpedia.ru
Окисленная медь - Большая Энциклопедия Нефти и Газа, статья, страница 1
Окисленная медь
Cтраница 1
Окисленная медь содержит в себе много кислорода, что нежелательно. Для восстановления закиси меди в расплавленный металл вводят древесину. Газообразные продукты сгорания, проходя через металл, перемешивают его. [1]
Окисленную медь восстанавливают в токе водорода при той же температуре. Полное удаление кислорода таким путем не достигается. [2]
Окисленную медь восстанавливают водородом. [3]
Окисленную медь растворяют в серной кислоте и далее процесс проводят, как описано на стр. [4]
Окисленную медь восстанавливают водородом. [5]
Окисленную медь дробят на кусочки длиной 3 - 4 мм и загружают в трубку для сожжения. [6]
Для окисленной меди, однако, интерференционные данные всего лишь на 20 % меньше, чем данные по адсорбции пальмитиновой кислоты. [7]
Если внести окисленную медь в восстановительную зону пламени бунзеновской горелки ( верхняя часть конуса), то оксид восстановится водородом, и мы увидим, что чистый металл красного цвета. [8]
Осаждение никеля на окисленную медь проводилось из электролита Уотта при рН 5 2 - 5 3, причем ток включался не сразу после погружения образца, а через 4 мин. Федера [28], значительная часть окиси ( - 350 А) растворяется, причем образовавшиеся ионы меди со-осаждаются с первым слоем никеля, образуя сплав медь - никель. При включении тока происходит также электрохимическое восстановление окиси. В случае тонких окисных пленок ( 650 А при включении тока или 1000 А перед погружением в электролит) вся окись восстанавливается. Более толстые пленки остаются под никелем. [9]
После удаления шлака для раскисления частично окисленной меди в расплав бросают сырые березовые чурки, которые при температуре печи образуют пары воды, водород и окись углерода. [10]
На рис. 181 показан коэффициент отража-тельности окисленной меди для различных углов падающего излучения и температуры источника черного излучения. [12]
Следовательно, выщелачиванию серной кислотой подлежат только руды окисленной меди, не содержащие в значительных количествах растворимых в серной кислоте соединений трехвалентного железа, карбонатов и основных солей. [13]
Изучая под электронным микроскопом структуру порошков чистой меди, окисленной меди и чистой меди, покрытой тонким слоем нитрованного масла, Е. С. Чуршуков установил, что нитрованное масло придает меди структуру, аналогичную окисленной меди. Таким образом, прямым наблюдением было показано, что нитрованное масло способно вызывать явление анодной пассивности меди со сдвигом потенциала в сторону положительных значений. [14]
По-видимому, разумно предположить, что в системе присутствует или может образоваться некоторое количество окисленной меди. [15]
Страницы: 1 2 3 4
www.ngpedia.ru
Кислород окисленной меди - Справочник химика 21
Открытие галоидов. Галоиды проще всего открываются по Бейльштейну—прокаливанием органического вещества с окисью меди в пламени горелки. Кислород окиси меди окисляет углерод и водород органического вещества в углекислый газ и воду, медь же соединяется с галоидом. Так, например, с хлороформом СНСГ, эту реакцию можно выразить уравнением [c.28]Вторая реакция используется в одном из методов очистки газов от примеси кислорода. Газ пропускают через сосуд с медными стружками, залитыми раствором ЫНз. Кислород окисляет медь [c.585]
Газ весь целиком может быть сожжен при высокой температуре порядка 900° с помощью окиси меди, содержащей в то же время некоторое количество и красной меди. Этан при этом весь сгорает, а закись азота разлагается на элементы, причем кислород окисляет медь и, таким образом, остаток после поглощения углекислоты будет представлять собой азот. Объем азота будет равен объему имевшейся ранее закиси азота. Можно определить содержание этана и закиси азота, если определить их удельный вес. [c.149]Реакции прямого окисления с помощью кислорода или воздуха имеют ряд отрицательных сторон, к которым в первую очередь следует отнести необходимость кислородных установок (при окислениях кислородом), разбавление продуктов реакции азотом (в случаях окисления воздухом), опасность сокрушительных взрывов и т. д. В последнее время предложены более рациональные и простые методы окисления с помощью окислов металлов, способных регенерироваться воздухом, что исключает большинство из недостатков прямых окислений. Для этой цели применяют окислы меди, титана, железа, кобальта, никеля, марганца, ванадия, часто с активирующими добавками. [c.197]
Ионы элементов подгруппы меди — ярко выраженные комплексообразователи, поэтому равновесие процесса М М. е-, может быть смещено вправо в результате связывания иона Аи (Си+, Ag+, Аи+) в комплексный ион. Например, серебро и золото в присутствии иона СМ окисляются в водном растворе кислородом, а медь — ионом водорода [c.232]
Перечисленные примеси либо отравляют катализатор димеризации ат ,е-тилена (РНд, HjS, NH ), либо в условиях процесса полимеризуются с образованием смол. Наиболее вредной примесью, содержащейся в пиролизном ацетилене, является диацетилен, который, попадая в хлоропрен-ректифи-кат, полимеризуется по радикальному механизму, приводя к сильному структурированию полимеров хлоропрена. Недопустимо также поисутствие кислорода. Кислород окисляет хлорид меди (I) до хлорида меди (Н) и тем самым снижает активность катализатора кроме того, в присутствии кислорода образуются перекисные высокомолекулярные соединения, которые разлагаются со взрывом. Для предотвращения образования перекисей в раствор катализатора добавляют ингибиторы полифенолы, ароматические амины. [c.226]
Методы получения инертных газов. Так называемый сырой аргон, состоящий из аргона с примесью небольшого количества других инертных газов, обычно получается из воздуха поглощением всех остальных его составных частей. Рэлей пропускал электрические искры через смесь воздуха и кислорода над щелочью, которая поглощала образовавшиеся окислы азота. Избыток кислорода поглощался нагретой медью. Предпочтителен метод Рамзая, в котором азот поглощается нагретыми магниевыми стружками, кислород — раскаленной медью, пары воды — фосфорным ангидридом и диоксид углерода — натронной известью. [c.639]
Электронейтральные атомы водорода Н° превратились в ионы Н+, т. е. потеряли по одному электрону. Произошло перемещение электронов от атомов водорода к ионам меди. Это — главное и существенное в данной реакции. Все остальное — следствия. Утратив заряд, атомы меди перестали притягиваться ионами кислорода, и медь выделилась в свободном виде. Получив положительный заряд, ионы водорода притянулись к отрицательно заряженным ионам кислорода, и образовались молекулы воды. Так как решающее значение в реакциях окисления-восстановления имеет перемещение электронов, окислительно-восстановительными мы назвали все реакции, обусловленные перемещением электронов от какого-либо одного элемента к другому об элементе, отдающем электроны, условились говорить, что он окисляется, а об элементе, получающем электроны, что он восстанавливается. [c.24]
В рассматриваемой нами реакции атомы водорода отдают электроны, значит, водород окисляется (так мы говорили о нем и при первом знакомстве с этой реакцией, только мотивировали иначе окисляется потому, что присоединяет кислород). Ионы меди присоединяют электроны, значит, медь восстанавливается (так мы говорили о ней и раньше, но мотивировали тоже иначе восстанавливается, потому что освобождается от связи с кислородом). [c.24]
Серебро и золото не окисляются кислородом воздуха. Медь окисляется до черного оксида СиО при 400°С. [c.442]
В учебной литературе часто описывается применение величин АС. Однако, для того чтобы получить величину АС, необходимо систему задавать с помощью концентраций и исходных веществ, и продуктов реакции. Тогда если ДС исходные вещества переходят в продукты, если ДС > О, то продукты — в исходные, если АС = О, то случайно выбраны равновесные концентрации и исходных, и продуктов. Однако в практической химии вопросы, ставят по-другому будет ли кислород окислять, например, медь В этом случае применять АС нельзя, так как если считать, что концентрации продуктов равны нулю, то Д С всегда будет равно -оо. [c.118]
Не только содержащие литий, но и обработанные им сплавы имеют хорошую структуру, пластичность и высокий предел прочности [68]. Поэтому лигатуры лития с Си, Ag, 2п, Са и А1 получили применение при дегазации, раскислении и десульфуризации расплавленных металлов и сплавов на основе Си, 2п, Mg, А1, РЬ, N1, а также на основе бронз, монель-металла и благородных металлов [10, 54]. Широкое применение получили, например, лигатуры лития для обработки меди, в особенности при получении отливок с высокой электропроводностью [10, 54, 69]. Использование лития в лигатурах в цветной металлургии основано на его способности взаимодействовать с водородом, азотом, кислородом (окислы) и серой (сульфиды) с образованием нерастворимых в металлах соединений, легко отделяемых от основного продукта. В отличие от многих добавок литий не оставляет в металлах вредных примесей важно и то, что в ряде случаев литий не растворяется в обрабатываемом металле (железо, медь) или не соединяется с ним. [c.19]
Спекание меди с керамикой в слабоокислительной среде. Химически осажденный слой меди толщиной 25—50 мкм спекается с подложкой из высокоглиноземистой керамики в слабоокислительной атмосфере аргона (азота) в смеси с весьма малым количеством кислорода (до 0,1%). Спекание протекает при точно поддерживаемой температуре 1070 5°С в течение 10 с. Расплавленный эвтектический слой Си + СигО, температура плавления которого 1065° С, смачивает сомкнутые поверхности металла и керамики в зоне контакта. Слой весьма тонкий, несколько микрометров, определяемый глубиной проникновения кислорода в медь. Электроотрицательный кислород приводит к образованию положительных ионов меди, которые затем ионной связью соединяются с твердофазным окислом керамики [33]. [c.71]
Получают озон действием тихого электрического разряда на сухой кислород. Озон является очень сильным окислителем в его атмосфере самовоспламеняются многие органические вещества, он легко окисляет медь, ртуть, серебро сульфиды превращает в сульфаты [c.252]
Альдегидная группа редуцирующего сахара за счет кислорода гидроксида меди окисляется в кислоту [c.79]
При пропускании над окисью меди, нагретой до 300—310°, окись углерода окисляется кислородом окиси меди по реакции [c.75]
В хлоридных растворах (особенно в кислых) наблюдается возрастающее во времени разрушение меди, так как образовавшиеся ионы меди (I) окисляются кислородом до меди (П) и послед- [c.209]
Для повышения скорости окисления Л/были предложены промоторы (это главное достижение в промышленной реализации данного процесса) - соли меди или железа в среде хлороводородной кислоты, играющие роль переносчиков кислорода (окисляя палладий, медь или железо восстанавливаются по реакциям) [c.455]
Экспериментально найденные значения теплот адсорбции окиси углерода, углекислого газа и кислорода (в ккал/моль) на поверхностях окислов меди, никеля и кобальта при различной предварительной обработке [c.317]
На окиси цинка СО окисляется при температуре 250° С [118—121] и 100° С [3, 122]. Реакция осуществляется при взаимодействии хемосорбированного кислорода и СО [3, 120], причем, по [3], скорость реакции не зависит от концентрации Ог и СО, а по [120, 122], и от концентрации СО, но зависит от концентрации кислорода. Присутствие СОа в газовой фазе не влияет на скорость окисления СО [122], как и на окислах меди, марганца, кобальта. Относительно юрм кислорода, участвующего в катализе, существуют различные мнения [3,119, 122—124]. По-видимому, для однозначного ответа на этот вопрос еще недостаточно материала [3]. [c.230]
Суммируя данные по каталитической активности окислов в отношении реакции окисления СО, можно констатировать, что в этой реакции, как и в процессах глубокого окисления углеводородов, наибольшей каталитической активностью обладают окислы со сравнительно низкой энергией связи поверхностного кислорода (окислы марганца, железа, кобальта, никеля, меди и др.), близкой к оптимальной величине поверхностный кислород которых более подвижен (Ag O), неустойчивый восстанавливаются в условиях реакции до металла. Окись никеля, несмотря на свою высокую каталитическую активность, малопригодна для низкотемпературного окисления СО, так как она сильно отравляется углекислым газом. [c.236]
Сул1,фиды меди в воде нерастворимы и с водой не взаимодействуют. При нагревании в атмосфере кислорода сульфиды меди подвергаются обжигу с образованием оксидов меди и диоксида серы. Сульфиды меди взаимодействуют ири нагревании с оксидами металлов, причем сера окисляется до ЗОг. Изучены диаграммы состояния систем, включающих сульфиды меди и мегаллическу о медь. [c.321]
На сложных окисных катализаторах, содержащих двуокись марганца,— смеси окислов меди и марганца, окислов железа, марганца и висмута, окислов меди и марганца с карбонатом кальция [300], окислов марганца и висмута [299] — выходы закиси азота при температурах 180—450° С колеблются в интервале 30—95%, очевидно, в соответствии с изменениями энергии связи кислорода на их поверхности. [c.253]
Совместное рассмотрение свойств металла и окислов связано также с тем, что в атмосфере водорода сравнительно легко происходит превращение окиси меди в закись и последней в металл, а в атмосфере кислорода — обратный переход, вследствие чего катализаторами часто являются сложные системы, содержащие Си, СигО и СиО. Серебро и золото применяются главным образом в виде металлов, поскольку их окислы значительно менее устойчивы, чем окислы меди. Каталитический спектр меди значительно богаче, чем спектр серебра. Было сделано немало попыток применить в качестве катализатора металлическое золото в большинстве случаев его активность оказалась низкой. [c.1216]
Направлению реакции в сторону образования дифениламина при реакции хлорбензола с водным аммиаком содействуют понижение количества аммиака (1 —1,5 моля Nh4 на 1 моль хлорбензола), более высокая температура (до 250°) и большая продолжительность взаимодействия. Катализаторы — те же, что и в ранее описанных процессах (СигО и более бедные кислородом окислы меди). Прибавление едкого натра для разложения Nh5 I и снижения расхода аммиака, рекомендованное в патенте вероятно, вызовет образование больших количеств фенола. [c.390]
Кислород и азот по очереди пропускаем над нгьгретой медью. Кислород окисляет медь [c.336]
Так как скорость регенерирования палладаевого катализатора (реакция з ) значительно меньше скорости его восстановления (реакция ж ), активность катализатора в ходе процесса падает очень быстро. Для увеличения скорости реакции (з) в катализаторный раствор вводятся промоторы — соли меди или железа в солянокислой среде, играющие роль переносчиков кислорода. Окисляя металлический палладий, они восстанавливаются, например [c.305]
Этилен можно также хлорировать в присутствии кислорода. Хлорирующими веществами служат либо хлор, либо хлористый водород. При высокой температуре получается смесь высокохлорированных этиленов. В данном случае кислород окисляет в хлоо хлористый водород, присутствовавший в исходной смеси или выделившийся в начальной стадии хлорирования таким образом достигается высокая степень использования хлора. Дня облегчения згой реакции следует применять катализатор окисления [5]. Так, например, если смесь этилена, хлора и кислорода, взятых в молярном отношении 1 2 1, пропускать при 375—425° над окисью меди на носителе, основными продуктами реакции являются трихлорэтилен и перхлор-этилен СС1г=СС12. Возвращая низшие хлорэтилены в процесс, можно получить 75—80%-ный выход пер хлорэтилена, считая на этилен. [c.166]
Проф. И. Н. Маслэницким был предложен автоклавный способ обработки анодных шламов электролитического рафинирования никеля Промытый и просеянный шлам подвергают сначала магнитной сепарации для отделения феррита никеля (NiO РёгОз), содержание которого достигает 10%, затем — флотации. В коицентрате содержатся сульфиды меди и никеля, селениды и теллуриды драгоценных металлов и металлические частицы твердого раствора, обогащенного драгоценными металлами. Во флотационные хвосты отходят силикатные компоненты шлама. Полученный концентрат обрабатывают разбавленным раствором серной кислоты (ж т= 10 1) в автоклаве при давлении 15 ат, температуре выше 115° и введении в раствор кислорода. Сульфиды меди и никеля окисляются до сульфатов. Эта схема позволяет получать концентраты с содержанием платиноидов до 80% при небольшом количестве отходов. [c.383]
Газометр наполнить из баллона азотом или инертным газом, предварительно очищенным от кислорода. Очистку азота от кислорода производить пропусканием газа через три колонки, наполненные спиралями из металлической меди и насыщенные раствором ЫН4С1 в ЫН40Н. При поглощении кислорода металлическая медь окисляется до Си + и раствор синеет. После подачи газа раствор быстро обесцвечивается, вследствие восстановления Си + до Си- металлической медью. После того как температура в термостате достигнет определенного значения, в сосуды 5 залить раствор гидросульфита цинка определенной концентрации (исследуемое вещество). Заполненные сосуды поместить в термостат и включить в общую систему. В аспиратор залить воду. Проверить герметичность системы и после установ- [c.166]
В разбавленной серпой кислоте в отсутствие окислите чей медь практически ке растворяется. Ксли же через ра.створ пропускать воздух, скорость реакции сильно вог растаст. В этих условиях медный купорос образуется в результате нескольких последовате.льно протекающих реакций. Вначале кислород воздуха растворяется п серной кислоте и окисляет медь [c.360]
ВЫДСЛЯЮП1ИЙСЯ при этой реакции кислород окисляет сахара. Следовательно, по количеству образовавншйся закиси меди можно рассчитать содержание редуцирующих сахаров в исследуемом материале. [c.219]
Свойства. Медь — светлокрасный ковкий металл. По своей прочности она следует за железом. По теплопроводности медь уступает золоту и серебру, а по электропроводности она ближе всего к серебру. Даже небольшие количества примесей, особенно мышьяка, весьма заметно отражаются на электропроводности. меди. Сухой воздух не окисляет медь, но во влажном воздухе, содержащем двуокись углерода, медь покрывается слоем основного карбоната, защищающим мегалл о дальнейшей коррозии. Чистая вода е оказывает заметного действия на медь, но горячая вода, содержащая растворенный кислород, вызывает коррозию. Важными сплавами меди являются латунь, бронза и нейзильбер (аргентан). [c.148]
При этом, видимо, кислород окисляет Си,С1, в оксохлориды меди (П), которые в присутствии H l переходят в u l,. [c.507]
В свете описанных опытов по адсорбции СОг представляло интерес выяснить, не получится ли лучшего согласия с экспериментальными теплотами взаимодействия, если исходить из реакции, приводящей к образованию не СОгодс), а комплекса СО3. Теплота адсорбции СО2 на поверхности, предварительно обработанной кислородом, оказалась равной 21 ккал/моль. Используя, как и раньше, два других экспериментальных значения теплот — 55 и 20 ккал/моль для адсорбции соответственно кислорода и СО на прогретой поверхности, — можно легко рассчитать ожидаемые теплоты образования комплекса СО3 на окисле меди следующим образом [15]. [c.315]
Механизм процессов рассматриваемого типа до последнего времени был плохо изучен. Недавно опубликованные работы [43] позволяют составить представление о существенных особенностях механизма глубокого окисления алифатических углеводородов. В этих работах исследовалось окисление до СО2 и НаО парафинов С —Се, олефинов Са—Сд и ацетиленовых углеводородов С2—Сз нормального строения на окислах меди. Показано, что при низких температурах (примерно до 200°С) реакции протекают по следующему механизму при взаимодействии углеводорода с поверхностным кислородом катализатора образуются поверхно- / г стные структуры карбоксилатного типа, разлагающиеся под действием молекулярного кислорода. Последняя стадия является лимитирующей, и в этой области наблюдается первый порядок по кислороду (т = О, п = 1). Образование карбоксилатных структур на поверхности катализаторов глубокого окисления ранее показано в работах [51, 52, 61]. [c.191]
Действу -льно, наиболее активные катализаторы окисления СО — окислы Со, Си — ймеют дз, близкую к Q/2. Эта зависимость, однако, имеет приблизительный характер при точном ее соблюдении наиболее активными катализаторами окисленья СО должны были быть Ре Оз, СГгОз, МпОа, у которых энергия связи кислорода с поверхностью ближе всего (29, 28, 28 ккал/моль соответственно) к значению Q/2. Практически же наибольшей каталитической активностью в реакции окисления СО обладают окислы меди и кобальта, энергия связи кислорода с поверхностью которых меньше (23 ккал/моль) Q/2. [c.221]
Теория прЬмежуточных поверхностных соединений дает наиболее четкие результаты в тех случаях, когда образование такого-соединения сочетается с переносным механизмом катализа, т. е. когда ускорение реакции объясняется самим фактом возникновения и распада промежуточных соединений. Однако применение изотопных методов чаще опровергает, чем подтверждает этот простой механизм. Например, В. А. Ройтер 46] показал, что для многих окисных катализаторов кислород окисла не удается обнаружить в продуктах реакций. Это найдено для окисления СО на двуокиси марганца или на окиси меди, Для окисления нафталина и сернистого газа на пятиокиси ванадия и т. п. В других случаях оказывается, что скорость окисления поверхности катализаторов-меньше скоростей каталитических реакций. Все это исключает простейший вариант переносного механизма катализа. Тем самым ускорение реакции приходится сопоставлять не просто с появлением и взаимными переходами тех или иных поверхностных соединений, а с общим во всех случаях и требующим дополнительного объяснения фактом, что совокупность реагентов на поверхности катализатора по неизвестным причинам быстрее образует продукты реакции. В отличие от механизма реакции, выражаемога-уравнениями (IV. 1) и (1 .2), только ссылка на образование поверхностного соединения теперь уже недостаточна для объяснения ускорения реакций по механизму (IV.З). [c.81]
chem21.info
как убрать окисление с меди?
Попробуте аммиаком. Если изделие не большое, то можно погрузить в раствор аммиака (нашатырный спирт) , а если большое, то просто смочите как следует. Нумизматы аммиаком чистят старые монеты.
силит бенк или паста гоя
для уменьшения окисления медь обрабатывается жиром, он предваряет доступ кислорода, а очистить-силит бенк и воздух сжатый
Изделия разные бывают уточните какие Кстати никому в голову не придет чистить монеты нашатырным спиртом и точно у вас коррозия а не благородная патина Окислы можно и водой смыть при определенном усердии
Я чищу очень тоненькой металлической щеточкой (как для посуды) , 2 минуты 10 на 10см меди
очень опасный способ. раствор хлорного железа, продаётся в любом магазине радиодеталей, инструкция на упаковке. опасный тем, что может совсем разъесть медь если передержать. поэтому нужно поливать или опускать на очень короткое время. а затем искать способ как защитить очищенную медь от последующих окислов. из всех усилий кстати потребуется только покачивание предмета в сосуде с раствором
Как убрать окисление с корпуса часов?! <img src="//otvet.imgsmail.ru/download/204534178_665e4389669d8c5964e8f84ed92bc13f_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/204534178_665e4389669d8c5964e8f84ed92bc13f_800.jpg" ><img src="//otvet.imgsmail.ru/download/204534178_ac494a789925b0dba033e28d04627a3a_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/204534178_ac494a789925b0dba033e28d04627a3a_800.jpg" ><img src="//otvet.imgsmail.ru/download/204534178_11709f1497d1702a6328e5654657a79d_120x120.jpg" data-hsrc="//otvet.imgsmail.ru/download/204534178_11709f1497d1702a6328e5654657a79d_800.jpg" >
touch.otvet.mail.ru
Окисление - медь - Большая Энциклопедия Нефти и Газа, статья, страница 1
Окисление - медь
Cтраница 1
Окисление меди в воде происходит только за счет окислительного действия кислорода и со скоростью, значительно меньшей, чемс окисление цинка. [2]
Окисление меди при высоких температурах происходит главным образом путем диффузии атомов меди через образовавшийся слой окалины, состоящий в основном из закиси меди, поверх которого образуется слой окиси меди. Такой механизм окисления меди играет существенную роль в процессе образования выпрямителя, так как вместе с диффузией атомов меди идет диффузия к фронту окисления атомов имеющихся в ней примесей, скапливающихся в основном в пограничной с медью области. Примеси играют важную роль в образовании полупроводника и-типа и влияют, следовательно, на качество выпрямителя. [4]
Окисление меди на 400 с наблюдается более воздухе при 800 С. [5]
Окисление меди кислородом будет итти с меньшей скоростью из-за того, что доступ кислорода к поверхности меди затруднен. [7]
Окисление меди проводят кислородом воздуха. [8]
Окисление меди, являющейся основным проводниковым материалом для обмоточных проводов, в диапазоне 300 - 800 С протекает во времени по параболической зависимости. [10]
Окисление меди в ионы, комплексуемые Ml 16, осуществляется Ре 3-ионами, содержащимися в удаляемых отложениях. [11]
Окисление меди воздухом при 600 сильно ускоряется, как это было обнаружено Гадсоном и его сотрудниками3, в присутствии следов хлористого водорода до 0 05 %; выше этой концентрации влияние становится менее заметным. [12]
Для окисления меди и поддержания в башне температуры 70 - 85 С в нижнюю часть башни под колосниковую решетку инжекторами 14 подают паровоздушную смесь и кислород. Орошающий раствор содержит 0 - 30 % медного купороса и 12 - 19 % свободной серной кислоты. Стекая по поверхности гранул меди, шн насыщается медным купоросом и на выходе из иатра-вочной башни содержит 42 - 49 % CuSO4 - 5h3O и 4 - 5 % свободной серной кислоты. [13]
Для окисления меди и подогрева раствора в нижнюю часть башни вдувают паро-воздушную смесь. Отработанная паро-воз-душная смесь отводится из башни через фаолитовую вытяжную трубу в атмосферу. [14]
Для окисления меди и поддержания температуры в пределах 75 - 80 С в низ башни, под колосниковую решетку, подают тремя ( Паровыми инжекторами паро-воздушную смесь. [15]
Страницы: 1 2 3 4
www.ngpedia.ru